Antimikróbne pôsobiace látky produkované baktériami mliečneho kvasenia
Antimicrobial substances produced by lactic acid bacteria
Lactic acid bacteria comprise several genera of Gram-positive bacteria that are known for the production of different antimicrobial substances. Lactic acid and related organic acids, usual metabolites of saccharide metabolism, inhibit the growth of other microbes mainly by lowering pH. Bacteriocins, proteinaceous antimicrobial substances, are produced ribosomally and those of lactic acid bacteria are well examined. Some species, for example Lactobacillus reuteri, are able to produce specific substances with miscellaneous structures. One of them, reutericyclin, a derivate of tetramic acid, is the first discovered antibiotic produced by a lactic acid bacterium. Reuterin, a complex of 3-hydroxypropionaldehyde and its related forms, is a strong antimicrobial substance produced by several species of the genus Lactobacillus. Because of a non-pathogenic character of lactic acid bacteria, they can be used as food preservatives or as promising antimicrobials in human and/or animal therapy.
Key words:
lactic fermentation bacteria – probiotics – antimicrobially active substances
:
H. Kiňová Sepová; A. Bílková; F. Bilka; L. Bezáková
:
Univerzita Komenského v Bratislave, Farmaceutická fakulta, Katedra bunkovej a molekulárnej biológie liečiv, Slovenská republika
:
Čes. slov. Farm., 2010; 59, 155-159
:
Review Articles
Baktérie mliečneho kvasenia zahŕňajú viaceré rody gram pozitívnych baktérií, ktoré sú známe produkciou rôznych antimikróbnych látok. Kyselina mliečna a príbuzné organické kyseliny – obligátne metabolity sacharidov, inhibujú rast niektorých iných mikroorganizmov hlavne znížením pH prostredia. Bakteriocíny, proteínové antimikróbne látky, sú produkované ribozomálne a u mliečnych baktérií sú pomerne dobre preskúmané. Niektoré druhy ako napríklad Lactobacillus reuteri sú schopné produkovať špecifické látky rôznej štruktúry. Jedna z nich, reutericyklín – derivát kyseliny tetrámovej – je prvým objaveným antibiotikom produkovaným mliečnymi baktériami. Reuterín, komplex 3–hydroxypropiónaldehydu a jeho príbuzných foriem, je silná antimikróbne pôsobiaca látka, ktorú produkujú viaceré druhy rodu Lactobacillus. Vďaka nepatogénnemu charakteru baktérií mliečneho kvasenia, môžu byť použité ako konzervanty potravín alebo ako nádejné antimikróbne látky v terapii ľudí a/alebo zvierat.
Kľúčové slová:
baktérie mliečneho kvasenia – probiotiká – antimikróbne pôsobiace látky
Úvod
Baktérie mliečneho kvasenia v ostatnom čase nachádzajú uplatnenie v rôznych oblastiach života. V potravinárskom priemysle sú vďaka produkcii antimikróbnych látok využívané ako prírodné konzervanty a tiež dávajú charakteristickú chuť a konzistenciu niektorým potravinám (napr. kefír, kyslá kapusta, syr, kysnuté cesto, kyslé uhorky, jogurt, víno, saláma). Kmene niektorých rodov mliečnych baktérií sa uplatňujú v proiotických prípravkoch používaných v humánnej a veterinárnej medicíne pre ich prospešné účinky na zdravie konzumentov. Skupina mliečnych baktérií zahŕňa rody schopné produkovať kyselinu mliečnu zo sacharidových zdrojov. Z baktérií s nízkym obsahom guanínu a cytozínu (G+C) v genóme sú to rody Aerococcus, Alloiococcus, Atopobium, Carnobacterium, Enterococcus, Lactobacillus, Lactococcus, Leuconostoc, Oenococcus, Paralactobacillus, Pediococcus, Streptococcus, Tetragenococcus, Vagococcus a Weissella. Okrem toho medzi mliečne baktérie radíme aj niektoré rody s vysokým obsahom G+C párov, a to napr. Bifidobacterium, Gardnerella, Scardovia a Parascardoviav 1). Baktérie mliečneho kvasenia sú gram-pozitívne, netvoria spóry a zvyčajne sú nepohyblivé. Pre limitované biosyntetické schopnosti majú zvyčajne vysoké nároky na živiny, získavané z okolitého prostredia 2).
Už na začiatku 20. storočia Iľja Mečnikov predpokladal, že niektoré potraviny ako fermentované mlieko a mliečne produkty napomáhajú eliminovať škodlivé baktérie z gastrointestinálneho traktu ľudí a nahradiť ich prospešnými 3). Za toto sú pravdepodobne okrem iného zodpovedné práve antimikróbne pôsobiace látky, produkované mliečnymi baktériami. Jedná sa o látky rozmanitej chemickej povahy, mechanizmu účinku a antimikróbného spektra účinku. Vďaka týmto látkam sú baktérie mliečneho kvasenia schopné inhibovať rast alebo usmrcovať iné mikroorganizmy, ktoré sa nachádzajú v ich environmentálnom okolí.
Kyselina mliečna a iné organické kyseliny
Organické kyseliny – mliečna, octová, propiónová, maslová a mravčia sú produkované počas anaeróbneho metabolizmu uhľovodíkov 4). Antimikróbny efekt týchto kyselín súvisí s narušením membránového potenciálu atakovanej bunky, inhibíciou aktívneho transportu cez membránu, redukciou intracelulárneho pH a inhibíciou rôznych metabolických funkcií bakteriálnej bunky 5).
Medzi organické kyseliny produkované niektorými druhmi mliečnych baktérií môžeme zaradiť aj kyselinu pyroglutámovú (kyselina 2–pyrolidón–5–karboxylová) prítomnú v ovocí, zelenine, trávach 6) a rôznych druhoch syrov 7). Cesta jej biosyntézy nie je zatiaľ jednoznačne potvrdená. Pravdepodobne sa začína z Glu a Gln, a toneenzymatickou alebo enzymatickou syntézou. Zapojenie enzýmu cyklotransferázy do biosyntézy kyseliny pyroglutámovej bolo potvrdené u Pseudomonas cruciviae a Streptococcus bovis 8, 9). Kyselinu pyroglutámovú nachádzame vo voľnej forme, ale aj viazanú na terminálny dusík proteínov 7), ktoré tak môže chrániť pred degradáciou 10). Väzba pyroglutamátu na rôzne bioaktívne peptidy je spojená s ich biologickou aktivitou 11). Tieto modifikované peptidy pôsobia napríklad ako antagonisti excitačných aminokyselín 12), mozgové stimulátory 13) a anxiolytiká 14). Pri rovnakej koncentrácii má kyselina pyroglutámová silnejší antimikróbny účinok ako kyselina mliečna 15). Zdá sa, že pôsobí podobným mechanizmom ako ostatné organické kyseliny 6).
Peroxid vodíka
Peroxid vodíka je radený k mimoriadne silným a biologicky aktívnym molekulám. Reaguje s lipidmi, proteínmi a nukleovými kyselinami a je zodpovedný za oxidačné poškodenia bunky 16). Niektoré druhy rodu Lactobacillus sú schopné produkovať peroxid vodíka do okolitého prostredia, kde hrá úlohu v inhibícii rastu niektorých baktérií, ktoré nedisponujú ochrannými mechanizmami. Medzi tieto mechanizmy patrí napríklad schopnosť produkcie katalázy alebo peroxidázy, ktoré rozkladajú peroxid vodíka. Medzi baktérie citlivé na peroxid vodíka patria prevažne obligátne anaeróby ako napr. Prevotella alebo Peptostreptococcus 16), ktoré sú pôvodcami bakteriálnych vaginóz 17). Hawes et al. 18) zistili, že u žien, ktoré majú pošvu osídlenú kmeňmi laktobacilov produkujúcich H2O2, je incidencia bakteriálnych vaginóz o polovicu nižšia ako u žien, ktoré nie sú kolonizované H2O2-produkujúcimi kmeňmi. Z hľadiska spektra účinku peroxid vodíka pôsobí na gram-pozitívne (G+) baktérie bakteriostaticky a na gram-negatívne (G-) baktericídne19).
Oxid uhličitý
Oxid uhličitý produkujú najmä heterofermentatívne baktérie mliečneho kvasenia pri fermentácii hexóz, ale je tvorený v baktériách aj inými metabolickými cestami (napr. fosfopentózovým cyklom, alkoholovým, propiónovým, butándiolovým, prípadne zmiešaným octovým kvasením) 20). Anaeróbne prostredie, vytvárané prítomnosťou CO2 je toxické pre niektoré aeróbne mikroorganizmy, u ktorých pôsobí na ich bunkovú membránu. Za mechanizmus účinku sa považuje inhibícia enzymatickej dekarboxylácie a porušenie permeability membrány nahromadením CO2 vo fosfolipidovej dvojvrstve 19). Røssland et al.21) detegovali schopnosť laktobacilov produkovať okrem iného oxid uhličitý, pričom testovali schopnosť vybraných kmeňov inhibovať rast Bacillus cereus NVH 45. Kmeň Latobacillus diacetylactis 184L, ktorý sa vyznačoval výrazne vyššou produkciou CO2 v porovnaní s ostatnými testovanými kmeňmi, inhiboval rast B. cereus účinnejšie ako ostatné kmene. Zdá sa ale, že funkcia CO2 v inhibícii rastu vybraných baktérií je len sekundárna, hlavná časť účinku sa pripisuje kyseline mliečnej 21). Uvádza sa, že G- baktérie sú citlivejšie na prítomnosť CO2 ako G+ 22).
Nízkomolekulové látky
Reutericyklín
Reutericyklín (3-acetyl-1-(2-trans-decenoyl)-2-hydroxy-(5R)-izobutyl-Δ2-pyrrolín-4-ón (obr. 1) je prvým objaveným nízkomolekulárnym antibiotikom, produkovaným baktériami mliečneho kvasenia 23). Jeho molekula s relatívnou molekulovou hmotnosťou 349 Da je odvodená od kyseliny tetrámovej 24), má amfifilný charakter, záporný náboj a je vysoko hydrofóbna 25, 26). Höltzel et al. 27) pri 13C NMR analýze zistili, že molekula reutericyklínu prešmykuje medzi troma tautomérmi, pričom dominuje forma 2, ktorá má až 60% zastúpenie (obr. 1). Čo sa týka chemickej štruktúry, zaujímavé je pripojenie α, ß-nenasýtenej mastnej kyseliny, ktorá sa v tetrámových kyselinách prirodzene nevyskytuje 28, 29).
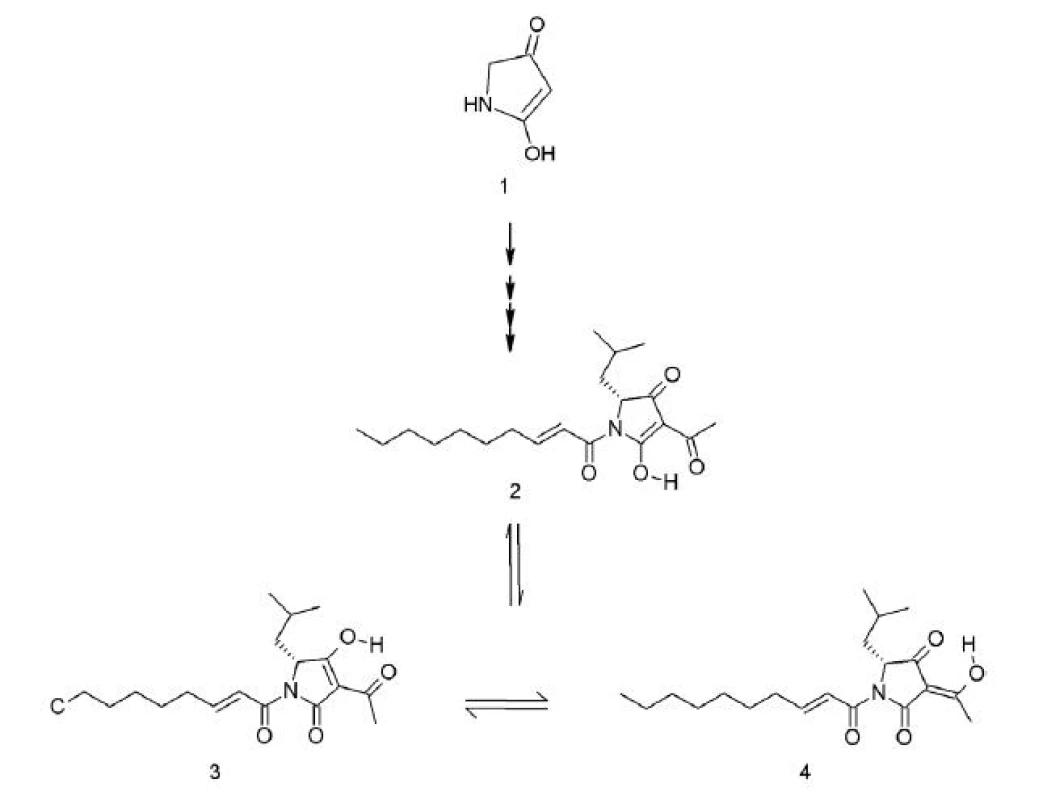
Produkcia reutericyklínu bola zaznamenaná u kmeňa Lactobacillus reuteri LTH 2584, ktorý bol izolovaný z kysnutého cesta 24). Pridanie mastných kyselín do média má výrazný vplyv na zvýšenie produkcie reutericyklínu a jeho sekréciu z producentských buniek 25). Gény, ktorých produkty sú zapojené do biosyntézy tetrámových kyselín, zatiaľ nie sú známe ani u baktérií ani u húb. Taktiež biosyntetické cesty vzniku reutericyklínu nie sú zatiaľ preskúmané 23).
Reutericyklín má široké spektrum účinku voči G+ baktériám (Lactobacillus spp., Bacillus subtilis a B. cereus, Enterococcus faecalis, Staphylococcus aureus, Listeria innocua). G- baktérie a kvasinky sú voči nemu rezistentné 24). Mechanizmus účinku reutericyklínu je podobný mechanizmu pôsobenia slabých organických kyselín. Predpokladá sa, že nespôsobuje vznik pórov v membráne cieľových buniek, ale účinkuje ako protónový ionofór. Vďaka svojej hydrofóbnosti sa začlení do cytoplazmatickej membrány a selektívne rozvráti transmembránový pH gradient 25).
Reuterín
Viaceré rody baktérií sú schopné za anaeróbnych podmienok produkovať z glycerolu látku s antimikróbnymi vlastnosťami, 3-hydroxypropiónaldehyd (3-HPA, reuterín (obr. 2). Reakciu katalyzuje glyceroldehydratáza (EC 4.2.30). Spomedzi mliečnych baktérií majú túto schopnosť niektoré kmene piatich druhov rodu Lactobacillus: Lactobacillus A 2-8 30), L. brevis 31), L. buchneri 31), L. reuteri 32) a L. collinoides 33). 3-HPA vykazuje široké antimikróbne spektrum účinku. Zaznamenaná bola jeho antibakteriálna, antifungálna, antiprotozoálna a antivírusová aktivita. Žiadne negatívne účinky reuterínu na ľudské bunky zatiaľ nie sú známe 34, 35).
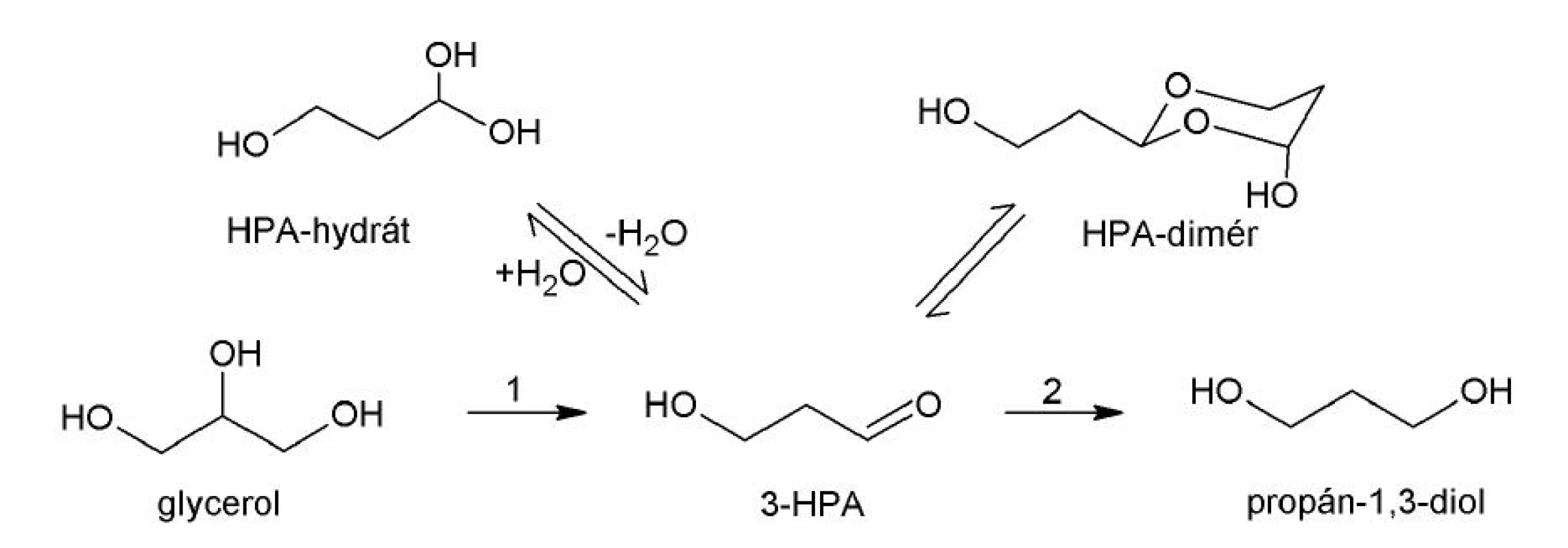
Antibakteriálnu aktivitu reuterínu voči Listeria monocytogenes a Escherichia coli O157:H7, ktorú zistili El‑Ziney et al. 36), je možné využiť v potravinárstve, ako biokonzervant, alebo v probiotických prípravkoch (BioGaia®, Ewopharma s.r.o., Švajčiarsko). Okrem toho môže mať 3-HPA uplatnenie v priemysle ako alternatívny zdroj kyseliny akrylovej, monoméru pre výrobu plastov a polymérov 37).
Reuterín tvorí dynamický multikomponentný systém (HPA systém) zahŕňajúci 3-HPA, HPA-hydrát a dimér HPA (obr. 2). Biologickej aktivity sa pravdepodobne zúčastňujú viaceré formy reuterínu. Hemiacetál HPA-diméru má štruktúru podobnú pentózam, čiže aj D‑ribóze. Jedným z predpokladaných mechanizmov účinku reuterínu môže byť kompetícia HPA-diméru s ribonukleotidmi o väzbové miesto na ribonukleotidreduktáze, enzýme podieľajúcom sa na tvorbe deoxyribonukleotidov 38). Iným vysvetlením antibakteriálneho pôsobenia reuterínu je možná interakcia aldehydových a alkoholových skupín reuterínu s nestabilnými sulfhydrylovými skupinami ribonukleotidreduktázy a tioredoxínu 39).
Bakteriocíny
Okrem vyššie uvedených antimikróbne pôsobiacich látok sú mliečne baktérie významné produkciou tzv. bakteriocínov. Jedná sa o látky peptidovej povahy, ktoré sú produkované ribozomálne. Niektoré molekuly sú tepelne a proteolyticky odolné, čo prispieva k ich možnému využitiu v praxi, či už potravinárskej alebo klinickej. Najznámejším a najpoužívanejším bakteriocínom je nizín, ktorý sa využíva pri spracovaní mliečnych produktov a pri konzervovaní potravín. Je produkovaný kmeňmi Lactoccocus lactis 40). Bakteriocíny ako skupina antimikróbnych substancií predstavujú širokú paletu látok a zaslúžia si viac priestoru v samostatnom prehľade 40).
Záver
Vďaka schopnosti mliečnych baktérií produkovať antimikróbne pôsobiace látky rôznej chemickej povahy, javia sa tieto baktérie veľmi zaujímavé pre potravinársky priemysel ako prírodné konzervanty. Pre ich probiotické účinky im v ostatnom období venuje veľkú pozornosť aj farmaceutický priemysel. Jedná sa predovšetkým o schopnosť mliečnych baktérií modifikovať mikroflóru tráviaceho traktu a pohlavných orgánov v prospech komenzálnych druhov, potláčať postantibiotické a cestovateľské hnačky, modulovať imunitný systém hostiteľa, znižovať hladinu cholesterolu v krvi a i. Tieto účinky boli zaznamenané u ľudí aj hospodárskych zvierat 41).
Kvôli stále sa zvyšujúcej rezistencii patogénnych mikroorganizmov voči antibiotikám, používaným v praxi je štúdium nových antimikróbnych látok opodstatnené a využiteľné ako vo farmaceutickom, tak v potravinárskom priemysle. Vďaka stále sa rozširujúcemu výskumu antimikróbne pôsobiacich látok a možnosti špecifického výberu medzi široko a úzko spektrálnymi antimikróbnymi látkami je veľký predpoklad, že nevznikne voči nim rezistencia.
Adresa pro korespondenci:
PharmDr. Hana Kiňová Sepová
Katedra bunkovej a molekulárnej biológie
liečiv FaF UK
Odbojárov 10, 832 32 Bratislava, SR
e-mail: kbm@fpharm.uniba.sk
Sources
1. Pot, B., Tsakalidou, E.: Phylogenetics and Taxonomy. In: Ljungh, Ā., Wadström, T. eds. Lactobacillus Molecular Biology: From Genomics to Probiotics, 1st ed. Norfolk: Caister Academic Press 2009.
2. Prescott, L. M., Harley, J. P., Klein, D. A.: Bacteria: the low G+C gram positives. In: Prescott, L. M., Harley, J. P., Klein, D. A. eds. Microbiology, 5th ed. New York: McGraw.Hill Companies, Inc., 2002.
3. Mečnikov, E.: Lactic acid as inhibiting intestinal putrefaction. In: Mitchell, P. C., ed. The prolongation of life: Optimistic studies, ed. New York: The Knickerbocker Press 1908.
4. Gillor, O., Etzion, A., Riley, M. A.: The dual role of bacteriocins as anti. and probiotics. Appl. Microbiol. Biotechnol., 2008; 81, 591–606.
5. Ross, R. P., Morgan, S., Hill, C.: Preservation and fermentation: past, present and future. Int. J. Food Microbiol., 2002; 79, 3–16.
6. Ouwehand, A. C., Vesterlund, S.: Antimicrobial components from lactic acid bacteria. In: Salminen, S., von Wright, A., Ouwehand, A. C., eds. Lactic Acid Bacteria: Microbiological and Functional Aspects, ed. 3rd New York: Marcel Dekker, Inc. 2004.
7. Mucchetti, G., Locci, F., Massara, P., Vitale, R., Neviani, E.: Production of pyroglutamic acid by thermophilic lactic acid bacteria in hard.cookes mini.cheeses. J. Dairy Sci., 2002; 85, 2489–2496.
8. Akita, S., Tanaka, K., Kinoshita, S.: Enzymic dehydration of L.glutamic acid. Biochem. Biophys. Res. Commun., 1959; 1, 179–181.
9. Chen, G. J., Russel, J. B.: Transport of glutamine by Streptococcus bovis and conversion of glutamine to pyroglutamic acid and ammonia. J. Bacteriol., 1989; 171, 2981–2985.
10. Van Coillie, E., Proost, P., Van Aelst, I., Struyf, S., Polfliet, M., De Meester, I., Harvey, D. J., Van Damme, J., Opdenakker, G.: Functional comparison of two human monocyte chemotactic protein.2 isoforms, role of the amino.terminal pyroglutamic acid and processing by CD26/dipeptidyl peptidase IV. Biochem. 1998; 37, 12672–12680.
11. Awade, A. C., Cleuziat, P., Gonzales, T. H., Robert.Baudouy, J.: Pyrrolidone carboxyl peptidase (Pcp.: an enzyme that removes pyroglutamic acid (pGlu. from pGlu.peptides and pGlu.proteins. Proteins Struct. Funct. Genet., 1994; 20, 34–51.
12. Beani, L., Bianchi, C., Baraldi, P. G., Manfredini, S., Pollini, G. P.: Protection by pyroglutamic acid and some of its newly synthesized derivatives against glutamate.induced seizures in mice. Drug Res., 1990; 40, 1187–1191.
13. Mirzoian, S. A., Zalinian, M. G., Balasanian, M. G., Topchian, A. V.: The central vascular and metabolic effects of pyroglutamic acid. Eksp. Klin. Farmakol., 1994; 57, 22–24.
14. Beni, M., Giampietro-Pellegrini, D. E., Moroni, F.: A new endogenous anxiolytic agent: L.pyroglutamic acid. Fundam. Clin. Pharmacol., 1988; 2, 77–82.
15. Yang, Z., Suomalainen, T., Mäyrä.Mäkinen, A., Huttunen, E.: Antimicrobial activity of 2.pyrrolidone.5.carboxylic acid produced by lactic acid bacteria. J. Food Prot., 1997; 60, 786–790.
16. Imlay, J. A.: How oxygen damages microbes: oxygen tolerance and obligate anaerobiosis. Adv. Microb. Physiol., 2002; 46, 111–153.
17. Falagas, M. E., Betsi, G.I., Athanasiou, S.: Probiotics for the treatment of women with bacterial vaginosis. Clin. Microbiol. Infect., 2007; 13, 657–664.
18. Hawes, S. E., Hillier, S. L., Benedetti, J., Stevens, C. E., Koutsky, L. A., Wolner.Hanssen, P., Holmes, K. K.: Hydrogen peroxide.producing lactobacilli and acquisition of vaginal infections. J. Infect. Dis., 1996; 174, 1058–1063.
19. Lindgren, S. E., Dobrogosz, W. J.: Antagonistic activities of lactic acid bacteria in food and feed fermentations. FEMS Microbiol. Rev. 1990; 87, 149–163.
20. Daniels, J. A., Krishnamurthi, R., Rizvi, S. S. H.: J. A review of effects of carbon dioxide on microbial growth and food quality. J. Food Prot., 1985; 48, 532–537.
21. RŅssland, E., Langsrud, T., Granum, P. E., SŅrhaug, T.: Production of antimicrobial metabolites by strains of Lactobacillus or Lactococcus co.cultured with Bacillus cereus in milk. Int. J. Food Microbiol., 2005; 98, 193–200.
22. Devlieghere, F., Debevre, J.: Influence of dissolved carbon dioxide on the growth of spoilage bacteria. Lebensm. Wiss. Technol., 2000; 33, 531–537.
23. Gänzle, M. G.: Reutericyclin: biological activity, mode of action, and potential applications. Appl. Microbiol. Biotechnol., 2004; 64, 326–332.
24. Messens, W., De, V. L.: Inhibitory substances produced by Lactobacilli isolated from sourdoughs – a review. Int. J. Food Microbiol., 2002; 72, 31–43.
25. Gänzle, M. G., Höltzel, A., Walter, J., Jung G., Hammes, W. P.: Characterization of reutericyclin produced by Lactobacillus reuteri LTH2584. Appl. Environ. Microbiol., 2000; 66, 4325–4333.
26. Gänzle, M. G., Vogel, R. F.: Studies on the mode of action of reutericyclin. Appl. Environ. Microbiol., 2003; 69, 1305–1307.
27. Höltzel, A., Gänzle, M. G., Nicholson, G. J., Hammes, W. P., Jung, G.: The first low.molecular.weight antibiotic from lactic acid bacteria: reutericyclin, a new tetramic acid. Angew. Chem. Int. Ed., 2000; 39, 2766–2768.
28. Imamura, N., Adachi, K., Sano, H.: Magnesidin A, a component of marine antibiotic magnesidin, produced by Vibrio gazogenes ATCC29988. J. Antibiot., 1994; 47, 257–261.
29. Royles, B. J. L.: Naturally occurring tetramic acids: structure, isolation, and synthesis. Chem. Rev., 1995; 95, 1981–2001.
30. Sobolov, M., Smiley, K. L.: Metabolism of glycerol by an acrolein.forming lactobacillus. J. Bacteriol., 1960; 79, 261–266.
31. Schutz, H., Radler, F.: Anaerobic reduction of glycerol to propanediol.1,3 by Lactobacillus brevis and Lactobacillus buchneri. Sys. Appl. Microbiol., 1984; 5, 169–178.
32. Talarico, T. L., Casas, I. A., Chung, T. C., Dobrogosz, W. J.: Production and isolation of reuterin, a growth inhibitor produced by Lactobacillus reuteri. Antimicrob. Agents Chemother., 1988; 32, 1854–1858.
33. Sauvageot, N., Gouffi, K., Laplace, J. M., Auffray, Y.: Glycerol metabolism in Lactobacillus collinoides: production of 3.hydroxypropionaldehyde, a precursor of acrolein. Int. J. Food Microbiol., 2000; 55, 167–170.
34. Axelsson, L. T., Chung, T. C., Dobrogosz, W. J., Lindgren, S. E.: Production of a broad spectrum antimicrobial substance by Lactobacillus reuteri. Microb. Ecol. Health Dis., 1989; 2, 131–136.
35. Chung, T. C., Axelsson, L. T., Lindgren, S. E., Dobrogosz, W. J.: In vitro studies on reuterin synthesis by Lactobacillus reuteri. Microb. Ecol. Health Dis., 1989; 2, 137–144.
36. El-Ziney, M. G., van der Tempel, T., Debevere, J., Jakobsen, M.: Application of reuterin produced by Lactobacillus reuteri 12002 for meat decontamination and preservation. J. Food Prot., 1999; 62, 257–261.
37. Lüthi.Peng, Q., Dileme, F. B., Puhan, Z.: Effect of glucose on glycerol bioconversion by Lactobacillus reuteri. Appl. Microbiol. Biotechnol., 2002; 59, 289–296.
38. Talarico, T. L., Dobrogosz, W. J.: Chemical characterization of an antimicrobial substance produced by Lactobacillus reuteri. Antimicrob. Agents Chemother., 1989; 33, 674–679.
39. Schauenstein, E., Esterbauer, H., Zollner, H.: Saturated aldehydes. In: Schauenstein, E., Esterbauer, H., Zollner, H., eds. Aldehydes in biological systems. Their natural occurrence and biological activities, ed. London: Pion 1997.
40. Twomey, D., Ross, R. P., Ryan, M., Meany, B., Hill, C.: Lantibiotics produced by lactic acid bacteria: structure, function and applications. Antonie Leeuwenhoek, 2002; 82, 165–185.
41. Nousiainen, J., Javanainen, P., Setälä, J., von Wright, A.: Lactic acid bacteria as animal probiotics. In: Salminen, S., von Wright, A., Ouwehand, A. C., eds. Lactic Acid Bacteria: Microbiological and Functional Aspects, 3rd ed. New York: Marcel Dekker Inc. 2004.
Labels
Pharmacy Clinical pharmacologyArticle was published in
Czech and Slovak Pharmacy

2010 Issue 4
-
All articles in this issue
- Antimicrobial substances produced by lactic acid bacteria
-
Standardní receptura pro přípravu léčivých přípravků v lékárnách IV
Čím může být užitečná sbírka Formularium hospitale
- Drug controlled release from dosage forms coated with aqueous cellulose and acrylic polymer dispersions
- Vývoj terapie těhotných žen s epilepsií v ostravském regionu v letech 1991 až 2006
- Technology of controlled-release tablets containing highly soluble active ingredients
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- About the journal
Most read in this issue
-
Standardní receptura pro přípravu léčivých přípravků v lékárnách IV
Čím může být užitečná sbírka Formularium hospitale
- Technology of controlled-release tablets containing highly soluble active ingredients
- Drug controlled release from dosage forms coated with aqueous cellulose and acrylic polymer dispersions
- Antimicrobial substances produced by lactic acid bacteria
