Vliv formulačních a procesních proměnných na vlastnosti chitosanových mikrosfér připravených vnější iontovou gelací
Impact of formulation and process parameters on the properties of chitosan-based microspheres prepared by external ionic gelation
The aim of this experimental study was to optimize a preparation of microspheres from high viscosity chitosan by external ion gelation and to evaluate selected aspects of their preparation. For drug-free microparticles, the concentration of chitosan dispersions was chosen as a formulation variable; the position of instrument for a dispersion extrusion (horizontal vs. vertical) was evaluated as a process variable. On the basis of sphericity and equivalent diameter results, three different concentrations of chitosan dispersions were used for 5-aminosalicylic acid (5-ASA) encapsulation with the extrusion instrument in horizontal position, which was considered as the optimal. In consequent drug-loaded microparticle preparation, the influence of the concentration of chitosan dispersions and composition of hardening solution (10% sodium tripolyphosphate (TPP) vs. 10% TPP containing drug) was evaluated. In prepared 5-ASA microspheres it was found that the equivalent diameter increased with increasing chitosan concentration. In the case of sphericity, significant differences were not found. Samples prepared with the drug in both chitosan dispersion and hardening solution had a higher drug content, a smaller equivalent diameter and they showed a faster in vitro drug release in comparison with the samples prepared with the drug in chitosan dispersion only.
Keywords:
microparticles • external ionic gelation • chitosan • formulation and process parameters • dissolution profile
:
Romana Kubánková; Jakub Vysloužil; Martina Kejdušová; David Vetchý; Kateřina Dvořáčková
:
Čes. slov. Farm., 2014; 63, 127-135
:
Original Articles
Cílem experimentální studie bylo optimalizovat přípravu mikrosfér z vysokoviskozitního chitosanu metodou vnější iontové gelace a zhodnotit vybrané aspekty jejich přípravy. U mikročástic bez léčiva byla formulační proměnnou koncentrace chitosanových disperzí, procesní proměnnou pak byla poloha přístroje (horizontální vs. vertikální) pro jejich extruzi. Na základě výsledků sféricity a velikosti připravených mikročástic byly vybrány tři koncentrace disperzí, které se použily pro enkapsulaci modelového léčiva 5-aminosalicylové kyseliny (5-ASA) metodou využívající horizontální polohu přístroje pro extruzi, která byla vyhodnocena jako optimální. U mikročástic s léčivem byly sledovanými proměnnými koncentrace chitosanu a složení tvrdícího roztoku (10% tripolyfosfát sodný (TPP) vs. 10% TPP s obsahem léčiva). Bylo zjištěno, že u připravených mikrosfér se s vzrůstající koncentrací chitosanu zvyšoval jejich ekvivalentní průměr, sféricita byla srovnatelná. Vzorky, při jejichž přípravě bylo léčivo přítomno jak v disperzi chitosanu, tak i v tvrdící lázni, měly vyšší obsah léčiva a menší ekvivalentní průměr a vykazovaly rychlejší uvolňování léčiva v podmínkách in vitro v porovnání se vzorky, u kterých bylo léčivo zapracováno pouze do disperze chitosanu.
Klíčová slova:
mikročástice • vnější iontová gelace • chitosan • formulační a procesní parametry • disoluční profil
Úvod
Chitosan je polosyntetický polymer připravovaný deacetylací přírodního polysacharidu chitinu obsaženého zejména v krunýři korýšů, kutikule hmyzu a v buněčné stěně hub1, 2). Z chemického hlediska je chitosan lineární polysacharid složený z jednotek N-acetyl-D-glukosaminu a D-glukosaminu3). Vlastnosti chitinu a chitosanu se liší v závislosti na uspořádání řetězců a stupni deacetylace. α-chitin (výskyt: krabi, krevety, humři) má polysacharidové řetězce spojeny antiparalelně, β-chitin (výskyt: chobotnice) paralelně a γ-chitin (výskyt: buněčné stěny hub) obsahuje řetězce spojené jak paralelně, tak antiparalelně2). Stupeň deacetylace chitosanu souvisí s jeho rozpustností ve vodě. V případě, že je stupeň deacetylace nízký (např. 40 %), je rozpustný v roztoku o pH vyšším než 9, naopak vysoký stupeň deacetylace (nad 85 %) umožňuje rozpouštění již při pH 6,54).
Díky svým jedinečným vlastnostem, snadné dostupnosti a nízké ceně se chitosan významně uplatňuje také při vývoji moderních lékových forem s řízeným a cílených transportem léčiva. Chitosan vykazuje biokompatibilitu a biodegradovatelnost, je ekologicky bezpečný a netoxický5). Aminové skupiny chitosanu jsou schopny elektrostaticky interagovat s deriváty N-neuraminové kyseliny mucinu. Chitosan tak vykazuje výborné mukoadhezivní vlastnosti6, 7). Jeho biologická aktivita spočívá v imunomodulačním a antimikrobiálním účinku, který byl předmětem zájmu mnoha vědeckých prací8, 9). Má schopnost aktivovat makrofágy a stimulovat uvolnění cytokinů10). Evansonová et al. a následně také Yen et al. prokázali antioxidační vlastnosti chitosanu z krunýře krabů a jeho schopnost vychytávat hydroxylové radikály2, 11). Mezi další významné vlastnosti, kterými chitosan disponuje, patří antivirová, antimykotická8) a hemostatická aktivita12).
Velmi oblíbeným je chitosan při formulaci mikročásticové lékové formy13, 14). Mikročástice se jako tzv. lékové mikroformy vyznačují nižšími nežádoucími účinky inkorporovaných léčiv, vyšší stabilitou a efektivitou terapie ve srovnání s klasickými lékovými formami15). Chitosanové mikročástice představují biodegradovatelný systém potencionálně vhodný pro celou řadu způsobů podání do organismu zahrnující perorální, parenterální i lokální podání. Na základě svých specifických vlastností často umožňují doručení enkapsulovaného léčiva do místa jeho působení. Takový cílený transport představuje nejefektivnější způsob současné farmakoterapie s minimalizací nežádoucích účinků16). Z výše popsaných důvodů se chitosanové mikročástice jeví jako vhodná transportní forma pro přívod léčiva do střeva nebo jeho částí postižených nespecifickým střevním zánětlivým onemocněním17). Chitosanové mikročástice jsou nejčastěji připravovány třemi metodami, a to sprejovým sušením18), metodou odpaření rozpouštědla19) a síťovacími metodami20). Polymerní síť může vzniknout tvorbou kovalentních vazeb (chemická gelace) nebo na základě elektrostatických interakcí na řetězcích polymerů (fyzikální neboli iontová gelace). Při iontové gelaci se jako síťovací činidlo pro polykationt chitosan nejčastěji používá netoxický tripolyfosfát sodný21, 22). Mezi základní formulační proměnné sledované při přípravě mikročástic iontovou gelací patří koncentrace polymeru, jeho molekulová hmotnost23), koncentrace síťovacího činidla, množství enkapsulovaného léčiva24, 25). Mezi sledované procesní proměnné vnější gelace patří zejména průměr otvoru, kterým je disperze polymeru extrudována, vzdálenost tohoto otvoru od hladiny síťovacího činidla, rychlost odkapávání26), doba tvrzení27).
Cílem studie byla optimalizace přípravy mikročástic na bázi vysokoviskozitního typu chitosanu získaného z krunýřů krabů jako potencionálního nosiče léčivé látky. Mikročástice se připravily metodou vnější gelace extruzí disperze přes jehlu injekční stříkačky. Jako tvrdící médium se použil 10% roztok tripolyfosfátu sodného (TPP). U mikročástic bez léčiva byla formulační proměnnou koncentrace chitosanu, procesní proměnnou pak byla poloha přístroje (horizontální vs. vertikální) pro extruzi disperzí. Na základě výsledků sféricity a velikosti připravených mikročástic byly vybrány tři šarže, u nichž byla hodnocena bobtnavost, které se dále použily pro enkapsulaci léčivé látky 5-aminosalicylové kyseliny. Sledoval se vliv koncentrace chitosanových disperzí a složení tvrdícího roztoku (10% TPP vs. 10% TPP s obsahem léčiva) na vlastnosti mikročástic s léčivem, a to na sféricitu, velikost mikročástic, obsah 5-aminosalicylové kyseliny, enkapsulační účinnost a disoluční chování v podmínkách in vitro.
Pokusná část
Materiál
Jako polymer pro přípravu mikročástic se použil vysokoviskozitní typ chitosanu získaný z krunýřů krabů; stupeň deacetylace 80 % (Sigma Aldrich, St. Louis, USA), síťovacím činidlem byl 10% roztok tripolyfosfátu sodného (Merck KGaA, Darmstadt, Německo) v čištěné vodě, modelovou léčivou látkou určenou k enkapsulaci do mikročástic byla 5 - aminosalicylová kyselina (5-ASA) (Sigma Aldrich, St. Louis, USA). Pro přípravu tlumivého roztoku o pH 6,8 bylo použito 13,87 g dihydrogenfosforečnanu draselného (MerckKGaA, Darmstadt, Německo) a 35,08 g hydrogenfosforečnanu sodného (MerckKGaA, Darmstadt, Německo). Na přípravu pufru o pH 3,0 bylo použito 3,4 g dihydrogenfosforečnanu draselného (MerckKGaA, Darmstadt, Německo) a k úpravě pH kyselina fosforečná (MerckKGaA, Darmstadt, Německo).
Příprava mikročástic
Zvolenou metodou pro přípravu mikročástic byla metoda vnější iontové gelace. Disperze chitosanu bez léčiva (0,75–1,75 %; nárůst koncentrace vždy o 0,25 %) byly připraveny jeho navrstvením na hladinu 1% roztoku kyseliny octové a následně se nechaly bobtnat 48 hodin. Disperze s léčivem (koncentrace léčiva 0,25 %) byly připraveny suspendováním 5-ASA do chitosanových disperzí (1,0–1,5 %) pomocí rotor-statorového homogenizátoru Ultra-Turrax T25 BASIC (IKA – Werke GmbH & Co. KG, Staufen, Německo) při 16 000 otáčkách za minutu. Disperze byly naplněny do injekčních stříkaček o objemu 2 ml s průměrem jehly 0,7 mm a odkapány do tvrdícího roztoku pomocí lineárního dávkovače LD 2 umístěného ve vertikální nebo horizontální poloze (vývojové dílny ČSAV, Praha, ČR). Jako tvrdící médium se použilo 60 ml 10% roztoku TPP nebo 10% roztoku TPP s 5-ASA (1160 mg/l)28). Doba tvrzení byla stanovena experimentálně a pohybovala se v rozmezí od 45–60 minut. Vzniklé mikročástice se filtrovaly pomocí filtračního sítka a promyly destilovanou vodou. Připravené vzorky se sušily v horkovzdušné sušárně Horo 048B (Dr. Ing. A. Hoffman, Ostfildern, Německo) při teplotě 25 °C po dobu 24 hodin.
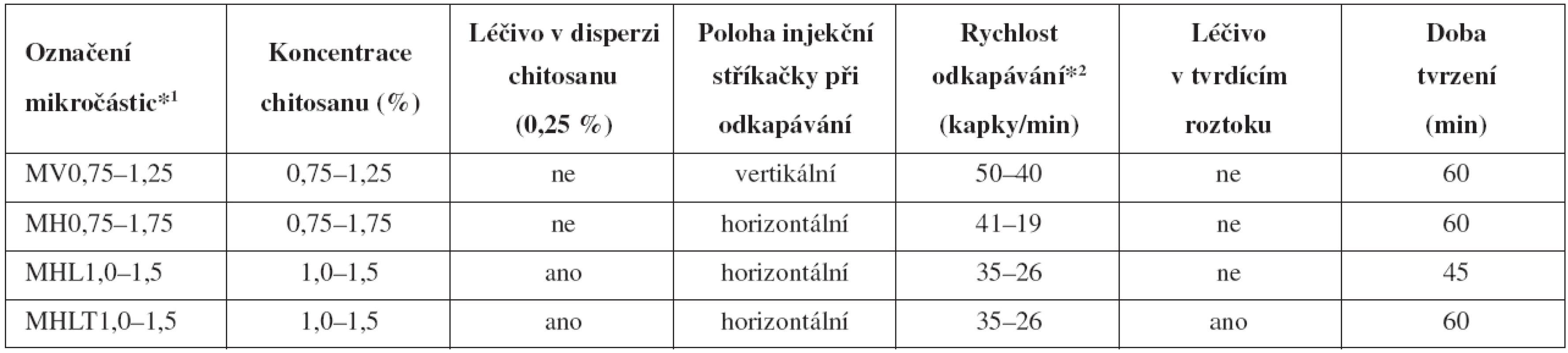
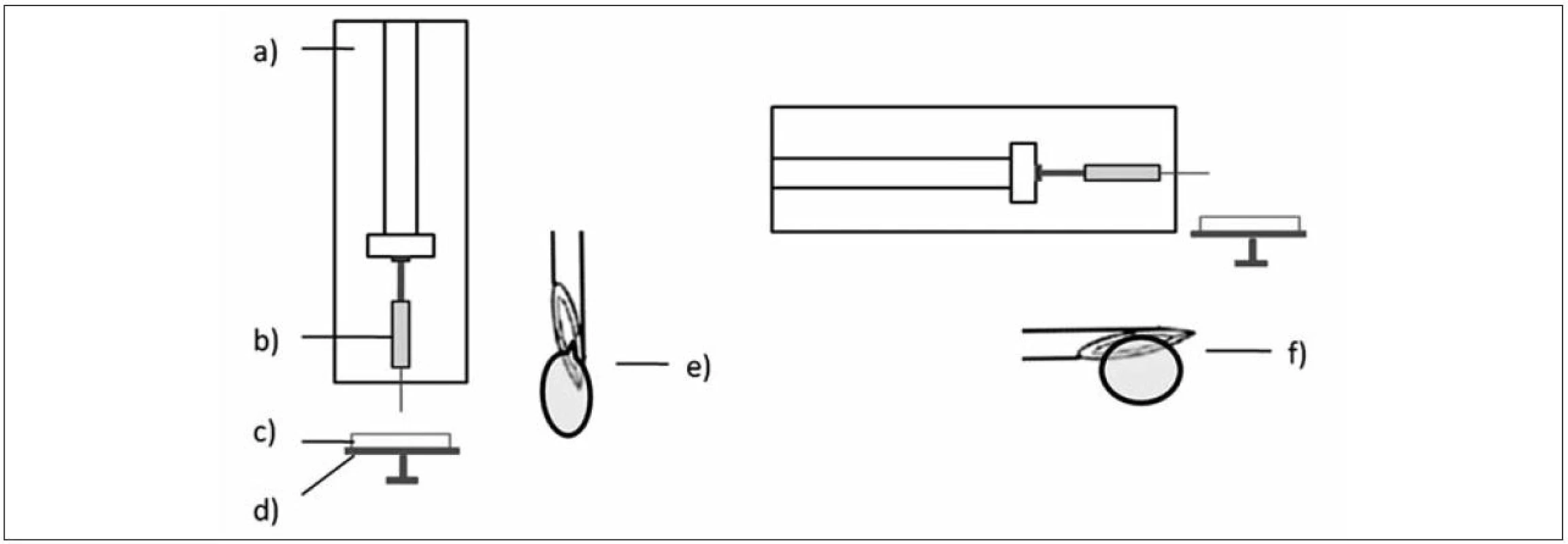
Popis jednotlivých šarží připravených mikročástic, rozsah koncentrací disperzí a podmínky přípravy jednotlivých vzorků jsou uvedeny v tabulce 1. Označování vzorků: „V“ – vertikální a „H“ – horizontální poloha lineárního dávkovače (obr. 1); „M“ – připravené mikročástice; „L“ – přítomnost léčiva v disperzi chitosanu; „LT“ – léčivo v disperzi chitosanu a současně v tvrdícím roztoku.
Charakteristika disperzí
Stanovení dynamické viskozity bylo důležitým parametrem pro zjištění injektability připravených disperzí. Měření probíhalo pomocí viskozimetru BROOKFIELD DV-II+Pro a programu RHEOCALC (Brookfield Engineering, USA). Během měření, které probíhalo při teplotě 37 °C, se použil adaptér pro měření malých vzorků a vřeteno SC4-21. Otáčky vřetena byly u všech měření stejné (200 ot./min). Výsledná viskozita a její směrodatná odchylka (SD) byla dána průměrem tří měření.
Charakteristika mikročástic
Mikroskopická analýza
Mikroskopická analýza byla provedena pomocí stereoskopického mikroskopu STM-902 ZOOM (Opting servis, Ostrava, Česká republika) s digitální kamerou ALPHAPHOT (Nikon, Tokyo, Japonsko). Ke zpracování obrazové analýzy sloužil program Ia32 (LecoCorporation, St. Joseph, USA). Snímky byly pořízeny pomocí stereoskopického mikroskopu NIKON SMZ1500, C-PS160 (Nikon, Tokyo, Japonsko). U 100 mikročástic z každé šarže byla stanovena sfericita pomocí faktoru kulatosti:
SF = 4πA/p2, [1]
kde A (area) je plocha mikročástice v mm2 a p (perimeter) je obvod mikročástice v mm. Dalším sledovaným parametrem byl ekvivalentní průměr (ED = equivalent diameter), který určuje průměr kružnice, která má stejnou plochu jako objekt29):
4 × A
ED = (–––––– – )1/2 (mm), [2]
π
kde A je plocha mikročástice (mm2).
Bobtnavost
U vybraných vzorků bez léčiva byla provedena zkouška bobtnavosti v tlumivém roztoku o pH 3,0 simulující pH žaludku po jídle a v tlumivém roztoku o pH 6,8, což odpovídá pH tenkého střeva30). Mikročástice o hmotnosti 200 mg z každé šarže bylo vloženo do zvážených kovových košíčků a nechalo se bobtnat v předepsaném prostředí. V daných intervalech (15, 30, 45, 60 minut, dále v čase 2, 3, 4, 5, 6 hodin) se košíčky vyjmuly, přebytečné disoluční médium se odstranilo a košíčky s mikročásticemi se zvážily na analytických vahách. Bobtnavost byla počítána podle vzorce (3):
Wt–Wo
Ssw = –––––– – × 100 (%), [3]
Wo
kde wt je hmotnost mikročástic v gramech v daném časovém intervalu, wo je původní hmotnost mikročástic v gramech30). Měření bylo provedeno 3krát v obou tlumivých roztocích u každé z šarží.
Stanovení obsahu léčiva a enkapsulační účinnosti
Obsah léčiva v mikročásticích byl stanoven spektrofotometricky. Přesně zvážené množství mikročástic (množství mikročástic odpovídající 0,5 mg léčiva vypočítané dle skutečného obsahu) bylo převedeno do odměrné baňky a doplněno čištěnou vodou. Baňka byla umístěna na ultrazvukovou lázeň Sonorex RK 52H (Bandelin, Berlín, Německo) po dobu 5 hodin. Absorbance byla měřena UV/VIS spektrofotometrem (Lambda 25, Perkin Elmer, St. Louis, USA) při vlnové délce 330 nm. Pomocí kalibrační křivky byl vypočítán obsah léčiva v mikročásticích. Enkapsulační účinnost byla vypočítána ze vztahu:
cs
EE = ––– – . 100 (%) [4]
ct
kde cs je skutečný obsah 5-ASA v gramech v mikročásticích a ct je teoretický obsah v gramech v mikročásticích31).
Zkouška disoluce
Ke zkoušce disoluce byla vybrána košíčková metoda. Zkouška probíhala v on-line disoluční lince Sotax AT7 Smart (Donaulab, Zurich, Švýcarsko) s automatickým odběrem vzorků a následnou spektrofotometrickou analýzou při vlnové délce 330 nm (Spektrofotometr Lambda 25, Perkin Elmer, Wellesley, USA). Jako disoluční médium sloužil lékopisný tlumivý roztok o pH 6,8 (dodekahydrát hydrogenfosforečnanu sodného a dihydrogenfosforečnan draselný – oba Merck KGaA, Darmstadt, Německo) v množství 500 ml a teplotě 37 ± 0,5 °C. Rychlost otáček hřídelí s košíčky byla 100 otáček za minutu. Odběry vzorků byly provedeny v časech 30 a 60 minut a poté každou hodinu.
Výsledky a diskuze
Charakteristika disperzí
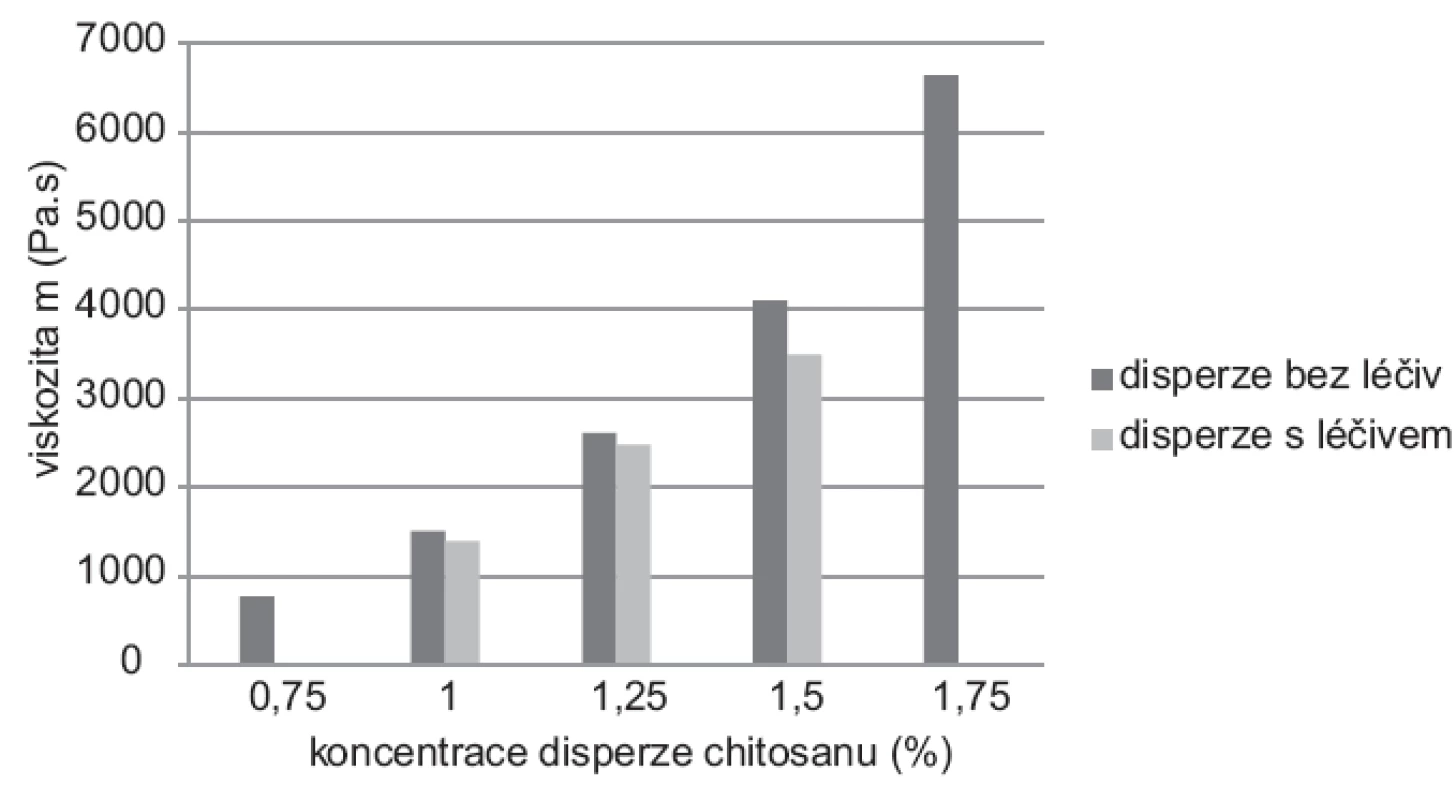
Naměřené hodnoty dynamické viskozity u disperzí (0,75–1,75 %) bez léčiva se pohybovaly v rozmezí 767–6598 mPa.s (SDmax ± 8,1), u disperzí s léčivem (1,0–1,5 %) v rozmezí 1390–3492 (SDmax ± 5,2). Z grafu uvedeného na obrázku 2 je patrné, že se vzrůstající koncentrací chitosanu rostla viskozita32). Hodnoty viskozity chitosanových disperzí s léčivem byly nižší než u disperzí bez obsahu léčiva při stejné koncentraci polymeru. Mura et al. ve své experimentální práci zjistili, že dochází k elektrostatickým interakcím mezi 5-ASA a chitosanem, které způsobují pravděpodobně změnu vnitřní struktury disperze projevující se snížením viskozity33).
Charakteristika mikročástic
Vizuální hodnocení připravených mikročástic a mikroskopická analýza
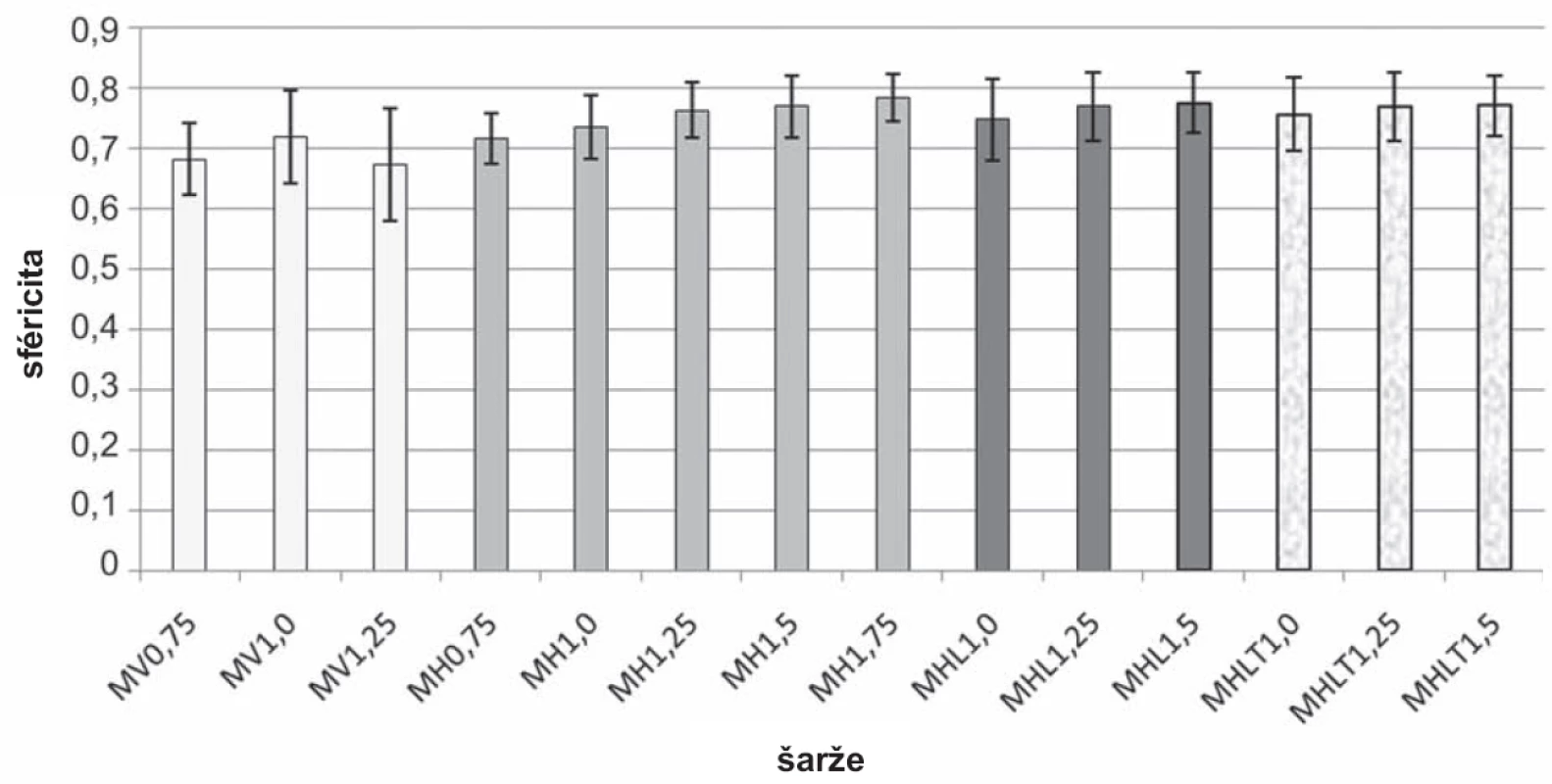
Při vertikálním umístění přístroje se podařilo připravit chitosanové mikročástice pouze při koncentraci disperze 0,75–1,25 %. Sféricita mikročástic (obr. 3) šarže MV0,75 (0,681 ± 0,059) byla nižší než sféricita mikročástic šarže MV1,0 (0,718 ± 0,078), což souvisí s faktem, že se zvyšující se viskozitou zpravidla roste sféricita připravovaných mikročástic34). Při přípravě částic z disperze chitosanu o koncentraci 1,25 % docházelo k tvorbě kapkovitých struktur (obr. 4a) s nižší sféricitou (0,673 ± 0,094). V případě vysokých koncentrací disperze chitosanu (1,5 % a 1,75 %) docházelo z důvodu vyšší viskozity k tvorbě podlouhlých částic (obr. 5a) až vláknitých struktur (obr. 5b), které byly zcela nevyhovující a byly z dalšího hodnocení vyloučeny. Při horizontální poloze přístroje byly mikročástice připraveny u všech pěti použitých koncentrací (MH0,75–MH1,75). Se zvyšující se koncentrací disperze chitosanu doprovázené nárůstem viskozity byl pozorován mírný nárůst sféricity připravených částic. Tento výsledek je ve shodě s již publikovanou vědeckou literaturou35). Jejich sféricita byla vyšší (0,716 ± 0,042–0,784 ± 0,04) ve srovnání s částicemi připravenými pomocí přístroje ve vertikální poloze (0,673 ± 0,094–0,718 ± 0,078). Srovnání tvaru mikrosfér přináší obrázek 4, a to vzorek MV1,25 (obr. 4a) a MH1,25 (obr. 4b).
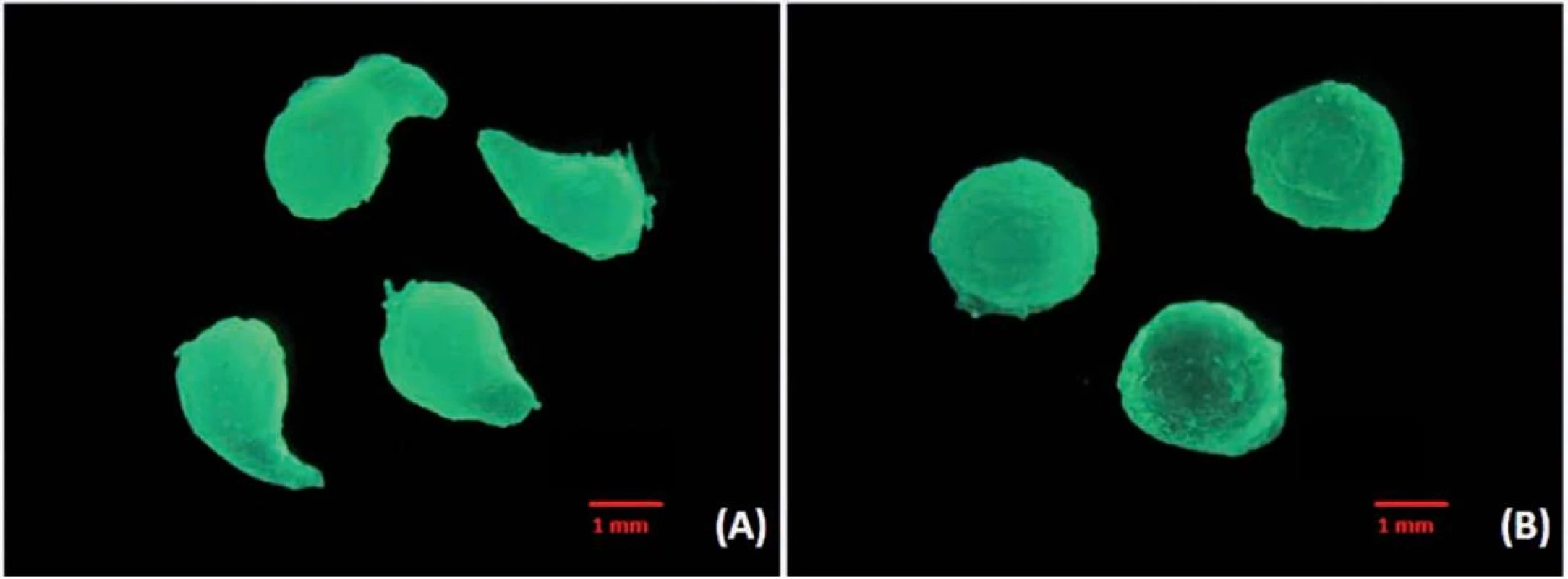
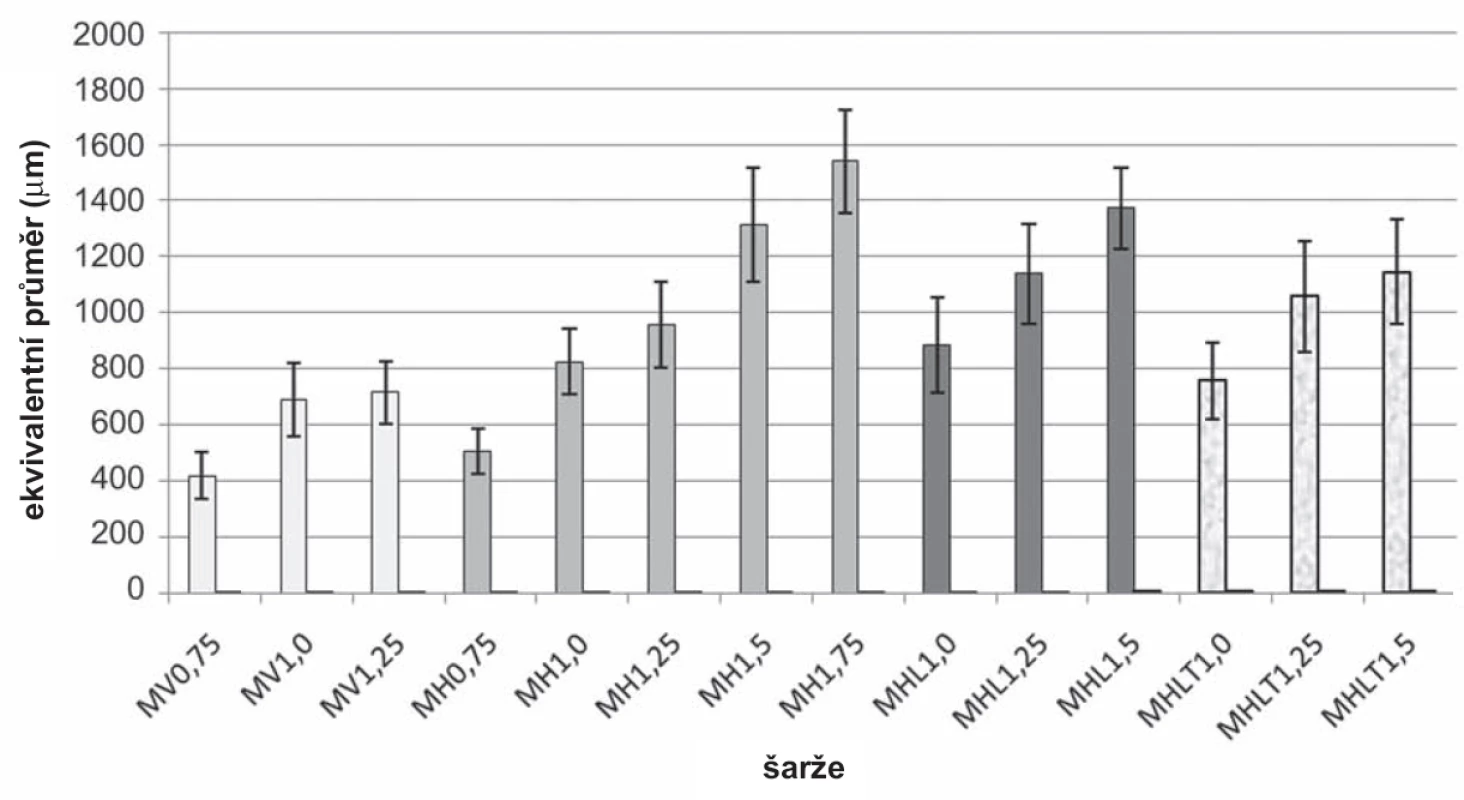
Při porovnání ekvivalentního průměru mikročástic bez léčiva vzorků MV0,75 (418 ± 85,2 μm) – MV1,25 (716 ± 110,7 μm) a MH0,75 (506 ± 82,2 μm) – MH1,75 (1541 ± 183,3 μm) bylo zjištěno, že velikost těchto částic byla větší v případě horizontální polohy (obr. 6). Z výsledků vyplývá, že zvyšující se koncentrace/viskozita disperzí chitosanu vedla k přípravě mikročástic s větší velikostí, což je ve shodě s již publikovanou literaturou34). Velikost kapky je závislá nejen na viskozitě, ale také na celé řadě dalších faktorů jako je mezifázové napětí, smáčivost, tlak, rychlost a úhel odkapávání, průměr a tvar otvoru, jímž roztok odkapává26, 36–38). V našem případě byla použita jehla, která měla zkosení (obr. 1). Na základě povrchového napětí docházelo v horizontální poloze k tvorbě větších kapek. Ve vertikální poloze se tvořily kapky menší, čemuž napomáhala ostrá hrana zkosení jehly. Tato ostrost se však postupně snižovala, a docházelo tak k tvorbě kapkovitých struktur s větším povrchem a muselo dojít k výměně jehly.
Na základě hodnocení mikročástic z hlediska sféricity, ekvivalentního průměru a injektability byly pro inkorporaci modelového léčiva vybrány tři koncentrace disperzí chitosanu, které se použily pro přípravu mikročástic s léčivem horizontální metodou a to 1,0 %; 1,25 % a 1,5 %. Vzorky MHL byly připraveny odkapáváním disperzí s léčivem do 10% roztoku TPP; doba tvrzení (45 minut) byla kratší z důvodu předpokládaného zvýšeného uvolňování léčiva do tvrdícího roztoku39). Vzorky MHLT byly připraveny odkapáváním disperzí s léčivem do 10% roztoku TPP obsahujícího 5-ASA v její nasycené koncentraci 1160 mg/l; doba tvrzení byla delší, a to 60 minut z důvodu nižší předpokládané ztráty léčiva. Ze srovnání sféricity vzorků MHL1,0 (0,747 ± 0,067) – MHL1,5 (0,775 ± 0,051) a vzorků MHLT1,0 (0,756 ± 0,06) – MHLT1,5 (0,770 ± 0,051) vyplývá, že hodnoty sféricity se výrazně nelišily. Kratší doba tvrzení obvykle vede ke snížení sféricity připravených částic40). Na druhou stranu vyšší obsah 5-ASA ve vzorcích MHLT (viz dále) ve srovnání se vzorky MHL by taktéž mohl být důvodem pro pokles sféricity41). Tyto dva protichůdné vlivy se pravděpodobně projevily ve výsledku srovnatelnou sféricitou vzorků MHL a MHLT (obr. 5).
Při porovnání ekvivalentního průměru šarží MH1,0 (825 ± 116,9 μm) – MH1,5 (1313 ± 201,6 μm) a MHL1,0 (882 ± 169,4 μm) – MHL1,5 (1373 ± 143,7 μm) se ukázalo, že tento parametr byl větší u částic s léčivem než u částic bez léčiva, což je ve shodě s publikovanou literaturou42). Ekvivalentní průměr mikročástic šarží MHLT1,0 (756 ± 139,2 μm) – MHLT1,5 (1145 ± 187,1 μm) byl menší, než ekvivalentní průměr mikročástic šarží MHL1,0 (882 ± 169,4 μm) – MHL1,5 (1373 ± 143,7 μm). Z uvedeného vyplývá, že pokud bylo přítomno v tvrdícím roztoku léčivo, velikost těchto mikročástic byla menší než v případě, že tvrdící roztok léčivo neobsahoval (obr. 6). Důvodem mohla být delší doba tvrzení a přítomnost 5-ASA v tvrdícím roztoku, čímž se více snížila viskozita disperze chitosanu, a tvrdící roztok tak lépe pronikal do mikročástice. V důsledku toho došlo ke snížení počtu nezesíťovaných řetězců molekuly chitosanu43, 44).
Hodnocení bobtnavosti mikročástic bez léčiva
K hodnocení bobtnavosti byly použity vzorky bez léčiva MH1,0; MH1,25; MH1,5, které na základě svých vlastností byly vybrány pro přípravu mikročástic s léčivem. Bobtnavost v tlumivém roztoku byla provedena o pH 3,0 simulující pH žaludku po jídle a v tlumivém roztoku o pH 6,8, což odpovídá pH tenkého střeva17). Při pH 3,0 se u šarže MH1,0 bobtnavost začala snižovat již po 15 minutách. U šarží MH1,25 a MH1,5 se bobtnavost během prvních 30 minut zvyšovala, přičemž nejvyšší hodnoty (163,44 %) bylo dosaženo u šarže MH1,25. Následně se hodnoty bobtnavosti s časem snižovaly. Při porovnání jednotlivých šarží se pak hodnoty mezi sebou výrazně nelišily (obr. 7). Průběh křivek svědčí o pravděpodobném rozpouštění chitosanových mikročástic v prostředí o daném pH45).
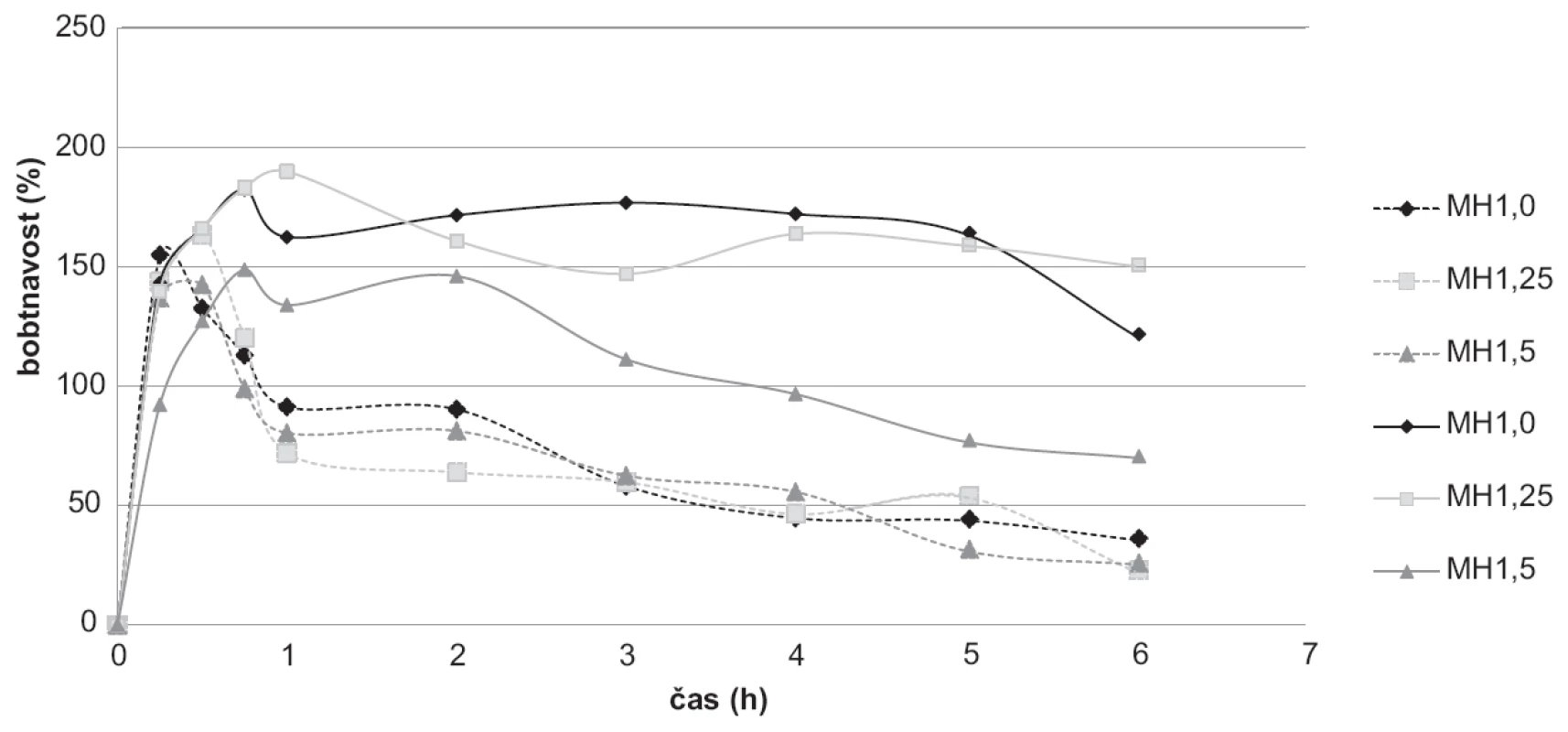
Při zkoušce v pH 6,8 docházelo u všech vzorků ke zvyšování přírůstku hmotnosti v první půl hodině až hodině zkoušky (149–190 %), přičemž nejvyšší hodnota byla naměřena u šarže MH1,25. Poté docházelo spíše ke snižování hmotnosti nabobtnalých mikročástic, a to zejména v případě šarže MH1,5, kdy nejnižší hodnota dosahovala 70,04 % (obr. 7). Nižší hodnoty bobtnavosti u této šarže mohly být způsobeny vyšší hustotou sítě díky vyšší koncentraci chitosanu a delší době tvrdnutí. To pravděpodobně omezilo difuzi vody do síťovité struktury43). Další možností je přítomnost většího množství nezesíťovaných molekul polymeru, které difundují z částice do okolního roztoku44). Nejvíce stabilní hodnoty bobtnavosti v pH 6,8 byly naměřeny u šarže MH1,0. Mezi 1. a 5. hodinou zkoušky se hodnota bobtnavosti u tohoto vzorku pohybovala v intervalu 162,55–177,18 %. Obecně byly naměřeny vyšší hodnoty při pH 6,8 (70,04–190,00 %) oproti bobtnavosti při pH 3,0 (22,44–163,43 %)46).
Stanovení obsahu a enkapsulační účinnosti mikročástic s léčivem
Výsledky obsahu 5-ASA v mikročásticích a jejich SD jsou uvedeny v tabulce 2. Z důvodu předpokládané ztráty léčiva při příliš dlouhé době tvrzení27), byla tato doba u šarží MHL1,0–MHL1,5 zkrácena na 45 minut. Obsah léčiva u vzorků MHL se pohyboval v intervalu 2,86 až 5,02 mg/1 g mikročástic, u vzorků MHLT v intervalu 8,24–8,60 mg/ 1 g mikročástic. Umístění 5-ASA v její nasycené koncentraci do tvrdícího roztoku tedy vedlo ke zvýšení obsahu léčiva. Zamezení ztráty léčiva tímto technologickým krokem se nejvíce projevilo u vzorku připraveného z nejméně viskózní 1% disperze chitosanu, u kterého obsah léčiva vzrostl téměř 3krát. Vliv rostoucí koncentrace chitosanových disperzí na obsah léčiva byl patrný pouze u vzorků MHL.
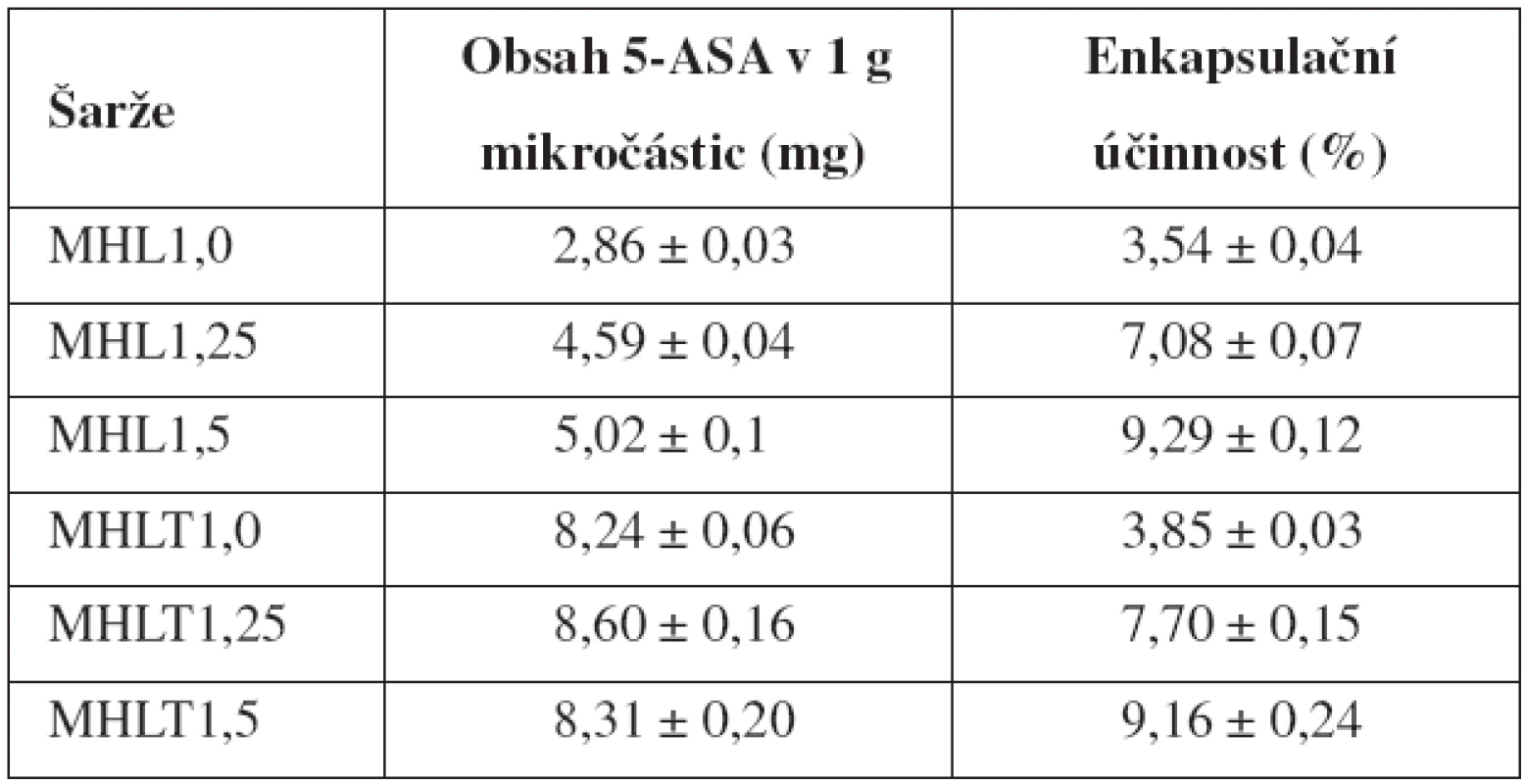
Z výsledků dále vyplývá, že se zvyšující se koncentrací disperzí chitosanu, a tedy také jejich viskozitou, se mírně zvyšovala enkapsulační účinnost. K podobným výsledkům dospěl Das et al. ve své experimentální studii zabývající se přípravou pektino-chitosanových mikročástic pro přívod léčiva do oblasti kolonu39). Enkapsulační účinnost u vzorků MHL1,0–MHL1,5 nabývala hodnot 3,54-9,29 %; u vzorků MHLT1,0 – MHLT1,5 pak byly hodnoty srovnatelné, a to v rozmezí 3,85–9,16 % (tab. 2). Srovnatelné výsledky enkapsulační účinnosti vzorků MHL a MHLT byly způsobeny nutností zahrnout do výpočtu EE u vzorků MHLT také léčivo obsažené v tvrdícím roztoku (69,6 mg 5-ASA/60 ml TPP roztoku). Obecně lze říci, že obsah léčiva i EE jsou poměrně nízké. Důvody lze spatřovat v hydrofilním charakteru léčiva, jeho nízké molekulové hmotnosti47) a hydrofilitě polymeru.
Zkouška disoluce
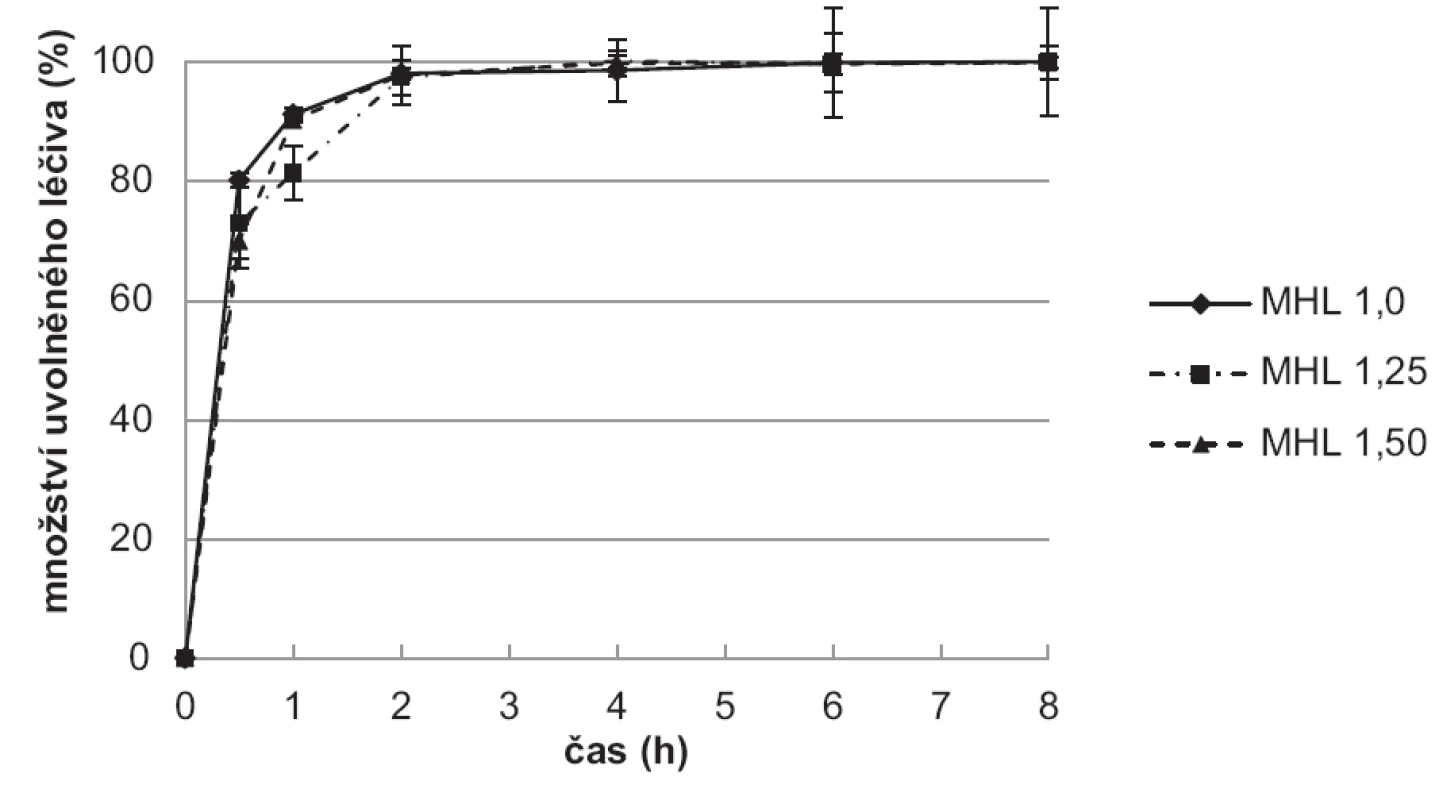
Výsledky disoluční zkoušky ukazují, že vzorky připravené použitím tvrdící lázně (10% TPP) bez léčiva (obr. 8) uvolnily léčivo pomaleji ve srovnání se vzorky připravenými v tvrdící lázni s léčivem (obr. 9). Hodnoty SD v jednotlivých časových bodech jsou vyjádřeny jako chybové úsečky.
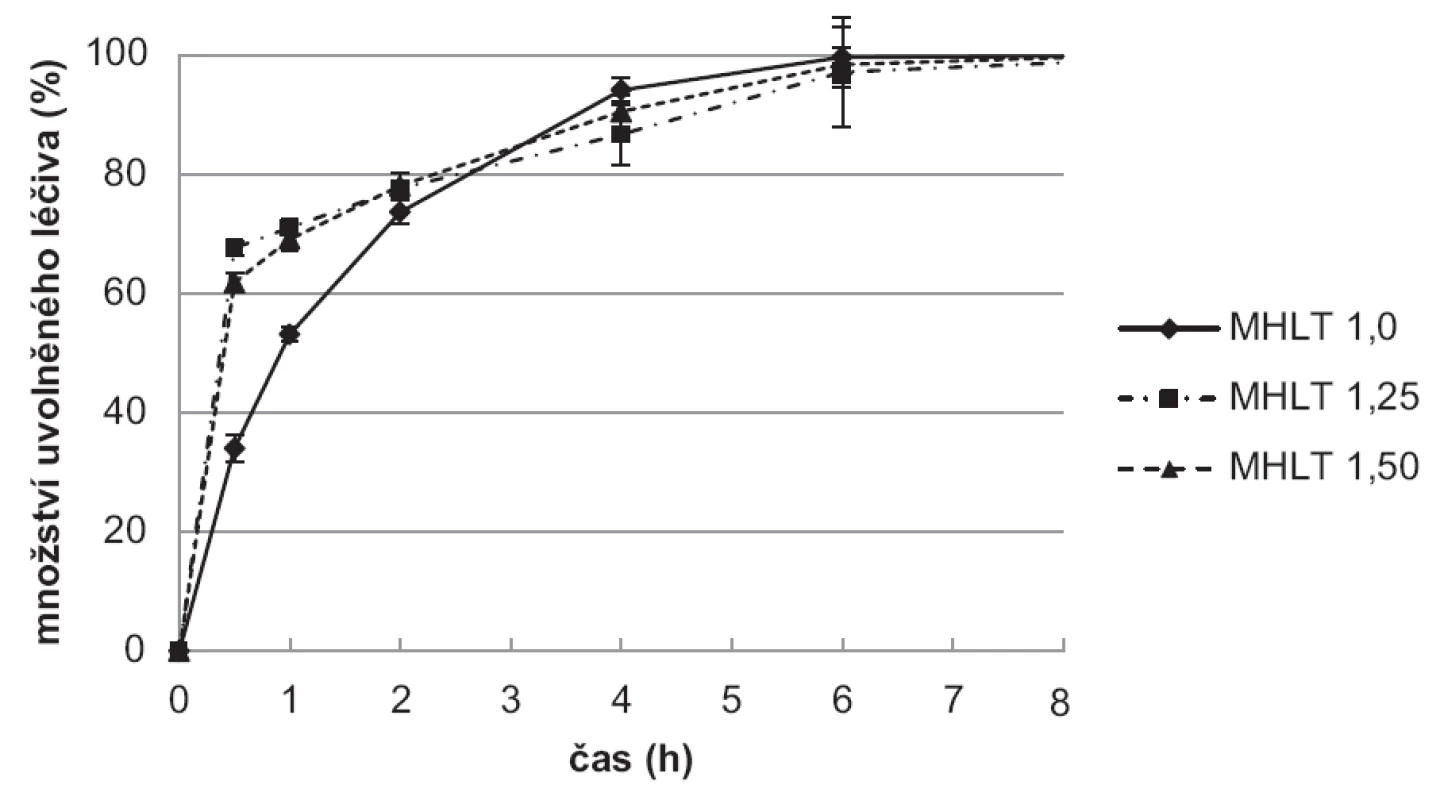
Vzorky připravené v tvrdící lázni s léčivem (MHLT) měly pravděpodobně značnou část léčiva enkapsulovanou při svém povrchu a uvolnily více než 70 % léčiva v čase 30 minut. Celé množství léčiva se pak uvolnilo v průběhu 2 hodin. Rychlejší uvolňování bylo dále podpořeno menší velikostí/větším povrchem částic připravených touto metodou. Zajímavé je srovnání s předchozí experimentální prací, při které se k přípravě mikročástic stejnou metodou použily disperze chitosanu s nižší viskozitou48). Tyto mikročástice uvolnily celé množství léčiva do 30 minut. Výsledky potvrzují významný vliv viskozity disperze na rychlost uvolňování léčiva z chitosanových mikročástic35, 49).
Vzorky připravené v tvrdící lázni bez léčiva (MHL) měly pravděpodobně léčivo rozmístěno rovnoměrněji, což vedlo k pomalejšímu uvolňování 5-ASA. Během prvních 30 minut se uvolnilo 34,0–67,6 % léčiva, celé množství potom v průběhu 6 hodin. Nejpomalejší uvolňování 5-ASA z chitosanových mikročástic bylo dosaženo u vzorku MHL 1,00, a to i přes nejmenší velikost jeho částic. Dosažené výsledky jsou pravděpodobně dány jak nejnižším obsahem léčiva v tomto vzorku, tedy nejnižším koncentračním gradientem, tak rovnoměrnou bobtnavostí vzorku MHL1,0 v čase (obr. 7).
Závěr
Z dosažených výsledků vyplývá, že 1–1,5% disperze chitosanu při horizontální poloze zařízení pro jejich extruzi jsou vhodné pro přípravu mikrosfér s použitým modelovým léčivem metodou vnější iontové gelace. Složení použitého tvrdícího roztoku významně ovlivnilo velikost mikročástic, obsah léčiva i jeho disoluční profil. Přítomnost léčiva v tvrdícím médiu vedla k přípravě mikrosfér s menší velikostí částic, s vyšším obsahem léčiva a rychlejším uvolňováním léčiva. Pro jejich perorální podání za účelem přívodu aktivní látky do distálních částí zažívacího traktu k léčbě nespecifických zánětů je nezbytné zajistit ochranu chitosanových mikročátic před kyselým pH žaludku, např. potažení mikročástic enterosolventním obalem.
Střet zájmů: žádný.
Došlo 21. května 2014 / Přijato 30. května 2014
R. Kubánková • J. Vysloužil • M. Kejdušová • D. Vetchý • doc. PharmDr. Kateřina Dvořáčková, PhD. (∗)
Veterinární a farmaceutická univerzita Brno, Farmaceutická fakulta, Ústav technologie léků
Palackého 1–3, 612 42 Brno
e-mail: dvorackovak@vfu.cz
Sources
1. Park J., Ye M., Park K. Biodegradable polymers for microencapsulation of drugs. Molecules 2005; 10, 146–161.
2. Yen M. T., Yang J. H., Mau J. L. Antioxidant properties of chitosanu from crab shells. Carbohydr. Polym. 2008; 74, 840–844.
3. Croisier F., Jérôme Ch. Chitosan-based biomaterials for tissue engineering. Eur. Polym. J. 2013; 49, 780–792.
4. Singla A. K., Chawla M. Chitosan: some pharmaceutical and biological aspects - an update. J. Pharm. Pharmacol. 2001; 53, 1047–1067.
5. Ilium L. Chitosan and its use as a pharmaceutical excipient. Pharmaceut. Res. 1998; 15, 1326–1331.
6. Meng-Lund E., Muff-Westergaard Ch., Sander C., Madelung P., Jacobsen J. A mechanistic based approach for enhancing buccal mucoadhesion of chitosanu. Int. J. Pharm. 2014; 461, 280–285.
7. Bravo-Osuna I., Vauthier Ch., Farabollini A., Palmieri G. F., Ponchel G. Mucoadhesion mechanism of chitosan and thiolated chitosan-poly(isobutyl cyanoacrylate) core-shell nanoparticles. Biomaterials 2007; 28, 2233–2243.
8. Yang T. C., Chou C. C., Li C. F. Antibacterial aktivity of N-alkylated disacharide chitosan derivatives. Int. J. Food Microbiol. 2005; 97, 237–245.
9. Dehghani F., Hoseini M. H. M., Memarnejadian A., Yeganeh F., Rezaie A. M., Khaze V., Sattari M., Darbandi Tamijani H., Labibi F., Mossaffa N. Immunomodulatory activities of chitin microparticles on Leishmania major-infected murine macrophages: interaction with a bacterial membrane model. Arch. Med. Res. 2011; 42, 572–576.
10. Baldrick P. The safety of chitosan as a pharmaceutical excipient. Regul. Toxicol. Pharm. 2010; 56, 290–299.
11. Evans J. R., Davids W. G., MacRae J. D., Amirbahman A. Kinetics of kadmium uptake by chitosan-based crab shells. Water Res. 2002; 36, 3219–3226.
12. Pusateri A. E., McCarthy S. J., Gregory K. W., Harris R. A., Cardenas L., McManus A. T., Goodwin C. W. Effect of a chitosan-based hemostatic dressing on blood loss and survival in a model of severe velus hemorrhage and hepatic injury in swine. J. Trauma 2003; 54, 177.
13. Wassmer S., Rafat M., Fong W. G., Baker A. N., Tsilfidis C. Chitosan microparticles for delivery of proteins to the retina. Acta Biomater. 2013; 9, 7855–7864.
14. Keegan G. M., Smart J. D., Ingram M. J., Barnes L.-M., Burnett G. R., Rees G. D. Chitosan microparticles for the controlled delivery of fluoride. J. Dent. 2012; 40, 229–240.
15. Bajerová M., Gajdziok J., Dvořáčková K., Masteiková R., Rabišková M. Metody přípravy mikročástic ve farmaceutické technologii. Čes. slov. Farm. 2009; 58, 191–199.
16. Lamprecht A., Torres H. R., Schäfer U., Lehr C. M. Biodegradable microparticles as a two-drug controlled release formulation: a potential treatment of inflammatory bowel disease. J. Control. Release 2000; 69, 445–454.
17. Rabišková M., Bautzová T., Gajdziok J., Dvořáčková K., Lamprecht A., Pellequer Y., Spilková J. Coated chitosanu pellets containing rutin intended for the treatment of inflammatory bowel disease: in vitro characteristics and in vivo evaluation. Int. J. Pharm. 2012; 422, 151–159.
18. Garekani H. A., Moghaddam Z. F., Sadeghi F. Organic solution versus aqueous dispersion of Eudragit RS in preparation of sustained release microparticles of theophylline using spray drying. Colloid Surface B. 2013; 108, 374–379.
19. Vysloužil J., Kejdušová M., Dvořáčková K., Vetchý D. Influence of formulation and process parameters on the characteristics of P LGA-based microparticles with controlled drug release. Čes. slov. Farm. 2013; 62, 120–126.
20. Bajerová M., Dvořáčková K., Gajdziok J., Masteiková R. Mikročástice na bázi oxycelulosy – vliv procesních proměnných na enkapsulační účinnost. Čes. slov. Farm. 2010; 59, 67–73.
21. Shu X. Z., Zhu K. J. A novel approach to prepare tripolyphosphate/chitosanu komplex beat for controlled release drug delivery. Int. J. Pharm. 2000; 201, 51–58.
22. Mi F. L., Sung H. W., Shyu S. S., Su C. C., Peng C. K. Synthesis and characterization of biodegradable TPP/genipin co-crosslinked chitosan gel beads: a new matrix for controlled release of pindolol. Polymer 2003; 44, 6521–6530.
23. Lemoine D., Wauters F., Bouchend’homme S., Préat V. Preparation and characterization of alginate microspheres containing a model antigen. Int. J. Pharm. 1998; 176, 9–19.
24. Narra K., Dhanalekshmi U., Rangaraj G., Raja D., Kumar C. S., Reddy P. N., Mandal A. B. Effect of formulation variables on rifampicin loaded alginate beads. Iran. J. Pharm. Res. 2012; 11, 715–721.
25. Siso M. I. G., Lang E., Carrenõ-Gómez B., Becerra M., Espinar F. O., Méndez J. B. Enzyme encapsulation on chitosan microbeads. Process Biochem. 1997; 32, 211–216.
26. Chan E.-S., Lee B.-B., Ravindra P., Poncelet D. Prediction models for shape and size of ca-alginate macrobeads produced through extrusion-dripping method. J. Colloid Interf. Sci. 2009; 338, 63–72.
27. Patel Y. L., Sher P., Pawar A. P. The effect of drug concentration and curing time on processing and properties of calcium alginate beads containing metronidazole by response surface metodology. AAPS Pharm. Sci. Tech. 2006; 7, E24–E30.
28. 5-Aminosalicylic acid.: Santa Cruz Biotech [online]. [cit. 2013-08-18]. Dostupné z: http://www.scbt.com/datasheet-202890-5-aminosalicylic-acid.html.
29. Smýkalová I., Horáček J., Hýbl M., Bjelková M., Pavelek M., Krulikovská T., Hampel D. Posuzování tvarových a barevných charakteristik semen modelových plodin i v korelaci s jejich obsahovými látkami. Chem. Listy 2011; 105, 138–145.
30. Desai K. G. H., Park H. J. Preparation and characterization of drug-loaded chitosan–tripolyphosphate microspheres by spray drying. Drug Develop. Res. 2005; 64, 114–128.
31. Bajerová M., Dvořáčková K., Gajdziok J., Masteiková R. Mikročástice na bázi oxycelulosy – vliv procesních proměnných na enkapsulační účinnost. Čes. slov. Farm. 2010; 59, 67–73.
32. Cho J., Heuzey M. C., Bégin A., Carreau P. J. Viscoelastic properties of chitosanu solutions: Effect of concentration and ionic strength. J. Food Eng. 2006; 74, 500–515.
33. Mura C., Nácher A., Merino V., Merino-Sanjuán M., Manconi M., Loy G., Fadda A. M., Díez-Sales O. Design, characterization and in vitro evaluation of 5-aminosalicylic acid loaded N-succinyl-chitosan microparticles for colon specific delivery. Colloid Surface B. Biointerfaces 2012; 94, 199–205.
34. Ouwerx C., Velings N., Mestdagh M. M., Axelos M. A. V. Physico-chemical properties and rheology of alginate gel beads formed with various divalent cations. Polym. gels Netw. 1998; 6, 393–408.
35. Ko J. A., Park H. J., Hwang S. J., Park J. B., Lee J. S. Preparation and characterization of chitosanu microparticles intended for controlled drug delivery. Int. J. Pharm. 2002; 249, 165–174.
36. Chen Ch. T., Maa J. R., Yang Y. M., Chang Ch. H. Drop formativ from flat tip nozzles in liquid-liquid systém. Int. Commun. Heat Mass 2001; 28, 681–692.
37. Yeom S., Lee S. Y. Dependence of micro-drop generation performance on dispenser geometry. Exp. Therm. Fluid Sci. 2011; 35, 1565–1574.
38. Lupo B., Maestro A., Porras M., Gutiérrez J. M., González C. Preparation of alginate microspheres by emulsification/internal gelation to encapsulate cocoa polyphenols. Food hydrocolloid. 2014; 38, 56–65.
39. Das S., Chaudhury A., Ng K. Y. Preparation and evaluation of zinc-pectin-chitosanu composite particles for drug delivery to the colon: Role of chitosan in modifying in vitro and in vivo drug release. Int. J. Pharm. 2011; 406, 11–20.
40. Shu X. Z., Zhu K. J. Controlled drug release properties of ionically cross-linked chitosan beads: the influence of anion structure. Int. J. Pharm. 2002; 233, 217–225.
41. Smrdel P., Bogataj M., Zega A., Planinšek O., Mrhar A. Shape optimization and characterization of polysaccharide beads prepared by ionotropic gelation. J. Microencapsul. 2008; 25, 90–105.
42. Sezer A. D., Akbuga J. Controlled release of piroxicam from chitosan beads. Int. J. Pharm. 1995; 121, 113–116.
43. Berger J., Reist M., Mayer J. M., Felt O., Peppas N. A., Gurny R. Structure and interactions in covalently and ionically crosslinked chitosan hydrogels for biomedical applications. Eur. J. Pharm. Biopharm. 2004; 57, 19–34.
44. Nandi S., Winter H. H. Swelling behavior of partially cross-linked polymers: A ternary system. Macromolecules 2005; 38, 4447–4455.
45. Aranaz I., Mengíbar M., Harris R., Paños I., Miralles B., Acosta N., Galed G., Heras Á. Functional characterization of chitin and chitosan. Curr. Chem. Biol. 2009; 3, 203–230.
46. Vaghani S. S., Patel M. M., Satish C. S. Synthesis and characterization of pH-sensitive hydrogel composed of carboxymethyl chitosan for colon targeted delivery of ornidazole. Carbohyd. Res. 2012; 347, 76–82.
47. Chiou S.-H., Wu W.-T., Huang Y.-Y., Chung T.-W. Effects of the characteristics of chitosan on controlling drug release of chitosan coated PLLA microspheres. J. Microencapsulation. 2001; 18, 613–625.
48. Kouřil J., Vysloužil J., Kejdušová M., Dvořáčková K., Vetchý D. Možnosti ovlivnění obsahu léčiva a enkapsulační účinnosti chitosanových mikrosfér připravených procesem iontové gelace. Čes. slov. Farm. 2014; 63, 75–83.
49. Williams C., Panaccione R., Ghosh S., Rioux K.: Optimizing clinical use of mesalazine (5-aminosalicylic acid) in inflammatory bowel disease. Therap. Adv. Gastroenterol. 2011; 4, 237–248.
Labels
Pharmacy Clinical pharmacologyArticle was published in
Czech and Slovak Pharmacy

2014 Issue 3
-
All articles in this issue
- Advances in the use of instrumental measurement of colour in the development, production and quality control of drugs, medicinal preparations and pharmaceutical auxiliary substances II*
- Preparation and evalution of the oral gel containing the essential oil from Siberian fir (Abies sibirica Ledeb.)
- Flavonoids – main constituents of the leaves of Philadelphus tenuifolius Rupr. et Maxim.
- Formulation of benzethonium chloride into gels
- 9th World Meeting on Pharmaceutics, Biopharmaceutics and Pharmaceutical Technology – PBP Meeting
- Impact of formulation and process parameters on the properties of chitosan-based microspheres prepared by external ionic gelation
- Alois Jandouš’s Czech pharmacopoeial terminology of 1864
- Rationalization in 20th-century Czechoslovak pharmacy practice – Commission for Rationalization and Standardization in Medicine, Veterinary Medicine and Pharmacy – Part 1
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Alois Jandouš’s Czech pharmacopoeial terminology of 1864
- Preparation and evalution of the oral gel containing the essential oil from Siberian fir (Abies sibirica Ledeb.)
- Impact of formulation and process parameters on the properties of chitosan-based microspheres prepared by external ionic gelation
- Rationalization in 20th-century Czechoslovak pharmacy practice – Commission for Rationalization and Standardization in Medicine, Veterinary Medicine and Pharmacy – Part 1
