Vrozená náchylnost k recidivující aftózní stomatitidě
(Přehledový článek)
Genetic Predisposition to Recurrent Aphthous Stomatitis
(Review)
Background:
Recurrent aphthous stomatitis (RAS), one of the most common diseases of the oral mucosa, is characterized by the formation of painful oral erosions or even ulcers. RAS diagnosis is based on anamnestical data and appearance of lesions; no laboratory tests to confirm the diagnosis are available. Treatment of this condition is only symptomatic and less effective. The disease etiopathogenesis is unknown, but risk factors associated with the origin and development of the disease have been described in the literature. Besides local trauma, food allergens, oral microbial dysbiosis, infectious agents, nutritious factors (deficiency of B12 vitamin, iron, and folic acid), stress and hormonal changes, the immunological profile of the patient and his/her genetic predispositions to this multifactorial disease play a role. The effect of heredity on the disease origin and development was previously confirmed by studies of twins and families. Genetic variability of the selected genes in patients with RAS compared with healthy controls (case-control study) conducted in different populations have been published. The main candidates for RAS are the genes associated with the immune system, response of the organism to oxidative stress, metabolism of mucosal tissues, vitamins, and minerals.
The aim of these studies was to find risk, or on the contrary protective, gene variants in the interleukin-1 (IL) and its receptor antagonist (IL-1RN), IL-4, IL-6, IL-10, tumor necrosis factor alpha (TNFalpha), NOD-like receptor 3 (NLRP3), Toll-like receptor 4 (TLR4), E - and L-selectin (SEL), angiotensin converting enzym (ACE), gene for Mediterranean fever (MEFV), serotonin transporter (SLC6A4), matrix metalloproteinase 9 (MMP9), methylenetetrahydrofolate reductase (MTHFR) and nitric oxide syntase 2 (NOS2), which may together with other factors influence the individual susceptibility to the disease development. In the present review, we summarize and discuss findings of genetic association studies.
Conclusion:
We assume that further research into RAS on the molecular level may lead to better understanding of this disease etiopathogenesis and improve prevention, diagnosis and treatment of the affected patients.
Keywords:
aphthous stomatitis – oral mucosa diseases – genetic study – gene variability – hereditary predisposition
:
P. Bořilová Linhartová 1,2; S. Valová 1,2; L. Izakovičová Hollá 1,2
:
Stomatologická klinika LF MU a FN u sv. Anny, Brno
1; Ústav patologické fyziologie LF MU, Brno
2
:
Česká stomatologie / Praktické zubní lékařství, ročník 117, 2017, 2, s. 27-34
:
Review Article
Předmět sdělení:
Recidivující aftózní stomatitida (RAS) je jedním z nejčastějších onemocnění sliznice dutiny ústní, které se projevuje tvorbou bolestivých erozí až ulcerací. Diagnostika RAS je založena na anamnestických údajích a klinickém vzhledu lézí; neexistují žádné laboratorní testy k potvrzení diagnózy. Léčba tohoto onemocnění je pouze symptomatická a málo efektivní. Etiopatogeneze RAS dosud není známa, v literatuře je ale popsána řada rizikových faktorů, které ke vzniku a rozvoji onemocnění mohou přispívat. Kromě lokálního traumatu, potravinových alergenů, mikrobiální dysbiózy, infekčních agens, nutričních faktorů (deficitu vitaminu B12, železa a kyseliny listové), stresu a hormonálních změn, hraje roli i imunologický profil pacienta a také genetické predispozice jedince k této multifaktoriální chorobě. Vliv dědičnosti na vznik, resp. rozvoj onemocnění byl již dříve potvrzen studiemi dvojčat a rodin. Aktuálně jsou publikovány genetické asociační studie zabývající se variabilitou vybraných genů u pacientů s RAS ve srovnání se zdravými kontrolami (tzv. studie kontrol a případů) v různých populacích. Za kandidátní jsou považovány zejména ty geny, které souvisejí s funkcí imunitního systému, s reakcí organismu na oxidační stres, s metabolismem tkání sliznic, vitaminů a minerálních látek.
Cílem těchto analýz bylo nalezení rizikových nebo naopak protektivních variant, a to v genech interleukinů-1 (IL) a antagonisty jejich receptoru (IL-1RN), IL-4, IL-6, IL-10, tumor nekrotizujícího faktoru α (TNFα), NOD-like receptoru 3 (NLRP3), Toll-like receptoru 4 (TLR4), E - a L-selektinů (SEL), angiotenzin konvertujícího enzymu (ACE), v genu pro středomořskou horečku (MEFV), serotoninový transportér (SLC6A4), matrix metaloproteinázu 9 (MMP9), metylentetrahydrofolát reduktázu (MTHFR) a syntázu oxidu dusnatého 2 (NOS2), které mohou v kontextu dalších faktorů ovlivňovat náchylnost jedince k rozvoji onemocnění.
Závěr:
V předloženém přehledovém článku jsou shrnuty a diskutovány závěry těchto genetických asociačních studií. Je pravděpodobné, že výzkum RAS na molekulární úrovni by mohl vést k alespoň částečnému pochopení etiopatogeneze tohoto onemocnění, a tím ke zlepšení prevence, diagnostiky a léčby postižených pacientů.
Klíčová slova:
aftózní stomatitida – onemocnění ústní sliznice – genetická studie – genová variabilita – vrozená predispozice
ÚVOD
Recidivující aftózní stomatitida (RAS, synonyma: recidivující afty, benigní afty, habituální afty, recidivující benigní aftóza) je chronické zánětlivé onemocnění, které se projevuje opakovaným výsevem erozí až vředů kruhového nebo oválného tvaru na sliznici dutiny ústní. Rozlišujeme tři hlavní klinické formy recidivujících aft: malé afty (Mikuliczovy, MiRAS), velké afty (Suttonovy, MaRAS) a herpetiformní afty (HeRAS) [74]. Ulcerace jsou velmi bolestivé, nejčastěji se vyskytují ve formě tzv. malých aft buď pouze na sliznici dutiny ústní, nebo jsou součástí systémových onemocnění typu Behcetova syndromu (BD), celiakie, Crohnovy choroby, ulcerózní kolitidy, periodické horečky s krční lymfadenopatií, faryngitidy a aftózní stomatitidy (PFAPA) nebo cyklické neutropenie [47, 68].
Diagnostika RAS je založena výhradně na anamnestických údajích a klinickém vzhledu lézí; neexistují žádné laboratorní testy k potvrzení diagnózy [48, 56]. Léčba je v současné době pouze symptomatická a málo efektivní. Dostupnými léčebnými postupy, ať již farmakoterapií [27, 41], nebo laserovou terapií [25], lze pouze snížit bolestivost, frekvenci výskytu nebo závažnost lézí.
Aftózní stomatitida postihuje přibližně 10–25 % celkové populace [19, 23, 62, 64]. K rozvoji onemocnění dochází nejčastěji v období puberty, s přibývajícím věkem frekvence postižení RAS klesá [71]. K onemocnění jsou podle některých studií náchylnější ženy ve srovnání s muži [40]; jiné práce však popisují prakticky stejnou prevalenci RAS u obou pohlaví. Větší riziko vzniku RAS hrozí nekuřákům [49].
ETIOPATOGENEZE RAS
Etiopatogeneze RAS dosud není zcela objasněna, v literatuře však byla popsána řada rizikových faktorů, které se mohou na vzniku onemocnění podílet. U pacientů s RAS byly oproti zdravým jedincům nalezeny změny v koncentracích minerálů (zinek, železo), vitaminů (kyselina listová, vitamin B12) [45, 58, 73] a proteinů podílejících se na zánětlivých a imunopatologických reakcích (cytokiny a další); byly zaznamenány také změny v expresi genů pro tyto proteiny [4, 9, 15, 17, 18, 43, 44, 51, 59], a to buď lokálně v dutině ústní, a/nebo systémově v krevním oběhu.
Kromě deficitu vitaminů i minerálů existuje řada dalších rizikových faktorů [1], které k rozvoji RAS mohou přispívat. Mezi ně patří lokální trauma sliznice dutiny ústní, potravinové alergeny a mikrobiální dysbióza v dutině ústní [39], přítomnost infekčního agens, hormonální změny a stres [21, 22]. Zásadní roli hraje imunologický profil; dysregulace imunitní odpovědi na vnější podněty může být důsledkem užívání imunosupresiv a jiných xenobiotik, vlivem systémového onemocnění jedince nebo jeho vrozenými predispozicemi [40, 66, 75].
Na obrázku 1 je nastíněna role vybraných vnitřních a vnějších faktorů v etiopatogenezi RAS, a také jejich vzájemné interakce. Faktory exogenního původu mohou ovlivňovat nejenom expresi genů a indukovat vznik jejich mutací, ale mají vliv i na funkci a stav celého organismu. Na druhou stranu vrozené vlastnosti predisponují jedince k určitému typu chování a jednání, např. schopnosti vyvarovat se expozici negativním vlivům vnějšího prostředí. Genetické determinanty hrají roli v regulaci a funkci imunitního a endokrinního systému, k náchylnosti k rozvoji systémových chorob a odolnosti vůči oxidačnímu stresu, jsou také určujícími faktory rozdílů v metabolismu měkkých tkání, vitaminů a minerálů a dalších látek.
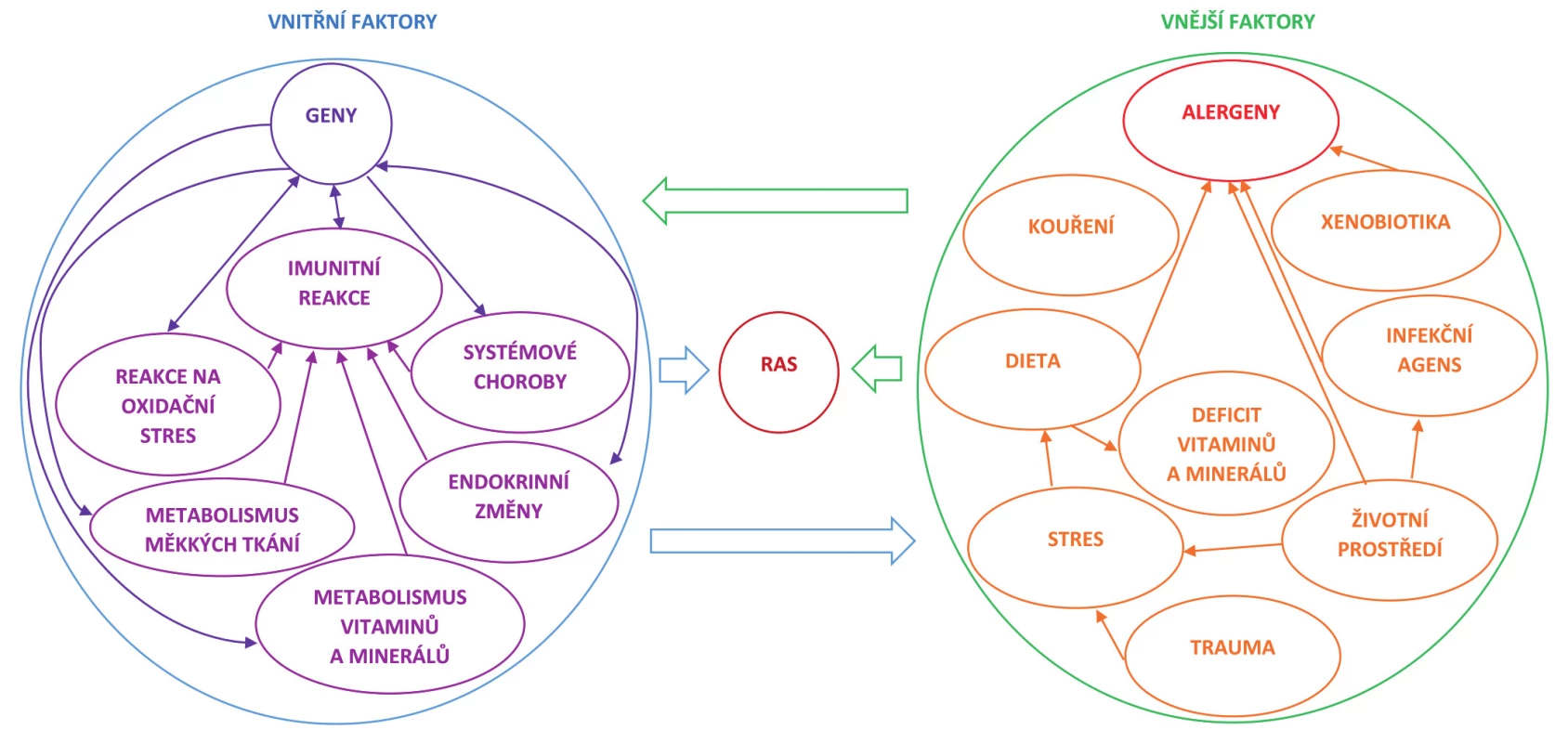
VROZENÁ NÁCHYLNOST K RAS
V polovině šedesátých let minulého století byla poprvé popsána role genetických dispozic jedince k rozvoji RAS. Na základě pozorování výskytu RAS v rodinách byl navržen pro tuto chorobu autozomálně recesivní nebo polygenní model dědičnosti [50, 69]. Úloha genetických faktorů v etiopatogenezi onemocnění byla potvrzena následnými asociačními studiemi na rodinách a u dvojčat s RAS [40]. U dítěte s oběma nemocnými rodiči pravděpodobnost, že onemocní, dosahuje až 90 %, zatímco u dětí se zdravými rodiči je jen kolem 20 % [70]. Z výsledků studie 29 rodin vyplývá, že náchylnost k RAS se dědí v souladu s konkrétními haplotypy (kombinované varianty více polymorfních úseků na určitém genu) pro lidské leukocytární antigeny (HLA) [5].
GENETICKÉ ASOCIAČNÍ STUDIE KONTROL A PŘÍPADŮ
Studie kontrol a případů (case-control study), při kterých jsou porovnávány skupiny pacientů s konkrétním onemocněním s adekvátní skupinou (podobný průměrný věk, zastoupení pohlaví, stejná populace apod.) zdravých osob, jsou vedle celogenomových studií (GWAS, genome-wide association study) a analýz rodin (family based study) jednou z variant genetických asociačních studií. U studie kontrol a případů jsou vybrány „kandidátní geny“ pro dané onemocnění; jejich variabilita je zkoumána a výsledky jsou statisticky zpracovány (ideálně pomocí multivariační analýzy, při níž jsou zjišťovány vztahy mezi klinickými, genetickými, imunologickými, biochemickými daty a údaji o zevních faktorech). Pro dostatečnou statistickou sílu testu (power of study) jsou nutné poměrně velké soubory osob zahrnutých do studie. Cílem těchto analýz je nalezení rizikových, nebo naopak protektivních genových variant, které mohou, v kontextu dalších faktorů, ovlivňovat náchylnost jedince k danému onemocnění.
KANDIDÁTNÍ GENY PRO RAS
Za kandidátní jsou považovány geny, které kódují proteiny zapojené do imunitních reakcí organismu, geny související s reakcí organismu na oxidační stres, s metabolismem slizničních struktur, vitaminů a minerálních látek, což logicky navazuje na etiopatogenetickou představu onemocnění RAS. Na obrázku 2 jsou uvedeny všechny proteiny (popř. nadřazený termín pro danou skupinu proteinů) kódované geny, jejichž variabilita byla v souvislosti s RAS studována. Je tedy zřejmé, že výzkum byl doposud orientován zejména na kandidátní geny podílející se na reakcích imunitního systému organismu.
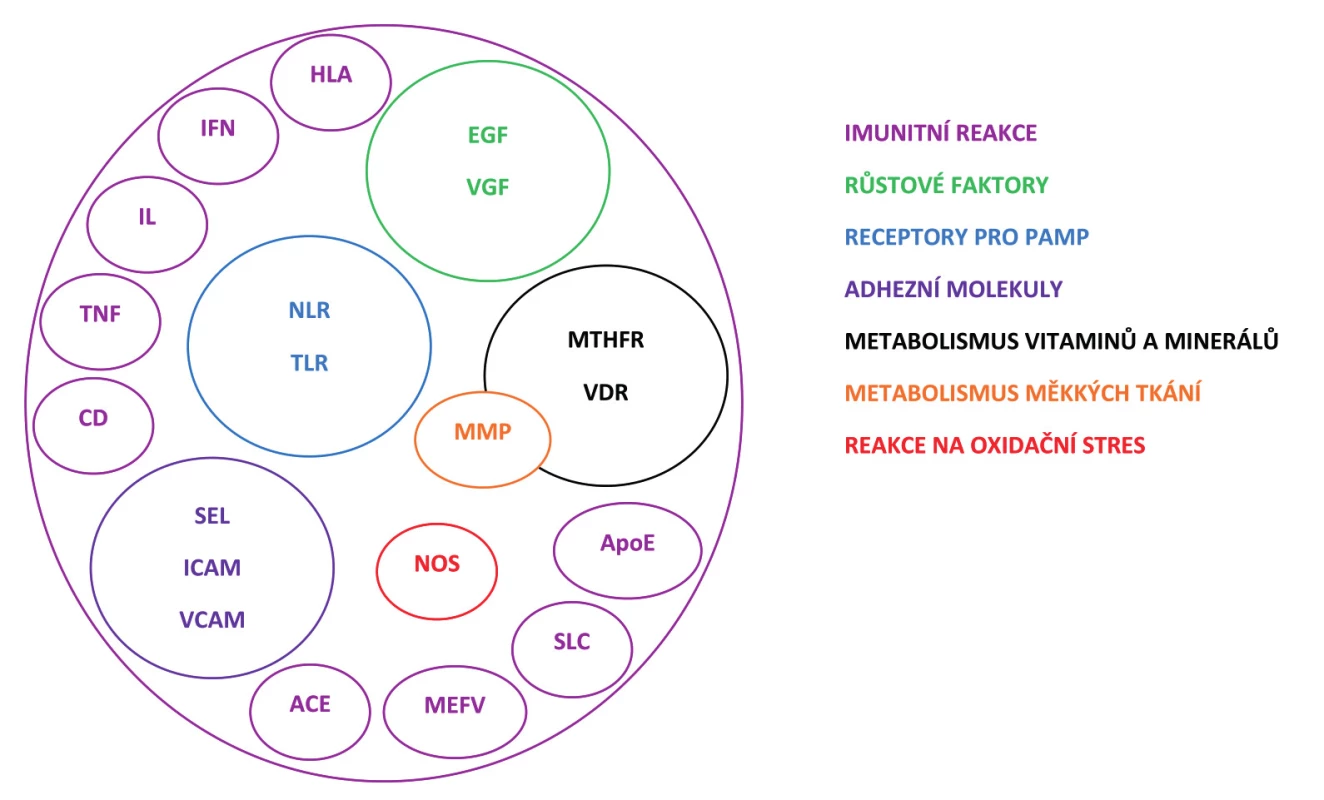
Kromě genů kódujících mediátory zánětu a signální molekuly, jako jsou interleukiny (IL) a jejich receptory nebo antagonisté receptorů, tumor nekrotizující faktory (TNF) a jejich receptor (Fas) [2, 11, 12, 13, 24, 26, 28, 29, 33, 52, 53, 54, 67, 72, 78] a interferon gama (IFN) [72], byly zkoumány geny pro CD (diferenciační skupina) antigeny na povrchu lymfocytů [37, 79], NOD-like (NLR) [14] a Toll-like receptory (TLR) [37] rozpoznávající molekulární vzory asociované s patogeny (PAMP, pathogen associated molecular pattern). Mnoho prací bylo zaměřeno na hodnocení úlohy vybraných antigenů HLA tříd v etiopatogenezi RAS [3, 20, 42, 55, 57, 61, 77].
Dalšími studovanými geny u pacientů s RAS byly ty, které kódují růstové faktory [72]. Jednalo se o epidermální růstový faktor (EGF), který hraje důležitou roli při růstu, proliferaci a diferenciaci mnoha typů buněk a je produkován především submandibulárními slinnými žlázami a Brunnerovou duodenální žlázou. Významný se zdá být také vaskulární endoteliální růstový faktor (VEGF), multifunkční cytokin účastnící se angiogeneze a hojení ran, jehož signifikantně nižší koncentrace byly nalezeny u pacientů s RAS [16, 60].
Z adhezních molekul důležitých pro průběh imunitních reakcí (při zánětu, hojení ran, metastázování atd.) byla u pacientů s RAS sledována variabilita v genech pro selektiny (SEL), intercelulární adhezní molekuly (ICAM) a vaskulární buněčné adhezní molekuly (VCAM) [7].
Dále byl studován inzerčně-deleční polymorfismus v genu pro angiotenzin konvertující enzym (ACE) [32], který je spojován především s funkcí renin-angiotenzin aldosteronového systému, ale také s imunitními procesy [63], a variabilita v genu pro středomořskou horečku (MEFV) podílející na regulaci apoptózy a zánětu [30]. Mezi dalšími analyzovanými byl gen pro apolipoprotein E (ApoE) [10], jehož protein je zapojený nejenom v lipidovém metabolismu a funkcích endotelu, ale i při supresi zánětlivé odpovědi [6], a také gen pro transportér serotoninu (SLC) [38, 46, 76], neurotransmiteru, který je schopen ovlivňovat mj. funkci polymorfonukleárních leukocytů [65].
Dalším kandidátním genem pro RAS je nukleární receptor pro vitamin D (VDR) [12], který váže vitamin D, a následně tak ovlivňuje transkripci mnoha dalších genů zodpovědných za snížení angiogeneze, zvýšení apoptózy a za imunoregulaci. Ke genům zkoumaným v souvislosti s RAS, které mají současně úlohu v metabolismu vitaminů nebo minerálů, patří také gen pro metylentetrahydrofolát reduktázu (MTHFR) [10, 31]. Tento enzym katalyzuje přeměnu kyseliny listové na biologicky aktivní foláty, které plní důležitou funkci v syntetické fázi při buněčném dělení. Ve folátovém cyklu působí jako kofaktor metabolických procesů i vitamin B12.
Matrix metaloproteinázy (MMP) jsou zinek-dependentní endonukleázy schopné degradovat matrixové proteiny, čímž se významně zapojují do metabolismu měkkých tkání, jako je sliznice dutiny ústní. Variabilita v genech pro MMP (konkrétně v genech pro gelatinázy) a pro tkáňové inhibitory MMP (TIMP), které hrají roli při zánětlivých procesech, byla již u pacientů s RAS sledována [36].
Oxid dusný, jehož biologická dostupnost je snížena při oxidačním stresu, je důležitým mediátorem imunitních reakcí a zánětlivé odpovědi organismu, reguluje adhezi buněk k endotelu, inhibuje agregaci krevních destiček a cévní proliferaci buněk hladkého svalstva [8]. Proto je syntáza oxidu dusného (NOS) považována za kandidátní gen pro RAS a v této souvislosti byly její genové varianty analyzovány [34, 35].
Změny ve struktuře genů, ať už se jedná o délku genu (inzerce, delece jednotlivých bazí nebo větších úseků, jako jsou např. repetitivní sekvence), nebo jeho obsah (záměnové mutace, např. jednonukleotidový polymorfismus, SNP, angl. single nucleotide polymorphism), mohou mít vliv na podobu a funkci výsledného proteinu a/nebo na míru jeho exprese. V případě, že v kandidátním genu existuje funkčně významná mutace, a navíc populační frekvence minoritní alely je alespoň pět procent, můžeme považovat danou variantu za vhodnou pro studium genetické podmíněnosti multifaktoriálních nemocí pomocí asociační studie kontrol a případů. Hovoříme o tzv. polymorfismu příslušného genu, a to již tehdy, pokud se méně častá varianta v dané populaci vyskytuje ve frekvenci vyšší než u jednoho procenta populace.
ASOCIACE VARIANT GENŮ S RAS
Od roku 2002 do současnosti bylo publikováno 36 asociačních studií kontrol a případů s RAS. Genetická variabilita byla zkoumána u třinácti různých populací. Jednalo se o populaci tureckou [2, 29, 30, 31, 32, 33, 57, 61, 78, 79], íránskou [14, 52, 53, 54, 55], jordánskou [7, 35, 36, 37, 38], brazilskou [24, 76, 77], čínskou [28, 72], korejskou [10], indickou [46], egyptskou [26] a populaci z USA [11, 12, 13]. U evropské populace byly dosud zveřejněny studie kontrol a případů s RAS ze Spojeného království [34, 42], z Itálie [20], Řecka [3] a z Polska [67]. Jen u některých kandidátních genů a jejich polymorfismů byla popsána asociace s RAS, přehled je uveden v tabuce 1. Varianty genů byly spojeny s rizikem rozvoje RAS nebo naopak, zdravé osoby s konkrétní alelou, genotypem, haplotypem a/nebo haplogenotypem byly před rozvojem daného onemocnění chráněny (protektivní varianta genu).
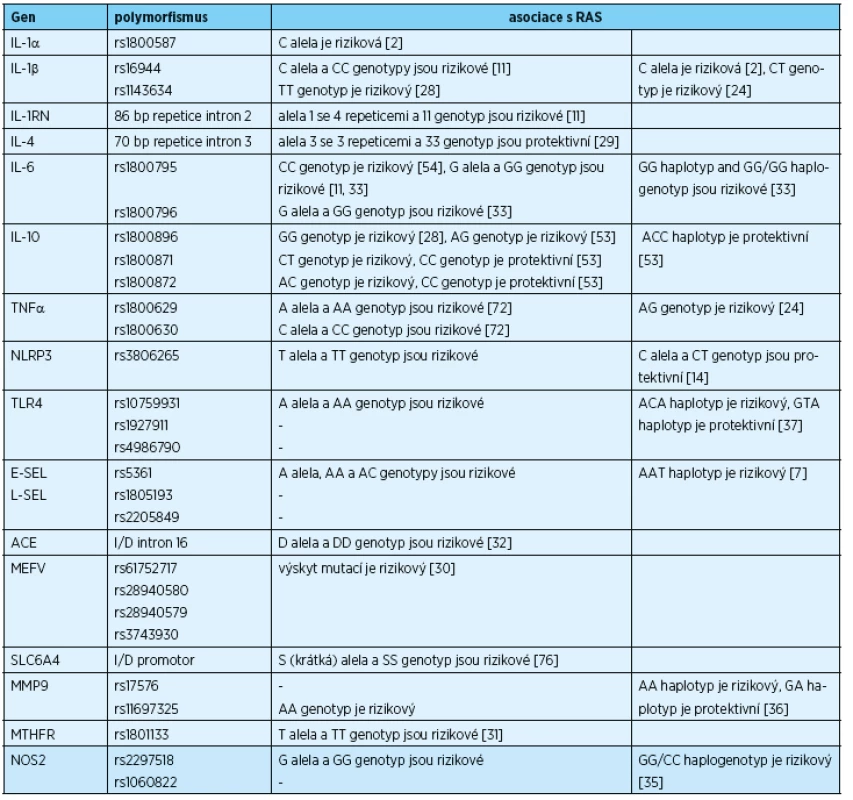
U pacientů s RAS byla ve srovnání se zdravými kontrolami pozorována vyšší incidence HLA-A33, HLA-B35 a HLA-B81 [77], HLA-B12 [42], HLA-DR7 [20], HLA-DR5, HLA-A24 [61], HLA-DRB1 a HLA-DRB5, a naopak nižší výskyt HLA-B5, HLA-DR4 [3, 20], HLA-DRB3 [55], HLA-DR10. HLA-DR17 a HLA-A30 [61]. Konkrétní alely HLA-DQB1 pak byly asociovány s protektivitou nebo rizikovostí rozvoje RAS [55] (pozn. není uvedeno v tab. 1).
U některých genových variant byly výsledky asociací s RAS kontroverzní; jednalo se především o variabilitu v genech pro IL-1 a antagonistu jeho receptoru (IL-1RN), IL-6, IL-10 a TNFα [2, 11, 12, 13, 24, 28, 33, 53, 54, 67, 72, 78], dále pak o polymorfismy v genech kódujících MTHFR [10, 31] a SLC6A4 [38, 46, 76]. Tyto protichůdné nálezy mohou být důsledkem genetické odlišnosti různých studovaných populací, nedostatečně velkým souborem studovaných pacientů a kontrol a/nebo jiným přístupem při statistické analýze získaných dat.
ZÁVĚR
Dosud nebyla provedena žádná celogenomová studie (GWAS) u pacientů s RAS, proto jsou v předloženém přehledovém článku shrnuty a zvažovány pouze závěry genetických asociačních studií kontrol a případů s RAS. Ačkoliv jsou výsledky těchto studií v různých populacích často nekonzistentní a význam jednotlivých polymorfismů v genech je obecně u multifaktoriálních onemocnění malý, klíčová role imunitního systému a genetických vloh v etiopatogenezi RAS jsou nesporné. Před tím, než bude možné použít získaná data ke zlepšení diagnostiky či léčby pacientů s RAS, je nezbytný další výzkum.
Článek vznikl s podporou projektu Specifický výzkum MUNI/A/0948/2016 a grantů AZV 15-29336A a GACR GB14-37368G.
Mgr. Petra Bořilová Linhartová, Ph.D.
Ústav patologické fyziologie
LF MU
Kamenice 5
625 00 Brno
e-mail: plinhart@med.muni.cz
Sources
1. Akintoye, S. O., Greenberg, M. S.: Recurrent aphthous stomatitis. Dental clinics of North America, roč. 58, 2014, č. 2, s. 281–297.
2. Akman, A., et al.: Relationship between periodontal findings and specific polymorphisms of interleukin-1a and-1ß in Turkish patients with Behçet‘s disease. Arch. Dermatol. Res., roč. 300, 2008, č. 1, s. 19–26.
3. Albanidou-Farmaki, E., et al.: HLA-A, B, C, and DR antigens in recurrent oral ulcers. Ann. Dentistry, roč. 47, 1988, č. 1, s. 5–8.
4. Albanidou-Farmaki, E., et al.: Detection, enumeration and characterization of T helper cells secreting type 1 and type 2 cytokines in patients with recurrent aphthous stomatitis. Tohoku J. experiment. Med., roč. 212, 2007, č. 2, s. 101–105.
5. Albanidou-Farmaki, E., et al.: HLA haplotypes in recurrent aphthous stomatitis: a mode of inheritance? Intern. J. Immunogenet., roč. 35, 2008, č. 6, s. 427–432.
6. Ali, K., et al.: Apolipoprotein E suppresses the type I inflammatory response in vivo. Circulation Res., roč. 97, 2005, č. 9, s. 922–927.
7. Alkhateeb, A., et al.: Association of cell adhesion molecule gene polymorphisms with recurrent aphthous stomatitis. J. Oral Pathol. Med., roč. 42, 2013, č. 10, s. 741–746.
8. Andrew, P. J., Mayer, B.: Enzymatic function of nitric oxide synthases. Cardiovascular Res., roč. 43, 1999, č. 3, s. 521–531.
9. Avci, E., et al.: Oxidative stress and cellular immunity in patients with recurrent aphthous ulcers. Brazil. J. med. biol. Res., roč. 47, 2014, č. 5, s. 355–360.
10. Baek, J. O., et al.: Methylenetetrahydrofolate reductase gene C677T mutation and apolipoprotein E gene mutation in recurrent aphthous stomatitis. Korean J. Dermatol., roč. 46, 2008, č. 2, s. 209–215.
11. Bazrafshani, M. R., et al.: IL-1B and IL-6 gene polymorphisms encode significant risk for the development of recurrent aphthous stomatitis (RAS). Genes Immunity, roč. 3, 2002, č. 5, s. 302–305.
12. Bazrafshani, M. R., et al.: Recurrent aphthous stomatitis and gene polymorphisms for the inflammatory markers TNF-α, TNF-ß and the vitamin D receptor: no association detected. Oral Dis., roč. 8, 2002, č. 6, s. 303–307.
13. Bazrafshani, M. R., et al.: Polymorphisms in the IL-10 and IL-12 gene cluster and risk of developing recurrent aphthous stomatitis. Oral Dis., roč. 9, 2003, č. 6, s. 287–291.
14. Bidoki, A. Z., et al.: NLRP3 gene polymorphisms in Iranian patients with recurrent aphthous stomatitis. J. Oral Pathol. Med., roč. 45, 2016, č. 2, s. 136–140.
15. Borra, R. C., et al.: The Th1/Th2 immune-type response of the recurrent aphthous ulceration analyzed by cDNA microarray. J. Oral Pathol. Med., roč. 33, 2004, č. 3, s. 140–146.
16. Brozovic, S., et al.: Salivary levels of vascular endothelial growth factor (VEGF) in recurrent aphthous ulceration. J. Oral Pathol. Med., roč. 31, 2002, č. 2, s. 106–108.
17. Buno, I. J., et al.: Elevated levels of interferon gamma, tumor necrosis factor α, interleukins 2, 4, and 5, but not interleukin 10, are present in recurrent aphthous stomatitis. Arch. Dermatol., roč. 134, 1998, č. 7, s. 827–831.
18. Dalghous, A. M., Freysdottir, J., Fortune, F.: Expression of cytokines, chemokines, and chemokine receptors in oral ulcers of patients with Behcet‘s disease (BD) and recurrent aphthous stomatitis is Th1-associated, although Th2-association is also observed in patients with BD. Scand. J. Rheumatol., roč. 35, 2006, č. 6, s. 472–475.
19. Feng, J., et al.: Prevalence and distribution of oral mucosal lesions: a cross-sectional study in Shanghai, China. J. Oral Pathol. Med., roč. 44, 2015, č. 7, s. 490–494.
20. Gallina, G., et al.: HLA-A, B, C, Dr, MT, and MB antigens in recurrent aphthous stomatitis. Oral Surg. Oral Med. Oral Pathol., roč. 59, 1985, č. 4, s. 364–370.
21. Gallo, C. de Barros, Mimura, M. A. M., Sugaya, N. N.: Psychological stress and recurrent aphthous stomatitis. Clinics, roč. 64, 2009, č. 7, s. 645–648.
22. Gavic, L., et al.: The role of anxiety, depression, and psychological stress on the clinical status of recurrent aphthous stomatitis and oral lichen planus. J.Oral Pathol. Med., roč. 43, 2014, č. 6, s. 410–417.
23. Ghanaei, F. M., et al.: Prevalence of oral mucosal lesions in an adult Iranian population. Iranian Red crescent Med. J., roč. 15, 2013, č. 7, s. 600–604.
24. Guimarães, A. L. S., et al.: Investigation of functional gene polymorphisms IL-1β, IL-6, IL-10 and TNF-α in individuals with recurrent aphthous stomatitis. Arch. Oral Biol., roč. 52, 2007, č. 3, s. 268–272.
25. Han, M., et al.: Effectiveness of laser therapy in the management of recurrent aphthous stomatitis: a systematic review. Scientifica, 2016, 2016, 9062430.
26. Hazzaa, H. H. A., Rashwan, W. A. M., Attia, E. A. S.: IL-18 gene polymorphisms in aphthous stomatitis vs. Behçet‘s disease in a cohort of Egyptian patients. J. Oral Pathol. Med., roč. 43, 2014, č. 10, s. 746–753.
27. Hosová, K.: Volně prodejné produkty pro léčbu chorob v dutině ústní. Dermatol. praxi, roč. 5, 2011, č. 1, s. 40–42.
28. Jing, C., Zhang, J. Q.: Association between interleukin gene polymorphisms and risk of recurrent oral ulceration. Genet. Molecul. Res., roč. 14, 2015, č. 2, s. 6838–6843.
29. Kalkan, G., et al.: Association between interleukin 4 gene intron 3 VNTR polymorphism and recurrent aphthous stomatitis in a cohort of Turkish patients. Gene, roč. 527, 2013, č. 1, s. 207–210.
30. Kalkan, G., et al.: Association between MEFV gene mutations and recurrent aphthous stomatitis in a cohort of Turkish patients. J. Dermatol., roč. 40, 2013, č. 7, s. 516–521
31. Kalkan, G., Karakus, N., Yigit, S.: Association of MTHFR gene C677T mutation with recurrent aphthous stomatitis and number of oral ulcers. Clin. Oral Investigations, roč. 18, 2014, č. 2, s. 437–441.
32. Karakus, N., et al.: High association of angiotensin-converting enzyme (ACE) gene insertion/deletion (I/D) polymorphism with recurrent aphthous stomatitis. Arch. Dermatol. Res., roč. 305, 2013, č. 6, s. 513–517.
33. Karakus, N., et al.: Effects of interleukin (IL)-6 gene polymorphisms on recurrent aphthous stomatitis. Arch. Dermatol. Res., roč. 306, 2014, č. 2, s. 173–180.
34. Karasneh, J. A., et al.: Endothelial nitric oxide synthase gene polymorphisms are not associated with recurrent aphthous stomatitis. Arch. Oral Biol., roč. 54, 2009, č. 6, s. 583–587.
35. Karasneh, J. A., et al.: Association between recurrent aphthous stomatitis and inheritance of a single-nucleotide polymorphism of the NOS2 gene encoding inducible nitric oxide synthase. J. Oral Pathol. Med., roč. 40, 2011, č. 9, s. 715–720.
36. Karasneh, J. A., et al.: Association of MMP but not TIMP-1 gene polymorphisms with recurrent aphthous stomatitis. Oral Dis., roč. 20, 2014, č. 7, s. 693–699.
37. Karasneh, J., et al.: TLR2, TLR4 and CD86 gene polymorphisms in recurrent aphthous stomatitis. J. Oral Pathol. Med, roč. 44, 2015, č. 10, s. 857–863.
38. Karasneh, J., et al.: Investigation of SLC6A4 gene polymorphisms in jordanian RAS patients. Oral Surg. Oral Med. Oral Pathol. Oral Radiol., roč. 120, 2015, č. 3, s. 141–142.
39. Kim, Y., et al.: Mucosal and salivary microbiota associated with recurrent aphthous stomatitis. BMC Microbiol., roč. 16, 2016, č. 1, s. 57.
40. Koybasi, S., et al.: Recurrent aphthous stomatitis: investigation of possible etiologic factors. Amer. J. Otolaryngol., roč. 27, 2006, č. 4, s. 229–232.
41. Landová, H., et al.: Oral mucosa and therapy of recurrent aphthous stomatitis. Ces. Slov. Farm., roč. 62, 2013, č. 1, s. 12–18.
42. Lehner, T., Welsh, K. I., Batchelor, J. R.: The relationship of HLA-B and DR phenotypes to Behcet‘s syndrome, recurrent oral ulceration and the class of immune complexes. Immunology, roč. 47, 1982, č. 4, s. 581–587.
43. Lewkowicz, N., et al.: Predominance of production of Th1 type cytokines in recurrent aphthous ulceration. Dental medical Problems, roč. 42, 2004, s. 655–660.
44. Lewkowicz, N., et al.: Expression of Th1/Th2/Th3/Th17-related genes in recurrent aphthous ulcers. Arch. Immunol. Ther. Experiment., roč. 59, 2011, č. 5, s. 399–406.
45. Lopez-Jornet, P., Camacho-Alonso, F., Martos, N.: Hematological study of patients with aphthous stomatitis. Intern. J. Dermatol., roč. 53, 2014, č. 2, s. 159–163.
46. Manchanda, A., Iyengar, A. R., Patil, S.: Association between serotonin transporter gene polymorphism and recurrent aphthous stomatitis. Dental Res. J., roč. 13, 2016, č. 3, s. 206–210.
47. Mantegazza, C., et al.: Oral manifestations of gastrointestinal diseases in children. Part 4: Coeliac disease. Eur. J. paed. Dentistry, roč. 17, 2016, č. 4, s. 248–250.
48. Mays, J. W., Sarmadi, M., Moutsopoulos, N. M.: Oral manifestations of systemic autoimmune and inflammatory diseases: diagnosis and clinical management. J. evidence based dental Pract., roč. 12, 2012, č. 3, s. 265–282.
49. Mccullough, M. J., Abdel-Hafeth, S., Scully, C.: Recurrent aphthous stomatitis revisited; clinical features, associations, and new association with infant feeding practices? J. Oral Pathol. Med., roč. 36, 2007, č. 10, s. 615–620.
50. Miller, M. F., et al.: Inheritance patterns in recurrent aphthous ulcers: twin and pedigree data. Oral Surg. oral Med. oral Pathol., roč. 43, 1977, č. 6, s. 886–891.
51. Miyamoto J. R., et al.: Immune-expression of HSP27 and IL-10 in recurrent aphthous ulceration. J. Oral Pathol. Med., roč. 37, 2008, č. 8, s. 462–467.
52. Moqadam, I. F., et al.: Lack of association between interleukin-12 gene polymorphisms and recurrent aphthous stomatitis. Avicenna J. med. Biotechnol., roč. 8, 2016, č. 4. s. 200–201.
53. Najafi, S., et al.: Interleukin-10 gene polymorphisms in recurrent aphthous stomatitis. Immunological Investigations, roč. 43, 2014, č. 4, s. 405–409.
54. Najafi, S., et al.: Association study of interleukin-1 family and interleukin-6 gene single nucleotide polymorphisms in recurrent aphthous stomatitis. Intern. J. Immunogenet., roč. 42, 2015, č.. 6. s. 428–431.
55. Najafi, S., et al.: HLA-DRB and HLA-DQB allele and haplotype frequencies in Iranian patients with recurrent aphthous stomatitis. Iranian J. Allergy Asthma Immunol., roč. 15, 2016, č. 4, s. 289–295.
56. Natah, S. S., et al.: Recurrent aphthous ulcers today: a review of the growing knowledge. Intern. J. Oral maxillofacial Surg., roč. 33, 2004, č. 3, s. 221–234.
57. Özdemir, M., et al.: HLA-B* 51 in patients with recurrent aphthous stomatitis. Acta derma-venereolog., roč. 89, 2009, č. 2, s. 202–203.
58. Özler, G. S.: Zinc deficiency in patients with recurrent aphthous stomatitis: a pilot study. J. Laryngol. Otol., roč. 128, 2014, č. 6, s. 531–533.
59. Ozyurt, K., et al.: Serum Th1, Th2 and Th17 cytokine profiles and alpha-enolase levels in recurrent aphthous stomatitis. J. Oral Pathol. Med., roč. 43, 2014, č. 9, s. 691–695.
60. Pammer, J., et al. Vascular endothelial growth factor is constitutively expressed in normal human salivary glands and is secreted in the saliva of healthy individuals. J. Pathol., roč. 186, 1998, č. 2, s. 186–191.
61. Pekiner, F. N., et al.: HLA-A, B (Class I) and HLA-DR, DQ (Class II) antigens in Turkish patients with recurrent aphthous ulceration and Behcet‘s disease. Medical principles practice, roč. 22, 2013, č. 5, s. 464–468.
62. Pentenero, M., et al.: The prevalence of oral mucosal lesions in adults from the Turin area. Oral Dis., roč. 14, 2008, č. 4, s. 356–366.
63. Reddy Gaddam, R., Chambers, S., Bhatia, M.: ACE and ACE2 in inflammation: a tale of two enzymes. Inflammation & allergy-drug targets (formerly current drug targets-inflammation & allergy), roč. 13, 2014, č. 4, s. 224–234.
64. Reichart, P. A.: Oral mucosal lesions in a representative cross-sectional study of aging Germans. Community dentistry and oral epidemiology, roč. 28, 2000, č. 5, s. 390–398.
65. Schuff-Werner, P., et al.: Serotonin acts as a radical scavenger and is oxidized to a dimer during the respiratory burst of human mononuclear and polymorphonuclear phagocytes. Eur. J. clin. Investigation, roč. 25, 1995, č. 7, s. 477–484.
66. Ślebioda, Z., Szponar, E., Kowalska, A.: Etiopathogenesis of recurrent aphthous stomatitis and the role of immunologic aspects: literature review. Archivum immunologiae et therapiae experimentalis, roč. 62, 2014, č. 3, s. 205–215.
67. Ślebioda, Z., et al.: Clinical phenotype of recurrent aphthous stomatitis and interleukin-1b genotype in a Polish cohort of patients. J. Oral Pathol. Med., 2016.
68. Scully, C., Hodgson, T., Lachmann, H.: Auto-inflammatory syndromes and oral health. Oral Dis., roč. 14, 2008, č. 8, s. 690–699.
69. Ship, I. I.: Inheritance of aphthous ulcers of the mouth. J. dental Res., roč. 44, 1965, č. 5, s. 837–844.
70. Ship, I. I.: Epidemiologic aspects of recurrent aphthous ulcerations. Oral Surg. oral Med. Oral Pathol., roč. 33, 1972, č. 3, s. 400–406.
71. Ship, J. A., et al.: Recurrent aphthous stomatitis. Quintessence inter., roč. 31, 2000, č. 2, s. 95–112.
72. Sun, M., et al.: Inflammatory factors gene polymorphism in recurrent oral ulceration. J. Oral Pathol. Med., roč. 42, 2013, č. 7, s. 528–534.
73. Sun, A., et al.: Significant association of deficiencies of hemoglobin, iron, vitamin B12, and folic acid and high homocysteine level with recurrent aphthous stomatitis. J. oral Pathol. Med., roč. 44, 2015, č. 4, s. 300–305.
74, Tappuni, A. R., et al.: Clinical assessment of disease severity in recurrent aphthous stomatitis. J. Oral Pathol. Med., roč. 42, 2013, č. 8, s. 635–641.
75. Theodoropoulou, K., Vanoni, F., Hofer, M.: Periodic fever, aphthous stomatitis, pharyngitis, and cervical adenitis (PFAPA) syndrome: a review of the pathogenesis. Current Rheumatol. Reports, roč. 18, 2016, č. 4, s. 1–7.
76. Victoria, J. M. N., et al.: Serotonin transporter gene polymorphism (5-HTTLPR) in patients with recurrent aphthous stomatitis. J.Oral Pathol. Med., roč. 34, 2005, č. 8. s. 494–497.
77. Wilhelmsen, N. S. W., et al.: Correlation between histocompatibility antigens and recurrent aphthous stomatitis in the Brazilian population. Brazilian J. Otorhinolaryngol., roč. 75, 2009, č. 3, s. 426–431.
78. Yakar, T., et al.: The relationship of recurrent aphthous stomatitis and Helicobacter pylori, cytokine gene polymorphism and cobalamin. Turkish J. Gastroenterol., roč. 26, 2015, č. 4. s. 304–308.
79. Yigit, S., et al.: Investigation of CD40 gene rs4810485 and rs1883832 mutations in patients with recurrent aphthous stomatitis. Arch. Oral Biol., roč. 74, 2017, s. 51–54.
Labels
Maxillofacial surgery Orthodontics Dental medicineArticle was published in
Czech Dental Journal

2017 Issue 2
- What Effect Can Be Expected from Limosilactobacillus reuteri in Mucositis and Peri-Implantitis?
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
-
Genetic Predisposition to Recurrent Aphthous Stomatitis
(Review) -
Dental Caries Prevention Strategies, Application of Evidence-Based Medicine
Part 3. Oral Hygiene in Dental Caries Prevention
(Review) -
Localization of Bone Plates in the Treatment of Zygomaticomaxillary Complex Fractures
(Original Article – Clinical Study) -
Leukoplakia of Oral Mucosa
(Review) -
Characteristic of the Local Factors in the Aetiology of the Burning Mouth Syndrome
(Review)
-
Genetic Predisposition to Recurrent Aphthous Stomatitis
- Czech Dental Journal
- Journal archive
- Current issue
- About the journal
Most read in this issue
-
Leukoplakia of Oral Mucosa
(Review) -
Genetic Predisposition to Recurrent Aphthous Stomatitis
(Review) -
Characteristic of the Local Factors in the Aetiology of the Burning Mouth Syndrome
(Review) -
Dental Caries Prevention Strategies, Application of Evidence-Based Medicine
Part 3. Oral Hygiene in Dental Caries Prevention
(Review)
