Faktory ovplyvňujúce vznik sarkómov maternice a možnosti ich klinickej diagnostiky
Factors affecting the uterine sarcomas developement and possibilities of their clinical diagnosis
Objective:
The main goal of this article is to summarize the known factors underlying the tumorigenesis of sarcomas and to present the limitations of clinical diagnosis.
Design:
A review article.
Settings:
Division of Molecular Medicine, Biomedical Center, JLF UK Martin, Slovakia; Department of Gynaecology and Obstetrics JLF UK and UNM Martin, Slovakia; Division of Oncology, Biomedical Center in Martin, JLF UK, Martin, Slovakia.
Methods:
An analysis and summarisation of published studies about etiology, aberrant factors and limmitations of clinical diagnosis of uterne sarcomas.
Results and conclusions:
Uterine sarcomas are heterogenous, malignant tumour types of mesenchymal origin with a very low incidence. On the other hand, sarcomas are very aggressive tumours with a poor prognosis, and a very low chance of surviving in general. The most common types of sarcomas are leiomyosarcomas, followed in percentage occurrence by endometrial stromal sarcomas and adenosarcomas. This tumour pathogenesis remains still relatively unknown. There are recognized only several predisposition factor types, and the limitated molecular-genetic aberrations associated with their occurrence. Importantly, the potential perturbation of the malignant mass during the implementation of invasive methods can be considered as the most serious risk factor. In regards to the visualization methods application, there are still limited ways of distinguishing between malignant and benign forms, especially in the case of leiomyosarcomas.
Keywords:
sarcomas, leiomyosarcomas, mesenchymal tumours, clinical diagnosis
Authors:
D. Dvorská 1,2; D. Braný 1,2; Z. Danková 3; E. Halášová 1; J. Višňovský 2
Authors‘ workplace:
Divízia molekulová medicína, Martinské centrum pre biomedicínu, JLF UK, Martin, riaditeľka divízie prof. RNDr. E. Halášová, PhD.
1; Gynekologicko-pôrodnícka klinika JLF UK a UNM Martin, prednosta prof. MUDr. P. Žúbor, PhD.
2; Divízia onkológia, Martinské centrum pre biomedicínu, JLF UK, Martin, riaditeľka divízie doc. RNDr. Z. Lasabová, PhD.
3
Published in:
Ceska Gynekol 2018; 83(5): 364-370
Category:
Original Article
Overview
Cieľ štúdie:
Cieľom článku je sumarizovať známe faktory podmieňujúce vznik sarkómov tela maternice a limitácie ich klinickej diagnostiky.
Typ štúdie:
Prehľadový článok.
Názov a sídlo pracoviska:
Divízia molekulová medicína, Martinské centrum pre biomedicínu, JLF UK Martin, Slovenská republika; Gynekologicko-pôrodnícka klinika JLF UK a UNM Martin, Slovenská republika; Divízia onkológia, Martinské centrum pre biomedicínu JLF UK Martin, Slovenská republika.
Metodika:
Analýza a sumarizácia poznatkov o etiológii, abnormálne pôsobiacich faktoroch a možnostiach diagnostiky sarkómov tela maternice na základe publikovaných štúdií.
Výsledky a záver:
Sarkómy maternice predstavujú veľmi heterogénne, malígne tumorové typy mezenchymalného pôvodu, ktorých výskyt je veľmi zriedkavý. Na druhej strane ide o veľmi agresívne tumory s veľmi zlou prognózou a celkovo nízkym intervalom prežívania. Najčastejším typom sarkómov sú leiomyosarkómy, nasledované v percentuálnom zastúpení endometriálnymi stromálnymi sarkómami a adenosarkómami. Patogenéza týchto tumorov zostáva doposiaľ relatívne neobjasnená. Sú známe určité skupiny predispozičných faktorov ako aj konkrétnych geneticko-molekulárnych zmien asociovaných s ich výskytom. Najväčšie riziko predstavuje pri invazivných diagnostických metódach možnosť rozrušenia malígnej vrstvy a pri využití zobrazovacích metód sú najväčšou limitáciou obmedzené možnosti v odlíšení medzi malígnymi a benígnymi variantmi, obzvlášť v prípade leiomyosarkómov.
Klúčové slová:
sarkómy, leiomyosarkómy, mezenchymálne tumory, klinická diagnostika
ÚVOD
Sarkómy maternice patria medzi veľmi zriedkavé malígne mezenchymálne tumory. Predstavujú 1 % zo všetkých gynekologických malignít a iba 3–5 % z celkového počtu tumorov tela maternice. Sarkómy postihujú v závislosti na veku, etniku a ďalších faktoroch globálne 2–5 žien z 100 000 [1]. Na Slovensku je kumulatívna incidencia oproti globálnej celkovo nižšia, udáva sa menej ako dva prípady sarkómov na 100 000 žien [9], pričom sarkómy predstavujú 3,8 % histologicky potvrdených malignít. Priemerný vek diagnózy sarkómov je 57 rokov [9]. Vo všeobecnosti majú mezenchymálne tumory zlú prognózu, hoci v dôsledku ich ojedinelého výskytu zapríčiňujú relatívne menej fatálnych prípadov [6]. V súčasnosti nie je známy dostatok relevantných informácií o etiológii sarkómov tela maternice. Limitujúcim faktorom v tomto smere ostáva ich obmedzený výskyt, vysoká heterogenita a stále pretrvávajúce nepresnosti v klasifikácii. Najčastejšie sa vyskytujúce malígne mezenchymálne tumory sú leiomyosarkómy (55 %) (LMS), nasledujú endometriálne stromálne sarkómy (ESS) (15–20 %) a adenosarkómy (7–10%). Zvyšných 7–15 % je tvorených ďalšími typmi tumorov [6].
RIZIKOVÉ FAKTORY
Za jeden z podstatných faktorov vplývajúci na zvýšený výskyt sarkómov možno považovať etnickú príslušnosť. Ich výskyt je u žien afrického pôvodu približne dvojnásobne vyšší oproti ženám kaukazského etnika. Druhé menované etnikum dosahuje zároveň percentuálne vyšší päťročný interval prežívania [1]. Doposiaľ bolo preukázaných niekoľko asociácií klinických faktorov s vyššou frekvenciou výskytu sarkómov. Tieto výsledky však vykazovali vo viacerých prípadoch niekoľko limitácií.
Negatívny vzťah medzi ožarovaním panvovej oblasti a formáciou LMS na jednej strane zahŕňal iba nedostatočný súbor pacientok. Na druhej strane, zvýšená incidencia nebola v konečnom hodnotení výrazne vysoká, pohybovala sa pod hodnotou 1 % [44]. Užívanie antikoncepcie štatisticky zvyšuje riziko vzniku LMS, rovnako zvýšená hladina estrogénov koreluje so zvýšenou frekvenciou endometriálnych stromálnych sarkómov (ESS) [6]. Obezita, hypertenzia a diabetes sú symptómy asociované so zvýšenou incidenciou ESS. Zvýšená incidencia LMS bola pozorovaná u pacientok, ktoré užívali dlhšie ako päť rokov tamoxifen [47], konkrétne v USA sa zvýšil výskyt ochorení na 17 prípadov na 100 000 žien [47]. Fajčenie môže byť v tomto prípade považované za protektívny faktor, keďže u fajčiarok je preukázaný štatisticky nižší výskyt LMS aj ESS [44].
Sarkómy, obzvlášť LMS možno považovať za tumory závislé na veku. Väčšina sarkómov je diagnostikovaná u žien starších ako 60 rokov, respektíve po menopauze. U 20–30ročných žien je ich výskyt štvornásobne nižší [12]. Štatisticky sa sarkómy vyskytujú častejšie u žien, ktoré trpia retinoblastómom [24], prípadne dedičnou leiomyomatózou [33]. Za zanedbateľný, respektíve nesignifikantný [6] sa považuje vplyv parity, vek menarché, ako aj menopauzy, hoci väčšina pacientok trpí sarkómami práve po menopauze. Otáznym stále zostáva vzťah medzi benígnymi leiomyómami (ULM) a LMS. Hoci sa predpokladá, že sarkómy vznikajú prioritne de novo, výskyt vzácnych, hybridných štruktúr, ktoré vykazujú znaky ULM aj LMS respektíve častejší výskyt malígnych LMS u žien, ktorým boli predtým diagnostikované ULM [38, 43], necháva túto otázku stále otvorenú.
MOLEKULÁRNO-GENETICKÉ FAKTORY
LMS, rovnako ako iné agresívne tumory majú mutovaný gén TP53 [28]. Relatívne často je mutovaný aj gén MED12 [28]. Veľmi zaujímavým je zistenie, že gén TP53 nie je takmer nikdy mutovaný v benígnych ULM [28]. Možno práve funkčnosť tohto dôležitého tumor-supresorového génu zabraňuje ich malígnej transformácii. Jednou z prvých širokospektrálnych analýz zaoberajúcou sa aberantnou expresiou vybraných génov LMS bola vykonaná autormi Skubitz et al. [37]. Preukázali rozdiely v expresii viacerých génov. Autori využili metódu Affimetrix®, pričom skúmali takmer 12 000 génov. Veľmi výrazne zvýšenú hladinu expresie v LMS v porovnaní so zdravým myometriom (MM) malo šesť génov. Výrazne zníženú hladinu expresie v LMS mali štyri gény. Iné autorské kolektívy [25] preukázali, že v tkanivách LMS má zvýšenú hladinu expresie ďalších päť génov (tab. 1). Na úrovni proteínov [45] nebol imunohistochemicky zaznamenaný rozdiel v expresii p16 a p21 medzi zdravým MM, ULM, atypickými ULM a ULM s neznámym malígnym potenciálom. Odlišný bol iba profil LMS. V týchto tumoroch mali dané proteíny zvýšenú hladinu expresie. Takmer u všetkých typov mezenchymálnych tumorov tela maternice je častá znížená hladina expresie génu BCL2 [26].

Pri analýzach na zvieracích modeloch (myši), ktorým bol molekulárnym postupom odstránený gén BRCA1, bol pozorovaný vyšší výskyt LMS oproti modelom, ktoré mali tento gén zachovaný. U jedincov, ktorí mali súbežne odstránený aj gén TP53 bol nástup ochorenia rýchlejší a agresívnejší oproti tým, ktorí mali odstránený iba samotný TP53 gén [50]. U myší, ktorým bol odstránený gén LMP2, dochádzalo tiež k spontánnemu a agresívnemu rozvoju LMS [15].
Vzhľadom k tomu, že sú mezenchymálne tumory vysoko variabilnou skupinou ochorení, možno očakávať genetickú variabilitu medzi primárnymi a metastázujúcimi tumormi. Vedecký kolektív Davidsona et al. [8] skúmal hladinu expresie u primárnych a metastázujúcich LMS. Výsledky štúdie sú zobrazené v tabuľke 2.
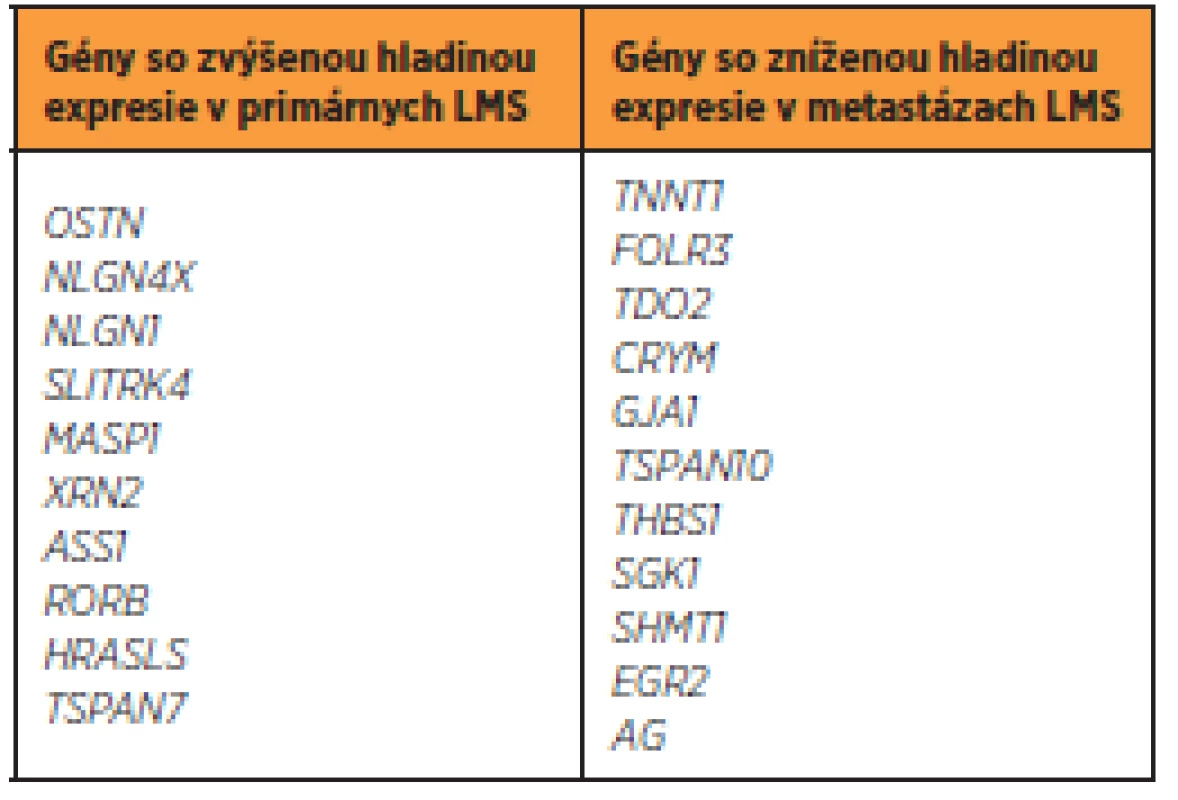
Ak vychádzame z predpokladu rozdielnej hladiny expresie v rámci jednej tumorovej skupiny, možno očakávať rozdielny model expresie obdobných génov medzi odlišnými skupinami sarkómov. Analýzami, zaoberajúcimi sa porovnávaním hladiny expresie [7] medzi LMS a ESS, sa preukázalo, že viacero génov je odlišne exprimovaných v tkanivách týchto tumorov (tab. 3). Aj napriek týmto odlišnostiam nemožno vylúčiť predpoklad, že určité defektné gény budú spoločné – ako spomenutý BCL2 gén, alebo CTAG1B gén, ktorý je tiež vyššie exprimovaný u väčšiny typov sarkómov tela maternice [25].
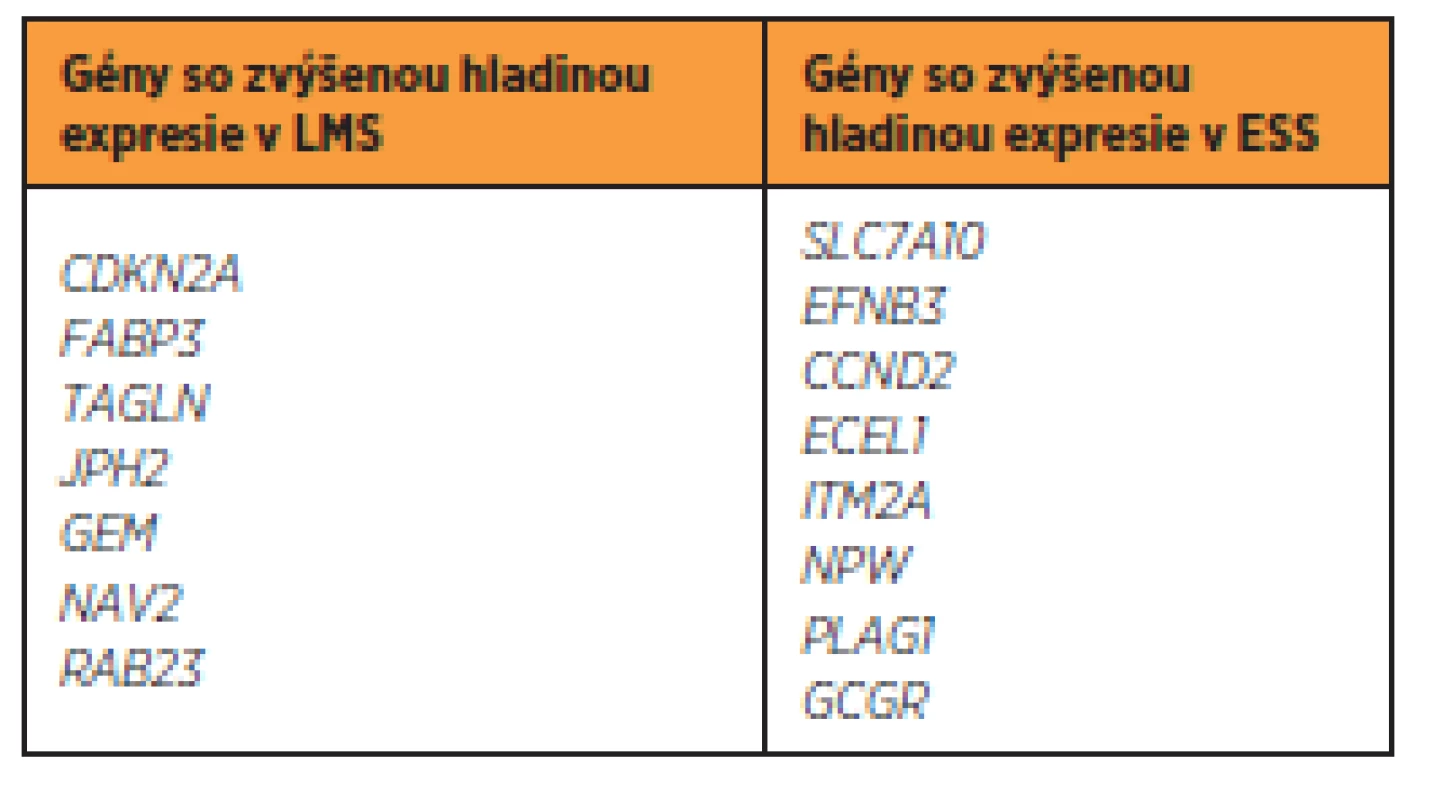
ESS sú charakteristické zvýšenou hladinou expresie génu CDK10 a β-katenínu, zároveň zníženou hladinou expresie desmínu [19]. Hladiny expresie p53, p16 a Ki-67 sú relatívne nízke [6]. Pre ESS je typická chromozómová prestavba, najčastejšie translokácia medzi génmi JAZF1-SUZ12 [3]. Progres v molekulárnych metódach, hlavne využitie sekvenovania druhej generácie (NGS), umožňuje efektívnejšie objasniť konkrétne genetické abnormality – inzercie, delécie alebo jednonukleotidové varianty (SNV). Kolektív autorov Jour et al. [18] v pilotnej štúdii klinickej využiteľnosti NGS spätne určil takmer 60 % cielených mutácií v rôznych typoch sarkómov. Identifikovali posunové (frameshift) mutácie, delécie a SNV v génoch RB1, NOTCH1, PIK3CA, PDGFRB, EPHA5, KDM6A, NF1 a FLT4. Zároveň autori detegovali aj necielené zmeny, zahŕňajúce stratu kópií TP53 (24 % prípadov), PTEN (16 % prípadov) a CDKN2A (20 % prípadov).
Metylácia ako jeden z faktorov môže tiež vplývať na výslednú úroveň aktivity génov. Metylačný status väčšiny LMS [35] je vyšší v promótorových oblastiach génu RASSF1A a MLH1. Zvýšená úroveň ich metylácie bola zistená okrem LMS aj u liposarkómov. Hypermetylovaný je rovnako u väčšiny typov sarkómov promótor génu PTEN [52]. Takéto zistenie poukazuje na fakt, že expresia génu PTEN môže pôsobiť ako významný regulátor bunkovej proliferácie u pacientok s LMS aj inými druhmi sarkómov. Na rozvoj sarkómov bol preukázaný aj vplyv viacerých aberantne pôsobiacich miRNA. Chuang et al. [4] analyzovali dopad abnormálnej expresie miR-200C. Génová rodina miR-200 pôsobí ako významný faktor pri výslednej bunkovej formácii, zahŕňajúcej angiogenézu a interakciu s extracelulárnou matrix. Autori vykonali experiment in vitro, s využitím SK-LMS-1 LMS bunkových línií. Zvýšená hladina expresie miR-200C v tejto línií a interakcia s neprekladanými regiónmi génov CDK2, CCNEC2 a IL8 vyústila do zníženia expresie týchto génov. Taktiež, zvýšená aktivita miR-200c priamo korelovala so zníženou tvorbou proteínu p65. Na druhej strane, v tomto prípade dochádzalo k zvýšeniu aktivity kaspázy 3 a kaspázy 7.
V prípade miRNA profilingu LMS a nediferencovaných pleiomorfnýmch sarkómov (UPS) sa zistilo, že tieto dva typy vykazujú výraznejšie rozdiely v expresii nasledujúcich miRNA: miR-199b-5p, miR-320a, miR-199a-3p, miR-126 a miR-2. Hladiny miR-199p a miR-320a mali zvýšenú hladinu expresie v prípade LMS ako aj UPS [13]. Mnohé z týchto miRNA ovplyvňujú diferenciáciu mezenchymálnych kmeňových buniek [16].
Rhabdomyosarkómy (RMS), zmiešané maternicové tumory a jedny z najčastejšie sa vyskytujúcich sarkómov u detí a mladistvých, sú charakteristické zvýšenou expresiou svalovo špecifických proteínov, vrátane β-aktínu a MyoD [49]. V prípade kultivovaných myoblastov je miR-206 prednostne indukovaná počas diferenciácie. Jej hlavnou úlohou je regulovať myogenézu inhibíciou proliferačných a signalizačných faktorov, ktoré pôsobia ako negatívne regulátory diferenciácie svalových buniek [42]. RMS mali aktivitu miR-206 ako aj miR-201 utlmenú [36]. Zároveň, znížená hladina expresie miR-206 negatívne koreluje s expresiou c-Met, ktorý preukázateľne ovplyvňuje rozvoj RMS [51]. Ďalším cieľom miR-206 je histón deacetyláza 4, ktorá inhibuje diferenciáciu supresiou aktivity myogénneho transkripčného faktora MEF2C [48].
Preukázané boli aj ďalšie miRNA interferencie, ktoré ovplyvňujú správnosť myogénnej diferenciácie a môžu súvisieť aj s rozvojom iných mezenchymálnych tumorov, nielen RMS. Išlo o onkogénny miR-19-92 klaster v rámci MIR17HG génu, pozostávajúci z miR-17, miR-18a, miR-19a, miR-19b, miR-20a a miR-92a [29]. Tretí intrón tohto génu zahŕňa miR-29, ktorá je súčasťou komplexu podieľajúcom sa na diferenciácii svalového tkaniva. Konkrétne, miR-29 je reprimovaná pôsobením NF-κB proteínového komplexu, ktorý ovplyvňuje aktivitu PcG (polycomb group protein complex). Okrem toho v prípade sarkómov bola miR-29 reprimovaná aberantne aktivovanou NF-κB-YY1 dráhou [5]. Pri rekonštrukcii miR-29 regulácie na zvieracích modeloch dochádzalo k inhibícii rastu tumorov a stimulácii diferenciácie. Možno očakávať, že aj jej pôsobenie je tumor-supresorové [5]. Nakoniec, mRNA cieľového génu miR-29-EZH2 mala v tomto prípade zvýšenú hladinu expresie. Produkt EZH2 génu pôsobí ako regulátor represívneho stavu v bunke, preto tento stav možno považovať za potenciálne obrannú reakciu bunky.
KLINICKÁ DIAGNOSTIKA SARKÓMOV
Pri klinickej diagnostike sarkómov, hlavne LMS predstavuje najväčšiu limitáciu vzájomná podobnosť vo viacerých smeroch s benígnymi a veľmi častými ULM [20, 30]. Vo všeobecnosti možno konštatovať, že sarkómy je možné s istotou diagnostikovať až histologicky, po resekcii tkaniva maternice. Predoperatívne a intraoperatívne diagnostiky zostávajú do značnej miery limitované v odhade malignity bunkovej masy. Predoperatívne palpačné vyšetrenie môže slúžiť ako prvotná, vstupná metóda, v prípade ktorej môže na potenciálnu malignitu masy poukazovať jej znížená mobilita [2]. Hoci sa malígne lézie oproti benígnym považujú za menej mobilné, v dôsledku ich zásahu do ďalších vrstiev, tento predpoklad nemožno generalizovať ani využiť pri konečnej diagnostike. Preto je potrebné palpačné vyšetrenie doplniť o ďalšie vyšetrovacie metódy [2]. Mali by byť primárne vizuálne, keďže v súčasnosti prevláda konsenzus prechádzať od invazívnych metód na neinvazívne [11]. Je tomu tak najmä z dôvodu potenciálneho rizika rozrušenia možnej malígnej masy tkaniva. Takouto metódou môže byť napríklad dilatácia a kyretáž, ktorá je relatívne invazívna, pričom rovnako výsledky sú často falošne pozitívne a záchyt patologických nálezov nemusí byť dostatočný [11]. Za výnimku možno považovať v prípade využitia kyretáže diagnostiku ESS, ktorá môže byť dostatočná až v 70 % prípadov ESS. Za dostatočne diagnostickú ju možno považovať iba v 30 % prípadov LMS [1].
Aj vizuálne metódy majú značné limitácie. Transvaginálna sonografia síce umožňuje diferencovať štruktúry typické pre LMS ako slabo echogénne štruktúry alebo štruktúry s centrálnou nekrózou [17]. Dopplerová sonografia umožňuje odhaliť abnormálne krvné zásobovanie, nízku impendanciu prietoku alebo vysoký PSV [6, 27]. Tieto všetky charakteristiky však môžu byť, hoci menej často prítomne aj u ULM [2]. Podľa štúdie Schwartz et al. [34] môže byť signifikantným znakom pri diagnostike sarkómov s využitím MRI ich neurčité ohraničenie. Štúdia, pri ktorej bolo použitá MRI s gadoliniumovou kontrastnou látkou vykazovala prediktívnu hodnotu viac ako 50 % [40]. MRI taktiež umožňuje odlíšiť LMS od endometriálnych tumorov, pokiaľ je opäť viditeľné nepravidelné ohraničenie [36]. Za pomoci MRI je možné diagnostikovať aj kalcifikované štruktúry, typické pre ULM [46]. Kalcifikácia sa považuje za znak nekrózy, spôsobený prerastením vlastného krvného zásobovania tumoru, ktoré nie je typické pre LMS [46]. Na druhej strane, veľké percento myómov zostáva nekalcifikovaných [46]. Za smerodajné, ale nie definitívne určujúce sa považuje zistenie intraléziových ložísk hemorágie, ktoré sú typickejšie pre sarkómy, ale taktiež sa nachádzajú aj u ULM [32].
V prípade LMS sa ako pomocné vyšetrenie na určenie malignity využíva RTG vyšetrenie hrudníka, keďže oba typy najčastejšie metastázujú do pľúc [44]. CT vyšetrenie sa nepovažuje za účelné pri rozlišovaní medzi benígnymi a malígnymi mezenchymálnymi tumormi [31], podobne je tomu aj v prípade PET vyšetrenia [23]. Za najvhodnejšiu kombináciu možno považovať prvotné sonografické vyšetrenie doplnené MRI vyšetrením s využitím gadoliniumovej kontrastnej látky. Ani rastové vzorce samotného tumoru nedokážu spoľahlivo poukázať na fakt, či ide o sarkóm alebo ULM. Rastové vzorce niektorých ULM môžu dosahovať rovnaké hodnoty ako v prípade sarkómov, hoci mnoho ULM vykazuje tendenciu počas tumorigenézy meniť svoje rastové tempo, respektíve sa dokonca do určitej miery samovoľne zmenšovať. Sarkómy rastú relatívne konštantne, bez výrazných výkyvov [6]. Zakladať si na rozdielnosti rastových vzorcov by teda vyžadovalo časovo náročné a opakované pozorovanie pacientky.
VÝHLADY PRE KLINICKÚ PRAX
Malígne sarkómy sú relatívne vzácnym, ale veľmi agresívnym nádorovým ochorením. Pre klinickú prax zostáva ich odlíšenie od benígnych ULM štandardnými zobrazovacími metódami stále veľmi komplikované. S dostatočnou istotou je možné stanoviť malígny charakter mezenchymálnych tumorov tela maternice až po chirurgickom zákroku s využitím histologických postupov. Tie sú síce dostatočne presné a robustné, v mnohých prípadoch však chirurgický zákrok, ktorý im predchádza predstavuje veľkú psychickú záťaž pre pacientku. Obzvlášť pri hysterektómii u žien, ktoré si plánujú zachovať fertilitu. Neochota pacientky podrobiť sa chirurgickému zákroku môže oddialiť odstránenie tumoru.
Veľkým problémom pre klinickú prax je, že mnoho žien vyhľadá odbornú pomoc, až keď symptomatické prejavy začnú byť akútne. Aj keď sú tieto symptómy spôsobené zväčša benígnymi ULM, ktoré ženu priamo neohrozujú na živote, u žien, ktoré majú malígne sarkómy, môže byť odklad vyšetrenia a následného odstránenia rozhodujúci pre priebeh ochorenia. Z pohľadu pacientky aj vyšetrujúceho lekára by bolo ideálne podporiť štandardné klinické diagnostikovanie tumorov tela maternice neinvazívnou metódou. Tá by mala byť dostatočne robustná a iba minimálne zaťažovať psychiku pacientky.
Potencionálnou sa v tomto smere zdá byť analýza cirkulujúcich tumorových DNA (ctDNA), ktoré sú uvoľňované do krvného obehu solídnymi tumormi. Je možné ich detegovať metódou tekutej biopsie, ktorá nevyžaduje invazívny zákrok, ale iba odber krvi. Je preukázané, že ctDNA uvoľňujú aj mezenchymálne tumory [10]. ctDNA by tiež mali vykazovať rovnaký model genetických [14] aj epigenetických zmien [41] ako pôvodné solídne tumory. Pokiaľ by sa na dostatočnom súbore vzoriek preukázalo, že benígne ULM majú určitý model zmien, dostatočne odlišný od malígnych variant (LMS), a model týchto zmien zostane rovnaký v sekvenciách ctDNA, bolo by možné analýzu ctDNA využiť ako pomocnú metódu, ktorá by mohla vyplniť medzeru v neinvazívnom klinickom odlíšení mezenchymálnych tumorov tela maternice. Tekutú biopsiu možno považovať stále za relatívne novú metódu, ktorú treba v mnohých ohľadoch zdokonaliť. Nemožno očakávať, že ju bude možné implementovať do klinickej praxe v priebehu najbližších mesiacov. Všeobecné odhady hovoria o hranici niekoľkých rokov, kedy by mohla byť relatívne bežne využívaná [14].
Povedomie o molekulárnych a epigenetických zmenách v tkanivách sarkómov je možné využiť aj pri návrhu medikamentóznej liečby. Liečivá, ktoré sa zakladajú na modulácii (hlavne inhibícii) aktivity konkrétnych génov, resp. bunkových kompartmentov, sú v súčasnosti klinicky aplikované na liečbu odlišných nádorových typov [22]. Nie je však možné vylúčiť, že by tento princíp nebolo možné využiť aj na liečbu sarkómov maternice. Z dôvodu agresivity nádorov je takmer vylúčené, že by takáto liečba mohla byť aplikovaná samostatne. Pokiaľ by však bola dostatočne účinná aspoň v čiastočnom zmiernení agresivity tumoru, najmä pri tvorbe metastáz, resp. spomalení jeho rastu, bola by pre klinickú prax veľmi prospešná. Obdobne ako v prípade klinickej diagnostiky, i pri potenciálnej medikamentóznej podpornej liečbe sarkómov je nutné uvažovať v širšom časovom období. Okrem návrhu a aplikácie viacerých typov inhibítorov, resp. aktivátorov konkrétnych génov môže byť povedomie o aktivite daných génov potenciálne využité aj pri génovej terapii. Ide o metódu, ktorá je v súčasnosti prakticky aplikovaná iba minimálne, avšak s obrovským potenciálom do budúcnosti. Niektorí autori predpokladajú, že pri súčasnom trende rozvoja molekulárno-genetických postupov bude tiež možné génovú terapiu aplikovať na liečbu v priebehu niekoľkých rokov [21]. Pokiaľ bude táto možnosť reálna, bude prospešné mať informácie o čo najväčšom množstve abnormalít v čo najširšom spektre nádorových ochorení.
ZÁVER
V tomto prehľadovom článku sme sumarizovali klinické a molekulárno-genetické rizikové faktory ovplyvňujúce tumorigenézu malígnych mezenchymálnych tumorov tela maternice a možnosti ich klinickej diagnostiky. Sarkómy maternice predstavujú relatívne vzácne nádorové ochorenia, ktoré možno považovať za veľmi agresívne a zapríčiňujúce percentuálne veľmi vysoký podiel úmrtí. V súčasnosti za jedinú možnosť ako predchádzať rozvoju sarkómov maternice s úplnou istotou, možno považovať hysterektómiu. Je tomu tak z dôvodu, že či už invazívnymi, alebo aj rôznymi kombináciami zobrazovacích metód nie je možné jednak predikovať vznik tumoru a rovnako zostáva veľmi problematické odhadnúť jeho malígny charakter. Aktuálne klinické postupy sú teda nedostatočné a vyžadujú objavenie vhodného genetického a epigenetického markeru, typického pre jednotlivé typy sarkómov. Práve takýto marker možno považovať za dôležitý element, ktorý by ako pomocný faktor mohol slúžiť k predikcii sarkómov v dostatočnom predstihu. Ich vysoká heterogenita a veľmi nízka incidencia predstavuje v tomto smere značnú prekážku.
Táto práca bola podporená projektom Martinské centrum pre biomedicínu - BioMed [ITMS 26220220187] a Grantom Univerzity Komenského UK 20/2018 a UK 22/2018.
RNDr. Dana Dvorská
Divízia molekulová medicína
Martinské centrum pre biomedicínu JLF UK
Malá Hora 4C
036 01 Martin
Slovenská republika
e-mail: dvorska@jfmed.uniba.sk
Sources
1. Abeler, VM., Røyne, O., Thoresen, S., et al. Uterine sarcomas in Norway. A histopathological and prognostic survey of a total population from 1970 to 2000 including 419 patients. Histopathology, 2009, 54, 3, p. 355–364.
2. Amant, F., Coosemans, AN., Debiec-Rychter, M., et al. Clinical management of uterine sarcomas. Lancet Oncol, 2009, 10, 12, p. 1188–1198.
3. Chiang, S., Ali, R., Melnyk, N., et al. Frequency of known gene rearrangements in endometrial stromal tumors. Am J Surg Pathol, 2011, 35, 9, p. 1364–1372.
4. Chuang, TD., Ho, M., Khorram, O. The regulatory function of miR-200c on inflammatory and cell-cycle associated genes in SK-LMS-1, a leiomyosarcoma cell line. Reproduct Sci, 2015, 22, 5, p. 563–571.
5. Cieśla, M., Dulak, J., Józkowicz, A. MicroRNAs and epigenetic mechanisms of rhabdomyosarcoma development. Intern J Biochem Cell Biol, 2014, 53, p. 482–492.
6. D’Angelo, E., Prat, J. Uterine sarcomas: a review. Gynecol Oncol, 2010, 116, 1, p. 131–139.
7. Davidson, B., Abeler, VM., Førsund, M., et al. Gene expression signatures of primary and metastatic uterine leiomyosarcoma. Hum Pathol, 2014, 45, 4, p. 691–700.
8. Davidson, B., Abeler, VM., Hellesylt, E., et al. Gene expression signatures differentiate uterine endometrialstromal sarcoma from leiomyosarcoma. Gynecol Oncol, 2013, 128, 2, p. 349–355.
9. Diba, C. Incidencia zhubných nádorov v Slovenskej republike 2008. Narodne centrum zdravotnickych informaci, 2014. [http: //www.nczisk.sk/Documents/publikacie/analyticke/incidencia_zhubnych_nadorov_2008.pdf ]
10. Eastley, CE., Ottolini, B., Neumann, R., et al. Circulating tumour-derived DNA in metastatic soft tissue sarcoma. Oncotaget, 2018, 9, 12, p. 10549–10560.
11. Falcone, T., Parker, WH. Surgical management of leiomyomas for fertility or uterine preservation. Obstet Gynecol, 2013, 121, 4, p. 856–868.
12. Giuntoli, RL., Gostout, BS., DiMarco, CS., et al. Diagnostic criteria for uterine smooth muscle tumors, leiomyoma variants associated with malignant behavior. J Reprod Med, 2007, 52, 11, p. 1001.
13. Guled, M., Pazzaglia, L., Borze, I., et al. Differentiating soft tissue leiomyosarcoma and undifferentiated pleomorphic sarcoma, a miRNA analysis. Genes Chromosomes Cancer, 2014, 53, 8, p. 693–702.
14. Han, X., Wang, J., Sun, Y. Circulating tumor DNA as a biomarker for cancer detection. Genomic, Proteomics Bioinformatics, 2017, 15, 2, p. 59–72.
15. Hayashi, T., Horiuchi, A., Sano, K., et al. Mice-lacking LMP2, immuno-proteasome subunit, as and animal model of spontaneous uterine leiomyosarcoma. Protein Cell, 2010, 1, 8, p. 711–717.
16. Huang, G., Nishimoto, K., Zhou, Z., et al. miR-20a encoded by the miR-17-92 cluster increases the metastatic potential of osteosarcoma cells by regulating Fas expression. Cancer Res, 2012, 72, 4, p. 908–916.
17. Hurley, V. Imaging techniques for fibroid detection. Bailliere’s Clin Obstet Gynaecol, 1998, 12, 2, p. 213–224
18. Jour, G., Scarborough, JD., Jones, RL., et al. Molecular profiling of soft tissue sarcomas using next-generation sequencing: a pilot study toward precision therapeutics. Hum Pathol, 2014, 45, 8, p. 1563–1571.
19. Jung, CK., Jung, JH. Diagnostic use of nuclear beta-catenin expression for the assessment of endometrial stromal tumors. Mod Pathol, 2008, 21, 6, p. 756–763.
20. Kadlecová, J., Hudeček, R., Mekiňová, L., et al. Histologické typy děložních myomů u pacientek v reprodukčním věku a postmenopauze. Čes Gynek, 2015, 80, 5, s. 360–364.
21. Keller, AM., El-Mallah, MK., Flotte, TR. Gene Therapy 2017: Progress and future directions. Clin Transl Sci, 2017, 10, p. 242–248.
22. Khera, N., Rajput, S. Therapeutic potential of small molecule inhibitors. J Cellular Biochemistry, 2017, 118, 5, p. 959–961.
23. Kitajima, K., Murakami, K., Kaji, Y., et. al. Spectrum of FDG PET/CT findings of uterine tumors. Amer J Roentgenol, 2010, 195, 3, p. 737–743.
24. Kleinerman, RA., Yu, CL., Little, MP., et al. Variation of second cancer risk by family history of retinoblastoma among long-term survivors. J Clin Oncol, 2012, 30, 9, p. 950–957.
25. Kobayashi, H., Uekuri, C., Akasaka, J., et al. The biology of uterine sarcomas: A review and update. Molecul Clinic Oncol, 2013, 1, 4, p. 599–609.
26. Koivisto-Korander, R. Immunohistochemical studies on uterine carcinosarcoma, leiomyosarcoma, and endometrial stromal sarcoma: expression and prognostic importance of ten different markers. Tumor Biol, 2011, 32, 3, p. 451–459.
27. Levine, D. Pelvic Doppler. Seminars in Ultrasound, CT and MRI. 1999, 20, 4, p. 239–249.
28. Mehine, M., Kaasinen, E., Mäkinen, N., et al. Characterization of uterine leiomyomas by whole genome sequencing. N Engl J Med, 2013, 369, 1, p. 43–53.
29. Mendell, JT. miRiad roles for the miR-17-92 cluster in development and disease. Cell, 2008, 133, 2, p. 217–222.
30. Műller, R., Břeský, P. Obrovský děložní myom – kazuistika. Čes Gynek, 2016, 81, 1, s. 71–75.
31. Rha, SE., Byun, JY., Jung, SE., et al. CT and MRI of uterine sarcomas and their mimickers. Amer J Roentgenol, 2003, 181, 5, p. 1369–1374.
32. Samuel, A., Fennesy, FM., Tempany, CM., et al. Avoiding treatment of leiomyosarcomas: the role of magnetic resonance in focused ultrasound surgery. Fertil Steril, 2008, 90, 3, p. 850.e9
33. Schmidt, LS., Linehan, WM. Hereditary leiomyomatosis and renal cell carcinoma. Intern J Nephrol Renovascular Dis, 2014, 7, p. 253.
34. Schwartz, LB., Zawin, M., Carcangiu, ML., et al. Does pelvic magnetic resonance imaging differentiate among the histologic subtypes of uterine leiomyomata? Fertil Steril, 1998, 70, 3, p. 580.
35. Seidel, C., Bartel, F., Rastetter, M., et al. Alterations of cancer-related genes in soft tissue sarcomas: hypermethylation of RASSF1A is frequently detected in leiomyosarcoma and associated with poor prognosis in sarcoma. Int J Cancer, 2005, 114, 3, p. 442–447.
36. Shozu, M., Murakami, K., Inoue, M., et al. Aromatase and leiomyoma of uterus. Seminars in reproductive medicine, 2004, 22, 1, p. 51–60.
37. Skubitz, KM., Skubitz, PN. Differential gene expression in leiomyosarcoma. Cancer, 2003, 98, 5, p. 1029–1038.
38. Špaček, J., Laco, J., Petera, J., et al. Prognostické faktory u mezenchymálních a smíšených nádorů děložního těla. Čes Gynek, 2009, 74, 4, s. 292–297.
39. Tal, R., Segars, JH. The role of angiogenic factors in fibroid pathogenesis: potential implications for future therapy. Hum Reprod Update, 2014, 20, 2, p. 194–216.
40. Tanaka, YO., Nishida, M., Tsunoda, H., et al. Smooth muscle tumors of uncertain malignant potential and leiomyosarcomas of the uterus: MR findings. J Magn Reson Imaging, 2004, 20, 6, p. 998.
41. Tanic, M., Beck, S. Cell-free DNA: Treasure trove for cancer medicine. Nature Materials, 2017, 16, 11, p. 1056.
42. Taulli, R., Bersani, F., Foglizzo, V., et al. The muscle-specific microRNA miR-206 blocks human rhabdomyosarcoma growth in xenotransplanted mice by promoting myogenic differentiation. J Clin Invest, 2009, 119, 8, p. 2366–2378.
43. Tomšová, M., Pohnětalová, D., Špaček, J. Vzácné nádory myometria – intravenózní leiomyomatóza a benigní metastázujíci leiomyom. Čes Gynek, 2007, 72, 2, p. 136–139.
44. Tropé, CG., Abeler, VM., Kristensen, GB. Diagnosis and treatment of sarcoma of the uterus. A review. Acta Oncologica, 2012, 51, 6, p. 694–705.
45. Ünver, NU., Acikalin, MF., Öner, Ü., et al. Differential expression of P16 and P21 in benign and malignant uterine smooth muscle tumors. Arch Gynecol Obstet, 2011, 284, 2, p. 483–490.
46. Van den Bosch, T., Coosemans, A., Morina, M., et al. Screening for uterine tumours. Best Pract Res Clin Obstet Gynaecol, 2012, 26, 2, p. 257–266.
47. Wickerham, DL., Fisher, B., Wolmark, N., et al. Association of tamoxifen and uterine sarcoma. J Clin Oncol, 2002, 20, 11, p. 2758–2760.
48. Winbanks, CE., Beyer, C., Hagg, A., et al. miR-206 represses hypertrophy of myogenic cells but not muscle fibers via inhibition of HDAC4. PLoS One, 2013, 8, 9, p. e73589.
49. Wu, Y., Li, C., Zhong, Y., et al. Head and neck rhabdomyosarcoma in adults. J Craniofac Surg, 2014, 25, 3, p. 922–925.
50. Xing, D., Scangas, G., Nitta, M., et al. A role for BRCA1 in uterine leiomyosarcoma. Cancer Res, 2009, 69, 21, p. 8231–8235.
51. Yan, D., Dong, XE., Chen, X., et al. MicroRNA-1/206 targets c-Met and inhibits rhabdomyosarcoma development. J Biol Chem, 2009, 284, 43, p. 29596–29604.
52. Yin, L., Cai, WJ., Liu, CX., et al. Analysis of PTEN methylation patterns in soft tissue sarcomas by MassARRAY spectrometry. PLoS One, 2013, 8, 5, p. e62971.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Czech Gynaecology

2018 Issue 5
-
All articles in this issue
- Hladina hCG po embryotransferu jako prognostický ukazatel fyziologického těhotenství
- Vyšší věk matky – rizikový faktor pro nízkou porodní váhu
- Poruchy příjmu potravy v těhotenství
- Faktory ovplyvňujúce vznik sarkómov maternice a možnosti ich klinickej diagnostiky
- Vaginální mikrobiom
- Vliv polychlorovaných bifenylů a organochlorovaných pesticidů na lidskou reprodukci
- Pánevní aktinomykóza a IUD
- Screening a diagnostika gestačného diabetes mellitus
- Gestační diabetes mellitus Mezioborová spolupráce
- Efekt cerkláže na délku děložní hrdla a vliv změn délky hrdla na prognózu těhotenství
- Úskalí screeningu gestačního diabetu v České republice – průzkum mezi pacienty
- Opakovaná děložní intrapartální ruptura po endoskopické operaci hluboké endometriózy rektovaginálního septa a močového měchýře
- Czech Gynaecology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Hladina hCG po embryotransferu jako prognostický ukazatel fyziologického těhotenství
- Vaginální mikrobiom
- Pánevní aktinomykóza a IUD
- Poruchy příjmu potravy v těhotenství
