Sérová hladina kyseliny hyaluronové – prediktivní biomarker rentgenové progrese osteoartrózy kloubů rukou
Serum level of hyaluronic acid – a marker with a predictive value for radiographic progression of hand osteoarthritis
Background:
Hyaluronic acid (HA) is considered a potential biomarker of progression of knee osteoarthritis (OA). The aim of this study was to measure the serum levels of HA in patients with erosive and non-erosive hand OA, and to determine its association with the disease specific structural changes.
Methods:
Fifty-five women with erosive and 33 with non-erosive OA underwent clinical examination and functional tests. Eighty-one patients underwent three-phase bone scintigraphy in order to determine the inflammation and remodeling of hand joints. Radiographs of hands were performed at baseline and after 2 years. Serum levels of HA were measured by ELISA.
Results:
Women only were included in this study. Both groups were comparable in terms of age, disease duration, BMI and inflammatory markers. The serum levels of HA correlated with age and disease duration. After adjustment for age and disease duration, HA serum levels were still higher in patients with erosive than non-erosive OA, and correlated with the number of joints with deviations and deformities. Furthermore, the serum levels of HA were associated with joint remodeling as assessed by late phase scintigraphy, and correlated with the severity of radiographic changes at baseline and after 2 years.
Conclusion:
The serum level of HA is increased in patients with erosive compared to patients with non-erosive hand OA. It is associated with local structural changes and may be regarded as a biomarker with a predictive value for radiographic progression of hand OA.
Key words:
hyaluronic acid, biomarker, erosive osteoarthritis, scintigraphy
:
M. Filková 1; L. Šenolt 1; M. Braun 1; H. Hulejová 1; A. Pavelková 1; O. Šléglová 1; K. Kupka 2; J. Gatterová 1; K. Pavelka 1
:
Revmatologický ústav, Experimentální laboratoř pro výzkum pojiva, Revmatologická klinika 1. LF UK, Praha
1; Ústav nukleární medicíny 1. LF UK a VFN, Praha
2
:
Čes. Revmatol., 17, 2009, No. 4, p. 184-190.
:
Original Papers
Kyselina hyaluronová (KH) je považována za potenciální biomarker progrese osteoartrózy (OA) kolenních kloubů. Cílem této práce bylo změřit sérové koncentrace KH u pacientů s erozivní a neerozivní formou OA rukou a určit jejich vztah ke strukturálním změnám onemocnění.
Úvod:
Kyselina hyaluronová (KH) je považována za potenciální biomarker progrese osteoartrózy (OA) kolenních kloubů. Cílem této práce bylo změřit sérové koncentrace KH u pacientů s erozivní a neerozivní formou OA rukou a určit jejich vztah ke strukturálním změnám onemocnění.
Metody:
Padesát pět žen s erozivní a 33 s neerozivní OA rukou absolvovalo klinické vyšetření a funkční testy. Osmdesát jedna pacientů podstoupilo 3fázovou kostní scintigrafii za účelem determinace zánětu a přestavby kloubů rukou. Rentgen rukou byl proveden na začátku a po 2 letech. Sérové hladiny KH byly měřeny metodou ELISA.
Výsledky:
Do studie byly zařazeny pouze ženy, které se v obou skupinách nelišily věkem, trváním příznaků, BMI a parametry zánětu. Sérové hladiny KH korelovaly s věkem a délkou trvání nemoci. Po adjustaci KH k těmto proměnným byly sérové hladiny KH stále vyšší u pacientů s erozivní OA v porovnání s neerozivní formou onemocnění a korelovaly s počtem kloubů postižených deviací a deformací. Navíc měla KH vztah ke kloubní přestavbě podle pozdní fáze kostní scintigrafie a korelovala se závažností rentgenových změn na počátku i po 2 letech studie.
Závěr:
Sérová hladina kyseliny hyaluronové je zvýšená u pacientů s erozivní v porovnání s pacienty s neerozivní OA rukou, má vztah k lokálním strukturálním změnám a může představovat prediktivní biomarker rentgenové progrese OA rukou.
Klíčová slova:
kyselina hyaluronová, biomarker, erozivní osteoartróza, scintigrafie
Úvod
Erozivní osteoartróza (EOA), která představuje podtyp osteoartrózy (OA) rukou, se manifestuje lokálním zánětem a rentgenovými známkami kostních erozí, kortikální destrukcí a následnou reparací především na drobných kloubech rukou (1). Významně se uplatňuje familiární predispozice a postiženy bývají především ženy středního věku. Přestože je OA charakterizována jako nezánětlivé onemocnění, vyšší sérové hladiny CRP byly prokázány u pacientů s OA kolenních i kyčelních kloubů ve srovnání se zdravou populací (2, 3). Systémové hladiny CRP mohou být podmíněny přítomností synoviálního zánětlivého infiltrátu, ale zatím neexistuje přesvědčivý důkaz, že CRP odráží aktivitu erozivního průběhu (4, 5, 6, 7).
V současnosti se diagnóza OA zakládá na charakteru klinického průběhu a na rentgenovém obraze, který je však již pozdním znakem a je nedostatečný pro predikci progrese nemoci. Biomarkery degradace, syntézy nebo zánětu, které mají funkční význam v kloubním kompartmentu, by mohly přispět k detekci nemoci v jejím časném stadiu a k identifikaci pacientů s rizikem rychlé progrese.
Kyselina hyaluronová (KH) přispívá ke strukturální a funkční integritě kloubní chrupavky. Je odpovědná za jedinečné visko-elastické vlastnosti synoviální tekutiny a pokládá se za marker synovitidy (10, 11). Vyšší koncentrace KH v synoviální tekutině v porovnání s hladinou v krevním oběhu u pacientů s revmatoidní artritidou (RA) a OA jsou pravděpodobně důsledkem zvýšené lokální produkce (12). Navíc byla u pacientů s OA oproti zdravým dobrovolníkům prokázána zvýšená sérová hladina KH (9, 12, 13, 14) a její prediktivní hodnota s ohledem na progresi OA kolen a kyčlí (13, 15, 16).
Cílem této práce bylo porovnat sérovou hladinu kyseliny hyaluronové mezi pacienty s erozivní a neerozivní formou OA rukou a zjistit její možný vztah ke strukturálním změnám a rentgenové progresi v průběhu 2 let.
Pacienti a metody
Pacienti
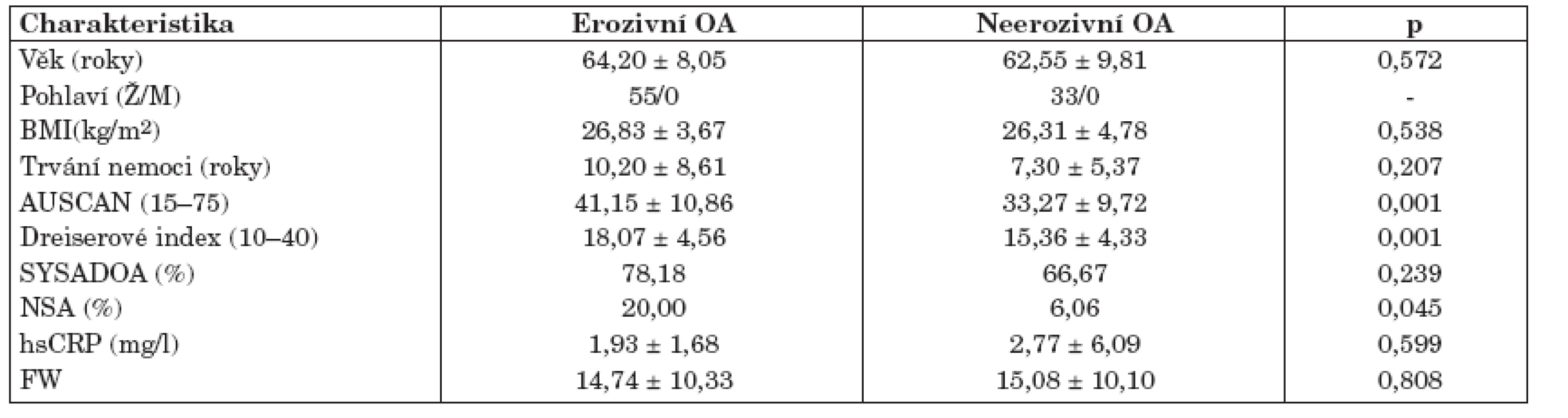
Studie se zúčastnilo 88 žen ve věku 52–72 let, které byly sledovány ambulantně v Revmatologickém ústavu v Praze a splňovaly kritéria Americké revmatologické společnosti (ACR) pro OA drobných kloubů rukou (17). Pacienti s EOA kromě výše uvedených kritérií měli navíc na rentgenovém snímku rukou patrnou minimálně jednu kostní erozi distálního nebo proximálního interfalangeálního kloubu. V této práci jsme rozšířili soubor pacientů s OA rukou, který byl objektem studia naší předchozí práce (18). Tato studie byla schválena lokální etickou komisí a všichni účastníci podepsali informovaný souhlas. Charakteristika pacientů je uvedena v tabulce 1.
Všichni pacienti vyplnili dotazník AUSCAN (Australian Canadian OA hand index), popisující bolest, ztuhlost a potíže při provádění běžných denních činností za posledních 48 hodin (19), a Dreiserové index (20). Klinické vyšetření kloubů rukou, provedeno na začátku studie, zahrnovalo vyšetření otoku, palpační citlivosti, deformace a deviace. Deformace zahrnují Heberdenovy a Bouchardovy uzle. Deviace byla hodnocena jako rozdíl mezi normální, přirozenou osou kloubu a aktuálním směrem – ulnárním nebo radiálním.
Zobrazovací metody
Předozadní snímek rukou na začátku studie a po 2 letech sledování byl zhodnocen jedním radiologem podle Kallmanova skóre (21). U jednotlivých kloubů byla hodnocena velikost osteofytů (škála 0–3), zúžení kloubní štěrbiny (0–3), přítomnost subchondrální sklerózy (0–1), subchondrálních cyst (0–1), úhlové vychýlení kloubu (0–1) a kolaps centrální části kortikální kosti (0–1). Technika rentgenového zobrazení kolenních kloubů v plné extenzi byla již popsána dříve (22) a hodnocení bylo provedeno podle Kellgrena a Lawrence (K-L), modifikace podle Steinbrockera (23).
Sonografie kolenních kloubů byla na začátku studie provedena zkušeným radiologem. Pro potřeby této studie byla hodnocena přítomnost/nepřítomnost kloubního výpotku a synoviálního edému. Rentgenové a sonografické vyšetření kolenního kloubu bylo provedeno s cílem vyloučit tento kloub jako možný zdroj kyseliny hyaluronové v důsledku probíhající přestavby či zánětu.
Trojfázovou kostní scintigrafii s aplikací injekčního bolusu Tc-99m metylén difosfonátu s aktivitou 600MBq do kubitální žíly podstoupili pacienti na začátku studie. Scintigramy druhé (blood pool) fáze byly zaznamenány po 10 min. a třetí (pozdní) fáze po 2,5 hod. po aplikaci. Scintigramy byly zaměřeny na oblast obou rukou a byly hodnoceny následující klouby: proximální a distální interfalangeální klouby, metakarpofalangeální, karpometakarpální, interkarpální a radiokarpální skloubení. Klouby byly vyhodnoceny jako zánětlivé na základě vychytávání radiofarmaka v blood pool fázi a osteoblastická aktivita reprezentující přestavbu kosti podle vychytávání radiofarmaka v pozdní fázi. V obou fázích byly sečteny pozitivní klouby.
Laboratorní měření
Krevní odběr z loketní žíly byl proveden u každého pacienta na začátku studie. Sérum bylo až do zpracování uchováno při teplotě -80 °C. Sérové hladiny CRP byly měřeny na začátku studie imuno-turbidimetrickou technikou (high sensitivity CRP, hsCRP) pomocí biochemického analyzátoru Olympus (model AU 400, Japonsko). KH byla analyzována pomocí komerčně dostupného kitu ELISA podle doporučení výrobce (Corgenix HA Test kit, Corgenix Inc., USA). Absorbance byla měřena na vlnové délce 450 nm (Tecan Sunrise, Rakousko). Normální rozmezí kyseliny hyaluronové stanoveno výrobcem je 0–75 ng/ml.
Statistická analýza
Data jsou vyjádřena jako průměr a směrodatná odchylka (SD). Pro porovnání hodnot mezi dvěma skupinami byl použit Mann-Whitneyův U-test, hodnota P menší než 0,05 byla považována za statisticky významnou. Pro vyhodnocení síly korelace byl použit Spearmanův korelační koeficient. Pearsonův korelační koeficient byl použit k vyhodnocení korelací, kde byly hladiny kyseliny hyaluronová adjustovány k věku a délce trvání nemoci. Data byla analyzována pomocí programu GraphPad Prism 5 (verze 5.02; GraphPad Software, La Jolla, CA, USA).
Výsledky
Klinické a demografické údaje
Osmdesát osm pacientů s OA drobných kloubů rukou bylo rozděleno podle výše uvedených kritérií do 2 skupin: 55 pacientů s erozivní a 33 pacientů s neerozivní formou OA. Obě skupiny tvořily pouze ženy a byly srovnatelné věkem, trváním choroby, BMI a hodnotami sedimentace erytrocytů a CRP (tab. 1). Nesteroidní antirevmatika (NSA) užívalo více pacientů s EOA oproti neerozivní OA (tab. 1). Výsledky dotazníku AUSCAN a Dreiserové indexu prokázali, že pacienti s EOA trpí větší bolestí a ztuhlostí drobných kloubů rukou a mají větší omezení při vykonávání denních činností. Klinické vyšetření potvrdilo těžší průběh erozivní formy, charakterizovaný vyšším počtem kloubů palpačně citlivých a postižených otokem, deviacemi a deformacemi (tab. 2).
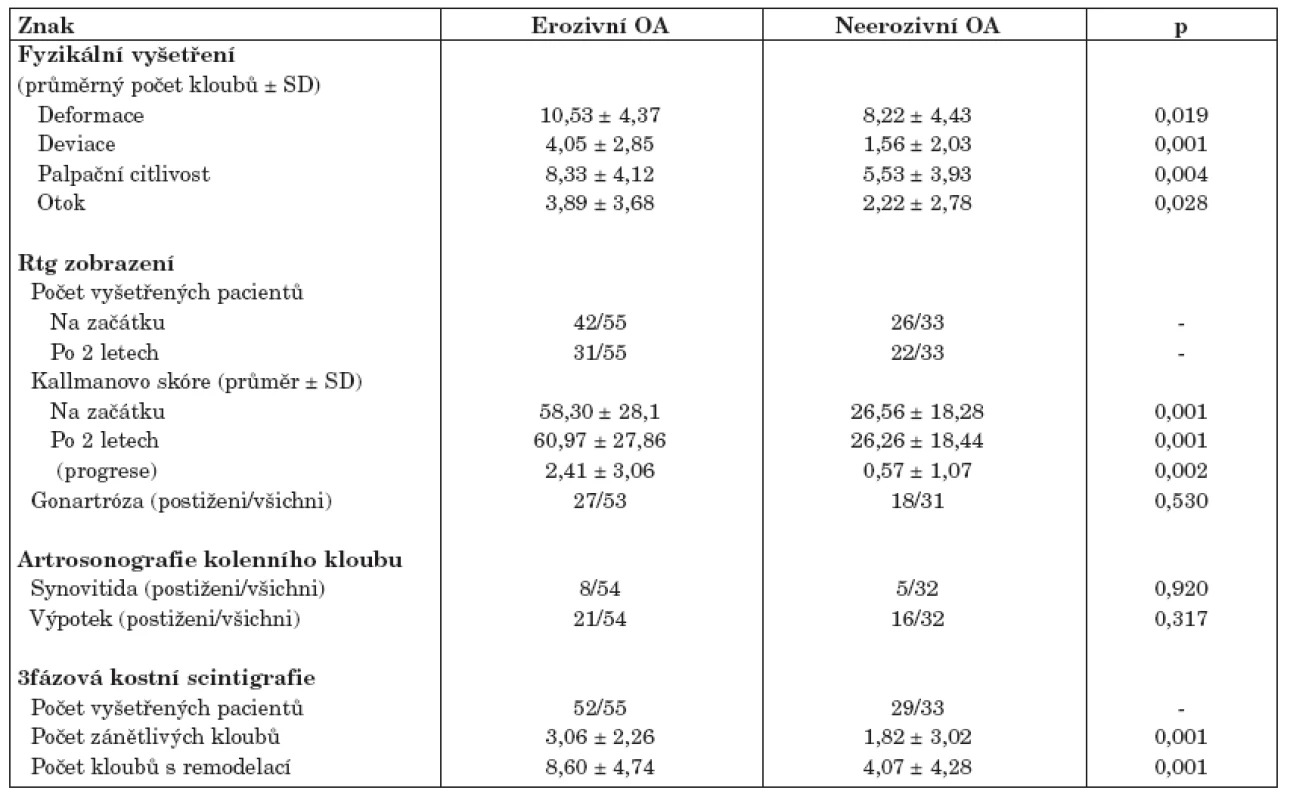
Rentgen rukou na začátku studie podstoupilo 68 pacientů a po 2 letech 53 pacientů. Počet erozí podle snímku rukou u pacientů s erozivní formou se pohyboval v rozmezí 1–19 (průměr ± SD: 8,18 ± 4,89). Pacienti s EOA měli závažnější rentgenové postižení na začátku studie i po 2 letech sledování. Rychlost rentgenové progrese (vyjádřena jako ∆ Kallmanova skóre) byla u těchto pacientů více než 4x vyšší (tab. 2).
Podle rentgenového vyšetření kolenních kloubů, které bylo provedeno u 53/55 EOA a 31/33 neerozivních OA pacientů, byla prevalence OA kolenních kloubů srovnatelná (tab. 2). Podobně se nelišil ani sonograficky stanovený výskyt synovialitidy a výpotku kolenních kloubů.
3fázovou kostní scintigrafii absolvovalo 52/55 pacientů s EOA a 29/33 pacientů s neerozivní OA. Celkový počet zánětlivých kloubů a počet kloubů s přestavbou byl signifikantně vyšší u pacientů s erozivní formou onemocnění (tab. 2).
Kyselina hyaluronová u pacientů s osteoartrózou drobných kloubů rukou
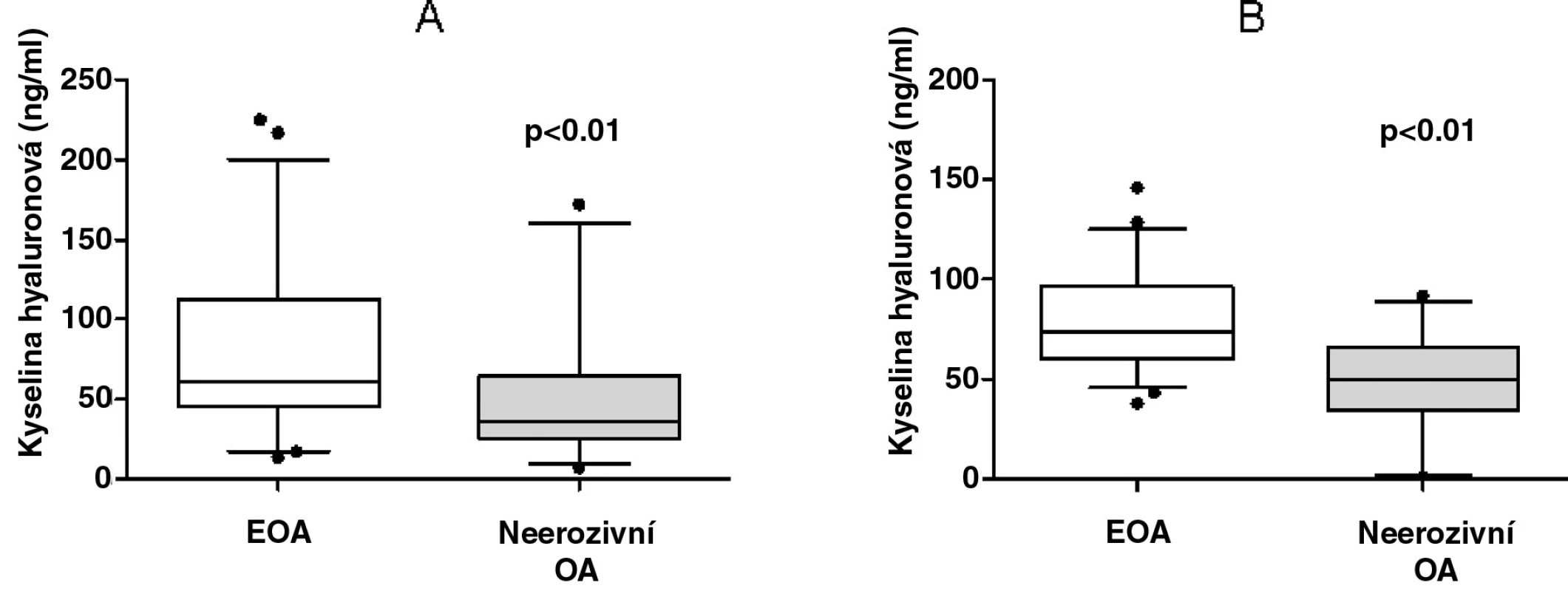
Hladiny kyseliny hyaluronové byly závislé na věku (r = 0,448, p < 0,01), délce trvání nemoci (r = 0,333, p < 0,01), ale ne na výši BMI (r = 0,195, p > 0,05) nebo podáváním NSA (r = -0,074, p > 0,05). Sérové koncentrace kyseliny hyaluronové byly signifikantně vyšší u pacientů s EOA ve srovnání s neerozivní OA (78,53 ± 51,31 vs. 50,45 ± 41,25 ng/ml, p < 0,01, obr. 1a). Tento rozdíl byl statisticky významný i po adjustaci koncentrací KH současně k věku a délce trvání nemoci (78,53 ± 23,59 vs. 50,45 ± 22,72 ng/ml, p < 0,01, obr. 1b). U všech pacientů s osteoartrózou kloubů rukou korelovala KH s počtem kloubů postižených deviací a deformací (r = 0,397 a r = 0,399, p < 0,01 pro obě korelace). Silný vztah KH k počtu kloubů postižených deviací a deformací byl přítomen pouze u pacientů s EOA. Nicméně sérová hladina KH nekorelovala s počtem kloubů postižených otokem nebo palpační bolestivostí. Koncentrace KH se nelišily mezi pacienty s přítomností osteoartrózy, výpotku či synovitidy kolenních kloubů a bez manifestace těchto příznaků.
Sérové hladiny KH u pacientů s OA korelovaly významně s celkovým počtem kloubů postižených osteoblastickou přestavbou podle pozdní fáze scintigrafie (r = 0,291, p < 0,01) u celé skupiny pacientů s OA rukou, ale ne v jednotlivých podskupinách. Po adjustaci hladin KH k věku a délce trvání nemoci zůstala u všech pacientů tato statistická významnost zachována (r = 0,412, p < 0,01), a objevila se navíc nová závislost mezi uvedenými parametry u pacientů s erozivní formou OA (r = 0,320, p = 0,05). Sérová hladina KH naopak nekorelovala s počtem zánětlivých kloubů podle hodnocení blood pool fáze.
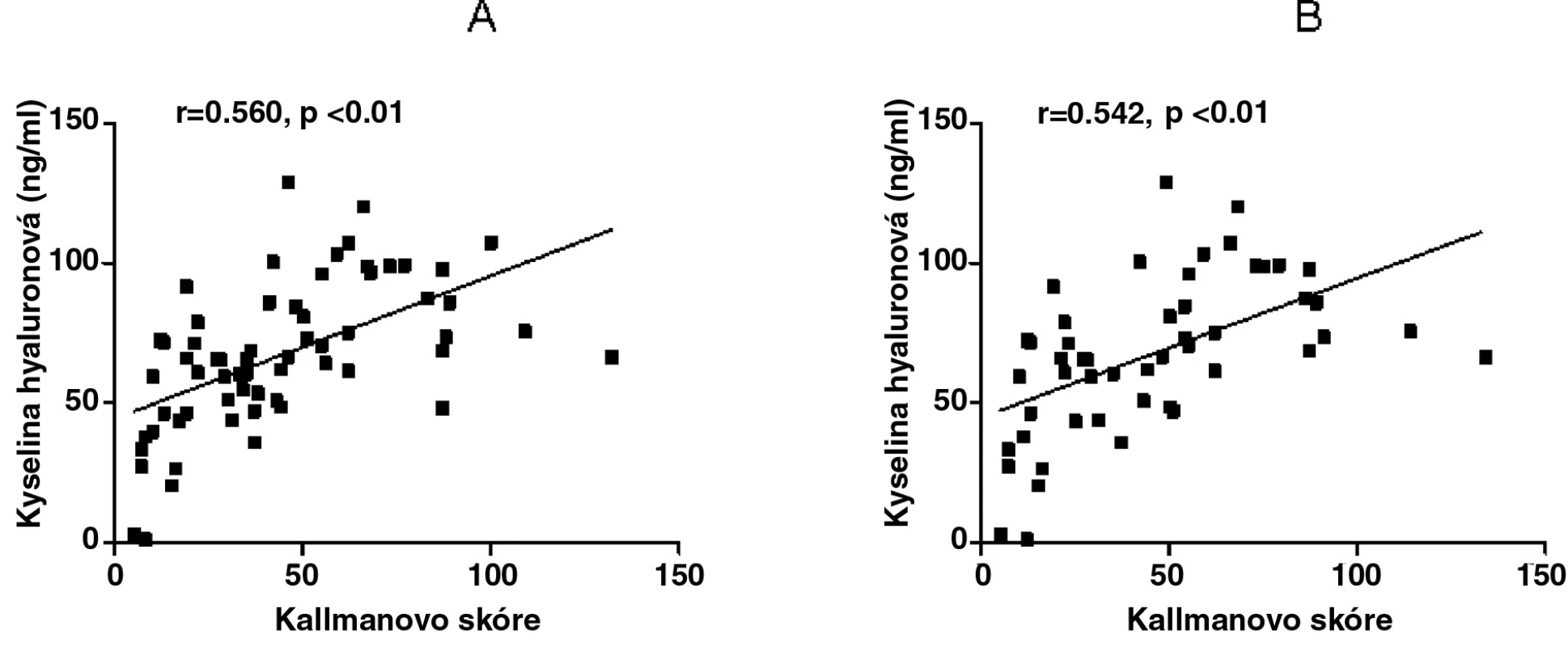
Kyselina hyaluronová měla významný vztah s Kallmanovým skóre v obou podskupinách na začátku studie (r = 0,402, p < 0,05 pro EOA a r = 0,597, p < 0,01 pro neerozivní OA) a po 2 letech (r = 0,391, p < 0,05 pro EOA a r = 0,634, p < 0,01 pro neerozivní OA). Po adjustaci k věku a délce trvání nemoci zůstala tato závislost významná pouze u pacientů s neerozivní OA (r = 0,416, p < 0,05 na začátku studie, r = 505, p < 0,05 po 2 letech), ale již ne u pacientů s erozivní OA (r = 0,287, p > 0,05 na začátku studie, r = 0,334, p > 0,05 po 2 letech). U celé skupiny pacientů s OA rukou byla zjištěna významná korelace mezi sérovou hladinou KH a Kallmanovým skóre na začátku a po 2 letech studie (r = 0,518, p < 0,01; r = 0,519, p < 0,01, obr. 2) a zachovala se i po adjustaci k věku a délce trvání nemoci (r=0,560, p < 0,01 a r = 0,542, p < 0,01, obr. 2).
Je zajímavé, že CRP se mezi pacienty s erozivní a neerozivní formou OA rukou nelišilo a nekorelovalo s počtem scintigraficky pozitivních kloubů a ani s rentgenovým skóre.
Diskuse
V této práci jsme poprvé zjistili vyšší sérové koncentrace kyseliny hyaluronové u pacientů s EOA v porovnání s pacienty s neerozivní formou nemoci. Sérové hladiny kyseliny hyaluronové měly navíc vztah k lokálním strukturálním změnám a k závažnosti rentgenového postižení. Kyselina hyaluronová by tak mohla představovat potenciální prediktivní faktor progrese OA rukou.
Bolest, otok, zarudnutí, proteplení a omezení funkce kloubů rukou jsou nejvíce typickým znakem u pacientů s EOA (24). Výsledek našeho klinického vyšetření potvrzuje závažnější průběh erozivní formy OA drobných kloubů rukou, co podle výsledků obou funkčních dotazníků následně vede i k významnému omezení denních aktivit v souladu s další studií (25).
Několik předchozích studií se zabývalo biochemickými markery u EOA. Punzi et. al. (6) na základě vyšších hladin CRP, klinických a scintigrafických dat u pacientů s EOA ve srovnání s neerozivní OA předpokládal, že by CRP mohlo odrážet klinickou aktivitu nemoci. Další studie však ukázala dokonce nižší koncentrace CRP u erozivní formy (5). V naší práci jsme nepozorovali žádné rozdíly v hodnotách systémových zánětlivých parametrů, i když kostní scintigrafie potvrdila větší počet postižených kloubů u erozivní formy OA. Domníváme se proto, že lokální zánětlivý proces nevede k celkové systémové odpovědi, alespoň ne v našem souboru pacientů.
Ve zdravém kloubu závisí funkční a metabolická aktivita kyseliny hyaluronové na její koncentraci a vysoké molekulární hmotnosti (26). V průběhu zánětu dochází k uvolnění volných kyslíkových radikálů, které následně depolymerizují molekulu KH a vedou tak ke snížení její molekulové hmotnosti (27, 28, 29). Tím dochází ke snížení viskozity synoviální tekutiny a prostupu fragmentů KH a disacharidových monomerů do oběhu (30, 31). Prozánětlivé cytokiny interleukin-1 (IL-1) a tumor nekrotizující faktor-α (TNF-α) rovněž přispívají k produkci KH (32). Malé oligosacharidy KH v kloubu interferují s její vysokomolekulární formou, ovlivňují interakci chondrocyt-extracelulární matrix (33, 34), zvyšují produkci a aktivitu metaloproteináz i oxidu dusnatého v chondrocytech a zánětlivých buňkách (35, 36, 37). Tento proces se podílí na patogenezi OA a může přispívat ke zvýšeným hladinám KH u pacientů s EOA, které tak odrážejí synovitidu a destrukci osteoartrotické chrupavky u EOA. Chen a kol. (38) nedávno demonstroval, že zvýšené hladiny KH u OA mají vztah k přítomnosti OA drobných kloubů rukou v porovnání s pacienty s OA bez postižení rukou. Zatím se jenom velmi málo studií zabývalo biomarkery u OA rukou (39) a naše práce je doposud první, která ukazuje zvýšené hladiny KH u pacientů s erozivní OAve srovnání s pacienty bez erozivní formy OA.
Scintigrafie kostí se zdá být užitečnou metodou v predikci klinické a rentgenové progrese OA kloubů rukou (5). V naší studii korelovaly sérové koncentrace KH s počtem osteoblasticky přestavěných kloubů na scintigrafii a to podporuje náš předpoklad, že KH má skutečně vztah k morfologickým změnám u OA rukou. Lze předpokládat, že věk a délka trvání nemoci mají velký vliv na hladiny KH. Po adjustaci koncentrací KH k uvedeným parametrům byla zjištěna korelace KH s počtem postižených kloubů přestavbovými změnami na scintigrafii ve skupině pacientů s EOA.
Zjistili jsme, že hladiny KH mají vztah k rentgenovým změnám na začátku studie a po 2 letech pozorování. Náš nález je tak ve shodě s předchozími publikacemi, které představují KH jako prediktivní faktor rentgenové progrese OA kolenních a kyčelních kloubů (15, 16, 40, 41). Po zohlednění věku a délky trvání nemoci na hladiny KH je její vztah k rentgenovým změnám stále zachován u všech pacientů s OA rukou, ale nikoliv u pacientů s erozivní formou.Naše studie má určité nedostatky. OA je onemocnění s často generalizovaným postižením a hladiny KH v séru tak mohou být zvýšeny v důsledku postižení dalších kloubů. S cílem zjištění prevalence OA kolenních kloubů, synovitidy či výpotku jsme provedli rentgenové a sonografické vyšetření kolenních kloubů. I když jsou v tomto směru obě studijní skupiny porovnatelné, nelze vyloučit postižení kyčelních kloubů či degenerativní změny páteře, které mohou přispívat ke zvýšeným hladinám KH v krvi. Z etických důvodů jsme však neprovedli rentgenové vyšetření těchto oblastí. Sérová hladina KH byla stanovena pouze na začátku studie. Zároveň se vyšetření po 2 letech zúčastnilo méně pacientů, většinou v důsledku jejich vlastního rozhodnutí. To je pravděpodobně jeden z důvodů, proč některé naše výsledky nedosáhly statistické významnosti. Jsme si vědomi, že naše práce nezahrnuje zdravé kontroly. Věříme však, že je rovněž neetické provádět rentgenové vyšetření několika oblastí u jinak zdravých osob, které mohou být navíc postiženy i subklinickou formou OA.Naše práce je první, ve které byly zjištěny vyšší hladiny KH u pacientů s EOA v porovnání s neerozivní formou onemocnění. Sérová hladina KH měla navíc vztah k lokálním strukturálním změnám a k parametrům rentgenové progrese u pacientů s OA kloubů rukou. Domníváme se proto, že by KH mohla představovat vhodný biomarker morfologických změn OA kloubů rukou a mohla by sloužit jako prediktivní faktor rentgenové progrese onemocnění.
Poděkování: Tato práci vznikla za podpory výzkumných záměrů č. 00023728 Ministerstva zdravotnictví České republiky.
MUDr. M. Filková
Revmatologický ústav
Na Slupi 4
128 50 Praha 2
Sources
1. Zhang W, Doherty M, Leeb BF, Alekseeva L, Arden NK, Bijlsma JW, Dincer F, Dziedzic K, Hauselmann HJ, Kaklamanis P, Kloppenburg M, Lohmander LS, Maheu E, Martin-Mola E, Pavelka K, Punzi L, Reiter S, Smolen J, Verbruggen G, Watt I, Zimmermann-Gorska I; ESCISIT. EULAR evidence-based recommendations for the diagnosis of hand osteoarthritis: report of a task force of ESCISIT. Ann Rheum Dis 2009; 68(1): 8–17.
2. Spector TD, Hart DJ, Nandra D, Doyle DV, Mackillop N, Gallimore JR, Pepys MB. Low-level increases in serum C-reactive protein are present in early osteoarthritis of the knee and predict progressive disease. Arthritis Rheum 1997; 40(4): 723–7.
3. Sowers M, Jannausch M, Stein E, Jamadar D, Hochberg M, Lachance L. C-reactive protein as a biomarker of emergent osteoarthritis. Osteoarthritis Cartilage 2002; 10(8): 595–601.
4. Pearle AD, Scanzello CR, George S, Mandl LA, DiCarlo EF, Peterson M, Sculco TP, Crow MK. Elevated high-sensitivity C-reactive protein levels are associated with local inflammatory findings in patients with osteoarthritis. Osteoarthritis Cartilage 2007; 15 : 516–23.
5. Olejarova M, Kupka K, Pavelka K, Gatterova J, Stolfa J. Comparison of clinical, laboratory, radiographic, and scintigraphic findings in erosive and nonerosive hand osteoarthritis. Results of a two-year study. Joint Bone Spine 2000; 67 : 107–12.
6. Punzi L, Ramonda R, Oliviero F, Sfriso P, Mussap M, Plebani M, Podswiadek M, Todesco S. Value of C reactive protein in the assessment of erosive osteoarthritis of the hand. Ann Rheum Dis 2005; 64(6): 955–7.
7. Cicuttini FM, Baker JR, Spector TD. The association of obesity with osteoarthritis of the hand and knee in women: a twin study. J Rheumatol 1996; 23 : 1221–6.
8. Thonar EJ. Molecular markers of metabolic changes in osteoarthritis. Osteoarthritis Cartilage 1999; 7(3): 338–9.
9. Garnero P, Piperno M, Gineyts E, Christgau S, Delmas PD, Vignon E. Cross sectional evaluation of biochemical markers of bone, cartilage, and synovial tissue metabolism in patients with knee osteoarthritis: relations with disease activity and joint damage. Ann Rheum Dis 2001; 60(6): 619–26.
10. Rousseau JC, Delmas PD. Biological markers in osteoarthritis. Nat Clin Pract Rheumatol 2007; 3(6): 346–56.
11. Uebelhart D, Williams JM. Effects of hyaluronic acid on cartilage degradation. Curr Opin Rheumatol. 1999; 11(5): 427–35.
12. Salisbury C, Sharif M. Relations between synovial fluid and serum concentrations of osteocalcin and other markers of joint tissue turnover in the knee joint compared with peripheral blood. Ann Rheum Dis 1997; 56(9): 558–61.
13. Sharif M, George E, Shepstone L, Knudson W, Thonar EJ, Cushnaghan J, Dieppe P. Serum hyaluronic acid level as a predictor of disease progression in osteoarthritis of the knee. Arthritis Rheum 1995; 38(6): 760–7.
14. Turan Y, Bal S, Gurgan A, Topac H, Koseoglu M. Serum hyaluronan levels in patients with knee osteoarthritis. Clin Rheumatol 2007; 26(8): 1293–8.
15. Pavelka K, Forejtová S, Olejárová M, Gatterová J, Senolt L, Spacek P, Braun M, Hulejová M, Stovícková J, Pavelková A. Hyaluronic acid levels may have predictive value for the progression of knee osteoarthritis. Osteoarthritis Cartilage 2004; 12(4): 277–83.
16. MaziŹres B, Garnero P, Guéguen A, Abbal M, Berdah L, Lequesne M, Nguyen M, Salles JP, Vignon E, Dougados M. Molecular markers of cartilage breakdown and synovitis at baseline as predictors of structural progression of hip osteoarthritis. The ECHODIAH Cohort. Ann Rheum Dis 2006; 65(3): 354–9.
17. Altman R, Alarcón G, Appelrouth D, Bloch D, Borenstein D, Brandt K, Brown C, Cooke TD, Daniel W, Gray R, et al. The American College of Rheumatology criteria for the classification and reporting of osteoarthritis of the hand. Arthritis Rheum 1990; 33 : 1601–10.
18. Filková M, Lisková M, Hulejová H, Haluzík M, Gatterová J, Pavelková A, Pavelka K, Gay S, Müller-Ladner U, Šenolt L. Increased serum adiponectin levels in female patients with erosive compared with non-erosive osteoarthritis, Ann Rheum Dis 2009 : 68 : 295–296.
19. Bellamy N, Campbell J, Haraoui B, Gerecz-Simon E, Buchbinder R, Hobby K, MacDermid JC. Clinimetric properties of the AUSCAN Osteoarthritis Hand Index; an evaluation of reliability, validity and responsiveness. Osteoarthritis Cartilage 2002; 10(11): 863–9.
20. Dreiser RL, Maheu E, Guillou GB, Caspard H, Grouin JM. Validation of an algofunctional index for osteoarthritis of the hand. Rev Rhum Engl Ed 1995; 62(6 Suppl 1): 43S–53S.
21. Kallman DA, Wigley FM, Scott WW Jr, Hochberg MC, Tobin JD. New radiographic grading scales for osteoarthritis of the hand. Reliability for determining prevalence and progression. Arthritis Rheum 1989; 32(12): 1584–91.
22. Pavelka K, Gatterová J, Gollerova V, Urbanová Z, Sedlácková M, Altman RD. A 5-year randomized controlled, double-blind study of glycosaminoglycan polysulphuric acid complex (Rumalon) as a structure modifying therapy in osteoarthritis of the hip and knee. Osteoarthritis Cartilage 2000; 8(5): 335–42.
23. Kellgren JH, Lawrence JS. Radiological assessment of osteo-arthrosis. Ann Rheum Dis 1957; 16(4): 494–502.
24. Punzi L, Ramonda R, Sfriso P. Erosive osteoarthritis. Best Pract Res Clin Rheumatol 2004; 18 : 739–58.
25. Maheu E, Michon M, Carrat F, Berenbaum F. Erosive versus non erosive hand OA: Prospective cross-sectional comparison of clinical data. Ann Rheum Dis 2008; 67 (Suppl II): 94.
26. Balazs EA, Watson D, Duff IF, Roseman S. Hyaluronic acid in synovial fluid. I. Molecular parameters of hyaluronic acid in normal and arthritis human fluids. Arthritis Rheum 1967; 10(4): 357–76.
27. Baker MS, Green SP, Lowther DA. Changes in the viscosity of hyaluronic acid after exposure to a myeloperoxidase-derived oxidant. Arthritis Rheum 1989; 32(4): 461–7.
28. Saari H, Sorsa T, Konttinen YT. Reactive oxygen species and hyaluronate in serum and synovial fluid in arthritis. Int J Tissue React 1990; 12(2): 81–9.
29. Al-Assaf S, Navaratnam S, Parsons BJ, Phillips GO. Chain scission of hyaluronan by peroxynitrite. Arch Biochem Biophys 2003; 411(1): 73–82.
30. Belcher C, Yaqub R, Fawthrop F, Bayliss M, Doherty M. Synovial fluid chondroitin and keratan sulphate epitopes, glycosaminoglycans, and hyaluronan in arthritic and normal knees. Ann Rheum Dis 1997; 56(5): 299–307.
31. Dahl LB, Dahl IM, Engström-Laurent A, Granath K. Concentration and molecular weight of sodium hyaluronate in synovial fluid from patients with rheumatoid arthritis and other arthropathies. Ann Rheum Dis 1985; 44(12): 817–22.
32. Nishida Y, D’Souza AL, Thonar EJ, Knudson W. Stimulation of hyaluronan metabolism by interleukin-1alpha in human articular cartilage. Arthritis Rheum 2000; 43(6): 1315–26.
33. Maleski MP, Knudson CB. Matrix accumulation and retention in embryonic cartilage and in vitro chondrogenesis. Connect Tissue Res 1996; 34(1): 75–86.
34. Ohno S, Im HJ, Knudson CB, Knudson W. Hyaluronan oligosaccharide-induced activation of transcription factors in bovine articular chondrocytes. Arthritis Rheum 2005; 52(3): 800–9.
35. Iacob S, Knudson CB. Hyaluronan fragments activate nitric oxide synthase and the production of nitric oxide by articular chondrocytes. Int J Biochem Cell Biol 2006; 38(1): 123–33.
36. Knudson W, Casey B, Nishida Y, Eger W, Kuettner KE, Knudson CB.Hyaluronan oligosaccharides perturb cartilage matrix homeostasis and induce chondrolysis. Arthritis Rheum 2000; 43(5): 1165–74.
37. Noble PW, McKee CM, Cowman M, Shin HS. Hyaluronan fragments activate an NF-kappa B/I-kappa B alpha autoregulatory loop in murine macrophages. J Exp Med 1996; 183(5): 2373–8.
38. Chen HC, Shah S, Stabler TV, Li YJ, Kraus VB. Biomarkers associated with clinical phenotypes of hand osteoarthritis in a large multigenerational family: the CARRIAGE family study. Osteoarthritis Cartilage 2008; 16(9): 1054–9.
39. Silvestri T, Pulsatelli L, Dolzani P, Punzi L, Meliconi R. Analysis of cartilage biomarkers in erosive and non-erosive osteoarthritis of the hands. Osteoarthritis Cartilage 2004; 12(10): 843–5.
40. Bruyere O, Collette JH, Ethgen O, Rovati LC, Giacovelli G, Henrotin YE, Seidel L, Reginster JY. Biochemical markers of bone and cartilage remodeling in prediction of longterm progression of knee osteoarthritis. J Rheumatol 2003; 30(5): 1043–50.
41. Bruyere O, Collette J, Kothari M, Zaim S, White D, Genant H, Peterfy C, Burlet N, Ethgen D, Montague T, Dabrowski C, Reginster JY. Osteoarthritis, magnetic resonance imaging, and biochemical markers: a one year prospective study. Ann Rheum Dis 2006; 65(8):
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology Surgery Orthopaedics General practitioner for adultsArticle was published in
Czech Rheumatology

2009 Issue 4
- Advances in the Treatment of Myasthenia Gravis on the Horizon
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Memantine Eases Daily Life for Patients and Caregivers
-
All articles in this issue
- Serum level of hyaluronic acid – a marker with a predictive value for radiographic progression of hand osteoarthritis
- Leflunomide in the current treatment algorithm for rheumatoid arthritis
- Anti-PM-Scl antibodies in myositis
- Heat shock proteins – an important component of immune response
- Massive gastrointestinal bleeding in a female patient with Wegener‘s granulomatosis – case report
- Czech Rheumatology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Anti-PM-Scl antibodies in myositis
- Heat shock proteins – an important component of immune response
- Leflunomide in the current treatment algorithm for rheumatoid arthritis
- Serum level of hyaluronic acid – a marker with a predictive value for radiographic progression of hand osteoarthritis
