Buschke-Löwensteinov tumor u imunodeficientného pacienta – popis prípadu a prehľad terapeutických možností
Buschke-Löwenstein Tumor in an Immunodeficient Patient – a Case Report and Review of Treatment Possibilities
Buschke-Löwenstein tumor, condyloma acuminata gigantea, is a very rare STI caused by HPV viruses (Human Papilloma Virus), mainly low-risk HPV 6 and 11. Tumor is characterized by a huge slowly growing cauliflower mass in anogenital region with invasive and destructive potential. Recurrence after treatment is very common. Primary or secondary immunodeficiency is the risk factor of Buschke-Löwenstein tumor development. The diagnosis is based on a typical clinical picture of a huge tumor mass with bleeding, effusion or fistulas. The histological evaluation reveals no typical signs of malignancy. The treatment guidelines do not exist, the local cytodestructive and immunomodulatory treatment is not efficient. The surgical intervention is preferred in cases with well developed features of the disease. Combination therapy might be also effective. Authors report a case of 44-year-old man with secondary immunodeficiency due to chronic inflammatory condition, namely bone tuberculosis, and chronic alcoholism. The patient suffered from giant genital warts in scrotal and perianal area. Histopathological examination revealed no signs of malignancy. Genetic-molecular methods (RT-PCR; Real Time Polymerase Chain Reaction) confirmed low risk HPV 6. The patient was successfully treated with surgery and subsequently with topical 5% imiqumod and metizoprinol systematically for several months. One-year follow-up was without recurrence.
Key words:
Buschke-Löwenstein tumor – condylomata acuminata gigantea – low-risk HPV 6, 11 – immunodeficiency – therapy of Buschke-Löwenstein tumor
Authors:
M. Králová; D. Švecová
Authors‘ workplace:
Dermatovenerologická klinika LF UK a UN Bratislava-Staré Mesto, prednostka prof. MUDr. Mária Šimaljaková, PhD.
Published in:
Čes-slov Derm, 89, 2014, No. 6, p. 270-274
Category:
Case interpretation
Overview
Buschke-Löwensteinov tumor označovaný aj condylomata acuminata gigantea patrí medzi veľmi zriedkavé STI spôsobené HPV vírusmi (Human Papilloma Virus), najmä nízko rizikovými typmi HPV 6 a 11. Tumor je charakteristický rozsiahlou pomaly rastúcou karfiolovitou masou v anogenitálnej oblasti. Vyznačuje sa lokálne agresívnym, deštruktívnym potenciálom a častou recidívou po liečbe. Jedinci trpiaci na primárny alebo sekundárny imunodeficit sú rizikovou skupinou pre rozvoj Buschke-Löwensteinovho tumoru. Diagnostika Buschke-Löwensteinovho tumoru sa opiera o typický klinický obraz rozsiahlej tumoróznej masy s krvácaním, secernáciou či fistuláciou. Histologická definícia ochorenia je bez jednoznačných čŕt malignity. Štandardné liečebné postupy tohto ochorenia neexistujú; lokálna cytodeštrukčná a imunomodulačná liečba nie je dostatočne účinná. Pri plne rozvinutom klinickom obraze Buschke-Löwensteinovho tumoru sa všeobecne preferuje chirurgická intervencia. Možné je použiť aj kombináciu viacerých terapeutických metód. Autori uvádzajú prípad 44-ročného muža so sekundárnym imunodeficitom na podklade chronického zápalového procesu (tuberkulóza kostí) a chronického alkoholizmu. Pacient trpel condylomata acuminata gigantea v skrotálnej a perianálnej oblasti. Histologicky bol nález z lézie bez známok malignity, geneticko-molekulárnymi metódami (RT-PCR; Polymerase Chain Reaction) bol izolovaný nízko rizikový HPV 6. Pacient sa podrobil chirurgickému zákroku s následnou lokálnou liečbou 5 % imiquimodom a metizoprinolom p. o. po dobu niekoľkých mesiacov. Pacient je počas ročného sledovania bez recidívy ochorenia.
Kľúčové slová:
Buschke-Löwensteinov tumor – condylomata acuminata gigantea – nízko rizikový HPV 6, 11 – imunodeficiencia – terapia Buschke-Löwensteinovho tumoru
ÚVOD
Buschke-Löwensteinov tumor bol prvýkrát popísaný v roku 1925 nemeckými dermatológmi Abrahamom Buschkem a Ludwigom Löwensteinovom. Autori popísali lézie na penise, ktoré niesli spoločné znaky condyloma acuminatum a spinocelulárneho karcinómu [11]. Historické štúdie realizované neskôr však nasvedčujú, že už v roku 1614 chirurg Wilhelm Fabry opísal prvý klinický prípad tohto ochorenia [6]. Buschke-Löwensteinov tumor je raritné ochorenie s incidenciou v populácii 0,1 % [8]. Častejšie bývajú postihnutí muži ako ženy, a to v pomere 3,5 : 1 [11]. Priemerný vek pacientov s Buschke-Löwensteinovým tumorom je 40–60 rokov [4]. Za vznik tohto tumoru sú zodpovedné najmä HPV 6 a 11, známe ako vírusy s nízkym onkogénnym rizikom. Najčastejšie postihnutou lokalitou je penis (5–24 %), anorektálna oblasť, vulva a cervix. Výskyt v skrotálnej oblasti je zriedkavý [11]. Na to, aby HPV mohli spôsobiť Buschke-Löwensteinov tumor sú potrebné kooperujúce faktory na strane hostiteľa. Predisponujúcimi faktoromi pre vznik Buschke-Löwensteinovho tumoru sú imunodeficiencia pacienta, chronické infekcie anogenitálnej oblasti, alkoholizmus, promiskuita, homosexualita a zlý hygienický štandard [12]. Napriek klinicky malígnemu obrazu, histologický obraz je zvyčajne bez známok typických pre malígne procesy. Pre nízky počet prípadov tohto ochorenia neexistujú štandardné liečebné postupy. Údaje o rôznych liečebných metódach sú dostupné len v rámci malého počtu izolovaných kazuistík.
POPIS PRÍPADU
Prezentujeme prípad 44-ročného heterosexuálne orientovaného muža s 3-mesačnou anamnézou početných rastúcich secernujúcich karfiolovitých lézií lokalizovaných v skrotálnej (obr. 1) a v perianálnej oblasti (obr. 2).
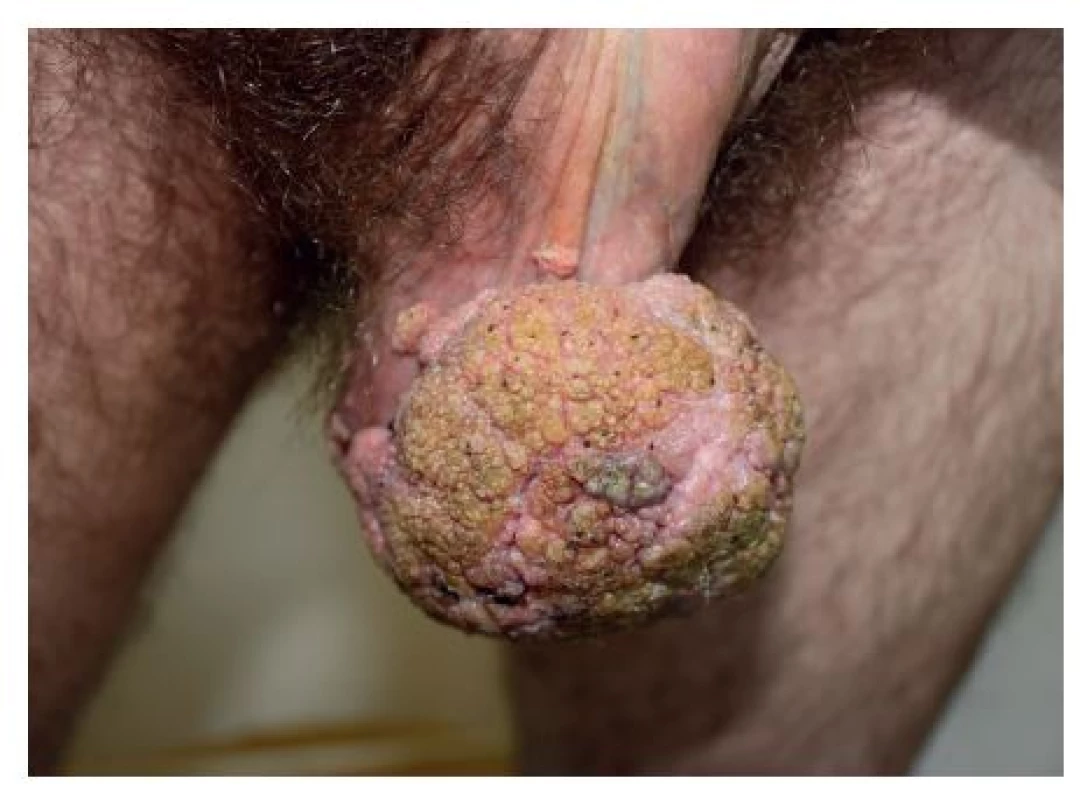
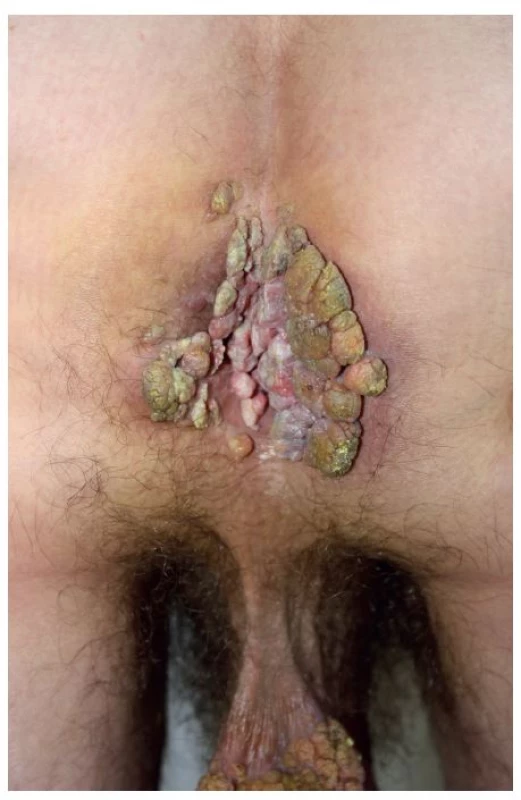
Pacient bol casus socialis, alkoholik. Pred 2 rokmi prekonal tuberkulózu kostí s kompresívnou fraktúrou stavcov chrbtice. V ebriete utrpel opakované úrazy hlavy, na CT prítomná atrofia mozgu. V epidemiologickej anamnéze uviedol viaceré, aj náhodné nechránené sexuálne vaginálne kontakty. U partneriek podobné prejavy nepozoroval. Sexuálny pomer s mužmi negoval. Doposiaľ absolvovaná lokálna terapia tekutým dusíkom a 5 % imiquimodom v kréme bola s minimálnym účinkom a pre nedostatočnú spoluprácu pacienta boli obidve liečebné metódy aplikované len krátku dobu. Pre slabé sociálne správanie bol pacient posledných 2,5 mesiaca bez liečby. Pacient subjektívne pociťoval bolestivosť v mieste lézií. Kvôli rozsiahlej tumoróznej mase na skróte mal ťažkosti pri chôdzi, čo ho priviedlo znovu k dermatológovi. Pri vyšetrení boli v uvedených lokalitách prítomné početné, na povrchu drsné karfiolovité útvary papilomatózneho vzhľadu na pohmat mäkkej konzistencie, s výraznou fragilitou lézií v perianálnej lokalizácii. Farba lézií kolísala od ružovej, hnedej až po zeleno sfarbené patologické prejavy s výrazným odórom a secernáciou spolu so spontánnym krvácaním, ktoré sa zvýrazňovalo pri palpácii. Na oboch rukách mal početné vulgárne bradavice veľkosti od 3 do 5 mm.
V krvnom obraze boli prítomné známky sideropenickej anémie (erytrocyty: 3,17 x 1012/l, hemoglobín: 93,2 g/l), CRP mierne zvýšené (37,5 mg/l), znížený obsah železa (2,32 μg/mmol). Ostatné biochemické parametre boli v norme. Elektroforéza bielkovín poukázala na chronický zápal a poškodenie pečene. Sérologické vyšetrenie na syfilis, hepatitídu B, hepatitídu C a HIV boli opakovane negatívne. Metódou prietokovej cytometrie boli stanovené hladiny jednotlivých tried T-lymfocytov svedčiace pre sekundárny imunodeficit: CD4 T-lymfocyty: 33,38 % (znížené), CD19 B-lymfocyty: 4,49 % (znížené), CD8 cytotoxické T-lymfocyty: 30,77 % (znížené), NK bunky: 26,06 % (zvýšené).
Na USG abdomenu zobrazené známky hepatopatie – steatózy mierneho stupňa a kalcifikát pečene veľkosti 5 mm. RTG vyšetrenie hrudníka v norme. Urologické vyšetrenie potvrdilo diagnózu condylomata acuminata gigantea a nezistilo žiaden iný patologický nález na genitáliách a vnútorných pohlavných orgánoch. Bakteriálna kultivácia zo secernujúcich páchnucich más potvrdila Pseudomonas aeruginosa a Beta-hemolytický Streptoccocus typu G. Pacient bol predoperačne preliečený antibiotikami podľa citlivosti: Gentamicín 80 g á 8 hod i. v. po dobu 5 dní a Penicilin G draselná soľ 20 mil.j. i.v. denne po dobu 14 dní. Po parenterálnom preliečení antibiotikami potvrdila bakteriálna kultivácia len nepatogénnu bakteriálnu flóru. Pacientovi bola v spinálnej anestéze realizovaná resekcia prejavov v skrotálnej a v perianálnej oblasti s dobrou pooperačnou adaptáciou.
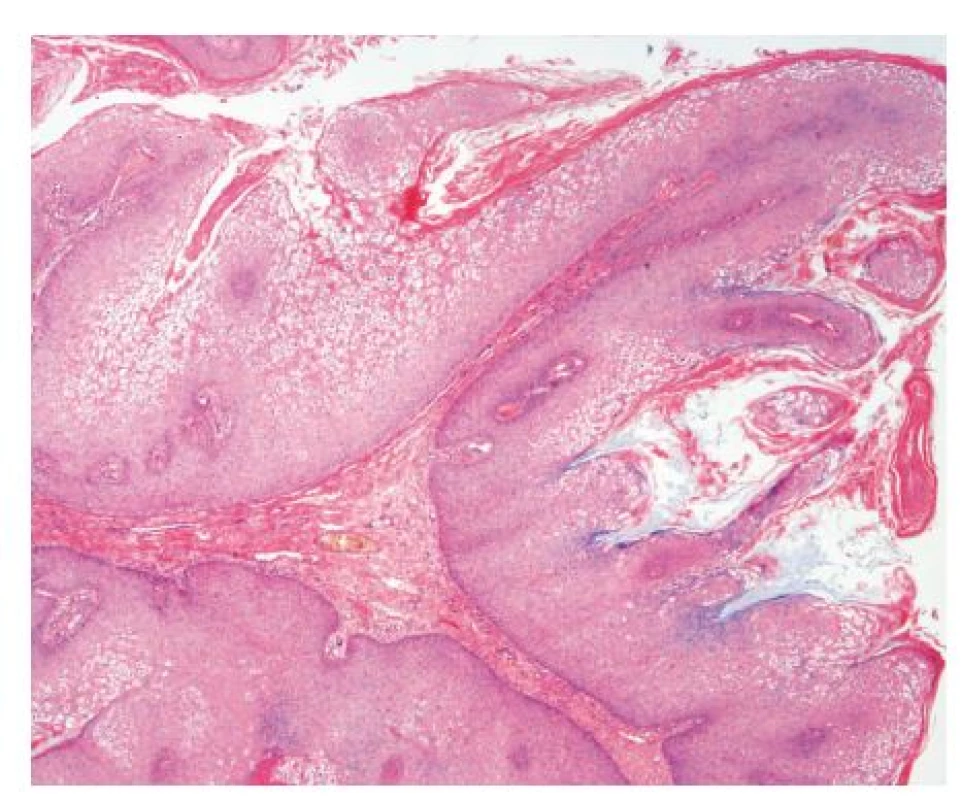
Histologický nález z viacerých vzoriek tkaniva potvrdil diagnózu condylomata acuminata. V histopatologickom obraze farbeným hematoxylín eozínom boli zachytené epitelové útvary s papilárnou stavbou, kryté hyperplastickým dlaždicovým epitelom s kompaktnou hyperkeratózou. Ložiskovo boli vizualizované početné epitelové bunky vzhľadu koilocytov. Mitotická aktivita vo vzorke bola zvýšená. V podkožnom tkanive, ktoré vybieha do vysokých papíl, bol zmiešaný lymfocytový a plazmocytový infiltrát. Cytologicky je proces benígnej povahy (obr. 3). Metódou RT-PCR (Real Time Polymerase Chain Reaction) bol zo vzorky tkaniva izolovaný nízko rizikový genotyp HPV 6. Rovnaký genotyp HPV bol potvrdený aj zo vzoriek vulgárnych verúk na rukách pacienta.
Po dvoch mesiacoch od chirurgického zákroku bola zaznamenaná recidíva prejavov v perianálnej oblasti. Lokálna terapia 5% imiquimodom v kréme a tekutým dusíkom bola pre zlú compliance pacienta bez žiaduceho účinku. Rektoskopia potvrdila prerastanie drobných kondylómov do rektálneho kanála. Pacient sa podrobil ďalšiemu chirurgickému zákroku s následnou liečbou 5% imiquimodom v kréme aplikovaného po dobu jedného mesiaca. Funkcia análneho sfinktera nebola počas operácie narušená. V tomto období užíval imunostimulačnú liečbu: 500 mg tbl. – 3 x 2 tbl. denne (spolu po dobu 5 mesiacov). Počas liečby došlo k vzostupu lymfocytov: CD8 cytotoxických T-lymfocytov na normálnu hodnotu (z iniciálnych 30,77 % na 34, 35 %). Počet NK buniek bol po liečbe zvýšený oproti norme (z iniciálnej hodnoty 26,06 % na 27,49 % po liečbe). Po 5 mesiacoch bola liečba metizoprinolom ukončená pre nežiaduce účinky, ktoré po vysadení vymizli (nechutenstvo, nausea, vomitus). Počas ročného sledovania bol pacient bez recidívy ochorenia. Predpokladáme, že u imunodeficitného pacienta došlo k autoinfekcii z primárneho ložiska na rukách, nakoľko z oboch lokalít bol dokázaný rovnaký genotyp HPV 6. Sekundárna imunodeficiencia a chronický návykový syndróm alkoholizmu, ako aj casus socialis a s ním spojený nízky hygienický štandard prispeli k rozvoju ochorenia. Napriek tomu pacient spolupracoval a jeden rok po úspešnej liečbe bol bez klinických prejavov HVP infekcie. Ďalší osud pacienta nie je známy.
DISKUSIA
Buschke-Löwensteinov tumor označovaný aj ako condylomata acuminata gigantea sa považuje za ochorenie so semimalígnym deštrukčným potenciálom lokalizované v oblasti genitálu a perianálnej oblasti [2]. Vývoju Buschke-Löwensteinovho tumoru vždy predchádzajú klasické condylomata acuminata. Hicheri et al. (2006) považujú condylomata acuminata za prekancerózne lézie [4]. Dôležitým faktorom v patogenéze tohto ochorenia je kongenitálny alebo získaný defekt imunity, nevynímajúc infekciu HIV (Human Immunodeficiency Virus), diabetes mellitus, nádorové ochorenia. Buschke-Löwensteinov tumor sa môže vyskytnúť aj u pacientov na imunosupresívnej terapii [4]. Najčastejšími klinickými príznakmi súvisiacimi s Buschke-Löwensteinovým tumorom svedčiacich pre možnú transformáciu do karcinómu sú obrovská tumorózna masa v anogenitálnej oblasti, krvácanie, bolestivosť, fistulácia, absces, lymfadenopatia.
V patogenéze Buschke-Löwensteinovho tumoru sa za etiologický agens ochorenia považujú HPV 6 a 11. Patria medzi HPV s nízkym onkogénnym rizikom. Genotypy HPV 6 a 11 sú izolované aj z condylomata acuminata a verrucae vulgares. V nádorových léziách typicky nachádzame genotypy HPV s vysokým onkogénnym rizikom, ako napr. 16 a 18. Doposiaľ nie sú úplne známe príčiny exapanzívneho potenciálu HPV 6 a 11 u imunosuprimovaných jedincov, ktoré umožnia progresiu condylomata acuminata do gigantického fenotypu [2]. Podľa práce Farr et al. (1991) sa možno domnievať, že v genotype HPV 6 existuje pomerne veľká génová variabilita, preto aj HPV s nízkym onkogénnym rizikom môže nadobudnúť invazívne malígne vlastnosti a narušiť bunkové mechanizmy [1]. Presný mechanizmus však nie je jasný. Podiel nízko onkogénnych HPV v karcinogenéze anogenitálnych malignít je menej ako 2 % [3]. Karcinómy spôsobené HPV 6 alebo HPV 11 sú histopatologicky verukopapilárneho charakteru, dobre diferencované spinocelulárne alebo histologicky prechodné lézie [3]. Súčasťou HPV sú gény E6 a E7, ktoré sú schopné indukovať degradáciu p53, tumorového supresorového proteínu, ktorý sa považuje za strážcu genómu. V dôsledku narušenia kontrolných mechanizmov infikovaná bunka nie je schopná ukončiť bunkový cyklus alebo indukovať apoptózu, čo má za následok nekontrolovateľné množenie buniek [11].
Buschke-Löwensteinov tumor je unikátny tým, že jeho biologicky potenciál a histologický nález nie sú totožné. Vo všeobecnosti je Buschke-Löwensteinov tumor považovaný za variantu verukózneho karcinómu, ktorá sa odlišuje od skupiny premalígnych nozologických jednotiek pomalým vývojom a agresívnym správaním s potenciálom malígnej transformácie do spinocelulárneho karcinómu [11]. Histopatologické znaky Buschke-Löwensteinovho tumoru však nie sú dodnes jednoznačne definované. Existujú dva názory na histopatologické črty tohto tumoru [8]. Podľa niektorých autorov možno za Buschke-Löwensteinov tumor považovať výlučne nález so znakmi typickými pre verukózny spinocelulárny karcinóm [8,11]. Podľa iných autorov, možno za Buschke-Löwensteinov tumor považovať aj histologicky benígne lézie [9, 12]. Podľa Tas S. et al. (2012) stojí Buschke-Löwensteinov tumor histopatologicky na rozmedzí condyloma acuminatum a perianálnym spinocelulárnym karcinómom [12]. Napriek agresívnemu deštrukčnému potenciálu, tumor nemetastázuje a lymfatické uzliny bývajú postihnuté iba zriedka [8]. Transformácia do spinocelulárneho karcinómu býva u 40–60 % postihnutých, prejaví sa zvyčajne do 5 rokov [9]. Podľa najväčšieho súboru doposiaľ analyzovaných kazuistík s Buschke-Löwensteinovým tumorom v počte 42, sa priemerný čas transformácie do malignity pohybuje od 2,8 do 9,6 rokov [5]. Mortalita je okolo 20 % [5]. Polovica všetkých prípadov prejde do invazívneho karcinómu, 8 % do karcinómu in situ a 42 % prípadov je bez známok invázie [14]. Kvôli extrémnej zriedkavosti tejto infekcie neexistujú štúdie, ktorý by slúžili ako podklad k vypracovaniu liečebných schém tejto diagnózy. Najefektívnejšou terapiou sa podľa jednotlivých kazuistík javí široká chirurgická excízia s histologickou kontrolou okrajov. Podľa Tas S. et al. (2012) by mala byť chirurgická excízia preferovaná už v skorých štádiách condyloma acuminatum, ak javí známky expanzívneho rastu. Za vhodný chirurgický zákrok s minimálnou stratou tkaniva sa považuje Mohsov chirurgický zákrok. Jeho výhodou je zachovanie nepostihnutého tkaniva a peroperačné postupné hodnotenie okrajov s vysokou mierou úspešnosti. Tento typ zákroku sa využíva v miestach, kde je málo podkožného tkaniva (tvár, genitál) s minimálnym rizikom mutilujúcich a rozsiahlých zákrokov. Disekcia lymfatických uzlín je indikovaná iba v prípadoch malígnej transformácie [4]. Radikálna panvová chirurgia sa preferuje iba u pacientov so známkami viscerálnej invázie [8].
Lokálna alebo systémová chemoterapia a rádioterapia by mali byť aplikované iba pacientom, u ktorých je chirurgický zákrok kontraindikovaný [12]. Chemoterapiu v podobe kombinácie 5-florouracilu a cisplatiny a rádioterapiu je možné použiť najmä na iniciálne zmenšenie tumoróznej masy [2] alebo ako pooperačnú adjuvantnú terapiu [8]. Rádioterapia sa používa iba zriedka. Neexistuje konsenzus, či má byť Buschke-Löwensteinov tumor predoperačne alebo pooperačne liečený cytostatikami a rádioterapiou. Niektorí autori sa domnievajú [2, 4, 11, 12], že lokálne aplikovaný imiquimod, laserovú vaporizáciu alebo systémovú terapiu interferónom je vhodné použiť až keď chirurgická liečba zlyhá a dôjde k recidíve prejavov choroby. Kryoterapia tekutým dusíkom a podofylotoxínom je pri tomto ochorení neúčinná [8]. Niektorí autori sa domnievajú, že u imunosuprimovaného pacienta by sa mali aj klasické condylomata acuminata chirurgicky riešiť, ako prevencia pred vznikom condylomata acuminata gigantea [8]. Terapia interferónom alfa alebo gamma (intramuskulárne, intralezionálne, lokálne) využíva imunomodulačný, antiproliferatívny a antivírusový efekt na infikované bunky vírusom HPV. Tento spôsob terapie má však limitovaný účinok, nevýhodou je vysoká cena a častá recidíva ochorenia po ukončení liečby [2, 11].
Kombinovaná liečba interferónom gamma so systémovými retinoidmi predstavuje ďalší spôsob liečby s dokumentovaným dobrým účinkom [13]. Autori okolo Mavrogianniho (2012) liečili pacienta s Buschke-Löwensteinovým tumorom kombináciou rádiofrekvenčnej excízie so súčasným podávaním acitretínu pre psoriatickú erytrodermiu pacienta s dobrým účinkom. Recidíva Buschke - -Löwensteinovho tumoru nebola zaznamenaná po dobu 23 mesiacov [7]. Doposiaľ neexistuje literárny údaj o spontánnej regresii tohto ochorenia, aj napriek imunostimulačnej liečbe. Napriek úspešnej terapii je riziko rekurencie s potenciálnou malígnou transformáciou veľmi vysoké. Toto riziko zvyšuje pokračujúca imunosupresia a chronický alkoholizmus [11].
ZÁVER
Touto kazuistikou dokumentujeme raritný prípad Buschke-Löwensteinovho tumoru. Klinický obraz diagnózy je pri tejto infekcii kľúčový a veľmi typický. Histologický nález najčastejšie nevykazuje cytologické kritéria malignity. Jedinci so známkami imunodeficiencie sú rizikovou skupinou pre vývoj Buschke-Löwensteinovho tumoru. Ochorenie zvyčajne začína ako condylomata acuminata a až neskôr sa mení na klinický obraz Buschke - -Löwensteinovho tumoru. Terapeutický prístup ku pacientom s touto diagnózou je náročný a odlišuje sa od liečby klasických condylomata acuminata. Za účinnú terapiu sa považuje hlboká a široká resekcia postihnutej oblasti so súčasnou dlhodobou imunostimulačnou liečbou. Môžu sa použiť aj kombinované liečebné schémy, napr. retinoidy a interferón gamma, chirugická ablácia a následná imunomodulačná liečba alebo kryoterapia. Až u 40–60 % pacientov s týmto zriedkavým ochorením môže v priebehu rokov dôjsť k malígnej transformácii, preto sa odporúča niekoľkoročná dispenzarizácia pacientov s využitím rádiologických a endoskopických metód za účelom vylúčenia prípadnej viscerálnej invázie s cieľom zabrániť fatálnemu priebehu ochorenia.
Do redakce došlo dne 25. 4. 2014.
Adresa pro korespondenci:
MUDr. Martina Kráľová
Dermatovenerologická klinika LF UK a UN Bratislava – Staré Mesto
Mickiewiczova 13
813 69 Bratislava
Slovenská republika
e-mail: martina.kralova@gmail.com
Sources
1. GEUSAU, A., HEINZ-PEER, G. et al. Regression of deeply infiltrating giant condyloma (Buschke-Löwenstein tumor) following long-term intralesional interferon alfa therapy. JAMA, 2000, Vol. 136, p. 707–710.
2. GUIMERň, N., LLOVERAS, B., LINDEMAN, J. et al. The occasional role of low-risk human papillomaviruses 6, 11, 42, 44, and 70 in anogenital carcinoma defined by laser capture microdissection/PCR methodology: results from a global study. Am. J. Surg. Pathol., 2013, 37, 9, p. 1299–1310.
3. HICHERI, J., JABER, K., DHAOUI, S. et al. Giant condyloma (Buschke-Löwenstein tumor). A case report. Acta Dermatoven. APA, 2006, Vol. 15, No 4, p. 181–183.
4. CHU, Q.D., VEZERIDIS, M. P., LIBBEY, N.P. et al. Giant condylama acuminatum (Buschke-Löwenstein tumor) of the anorectal and perianal regions. Analysis of 42 cases. Dis. Colon Rectum, 1994, 37, 9, p. 950–957.
5. MARX, F.J. et al. Wilhelm Fabry’s 1614 report on a giant condyloma of the penis. Br. J. Dermatol., 2012, 166, 2, p. 247–251.
6. MAVROGIANNI, P., FALLIDAS, E. et al. Therapeutic combination of rediofrequency surgical dissection and oral acitretin in the management Buschke-Löwenstein tumor: a case report. Int. J. STD AIDS, 2012, 23, 5, p. 362–364.
7. PAPIU, H. S., DUMNICI, T. et al. Perianal giant condyloma acuminatum (Buschke-Löwenstein tumor). Case report and review of the literature. Chirurgia, 2011, Vol.106, No. 4, p. 535–539.
8. PATTI, R., AIELLO, P. et al. Giant condylma acuminatum quickly growing: case report. G. Chir., 2012, 33, 10, p. 327–330.
9. SALAVEC, M., BOŠTÍKOVÁ, V., BOŠTÍK, P. HIV infekce – historie, patogeneze, klinické manifestace. Čes-slov Derm, 2011, Vol. 86, No. 2, p. 67–81.
10. TAMPA, M., MALIN-BANEA M. A., SARBU, M. I. et al. A case of giant rapid evolving Buschke-Löwenstein tumor in an immunocompetent patient. J. Infect. Dis., 2013, Vol. XVI, No. 2, p. 83–87.
10. TAS, S., KASIM ARIK, M., OZKUL, F. et al. Perianal giant condyloma acuminatum – Buschke-Löwenstein tumor. A case report. Case Rep. Surg., 2012, doi: 10.1155/2012/ 507374.
11. TIAN, Y. P., YAO, L., MALLA, P., SONG, Y., L. I., S. S. Successful treatment of giant condyloma acuminatum with combination retinoid and interferon-γ therapy. Int. J. STD AIDS, 2012, 23, 6, p. 445–447.
12. TROMBETTA, L. J., PLACE, R. J. Giant condyloma acuminatum of the anorectum. Trends in epidemiology and management: report of a case and review of the literature. Dis. Colon. Rectum, 2002, 44, 12, p. 1878–1886.
Labels
Dermatology & STDs Paediatric dermatology & STDsArticle was published in
Czech-Slovak Dermatology

2014 Issue 6
Most read in this issue
- Fytofotodermatitidy
- Hepatitida jako vzácný projev sekundární syfilis – popis případu
- Dermatologický index kvality života rodiny – validace české verze dotazníku
- Buschke-Löwensteinov tumor u imunodeficientného pacienta – popis prípadu a prehľad terapeutických možností
