Mnohopočetné verrucae vulgares spôsobené vysoko onkogénnym HPV 16 u imunodeficitného pacienta s HIV infekciou
Multiple Vulgar Warts Caused by a High-Risk HPV 16 in an HIV Positive Immunodeficient Patient
HPV infections (Human Papilloma Virus) are the most common infections of the skin and mucous membranes. Some of them can be classified as sexually transmitted infections with the highest incidence in the younger sexually active population. Fully functional immune system is able to deal with the high-risk virus infection in some cases. In immunodeficient individuals HPV infection can present with different clinical picture and torpid course. The authors present a case of 48-year-old HIV-positive patient with numerous papular lesions on his face. Histopathologic examination confirmed the diagnosis of vulgar warts. Molecular genetic method (PCR) demonstrated the presence of highly oncogenic HPV 16, which is not considered as an etiological agent in verrucae vulgares. HPV 16 may lead to dysplastic changes localized on the cervix, vagina, vulva, penis, anus and oropharynx. Due to HIV infection, the patient was treated with triple combination of antivirals (lamivudine, etravirine, darunavir), with 30/µl of CD4 T lymphocyte count initially. Antiretroviral treatment was given continuously during topical treatment of HPV infection. Topical application of imiquimod was effective in eradicating of all skin lesions within 1 month of therapy. After one-year follow up, the patient was without any cutaneous manifestations of HPV infection.
Keywords:
vulgar warts – HPV infection – HIV - immunodeficiency – imiquimod
Authors:
M. Part; D. Švecová
Authors‘ workplace:
Dermatovenerologická klinika LF UK a UNB Bratislava-Staré Mesto, prednosta prof. MUDr. Mária Šimaljaková, PhD.
Published in:
Čes-slov Derm, 90, 2015, No. 1, p. 20-24
Category:
Case interpretation
Overview
Infekcie vírusom HPV (Human Papilloma Virus) patria medzi najčastejšie infekcie kože a slizníc. Niektoré z nich možno zaradiť medzi pohlavne prenosné infekcie, s najvyšším výskytom vo vekovo mladšej sexuálne aktívnej populácii. Plne funkčný imunitný systém sa dokáže v niektorých prípadoch aj bez terapeutickej intervencie vysporiadať aj s vysoko rizikovými typmi vírusu. U imunodeficientných jedincov môže mať však infekcia HPV odlišný klinický obraz a torpídny priebeh. Autori prezentujú prípad 48-ročného HIV pozitívneho pacienta s početnými bradavicovitými útvarmi na tvári. Histopatologický obraz lézií potvrdil diagnózu verrucae vulgares. Molekulárno-genetickými metódami (PCR) bola dokázaná prítomnosť vysoko onkogénneho HPV 16, ktorý sa nepovažuje za vyvolávateľa verrucae vulgares, ale býva vyvolávateľom dysplastických zmien lokalizovaných na cervixe, vagíne, vulve, penise, anuse a oropharynxe. Pre HIV infekciu je pacient liečený trojkombináciou virostatík (lamivudin, etravirin, darunavir) s iniciálnou hodnotou CD4 T lymfocytov 30/µl. Antivirotická liečba nebola počas lokálnej liečby HPV infekcie prerušená. Aplikácia lokálneho imunomodulansu 5 % imiquimodu účinne eradikovala kožné lézie počas 1-mesačnej liečby. Počas 1 roka od skončenia liečby bol pacient bez kožných prejavov HPV infekcie.
Kľúčové slová:
verrucae vulgares - HPV infekcia – HIV – imunodeficiencia - imiquimod
ÚVOD
Infekcie HPV patria medzi najrozšírenejšie ochorenia kože a slizníc s celosvetovým výskytom [3], nevynímajúc vyspelé krajiny. HPV spôsobujú široké spektrum ochorení, od benígnych papilomatóznych útvarov (HPV 1, 2, 4, 6, 11, 42, 43, 44 atď.) až po malígne novotvary (HPV 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 66 atď). Vysoko rizikové vírusy HPV 16, 18, 32, 59 atď. sa bežne v bradaviciach nevyskytujú.
V súčasnosti je známych spolu vyše 189 typov papillomavírusov patriacich do rodiny Papillomaviridae. Asi 120 typov z tohto počtu infikuje výlučne sliznice a kožu človeka, [3, 7, 11]. Ostatné typy papillomavírusov môžu infikovať vtáky, plazy a iné cicavce. HPV vírusy vykazujú prísnu druhovú špecificitu a infikujú výlučne viacvrstvový dlaždicový epitel. HPV sa do organizmu dostáva cez mikrotrhlinky epitelov a preniká až do spodných častí epitelu, kde infikuje bazálne bunky. Po infikovaní bazálnych buniek sa vírusová DNA spolu s diferenciáciou keratinocytov dostáva do vyšších vrstiev epitelov. V stratum spinosum dochádza ku skompletizovaniu vírusovej častice. Zrelé virióny sa potom uvoľňujú spolu s odlučujúcimi sa bunkami kože. Životný cyklus HPV je viazaný na epitel, čím je zabezpečený minimálny kontakt vírusu s imunitným systémom jedinca, čo umožňuje vznik chronickej infekcie [7, 11]. Vírus HPV je odolný, dlhodobo stabilný a infekčný aj v prostredí mimo hostiteľskej bunky [7].
HPV je malý vírus s priemerom 55 nm tvorený bielkovinovou ikosahedrálnou kapsidou a centrálne uloženou dvojvláknovou prstencovito usporiadanou DNA. Genóm vírusu tvorí 8000 báz. Genóm HPV tvoria gény pre štrukturálne proteíny L1 a L2 a gény pre tzv. včasné proteíny E1–E7. Včasné gény sú zodpovedné za vírusovú transkripciu, replikáciu a interakciu s genómom hostiteľskej bunky. Úseky L1 a L2, označované ako neskoré gény, kódujú bielkoviny kapsidy. L1 zároveň slúži ako receptor pre vstup vírusu do hostiteľskej bunky. L2 proteín sa podieľa na aktivácii endocytózy bunkou. Umožňuje presun viriónu a jeho celého genómu k jadru hostiteľskej bunky a napomáha rozbaleniu viriónu tzv. enkapsidácii.
Protilátky proti HPV vírusu sú považované za marker u dlhotrvajúcich infekcií. V nízkych titroch môžu v krvi pretrvávať aj niekoľko rokov po odhojení lézií. Senzitivita dosahuje u HPV-DNA pozitívnych pacientov iba 50 až 60 % [7, 11]. Z tohto dôvodu nie je sérologická diagnostika protilátok vhodná na rutinné použitie. Testy protilátkovej aktivity nie sú vhodne k diagnostike aktuálne prebiehajúcich infekcií pacientov, môžu byť však užitočné pri vytváraní epidemiologických štúdií. Doposiaľ nie je jasné, prečo je humorálna odpoveď preukázateľná iba u 50 % pacientov. K získaniu viriónových antigénov sa pre diagnostiku HPV (metódou ELISA) presadil vývoj tzv. „virus-like particles“ (VLPs)/neinfekčných vírusových plášťov. VLPs predstavujú vírusové obaly, ktoré neobsahujú DNA. Môžu sa vytvoriť z denaturovaných L1, alebo L1/L2 štrukturálnych proteínov [7, 11]. Vysoký titer protektívnych neutralizačných protilátok možno dosiahnúť profylaktickou vakcináciou, ktorá počas svojej éry od uvedenia do praxe zaznamenáva sľubné výsledky s dobrou efektívnosťou a toleranciou. Medzi jednotlivými geneticky podobnými typmi HPV vírusov existujú skrížené reakcie, ktoré umožňujú širšie spektrum účinku [4].
Liečba HPV infekcií u imunosuprimovaných jedincov je pomerne náročná, nakoľko bunková imunita hrá dôležitú úlohu v obrane proti vírusovej infekcii [15]. Infekcie HPV sú torpídnejšie a agresívnejšie v porovnaní s imunokompetentnými jedincami, môžu byť veľkého rozsahu, v netypických lokalitách a často po liečbe recidivujú. U ľudí so známkami imunosupresie, vrátane HIV pozitívnych jedincov a pacientov po transplantácii orgánov, dochádza ku vzniku karcinómov v oblasti análneho otvoru a cervixu so zníženou latenciou [8, 9].
POPIS PRÍPADU
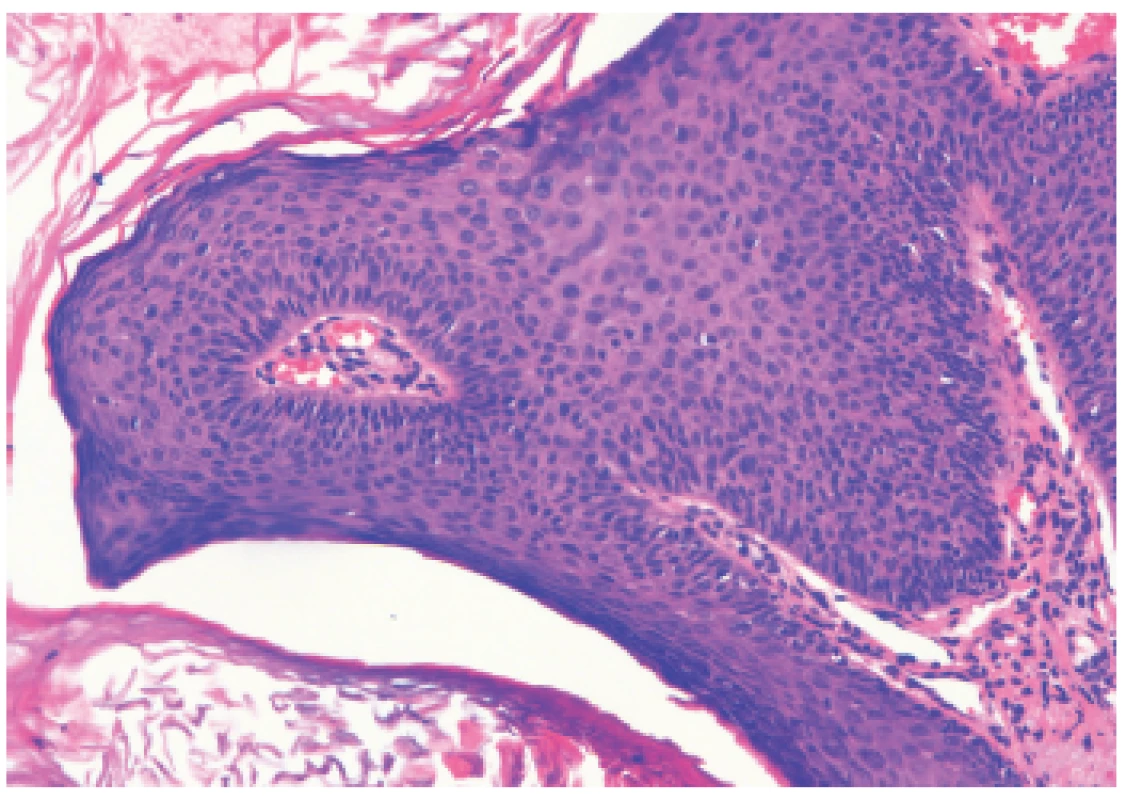
48-ročný HIV pozitívny muž opakovane preliečený pre syfilis (syphilis secundaria, neskôr reinfekcia) prišiel na Dermatovenerologickú kliniku asi s 50 bradavicovitými útvarmi lokalizovanými na brade a v periorálnej oblasti. Lézie tvorili hustú masu, boli šedoružovej farby s drsným povrchom, s veľkosťou do 2–15 mm, niektoré mali filiformný charakter (obr.1). Iné lokality tela vrátane sliznice dutiny ústnej neboli postihnuté. HBV pozitívny “man having sex with men“/MSM je od roku 2008 infikovaný HIV vírusom. Pacientovi bola pred štyrmi mesiacmi nasadená liečebná trojkombinácia antiretrovirotík (lamivudin, etravirin, darunavir) s iniciálnou hodnotou CD4 T lymfocytov 30/µl. Krvný obraz bol pri vyšetrení na hornej hranici normy, mal zvýšené hodnoty lipidových parametrov. Na elektroforéze bielkovín naznačený obraz zápalu, zápalové biochemické parametre sa nachádzali v medziach fyziologickej normy. Submandibulárne a okcipitálne lymfatické uzliny boli palpačne tuhé, zväčšené (1,5–3 cm). Pri manifestácii HPV infekcie boli prietokovou cytometriou namerané patologické hodnoty jednotlivých lymfocytov: CD4 pomocné T-Ly – 5,01 % (33–41 %), čo v absolútnych číslach predstavovalo 52/µl, CD3-Ly – 85,87 % (norma 66–76 %), CD8 cytotoxické T-Ly 78,85 % (27–35 %), CD19 B-Ly – 5,80 % (12–22 %), pomer CD4/CD8 – 0,06 (1,10–1,40). Množstvo cirkulujúcich RNA kópii HIV v krvi predstavovalo 38 000 kópií/µl krvi. Interným vyšetrením diagnostikovaná duodenitída s ulceráciami (Cytomegalovirus pozitívna), vyjadrené podozrenie na tumoróznu infiltráciu steny žalúdka, diagnostikovaný adenóm nadobličky, hyperplázia prostaty, hepatomegália, struma diffusa. Z lézie na tvári bola elektrokauterizáciou odobratá vzorka za účelom histolopatologického vyšetrenia a HPV genotypizácie. Histologický obraz potvrdil diagnózu verrucae vulgares, pripomínajúce kožný papilóm s hyperplastickým pravidelným dlaždicovým epitelom s hyperkeratózou a parakeratózou (obr. 2). Molekulárno-genetickou metódou PCR (Polymerase Chain Reaction) bol vo vzorke dokázaný vysoko rizikový HPV 16, ktorý nie je typický pre verrucae vulgares. Vzorka bola podrobená molekulárnej analýze 16 typov HPV (LR-HPV, HR-HPV) dostupných v amplifikačných AmpliSens® kitoch laboratória. Prítomnosť iných typov HPV sa vo vzorke nepreukázala. Vo vzorke sa ďalej analyzoval aj tzv. molekulový podpis dysplázie, čím sme sledovali aktivitu jednotlivých génov dokazujúcu agresivitu dysplastických buniek. Vo vzorke bola dokázaná nízka hladina topoizomerázy TOP2a a Ki67, čo znamená nízku mitoticku aktivitu buniek a teda nízke riziko malígnej transformácie. Pacientovi bolo doporučené ORL vyšetrenie pre prípadnú papilomatózu hrtana, ktoré však neabsolvoval.
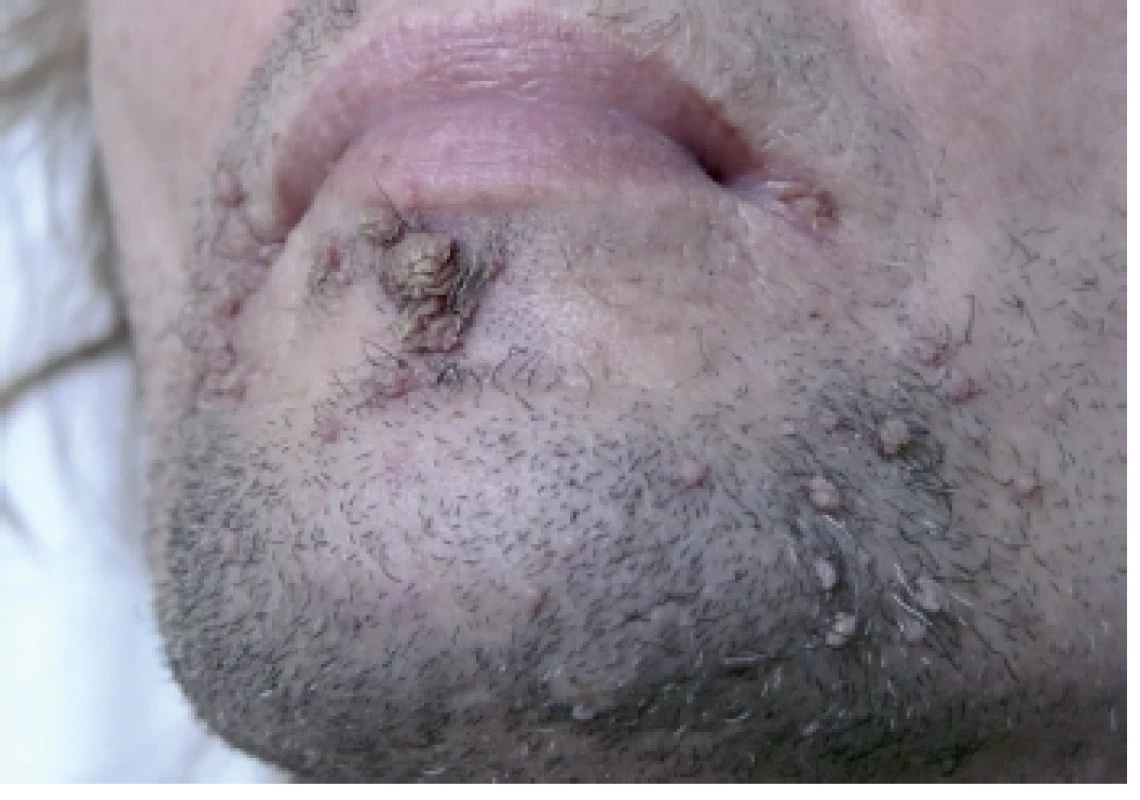
Pacient je monitorovaný pre HIV infekciu a v súčasnosti liečený trojkombináciou spomínaných anti-HIV liekov, ktorú užíval aj počas lokálnej liečby HPV infekcie 5% imiquimodom. Lokálna terapia imiquimodom sa aplikovala cielene na prejavy 3x týždenne počas 1 mesiaca. Postupne došlo k deštrukcii patologických lézií iba s miernou lokálnou reakciou v podobe erytému. Iné lokálne ani celkové vedľajšie účinky neboli zaznamenané. Počas ročného sledovania je pacient bez prejavov HPV infekcie.
DISKUSIA
Verrucae vulgares sú častým vírusovým ochorením kože, ktoré sa makroskopicky prejavujú v podobe hyperkeratotických papilomatóznych lézií. Najčastejšie ich nachádzame na akrálnych častiach tela, v lokalitách s nižšou cirkuláciou krvi [13]. Ich typickým klinickým prejavom na tvári sú filiformné veruky. Verrucae planae sa často manifestujú v tvárovej oblasti zväčša u detí. Rozlíšenie je možné klinicky, pri nejasnostiach histopatologicky. Pri verrucae vulgares je histologicky prítomný papilomatózny útvar s akantózou, hyperkeratózou a parakeratózou lokalizovanou najmä vo vrcholoch papíl. Súčasne je rozšírené stratum granulosum, prítomné sú koilocyty. Pri verrucae planae je histologicky nález odlišný. Akantóza je prítomná, hyperkeratóza, je však iba mierneho stupňa, papilomatóza a parakeratóza chýbajú. Koilocyty sú taktiež prítomné. Diferenciálne diagnosticky možno v prípade papulózneho postihnutia tváre u HIV pozitívneho pacienta uvažovať aj o moluskách, Kaposiho sarkóme, eozinofilnej folikulitíde, rozaceiformej dermatitíde, papulárnej pruritickej dermatitíde atď. [19].
Na to, aby došlo k malígnemu zvrhnutiu lézie, je potrebný viacrvrstvový dlaždicový epitel kože a slizníc a infekcia onkogénnym typom HPV. Rovnako potrebné sú aj kooperujúce faktory na strane hostiteľa, ktoré umožnia vírusu uplatniť sa v napadnutej bunke [4]. Sú to predovšetkým procesy súvisiace s celkovou alebo lokálnou imunosupresiou. Vírus inkorporáciou do bunky hostiteľa cez ovplyvnenie proteínu p53, ktorý sa označuje ako strážca genómu, spôsobuje zlyhanie kontrolných mechanizmov, nestabilitu genómu bunky, čím dochádza k akumulácií mutácií s následným vývojom malignity [16]. Pri vysoko onkogénnych typoch HPV sa laboratórne monitoruje aj nadexpresia génov regulujúcich bunkový cyklus – tzv. génov molekulového podpisu (CDKN1/p21, topoizomeráza TOP2a a Ki67). Zvýšená expresia týchto génov poukazuje na zrýchlené delenie buniek a riziko malígnej transformácie. Pacienti so zvýšenou expresiou týchto génov by mali byť dôsledne monitorovaní.
Najčastejšie sú z verrucae vulgares izolované HPV 1–4, 26–29, vírusy s nízkym onkogénnym potenciálom, ktoré sú zodpovedné za približne 80 % bradavíc [4, 15]. Paradoxne bol však u nášho imunodeficientného pacienta zachytený vysoko rizikový genotyp HPV 16. U MSM so súčasnou HIV infekciou možno izolovať vysoko rizikový HPV 16 z bowenoidnej papulózy lokalizovanej v anorektálnej oblasti. Extenzívne HIV infekcie nadobúdajú u týchto jedincov klinický obraz epidemodysplasia verruciformis (HPV 5, HPV 8). Giannaki M. et al. (2013) potvrdili prítomnosť vysokorizikového HPV 16 vo vulgárnych verukách na rukách, stupajách, na tvári a krku detí [6]. Vysoko rizikový HPV 69 identifikoval Whitaker J. M. et al. (2009) z agresívnych plantárnych verúk u HIV pozitívneho pacienta [18]. Pri záchyte vysoko onkogénneho typu HPV sa nedá vylúčiť ani kontaminácia povrchu lézie vírusovou DNA prostredníctvom inokulácie z iných častí tela. Štúdie s imunodeficientnými pacientami dokazujú, že imunitný systém jedinca hrá dôležitú úlohu v patogenéze pôsobenia HPV [2, 12]. Sú zaznamenané prípady, v ktorých po posilnení imunity došlo k spontánnemu vymiznutiu prejavov spôsobených HPV. U takmer 90 % imunokompetentných jedincov je imunitný systém schopný eliminovať HPV infekciu v priebehu troch rokov, 10 % prechádza do chronicity a len 1 % infekcií vyústi do malignity [12]. U HIV pacientov je však situácia komplikovanejšia ako u jedincov s plne funkčným imunitným systémom. Mechanizmus interakcie medzi HIV a HPV nie je úplne objasnený [10]. Doposiaľ nie je dostatočne známe, či je HIV schopný molekulárnymi interakciami ovplyvniť transkripcu génov HPV priamo, alebo nepriamo cez imunitný systém infikovaného jedinca [1].
Bunkovú imunitu HIV pozitívnych sa často nedarí rekonštruovať dostatočne, napriek vysoko agresívnej antiretrovírusovej liečbe. HIV pozitívni jedinci sú preto náchylnejší na recidívu alebo pretrvávanie HPV infekcií v porovnaní s imunokompetentnými jedincami [17]. Nie je dostatočne známe, či počet (pokles počtu) CD4 lymfocytov vplýva aj na rozvoj a početnosť klinických lézií [13].
Pri zahájení antiretrovirotickej liečby u HIV pozitívnych jedincov s ťažkou imunosupresiou sa može prejaviť tzv. IRIS fenomén (Immune Reconstruction Inflammatory Syndrome). IRIS je definovaný klinickou manifestáciou oportúnnych infekcií po zahájení antiretrovirotickej liečby [14] u pacienta s iniciálne nízkymi hodnotami CD4 T lymfocytov (pod 50/µl). Organizmus reaguje po zahájení terapie na návrat imunokompetentnosti organizmu výraznou zápalovou reakciou, ktorá príznaky oportúnnej infekcie získanej ešte pred zahájením antiretrovirotickej liečby zhoršuje [14]. Kvôli širokému spektru príznakov a rozdielnej klinickej manifestácii môže byť diagnostika IRIS fenoménu problematická [14]. Pri jedincoch so súčasnou infekciou HIV a inou oportúnnou infekciou v nezvyčajnej lokalizácii či nezvyčajného rozsahu a správania, treba pamätať na tento paradoxný fenomén. Vzhľadom na začatie antiretrovírusovej terapie niekoľko mesiacov pred manifestáciou HPV lézii predpokladáme výskyt IRIS fenoménu aj u nášho pacienta.
Terapia HPV lézii u imunokompromitovaných pacientov je náročná kvôli rozsahu, torpídnosti a častej recidíve prejavov. U HIV pozitívnych pacientov je možné použiť všetky dostupné liečebné modality HPV lézií (cytotoxické, cytodeštrukčné, chirurgicko-ablačné) zvyčajne však s väčšou agresiou, resp. využiť ich vzájomné kombinovanie [2, 18]. Lokálne aplikovaný 5-% imiquimod v kréme, ktorý sme použili v liečbe nášho pacienta, predstavuje vhodnú terapeutickú metódu nielen v liečbe condylomata acuminata, ale aj v liečbe verrucae vulgares. Tento typ lokálnej liečby sme zvolili po konzultácii s pacientom, ktorý sa obával bolestivosti pri použití iných liečebných prostriedkov a zároveň kvôli pracovnej zaneprázdnenosti nemohol pravidelne dochádzať do dermatologickej ambulancie za účelom aplikovania liečby. Pri lokálnej terapii 5-% imiquimodom sa využíva imunomodulačná aktivita synteticky vyrobenej molekuly imiquimodu s antitumoróznou, antiangiotickou a antivírusovou aktivitou. Imiquimod je schopný modifikovať prirodzenú aj špecifickú celulárnu imunitnú odpoveď cez väzbu na Toll-like 7 receptory. Po naviazaní sa na Toll-like receptor dochádza k stimulácii Langerhansových buniek, ktoré uvoľňujú cytokíny typu: INF-α, TNF - α, IL-1α a INF-γ [7]. Svojou aktivitou tak podporujú Th 1 bunkovú odpoveď organizmu. Imiquimod je schopný interagovať s dendritickými bunkami, aktivovať prozápalové cytokíny, čo nakoniec vyústi k apoptóze patologických buniek, k inhibícii rastu a samotnej deštrukcii infikovaných buniek cez NK bunky a T-lymfocyty. Nežiadúce účinky pri liečbe 5-% imiquimod krémom sa vyskytujú zriedkavo, najčastejšie iba v podobe lokálnej reakcie ako pruritus, pálenie, erytém či ekzematózne zmeny v mieste aplikácie [5]. Liečbu je preto často nutné prerušiť kvôli nežiadúcej reakcii.
ZÁVER
Verrucae vulgares u imunodeficientých pacientov môžu dorásť do nezvyčajne veľkých rozmerov, môžu postihovať veľké plochy a častokrát sú terapeuticky ťažko zvládnuteľné. U HIV pozitívnych jedincov je možné použiť všetky dostupné liečebné metódy HPV infekcií (cytotoxické, cytodeštrukčné, chirurgicko-ablačné), zvyčajne však s väčšou agresivitou, resp. využiť kombinácie jednotlivých typov terapií. Na liečbu nášho imunodeficientného HIV pacienta sme použili 5-% imiquimod v kréme pre jeho imunomodulačný efekt. Tento spôsob liečby má veľmi dobrú účinnosť, zo strany pacientov je dobre tolerovaný a môže sa použiť nielen na liečbu condyloma acuminatum, ale aj na liečbu verrucae vulgares u imunodeficientných pacientov. Záchyt vysoko onkogénneho HPV 16 zo vzorky vulgárnej veruky u HIV pozitívneho pacienta predstavuje raritný nález, ktorý je v literatúre zdokumentovaný ojedinele iba prostredníctvom kazuistík. V prípade nálezu vysoko rizikového HPV treba pamätať na dôsledný monitoring pacienta pre možnú malígnu transformáciu.
Poďakovanie
Autori ďakujú za vynikajúcu spoluprácu RNDr. E. Weismanovej, PhD., z Oddelenia lekárskej genetiky, Onkologický ústav sv. Alžbety, Bratislava, Slovenská republika, za odbornú pomoc pri genotypizácii HPV vírusov a za histologické spracovanie a vyhodnotenie preparátov prof. MUDr. P. Babálovi, CSc., z Ústavu patologickej anatómie Lekárskej fakulty Univerzity Komenského v Bratislave, Slovenská republika.
Do redakce došlo dne 18. 9. 2014.
Adresa pro korespondenci:
MUDr. Martina Part
Dermatovenerologická klinika LF UK a UNB
Mickiewiczova 13
813 69 Bratislava,
Slovenská republika
e-mail: martina.kralova@gmail.com
Sources
1. ARANY, I., TYRING, S. K. Systemic immunosuppresion by HIV infection influences HPV transcription and thus local immune responses in condyloma acuminatum. Int. J. STD AIDS, 1998, 5, p. 268–271.
2. BARBOSA, P. Plantar verruca and HIV infection. Clin. Podiatr. Med. Surg., 1998, 15 2, p. 317–327.
3. BERNARD, H., BURK, R. D., CHEN, Z. et al. Classification of papillomaviruses (PVs) based on 189 PV types and proposal of taxonomic amendments. Virology, 2010, 401, p. 70–79.
4. DELIGEOROGLOU, D., GIANNOULI, A. et al. HPV infection: immunological aspects and their utility in future therapy. Infect. Dis. Obstet. Gynecol., 2013, 2013 : 540850. doi: 10.1155/2013/540850.
5. FATHI, R., TSOUKAS, M. M. Genital warts and other HPV infections: Established and novel therapies. Clin. Dermatol., 2014, 32, p. 299–306.
6. GIANNAKI, M., KAKOUROU, T., THEODORIDOU, M. et al. Human papillomavirus (HPV) genotyping of cutaneous warts in Greek children. Pediatr. Dermatol., 2013, 30, 6, p. 730–735.
7. HENGGE, U. R. Papillomaviruserkrankungen. Hautarzt, 2004, 55, p. 841–854.
8. HENGGE, U. R. Spektrum der HPV-Infektion in der Dermatologie: Besonderheiten bei Organtransplantieren und HIV-Patienten. In Hengge, U. R. HPV-Infektionen und Neoplasien der Haut. UNI-MED, 2003, Bremen.
9. HENGGE, U. R., MOTA, R., MARINI, A. Häufige und seltene dermatologische Erkrankungen bei HIV-Patienten. Hautartz, 2006, 57, p. 975–987.
10. HILLE, J. J., WEBSTER-CYRIAQUE, J. et al. Mechanisms of expression of HHV8, EBV and HPV in selected HIV-associated oral lesions. Oral Dis., 2002, 8, 2, p. 161–168.
11. HOWLEY, P. M., LOWY, D. R. Papillomaviruses and their replication. In Knipe, D. M., Howley, P. M. Fields virology, 4th end. Lippincott Williams and Wilkins, Philadelphia, 2001, p. 2197–2229.
12. CHOW, L. T., BROKER, T. R. Human papillomavirus infections: warts or cancer? Cold Spring Harb Perspect Biol., 2013, 5, 7, doi: 10.1101/cshperspect.a012997.
13. LUU, H., AMIRIAN, E. S., CHAN, W. et al. CD4+ cell count and HIV load as predictors of size of anal warts over time in HIV-infected women. J. Infect. Dis., 2012, p. 578–585.
14. MEYS, R., GOTCH, F. M., BUNKER, C. B. Human papillomavirus in the era of highly antiretrovirus therapy for human immunodeficiency virus: an immune reconstruction-associated disease? Br. J. Dermatol., 2010, 162, 1, p. 6–11.
15. SALAVEC, M. Virová oněmocnení kuže a sliznic působená herpes simplex viry a lidskými papilomaviry. Čes.-slov. Derm., 2006, 81, 5, p. 249–269.
16. VOJTAŠŠÁK, J. et al. Etiopatogenéza rakoviny krčka maternice. Onkológia (Bratisl.), 2010, 5, 5, p. 278–281.
17. WEISMANOVÁ, E. et al. HPV a krčok maternice: genetická podstata malígnej transformácie bunky. Onkológia (Bratisl.), 2008, 3, 6, p. 389–392.
18. WHITAKER, J. M., PALEFSKY, J. M., DE COSTA, M. et al. Human papilloma virus type HPV 69 identified in a clinically aggressive plantar verruca from an HIV-positive patient. J. Am. Podiatr. Med. Assoc., 2009, 99, 1, p. 8–12.
19. WOLFF, K., JOHNSON, R. A. et al. Fitzpatrick’s Color Atlas and Synopsis of Clinical Dermatology. 7th edition. Mc Graw Hill Education, USA, 2013, p. 692–698. ISBN 978-0-07-179302-5.
Labels
Dermatology & STDs Paediatric dermatology & STDsArticle was published in
Czech-Slovak Dermatology

2015 Issue 1
Most read in this issue
- Akarodermatitidy – roztočové dermatitidy
- Klonální melanocytární névy
- Mnohopočetné verrucae vulgares spôsobené vysoko onkogénnym HPV 16 u imunodeficitného pacienta s HIV infekciou
- Terapeutická edukace v dermatologii
