Kyselina listová a poruchy uzatvárania neurálnej rúry – od minulosti po súčasnosť
The folic acid and neural tube defects – from past to present
It has been 20 years now since the first study demonstrated the embryo protective effect of folic acid in the prevention of neural tube defects. Nevertheless these defects represent one of the most common congenital anomalies in the world. For this reason we offer the review of the relationship between folic acid and inborn anomalies focused on neural tube defects. The present article gives a historical view on the most important studies demonstrated the embryo protective effects of folic acid, an overview of actual knowledge about pathogenesis, genetic and environmental aspects of neural tube defects formation. Moreover it emphasizes the possibility of folic acid utilization in the prevention of congenital anomalies. We mentioned about the possible risks of using folic acid (focused on tumorgenesis) as well as about using folic acid in women with epilepsy.
Key words:
folic acid, congenital anomalies, neural tube defects, primary prevention
Authors:
V. Cingel 1; H. Gbelcová 2; J. Rajec 3,4; N. Gašparovičová 5; I. Varga 6,7
Authors‘ workplace:
Univerzitné pracovisko reprodukčnej medicíny, 1. Gynekologicko-pôrodnícka klinika
; II. Gynekologicko-pôrodnícka klinika, Lekárska fakulta a Univerzitná Nemocnica Bratislava
; Ústav farmakológie a klinickej farmakológie, Lekárska fakulta, Univerzita Komenského
; Ústav lekárskej biológie, genetiky a klinickej genetiky, Lekárska fakulta
; Klinika detskej chirurgie, Detská fakultná nemocnica a Lekárska fakulta
; Univerzita Komenského, Bratislava
prednosta doc. MUDr. J. Trnka, CSc.
1; a Univerzitná nemocnica Bratislava, Univerzita Komenského, Bratislava
prednosta doc. MUDr. D. Böhmer, PhD.
2; Bratislava
prednosta prof. MUDr. V. Kristová, CSc.
3; II. Onkologická klinika, Národný onkologický ústav, Bratislava
prednosta doc. MUDr. J. Mardiak, CSc., mim. prof.
4; Univerzita Komenského, Bratislava
prednosta prof. MUDr. K. Holomáň, CSc.
5; Ústav histológie a embryológie, Lekárska fakulta, Univerzita Komenského, Bratislava
prednosta doc. MUDr. Š. Polák, CSc.
6; Lekárska fakulta a Univerzitná Nemocnica Bratislava, Univerzita Komenského, Bratislava
prednosta prof. MUDr. L. Borovský, CSc.
7
Published in:
Čes-slov Pediat 2012; 67 (Suppl 1): 45-55.
Category:
Review
Overview
Aj 20 rokov od zverejnenia prvej štúdie, ktorá jednoznačne preukázala embryoprotektívny efekt kyseliny listovej v prevencii porúch uzatvárania neurálnej rúry, patria tieto poruchy k najčastejším vrodeným vývinovým chybám na celom svete. Prinášame preto prehľadový článok popisujúci vzťah kyseliny listovej k vrodeným anomáliám so zameraním na poruchy uzatvárania neurálnej rúry. Príspevok obsahuje historický pohľad na najvýznamnejšie štúdie o embryoprotektívnych účinkoch kyseliny listovej, prehľad o súčasných znalostiach patomechanizmu vzniku porúch uzatvárania neurálnej rúry, o genetických a environmentálnych aspektoch týchto porúch ako aj o možnosti využitia kyseliny listovej v prevencii vrodených vývinových chýb. Zmieňujeme sa aj o možných rizikách užívania kyseliny listovej vo vzťahu k vzniku malignít a o užívaní kyseliny listovej počas antiepileptickej liečby.
Kľúčové slová:
kyselina listová, vrodené vývinové chyby, poruchy uzatvárania neurálnej rúry, primárna prevencia
ÚVOD
Každý rok sa na svete narodí priemerne 135 miliónov novorodencov, z ktorých približne 3 % sú postihnuté rôzne závažnou vrodenou vývinovou chybou (VVCh). Z týchto údajov vyplýva, že každý rok sa narodí viac ako 4 milióny detí s VVCh, teda denne vyše 11 tisíc [1]. Poruchy uzatvárania neurálnej rúry (angl. neural tube defects, NTDs), ako spina bifida, encephalocele alebo anencephalia, patria k najčastejším vrodeným anomáliám, postihujúcim priemerne 0,5 až 2 z tisíc novorodencov (0,05–0,2 %) na celom svete [2]. Vo frekvencii výskytu ich predstihujú iba VVCh srdca [3, 4]. V období rokov 1961 až 1999 sa narodilo na území Českej republiky 0,084 % novorodencov s NTDs [5]. Incidencia NTDs medzi živonarodenými deťmi je na Slovensku o niečo nižšia, v rokoch 1996 až 2004 predstavovala 0,028 %. Spomedzi všetkých gravidít (vrátane mŕtvorodených plodov a interrupcií) je výskyt NTDs na území Slovenska 0,053 % [6]. Údaje z Čiech a zo Slovenska však nemožno porovnávať, nakoľko spomenuté výskumy sa uskutočnili vo výrazne odlišnom časovom období.
Následkom narušenia embryonálneho procesu uzatvárania neurálnej rúry dochádza k zmenám vo vývine mozgu a/alebo miechy. Vyvíjajúce sa nervové tkanivo nie je chránené kožným a/alebo kosteným krytom a vnútromaternicovo je vystavené pôsobeniu extra-embryonálneho prostredia (amniónovej tekutiny). To vedie k degenerácii nervových štruktúr so stratou neurologických funkcií postihnutej oblasti [7]. Poruchy uzatvárania neurálnej rúry sú heterogénnou skupinou vrodených chýb centrálneho nervového systému (CNS), ktoré zahrňajú letálne malformácie (napr. anencephalia alebo cranioschisis), pri ktorých novorodenci prežívajú najviac niekoľko dní, ale aj liečiteľné vrodené chyby (napr. spina bifida). Vďaka včasným neurochirurgickým výkonom v porovnaní s minulosťou výrazne vzrástol počet prežívajúcich detí. Avšak aj napriek chirurgickej intervencii možno pozorovať u časti pacientov so spina bifida trvalý neurologický deficit rôzneho stupňa (senzomotorický, autonómny či mentálny), pričom práve stupeň neurologického poškodenia je najdôležitejším prognostickým faktorom z pohľadu ďalšieho vývinu jedinca [8, 9]. V Spojených štátoch amerických je mortalita pacientov so spina bifida v období detstva až okolo 10 %. Prvých tridsať rokov prežíva 52 až 68 % tých pacientov s NTDs, ktorí v ranom detstve podstúpili chirurgický zákrok [10, 11].
Pri vzniku NTDs sa predpokladá súhra genetických a nutričných faktorov, ako aj možný vplyv teratogénov z vonkajšieho prostredia. Je tomu 20 rokov, čo prvé randomizované štúdie jednoznačne preukázali embryoprotektívny efekt kyseliny listovej [12], resp. multivitamínových preparátov obsahujúcich kyselinu listovú [13] v primárnej prevencii anencephalia a spina bifida. Následne v septembri 1992 vydala americká organizácia Center for Disease Control and Prevention vyhlásenie, v ktorom odporúča všetkým ženám v reprodukčnom veku užívať 0,4 miligramu kyseliny listovej denne za účelom zníženia rizika vývinu plodu s NTDs [14]. Tento príspevok prináša prehľad aktuálnych poznatkov o patogenéze vzniku porúch uzatvárania neurálnej rúry, ako aj najnovšie návrhy vysvetlenia možného embryoprotektívneho vplyvu užívania kyseliny listovej v peri-koncepčnom období (tri mesiace pred plánovaným počatím do 8. týždňa po počatí).
PATOGENÉZA PORÚCH UZATVÁRANIA NEURÁLNEJ RÚRY
Neurulácia, proces vývinu neurálnej (medulárnej) rúry ako základu budúceho CNS, pozostáva z troch za sebou nasledujúcich krokov: vývin neurálnej platničky (neuroektodermy) na budúcej chrbtovej strane embrya, utváranie neurálneho žliabku a nadvihujúcich sa neurálnych valov a nakoniec zrastanie neurálnych valov do neurálnej rúry. Neurulácia prebieha vo včasných štádiách embryogenézy, v treťom a štvrtom týždni po oplodnení. Narušenie vývinu budúceho CNS môžu ovplyvniť interakcie na úrovni génov, génov a vonkajšieho prostredia aj génov a výživy. Predpokladá sa, že väčšina prípadov porúch uzatvárania neurálnej rúry má multifaktorový pôvod s významnou genetickou zložkou (napr. polymorfizmy v rodine HOX a PAX génov), ktoré sú podmienené množstvom environmentálnych faktorov [15, 16].
Mechanizmus vzniku NTDs bol predmetom záujmu vedcov už v minulých storočiach. Zakladateľ modernej patológie Giovanni Morgagni (1682–1771) predpokladal, že vyšší tlak v mozgových komorách spôsobený zvýšenou produkciou mozgovo-miechového moku spôsobuje znovu-otvorenie pôvodne už uzavretej neurálnej rúry. Naopak, Friedrich von Recklinghausen (1833–1910) predpokladal primárne zlyhanie zrastania neurálnych valov, pričom na pomenovanie tohto stavu použil termín dysraphia [17]. Nejednotnosť v názore na patogenézu vzniku NTDs pretrváva dodnes. Veľká časť súčasných autorov spomína len mechanizmus prvotného zlyhania uzatvárania neurálnej rúry. Existujú však klinické aj experimentálne štúdie potvrdzujúce možnosť sekundárneho otvorenia pôvodne už uzavretej neurálnej rúry v mechanizme vzniku NTDs [18, 19].
Väčšina súčasných literárnych prehľadov sa venuje NTDs ako samostatne sa vyskytujúcej vrodenej chybe. Zabúda sa pri tom na to, že mnohé prípady sú súčasťou širokého spektra rôznych anomálií postihujúcich rôzne tkanivá a orgány mimo CNS. Vývinové chyby iných orgánov a orgánových systémov sa najčastejšie vyskytujú pri craniorachischisis a pri spina bifida v hornej hrudníkovej oblasti a takmer nikdy sa nevyskytujú pri spina bifida v driekovo-krížovej oblasti. To naznačuje, že narušenie vývinu neurálnej rúry má značný dopad aj na vývin okolitých ne-nervových štruktúr a tkanív [20].
FAKTORY VONKAJŠIEHO PROSTREDIA VO VZNIKU NTDs
Odlišná incidencia NTDs u detí z rôznych geografických lokalít, s rôznym socio-ekonomicko-hygienickým štandardom rodičov upriamili pozornosť vedcov na vonkajšie faktory podieľajúce sa na patogenéze NTDs. Je známe, že mexické imigrantky v USA, ktoré majú v porovnaní s domácim obyvateľstvom odlišnú socio-ekonomickú úroveň, majú v prvých dvoch rokoch od presťahovania sa až 7-násobne zvýšené riziko narodenia dieťaťa s NTDs. Riziko narodenia dieťaťa s NTDs pôvodne mexických imigrantov v druhej alebo tretej generácii je však už rovnaké ako u obyvateľstva USA [21]. Vrodené anomálie CNS môžu spôsobiť viaceré faktory vonkajšieho prostredia, ku ktorým patria [17, 22, 23]:
- fyzikálne vplyvy (röntgenové žiarenie, hypertermia),
- niektoré liečivá (thalidomid, antagonisti kyseliny listovej, androgény, antiepileptiká ako valproát, hypervitaminóza A),
- abúzus alkoholu,
- ťažké kovy (ortuť, olovo),
- toxické látky vo vzduchu alebo v pitnej vode v okolí tovární (polychlórované bifenyly, benzén, trichlóretylén),
- infekcie matky (vírus rubeoly, cytomegalovírus, Toxoplasma gondii, Treponema pallidum),
- metabolické poruchy matky (fenylketonúria, diabetes mellitus, endemický kretenizmus, obezita),
- výživa matky (diskutovaná v ďalších kapitolách samostatne).
Zo všetkých spomenutých vonkajších faktorov je najpodrobnejšie preskúmaný neuroteratogén hypertermia [24]. Zvýšená telesná teplota ovplyvňuje tak bunkovú proliferáciu, migráciu, diferenciáciu, ako aj samotný proces programovanej bunkovej smrti. Viaceré štúdie potvrdili, že hypertermia matky v ranom vývine zárodku spôsobuje narušený vývin neurálnej rúry a vznik NTDs [25, 26].
MECHANIZMUS ÚČINKU KYSELINY LISTOVEJ
Kyselinu listovú objavila anglická hematologička Lucy Willsová (1888–1964), ktorá ženám z chudobných častí Indie s makrocytovou anémiou odporučila užívať extrakt z kvasníc [27]. Pojem „kyselina listová“ zaviedli Mitchell so spolupracovníkmi po jej chemickej izolácii z listov špenátu [28].
Kyselina listová (kyselina pteroyl-monoglutámová, kyselina folová) je vitamín skupiny B rozpustný vo vode. Od nej je odvodená skupina ďalších látok spoločne nazývaných foláty (polyglutamáty) (z lat. folium – list). Vlastná kyselina listová nie je biologicky aktívna. V metabolických procesoch pôsobí vo svojej redukovanej forme. Po transporte do buniek pôsobí ako lapač jednouhlíkových zvyškov odštiepených z veľkých molekúl. Priamo na svojej molekule takýto zvyšok premení do podoby, v ktorej môže byť v metabolizme ďalej využitý, alebo vylúčený z tela von. Keby zostali jednouhlíkové zvyšky (napr. formaldehyd, kyselina mravčia, metylové radikály a i.) voľné, pôsobili by silne toxicky. Foláty zároveň poskytujú metylovú skupinu pre remetyláciu homocysteínu, čím sa zúčastňujú syntézy aminokyseliny metionínu. Metionín je najdôležitejším donorom metylových skupín v procese metylácie DNA a transferovej RNA. Ďalšie jednouhlíkové skupiny prenášajú foláty do dráh syntézy purínov a pyrimidínov (základné stavebné jednotky DNA) a syntézy S-adenozyl metionínu, ktorý predstavuje univerzálny zdroj metylových skupín pre všetky makromolekuly. Enzýmy vystupujúce v metabolickom cykle využívajú ako kofaktory vitamíny skupiny B (vitamíny B12 a B6). Metabolický cyklus folátov je zobrazený na obrázku 1.
![Ilustračná schéma prepojenia metabolického cyklu folátov a homocysteínu.
<em>FR – folátový receptor, RFC – redukovaný prenášač folátov, THF – tetrahydrofolát, MTHFD – metyléntetrahydrofolát dehydrogenáza, MTHFR – 5,10-metylén-THF reduktáza, SAM – S-adenozyl-L-metionín, SAH – S-adenozyl-homocysteín, MS – metionín syntáza, CBS – cystation-β syntáza (upravené podľa [40]).</em>](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/bada2d67212860d491fc26dafd3037e6.png)
K významným prírodným zdrojom folátov patrí pečeň, surová, najmä listová zelenina, orechy, obilné klíčky, celozrnné výrobky, niektoré druhy ovocia, mliečne výrobky, strukoviny a kvasnice [29].
Prvé údaje o nižšej hladine folátov a vitamínov B2 a C v krvi žien, ktorým sa narodilo dieťa s NTDs, pochádzajú už z roku 1976 [30]. Vznik NTDs však začal byť spájaný s nedostatkom kyseliny listovej najmä potom, ako sa pozorovalo, že tehotným ženám užívajúcim liečivá interferujúce s metabolizmom folátov (aminopterín, karbamazepín, kyselina valproová) sa vo vyššej miere rodili deti so spina bifida [31]. Dodnes však neexistuje jednoznačné vysvetlenie, prečo je vývin CNS významne citlivejší na nedostatok kyseliny listovej než vývin ostatných orgánových systémov. Faktom zostáva, že foláty sa spolu s DNA metyltransferázou 1 (Dnmt1) vyskytujú v CNS počas vývinu vo vyššej koncentrácii ako v iných tkanivách [32], a zároveň bunky vyvíjajúceho sa CNS vo vyššej miere exprimujú folátový receptor [33].
V súčasnosti prevláda teória, že deficit kyseliny listovej, ktorá je zdrojom metylových skupín pre mnohé metylačné reakcie, spôsobuje hypometyláciu genómovej DNA [34]. Metylácia je nevyhnutná v procese syntézy membránových fosfolipidov, myelínových proteínov, neurotransmiterov a pre vytvorenie vhodnej génovej expresie počas embryogenézy vôbec [35]. Počas embryogenézy dochádza k expresii všetkých troch majoritných DNA metyltransferáz Dnmt1, Dnmt3a, Dnmt3b, ktoré sú viac alebo menej dôležité pre správne vytvorenie a udržanie žiadanej miery metylácie genómu [36]. V období medzi 8. a 16. bunkovým vývinovým štádiom embrya dochádza k demetylácii genómu. Pred začiatkom vývinu zárodkových listov genóm embrya podstupuje globálnu remetyláciu na špecifických miestach DNA označovaných ako CpG (cytozín-fosfát-guanín) [32, 37]. Za týmto procesom opäť nasleduje demetylácia a transkripcia tkanivovo špecifických génov počas organogenézy [38]. Štúdie ukázali, že nesprávne zákonitosti metylácie môžu viesť k viacnásobným vývinovým malformáciám až k smrti embrya.
Celková hypometylácia DNA môže byť rovnako spôsobená zvýšeným množstvom S-adenozyl-homocysteínu (SAH). S-adenozyl-L-metionín (SAM) sa po odovzdaní metylovej skupiny zmení na SAH, ktorý SAH-hydroláza v reverzibilnej reakcii mení na homocysteín [39]. Ak nie je homocysteín konvertovaný na metionín, mení sa späť na SAH, ktorý inhibuje DNA metyltransferázy, nakoľko tieto majú väčšiu afinitu k SAH než k SAM [36]. Bunkový homocysteín môže byť ireverzibilne odstránený v tzv. transsulfurovej dráhe. Zdá sa, že folát-špecifické defekty korešpondujú so zvýšenou hladinou homocysteínu. Pravdepodobnosť mať dieťa s NTDs sa zvyšuje u žien, ktoré síce majú normálnu hladinu folátu, no majú zvýšenú hladinu homocysteínu v plazme [31].
V skutočnosti väčšina gravidít s plodom postihnutým NTDs nie je sprevádzaná zníženou hladinou folátov. Z toho vyplýva, že samotné suboptimálne hladiny folátov nie sú príčinou vzniku NTDs, ale v kombinácii s ďalšími, či už genetickými alebo environmentálnymi faktormi môžu predstavovať pre vznik NTDs významnú predispozíciu [40].
GENETICKÉ ASPEKTY PORÚCH UZATVÁRANIA NEURÁLNEJ RÚRY
Kandidátne genetické faktory sa našli okrem iného aj medzi génmi súvisiacimi práve s metabolizmom folátov. Prvú skupinu faktorov predstavujú gény kódujúce proteíny potrebné pre transport folátov a ich zadržanie v bunke, konkrétne gény pre folátové receptory FRα, FRβ, FRγ a pre redukovaný prenášač folátov RFC1 [41]. Je známe, že ženy počas tehotenstva s plodom s NTDs produkujú auto-protilátky viažuce sa na folátové receptory placentovej membrány, čím blokujú naviazanie kyseliny listovej. Zatiaľ čo polymorfizmy v génoch pre receptory folátov súvisiace so zvýšeným rizikom vzniku NTDs identifikované neboli [41, 42], polymorfizmus A80G v géne RFC-1 predstavuje dokázateľný rizikový faktor vzniku NTD špeciálne v podmienkach deficitu folátu u matky [43, 44].
Najštudovanejší gén ďalšej skupiny potenciálnych rizikových faktorov pre vznik NTDs je MTHFR, ktorého produktom je 5,10-metylén-tetrahydrofolát reduktáza. Dôsledkom jednonukleotidového polymorfizmu C677T v tomto géne je zníženie enzýmovej aktivity ním kódovanej reduktázy, následné zvýšenie hladiny homocysteínu v plazme a zvýšenie rizika vzniku NTDs. Tento jav bol preukázaný v írskej a holandskej populácii [45, 46]. V prípade ďalších populácií, vrátane slovenskej, pozorovaný nebol [42, 47–49]. O niečo menej významné zníženie aktivity 5,10-metylén-tetrahydrofolát reduktázy a zvýšenie rizika vzniku NTDs sa spája aj s jednonukleotidovým polymorfizmom A1298C MTHFR génu, avšak tento polymorfizmus neovplyvňuje hladinu homocysteínu v plazme [45, 50]. Z ďalších študovaných génov, ktorých produkty by mohli ovplyvniť metylačný cyklus prostredníctvom remetylácie (MTR, MTRR, BHMT, BHMT2) alebo transulfurácie homocysteínu (CBS), bol za genetický rizikový faktor pre vznik NTDs označený len MTRR gén (reduktáza metionín syntázy), konkrétne polymorfizmus A66G [51].
Treťou veľkou študovanou skupinou sú gény kódujúce tie enzýmy metabolického cyklu folátov, ktoré sú potrebné pre de novo syntézu purínov a pyrimidínov a teda aj DNA biosyntézu. So zvýšeným rizikom vzniku NTDs súvisí polymorfizmus G1958A génu MTHFD1 pre trojfunkčný enzým cytoplazmy metylén-tetrahydrofolát dehydrogenázu (MTHFD, označuje sa aj ako C1THF syntáza) [52]. Následkom je redukcia syntézy MTHFD a biosyntézy purínov. Tento efekt môže byť umocnený súčasným výskytom polymorfizmu génu MTHFD1 v promótorovej oblasti [53].
KYSELINA LISTOVÁ V PRIMÁRNEJ PREVENCII NTDs – SKUTOČNOSŤ ČI MÝTUS?
Prvé výskumy s „embryoprotektívnymi“ vitamínmi uskutočnil profesor Smithells, ktorý už v roku 1976 zaznamenal nižšie hladiny niektorých vitamínov v krvi tých žien, ktorým sa narodilo dieťa s NTDs [30]. Následne uskutočnil vo Veľkej Británii štúdiu, ktorej sa zúčastnili ženy, ktoré už v minulosti mali plod alebo dieťa s NTDs a plánovali ďalšiu graviditu. Kým v skupine žien, ktoré užívali pred plánovaným počatím multivitamínové preparáty (s obsahom 0,36 mg kyseliny listovej) sa narodilo dieťa s NTDs v 0,7 %, v skupine žien, ktoré vitamíny neužívali, to bolo až 5,2 % (pozn. v prípade ak sa v rodine už vyskytol plod/dieťa s NTDs, pravdepodobnosť opakovaného výskytu je 10-násobne vyššia – v tom čase bola incidencia NTDs vo Veľkej Británii 0,5 %, teda v kontrolnej skupine žien sa očakával výskyt NTDs na úrovni 5 %). Tým sa potvrdila embryoprotektívna úloha multivitamínových preparátov s obsahom kyseliny listovej pri opakovanej tehotnosti žien, ktoré už mali plod alebo dieťa s NTDs [54, 55].
Po prvých pozitívnych informáciách uskutočnila anglická organizácia Medical Research Council medzinárodnú dvojito slepú štúdiu, na ktorej sa podieľalo 7 štátov. Štúdie sa zúčastnilo 1195 žien s potvrdeným plodom/dieťaťom s NTDs v predchádzajúcej tehotnosti, ktoré plánovali ďalšie dieťa. Štúdia sa uzavrela v apríli 1991 s konštatovaním, že vysoké dávky kyseliny listovej znižujú riziko opätovného výskytu NTDs v rodine až o 71 % [12].
Otázne ostalo, či je kyselina listová účinná aj v primárnej prevencii NTDs, teda u tých žien, u ktorých sa plod s NTDs objaví prvýkrát. Túto otázku zodpovedali ako prví Maďari pod vedením profesora Czeizela, ktorí uskutočnili štúdiu s účasťou vyše 5 tisíc žien. Kým časť žien dostávala multivitamínové preparáty s obsahom 0,8 mg kyseliny listovej, druhá skupina žien užívala ako placebo minerálne látky s vitamínom C. Ako dokumentuje obrázok 2, táto štúdia podala jednoznačný dôkaz o tom, že užívanie kyseliny listovej v peri-koncepčnom období dokáže výrazne znížiť riziko výskytu NTDs [13].
![Dizajn štúdie Czeizela a Dudása [13], ktorá ako prvá poukázala na to, že pri užívaní multivitamínových preparátov s obsahom 0,8 mg kyseliny listovej dochádza k redukcii rizika vzniku NTDs aj v rámci primárnej prevencie.](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/4705036bef4ebc54c2fb0672721c35fd.png)
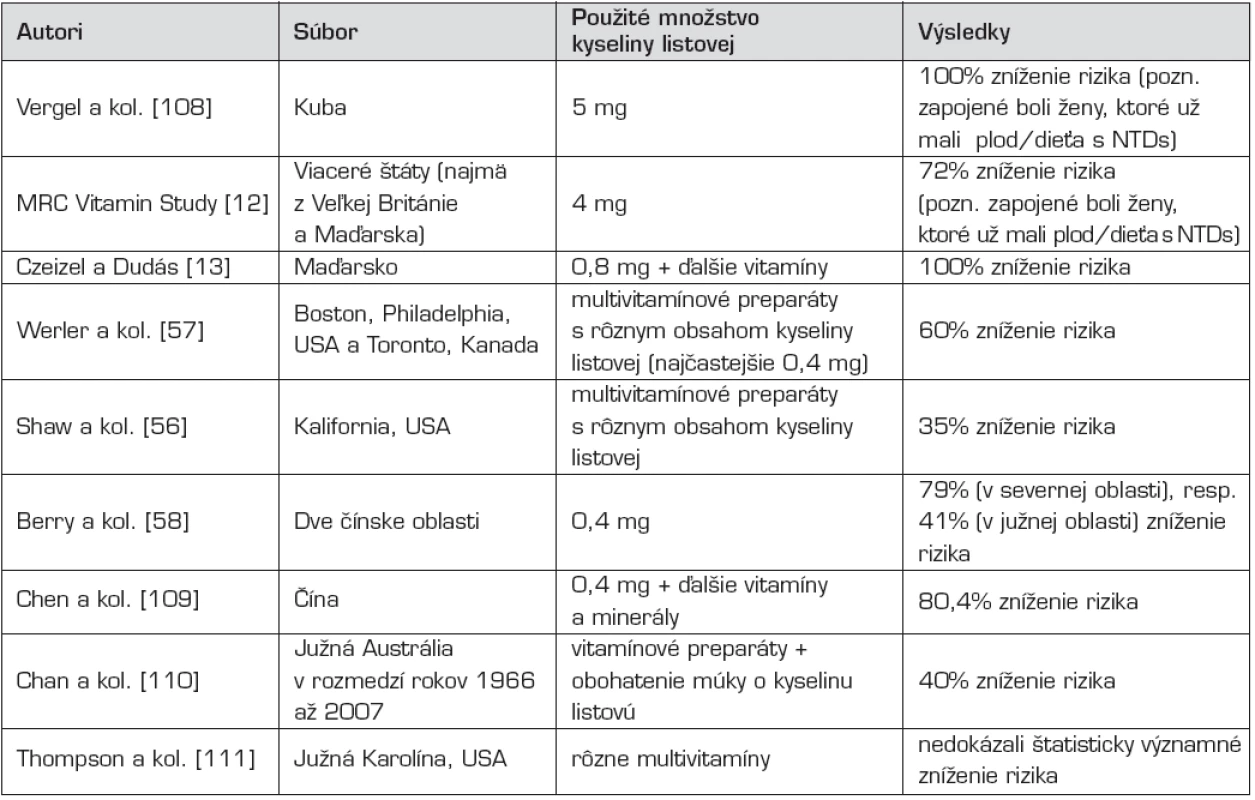
Po týchto pilotných štúdiách sa uskutočnilo veľké množstvo ďalších, ktoré potvrdili embryoprotektívny účinok kyseliny listovej (tab. 1). Ich výsledky sú však značne odlišné. Pri retrospektívnych, dotazníkových štúdiách [napr. 56, 57] sú výsledné percentuálne zníženia rizika vzniku NTDs značne nižšie, ako pri ostatných štúdiách, kde autori prospektívne sledovali ženy užívajúce vitamínové preparáty [napr. 13, 58]. Pri posledne menovaných štúdiách je predpoklad, že ženy poučené pred uskutočnením výskumu pravidelnejšie užívajú zadarmo poskytnuté výživové doplnky.
KYSELINA LISTOVÁ A OSTATNÉ VRODENÉ CHYBY
Naďalej je otázny protektívny vplyv kyseliny listovej vo vzťahu k iným vrodeným vývinovým chybám. Maďarská randomizovaná klinická štúdia preukázala štatisticky významný pokles vrodených chýb obličiek, srdca, končatín a vrodenej stenózy pyloru žalúdka po peri-koncepčnom užívaní multivitamínových preparátov [59–61]. Na protektívny efekt kyseliny listovej vo vzťahu k vrodeným chybám srdca poukazujú aj Van Beynum a kol. [62]. Vo vyše 10-ročnej štúdii zaznamenali zníženie rizika vzniku vrodených chýb srdca o 18 % (pri defekte priehradiek srdca až o 38 %). Žiaľ, zníženie počtu viacnásobných vrodených chýb (kombinácia anomálií dvoch a viacerých rôznych orgánov u toho istého jedinca) sa po užívaní kyseliny listovej nepreukázalo [63].
Pred takmer 30 rokmi doktorka Tolarová poukázala na ochranný vplyv vysokých dávok kyseliny listovej (10 mg denne) pri opakovanom výskyte rázštepu pery a/alebo rázštepu podnebia [64]. Ďalšie štúdie však tento ochranný vplyv pri užívaní fyziologických dávok (do 0,8 mg denne) kyseliny listovej nepotvrdili [napr. 1, 65]. Preto je účinok nedostatku/vplyvu kyseliny listovej na vývin pery a podnebia stále otázny [66]. Czeizel a kol. [67] predpokladajú, že v prevencii rázštepov pery a/alebo podnebia môžu byť účinné len mimoriadne vysoké dávky kyseliny listovej (nad 6 mg denne) a len v kritickom období vývinu podnebia.
ĎALŠIE VPLYVY KYSELINY LISTOVEJ NA PRENATÁLNY A POSTNATÁLNY VÝVIN DIEŤAŤA
Vplyv užívania kyseliny listovej u tehotných žien sa v posledných rokoch skúmal z rôznych aspektov. Zaujímavo vyznieva asociácia medzi peri-koncepčným užívaním kyseliny listovej a viacnásobnou graviditou. Kým Li a kol. [68] v skupine takmer štvrť milióna čínskych žien užívajúcich kyselinu listovú nezistili nárast výskytu viacplodovej gravidity, ďalšie tri výskumy poukazujú v priemere o 40 % nárast pravdepodobnosti narodenia dvojičiek [69–71]. Ericson a kol. [71] sa zároveň zamýšľajú, či pri dokázanej kauzalite medzi zvýšeným výskytom dvojčiat a užívaním kyseliny listovej nie je riziko vzniku komplikácií pri viacnásobnej gravidite väčšie ako samotné riziko vývinu vrodených chýb, najmä v geografických oblastiach s nízkym výskytom NTDs.
Dlhodobé užívanie kyseliny listovej znižuje riziko predčasného pôrodu (najmä pri jej užívaní počas tretieho trimestra) [72] a znižuje riziko narodenia hypotrofického novorodenca a novorodenca s nízkou pôrodnou hmotnosťou u fajčiarok [73]. Zvýšená hladina homocysteínu v krvi matky, ktorú kyselina listová pomáha znižovať, môže zohrávať kľúčovú úlohu pri vaskulopatiách placenty a predčasnom pretrhnutí plodových obalov [72, 74, 75].
Deti, ktorých matky peri-koncepčne užívali kyselinu listovú, sa v postnatálnom období neodlišujú v somatickom ani mentálnom vývine od kontrolnej skupiny [76]. V postnatálnom období sa však u týchto detí vyskytujú menej často nádory z nervového tkaniva, najmä nádory CNS, v porovnaní s kontrolnou skupinou, ktorých matky kyselinu listovú neužívali [77]. Presný mechanizmus vplyvu prenatálneho užívania kyseliny listovej na postnatálny vznik nádorov CNS nie je doposiaľ známy.
VEDOMOSTI VEREJNOSTI O KYSELINE LISTOVEJ
Ray a kol. [78] sa zamerali na mieru užívania kyseliny listovej tabletovou formou u žien v reprodukčnom veku v rôznych štátoch sveta. Našli výrazné výkyvy medzi jednotlivými štátmi v užívaní kyseliny listovej v pred-koncepčnom období (od 0,9 % v severnom Izraeli až do 49 % v kanadskom Vancouveri) aj v peri-koncepčom období (od 0,5 % na talianskej Sicílii až po 52 % v Holandsku).
Vedomosti lekárov o embryoprotektívnom účinku kyseliny listovej sú na veľmi dobrej úrovni. V celosvetovom meradle 91 % gynekológov a 56 % urológov má dostatočné informácie o význame peri-koncepčného užívania kyseliny listovej [79]. Podobné prieskumy vedomostí o kyseline listovej medzi širokou laickou verejnosťou nie sú až také optimistické. Zaujímavá je rozsiahla štúdia Pötzscha a kol. [80] realizovaná v Nemecku na vzorke vyše 4 tisíc študentov vo veku od 15 do 21 rokov. Zarážajúce sú výsledky týkajúce sa prijímania kyseliny listovej prirodzenou formou: len polovica z opýtaných denne konzumuje ovocie a len tretina zeleninu. Z týchto študentov 61 % už o kyseline listovej počulo, avšak len 4,5 % vedelo, že sa jedná o vitamín a len 0,7 % malo vedomosti o embryoprotektívnom účinku kyseliny listovej! Gjergja a kol. [81] urobili podobný výskum medzi tehotnými ženami v Chorvátsku. Napriek tomu, že viac ako 75 % z opýtaných žien graviditu vopred plánovalo, len 14 % z nich užívalo kyselinu listovú v peri-koncepčnom období. Podobné výsledky priniesla aj maďarská štúdia Paulika a kol. [82], v ktorej až vyše 83 % žien plánovalo počatie, avšak len 31 % z opýtaných užívalo pred otehotnením kyselinu listovú. Z uvedených európskych štúdií vidieť (v databázach PubMed/Medline alebo Web of Science neexistujú podobné údaje z českej alebo slovenskej populácie, výnimkou je práca Rambouskovej a kol. [83], ktorá sa zameriava najmä na rómsku subpopuláciu), že relatívne nízke percento žien v reprodukčnom veku prijíma odporúčané denné množstvo kyseliny listovej. Aj napriek tomu, že doteraz prezentované výsledky výskumov prinášajú istú nádej v možnosti znižovania počtu detí narodených s rôznymi VVCh, tento literárny prehľad upozorňuje na dlhú cestu implementácie výsledkov výskumu do každodenného života.
ZÁVEREČNÉ ODPORÚČANIA K UŽÍVANIU KYSELINY LISTOVEJ
Keďže embryoprotektívny účinok kyseliny listovej sa dostaví len v prípade, ak je už počas raného vývinu zárodku v krvi matky žiadané množstvo kyseliny listovej, je dôležité, aby žena už pred plánovaným počatím myslela na túto skutočnosť. Žiaľ, až vyše 50 % gravidít na Slovensku nie je plánovaných, a preto nemusí byť zdravotný stav žien v období počatia optimálny [6, 84]. Okrem toho informovanosť širokej verejnosti a najmä mladých žien o dôležitosti príjmu kyseliny listovej pred plánovaným otehotnením a o jej potenciálnom protektívnom účinku na vyvíjajúci sa zárodok nie je dostatočná.
Zvýšený príjem kyseliny listovej v peri-koncepčnom období je možné docieliť troma rôznymi spôsobmi [29]:
- zvýšením príjmu potravín bohatých na kyselinu listovú,
- suplementáciou v tabletovej forme (tablety kyseliny listovej alebo multivitamínové prípravky),
- fortifikovanými potravinami (napr. múkou obohatenou o kyselinu listovú).
Ak sa pristúpi k suplementácii kyseliny listovej formou vitamínových preparátov, nastáva otázka, aké je jej denné adekvátne množstvo. V prvých štúdiách sa denná dávka často počítala v miligramoch, dnes sú to už desatiny miligramu. Vo väčšine súčasných štúdií sa podáva denná dávka 0,4 mg kyseliny listovej. Paradoxne nie je toto množstvo definované na základe vedeckých výsledkov, ale je ovplyvnené skutočnosťou, že väčšina multivitamínových preparátov obsahuje práve 0,4 mg kyseliny listovej [85]. Národná akadémia vied Spojených štátov amerických považuje za potrebné diferencovať odporúčanú dennú dávku kyseliny listovej na základe toho, či sú dôvody jej užívania preventívne (do 1 mg) alebo terapeutické, napr. pri megaloblastovej anémii (nad 1 mg) [86]. Z toho vyplýva, že denný príjem kyseliny listovej by u zdravej ženy nemal presiahnuť 1 mg, ani po započítaní prirodzene stravou prijatého množstva tohto vitamínu. Priemerný príjem kyseliny listovej stravou je u Európana 0,2 mg denne, teda tabletovou formou by denný príjem nemal presiahnuť 0,8 mg/denne. Väčšina odborných spoločností (napr. americké organizácie Center for Disease Control and Prevention alebo United States Public Health Service) odporúča všetkým ženám vo fertilnom veku umelo prijímať kyselinu listovú v dávke 0,4 mg denne (400 μg/deň) k vyváženej, na kyselinu listovú bohatej strave bez ohľadu na to, či plánujú tehotenstvo alebo nie [14]. Napriek tomu sú aj odborníci, ktorí ženám v peri-koncepčnom období odporúčajú prijímať maximálnu doporučenú dennú dávku, teda 0,8 mg denne [85, 87].
Ďalšou možnou cestou zvýšenia príjmu kyseliny listovej je jej umelé pridávanie do múky a múčnych výrobkov (fortifikácia múky) [88]. V USA či Kanade sa tým docielilo zvýšenie priemerného denného príjmu kyseliny listovej u obyvateľstva o 0,1 až 0,15 mg [89], následne v Kanade došlo k zníženiu počtu detí narodených s NTDs o 50 až 70 % [90, 91]. Celoplošné obohatenie múky je pravdepodobne účinnejšie ako reklamné kampane zamerané na dobrovoľný príjem kyseliny listovej ženami v reprodukčnom veku. Dôkazom je Omán, kde od roku 1990 síce prebehla masívna kampaň zameraná na dobrovoľnú suplementáciu kyseliny listovej, avšak od roku 1996 tu pristúpili k obohateniu múky kyselinou listovou. Incidencia NTDs sa v rokoch 1991 až 1996 pohybovala do 4,03 na tisíc pôrodov, po obohatení múky kyselinou listovou od roku 1996 incidencia klesla na 0,29 na tisíc pôrodov [92].
RIZIKÁ UŽÍVANIA KYSELINY LISTOVEJ
Výhody z dokázanej zníženej incidencie plodov s NTDs po fortifikácii múky kyselinou listovou však musia byť zvažované v súvislosti s potenciálnym rizikom kyseliny listovej ako promótora v procese karcinogenézy. Uvedenú hypotézu podporujú viaceré predklinické ako i klinické štúdie, hoci výsledky nedovoľujú jednoznačné klinické závery [93]. Klinickou štúdiou sa preukázala štatisticky vyššia incidencia karcinómu prostaty u mužov suplementovaných kyselinou listovou [94]. Pri kolorektálnom karcinóme sa v metaanalýze síce nedokázal negatívny vplyv kyseliny listovej na riziko vzniku uvedenej malignity, avšak užívanie folátov dlhšie ako 3 roky bolo spojené s vyšším výskytom pokročilých črevných adenómov, známej prekancerózy kolorektálneho karcinómu [95]. Aj keď sa zdá, že ide o dávkovo závislý karcinogénny efekt, bezpečná dávka nie je definovaná. Vyššie riziko malignity je pri umelých prípravkoch kyseliny listovej ako pri suplementácii prírodnými zdrojmi vitamínu [96].
Nakoľko kyselina listová indukuje hemopoézu, jej vysoké dávky môžu prekryť príznaky pernicióznej anémie, čo môže viesť k vzniku neuroanemického syndrómu. Preto je pri podozrení na pernicióznu anémiu vždy potrebné najprv substituovať vitamín B12. Deficitom vitamínu B12 sú ohrození pacienti s nedostatkom vnútorného faktora vylučovaného parietálnymi bunkami žalúdka (napr. chronická gastritída, stavy po gastrektómii), prípadne s patologickými procesmi postihujúcimi ileum. Ani jedno z vyššie uvedených rizík však nehrozí pri užívaní nízkych preventívnych dávok (teda do 1 mg denne).
ANTIEPILEPTIKÁ A KYSELINA LISTOVÁ
Antiepileptiká patria medzi teratogénne pôsobiace liečivá. Podľa americkej Food and Drug Administration klasifikácie bezpečnosti liečiv v gravidite patria viaceré z nich do skupiny D, t. j. liečiv s dokázaným teratogénnym potenciálom u ľudí. Je známe, že až 90 % pacientov liečených fenytoínom, karbamazepínom a barbiturátmi má znížené sérové koncentrácie folátov, čo sa vysvetľuje farmakologickou interakciou s metabolizmom kyseliny listovej. Zrejme aj tento mechanizmus prispieva k teratogénnemu efektu antiepileptík. Preto stratégia prevencie kyselinou listovou je v rizikovej skupine mladých žien s epilepsiou obzvlášť dôležitá [97–100].
Presná odporúčaná dávka kyseliny listovej u žien vo fertilnom veku užívajúcich antiepileptiká nie je jednoznačne definovaná. Podľa Americkej akadémie neurológie sa rutinne odporúča suplementácia kyselinou listovou v dávke 0,4–4 mg/deň u žien vo fertilnom veku liečených antiepileptikami [101, 102]. Novšie odporúčania sa prikláňajú skôr k vyššej dávke kyseliny listovej, až 4–5 mg/deň u aktívne liečených epileptičiek v peri-koncepčnom období [103–105].
Napriek riziku vzniku VVCh sa neodporúča u ženy s epilepsiou prerušiť antiepileptickú liečbu. Dobre známy „rebound fenomén“ (fenomén z vysadenia) ohrozuje pacientku ako aj plod vznikom záchvatu typu grand mal, prípadne status epilepticus. Odporúča sa pokračovať v monoterapii antiepileptikom v čo najnižšej účinnej dávke rozdelenej do viacerých denných dávok pri súčasnom monitorovaní plazmatických hladín liečiva. Žena by mala byť poučená o riziku farmakoterapie, ale i možného závažného dôsledku jej náhleho prerušenia [106].
Súčasné užívanie vyšších dávok kyseliny listovej s antiepileptikami (fenytoín, karbamazepín a barbituráty) môže viesť k urýchleniu metabolizmu obidvoch liečiv a tým k zníženiu ich hladín v krvi. Výsledkom môže byť zlyhanie antiepileptického účinku [107]. Preto môže byť potrebné primerane zvýšiť dávkovanie antiepileptík aj s využitím monitorovania hladín liečiv.
Došlo: 14. 8. 2011
Přijato: 31. 1. 2012
RNDr. Ivan Varga, PhD.
Ústav histológie a embryológie
Lekárska fakulta,
Univerzita Komenského v Bratislave
Sasinkova 4
811 08 Bratislava 1
Slovenská republika
e-mail: ivan.varga@fmed.uniba.sk
Sources
1. Czeizel AE. The primary prevention of birth defects: Multivitamins or folic acid? Int J Med Sci 2004; 1 : 50–61.
2. Mitchell LE. Epidemiology of neural tube defects. Am J Med Genet C Semin Med Genet 2005; 135 : 88–94.
3. Manning N, Archer N. Treatment and outcome of serious structural congenital heart disease. Semin Neonatol 2001; 6 : 37–47.
4. Vojtassák J, Malová J, Demjenová L, et al. Developmental defects and chromosomal aberrations in spontaneous abortions and stillbirths. Gen Physiol Biophys 1999; 18 : 182–188.
5. Šípek A, Horáček J, Gregor V, et al. Neural tube defects in the Czech Republic during 1961–1999: incidences, prenatal diagnosis and prevalences according to maternal age. J Obstet Gynaecol 2002; 22 : 501–507.
6. Behunová J, Podracká L. Rázštepy nervovej trubice – súčasné pohľady na etiopatogenézu a možnosť prevencie kyselinou listovou. Čes-slov Pediat 2008; 63 : 38–46.
7. Copp AJ, Greene NDE. Genetics and development of neural tube defects. J Pathol 2010; 220 : 217–230.
8. Šabová L, Horn F, Drdulová T, et al. Clinical condition of patients with neural tube defects. Rozhl Chir 2010; 89 : 471–477.
9. Horn F, Smrek M, Babala J, et al. Kraniálne defekty neurálnej rúry. Čes Slov Neurol N 2010; 73 : 706–710.
10. Shurtleff DB, Luthy DA, Nyberg DA, et al. Meningomyelocele: managment in utero and post natum. Ciba Found Symp 1994; 181 : 270–286.
11. Hunt GM. The median survival time in open spina bifida. Dev Med Child Neurol 1997; 39 : 568.
12. MRC Vitamin Study Research Group. Prevention of neural tube defects: results of the Medical Research Council vitamin study. Lancet 1991; 338 : 131–137.
13. Czeizel AE, Dudás I. Prevention of the first occurrence of neural-tube defects by periconceptional vitamin supplementation. N Engl J Med 1992; 327 : 1832–1835.
14. Center Disease Control. Recommendations for the use of folic acid to reduce the number of cases of spina bifida and other neural tube defects. MMWR Recomm Rep 1992; 41 : 1–7.
15. Volcik KA, Blanton SH, Kruzel MC, et al. Testing for genetic associations in a spina bifida population: analysis of the HOX gene family and human candidate gene regions implicated by mouse models of neural tube defects. Am J Med Genet 2002; 110 : 203–207.
16. Frey L, Hauser WA. Epidemiology of neural tube defects. Epilepsia 2003; 44 : 4–13.
17. Padmanabhan R. Etiology, pathogenesis and prevention of neural tube defects. Cong Anomal 2006; 46 : 55–67.
18. Padmanabhan R. Scanning-electron-microscopic studies on the pathogenesis of exencephaly and cranioschisis induced in the rat after neural tube closure. Acta Anat (Basel) 1990; 138 : 97–110.
19. Van Allen MI. Multisite neural tube closure in humans. Birth Defects Orig Arctic Ser 1996; 30 : 203–225.
20. Seller MJ, Kalousek DK. Neural tube defects: heterogeneity and homogeneity. Am J Med Genet Suppl 1986; 2 : 77–87.
21. Velie EM, Shaw GM, Malcoe LH, et al. Understanding the increased risk of neural tube defect-affected pregnancies among Mexico-born women in California: immigration and anthropometric factors. Paediatr Perinat Epidemiol 2006; 20 : 219–230.
22. Shepard TH, Brent RL, Friedman JM, et al. Update on new developments in the study of human teratogens. Teratology 2002; 65 : 153–161.
23. Ray JG, Vermeulen MJ, Meier C, Wyatt PR. Risk of congenital anomalies detected during antenatal serum screening in women with pregestational diabetes. QJM 2004; 97 : 651–653.
24. Vašut K, Anděl T, Kolář J. Hypertermia v těhotenství – rizika a možnosti léčby. Prakt Gyn 2004; 6 : 25–27.
25. Moretti ME, Bar-Oz B, Fried S, Koren G. Maternal hyperthermia and the risk for neural tube defects in offspring: systematic review and meta-analysis. Epidemiology 2005; 16 : 216–219.
26. Suarez L, Felkner M, Hendricks K. The effect of fever, febrile illnesses, and heat exposures on the risk of neural tube defects in a Texas-Mexico border population. Birth Defects Res A Clin Mol Teratol 2004; 70 : 815–809.
27. Hoffbrand AV, Weir DG. Historical review. The history of folic acid. Br J Haematol 2001; 113 : 579–589.
28. Mitchell HK, Snell EE, Williams RJ. The concentration of „folic acid“. J Am Chem Soc 1941; 63 : 2284.
29. Šabová L, Kovács L. Kyselina listová a vrodené vývojové chyby. Pediatr Prax 2008; 1 : 36–38.
30. Smithells RW, Sheppard S, Schorah CJ. Vitamin deficiencies and neural tube defects. Arch Dis Child 1976; 51 : 944–949.
31. Johnson WG, Stenroos ES, Heath SC, et al. Distribution of alleles of the methylenetetrahydrofolate reductase (MTHFR) C677T gene polymorphism in familial spina bifida. Am J Med Genet 1999; 87: P407–P412.
32. Finnell R, Spiegelstein O, Wlodarczyk B, et al. DNA methylation in Folbp1 knockout mice supplemented with folic acid during gestation. J Nutr 2002; 132 : 2457S–2461S.
33. Boot MJ, Steegers-Theunissen RPM, Poelmann RE, et al. Folic acid and homocysteine affect neural crest and neuroepithelial cell outgrowth and differentiation in vitro. Dev Dyn 2003; 227 : 301–308.
34. Mathers JC. Reversal of DNA hypomethylation by folic acid supplements: Possible role in colorectal prevention. Gut 2005; 54 : 579–581.
35. Biniszkiewicz D, Girbnau J, Ramsahoye B, et al. Dnmt1 overexpression causes genomic hypermethylation. Loss of imprinting, and embryonic lethality. Mol Cell Biol 2002; 22 : 2124–2328.
36. Jackson M, Krassowska A, Gilbert N, et al. Severe global DNA hypomethylation blocks differentiation and induces histone hyperacetylation in embryonic stem cells. Mol Cell Biol 2004; 24 : 8862–8871.
37. Santos F, Hendrich B, Dean W. Dynamic reprogramming of DNA methylation in the early mouse embryo. Dev Biol 2002; 241 : 172–182.
38. Jackson-Grusby L, Beard C, Possemato R, et al. Loss of genomic methylation causes p53 dependent apoptosis and epigenic deregulation. Nat Genet 2001; 27 : 31–39.
39. Bohnsack BL, Hirschi KK. Nutrient regulation of cell cycle progression. Annu Rev Nutr 2004; 24 : 433–453.
40. Greene NDE, Stanier P, Copp AJ. Genetics of human neural tube defects. Hum Mol Genet 2009; 18: R113–R129.
41. Van der Linden IJ, Afman LA, Heil SG, et al. Genetic variation in genes of folate metabolism and neural-tube defect risk. Proc Nutr Soc 2006; 65 : 204–215.
42. Boyles AL, Billups AV, Deak KL, et al. Neural tube defects and folate pathway genes: Family-based association tests of gene-gene and gene-environment interactions. Environ Health Perspect 2006; 114 : 1547–1552.
43. De Marco P, Calevo M, Moroni A, et al. Reduced folate carrier polymorphism (80A—>G) and neural tube defects. Eur J Hum Genet 2003; 11 : 245–252.
44. O’Leary VB, Pangilinan F, Cox C, et al. Reduced folate carrier polymorphisms and neural tube defect risk. Mol Genet Metab 2006; 87 : 364–369.
45. Van der Put NMJ, Steegers-Theunissen RPM, Frosst P, et al. Mutated methylenetetrahydrofolate reductase as a risk factor for spina bifida. Lancet 1995; 346 : 1070–1071.
46. Shields DC, Kirke PN, Mills JL, et al. The ‘thermolabile’ variant of methylenetetrahydrofolate reductase and neural tube defects: an evaluation of genetic risk and the relative importance of the genotypes of the embryo and the mother. Am J Hum Genet 1999; 64 : 1045–1055.
47. Behunova J, Klimcakova L, Zavadilikova E, et al. Methylenetetrahydrofolate reductase gene polymorphisms and neural tube defects epidemiology in the Slovak population. Birth Defects Res A Clin Mol Teratol 2010; 88 : 695–700.
48. Raslova K, Bederova A, Gasparovic J, et al. Effect of diet and 677 C—> T 5,10-methylenetetrahydrofolate reductase genotypes on plasma homocyst(e)ine concentrations in Slovak adolescent population. Physiol Res 2000; 49 : 651–658.
49. Stegmann K, Ziegler A, Ngo ET, et al. Linkage disequilibrium of MTHFR genotypes 677C/T-1298A/C in the German population and association studies in probands with neural tube defects (NTD). Am J Med Genet 1999; 87 : 23–29.
50. Botto LD, Yang Q. 5,10-methylenetetrahydrofolate reductase gene variants and congenital anomalies: a HuGE review. Am J Epidemiol 2000; 151 : 862–877.
51. Zhu H, Wicker NJ, Shaw GM, et al. Homocysteine remethylation enzyme polymorphisms and increased risks for neural tube defects. Mol Genet Metab 2003; 78 : 216–221.
52. Brody LC, Conley M, Cox C, et al. A polymorphism, R653Q, in the trifunctional enzyme methylenetetrahydrofolate dehydrogenase/methenyltetrahydrofolate cyclohydrolase/formyltetrahydrofolate synthetase is a maternal genetic risk factor for neural tube defects: Report of the Birth Defects Research Group. Am J Hum Genet 2002; 71 : 1207–1215.
53. Carroll N, Pangilinan F, Molloy AM, et al. Analysis of the MTHFD1 promoter and risk of neural tube defects. Hum Genet 2009; 125 : 247–256.
54. Smithells RW, Sheppard S, Schorah CJ, et al. Possible prevention of neural tube defects by periconceptional vitamin supplementation. Lancet 1980; 1 : 339–340.
55. Smithells RW, Sheppard S, Wild J, Schorah CJ. Prevention of neural tube defects recurrences in Yorkshire: final report. Lancet 1989; 2 : 498–499.
56. Shaw GM, Schaffer D, Velie EM, et al. Periconceptional vitamin use, dietary folate, and the occurrence of neural tube defects. Epidemiology 1995; 6 : 219–226.
57. Werler MM, Shapiro S, Mitchell AA. Periconceptional folic acid exposure and risk of occurrent neural tube defects. JAMA 1993; 269 : 1257–1261.
58. Berry RJ, Li Z, Erickson JD, Li S, et al. Prevention of neural-tube defects with folic acid in China. China-U.S. collaborative project for neural tube defect prevention. N Engl J Med 1999; 341 : 1485–1490.
59. Czeizel AE. Reduction of urinary tract and cardiovascular defects by periconceptional multivitamin supplementation. Am J Med Genet 1996; 62 : 179–183.
60. Czeizel AE. Periconceptional folic acid containing multivitamin supplementation. Eur J Obstet Gynecol Reprod Biol 1998; 78 : 151–161.
61. Mašková J, Šípek A, Kollár P. A population-based control study of congenital abormalities and medication use during pregnancy using the Czech National Register of Congenital Abnormalities. Cent Eur J Med 2011; 6 : 435–441.
62. Van Beynum IM, Kapusta L, Bakker MK, et al. Protective effect of periconceptional folic acid suppements on the risk of congenital heart defects: a registry-based case-control study in the northern Netherlands. Eur Heart J 2010; 31 : 464–471.
63. Czeizel AE, Medveczky E. Periconceptional multivitamin supplementation and multimalformed offspring. Obstet Gynecol 2003; 102 : 1255–1261.
64. Tolarova M. Periconceptional supplementation with vitamins and folic acid to prevent recurrence of cleft lip. Lancet 1982; 2 : 217.
65. Czeizel AE, Dobo M, Vargha P. Hungarian cohort controlled trial of periconceptional multivitamin supplementation shows a reduction in certain congenital anomalies. Birth Defects Res 2004; 70 : 853–861.
66. Wehby GL, Murray JC. Folic acid and orofacial clefts: a review of the evidence. Oral Dis 2010; 16 : 11–19.
67. Czeizel AE, Tímár L, Sárközi A. Dose-dependent effect of folic acid on the prevention of orofacial clefts. Pediatrics 1999; 104 : 1–7.
68. Li Z, Gindler J, Wang H, et al. Folic acid supplements during early pregnancy and likelihood of multiple births: a population-based cohort study. Lancet 2003; 361 : 380–384.
69. Werler MM, Cragan JD, Wasserman CR, et al. Multivitamin supplementation and multiple births. Am J Med Genet 1997; 71 : 93–96.
70. Czeizel AE, Métneki J, Dudás I. The higher rate of multiple births after periconceptional multivitamin supplementation: an analysis of causes. Acta Genet Med Gemellol (Roma) 1994; 43 : 175–184.
71. Ericson A, Källén B, Aberg A. Use of multivitamins and folic acid in early pregnancy and multiple births in Sweden. Twin Res 2001; 4 : 63–66.
72. Czeizel AE, Puhó EH, Langmar Z, et al. Possible association of folic acid supplementation during pregnancy with reduction of preterm birth: a population-based study. Eur J Obstet Gynecol Reprod Biol 2010; 148 : 135–140.
73. Sram RJ, Binkova B, Lnenickova Z, et al. The impact of plasma folate levels of mothers and newborns on intrauterinne growth retardation and birth weight. Mut Res 2005; 591 : 302–310.
74. Van der Molen EF, Verbruggen B, Nováková I, et al. Hyperhomocysteinemia and other thrombotic risk factors in women with placental vasculopathy. Br J Obstet Gynaecol 2000; 107 : 785–691.
75. Ferguson SE, Smith GN, Walker MC. Maternal plasma homocysteine levels in women with preterm premature rupture of membranes. Med Hypotheses 2001; 56 : 85–90.
76. Dobó M, Czeizel AE. Long-term somatic and mental development of children after periconceptional multivitamin supplementation. Eur J Pediatr 1998; 157 : 719–723.
77. Ortega-García JA, Ferrís-Tortajada J, Claudio L, et al. Case control study of periconceptional folic acid intake and nervous system tumors in children. Childs Nerv Syst 2010; 26 : 1727–1733.
78. Ray JG, Singh G, Burrows RF. Evidence for suboptimal use of periconceptional folic acid supplements globally. BJOG 2004; 111 : 399–408.
79. Kondo A, Kamihira O, Gotoh M, et al. Folic acid prevents neural tube defects: international comparison of awareness among obstetricians/gynecologists and urologists. J Obstet Gynaecol Res 2007; 33 : 63–67.
80. Pötzsch S, Hoyer-Schuschke J, Seelig M, Steinbicker V. Knowledge among young people about folic acid and its importance during pregnancy: a survey in the Federal State of Saxony-Anhalt (Germany). J Appl Genet 2006; 47 : 187–190.
81. Gjergja R, Stipoljev F, Hafner T, et al. Knowledge and use of folic acid in Croatian pregnant women – a need for health care education initiative. Reprod Toxicol 2006; 21 : 16–20.
82. Paulik E, Császár J, Kozinszky Z, Nagymajtényi L. Preconceptional and prenatal predictors of folic acid intake in Hungarian pregnant women. Eur J Obstet Gynecol Reprod Biol 2009; 145 : 49–52.
83. Rambousková J, Dlouhý P, Krízová E, et al. Health behaviors, nutritional status, and anthropometric parameters of Roma and non-Roma mothers and their infants in the Czech Republic. J Nutr Educ Behav 2009; 41 : 58–64.
84. Behunová J, Podracká Ľ. Prevencia rázštepov nervovej trubice alebo, ako možno znížiť výskyt vrodených anomálii CNS? Detský Lekár 2006; 2 : 19–22.
85. Czeizel AE. Folic acid: a public - -health challenge. Lancet 2006; 367 : 2056.
86. US National Academy of Sciences. Dietary reference intakes for thiamin, riboflavin, niacin, vitamin B6, folate, vitamin B12, pantothenic acid, biotin, and choline – a report of the Standing Committee on the Scientific Evaluation of Dietary Reference Intakes and its Panel on Folate, Other B Vitamins, and Choline and Subcommittee on Upper Reference Levels of Nutrients, Food and Nutrition Board, Institute of Medicine. Washington: National Academy Press, 1998 : 1–567.
87. Simpson JL, Bailey LB, Pietrzik K, et al. Micronutrients and women of reproductive potential: required dietary intake and consequences of dietary deficiency or excess. Part I – folate, vitamin B12, vitamin B6. J Matern Fetal Neonatal Med 2010; 23 : 1323–1343.
88. Almeida LC, Cardoso MA. Recommendations for folate intake in women: implications for public health strategies. Cad Saúde Pública Rio de Janeiro 2010; 26 : 2011–2026.
89. Berry RJ, Bailey L, Mulinare J, et al. Fortification of flour with folic acid. Food Nutr Bull 2010; 31: S22–S35.
90. Persad VL, Van den Hof MC, Dubé JM, Zimmer P. Incidence of open neural tube defects in Nova Scotia after folic acid fortification. CMAJ 2002; 167 : 241–245.
91. Liu S, West R, Randell E, et al. A comprehensive evaluation of food fortification with folic acid for the primary prevention of neural tube defects. BMC Pregnancy Childbirth 2004; 4 : 20.
92. Alasfoor D, Elsayed MK, Mohammed AJ. Spina bifida an birth outcome before and after fortification of flour with iron and folic acid in Oman. East Mediterr Health J 2010; 16 : 533–538.
93. Schneiderka P. Homocysteinémia a folatémia v éře fortifikace folátem. Klin Biochem Metab 2008; 16 : 228–231.
94. Figueiredo JC, Grau MV, Haile RW, et al. Folic acid and risk of prostate cancer: results from a randomized clinical trial. J Natl Cancer Inst 2009; 101 : 432–435.
95. Fife J, Raniga S, Hider PN, et al. Folic acid supplementation and colorectal cancer risk: a meta-analysis. Colorectal Dis 2011; 13 : 132–137.
96. Kim YI. Folate and colorectal cancer: an evidence-based critical review. Mol Nutr Food Res 2007; 51 : 267–292.
97. Werler MM, Ahrens KA, Bosco JLF, et al. Use of antiepileptic medications in pregnancy in relation to risks of birth defects. Ann Epidemiol 2011; 21 : 842–850.
98. Ogawa Y, Kaneko S, Otani K, et al. Serum folic acid levels in epileptic mothers and their relationship to congenital malformations. Epilepsy Res 1991; 8 : 75–78.
99. Sander JWAS, Patsalos PN. An assessment of serum and red blood cell folate concentrations in patients with epilepsy on lamotrigine therapy. Epilepsy Res 1992; 13 : 89–92.
100. Kishi T, Fujita N, Eguchi T, et al. Mechanism for reduction of serum folate by antiepileptic drugs during prolonged therapy. J Neurol Sci 1997; 145 : 109–112.
101. Quality Standards Subcommittee of the American Academy of Neurology. Practice Parameter: management issues for women with epilepsy (summary statement). Neurology 1998; 51 : 944–948.
102. Zahn CA, Morell ML, Collins SD, et al. Management issues for women with epilepsy: a review of the literature. Neurology 1998; 51 : 949–956.
103. Wilson RD, Johnson JA, Wyatt P, et al. Pre-conceptional vitamin/folic acid supplementation 2007: the use of folic acid in combination with multivitamin supplement for the prevention of neural tube defects and other congenital anomalies. Obstet Gynaecol Can 2007; 29 : 1003–1026.
104. Goh YI, Bollano E, Einarson TR, Koren G. Prenatal multivitamin supplementation and rates of congenital anomalies: a meta-analysis. J Obstet Gynaecol Can 2006; 28 : 680–689.
105. Harden CL, Meador KJ, Pennell, PB, et al. Practice parameter update: management issues for women with epilepsy-focus on pregnancy (an evidence-based review): teratogenesis and perinatal outcomes: report of the Quality Standards Subcommittee and Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology and American Epilepsy Society. Neurology 2009; 73 : 133–141.
106. Kriška M, Ambrózy E, Bada V, et al. Memorix klinickej farmakológie a liekov. Bratislava: Slovak Academy Press, 2006 : 1–610.
107. Súhrn charakteristických vlastností lieku Acidum folicum Léčiva. Online: http://www.adcc.sk/web/humanne-lieky/spc/acidum-folicum-leciva-spc-30013.html.
108. Vergel RG, Sanchez LR, Heredero BL, et al. Primary prevention of neural tube defects with folic acid supplementation: Cuban experience. Prenat Diagn 1990; 10 : 149–152.
109. Chen G, Song X, Ji Y, et al. Prevention of NTDs with periconceptional multivitamin supplementation containing folic acid in China. Birth Defects Res A Clin Mol Teratol 2008; 82 : 592–596.
110. Chan AC, van Essen P, Scott H, et al. Folate awareness and the prevalence of neural tube defects in South Australia, 1966–2007. Med J Aust 2008; 189 : 566–569.
111. Thompson SJ, Torres ME, Stevenson RE, et al. Periconceptional multivitamin folic acid use, dietary folate, total folate and risk of neural tube defects in South Carolina. Ann Epidemiol 2003; 13 : 412–418.
Labels
Neonatology Paediatrics General practitioner for children and adolescentsArticle was published in
Czech-Slovak Pediatrics

2012 Issue Suppl 1
- What Effect Can Be Expected from Limosilactobacillus reuteri in Mucositis and Peri-Implantitis?
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
- Extracorporeal Membrane Oxygenation – trocha historie, současnost, ale hlavně budoucnost
- ECMO (extrakorporální membránová oxygenace) v léčbě respiračního a oběhového selhání u novorozenců a dětí
- ECMO (extrakorporální membránová oxygenace) v léčbě respiračního a oběhového selhání u novorozenců a dětí – kazuistiky
-
Terminálne zlyhanie obličiek u detí na Slovensku
Epidemiológia z Európskej perspektívy - Diagnostika a léčba dětské katarakty
- Demyelinizační změny mozku u dětí s Crohnovou nemocí
- Cizí těleso v gastrointestinálním traktu (kazuistika) a současná diagnostická a terapeutická doporučení
- Syndrom týrané rodiny dítětem v dětské obezitologické ambulanci
- Kyselina listová a poruchy uzatvárania neurálnej rúry – od minulosti po súčasnosť
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Diagnostika a léčba dětské katarakty
- Cizí těleso v gastrointestinálním traktu (kazuistika) a současná diagnostická a terapeutická doporučení
- ECMO (extrakorporální membránová oxygenace) v léčbě respiračního a oběhového selhání u novorozenců a dětí
- Kyselina listová a poruchy uzatvárania neurálnej rúry – od minulosti po súčasnosť
