Neurokristopatie: Význam poruchy vývinu buniek neurálnej lišty pri vzniku vrodených chýb na príklade Hirschsprungovej choroby
Neurocristopathies: The role of neural crest-derived cells in pathogenesis of congenital anomalies in the example of Hirschsprung´s disease
Hirschsprung´s disease (HSCR) is the most common congenital gut motility disorder and is characterized by a lack of nerve ganglia (aganglionosis) in a variable length of aboral gut. Hirschsprung´s disease, as a neurocristopathy, has a strong association with numerous other congenital anomalies, syndromes and also functional abnormalities. In our group of examined patients with HSCR the incidence of associated congenital anomalies was 26.1%. But if we also add malfunctions (hypothyroidism, primary defects in cellular immunity, neurological and psychomotor deficit), the rate of the patients with HSCR with additional defects achieves more than 50%. Most of these anomalies are based on disrupt development, migration or differentiation of multipotent neural crest cells during embryogenesis. We describe an embryological relationship among disrupted development of enteric nervous system, and developmental anomalies of the thymus and urinary system, congenital hypothyroidism, congenital heart defects, Down syndrome (trisomy 21) or craniofacial abnormalities. Our results show that Hirschsprung´s disease is not only a simple lack of neurons in aboral part of gut, but associated anomalies and malfunctions may affect numerous organs and may influence many physiological processes.
Key words:
Hirschsprung´s disease, neural crest, cellular immunity, congenital genito-urinary anomalies, congenital hypothyroidism, anorectal malformations, Down syndrome, congenital heart defect
Authors:
T. Sláviková 1; L. Zábojníková 2; Š. Polák 1; I. Varga 1
Authors‘ workplace:
Ústav histológie a embryológie LFUK, Bratislavaprednosta doc. MUDr. Š. Polák, CSc.
1; Klinika detskej chirurgie, DFNsP a LFUK, Bratislavaprednosta doc. MUDr. J. Trnka, CSc.
2
Published in:
Čes-slov Pediat 2013; 68 (5): 319-330.
Category:
Original Papers
Overview
Hirschsprungova choroba vzniká narušením vývinu, migrácie alebo diferenciácie multipotentných buniek neurálnej lišty (tzv. neurokristopatia), ktoré sa v základe čreva diferencujú na nervové gangliá. Retrospektívne sme analyzovali 130 detských pacientov s morbus Hirschsprung a u vyše 26 % sme zistili ďalšie pridružené morfologické vrodené chyby. Ak k týmto morfologickým anomáliám pripočítame aj nálezy narušenia funkcie štítnej žľazy (kongenitálna hypotyreóza), týmusu (primárne defekty v bunkovej imunite) a neurologické a psychomotorické deficity, vyše polovica pacientov skúmaného súboru mala pridruženú vrodenú anomáliu. Väčšina týchto anomálií sa dá embryologicky vysvetliť narušeným vývinom neurálnej lišty, ktorej multipotentné bunky sú zdrojom širokej palety rôznych bunkových populácií v rôznych častiach tela.
V práci opisujeme vzťah medzi vývinom nervových ganglií v čreve a vrodenými chybami týmusu, močovo-pohlavnej sústavy, kongenitálnou hypotyreózou, vrodenými chybami srdca, Downovým syndrómom, kraniofaciálnymi anomáliami a ďalšími. Z našich výsledkov vyplýva, že na Hirschsprungovu chorobu sa neslobodno pozerať len ako na „jednoduchú“ aganglionózu čreva. Vždy treba pátrať aj po ďalších vrodených chybách a malfunkciách orgánov, ktorých embryonálny vývin je ovplyvnený bunkami neurálnej lišty.
Kľúčové slová:
Hirschsprungova choroba, neurálna lišta, bunková imunita, vrodené chyby močovo-pohlavnej sústavy, kongenitálna hypotyreóza, anorektálne malformácie, Downov syndróm, vrodené chyby srdca
Úvod
Morbus Hirschsprung je najčastejšia vrodená porucha motility čreva. Je charakterizovaná neprítomnosťou autonómnych nervových ganglií (aganglionóza) vo variabilne dlhej časti hrubého čreva [1]. Zvyčajne postihuje len aborálny segment hrubého čreva (colon sigmoideum a rectum), v niektorých prípadoch však postihnuté môže byť aj celé hrubé črevo, prípadne až ileum. Následkom chýbajúcich nervových ganglií v postihnutej časti čreva nie je svalovina schopná relaxácie, je trvalo kontrahovaná a tento úsek preto nie je schopný prenášať peristaltické vlny. Konečným dôsledkom je nepriechodnosť čreva, akumulácia obsahu čreva nad aganglionárnym úsekom, pričom tu vzniká tzv. „megacolon“ [2, 3].
Normálna motilita čreva je daná koordinovanou súhrou troch rôznych bunkových populácií steny čreva:
- hladká svalovina,
- Cajalove intersticiálne bunky s „pacemaker“-ovou aktivitou,
- autonómne nervové gangliá a ich nervové vlákna usporiadané do podsliznicovej nervovej spleti (plexus submucosus Meissneri) a nervovej spleti uloženej vo svalovej vrstve (plexus myentericus Auerbachi).
Z pohľadu embryonálneho pôvodu sú hladká svalovina a Cajalove intersticiálne bunky derivátmi embryonálneho väziva (mezenchýmu z mezodermy). Avšak neuróny a neurogliové bunky ganglií pochádzajú z buniek neurálnej lišty, sú teda neuroektodermového pôvodu [4].
Neurálna lišta je dočasnou embryonálnou štruktúrou, ktorá sa u stavovcov zakladá počas vývinu centrálneho nervového systému. Pri uzatváraní neurálnej rúry, počas 4. týždňa vývinu, sa časť buniek neuroektodermy odčlení a migruje do celého tela embrya. Bunky neurálnej lišty sú multipotentné. Bunky vytvoria autonómne gangliá, paragangliá alebo migrujú do iných vyvíjajúcich sa orgánov celého tela embrya. Ich diferenciáciou vzniká viac ako 50 rôznych druhov buniek (tab. 1), od buniek periférneho nervového systému až po spojivo tváre [5, 6]. Bunky neurálnej lišty sú zdrojom pre neuróny a neurogliové bunky periférneho nervového systému (vrátane ganglií v stene čreva), dreň nadobličky, pigmentové bunky (melanocyty), aj odontoblasty produkujúce dentín zubov [7, 8]. V oblasti budúcej hlavy a krku embrya dávajú základ embryonálnemu väzivu žiabrových oblúkov. Sú preto nenahraditeľné v normálnom vývine tváre, prednej strany krku, prištítnych teliesok, štítnej žľazy a týmusu [9, 10]. Bunky neurálnej lišty sa zúčastňujú aj vývinu srdca. Sú potrebné pri oddeľovaní veľkých ciev v procese septácie výtokovej časti (oddelenie aorty od truncus pulmonalis), vo vývine chlopní a prevodového systému srdca [11]. Aj z uvedeného možno usúdiť, že neurálna lišta je jedinečná štruktúra. Pre svoju dôležitú úlohu počas vývinu viacerých orgánov stavovcov ju niektorí autori označujú „štvrtým embryonálnym zárodkovým listom“ [12].
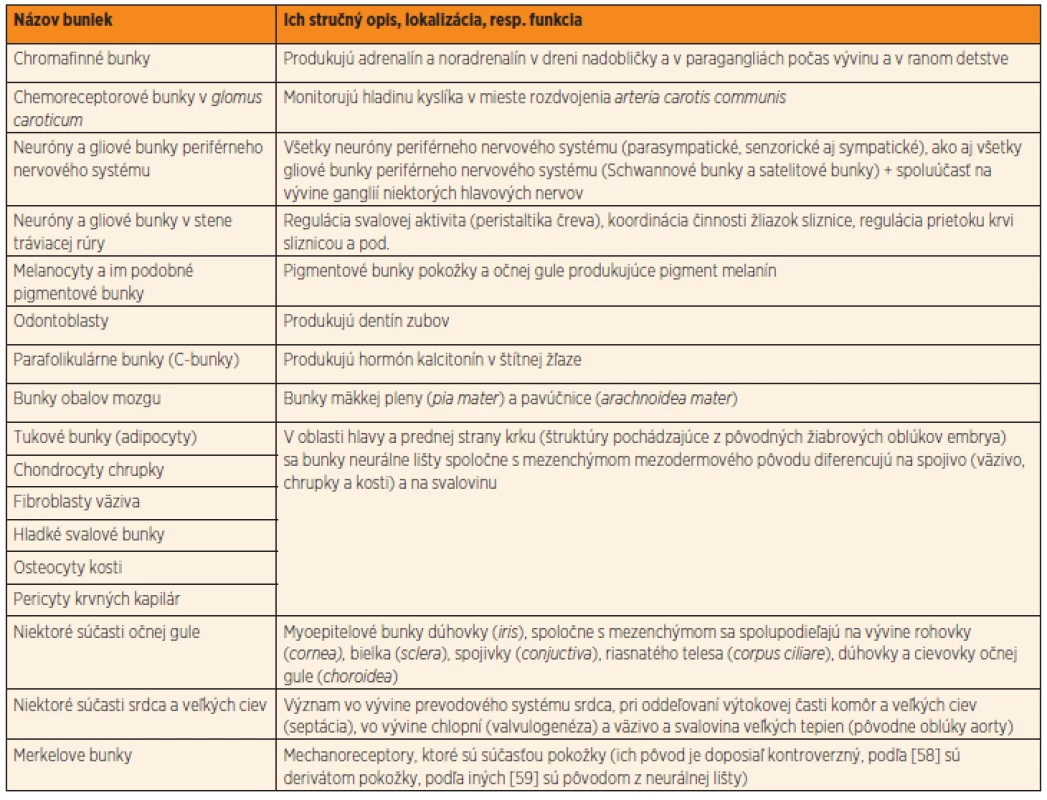
V našej práci sme analyzovali vzťah medzi Hirschsprungovou chorobou a inými vrodenými vývinovými chybami, alebo vrodenými funkčnými defektmi. Všetky tieto anomálie sa dajú vysvetliť abnormálnou migráciou, proliferáciou, diferenciáciou alebo prežívaním buniek neurálnej lišty počas normogenézy rôznych orgánov.
Súbor a metódy
Retrospektívne sme analyzovali 130 detských pacientov s histologicky verifikovanou Hirschsprungovou chorobou, ktorí boli hospitalizovaní na Klinike detskej chirurgie LF UK a DFNsP Bratislava v rokoch 2002 až 2012.
Jedinou kauzálnou liečbou pri danom ochorení je aj v súčasnej dobe operačná liečba. Konvenčný, resp. klasický chirurgický prístup zahŕňa dve alebo tri fázy. V prvej sa vykoná laparotómia (v posledných rokoch je preferovaný miniinvazívny prístup – laparoskopia), kedy sa vykonáva revízia brušnej dutiny, etážovitá biopsia hrubého čreva a následne je na úrovni „tranzitórnej“ zóny vyvedená kolostómia, zabezpečujúca deriváciu črevného obsahu až do ďalšej fázy operačného riešenia. Druhý krok, ktorý sa vykonáva väčšinou po troch mesiacoch (maximálne do jedného roka veku dieťaťa), zahŕňa resekciu histologicky verifikovaného aganglionárneho úseku hrubého čreva. Následne sa vykonáva kolono-análna anastomóza transponovaného zdravého hrubého čreva. Uzatvorenie kolostómie môže byť súčasťou tohto výkonu (dvojdobý postup), alebo ako samostatná tretia fáza operačného riešenia. Najčastejší chirurgický postup riešenia pacientov s poruchou črevnej inervácie v našom súbore bol retro-rektálna „pull-through” operácia podľa Duhamela [13] s Ikedovou a Soperovou modifikáciou [14–16]. V súčasnosti sa všeobecne odporúča jednodobé riešenie miniinvazívnou cestou.
Počas zhromažďovania údajov zo zdravotnej dokumentácie detí hospitalizovaných na Klinike detskej chirurgie DFNsP v Bratislave sme sa zamerali nie len na morfologické abnormality (stigmatizácia tváre, defekty končatín a skeletu, vrodené vývinové chyby srdca a ďalšie), ale aj na údaje o poruche funkcie štítnej žľazy a týmusu a na prípadné neurologické alebo psychomotorické odchýlky.
Výsledky
Vybraný súbor pacientov s Hirschsprungovou chorobou sme hodnotili nami stanovenými kritériami. Z celkového množstva pacientov tvorila najväčšiu časť skupina eutrofických novorodencov (detí narodených s normálnou pôrodnou hmotnosťou 2500 až 3500 gramov). Priemerný vek matiek v čase pôrodu bol 29 rokov, priemerný vek detí pri prvej operácii bol 350 dní. Títo pacienti podstúpili v priemere 2,56 operácií brušnej dutiny. Pomer chlapcov a dievčat bol v našom súbore 1,6 : 1. U piatich pacientov (3,85 %) sme našli pozitívnu rodinnú anamnézu Hirschsprungovej choroby u rodičov alebo súrodencov.
Až u 26,1 % (34 prípadov) sledovaných detských pacientov s Hirschsprungovou chorobou sme odhalili pridružené morfologické vrodené chyby. Len u 12 % z nich bola prítomná len jedna vrodená anomália, až 88 % z týchto 34 pacientov malo súčasne ďalšie vývinové chyby. Ak k týmto morfologickým anomáliám pripočítame aj funkčné odchýlky (hypotyreóza, defekty v bunkovej imunite, neurologický deficit), viac ako polovica detských pacientov s Hirschsprungovou chorobou (50,1 %, t.j. 66 prípadov) mala okrem aganglionózy čreva aj inú vrodenú morfologickú alebo funkčnú anomáliu. Detailný prehľad získaných výsledkov je zhrnutý v tabuľke 2.
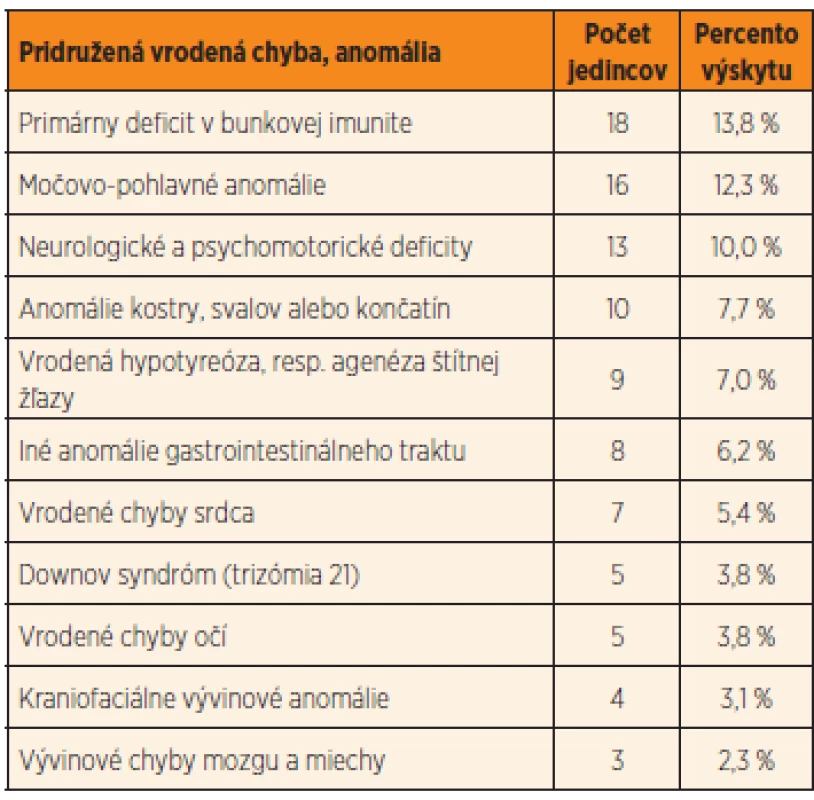
Najčastejšími funkčnými poruchami u detí s Hirschsprungovou chorobou (viac ako 13,8 % pacientov) boli primárne poruchy celulárnej imunity. Tie sú pravdepodobne spôsobené narušením vývinu týmusu a následne aj tymopoézy.
Vrodené anomálie močovo-pohlavnej sústavy sme zaznamenali u 12,3 % pacientov, tvorili ich napríklad vrodené anomálie obličiek, agenéza obličiek, hydronefróza/hydro-ureter, retencia semenníkov a funkčné poruchy močového mechúra.
U 10 % pacientov sa vyskytovala variabilne závažná psychomotorická retardácia alebo mali neurologický deficit bez špecifického morfologického nálezu v dostupných zobrazovacích metódach využitých pri diagnostike. Väčšina týchto pacientov je v dlhodobom sledovaní neurológa a/alebo psychológa.
Vrodenú vývinovú chybu centrálneho nervového systému sme odhalili u 2,3 % pacientov. Medzi tieto patrili spina bifida, meningokéla a hydrocefalus na podklade vrodenej stenózy aqueductus mesencephali Sylvii.
Anomálie kostry, svalov, končatín, resp. prstov sme pozorovali u 7,7 % detských pacientov s morbus Hirschsprung. Táto skupina anomálií bola reprezentovaná chondrodystrofiou, torakálnou kyfózou, pectus excavatum, unilaterálnou fokoméliou, sakrálnou agenézou, Duchennovou svalovou dystrofiou, syndaktýliou, valgóznou alebo varóznou deformitou kolien, pedes plani a globálnou svalovou hypotóniou.
U 7,0 % prípadov sme zistili kongenitálnu hypofunkciu štítnej žľazy, v dvoch prípadoch (1,5 %) sme dokonca odhalili úplnú agenézu štítnej žľazy.
Viac ako 6,2 % pacientov malo popri aganglionóze čreva aj inú komorbiditu gastrointestinálneho traktu, ako napríklad atréziu ilea, gastroschízu a atréziu anu a rekta. Anorektálna malformácia bola najčastejšou pridruženou anomáliou gastrointestinálneho traktu (2,3 %, t.j. 3 pacienti). V dvoch prípadoch sa jednalo o atresio ani et recti s rektoperineálnou fistulou a v jednom prípade o atresio ani et recti s rektouretrálnou fistulou.
Takmer 5,5 % pacientov s Hirschsprungovou chorobou malo súčasne vrodenú chybu srdca, a to najmä defekt medzikomorovej alebo medzipredsieňovej priehradky (po vylúčení pacientov s Downovým syndrómom, pri ktorom je asociácia s vrodenými chybami srdca dobre známa).
Vrodené vývinové chyby očí (3,8 % pa-cientov) a iné kraniofaciálne anomálie (3,1 %) dominovali u pacientov s polystigmatizáciou. Z očných anomálií sme zistili dva prípady konvergentného strabizmu, mikroftalmiu, retinopatiu a keratopatiu v jednom prí-pade.
Downov syndróm sme súčasne s Hirsch-sprungovou chorobou zaznamenali u 5 pa-cientov (3,8 %). Dvom z týchto pacientov bola diagnostikovaná kongenitálna hypotyreóza a jeden pacient mal zároveň vrodenú srdcovú chybu (defekt v medzikomorovej priehradke).
Diskusia
Neurálna lišta je dočasná, multipotentná embryonálna štruktúra, ktorá je derivátom neuroektodermy. Jej bunky podstupujú počas 3. a 4. týždňa vývinu zložitú prestavbu a oddeľujú sa od pôvodnej neuroektodermy (tzv. epitelovo-mezenchýmová transformácia) [17]. Putujú do celého tela po vopred určených trasách a v mieste ukončenia migrácie sa diferencujú na konkrétne typy buniek [18–20].
Až tretina všetkých vrodených vývinových chýb je zapríčinená narušeným vývinom neurálnej lišty. Ako prvý upozornil na danú skutočnosť americký detský patológ Robert P. Bolande v roku 1974 [21] a pomenoval túto skupinu rôznorodých vrodených chýb ako „neurokristopatie“ (lat. crista neuralis, angl. neural crest – neurálna lišta). Tento termín si nachádza postupne uplatnenie medzi výskumnými aj klinickými pracovníkmi. Svedčí o tom už vyše 120 rôznych vedeckých prác v medicínskej databáze PubMed/MedLine, ktoré sa venujú neurokristopatiám. Neurokristopatie zahŕňajú rôznorodé neurologické, endokrinné, gastrointestinálne, nádorové a iné choroby spôsobené narušeným rastom, migráciou alebo diferenciáciou buniek neurálnej lišty. Príčina ich vzniku je multifaktoriálna. Okrem genetickej záťaže zohrávajú dôležitú úlohu aj rôzne teratogénne faktory vonkajšieho prostredia [22].
Neurokristopatie môžu postihovať jeden orgán, avšak postihnuté môžu byť aj viaceré orgány a orgánové systémy, ktorých normálny vývin je spoločne podmienený bunkami neu-rálnej lišty (pre úplnosť uvádzame najvýznam-nejšie príklady takýchto chorôb a vrodených anomálií v tabuľke 3, tieto údaje sú nad rámec našej štúdie). Hirschsprungova choroba, či už s alebo bez pridružených ďalších vrodených vývinových chýb, patrí medzi typickú neurokristopatiu [23]. Význam neurálnej lišty vo vývine nervových spletí čreva, ako aj patogenézu Hirschsprungovej choroby podrobne rozoberáme v našej predchádzajúcej štúdii [3].
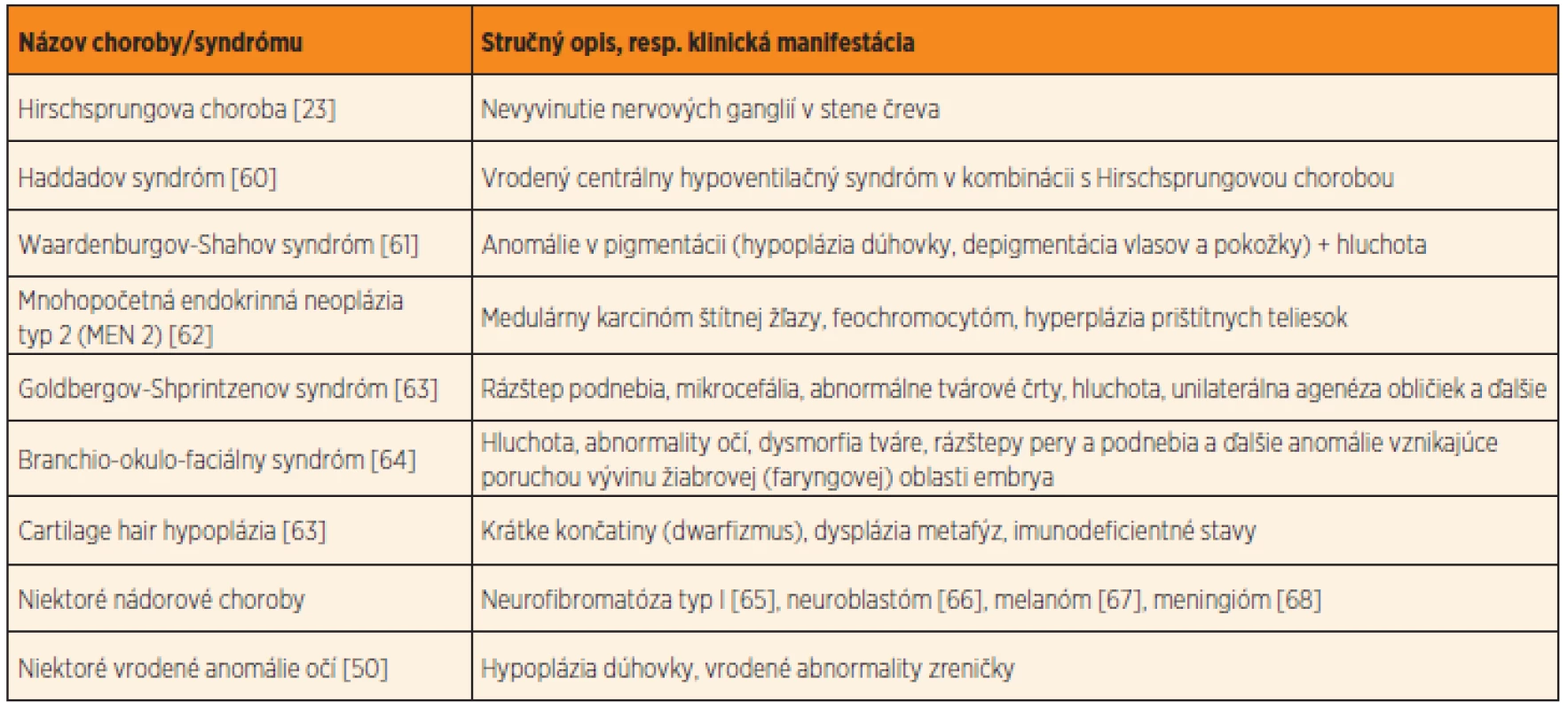
Pomer pohlaví v našom súbore 130 detských pacientov s Hirschsprungovou chorobou bol 1,6 chlapcov ku 1 dievčaťu. Tento pomer sa výrazne odlišuje od svetovo publikovaných údajov, v ktorých sa uvádza, že chlapci sú Hirschsprungovou chorobou postihnutí takmer 4-krát častejšie ako dievčatá [24]. Možným vysvetlením tohto javu je to, že na našu bratislavskú kliniku posielajú často najťažšie prípady (postihnutie dlhšieho segmentu čreva) z celého Slovenska, čo môže výsledok skresľovať. Potvrdzujú to aj údaje Amiela et al. [25], podľa ktorých je pomer chlapcov ku dievčatám významne nižší pri postihnutí dlhšieho úseku čreva (pomer 1,2 až 1,9 ku 1) ako pri postihnutí krátkeho úseku čreva (4,2 až 4,4 ku 1).
V našom súbore 130 detských pacientov s Hirschsprungovou chorobou malo viac ako 26 % z nich aj iné pridružené vrodené vývinové chyby. Moore [26] analyzoval prostredníctvom medicínskych databáz 4328 publikovaných prípadov pacientov s morbus Hirschsprung. Podľa rôznych autorov sa pridružené vrodené chyby vyskytovali u 5–32 % pacientov, s priemerným výskytom u 21,1 % pacientov. V našom súbore sme sa zamerali okrem morfologických anomálií aj na anomálie funkčné (endokrinné, imunologické a neurologické). Z našej retrospektívnej štúdie vyplýva, že viac ako 50 % pacientov s Hirschsprungovou chorobou má pridružené ďalšie morfologické a/alebo funkčné vrodené anomálie.
Vo svetovej literatúre sa stretáme len s jednou odbornou prácou, ktorá dáva do súvislosti vrodené anomálie hrubého čreva a vývin imunitného systému [27]. Primárny deficit bunkovej imunity v našom súbore detí s Hirschsprungovou chorobou tvorilo 13 %. Možným vysvetlením asociácie medzi aganglionózou čreva a poškodením bunkovej imunity je narušený embryonálny vývin týmusu. Progenitorové bunky nervových ganglií vyvíjajúceho sa hrubého čreva totiž pochádzajú z rovnakej oblasti neurálnej lišty, ako tie bunky, ktoré zohrávajú úlohu vo vývine mezenchýmu hltanovej (žiabrovej) oblasti embrya. Interakcia medzi epitelovým základom týmusu (derivát endodermy embryonálneho hltana) a bunkami neurálnej lišty je bezpodmienečne potrebný na vývin plnohodnotného thymus lymphaticus schopného riadiť dozrievanie T-lymfocytov [28–30].
Prítomnosť pridružených anomálií močovo-pohlavnej sústavy bola zaznamenaná u viac ako 12 % pacientov. Náš výsledok je výrazne vyšší v porovnaní so svetovou incidenciou, ktorá je 6,05 % [26]. Možným vysvetlením súčasného výskytu oboch anomálií je mutácia RET proto-onkogénu, ktorá sa v susednej Českej republike vyskytuje u 10 % pacientov s Hirschsprungovou chorobou [31]. RET proto-onkogén kóduje transmembránovú receptorovú tyrozínkinázu, ktorá hrá kľúčovú úlohu jednak vo vývine nervových ganglií čreva [32], ako aj vo vývine obličiek (obzvlášť vo vývine ureterových pupeňov, ktorých interakcia s mezodermovým základom obličky podmieňuje vývin odvodného systému). Jasným dôkazom sú geneticky „knock-out“-ované myši bez RET proto-onkogénu, pre ktoré je charakteristická totálna aganglionóza čreva aj agenéza obličiek [33, 34]. Žiaľ, údaje molekulovo-genetických analýz zameraných na mutácie RET proto-onkogénu pacientov s Hirschsprungovou chorobou (najmä pri súčasnom výskyte vrodených chýb obličiek) zo Slovenska doposiaľ chýbajú.
Približne 10 % pacientov z nášho súboru malo diagnostikované neurologické alebo psychomotorické postihnutie. Podobné výsledky opisujú Moore a Tshifularo [35], ktorí zistili pridružené neurologické postihnutie u vyše 6 % pacientov s Hirschsprungovou chorobou. O neurologických deficitoch takýchto pacientov sa zmieňujú aj iní autori a prezentujú ich formou kazuistík [36, 37]. Predpokladáme, že väčšina neurologických anomálií môže byť spojená s narušenou migráciou alebo diferenciáciou buniek neurálnej lišty, najmä v prípadoch Hirschsprungovej choroby spojenej s rôznymi syndrómami (Goldbergov-Shprintzenov syndróm alebo Haddadov syndróm). Psychomotorický vývin detí môže nezanedbateľnou mierou ovplyvniť aj počet re-operácií, kvalita anestézie, priebeh operácie a post-operačná starostlivosť.
Podľa Moora [26] kostra, svaly a končatiny bývajú postihnuté približne u 5,12 % pacientov s morbus Hirschsprung. V našom súbore 7,7 % pacientov malo pridružené rôznorodé anomálie kostry, svalov, končatín, resp. prstov. Niektorí pacienti s rôznymi anomáliami kostry a svalov boli súčasťou syndrómov (napr. prípad sakrálnej agenézy u pacienta s diagnózou curarrino trias, chondrodystrofia u pacienta s cartilage-hair hypoplasia alebo Duchennova svalová dystrofia).
S incidenciou na úrovni 7,6 % nášho súboru detí s Hirschsprungovou chorobou sa vyskytovala kongenitálna hypotyreóza, pričom v dvoch prípadoch (1,5 %) sa jednalo o úplnú vrodenú agenézu štítnej žľazy. Prekvapilo nás málo literárnych údajov, ktoré by túto spojitosť opisovali. Pritom je dobre známe, že znížené hladiny hormónov štítnej žľazy počas vývinu narúšajú migráciu budúcich neurónov mozgu a tým spôsobujú nezvratné morfologické zmeny v cytoarchitektonike mozgovej kôry [38]. Prvá zmienka o vzťahu medzi Hirschsprungovou chorobou a kongenitálnou hypotyreózou pochádza od Mustafina a Sultanovej z roku 1985 [39]. Vo svojej práci opísali tri prípady hypotyreózy v skupine 78 detí s Hirschsprungovou chorobou (3,8 %). Od tejto doby sme našli len tri ďalšie odborné práce (z toho dve kazuistiky), ktoré poukazujú na vzťah medzi hypotyreózou a morbus Hirschsprung [40–42]. Z embryologického pohľadu sa aj narušený vývin štítnej žľazy môže považovať za neurokristopatiu. Bunky neurálnej lišty hrajú dôležitú úlohu vo vývine väziva štítnej žľazy (budúce puzdro a väzivové priehradky) a sú tiež zdrojom parafolikulárnych buniek štítnej žľazy produkujúcich kalcitonín [5, 9, 43]. Záverom možno doplniť, že na animálnych modeloch sa jasne preukázal negatívny vplyv nízkych hladín hormónov štítnej žľazy na motilitu a funkciu čreva [44]. Napriek tomu neexistujú doposiaľ štúdie, ktoré by dlhodobo sledovali vplyv vrodenej hypotyreózy na funkciu už aj tak poškodenej peristaltiky čreva pacientov s morbus Hirschsprung.
Do vývinu viacerých derivátov embryonálneho primitívneho čreva sú zapojené rovnaké molekulové signálne dráhy. Aj preto nie je prekvapením, že až 6,2 % našich pacientov s Hirschsprungovou chorobou malo súčasne aj inú vrodenú vývinovú chybu gastrointestinálneho traktu. Vo svetovej literatúre sa uvádza podobný nález koincidencie na úrovni 8,05 % [26]. Najčastejšou pridruženou vrodenou chybou tráviacej sústavy boli anorektálne malformácie (2,3 %, teda 3 prípady). Tento náš nález je v súlade s publikovanou incidenciou anorektálnych malformácií u pacientov s morbus Hirschsprung (2,3–3,4 %) [45].
Celosvetovo približne 0,4–0,6 % novorodencov trpí rôzne závažnou vrodenou vývinovou chybou srdca [46]. V našej skupine bola incidencia kongenitálnej srdcovej chyby na úrovni 5,4 %. Ako uvádzajú Spouge a Baird [47], kardiovaskulárne anomálie sa často vyskytujú u pacientov s Hirschsprungovou chorobou a ich incidenciu uvádzajú na úrovni 5,6 %. Etiologickým faktorom vzniku oboch vrodených chýb sú opäť raz bunky neurálnej lišty, ktoré sú nevyhnutné aj v normogenéze srdca. V experimentoch, na animálnych modeloch, spôsobuje ablácia častí neurálnej lišty (označovaná ako kardiogénna neurálna lišta) narušenie vývinu septácie srdca, čo môže viesť napríklad k vzniku Fallotovej tetralógie alebo dvojvýtokovej pravej komory [48, 49].
V našom súbore sme u 5 pacientov (3,8 %) odhalili rôzne závažné anomálie očí, ktorých incidencia je podobná údajom publikovaným v literatúre (2,2 %) [26]. Mnohé vrodené chyby očí patria medzi neurokristopatie, ako napríklad abnormality zrenice alebo dysplázia dúhovky (pozn. myoepitelové bunky dúhovky sú pôvodom z neurálnej lišty) [50]. Súčasný výskyt Hirschsprungovej choroby a konvergentného strabizmu u dvoch pacientov však vysvetliť nedokážeme, nakoľko neexistujú exaktné literárne údaje o význame buniek neurálnej lišty vo vývine okohybných svalov. V literatúre sme však našli tri podobné kazuistiky súčasného výskytu morbus Hirschsprung a strabizmu, aj keď vo všetkých prípadoch sa jednalo o viacpočetné anomálie tváre [51–53].
Viac ako 3 % pacientov zo skúmaného súboru malo kraniofaciálne abnormality. Literárne údaje opisujú túto ko-incidenciu na úrovni 2,86 % [26]. Vzťah medzi Hirschsprungovou chorobou a poruchami vývinu tváre je dobre známa. Bunky neurálnej lišty sú základom pre vývin spojiva v hlavovej oblasti embrya (od väziva, cez chrupky až po kosti), ktoré má v ostatných častiach tela pôvod z mezodermy. Navyše je diferenciácia buniek neurálnej lišty pri vývine tváre aj nervových ganglií v čreve koordinovaná rovnakými molekulovými signálnymi dráhami a rastovými faktormi [54].
U pacientov s Hirschsprungovou chorobou je opísané veľké množstvo chromozómových anomálií. Trizómia chromozómu 21 (Downov syndróm) je najčastejšia z nich a podľa svetových údajov postihuje 2 až 15 % pacientov s morbus Hirschsprung [25, 55]. Štatisticky majú novorodenci s Downovým syndrómom oproti bežnej populácii novorodencov až 40-násobne vyššiu pravdepodobnosť, že sa u nich súčasne vyskytne aj Hirschsprungova choroba. Možným vysvetlením môže byť interakcia chromozómu 10, ktorý obsahuje často mutovaný RET proto-onkogén, s chromozómom 21 [56]. V našom súbore malo 3,8 % pacientov zároveň aj trizómiu chromozómu 21. Deti so spoločnou Hirschsprungovou chorobou aj Downovým syndrómom sú podľa literárnych údajov rizikovejší z viacerých pohľadov. Majú vyššie riziko po-operačných komplikácií, sú častejšie a dlhšie hospitalizované a častejšie sa u nich vyskytujú aj závažné enterokolitídy [57].
Záver
Hirschsprungova choroba, ako typický príklad neurokristopatie, má silný vzťah s ďalšími vrodenými vývinovými chybami. V súbore 130 pacientov s morbus Hirschsprung sme zistili u vyše 26 % pridružené vrodené vývinové chyby. Ak k týmto morfologickým anomáliám pripočítame aj narušenú funkciu štítnej žľazy (kongenitálna hypotyreóza), týmusu (primárne defekty v bunkovej imunite) a neurologické a psychomotorické deficity, vyše polovica z nich mala pridruženú vrodenú anomáliu. Väčšina týchto anomálií sa dá embryologicky vysvetliť narušeným vývinom neurálnej lišty, ktorej multipotentné bunky sú zdrojom širokej palety rôznych bunkových populácií v rôznych častiach tela.
Z našich výsledkov vyplýva, že na Hirschsprungovu chorobu sa neslobodno pozerať len ako na „jednoduchú“ aganglionózu čreva. Vždy treba pátrať aj po ďalších vrodených chybách a malfunkciách orgánov, ktorých embryonálny vývin je ovplyvnený bunkami neurálnej lišty.
Štúdia bola financovaná prostredníctvom Grantu Univerzity Komenského č. UK/468/2013.
Došlo: 12. 5. 2013
Přijato: 15. 8. 2013
doc. RNDr. Ivan Varga, PhD.
Ústav histológie a embryológie LFUK
Sasinkova ulica 4
811 08 Bratislava
Slovensko
e-mail: ivan.varga@fmed.uniba.sk
Sources
1. Kenny SE, Tam PK, Garcia-Barcelo M. Hirschsprung’s disease. Semin Pediatr Surg 2010; 19 : 194–200.
2. Newgreen D, Young HM. Enteric nervous system: development and developmental disturbances – part 1. Pediatr Dev Pathol 2002; 5 : 224–247.
3. Zábojníková L, Cingel V, Murgaš D, Fuňáková M, Sláviková T, Varga I. The development of enteric nervous system and pathogenesis of Hirschsprung disease. Čes-slov Pediat 2012; 67 : 402–409.
4. Newgreen D, Young HM. Enteric nervous system: development and developmental disturbances – part 2. Pediatr Dev Pathol 2002; 5 : 329 – 349.
5. Vickaryous MK, Hall BK. Human cell type divrsity, evolution, development, and classification with special reference to cells derived from the neural crest. Biol Rev Camb Philos Soc 2006; 81 : 425–455.
6. Bronner ME, LeDouarin NM. Development and evolution of the neural crest: an overview. Dev Biol 2012; 366 : 2–9.
7. Anderson RB, Newgreen DF, Young HM. Neural crest and the development of the enteric nervous system. Adv Exp Med Biol 2006; 589 : 181–196.
8. Ibarretxe G, Crende O, Aurrekoetxea M, García-Murga V, Etxaniz J, Unda F. Neural crest stem cells from dental tissues: a new hope for dental and neural regeneration. Stem Cells Int 2012; 2012 : 103503.
9. Varga I, Pospisilova V, Gmitterova K, Galfiova P, Polak S, Galbavy S. The phylogenesis and ontogenesis of the human pharyngeal region focused on the thymus, parathyroid, and thyroid glands. Neuro Endocrinol Lett 2008; 29 : 837–845.
10. Graham A, Richardson J. Developmental and evolutionary origins of the pharyngeal apparatus. EvoDevo 2012; 3 : 24.
11. Keyte A, Hutson MR. The neural crest in cardiac congenital anomalies. Differentiation 2012; 84 : 25–40.
12. Hall BK. The neural crest as a fourth layer and vertebrates as quadroblastic not triploblastic. Evolution & Development 2000; 2 : 3–5.
13. Duhamel B. A new operation for the treatment of Hirschsprung’s disease. Arch Dis Child 1960; 35 : 38–39.
14. Ikeda K. New techniques in the surgical treatment of Hirschsprung’s disease. Surgery 1967; 61 : 503–505.
15. Soper RT, Miller FE. Modification of Duhamel procedure: elimination of rectal pouch and colorectal septum. J Pediatr Surg 1968; 3 : 376–385.
16. Vidiščák M, Kirňák J, Smrek M. Výsledky operácií u detí s megacolon congenitum. Rozhl Chir 2001; 80 (4): 197–200.
17. Kang P, Svoboda KK. Epithelial-mesenchymal transformation during craniofacial development. J Dent Res 2005; 84 : 678–690.
18. Vaglia JL, Hall BK. Regulation of neural crest cell populations: occurrence, distribution and underlying mechanisms. Int J Dev Biol 1999; 43 : 95–110.
19. Baker CV. The evolution and elaboration of vertebrate neural crest cells. Curr Opin Genet Dev 2008; 18 : 536–543.
20. Varga I, Hollý D, Vojtaššák J, Böhmer D, Polák Š, Danišovič Ľ. Morphological characterization of in vitro expanded human dental pulp-derived stem cells. Biologia 2011; 66 : 707–711.
21. Bolande RP. The neurocristopathies: A unifying concept of disease arising in neural crest maldevelopment. Hum Pathol 1974; 5 : 409–429.
22. Bolande RP. Neurocristopathy: its growth and development in 20 years. Pediatr Pathol Lab Med 1997; 17 : 1–25.
23. Martucciello G. Hirschsprung‘s disease as a neurochristopathy. Pediatr Surg Int 1997; 12 : 2–10.
24. Badner JA, Sieber WK, Garver KL, Chakravarti A. A genetic study of Hirschsprung disease. Am J Hum Genet 1990; 46 : 568–580.
25. Amiel J, Sproat-Emison E, Garcia-Barcelo M, Lantieri F, Burzynski G, et al; Hirschsprung Disease Consortium. Hirschsprung disease, associated syndromes and genetics: a review. J Med Genet 2008; 45 : 1–14.
26. Moore SW. The contribution of associated congenital anomalies in understanding Hirschsprung‘s disease. Pediatr Surg Int 2006; 22 : 305–315.
27. Kushch NL, Grona VN, Kimbarovskaia EM, Evseeva LI. Clinico-immunologic comparisons of developmental defects of the large intestine in children. Klin Khir 1988; 6 : 10–12.
28. Itoi M, Tsukamoto, Yoshida H, Amagai T. Mesenchymal cells are required for functional development of thymic epithelial cells. Int Immunol 2006; 19 : 953–964.
29. Foster K, Sheridan J, Veiga-Fernandes H, Roderick K, Pachnis V, et al. Contribution of neural crest-derived cells in the embryonic and adult thymus. J Immunol 2008; 180 : 3183–3189.
30. Varga I, Pospisilova V, Jablonska-Mestanova V, Galfiova P, Polak S. The thymus: Picture review of human thymus prenatal development. Bratisl lek Listy 2011; 112 : 368–376.
31. Vaclavikova E, Kavalcova L, Skaba R, Dvorakova S, Macokova P, Rouskova B, Bendlova B. Hirschsprung’s disease and medullary thyroid carcinoma: 15-year experience with molecular genetic screening of the RET proto-oncogene. Pediatr Surg Int 2012; 28 : 123–128.
32. Dvořáková Š, Václavíková E, Škába R, Kavalcová L, Bendlová B. Hirschsprungova choroba a její genetické příčiny. Čes-slov Pediat 2013; 68 (3): 167–176.
33. Jijiwa M, Fukuda T, Kawai K, Nakamura A, Kurokawa K, et al. A targeting mutation of tyrosine 1062 in Ret causes a marked decrease of enteric neurons and renal hypoplasia. Mol Cell Biol 2004; 24 : 8026–8036.
34. Chi X, Michos O. Immunohistochemical staining of dpERK staining during early kidney development. Methods Mol Biol 2012; 886 : 261–265.
35. Moore SW, Tshifularo N. Hirschsprung‘s disease in the neurologically challenged child. Int J Adolesc Med Health 2011; 23 : 223–227.
36. Shahar E, Shinawi M. Neurocristopathies presenting with neurologic abnormalities associated with Hirschsprung‘s disease. Pediatr Neurol 2003; 28 : 385–391.
37. Baranyay F, Bogár G, Sebestyén M. Adult Hirschsprung‘s disease with mental retardation and microcephaly. Orv Hetil 2000; 141 : 1673–1676.
38. Ausó E, Lavado-Autric R, Cuevas E, Del Rey FE, Morreale De Escobar G, Berbel P. A moderate and transient deficiency of maternal thyroid function at the beginning of fetal neocorticogenesis alters neuronal migration. Endocrinology 2004; 145 : 4037–4047.
39. Mustafin AA, Sultanova LM. Differential diagnosis of Hirschsprung‘s disease and congenital hypothyroidism in children. Vestn Khir Im I I Grek 1985; 134 : 89–91.
40. Kota SK, Modi KD, Rao MM. Hirschsprungs disease with congenital hypothyroidism. Indian Pediatr 2012; 49 : 245–246.
41. Eren M, Celik M, Kinik S, Arda IS. A case of Hirschsprung disease: does thyroid hormone have any effect? Turk J Pediatr 2009; 51 : 94–96.
42. Monroy-Santoyo S, Ibarra-González I, Fernández-Lainez C, Greenawalt-Rodríguez S, Chacón-Rey J, et al. Higher incidence of thyroid agenesis in Mexican newborns with congenital hypothyroidism associated with birth defects. Early Hum Dev 2012; 88 : 61–64.
43. Manley NR, Capecchi MR. Hox group 3 paralogs regulate the development and migration of the thymus, thyroid, and parathyroid glands. Dev Biol 1998; 195 : 1–15.
44. Goto S, Billmire DF, Grosfeld JL. Hypothyroidism impairs colonic motility and function. An experimental study in the rat. Eur J Pediatr Surg 1992; 2 : 16–21.
45. Sinha CK, Grewal A, Ward HC. Short-segment Hirschsprung‘s disease, cat eye syndrome, and anorectal malformation: a unique association. J Pediatr Surg 2007; 42 (8): 1454–1456.
46. Fahed AC, Gelb BD, Seidman JG, Seidman CE. Genetics of congenital heart disease: the glass half empty. Circ Res 2013; 112 : 707–720.
47. Spouge D, Baird PA. Hirschsprung disease in a large birth cohort. Teratology 1985; 32 : 171–177.
48. Pelech AN, Broeckel U. Toward to etiologies of congenital heart disease. Clin Perinatol 2005; 32 : 825–844.
49. Hutson MR, Kirby ML. Model systems for the study of heart development and disease. Cardiac neural crest and conotruncal malformations. Semin Cell Dev Biol 2007; 18 : 101–110.
50. Bergstrom CS, Saunders RA, Hutchinson AK, Lambert SR. Iris hypoplasia and aorticopulmonary septal defect: a neurocristopathy. J AAPOS 2005; 9 : 264–267.
51. el-Halaby E, Coran AG. Hirschsprung‘s disease associated with Ondine‘s curse: report of three cases and review of the literature. J Pediatr Surg 1994; 29 : 530–535.
52. Nagaya M, Kato J, Niimi N, Tanaka S, Wakamatsu N. Clinical features of a form of Hirschsprung‘s disease caused by a novel genetic abnormality. J Pediatr Surg 2002; 37 : 1117–1122.
53. Skiker H, Laghmari M, Cherkaoui O, Lachgar R, Daoudi R. Bilateral Duane syndrome associated with crocodile tears, and congenital megacolon: a case study. J Fr Ophtalmol 2008; 31: e6.
54. Farlie PG, McKeown SJ, Newgreen DF. The neural crest: basic biology and clinical relationships in the craniofacial and enteric nervous systems. Birth Defects Res C Embryo Today 2004; 72 : 173–189.
55. Amiel J, Lyonnet S. Hirschsprung disease, associated syndromes, and genetics: a review. J Med Genet 2001; 38 : 729–739.
56. Arnold S, Pelet A, Amiel J, Borrego S, Hofstra R, et al. Interaction between a chromosome 10 RET enhancer and chromosome 21 in the Down syndrome-Hirschsprung disease association. Hum Mutat 2009; 30 : 771–775.
57. Travassos D, van Herwaarden-Lindeboom M, van der Zee DC. Hirschsprung’s disease in children with Down syndrome: a comparative study. Eur J Pediatr Surg 2011; 21 : 220–223.
58. Morrison KM, Miesegaes GR, Lumpkin EA, Maricich SM. Mammalian Merkel cells are descended from the epidermal lineage. Dev Biol 2009; 336 : 76–83.
59. Szeder V, Grim M, Halata Z, Sieber-Blum M. Neural crest origin of mammalian Merkel cells. Dev Biol 2003; 253 : 258–263.
60. Shuman L, Youmans D. Haddad syndrome: a case study. Neonatal Network 2005; 24 : 41–44.
61. Mahmoudi A, Rami M, Khattala K, Elmadi A, Afifi MA, Youssef B. Shah-Waardenburg syndrome. Pan Afr Med J 2013; 14 : 60.
62. Martucciello G, Lerone M, Bricco L, Tonini GP, Lombardi L, Del Rossi CG, Bernasconi S. Multiple endocrine neoplasias type 2B and RET proto-oncogene. Ital J Pediatr 2012; 38 : 9.
63. Amiel J, Lyonnet S. Hirschsprung disease, associated syndromes, and genetics: a review. J Med Genet 2001; 38 : 729-739.
64. Lin AE, Gorlin RJ, Lurie IW, Brunner HG, van der Burgt I, et al. Further delineation of the branchio-oculo-facial syndrome. Am J Med Genet 1995; 56 : 42–59.
65. Quatresooz P, Vandenbossche G, Piérard-Franchimont C, Piérard GE. Skin and its main neurocristopathies. Rev Med Liege 2008; 63 : 354–358.
66. Jiang M, Stanke J, Lahti JM. The connections between neural crest development and neuroblastoma. Curr Top Dev Biol 2011; 94 : 77–127.
67. Volkovova K, Bilanicova D, Bartonova A, Letašiová S, Dusinska M. Associations between environmental factors and incidence of cutaneous melanoma. Review. Environ Health 2012; 11 (Suppl 1): S12.
68. Mehta P, Agrawal P, Luthert P, Durrani OM. Optic nerve sheath meningioma in a patient with choroidal malignant melanoma: a case report of a complex neurocristopathy. Orbit 2009; 28 : 436–438.
Labels
Neonatology Paediatrics General practitioner for children and adolescentsArticle was published in
Czech-Slovak Pediatrics

2013 Issue 5
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
- What Effect Can Be Expected from Limosilactobacillus reuteri in Mucositis and Peri-Implantitis?
-
All articles in this issue
- Vliv perikoncepční expozice kouření na mužskou reprodukci: poměr pohlaví a nástup puberty
- Alkoholové a drogové intoxikace u dospívajících přijatých na dětská oddělení v ČR
- Je prostredie detských pieskovísk pre zdravie detí bezpečné?
- Rozdiely v duševnom zdraví žiakov v meste a na vidieku
- Neurokristopatie: Význam poruchy vývinu buniek neurálnej lišty pri vzniku vrodených chýb na príklade Hirschsprungovej choroby
- Klinické souvislosti vývoje štítné žlázy a jeho poruch u plodu a novorozence (2. část)
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Alkoholové a drogové intoxikace u dospívajících přijatých na dětská oddělení v ČR
- Neurokristopatie: Význam poruchy vývinu buniek neurálnej lišty pri vzniku vrodených chýb na príklade Hirschsprungovej choroby
- Klinické souvislosti vývoje štítné žlázy a jeho poruch u plodu a novorozence (2. část)
- Je prostredie detských pieskovísk pre zdravie detí bezpečné?
