Doporučený postup České pediatrické společnosti a Odborné společnosti praktických dětských lékařů ČLS JEP pro suplementaci dětí a dospívajících vitaminem D
Authors:
Doc. MUDr. Ph.D. Bronský Jiří 1; MUDr. Kalvachová Božena; CSc. 2; Doc. MUDr. Kutílek Štěpán; CSc. 3; MUDr. Šebková Alena 4; MUDr. Škvor Jaroslav 5; Prof. MUDr. Šumník Zdeněk; Ph.D. 1; MUDr. Tláskal Petr; CSc. 6; MUDr. Zíma Zdeněk 7
Published in:
Čes-slov Pediat 2019; 74 (8): 473-482.
Category:
SOUHRN PRO KLINICKOU PRAXI
- Zdravým fyziologickým i rizikovým novorozencům a kojencům podáváme profylakticky 400–500 IU vitaminu D p.o. v jedné denní dávce počínaje 2. týdnem věku do konce 1. roku života.
- U nedonošených jedinců by měla být od propuštění do domácí péče až do 1 roku korigovaného věku podávána dávka vitaminu D 400–500 IU/den (max. 1000 IU) navíc k ostatním zdrojům.
- U všech dětí a adolescentů je třeba podporovat zdravý životní styl, neboť zásadním zdrojem vitaminu D je sluneční záření, vedlejším zdrojem pak strava bohatá na vitamin D.
- U rizikových skupin dětí je vhodné cíleně pátrat po deficitu vitaminu D a případně jej substituovat. Základem vyšetřování zásobení organismu vitaminem D je podrobná anamnéza (jídelní návyky, expozice slunečnímu záření, potravinové doplňky). V případě pochybností je vhodné ověření sérové hladiny 25-OHD, která je pro zdravý kalciumfosfátový a kostní metabolismus dostačující ve výši 25–30 nmol/l (spolu s vyšetřením kalcémie, ALP a PTH). Rozmezí 30–50 nmol/l může značit insuficienci, v takovém případě je vhodné zajistit dostatečný příjem kalcia ve stravě a případně opakovat vyšetření hladin s odstupem.
- Zjistíme-li současně nízkou koncentraci 25-OHD a elevaci ALP či PTH, zahajujeme léčbu vždy, a to v počáteční dávce 1000–2000 IU vitaminu D denně p.o. a současně doporučíme zvýšený příjem kalcia ve stravě. Dále postupujeme dle dynamiky klíčových parametrů.
- Plošná suplementace těhotných vitaminem D je doporučena v dávce 400–500 IU/den. U kojících žen pokračujeme v suplementaci vitaminem D stejně jako před porodem, a navíc doplňujeme kalciem v dávce 1000 mg/den.
1. ÚVOD
Vitamin D je souhrnný název pro steroidní hormonální prekurzory, označované jako kalciferoly. Podle struktury rozlišujeme vitamin D2 (ergokalciferol) a vitamin D3 (cholekalciferol), jejich biologická účinnost je podobná. Pokud v rámci tohoto doporučení hovoříme o vitaminu D bez další specifikace, není v daném kontextu podstatné, o jaký typ či metabolit se jedná. V ostatních případech používáme specifické názvosloví.
Následující společné doporučení dvou pediatrických společností ČLS JEP vychází z publikovaných konsenzů mezinárodních odborných společností, zejména z Globálního konsenzu pro prevenci a terapii rachitidy (Munns 2016), na kterém se spolupodíleli odborníci z dětské endokrinologie, osteologie i gastroenterologie a výživy, a Doporučení Komise pro výživu ESPGHAN (Braegger 2013), další výzkumy v této oblasti mohou přinést další poznatky a případné změny doporučených postupů.
2. FYZIOLOGICKÁ VÝCHODISKA
Endogenním prekurzorem vitaminu D je 7-dehydrocholesterol, z něhož v kůži vlivem UV záření vzniká cholekalciferol. Cholekalciferol se hydroxyluje v játrech na 25-hydroxycholekalciferol (25-OHD, kalcidiol) a následně v ledvinách a dalších tkáních na účinný metabolit 1,25-dihydroxycholekalciferol (1,25-OHD, kalcitriol). Endogenní produkce vitaminu D je nejdůležitějším zdrojem vitaminu D pro lidský organismus, dodávka vitaminu D ve stravě je spíše minoritní, představuje přibližně 10 % příjmu. Exogenním zdrojem vitaminu D je zejména kalciferol obsažený v mléce a mléčných výrobcích, drůbeži a rybách. Přílohy 1 a 2 uvádějí obsah vitaminu D v kojeneckých formulích a některých potravinách.
Hlavním cílovým orgánem pro vitamin D je střevo, kde stimuluje resorpci kalcia a fosforu. Hovoříme-li tedy o doporučených hladinách vitaminu D, vždy je třeba zohlednit adekvátnost dodávky kalcia, bez které vitamin D ztrácí svoji účinnost na kostní metabolismus (obr. 1). Kalcium a vitamin D se částečně navzájem doplňují ve svých fyziologických rolích, jak ukazuje obrázek 1. Toto doporučení se zabývá především vlivem vitaminu D na metabolismus kalcia a fosforu. Mimoskeletální působení vitaminu D zmíníme pouze okrajově.
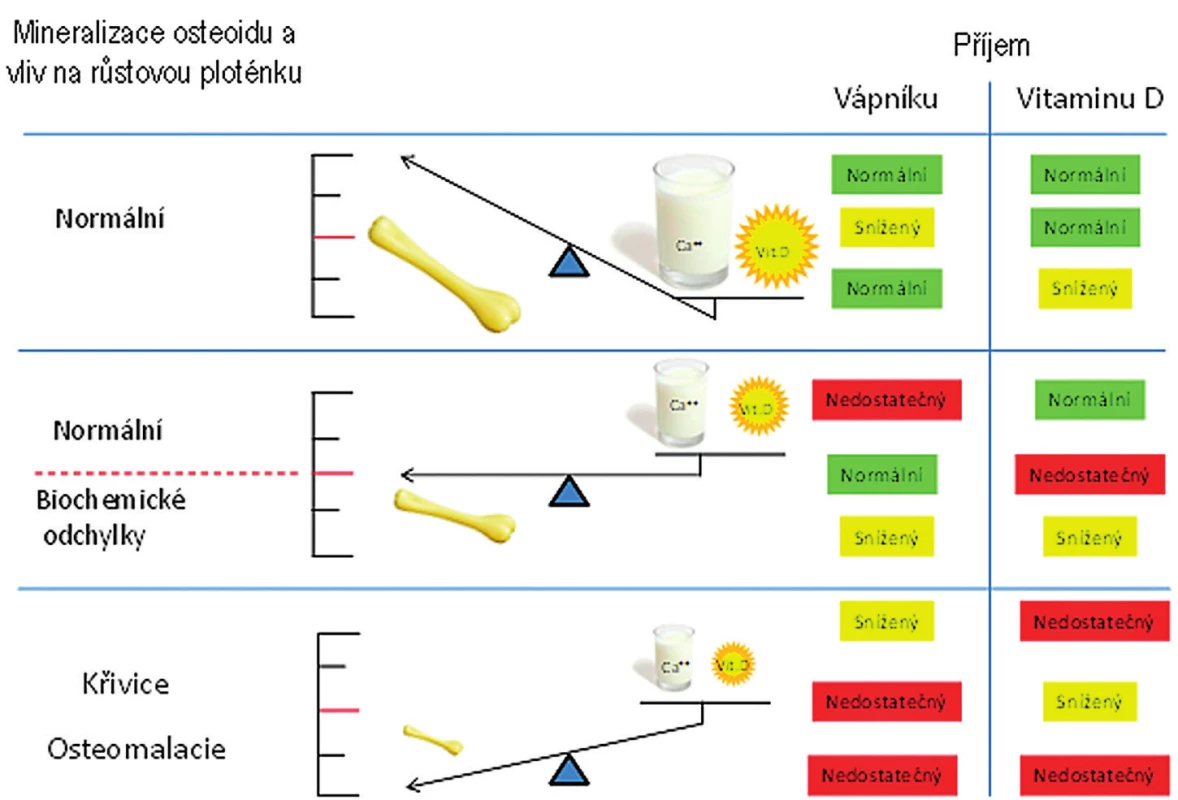
Hlavními regulátory kalcémie jsou vitamin D a parathormon (PTH). Schéma regulace kalcémie znázorňuje obrázek 2.
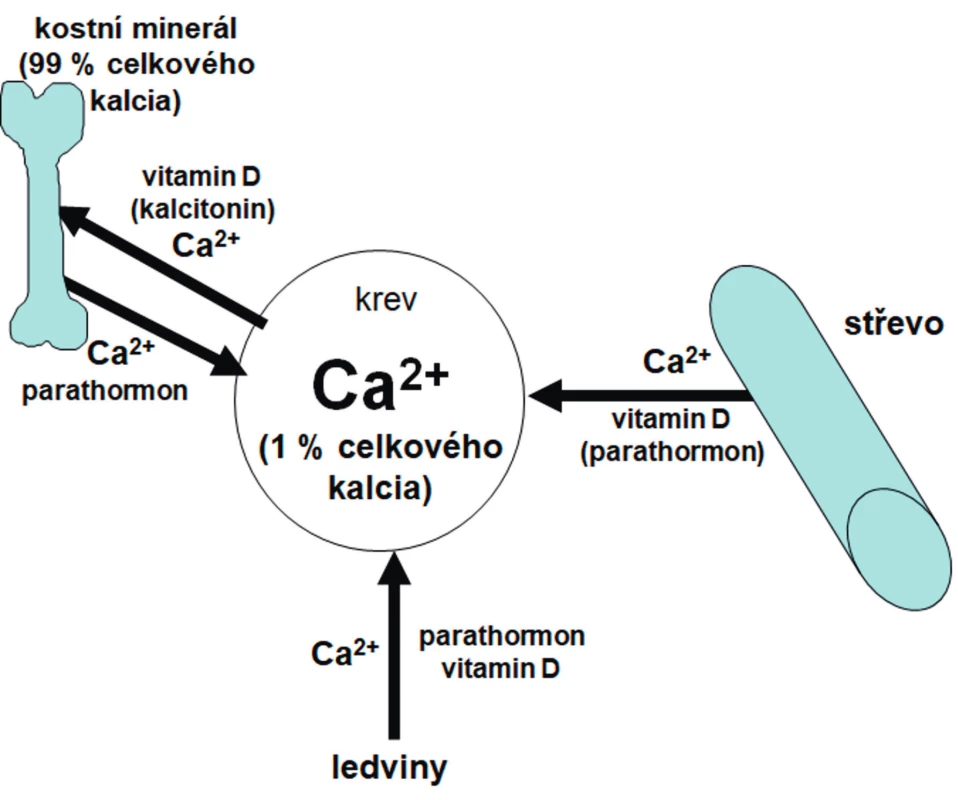
Prioritními cílovými orgány pro hospodaření s kalciem jsou střevo, ledviny a kost. Vitamin D a PTH působí v ledvinách synergicky – posilují reabsorpci kalcia, PTH navíc stimuluje exkreci fosforu. Dalším důležitým orgánem v regulaci Ca/P metabolismu je střevo. Vitamin D stimuluje aktivní transport obou těchto iontů přes střevní stěnu, PTH působí na střevo sekundárně stimulací produkce kalcitriolu a aktivací 1-alfa hydroxylázy v ledvinách. V kosti vitamin D podporuje diferenciaci chondrocytů, mineralizaci růstové ploténky a osteoidu. Reakcí na nedostatek vitaminu D nebo kalcia je zvýšení sérové koncentrace alkalické fosfatázy (ALP) a PTH, který zvyšuje kalcémii snížením exkrece kalcia v ledvinách a zvýšenou osteoresorpcí. Proto je třeba koncentraci ALP a PTH vždy zohlednit při interpretaci laboratorně zjištěného deficitu vitaminu D.
2.1. Význam UV záření v metabolismu vitaminu D
Sluneční záření je nejdůležitějším a nejefektivnějším zdrojem vitaminu D pro lidský organismus. Záření UVB (290–315 nm) podporuje epidermální syntézu previtaminu D3 z 7-dehydrocholesterolu. Omezení expozice slunečnímu záření může vést k deficitu vitaminu D a zvýšit riziko nutriční rachitidy v závislosti na zeměpisné šířce, nadmořské výšce, ročním období, denní době, oblačnosti a znečištění ovzduší, době pobytu na slunci, pigmentaci kůže, typu oblečení, ochranných krémech proti UV záření, věku, tělesném složení a genetických faktorech (Munns 2016). Sluneční záření nemůže vést k toxickým hladinám vitaminu D (Holick 2007).
Vztahem mezi UV zářením a vitaminem D se zabývala řada publikací, jejich výsledky se však různí (Cranney 2007). V naší zeměpisné šířce lze denní syntézu vitaminu D v ekvivalentu 400 IU dosáhnout běžnou hodinovou expozicí tváře a rukou polednímu slunci po určitou část roku (od dubna do září), bez rizika kožního erytému (Braegger 2013, Webb 2008). Pro osoby s větší pigmentací kůže může být tato doba 2–10x vyšší. Matematický model, který zohledňuje řadu faktorů, uvádí, že denní expozice slunečnímu záření po dobu 10–20 minut během letních měsíců může zvýšit sérové hladiny 25-OHD maximálně o 5–10 nmol/l (Diffey 2010). Čím je menší intenzita slunečního záření, tím větší tělesný povrch musí být exponován k dosažení příslušných změn sérových koncentrací 25-OHD (Bogh 2011).
Jakákoliv expozice UVB, která by zajistila dostatečnou syntézu vitaminu D, zvyšuje zároveň riziko kožních nádorů (Munns 2016). Uvádí se, že použití krémů s vysokým ochranným faktorem (více než 15) může omezit tvorbu vitaminu D (Zlotkin 1999). Recentní studie prokázala pouze nevýznamný efekt krátkodobého použití krémů s faktorem nad 50 na hladinu 25-OHD i přesto, že produkce vitaminu D v kůži byla blokována (Libon 2017, SACN 2016). Na základě současných znalostí není tedy možné doporučit dobu minimální či optimální expozice slunečnímu záření platnou pro celou populaci. Přístup musí být individuální s přihlédnutím k výše uvedeným faktorům. Obecně je třeba podporovat děti a adolescenty ve zdravém životním stylu včetně aktivit spojených s pobytem venku na slunci (Braegger 2013).
2.2. Mimokostní účinky vitaminu D
Studium mimokostních účinků kalcitriolu bylo odstartováno průkazem jeho tvorby i mimo proximální tubuly ledvin. Dosud je tvorba kalcitriolu prokázána v dalších 35 tkáních a orgánech (Norman 2008, Wang 2012). Buňky těchto tkání jsou vybaveny jak enzymem 1-alfa hydroxylázou, tak vitamin D receptorem (VDR). Kalcitriol v těchto buňkách vzniklý se naváže na VDR, touto aktivací dochází k transkripci takzvaných vitamin D responzivních elementů (VDREs) a expresi genových informací. Kalcitriol zde funguje jako mediátor transkripce celé řady genů. Je zacílený především na imunitní děje a regulaci buněčných cyklů. Mimokostní účinky se odehrávají výhradně lokálně způsobem autokrinním a parakrinním. Tvorba kalcitriolu je v těchto místech vzniku a působení závislá především na přísunu kalcidiolu krevním oběhem. Pochopení jeho účinků v těchto místech je předmětem stále narůstajícího počtu experimentálních i klinických studií. Nejčastěji se věnují souvislosti mezi nízkou hladinou kalcidiolu a možným rozvojem alergických a autoimunitních chorob, s inzulinovou rezistencí, s rozvojem neurodegenerativních chorob včetně poruch autistického spektra, s výskytem kardiovaskulárních onemocnění a některých nádorů, se vznikem preeklampsie u těhotných, předčasným porodem a intrauterinními riziky pro plod. Průkaz kauzality je ale obtížně dokazatelný. Hladina celkového kalcidiolu, ze které většina studovaných prací vychází, nemusí odrážet nabídku volného a tudíž disponibilního substrátu (Miraglia del Giudice 2015). Alelické varianty VDR navíc komplikují interpretaci individuálních účinků. Kalcitriol působí ve většině buněk imunitního systému (DeLuca 2004, Štercl 2012, Hewison 2003, Hewison 2010, Agmon-Levin 2013) a je významným neurosteroidem, důležitým pro vývoj mozku (DeLuca 2013). Nejen z těchto důvodů řada klinických prací akcentuje důležitost správné saturace vitaminem D těhotných žen, nejlépe již prekoncepčně (Gellert 2017, Franasiak 2017, Ceccaldi 2017).
3. HODNOCENÍ NASYCENÍ ORGANISMU VITAMINEM D
Nasycení organismu vitaminem D posuzujeme podle sérové koncentrace 25-OHD. Ten sice není aktivním metabolitem, nicméně jeho hladiny jsou vlivem delšího poločasu stabilnější než u kalcitriolu. Výjimkou jsou pacienti s nefropatiemi, u nich naopak upřednostňujeme vyšetřování kalcitriolu. Vyšetřování metabolitů vitaminu D je poměrně drahé a při jeho indikaci bychom měli postupovat uvážlivě. Vhodným vodítkem může být tabulka 1 (dle Shaw 2013). Při hodnocení koncentrací 25-OHD je třeba zohlednit fyziologické sezónní kolísání v důsledku rozdílné doby slunečního svitu. Nejvyšší hladiny 25-OHD jsou na konci léta, naopak nejnižší koncem zimy a v prvních jarních měsících (Kasahara 2013). U zdravých dětí se vitamin D ukládá v tukové tkáni a tyto zásoby dostačují po celý rok. Definice normálních hladin je v současné době předmětem diskuse, poslední doporučení ukazuje tabulka 2. Hladiny mezi 30–50 nmol/l vedou pouze výjimečně ke vzestupu PTH a osteoresorpci, z hlediska kostního metabolismu proto nepředstavují zpravidla důvod k dlouhodobé substituci vitaminem D, pokud k substituci není jiný důvod. Sledování pacienta je ale nezbytné (Munns 2016). Některé laboratoře udávají sérové koncentrace vitaminu D v jednotkách ng/ml, konverzní faktor je uveden níže:
Konverze jednotek 25-OHD v séru: 2,5 nmol/l = 1 ng/ml a vitaminu D3 ve zdrojích: 1 μg = 40 IU
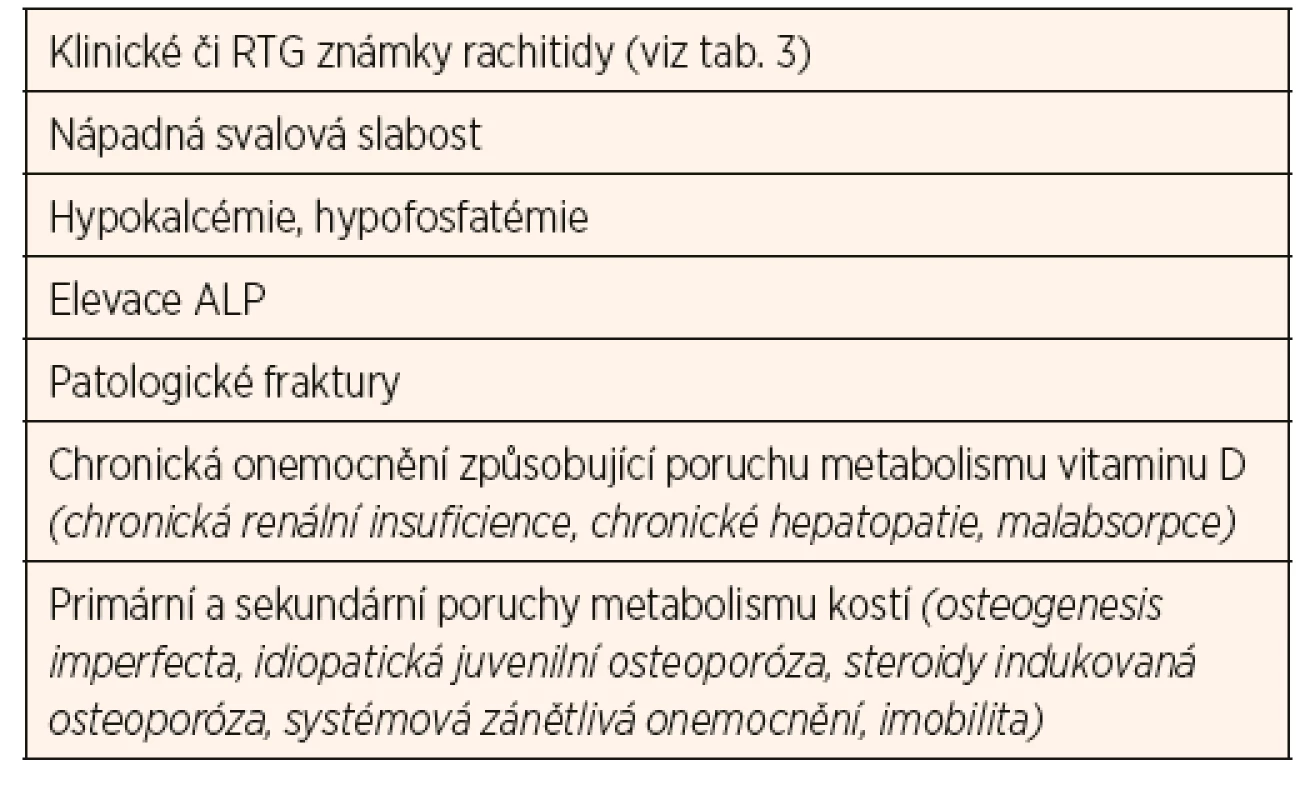
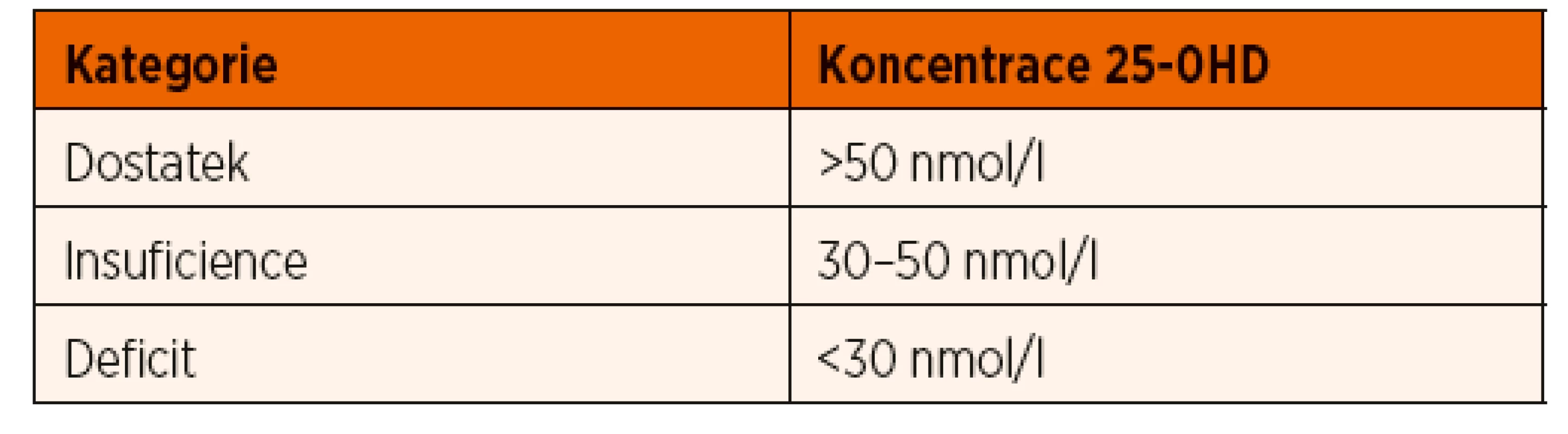
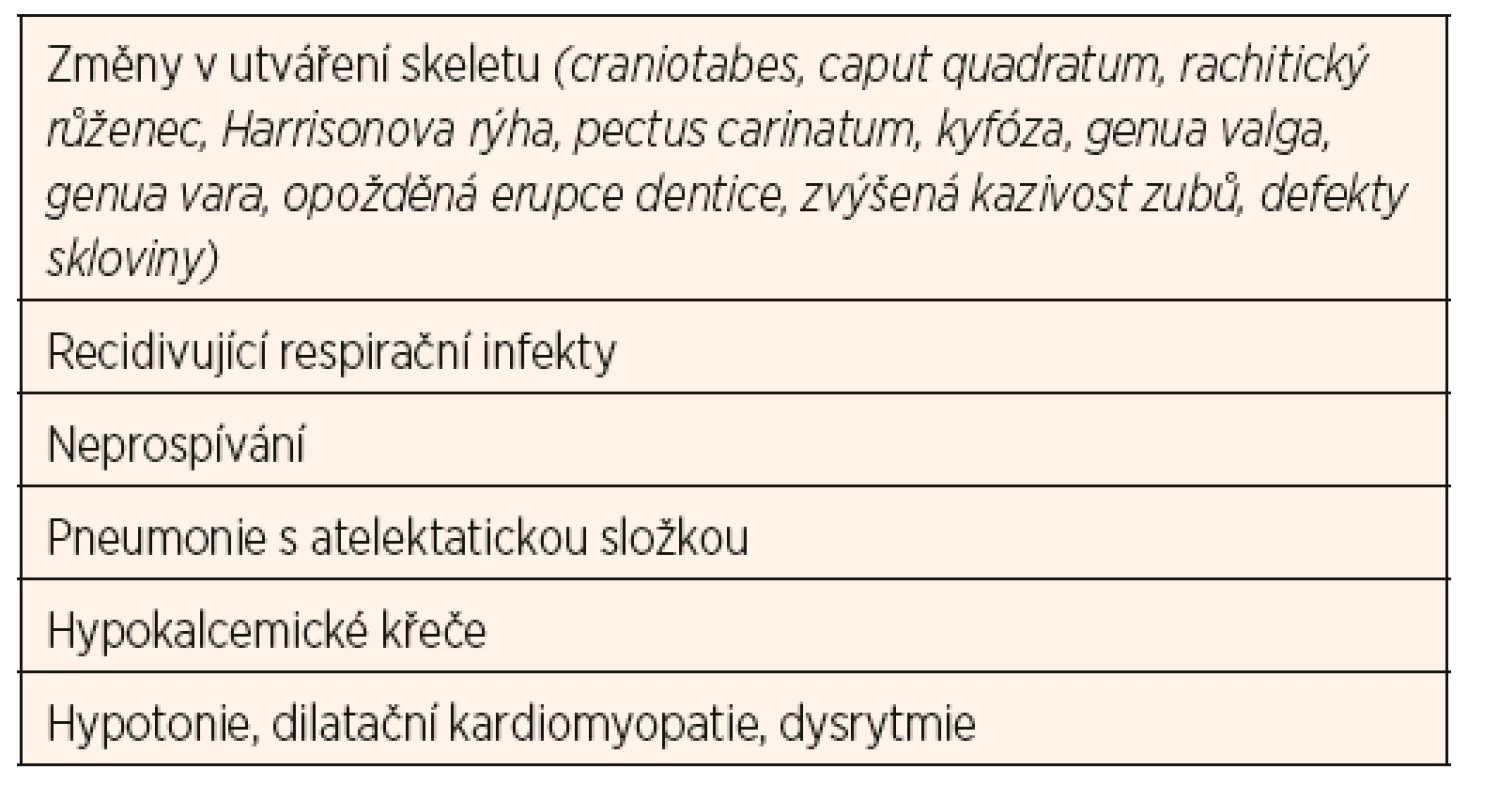
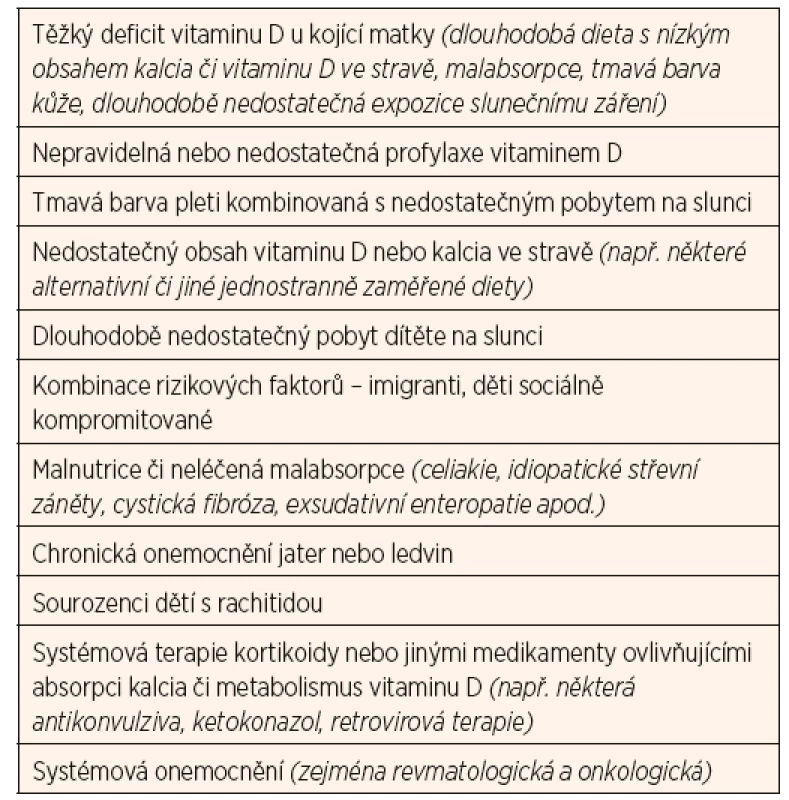
Dlouhodobý deficit vitaminu D zvyšuje riziko rachitidy u rostoucího organismu (zejména v kojeneckém a batolecím období), resp. osteomalacie u dospělých. Manifestní křivice je u nás vzácná, nicméně je třeba na ni myslet u dětí s klinickými symptomy uvedenými v tabulce 3 a u dětí z rizikových skupin (tab. 4). Diagnostika latentních forem deficitu vitaminu D je daleko obtížnější, protože tyto děti nevykazují žádné klinické známky chronického onemocnění. U některých skupin je třeba provádět pravidelný screening jako součást standardní péče (tab. 4).
Při interpretaci hodnot uvedených v tabulce 2 mějme na paměti následující:
- Výsledky 25-OHD v jednotlivých laboratořích se mohou velmi lišit a lze je obtížně porovnávat (Carter 2011).
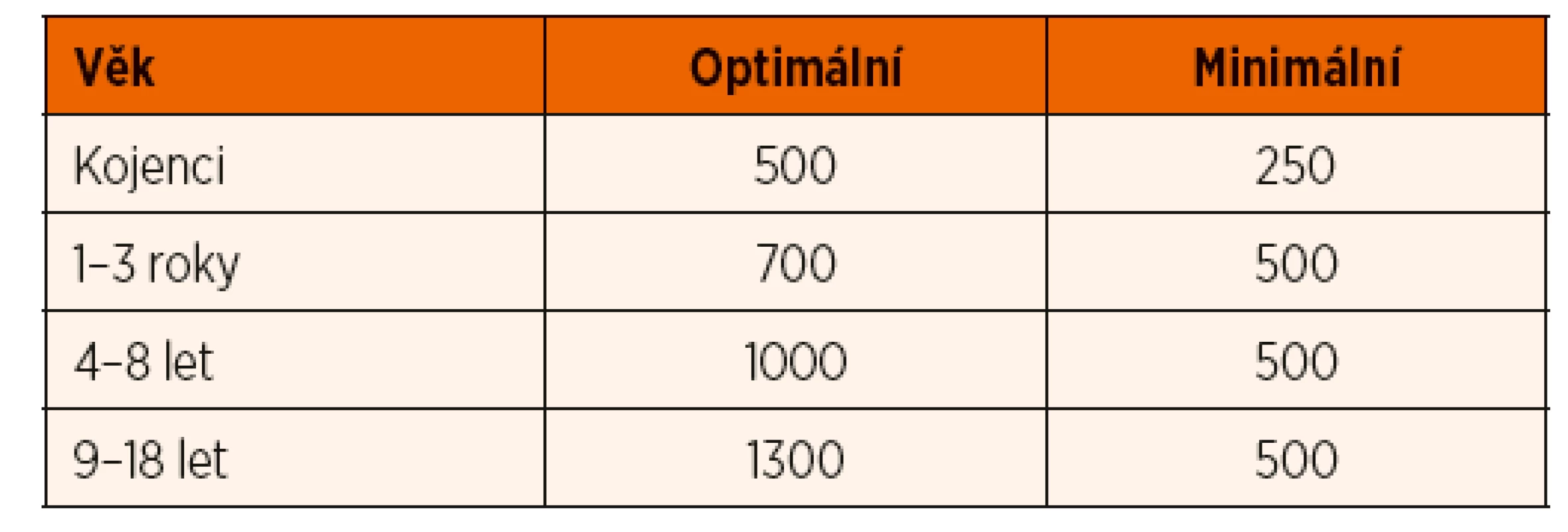
- Nízká hodnota 25-OHD nemusí automaticky vést k zahájení substituce u jinak zdravého dítěte s negativní anamnézou fraktur a bez jiné rizikové anamnézy. Koncentrace 25-OHD 30–50 nmol/l (zejména pokud se vyskytují pouze přechodně) nezpůsobují poruchu mineralizace a nevedou k rozvoji křivice. Mnoho dětí s insuficiencí 25-OHD je asymptomatických, zvláště pokud má dítě dostatečný přísun kalcia ve stravě (Munns 2016). Rachitida či osteomalacie vzniká pouze v případě deficitu obou těchto klíčových hráčů mineralizace skeletu (obr. 1). Doporučený příjem kalcia ve stravě ukazuje tabulka 5, obsah kalcia v některých potravinách přináší příloha 3. Při běžné stravě je více než 50 % příjmu kalcia ve stravě pokryto mlékem a mléčnými výrobky, které mají také nejlepší parametry vstřebávání.
- Hladinu 25-OHD nelze interpretovat izolovaně a měli bychom toto vyšetření indikovat uvážlivě. Uvažujeme-li o dlouhodobé substituci, měli bychom ji posuzovat v kontextu ke koncentraci ALP a PTH. Pokud jsou v normě, je závažný deficit vitaminu D nepravděpodobný.
- Mezi koncentrací 25-OHD a kostní denzitou není přímá souvislost (Hradský 2017, Maratová 2018).
4. VITAMIN D V JEDNOTLIVÝCH OBDOBÍCH ŽIVOTA
4.1. Fyziologičtí novorozenci a kojenci
a) Doporučení pro suplementaci
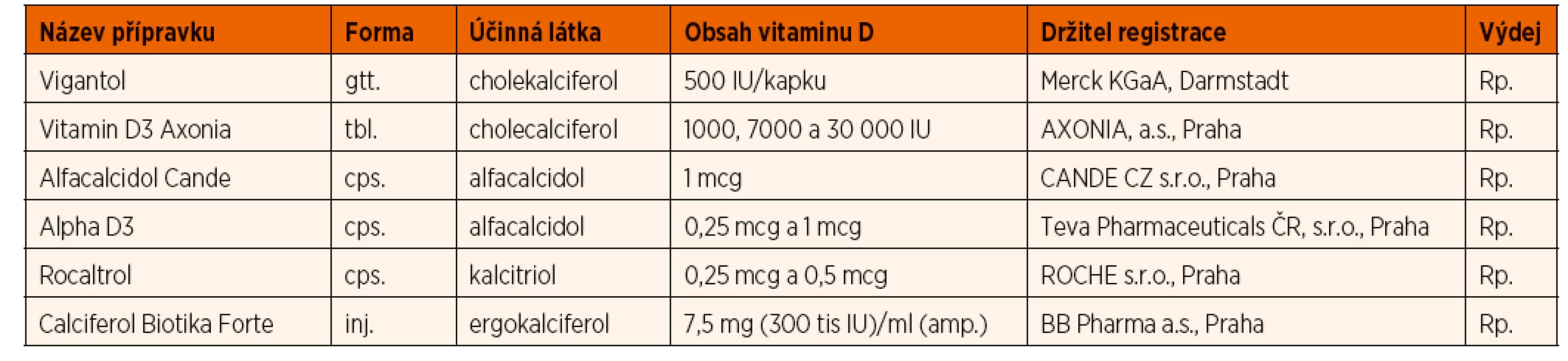
V souladu s Doporučením Pracovní skupiny dětské gastroenterologie a výživy ČPS (PSDG) pro výživu kojenců a batolat (PSDG 2014) a doporučením ESPGHAN (Braegger 2013) podáváme jak dětem kojeným, tak kojencům živeným náhradní kojeneckou mléčnou výživou (kojeneckou formulí) od druhého týdne života v průběhu celého prvního roku vitamin D3 (cholekalciferol) v dávce 400–500 IU denně p.o. Dosud zavedená praxe podávání cholekalciferolu diferencovaně do 12, resp. 18 měsíců podle sezonality narození dítěte, činí v praxi potíže a není založena na jednoznačných důkazech efektivity. Proto jsme se v tomto doporučení rozhodli změnit dosavadní praxi a u zdravých kojenců bez rizikových faktorů limitovat podávání vitaminu D do 12 měsíců. Dávka 500 IU odpovídá 1 kapce v současnosti na trhu nejdostupnějšího preparátu v ČR. Při dlouhodobém podávání této dávky nebyl popsán vznik rachitidy. Preparáty určené k substituci vitaminu D u dětí a dostupné na našem trhu uvádí tabulka 6.
Praktický lékař pro děti a dorost by měl pravidelně upozorňovat rodiče na nutnost podávání suplementace vitaminem D, neboť je známo, že ne vždy jsou preparáty vitaminu D rodiči aplikovány pravidelně (Uday 2016).
b) Tolerovatelná horní hranice denního příjmu
Dávka 400–500 IU denně se zdá být racionální i vzhledem k evropským doporučením (European Food Safety Authority - EFSA), kdy je za tolerovatelnou horní hranici denního příjmu vitaminu D u zdravého kojence považováno 1000 IU (EFSA panel 2012). Tento celkový příjem ve stravě zahrnuje také vitamin D obsažený v kojeneckých formulích, příkrmech a event. také potravinových doplňcích. Je tedy třeba na tuto skutečnost myslet a cílenou anamnézou orientačně ověřit celkový perorální příjem vitaminu D u kojence.
Podle nařízení Evropské komise (direktiva 2006/141/EC) jsou všechny počáteční formule fortifikovány vitaminem D v dávce 1–2,5 μg/100 kcal (40–100 IU/100 kcal) a pokračovací formule v dávce 1–3 μg/100 kcal (40 až 120 IU/100 kcal). Pro batolecí formule není toto doporučení závazné. Příklady obsahu vitaminu D v některých formulích dostupných na českém trhu jsou uvedeny v příloze 1. Kojenci, kteří jsou výlučně kojeni nebo nedostávají alespoň 500 ml kojenecké formule denně, mohou být v riziku deficitu vitaminu D, pokud by nedostávali doporučenou substituci vitaminem D. Riziko je ještě větší v případě, kdy kojící matka trpí deficitem vitaminu D.
Při zavádění příkrmů je vhodné zařadit do jídelníčku skupiny potravin, které jsou dobrým zdrojem vitaminu D. Orientační obsah vitaminu D v některých potravinách je uveden v příloze 2.
Podávání potravinových doplňků s obsahem vitaminu D není u zdravých fyziologických kojenců opodstatněné, v praxi se s ním však v některých případech setkáváme. Na tuto skutečnost je třeba myslet a cíleně po ní pátrat v anamnéze. Navíc některé kombinované přípravky obsahují i vitamin A, u něhož hrozí riziko předávkování.
4.2. Nedonošené děti
Prematurita s sebou nese zvýšené riziko deficitu vitaminu D, zejména z důvodu nízkých tukových zásob a sníženého příjmu mléka (i pokud se jedná o mléko fortifikované vitaminem D). Dvojitě zaslepená studie zjistila, že souhrnná dávka vitaminu D 200 IU/kg/den ze všech zdrojů do celkové maximální dávky 400 IU/den je dostatečná k udržení normálních hladin vitaminu D a normální kostní denzity u nedonošených (Backström 1999). V jiné studii byla pro zachování optimálních hladin vitaminu D dostačující dávka 200 IU/den při dostatečném příjmu kalcia ve stravě (Koo 1995).
V souladu s mezinárodními doporučeními považujeme za praktické doporučení podávat nedonošeným jedincům od propuštění do domácí péče až do 1 roku korigovaného věku vitamin D v dávce 400–500 IU/den navíc k ostatním zdrojům (ze stravy, mléka či fortifikátorů apod.). ESPGHAN doporučuje celkový denní příjem ze všech zdrojů v rozmezí 800–1000 IU/den (Agostoni 2010). V současnosti je v ČR rozšířená praxe podávání suplementace v dávce 1000 IU/den, kterou lze taktéž akceptovat, nicméně nebyl dosud popsán případ, kdy by dávka 500 IU/den nebyla dostatečná u nedonošeného dítěte bez dalšího rizikového faktoru.
Zásady podávání vitaminu D kojencům přehledně podává tabulka 7.
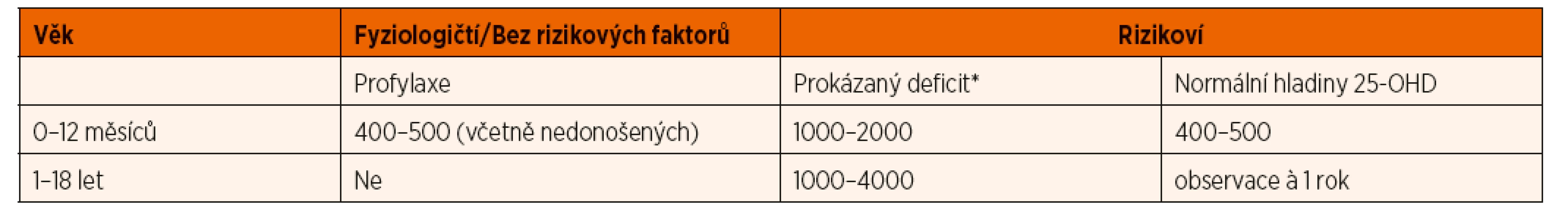
4.3. Děti starší 1 roku potenciálně rizikové z nedostatku vitaminu D a kalcia
U dětí starších jednoho roku není paušální suplementace vitaminem D doporučována (Munns 2016), může být však výhodná u některých dětí z rizikových skupin (tab. 4). Frekvence provádění biochemického screeningu k vyloučení deficitu vitaminu D se řídí doporučeními pro konkrétní diagnózu a přesahuje šíři tohoto doporučení primárně zaměřeného na zdravou dětskou populaci.
Před zahájením substituce je u rizikových pacientů nutné vyšetřit hladinu 25-OHD, kalcémii, ALP a PTH. V případě, že ALP a PTH nejsou zvýšené (pozor, nutno používat věkově specifické normy pro ALP), pak indikace pro substituci není imperativní a závisí na celkovém klinickém stavu pacienta.
Zjistíme-li současně nízkou koncentraci 25-OHD a elevaci PTH či ALP, zahajujeme léčbu vždy, a to v počáteční dávce 1000–2000 IU denně. Současně doporučíme zvýšený příjem kalcia ve stravě. Efektivitu podávání kontrolujeme nejlépe pomocí sérových hladin kalcia, 25-OHD a PTH, zpočátku à 6–8 týdnů. V případě, že na této dávce nedosáhneme koncentrace 25-OHD >35 nmol/l (Munns 2016), je možno dávku postupně navyšovat až na 4000 IU (u dětí nad 1 rok věku) za bedlivého monitorování kalcémie a 25-OHD. Optimální rozmezí 25-OHD je u těchto dětí mezi 50 a 150 nmol/l, vyšší koncentrace mohou způsobovat nadměrnou osteoresorpci s následnou hyperkalcémií a zvyšovat riziko nefrokalcinózy. U řady z těchto pacientů je nutná substituce pouze v zimních měsících.
Pomine-li důvod zvýšeného rizika deficitu vitaminu D, například z důvodu kompenzace základního onemocnění či jeho vyléčení/kompletní remise, měli bychom se pokusit léčbu vysadit po edukaci pacienta stran příjmu kalcia a režimových opatření. U většiny dětí s příznivým průběhem chronického onemocnění není nutná celoživotní léčba, příležitostné kontroly hladiny 25-OHD jsou vhodné.
Praktický přístup k podávání vitaminu D v jednotlivých věkových skupinách podává tabulka 7.
4.4. Těhotné a kojící ženy
Globální konsenzus pro prevenci a terapii nutriční rachitidy doporučuje plošnou suplementaci těhotných vitaminem D3 v dávce 600 IU denně po celou dobu gravidity (pokud není dostatečný příjem vitaminu D zajištěn spolehlivě jiným způsobem) (Munns 2016). Některá jiná doporučení (Holick 2011) udávají i vyšší doporučené hodnoty (1000–2000 IU/den), pro jejich užití však nejsou v současné době dostatečně přesvědčivá data. V našich podmínkách lze z praktických důvodů akceptovat denní dávku u těhotných 500 IU vitaminu D3 vzhledem k dostupnosti preparátu, který obsahuje 500 IU v 1 kapce preparátu po celou dobu gravidity. Tato dávka by měla pokrýt zvýšenou potřebu vitaminu D u gravidních žen. Podávání vitaminu D však nezvyšuje kostní denzitu u novorozenců či malých kojenců (Cooper 2016) a vliv suplementace na antropometrická porodní data ukazuje různorodé výsledky, intervenční studie neprokázaly žádný vliv na postnatální vývoj dítěte (Hollis 2011, Wagner 2013, Dawodu 2013). Příjem kalcia by měl být zajištěn jeho dostatečným zastoupením v jídelníčku těhotné, přičemž zvýšená suplementace kalciem se u této skupiny žen paušálně nedoporučuje (Munns 2016). U kojících žen je vhodné pokračovat v suplementaci vitaminem D stejně jako před porodem a navíc doplnit kalciem v dávce 1000 mg/den (pokud není dostatečný příjem kalcia zajištěn spolehlivě jiným způsobem).
V těhotenství a při kojení jsou za bezpečné považovány dávky vitaminu D maximálně 4000 IU denně a kalcia 3000 mg denně (a to i ve vzájemné kombinaci). V plošné substituci je však nedoporučujeme, 500-1000 IU/den se zdá být zcela dostatečné (Munns 2016). Podobně jednorázové podávání velmi vysokých dávek (kumulovaná dávka za delší období – 50 000–150 000 IU jednorázově á 3 měsíce) užívané v některých zemích, nepovažujeme v našich podmínkách za smysluplné.
5. DIAGNOSTIKA A TERAPIE RACHITIDY Z NEDOSTATKU VITAMINU D A KALCIA (NUTRIČNÍ RACHITIDA)
Vitamin D deficitní rachitida vzniká u dětí vlivem nedostatku vitaminu D a/nebo kalcia. Ekvivalentem této nemoci v dospělosti je osteomalacie. V současné době se tento typ rachitidy může u nás vyskytnout prakticky výhradně u dětí, kterým rodiče nepodávají vitamin D, nebo které mají přísnou vegetariánskou (veganskou) stravu, nebo u dětí s malabsorpcí nebo mají jiné onemocnění snižující koncentraci kalcitriolu či dostupnost kalcia.
V patogenezi nutriční rachitidy rozlišujeme několik fází. V důsledku nízké hladiny vitaminu D klesá resorpce kalcia ve střevě, což vede ke snížené nabídce kalcia pro skelet. V důsledku toho dochází k poruše enchondrální a periostální osifikace. Kostní matrix zůstává neosifikována, což se projeví typickými klinickými příznaky (tab. 3). Při pokračujícím deficitu vitaminu D dále klesá střevní resorpce kalcia, rozvíjí se sekundární hyperparatyreóza s cílem udržet kalcémii v normálním rozmezí. Snižuje se růstová rychlost, dochází k deformacím kostí (deformity hrudníku zvyšují riziko pneumonie s atelektázami), mohou se objevit patologické fraktury. Pro nejtěžší fázi rachitidy jsou typické symptomy hypokalcémie - spazmofilie, tetanie, laryngospazmus, kardiomyopatie s rizikem arytmií a hypokalcemické křeče.
Vitamin D deficitní rachitidu léčíme vitaminem D podle doporučení Globálního konsenzu pro prevenci a terapii rachitidy z roku 2016 (Munns 2016) (viz tab. 8). U kojenců podáváme terapeuticky 2000 IU vitaminu D3 po dobu 90 dnů, u dětí ve věku 3–12 měsíců lze ve výjimečných případech alternativně akceptovat jednorázovou dávku vitaminu D2 50 000 IU podanou i.m. Tento přístup aplikujeme zejména v případě malabsorpce či předpokládané nespolupráce rodiny. U dětí starších 12 měsíců a mladších 12 let se tyto dávky zvyšují na 3000–6000 IU/den, resp. 150 000 IU jednorázově i.m., u starších dětí potom doporučujeme 6000 IU/den či 300 000 IU jednorázově i.m. Vždy je následně nutné pokračovat v substituci v dávce 500 IU denně bez ohledu na věk. Současně je zcela nezbytné substituovat kalcium v dostatečném množství. Při manifestní tetanii je první pomocí velmi pomalá i.v. injekce 10% Calcium gluconicum v dávce 1 ml/kg/dávku. Přehled léčiv s obsahem vitaminu D registrovaných v ČR je uveden v tabulce 6.
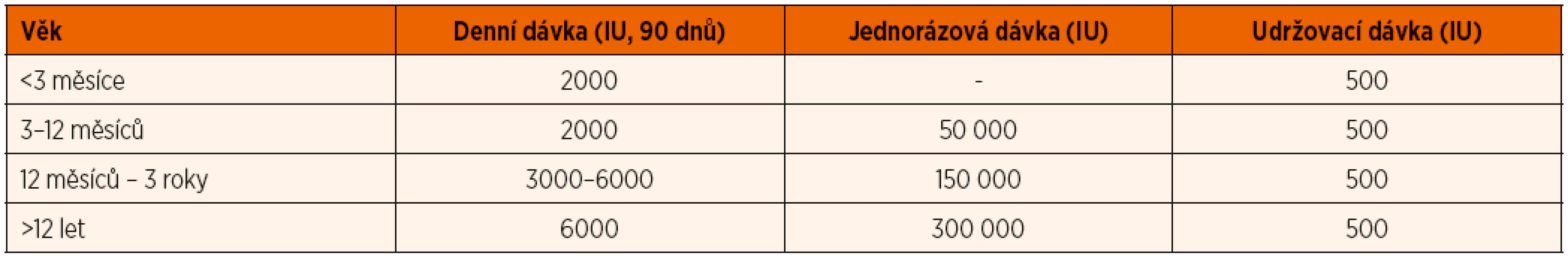
5. 1. Předávkování vitaminem D
Při podávání vyšších dávek vitaminu D bez adekvátní kontroly 25-OHD hrozí předávkování, které se klinicky projevuje neprospíváním, nechutenstvím, zvracením, zácpou, polyurií, polydipsií, v dlouhodobém horizontu vznikem nefrokalcinózy, vaskulárních či jiných ektopických kalcifikací (Vogiatzi 2014, Jackson 2006). Laboratorně nacházíme hyperkalcémii, hyperfosfatémii, elevaci ALP, snížení PTH, zvýšení 25-OHD a vysoký Ca/kreatininový index. Jde o poměrně vzácnou komplikaci typicky odhalenou při hladinách kalcidiolu přesahujících 250 nmol/l, výjimečně při hladinách nižších. Longitudinální studie u dospělých ukazují, že dlouhodobé podávání vitaminu D u neselektované populace vede k mírnému zvýšení rizika nefrokalcinózy (Jackson 2006). Proto bychom měli indikovat dlouhodobé podávání preparátů vitaminu D uvážlivě a pravidelně kontrolovat uvedené markery, zejména v prvních měsících podávání.
6. ZÁVĚR
Význam vitaminu D pro zdraví člověka je nepochybný. Zavedení profylaxe rachitidy u novorozenců a kojenců patří mezi důležité mezníky pediatrie a měla by být důsledně indikována a kontrolována. Potravinové doplňky nejsou u dětí do 1 roku dlouhodobě vhodnou alternativou k léčivým přípravkům. Vyšetřování hladin 25-OHD a podávání vitaminu D u zdravých dětí starších 1 roku se paušálně nedoporučuje. U rizikových skupin je však třeba cíleně pátrat po biochemických parametrech insuficience a v případě potřeby zahájit terapii.
Adresa pro korespondenci:
Prof. MUDr. Zdeněk Šumník, Ph. D.
Pediatrická klinika 2. LF UK
a FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: zdenek.sumnik@lfmotol.cuni.cz
Vytvořeno: 27. 7. 2019



Obsah kalcia v potravinách na příkladech
300 mg kalcia je možno získat např. z těchto zdrojů:
3 kg pomerančů
2 jogurty
5 baget
250 ml mléka
1 kapusta o váze asi 850 g
30 g tvrdého sýra, např. ementálu
40 g sýra s modrou plísní
300 g tvarohu nebo čerstvého sýra
4 kg hovězího masa
120 g mandlí
80 g sardinek
2,5 l pomerančového džusu
10 talířů sojových klíčků
Sources
1. Agmon-Levin N, Theodor E, Segal RM, Schoenfeld Y. Vitamin D in systemic and organ-specific autoimmune disease. Clin Rev Allergy Immunol 2013; 45 : 256–266.
2. Agostoni C, et al. Enteral nutrient supply for preterm infants: commentary from the European Society of Paediatric Gastroenterology, Hepatology and Nutrition Committee on Nutrition. J Pediatr Gastroenterol Nutr 2010 Jan; 50 (1): 85–91.
3. Backström MC, Mäki R, Kuusela AL, et al. Randomised controlled trial of vitamin D supplementation on bone density and biochemical indices in preterm infants. Arch Dis Child Fetal Neonatal Ed 1999; 80: F161–166.
4. Bělohlávková S, Bronský J, et al. Doporučení Pracovní skupiny dětské gastroenterologie a výživy ČPS pro výživu kojenců a batolat. Čes-slov Pediat 2014; 69 (Suppl 1): 1–47.
5. Bogh MK, Schmedes AV, Philipsen PA, et al. Interdependence between body surface area and ultraviolet B dose in vitamin D production: a randomized controlled trial. Br J Dermatol 2011; 164 : 163–169.
6. Braegger C, Campoy C, Colomb V, et al. Vitamin D in healthy European paediatric population. J Pediatr Gastroenterol Nutr 2013; 56 : 692–701.
7. Carter GD. A ccuracy of 25-hydroxyvitamin D assays: confronting the issues. Curr Drug Targets 2011; 12 : 19–28.
8. Ceccaldi PF, Pejoan H, Breau N. French prenatal vitamin D recommended supplementation: Enough or not? J Gynecol Obstet Hum Reprod 2017 Jan; 46 (1).
9. Cooper C, et al. Maternal gestational vitamin D supplementation and offspring bone health (MAVIDOS): a multicenter, double-blind, randomised placebo-controlled trial. Lancet Diabetes & Endocrinology 2016; 4 (5): 393–402.
10. Cranney A, Horsley T, O’Donnell S, et al. Effectiveness and Safety of Vitamin D in Relation to Bone Health. Evidence Report/Technology Assessment No. 158 (Prepared by the University of Ottawa Evidence-based Practice Center (UO-EPC) under Contract No. 290-02-0021. AHRQ Publication No. 07-E013. Rockville, MD: Agency for Healthcare Research and Quality. August 2007.
11. Dawodu A, Saadi HF, Bekdache G, et al. Randomized controlled trial (RCT) of vitamin D supplementation in pregnancy in a population with endemic vitamin D deficiency. J Clin Endocrinol Metab 2013; 98 : 2337–2346.
12. DeLuca GC, Kimball SM, Kolasinski J, et al. The role of vitamin D in nervous system health and disease. Review. Neuropathol Appl Neurobiol 2013; 39 : 458–484.
13. DeLuca HF. Overview of general physiologic features and functions of vitamin D. Am J Clin Nutr 2004; 80 (Suppl): 1689S–1696S.
14. Diffey BL. Modelling the seasonal variability of vitamin D due to sun exposure. Br J Dermatol 2010; 162 : 1342–48.
15. Direktiva Evropské komise 2006/141/ES ze dne 22. prosince 2006 o počáteční a pokračovací kojenecké výživě a o změně směrnice 1999/21/ES.
16. EFSA Panel on Dietetic Products NaACA. Scientific opinion on the tolerable upper intake level of vitamin D. EFSA J 2012; 10 : 45.
17. Franasiak JM, Lara EE, Pellicer A.Vitamin D in human reproduction. Curr Opin Obstet 2017, May 29.
18. Gellert S, Strohle A, Bitterlich N. Higher prevalence of vitamin D deficiency in German pregnant women compared to non pregnant women. Arch Gynecol Obstet 2017; May 19.
19. Hewison M, Freeman L, Hughes SV, et al. Differential regulation of vitamin D receptor and its ligand in human monocyte-derived dendritic cells. J Immunol 2003 : 170 : 5382–5390.
20. Hewison M. Vitamin D and the immune system: new perspectives on an old theme. Endocrinol Metab Clin North Am 2010; 39 : 365–379.
21. Holick MF. Vitamin D deficiency. N Engl J Med 2007; 357 : 266–281.
22. Holick MF. Evaluation, treatment, and prevention of vitamin D deficiency: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab 2011; 96 : 1911–1930.
23. Hollis BW, Johnson D, Hulsey TC, et al. Vitamin D supplementation during pregnancy: double-blind, randomized clinical trial of safety and effectiveness. J Bone Miner Res 2011; 26 : 2341–2357.
24. Hradsky O, Soucek O, Maratova K, et al. Supplementation with 2000 IU of cholecalciferol is associated with improvement of trabecular bone mineral density and muscle power in pediatric patients with IBD. Inflamm Bowel Dis 2017 Apr; 23 (4): 514–523.
25. Institute of Medicine (IOM). Dietary Reference Intakes for Calcium and Vitamin D. Washington, DC: National Academies Press, 2011.
26. Jackson RD, LaCroix AZ, Gass M, et al. Calcium plus vitamin D supplementation and the risk of fractures. N Engl J Med 2006 Feb 16; 354 (7): 669–683.
27. Kasahara AK, Singh RJ, Noymer A. Vitamin D (25OHD) serum seasonality in the United States. PLoS One 2013 Jun 21; 8 (6): e65785.
28. Koo WW, et al. Effect of three levels of vitamin D intake in preterm infants receiving high mineral-containing milk. J Pediatr Gastroenterol Nutr 1995 Aug; 21 (2): 182–189.
29. Libon F, Courtois J, Le Goff C, et al. Sunscreens block cutaneous vitamin D production with only a minimal effect on circulating 25-hydroxy--vitamin D. Arch Osteoporos 2017 Dec; 12 (1): 66.
30. Maratova K, Soucek O, Matyskova J, et al. Muscle functions and bone strength are impaired in adolescents with type 1 diabetes. Bone 2018 Jan; 106 : 22–27.
31. Miraglia del Giudice E, Grandone A, Cirillo G, et al. Bioavailable vitamin D in obese children: The role of insulin resistance. J Clin Endocrinol Metab 2015; 100 : 3949–3955.
32. Munns CF, Shaw N, Kiely M, et al. Global Consensus Recommendations on Prevention and Management of Nutritional Rickets. Horm Res Paediatr 2016; 85 (2): 83–106.
33. Norman AW. From vitamin D to hormone D: fundamentals of the vitamin D endocrine system essential for good health. Am J Clin Nutr 2008; 88 (2): 491–499.
34. SACN (Scientific Advisory Committee for Nutrition). Vitamin D and Health report, July 2016, https://www.gov.uk/government/publications/sacn-vitamin-d-and-health-report.
35. Shaw NJ, Mughal MZ. Vitamin D and child health: part 2 (extraskeletal and other aspects). Arch Dis Child 2013 May; 98 (5): 368–372.
36. Štercl I. D vitamin a imunita. Vnitř Lék 2012; 58 (5): 405–410.
37. Uday S, Kongjonaj A, Tulchinsky T, Högler W. Characteristics of vitamin D supplementation programs for the prevention of rickets in infants and young children in Europe: Factors influencing compliance. BSPED 2016. ISSN 1479–6848 (online). Available from: http://www.endocrine-abstracts.org/ea/0045/BSPED2016AbstractBook.pdf.
38. Vogiatzi MG, Jacobson-Dickman E, DeBoer MD; Drugs, and Therapeutics Committee of The Pediatric Endocrine Society. Vitamin D supplementation and risk of toxicity in pediatrics: a review of current literature. J Clin Endocrinol Metab 2014 Apr; 99 (4): 1132–1141.
39. Wagner CL, McNeil R, Hamilton SA, et al. A randomized trial of vitamin D supplementation in 2 community health center networks in South Carolina. Am J Obstet Gynecol 2013; 208 : 137.e1–e13.
40. Wang Y, Zhu J, DeLuca HF. Where is the vitamin D receptor? Arch Biochem Biophys 2012; 523 : 123–133.
41. Webb AR, Engelsen O. Ultraviolet exposure scenarios: risks of erythema from recommendations on cutaneous vitamin D synthesis. Adv Exp Med Biol 2008; 624 : 72–85.
42. Zlotkin S. Vitamin D concentrations in Asian children living in England. Limited vitamin D intake and use of sunscreens may lead to rickets. BMJ 1999; 318 : 1417.
Labels
Neonatology Paediatrics General practitioner for children and adolescentsArticle was published in
Czech-Slovak Pediatrics

2019 Issue 8
- What Effect Can Be Expected from Limosilactobacillus reuteri in Mucositis and Peri-Implantitis?
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
- Treatment of appendicitis in pediatric patients – Status quo 2017
- Changes in blood pressure and some other parameters in term infants during phototherapy
- Is coarctation of the aorta in pediatrics a risk diagnosis?
- Amniotic fluid aspiration in newborn
- Adenoid vegetation and adenoidectomy in children
- Doporučený postup České pediatrické společnosti a Odborné společnosti praktických dětských lékařů ČLS JEP pro suplementaci dětí a dospívajících vitaminem D
- XXXIV. Celoštátna konferencia Spoločnosti dorastového lekárstva s medzinárodnou účasťou
- Vzpomínka na MUDr. Josefa Havlíka (1931–2019)
- Věcný rejstřík
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Amniotic fluid aspiration in newborn
- Doporučený postup České pediatrické společnosti a Odborné společnosti praktických dětských lékařů ČLS JEP pro suplementaci dětí a dospívajících vitaminem D
- Adenoid vegetation and adenoidectomy in children
- Treatment of appendicitis in pediatric patients – Status quo 2017
