EMFYZEMATÓZNÍ PYELONEFRITIDA – POPIS ŠESTI PŘÍPADŮ
EMPHYSEMATOUS PYELONEPHRITIS – DESCRIPTION OF SIX CASES
The author of this communication describes six cases of emphysematous pyelonephritis. The mean age of patients was 63.5, with the disease seen most frequently in men. None of the cases were associated with stone disease. Two thirds of patients had diabetes mellitus. Escherichia coli was confirmed in the urine most frequently, and in one case, Klebsiella pneumoniae was identified. The author presents the methods of treatment used in each case. Emphysematous pyelonephritis resulted in death of a patient in one case only.
KEY WORDS:
Emphysematous pyelonephritis.
Authors:
Petr Prošvic
Authors‘ workplace:
Urologické oddělení, Oblastní nemocnice Náchod, a. s.
Published in:
Ces Urol 2015; 19(1): 69-77
Category:
Case report
Overview
Autor v článku popisuje šest případů emfyzematózní pyelonefritidy. Průměrný věk nemocných byl 63,5 roku, onemocnění se vyskytovalo častěji u mužů a ani v jednom případě nebyl příčinou konkrement. Dvě třetiny nemocných byli diabetici a nejčastěji byla prokázána jako etiologické agens Escherichia coli a v jednom případě Klebsiella pneumonie. Autor uvádí způsoby léčby jednotlivých případů onemocnění. Pouze v jednom případě vedla emfyzematózní pyelonefritida ke smrti pacienta.
KLÍČOVÁ SLOVA:
Emfyzematózní pyelonefritida.
ÚVOD
Emfyzematózní pyelonefritida (EP) je vzácné zánětlivé onemocnění ledvinného parenchymu a přilehlých perirenálních tkání vyvolané plynem tvořícími mikroorganizmy. Vždy jde o velmi závažný stav ohrožující život pacienta a zpravidla vede k nevratnému poškození funkce postižené ledviny. EP byla popsáno jako komplikace řady onemocnění, avšak postihuje především diabetiky a může být i prvním projevem onemocnění (1–9). Na EP je třeba pomýšlet v prvé řadě u septických diabetiků, zvláště v případě současného rozvoje akutní renální insuficience (5).
Ve většině případů se jedná o jednostranné postižení. Oboustranné postižení je spojené s vysokou mortalitou (10). Vyskytuje se velmi vzácně, asi v 10 % případů (11). Vždy jde o závažný, život ohrožující stav, zvláště pak v případě oboustranného postižení, které velmi často vede ke smrti pacienta (mortalita se pohybuje okolo 10–40 %) (12, 13).
První případ emfyzematózní pyelonefritidy byl popsán v roce 1898 jako akutní nekrotizující infekce plyn produkujícími bakteriemi postihující parenchym a perirenální tkáně (14). Hlavní faktory vedoucí ke vzniku EP jsou čtyři (15): infekce plyn tvořícími bakteriemi, vysoká hladina glukózy v parenchymu, nedostatečná perfuze parenchymu (infarkt, trombóza, arterioloskleróza a glomeruloskleróza) (16) a poruchy imunitní odpovědi.
Onemocnění postihuje především diabetiky, a to v 70–96 % všech případů (16–19). Postižení diabetiků je častější u nemocných s nedostatečně kompenzovaným diabetem (hladina A1c hemoglobinu více jak 11 %) (20). Ženy jsou postiženy častěji v poměru 6 : 1 (4). Může postihnout pacienty různého věku, dle Narlawara od 24 do 75 let (21), průměrný věk byl 56,3 roku. Častěji je postižena ledvina levá (52 vs. 43 %) (3).
Riziko vzniku EP zvyšuje současný výskyt subrenální obstrukce (v 19 %) a výskyt litiázy (23 %) (3, 16). Bilaterální onemocnění bylo popsáno také u adultních polycystických ledvin (22). Současný výskyt byl popsán také u tumorů ledvin (23, 24), u pacienta v konečném stadiu ledvinného selhání na peritoneální dialýze (25) a v transplantované ledvině (26).
Jako infekční agens se nejčastěji prokáže Escherichia coli (69 %), Klebsiella pneumoniae (29 %) a zcela ojediněle i další plynotvorné a anaerobní bakterie (Proteus mirabilis, Pseudomonas aeruginosa, Streptococcus skupiny D, koaguláza negativní Staphylococcus, Clostridium septicum, Cryptococcus neoformans, Pneumocystis jiroveci), které produkují vodík a oxid uhličitý (v menším množství také amoniak, metan a oxid uhelnatý) štěpením glukózy (16, 20, 27, 28). Jako další agens byla popsána i u oboustranného výskytu kandidová infekce (C. tropicalis, C. albicans) (29–31). U pacienta s EP v transplantované ledvině byla v hemokultuře a v moči prokázána infekce Salmonelou (sérotyp O 6, 8 nebo C 2) a v hemokultuře Enterobacter cloacae (26), úspěšná léčba byla zahájena empiricky imipenemem, cefepimem, metronidazolem a diflucanem s následnou šestitýdenní léčbou ciprofloxacinem. Ahmad popsal EP vyvolanou plísňovou infekcí Aspergillus fumigatus u nediabetického pacienta úspěšně léčeného amfotericinem B a 5-fluorocytosinem (32). Yanagawa prokázal v roce 2013 jako etiologické agens Citrobacter freundii (33).
EP se projevuje nejčastěji jako horečky spojené se zimnicemi (80 %) a bolesti v kostovertebrálním úhlu (71 %) (3), nevolnost, zvracení, bolesti břicha, šokový stav, zmatenost a letargie (34). U pacienta na peritoneální dialýze se EP projevila jako symptomy náhlé břišní příhody (25). Byly popsány případy výskytu pneumomediastina a subkutánního emfyzému (24) a také, právě u oboustranné EP, průnik plynu do okolí míchy a vznik subkapsulárního hematomu (19, 35, 36). V některých případech se plyn šíří také do šourku a semenného provazce (21).
K vyšetřením, která pomáhají v diagnostice EP, patří nativní rtg snímek ledvin, ultrasonografie, vylučovaní urografie, computerová tomografie a retrográdní pyelografie (37). Senzitivita detekce abnormálního plynu je dle Kua 66 % pro nativní snímek a 88 % pro ultrasonografii. Základním vyšetřením je computerová tomografie (CT). Dle CT nálezu rozděluje Huang EP do čtyř tříd – viz tabulka 1 (16).

Ke sledování lze užít CT a renální scintigrafii. Při dlouhodobém sledování vývoje onemocnění prokazuje CT renální atrofii a okrskové jizvení. Průměrné snížení ledvinných funkcí je dle scintigrafie 30 % (37).
Úspěšnost léčby závisí na její časnosti a radikalitě. Základem je terapie šokového stavu, intenzivní kombinovaná antibiotická terapie (podaná vždy intravenózně – cefalosporin III. generace, kombinovaný penicilinový preparát s inhibitorem beta-laktamázy, aminoglykosid, fluorochinolon a metronidazol) v kombinaci s terapií šokového stavu a radikální chirurgickou léčbou v podobě urgentní nefrektomie (4, 12, 16). Byly však popsány případy úspěšného vyléčení pouze medikamentózní terapií – intenzivní antibiotickou léčbou a podporou oběhu (5, 38). Konzervativní intervenční léčba zahrnuje použití perkutánní nefrostomie (21, 39, 40) či zavedení ureterálních stentů (41), které zajistí drenáž hnisu a plynu. Bilaterální nefrostomie byla s úspěchem použita i u bilaterálního onemocnění (42). S úspěchem byla také použita metoda perkutánní drenáže ložisek EP (43–45).
KAZUISTIKA 1
V srpnu 2005 přichází pacient, 66 let, diabetik (DM) na perorálních antidiabeticích, obézní, jinak zcela zdráv. Přichází pro pět dní trvající pocit žízně, únavu, slabost a dva dny trvající teploty kolem 38 °C. Udává makroskopickou hematurii. Sonograficky byl nalezen plyn v dutém systému pravé ledviny a v jejím okolí, plyn v okolí levé ledviny. Computerová tomografie (CT) zobrazila oboustranný rozpad tkáně ledvin s obrazem flegmonózní plynotvorné infekce (obr. 1). Laboratorně zjištěna anémie, leukocytóza, trombocytopenie, prodloužení koagulačních testů a pokles antitrombinu III s rozvojem diseminované intravaskulární koagulace. Biochemicky bylo zvýšení jaterních testů a minerálová dysbalance. Kultivačně byla v moči i v krvi prokázaná Escherichia coli citlivá na veškerá běžná antibiotika. Zahájena antibiotická (ATB) léčba – metronidazol, cefotaxim a amoxicilin. Od přijetí byl pacient oligoanurický, proto byla provedena akutní hemodialýza. Provedeny byly převody erymasy, plazmy, trombocytární náplavy a antitrombinu III, aplikován byl nízkomolekulární heparin a diabetes byl kompenzován krátkodobým inzulinem. Postupně přes intenzivní léčbu dochází k rozvoji septického šoku. Pro progresi stavu přistoupeno k akutní bilaterální nefrektomii. Celkový stav pacienta se však nadále zhoršoval a pacient 50 hodin od přijetí umírá na akutní sepsi.

KAZUISTIKA 2
V září 2007 přichází pacient ve věku 56 let, fumator, diabetik na inzulinoterapii s přidruženými onemocněními (chronická obstrukční plicní nemoc 2. stupně, hypertenze, chronická pankreatitida) pro 12 hodin trvající anurii a tři dny trvající horečky kolem 40 °C spojené s bolestmi v obou bederních krajinách. Ultrasonograficky (US) byly ledviny bez městnání, bohatšího parenchymu. Laboratorně byla zjištěna elevace urey a kreatininu, hyperglykemie a elevace CRP, v krevním obrazu byla anémie a leukocytóza. Kultivačně byla prokázána Escherichia coli citlivá na veškerá běžná antibiotika. Nasazena byla ATB terapie ciprofloxacinem. Následující den po přijetí trvá oligoanurie a febrilie – do kombinace byl přidán gentamicin a metronidazol. Čtvrtý den dle US byl oboustranně edematózní parenchym široký 40 mm, hypotonie pánvičky vpravo (12 mm) a ložisko plynu o velikosti 35 mm. Provedená computerová tomografie prokazuje emfyzematózní pyelonefritidu dolního pólu pravé ledviny (obr. 2). Vzhledem k nálezu a rozvoji septického stavu byl zaveden stent vpravo a ciprofloxacin nahrazen cefotaximem. Otevřená operace neindikována vzhledem k prodloužení koagulačních parametrů. Tentýž den dochází k progresi septického stavu, a proto přistoupeno po přípravě čerstvou plazmou k operační revizi pravé ledviny. Vzhledem k nálezu solitárního dobře přístupného ložiska a stabilizaci celkového stavu pacienta byla provedena dekapsulace ledviny a drenáž. Pokračovala ATB terapie ve čtyřkombinaci cefotaxim, flukonazol, metronidazol a ciprofloxacin. Postupně došlo k úplné úpravě celkového stavu a funkci ledvin. Poslední US kontrola s nálezem přiměřeného a homogenního parenchymu ledvin (obr. 3), hladina urey byla 6,1 mmol/l a kreatininu 99 μmol/l.


KAZUISTIKA 3
V březnu 2009 byl přijat pacient, 74 let, kompenzovaný kardiak, na interní oddělení pro asi dva měsíce trvající bolesti v pravém kyčelním kloubu, nechutenství a zhubnutí 15 kilogramů. Laboratorně mírná leukocytóza a výrazná elevace CRP, ostatní nález v oblasti fyziologických hodnot. Nasazen byl empiricky amoxicilin/klavulanát 3 x 1.2 g i. v. Druhý den dochází k rozvoji intenzivních bolestí v pravé polovině břicha. Kultivačně byla prokázána Escherichia coli citlivá na veškerá běžná antibiotika. Dle US a CT vyšetření byl prokázán rozsáhlý absces pravé ledviny s bublinkami plynu (obr. 4). Vzhledem k nálezu byla provedena akutní pravostranná nefrektomie a zahájena terapie dvojkombinací ATB – ciprofloxacin + gentamicin. Postupně došlo k úplné úpravě celkového stavu, zůstává chronická renální insuficience (CHRI) 3. stupně na podkladě levostranné chronické tubulointersticiální nefritidy.

KAZUISTIKA 4
V listopadu 2011 byl přijat pacient, 66 let, s DM II. typu dekompenzovaný na inzulinoterapii s CHRI na podkladě diabetické nefropatie, hypertenzní nefrosklerózy a mnohočetných cyst oboustranně, kardiak po revaskularizační operaci a s intersticiální plicní fibrózou na terapii kortikosteroidy na interní oddělení pro bolesti v levém hemitoraxu a levé polovině břicha trvající dva dny. Laboratorně byla leukocytóza s posunem k nezralým formám leukocytů, elevace CRP, dekompenzace CHRI a elevace jaterních testů. Zahájena byla ATB terapie kombinací klaritromycin + amoxicilin/klavulanát, která následně byla změněna na metronidazol + ciprofloxacin. Kultivačně byla nalezena polyrezistentní Klebsiella pneumonie. Po pěti dnech byl dle CT vyšetření prokázán rozsáhlý absces levé ledviny s bublinami plynu (obr. 5). Byla provedena drenáž a dekapsulace levé ledviny a změna ATB terapie na meropen. Postupně dochází ke zlepšení celkového stavu i renálních funkcí, ale po deseti dnech po operaci dochází k dekompenzaci plicního onemocnění a pacient na jeho dekompenzaci umírá na interním oddělení jeden měsíc po urologické operaci.

KAZUISTIKA 5
V říjnu 2013 pacient, 53 let, bez přidružených onemocnění, byl přijat k operační revizi levé ledviny pro CT nález emfyzematózní pyelonefritidy dolního pólu (obr. 6). Pro močovou infekci v té době léčen třetí den ciprofloxacinem. Laboratorně byla leukocytóza a elevace CRP, ostatní výsledky byly ve fyziologických mezích. Kultivačně prokázána Escherichia coli citlivá na veškerá běžná ATB. Byla zahájena ATB terapie kombinací amoxicilin/klavulanát + gentamicin. V den přijetí byla akutně provedena operační revize, dekapsulace a drenáž. Postupně došlo k úplné úpravě celkového stavu. Poslední US kontrola s nálezem přiměřeného a homogenního parenchymu obou ledvin.
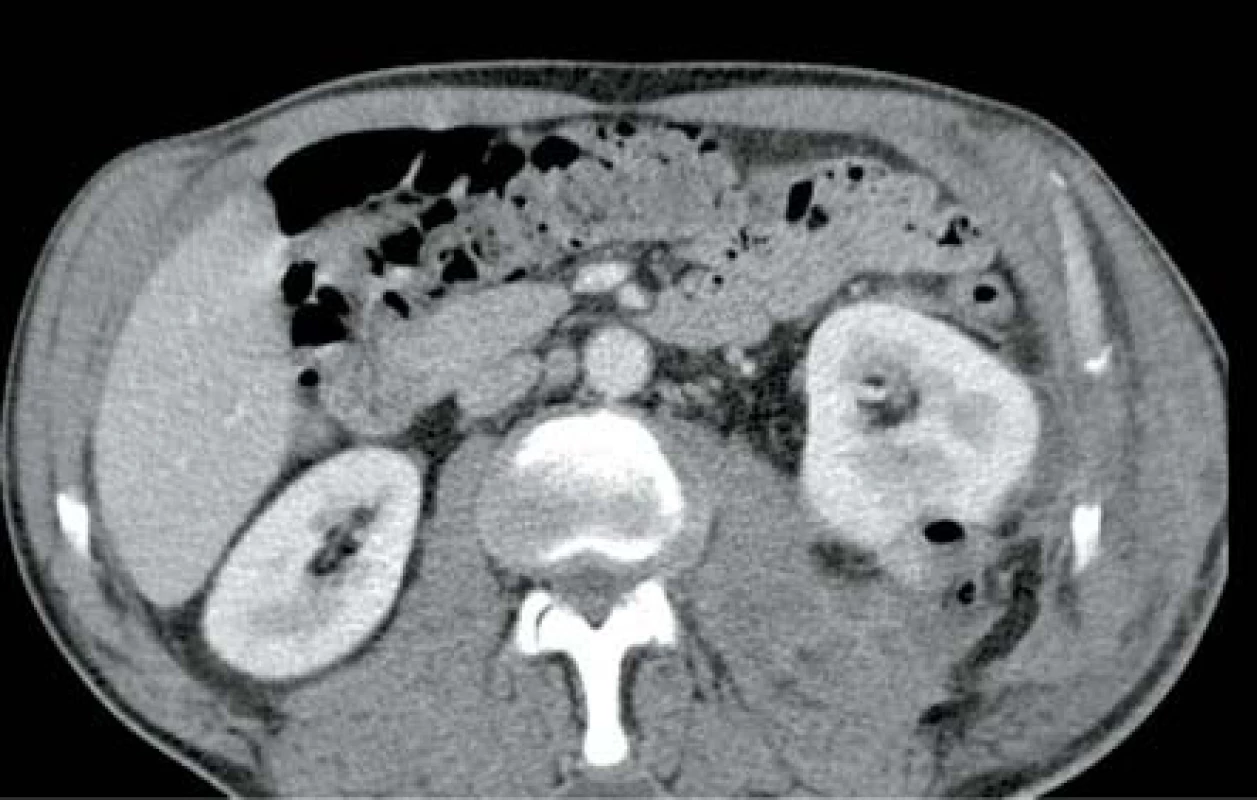
KAZUISTIKA 6
V listopadu 2013 pacientka, 66 let, diabetička II. typu na inzulinoterapii s interní multimorbiditou (kardiačka, hypertonička) byla přijata na interní oddělení pro týden trvající bolesti v zádech, průjmy, zvracení a subfebrilie. Na CT břicha bylo v den přijetí prosáknutí levé ledviny bez průkazu abscesu (obr. 7). Laboratorně byla leukocytóza s posunem k nezralým formám leukocytů, elevace CRP a dusíkatých katabolitů. Kultivačně byla prokázána Escherichia coli citlivá na veškerá běžná ATB. Zahájena byla empirická ATB terapie v kombinaci amoxicilin/klavulanát + ciprofloxacin. Vzhledem ke zhoršení stavu s rozvojem septického šoku bylo provedeno druhý den kontrolní CT vyšetření, kde byla prokázána emfyzematózní pyelonefritida vlevo s četnými drobnými ložisky plynu v parenchymu ledviny (obr. 8). Tentýž den byla provedena levostranná nefrektomie. Postupně došlo k úplné úpravě celkového stavu a funkci pravé ledviny.


DISKUZE
V našem malém souboru jsme zjistili shodu i některé odlišnosti od údajů v literatuře.
Pouze v jednom případě se jednalo o oboustrannou EP, jde tedy o velmi vzácné případy. Zabbo uvádí výskyt pouze 10 % (11).
Shodně s literárními údaji byly 2/3 nemocných diabetici. V literatuře je popisován podíl diabetiků na EP 70–96 % (16–19).
Průměrný věk byl v našem souboru vyšší, a to 63,5 roku. Narlawar uvádí průměrný věk o sedm let nižší (21).
Onemocnění se vyskytovalo častěji u mužů, což je v rozporu s nálezy Andul-Halima, který udává významně častější výskyt u žen (4).
V případech jednostranného postižení se jednalo častěji o ledvinu levou, což uvádí také Tang (3).
Ani v jednom případě nebyl příčinou konkrement. Tang a Huang přitom uvádí litiázu jako příčinu významného počtu případů EP (3, 16).
Nejčastěji byla prokázána Escherichia coli a v jednom případě Klebsiella pneumonie, které jsou ve shodě s literárními údaji uváděny jako nejčastější infekční agens vyvolávající EP (16, 20, 27, 28).
U bilaterálního postižení byla provedena oboustranná nefrektomie vzhledem k extenzivnímu nálezu plynu v oblasti parenchymu obou ledvin dle CT, které bylo vždy indikováno na podkladě sonografického nálezu, při kterém bylo vysloveno podezření na absces ledviny. Kuo uvádí sonografické vyšetření jako vyšetření specifické a senzitivní (37), avšak CT vyšetření je dle většiny autorů suverénní (3, 6, 10, 16, 27) a dle Somaniho nezbytnou metodou diagnostiky EP (43). CT vyšetření umožňuje rozhodnout o způsobu terapie, zda je možná perkutánní punkce lézí, otevřená drenáž či je nezbytná nefrektomie.
U jednostranných postižení byla v případě přítomnosti ložisek subkapsulárních a dobře přístupných zvolena dekapsulace a drenáž (tři případy). Tam, kde byla ložiska mnohočetná, postihující parenchym ledviny, byla provedena nefrektomie (dva případy). Výkon byl vždy zvažován na podkladě celkového stavu pacienta. V našem souboru, mimo bilaterálního nálezu, nebyl stav žádného pacienta závažný natolik, aby vyžadoval urgentní provedení nefrektomie bez možnosti záchovné drenážní operace, proto byl způsob operačního řešení zvažován dle CT nálezu. Dekapsulace byla provedena ke zlepšení prokrvení ledviny uvolněním edematózního parenchymu z pevného vazivového pouzdra ledviny. Kromě otevřené drenážní operace a nefrektomie je řadou autorů popisována perkutánní drenáž abscesových ložisek s plynem (6, 16, 21, 39, 43, 44, 45). Poprvé perkutánní drenáž u EP popsal v roce 1986 Hudson (44). Somani doporučuje k drenáži katétr minimálně 14 Fr a v případě vícečetných ložisek zaznamenal úspěch s více punkčními drenážemi téže ledviny ideálně prováděné pod CT kontrolou (43).
V přímé souvislosti s EP zemřel pouze pacient s bilaterální EP. Jeden pacient zemřel jeden měsíc po zjištění EP na dekompenzaci intersticiální plicní fibrózy, která se projevila po zlepšení celkového stavu a reparaci ledvinných funkcí po deseti dnech od diagnózy EP. Proto jeho úmrtí nedáváme do přímé souvislosti s EP. V našem souboru je mortalita při jednostranném postižení nulová. V současné době je celková mortalita uváděna mezi 10–20 % (3, 6, 16, 21, 27, 43, 45).
ZÁVĚR
Emfyzematózní pyelonefritida je závažným onemocněním s vysokou mortalitou. Včasná diagnostika, intenzivní medikamentózní léčba šokového stavu, razantní parenterální léčba širokospektrými antibiotiky a časná intervence mohou infaustní prognóze zabránit.
Základem diagnostiky je CT vyšetření umožňující i terapeutickou rozvahu o rozsahu intervence.
Chirurgická intervence je nezbytná s důrazem na její urgentní provedení. V závažných případech alterace celkového stavu a v případě rozsáhlého intraparenchymového postižení je nezbytné provedení akutní nefrektomie. Ve vybraných a méně závažných případech je možné provedení akutní perkutánní punkce zajišťující drenáž hnisu a plynu z ložisek, případně otevřená drenáž a dekapsulace ledviny.
Došlo: 8. 10. 2014
Přijato: 30. 1. 2015
Kontaktní adresa:
MUDr. Petr Prošvic
Urologické oddělení Oblastní nemocnice Náchod, a. s.
Purkyňova 446,
547 69 Náchod
email: prosvic.petr@nemocnicenachod.cz
Střet zájmů: žádný.
Prohlášení o podpoře:
Zpracování tohoto sdělení nebylo podpořeno žádnou společností.
Sources
1. Jain SK, Agarwal N, Chaturvedi SK. Emphysematous pyelonephritis: a rare presentation. J Postgrad Med, 2000; 46(1): 31–32.
2. Juany JJ, Tseng CC. Emphysematous pyelonephritis: clinicoradiological classification, management, prognosis, and pathogenesis. Arch Intern Med, 2000; 160(6): 797–805.
3. Tang HJ, Li CM, Yen MY, et al. Clinical characteristics of emphysematous pyelonephritis. J Microbiol Immunol Infect, 2001; 34(2): 125–130.
4. Andul-Halim H, Kehinde EO, Abdeen S, et al. Severe emphysematous pyelonephritis in diabetis patiens: diagnosis and aspects of surgical management. Urol. Int, 2005; 75(2): 123–128.
5. Tahir H, Thomas G, Sheerin N, et al. Successful medical treatment of acute bilateral emphysematous pyelonephritis. Am J Kidney Dis., 2000; 36(6): 1267–1270.
6. Hušek P, Broďák M, Pacovský J. Emfyzematózní pyelonefritida – život ohrožující stav. Urol. praxi, 2010; 11(6): 327–328.
7. Rybka J, a kol. Emfyzematózní pyelonefritida. In: Diabetes mellitus – komplikace a přidružená onemocnění. Grada, 2007 : 242.
8. Broďák M, Romžová M, Košina J. Urologické výkony u diabetika. Vnitř Lék, 2008; 54(5): 457–463.
9. Nasr AA, Kishk AG, Sadek EM, Parayil SM. A case report of emphysematous pyelonephritis as a first presentation of diabetes mellitus. Iran Red Crescent Med J. 2013 Dec; 15(12): e10384.
10. Lin DC, Shieh GS, Tong YC. Bilateral emphysematous pyelonephritis combined with subcapsular hematoma and disseminated necrotizing fasciitis. Urol Int, 2000; 70(3): 244–246.
11. Zabbo A, Montie JL, Popowniak KL, et al. Bilateral emphysematous pyelonephritis. Urology 1985; 25 : 293–296.
12. Flores G, Nellen H, Magana F, Calleja J. Acute bilateral emphysematous pyelonephritis successfully managed by medical therapy alone: A case report and review of the literature. BMC Nephrology, 2002, 3 : 4.
13. Dančík P, Košař V, Kraus J. Akutní emfyzematózní pyelonefritida. Urol. praxi, 2006; 1 : 32–33.
14. Michaeli J, Mogle P, Perlberg S, Heiman S, Caine M. Emphysematous pyelonephritis. J Urol, 1984; 131(2): 203–208.
15. Chen KW, Juany JJ, Wu MH, et al. Gas in hepatic veins: a rare and critical presentation of emphysematous pyelonephritis. J Urol, 1994; 151 : 125–126.
16. Huang JJ, Tseng CC. Emphysematous pyelonephritis: clinicoradiological classification, management, prognosis, and pathogenesis. Arch Intern Med. 2000, 160(6): 797–805.
17. Cook DJ, Achong MR, Dobranowski J. Emphysematous pyelonephritis. Complicated urinary tract infection in diabetes. Diabetes Care, 1989; 12 : 229–232.
18. Evanoff GV, Thompson CS, Foley R, et al. Spectrum of gas within the kidney. Emphysematous pyelonephritis and emphysematous pyelitis. Am J Med, 1987; 83 : 149–154.
19. Sailesh S, Randeva HS, Hillhouse EW, Patel V. Fatal emphysematous pyelonephritis with gas in the spinal extradural space in a patient with diabetes. Diabet Med, 2001; 18(1): 68–71.
20. Tseng CC, Wu JJ, Wang MC, et al. Host and bacterial virulence factors predisposing to emphysematous pyelonephritis. Am J Kidney Dis, 2005; 46(3): 432–439.
21. Narlawar RS, Raut AA, Nagar A, et al. Imaging features and guided drainage in emphysematous pyelonephritis? A study of 11 cases. Clin Radiol, 2004; 59(2): 192–197.
22. Shimizu H, Hariu K, Kamiyama Y, et al. Bilateral empysematous pyelonephritis with autosomal-dominant polycystic kidney disease successfully treated by konservative Metod. Urol Int, 1999; 63(4): 252–254.
23. Wang MC, Tseng CC, Lan RR, et al. Double cancers of the kidney and ureter complicated with emphysematous pyelonephritis within the parenchyma of the renal tumour. Scand J Urol Nephrol, 1999; 33(6): 420–422.
24. Lin CH, Juany JJ, Liu HL, et al. Renal cell carcinoma complicated by emphysematous pyelonephritis in a non-diabetic patient with renal failure. Neohron, 2002, 92(1): 227–229.
25. Anwar N, Chawla LS, Lew SQ. Emphysematous pyelitis presenting as an acute abdomen in an end - stage renal disease patient treated with peritoneal dialysis. Am J Kidney Dis, 2002; 40 (4): E13.
26. Fujita S, Watanabe J, Reed AI, et al. Case of emphysematous pyelonephritis in renal allograft. Clin Transplant, 2005; 19(4): 559–562.
27. Wan YL, Lee TY, Bullard MJ, Tsai CC. Acute gas-producing bacterial renal infection: correlation between imaging findings and clinical outcome. Radiology. 1996 Feb; 198(2): 433–438.
28. Khaira A, Gupta, A, Rana, DS, et al. Retrospective analysis of clinical profile prognostic factors and outcomes of 19 patients of emphysematous pyelonephritis. Int Urol Nephrol. 2009 Dec; 41 (4): 959–966. Epub 2009 Apr 30.
29. Wu, VC, Fang, CC, Li, WY, Hsueh, PR, Chu, TS. Candida tropicalis-associated bilateral renal papillary necrosis and emphysematous pyelonephritis. Clin Nephrol, 2004; 62 (6): 473–476.
30. Kamaliah, MD, Bhajan, MA, Dzarr, GA. Emphysematous pyelonephritis cause by Candida infection. Southeast Asian J Trop Med Public Health, 2005; 36 (3): 725–727.
31. Hildebrand, TS, Nibbe, L, Frei, U, Schindler, R. Bilateral emphysematous pyelonephritis cause by Candida infection. Am J Kidney Dis, 1999; 33 (2): E10.
32. Ahmad, M, Dakshinamurty, KV. Emphysematous renal tract diease due to Aspergillus fumigatus. J assoc Physicians India, 2004; 52 : 495–497.
33. Yanagawa Y, Hirano Y, Matsumoto N, Ogishima T. A case of emphysematous pyelonephritis induced by Citrobacter freundii infection. J Emerg Trauma Shock. 2013 Oct; 6(4): 287–288.
34. Jain SK, Agarwal N, Chaturvedi SK. Emphysematous pyelonephritis: a rare presentation. J Postgrad Med. 2000; 46(1): 31–32.
35. Wang YC, Wang JM, Chow YC, Chiu AW, Yang S. Pneumomediastinum and subcutaneous emphysema as the manifastation of emphysematous pyelonephritis. Int J Urol. 2004; 11(10): 909–911.
36. Lin DC, Shieh GS, Tong YC. Bilateral emphysematous pyelonephritis combined with subcapsular hematoma and disseminated necrotizing fasciitis. Urol Int, 2003; 70(3): 244–246.
37. Kuo YT, Chen MT, Liu GC, et al. Emphysematous pyeloneprhitis: imaging diagnosis and follow-up. Kaohsiung J Med Sci, 1999; 15(3): 159–170.
38. Punnose J, Yahya TM, Premchandran JS, et al. Emphysematous pyelonephritis responding to medical therapy. Int J Clin Pract 1997; 51 : 468–470.
39. Mydlo JH, Aybee GJ, Ali-Khan MM. Percutaneous grainage and/or nephrectomy in the treatment of emphysematous pyelonephritis. Urol Int., 2003; 70(3): 147–150.
40. Mallet M, Knockaert DC, Oyen RH, Van Poppel HP. Emphysamatous pyelonephritis: no longer a surgical disease? Eur J Emerg Med, 2002; 9(3): 266–269.
41. Ku JH, Kim ME, Lee NK, Park YH. Emphysematous pyelonephritis recovered by ureteral stenting in a finctionally solitary kidney. Urol Int, 2002; 69(4): 321–322.
42. Lim CS, Kim WB, Kim YS, et al. Bilateral emphysematous pyelonepritis with perirenal abscess cured by consservative therapy. J Nephrol, 2000; 13(2): 155–158.
43. Somani BK, Nabi G, Thorpe P, at al. Is percutaneous drainage the new gold standard in the management of emphysematous pyelonephritis? Evidence from a systematic review. J Urol. 2008; 179(5): 1844–1849.
44. Hudson MA, Weyman PJ, van der Vliet AH, Catalona WJ. Emphysematous pyelonephritis: successful management by percutaneous drainage. J Urol. 1986; 136(4): 884–886.
45. Kapoor R, Muruganandham K, Gulia AK, et al. Predictive factors for mortality and need for nephrectomy in patients with emphysematous pyelonephritis. BJU Int. 2010; 105(7): 986–989.
Labels
Paediatric urologist Nephrology UrologyArticle was published in
Czech Urology

2015 Issue 1
-
All articles in this issue
- VLIV VOLNÝCH RADIKÁLŮ NA FERTILITU MUŽE A MOŽNOSTI LÉČBY
- ONKOLOGICKÁ LÉČBA KARCINOMU PENISU Z POHLEDU RADIAČNÍHO ONKOLOGA
- IMUNOSTIMULACE POLYBAKTERIÁLNÍM LYZÁTEM (URIVAC®) V PREVENCI RECIDIVUJÍCÍCH INFEKCÍ DOLNÍCH MOČOVÝCH CEST
- VÝZNAM STANOVENÍ MOČOVÉ HLADINY TATI (TUMOUR ASSOCIATED TRYPSIN INHIBITOR) PRO DIAGNOSTIKU A PROGNÓZU TUMORŮ MOČOVÉHO MĚCHÝŘE
- KOMUNIKACE MEZI UROLOGEM A PACIENTEM S RAKOVINOU PROSTATY V PRŮBĚHU LÉKAŘSKÉ KONZULTACE
- KOMPLIKACE PO RADIKÁLNÍ PROSTATEKTOMII OTEVŘENÝM A LAPAROSKOPICKÝM PŘÍSTUPEM, SROVNÁNÍ VÝSLEDKŮ PODLE CLAVIENOVA SYSTÉMU KLASIFIKACE
- KOMPLIKACE PO LOKÁLNÍ APLIKACI CIZORODÉHO MATERIÁLU DO PODKOŽÍ PENISU
- EMFYZEMATÓZNÍ PYELONEFRITIDA – POPIS ŠESTI PŘÍPADŮ
- RYCHLE PROGREDUJÍCÍ UROTELIÁLNÍ TUMOR PÁNVIČKY LEVÉ LEDVINY S TROMBÓZOU VENA CAVA INFERIOR
- JEDNOPORTOVÁ LAPAROSKOPICKÁ (LESS-LAPARO-ENDOSCOPIC SINGLE-SITE SURGERY) NEFREKTOMIE
- Czech Urology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- IMUNOSTIMULACE POLYBAKTERIÁLNÍM LYZÁTEM (URIVAC®) V PREVENCI RECIDIVUJÍCÍCH INFEKCÍ DOLNÍCH MOČOVÝCH CEST
- KOMPLIKACE PO LOKÁLNÍ APLIKACI CIZORODÉHO MATERIÁLU DO PODKOŽÍ PENISU
- ONKOLOGICKÁ LÉČBA KARCINOMU PENISU Z POHLEDU RADIAČNÍHO ONKOLOGA
- EMFYZEMATÓZNÍ PYELONEFRITIDA – POPIS ŠESTI PŘÍPADŮ
