ROBOTICKY ASISTOVANÉ VÝKONY V ANDROLOGII
ROBOT ASSISTED PERFORMANCES IN ANDROLOGY
In four years, it will be exactly 100 years since Karel Čapek used the word ‘robot’ in his famous drama, R.U.R. for the first time. In this period of time this bare abstrakt idea became widely used in various industries. We consider 1999 as a milestone for using a robot in human medicine, when the first robot-assisted operation was performed using daVinci system by the American company, Intuitive Surgical. The first robot-assisted surgery in Urology, a radical prostatectomy, was compleated in 2000. The undisputed advantages of the robotic platform are elimination of the operator’s hand tremor, better stability, seven degree of free instrument movement, multi-screen visualization – projection up to three images simultaneously, high-resolution image, enlargement of the operating field and posibility of manipulation with three surgical instruments and the camera all at once. These benefits made the inclusion of robot-assisted surgery into microsurgery inevitable and the robotic platform is considered to be as a suitable replacement for the operating microscope, which enabled this department to being formed after 1970. This review article summarizes the basic robot-assisted operations in andrological microsurgery, concretely a vasovasostomy, vasoepididymostomy, targeted denervation of the spermatic cord, varicocelectomy and testicular sperm extraction.
Key words:
Chronic orchialgia, robotic assisted surgery, vasectomy reversal, vasoepididymostomy, vasovasostomy.
Authors:
Milan Čermák 1; Jiří Kočárek 1,2; Jiří Heráček 1,2
Authors‘ workplace:
Urologické oddělení, Ústřední vojenská nemocnice – Vojenská fakultní nemocnice Praha
1; Urologická klinika, 1. lékařská fakulta, Univerzita Karlova v Praze
2
Published in:
Ces Urol 2016; 20(2): 104-112
Category:
Review article
Overview
Za čtyři roky tomu bude přesně 100 let, kdy Karel Čapek poprvé použil slovo „robot“ ve své slavné hře R.U.R. Od pouhé abstraktní představy jsme za tuto dobu dospěli až k praktickému využití robotiky v nejrůznějších oborech. Za zlomový rok pro využití robota v humánní medicíně považujeme rok 1999, kdy byla provedena první roboticky asistovaná operace za použití systému daVinci od americké firmy Intuitive Surgical. První roboticky asistovaná urologická operace byla provedena v roce 2000, konkrétně radikální prostatektomie. Nespornými výhodami robotické platformy je eliminace třesu rukou operatéra, lepší stabilita, sedm stupňů volnosti pohybu nástrojů, multiobrazová vizualizace – promítání až tří obrazů současně, vysoké rozlišení obrazu, zvětšení operačního pole a možnost manipulovat se třemi chirurgickými nástroji a kamerou současně. Z těchto důvodů bylo zařazení roboticky asistovaných výkonů do mikrochirurgie nevyhnutelné a robotická platforma se jeví jako vhodná náhrada za operační mikroskop, který umožnil tomuto oboru po roce 1970 vzniknout. Přehledový článek popisuje základní roboticky asistované výkony v andrologické mikrochirurgii, konkrétně vazovazostomii, vazoepididymostomii, cílenou denervaci semenného provazce, varikokelektomii a testikulární extrakci spermatické tkáně.
Klíčová slova:
Chronická orchialgie, roboticky asistované výkony, vazoepididymostomie, vazovazostomie, zpětná vazektomie.
ZRUŠENÍ VAZEKTOMIE
Vazektomie je nejspolehlivější mužská antikoncepční metoda na světě. Odhaduje se, že na tento typ chirurgické antikoncepční metody spoléhá přibližně 40–60 milionů mužů po celém světě. Vazektomie je jedním z nejběžnějších urologických operačních výkonů ve Spojených státech amerických. Přibližně 2–6 % mužů v prvních deseti letech po vazektomii podstoupí vazovazostomii nebo vazoepididymostomii za účelem obnovení plodnosti (1).
Zrušení vazektomie je technicky náročný výkon, který byl poprvé popsán v roce 1919. Chirurgický výkon bez použití mikroskopu dosahoval přibližně 60% obnovení plodnosti. Před zavedením operačního mikroskopu do klinické praxe v roce 1970 byla tato operační metoda jediná, která umožňovala obnovit plodnost u mužů po vazektomii (2). Silber a kol. uvedli jako první operační mikroskop do klinické andrologie. O třicet let později stejný kolektiv publikoval své zkušenosti s více jak 4 000 takto operovaných mužů. Podařilo se obnovit plodnost u 94 % operovaných mužů oproti původním 60 % (3). Použití operačního mikroskopu při vazovazostomii bylo následně zavedeno i do praktických doporučení Americké společnosti pro reprodukční medicínu. Hlavním důvodem bylo dosažení vynikajících výsledků obnovení plodnosti. I přes tyto nesporné výhody vyžaduje dosažení těchto skvělých výsledků rozsáhlé mikrochirurgické a klinické zkušenosti chirurga. Nezbytnou podmínkou úspěšnosti této mikrochirurgické metody je přítomnost zručného a zkušeného asistenta.
Kuang a kol. provedli jednu z prvních robotických mikrochirurgických studií, ve které porovnávali roboticky asistovanou vazovazostomii (systém daVinci Standard) a klasickou mikrochirurgickou vazovazostomii na ex vivo modelech. Ve studii prokázali, že u roboticky asistované vazovazostomie bylo nutné určité období k zaškolení operatéra – během tohoto období byl operační čas delší, docházelo k častějšímu přetržení niti nebo ohnutí jehly oproti klasické mikrochirurgické vazovazostomii. Operační čas roboticky asistované vazovazostomie však významně klesal s každým dalším operačním výkonem. Z původního operačního času 104 minut došlo ke snížení na 62 minut po více než pěti operacích. Studie prokázala potenciálně kratší dobu zaškolení chirurga u roboticky asistované vazovazostomie oproti klasické mikrochirurgické vazovazostomii (4).
Schiff a kol. provedli první randomizovanou kontrolovanou studii srovnávající klasickou mikrochirurgickou vazovazostomii a vazoepididymostomii s roboticky asistovanými výkony (systém daVinci Standard) na potkanech. Ačkoliv byla u roboticky asistované metody návratnost plodnosti 100 % a u klasické mikrochirurgické metody 90 %, nebyl tento rozdíl shledán statisticky signifikantním, protože testovaný vzorek byl příliš malý. Avšak počet nalezených spermatických granulomů v anastomóze (k posouzení hojení anastomózy byli potkani usmrceni a pitváni několik týdnů po operačním výkonu) byl signifikantně nižší u skupiny potkanů po roboticky asistované vazovazostomii. Konkrétně 27 % u roboticky asistované vazovazostomie oproti 70 % u skupiny potkanů po klasické mikroskopické vazovazostomii. Podle autorů uvedené studie byl nižší výskyt granulomů v operační anastomóze ve skupině potkanů po roboticky asistované vazovazostomii výsledkem preciznějšího naložení stehů, které vedlo k větší těsnosti anastomózy. Operační doba byla v dané studii signifikantně kratší u roboticky asistované vazovazostomie oproti klasické mikroskopické vazovazostomii, konkrétně 68,5 minut oproti 102,5 minut (5).
Fleming a kol. v roce 2004 demonstrovali první využití roboticky asistované vazovazostomie (systém daVinci Standard) v humánní medicíně. Operaci provedli na dvou mužích, u obou dosáhli 100% obnovení pooperační plodnosti. Zdůraznili kratší dobu zaškolení operatéra oproti klasické mikroskopické technice, snadnější provedení operačního výkonu a preciznější zakládání stehů (6).
Parekattil a kol. publikovali prospektivní kohortovou studii srovnávající 110 robotických výkonů (systém daVinci Si), z toho 66 případů oboustranné roboticky asistované vazovazostomie a 44 případů roboticky asistované vazoepididymostomie (alespoň na jedné straně), se 45 mikrochirurgickými výkony, z toho 28 případů oboustranné mikrochirurgické vazovazotomie a 17 případů mikrochirurgické vazoepididymostomie (alespoň na jedné straně). Medián klinického sledování byl 17 měsíců (1–52 měsíců). Medián doby od provedení vazektomie byl 7 let u skupiny před robotickým výkonem (1–21 let), a 6,5 let u skupiny před mikrochirurgickým výkonem (1–19 let). Medián věku pacientů v době roboticky asistovaného výkonu byl 41 let a u mikrochirurgického výkonu 39 let. Signifikantně lepších výsledků návratu plodnosti, konkrétně 96 %, bylo dosaženo u skupiny, která podstoupila roboticky asistovaný výkon, oproti 80 % u skupiny pacientů po mikrochirurgickém výkonu. Počet těhotenství rok od operačního výkonu se výrazně nelišil – 65 % u pacientů po robotickém výkonu ve srovnání s 55 % u pacientů po mikrochirurgickém výkonu. Operační čas (skin to skin) se během prvních deseti případů roboticky asistovaných výkonů pohyboval v rozmezí od 150 do 180 minut. Avšak medián operačního času pro všechny roboticky asistované vazovazostomie se následně snížil až na 97 minut (v rozmezí 40 až 180 minut). Medián operačního času pro klasický mikrochirurgický výkon byl 120 minut (v rozmezí 60 až 180 minut). Medián operačního času u roboticky asistované vazoepididymostomie byl 120 minut (v rozmezí 60 až 180 minut) a byl výrazně nižší než medián 150 minut (v rozmezí 120 až 240 minut) pro klasickou mikrochirurgickou vazoepididymostomii. Tato práce potvrdila výsledky předchozích, dříve uvedených studií (7).
Chirurgická technika roboticky asistované vazovazostomie
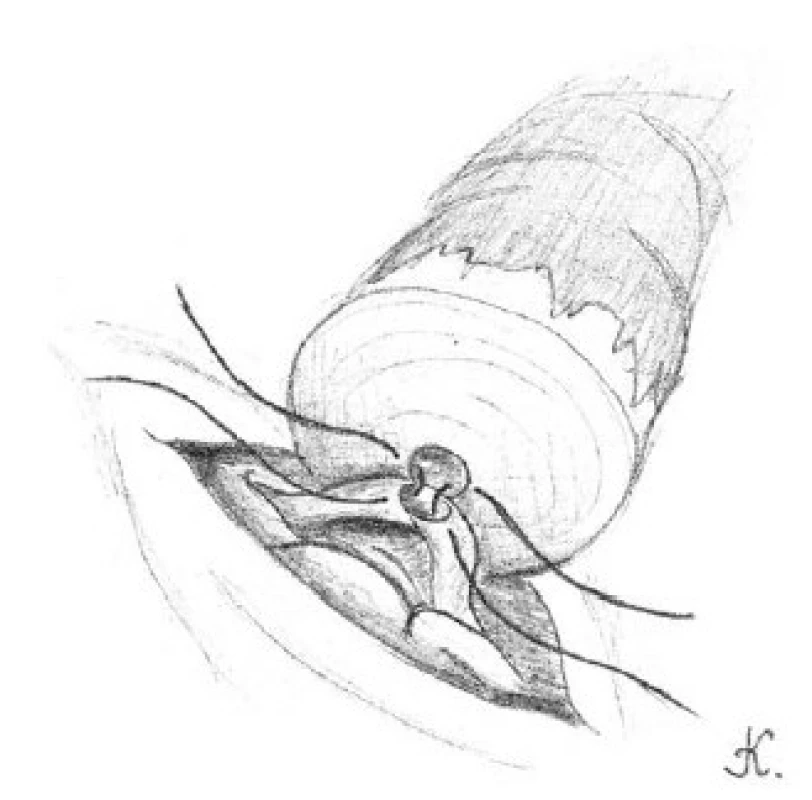
Poloha pacienta a postup preparace obou konců chámovodu nebo nadvarlete jsou podobné jako u standardní mikrochirurgické metody. Distální konec chámovodu důkladně vypreparujeme, abychom zajistili volný tah budoucí anastomózy. Proximální konec chámovodu pečlivě nařízneme. Výtok z lumen zachytíme na podložní sklíčko. Přítomnost spermií v získaném vzorku zjišťujeme fázovým kontrastním mikroskopem. Pokud ve vzorku nalezneme spermie a výtok je hojný a čirý nebo mléčný, provedeme roboticky asistovanou vazovazostomii. Jestliže vzorek neobsahuje žádné spermie a výtok je kalný a mazlavý, přistoupíme k roboticky asistované vazoepididymostomii.
Distální konec chámovodu nařízneme. Oba vypreparované konce chámovodu vzájemně přiblížíme ke kontrole volného tahu budoucí anastomózy. Oba konce umístíme na ¼ Penros drén. Volného tahu anastomózy docílíme sešitím adventicií obou konců chámovodu 3-0 prolénovými stehy. Robotickou platformu umístíme nad operační pole a provedeme vlastní mikrochirurgický výkon. Pravostrannou vazovazostomii provádíme zpravidla jako první. Na první a druhé pracovní rameno robota umístíme mikrokleště. Robotické rameno pro kameru osadíme přímou optikou. Do třetího pracovního ramena robota umístíme mikronůžky (tabulka 1). Asistent oplachuje operační pole fyziologickým roztokem pomocí stříkačky.
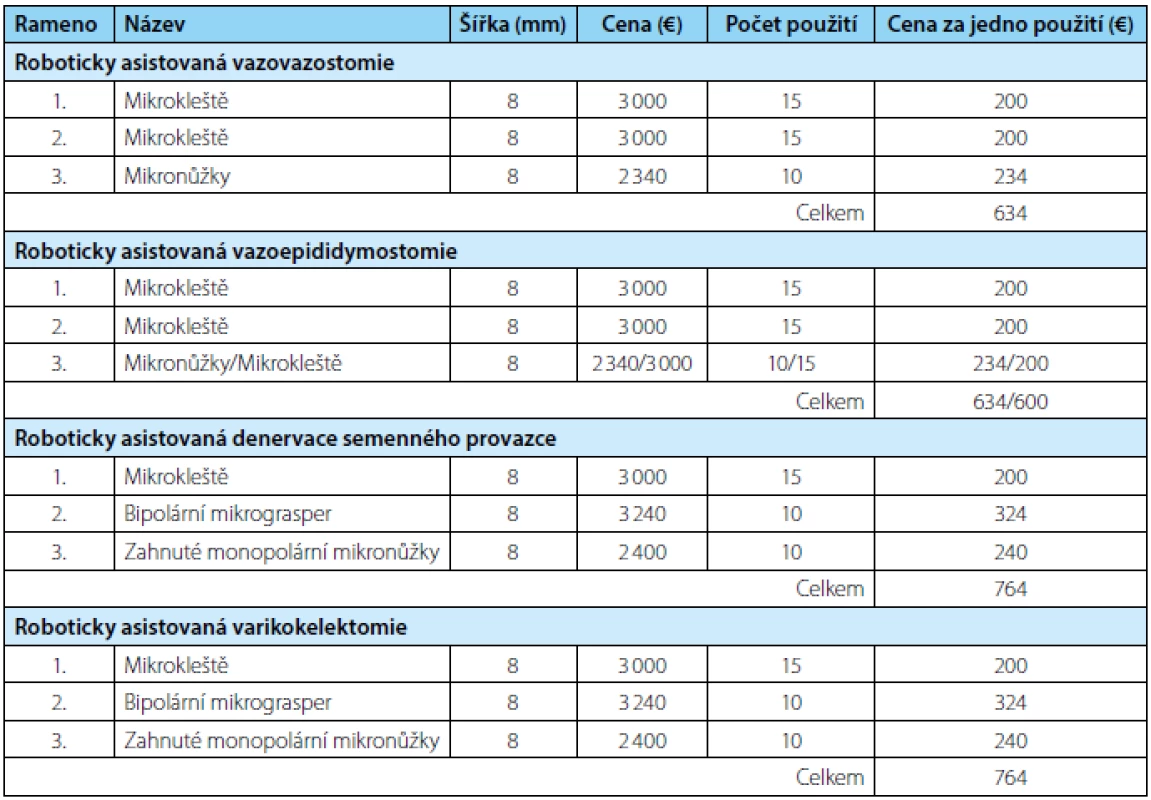
Asistent připraví 9-0 nylonový steh na okraj operačního pole. Chirurg uchopí steh do prvního robotického ramene a nastřihne ho mikronůžkami na pět centimetrů dlouhé díly. K uchopení a manipulaci s 9-0 nylonovým stehem slouží první a druhé robotické rameno s mikrokleštěmi, jež mohou posloužit i jako jehelec. Výše uvedeným stehem přiblížíme zadní svalové vrstvy obou konců chámovodu. Stehy střiháme mikronůžkami, které jsou na třetím robotickém rameni.
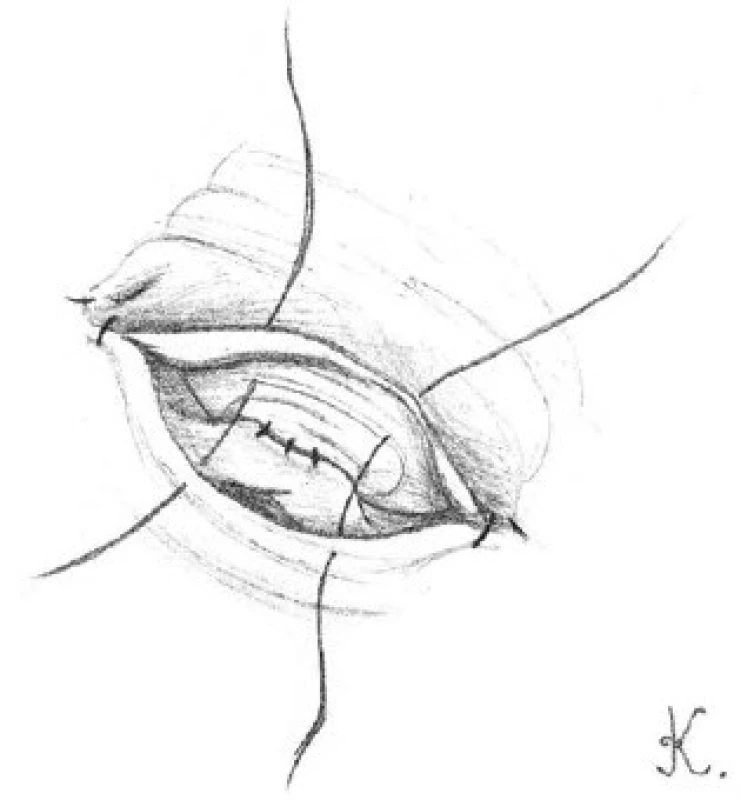
Dvěma nebo třemi dvojitými 10-0 nylonovými stehy provedeme reanastomózu zadní slizniční vrstvy chámovodu (obrázek 1). Stehy vedeme zevnitř ven, abychom zajistili správné přiblížení slizničních vrstev chámovodů. Před utažením musí být všechny stehy na zadní stěně vhodně založeny.
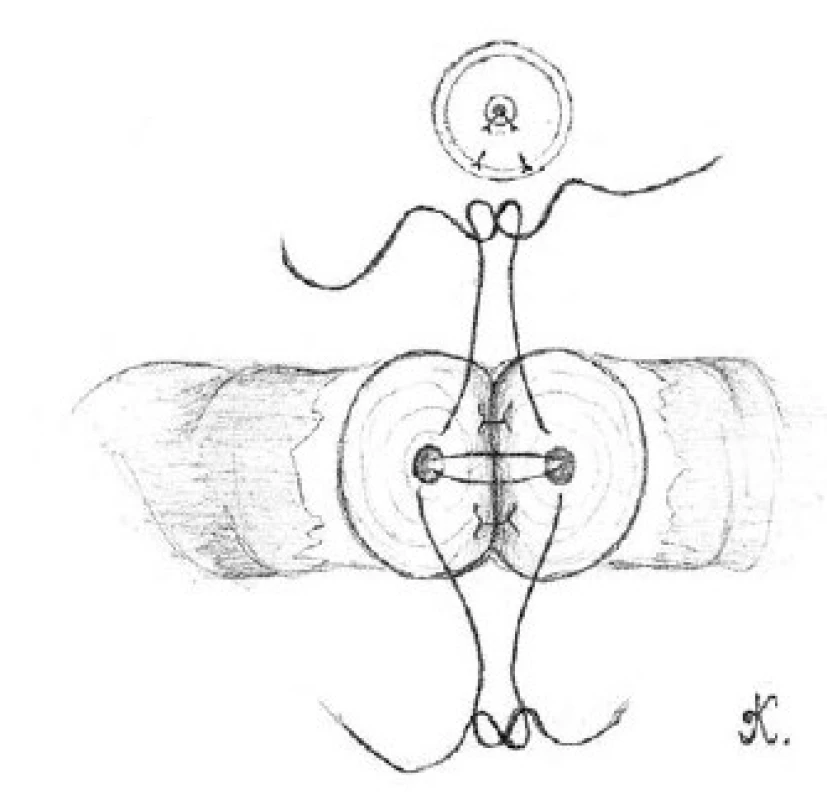
Přední slizniční vrstvy obou konců chámovodu přiblížíme pomocí tří dvojitých 10-0 nylonových stehů (obrázek 2). Pět až šest 9-0 nylonových stehů použijeme ke spojení přední svalové vrstvy chámovodu (obrázek 3). Penrose drén, umístěný pod prováděnou anastomózou, opatrně odstraníme. Chámovod vložíme zpět do skrota. Stejným postupem provedeme výkon na kontralaterální straně.
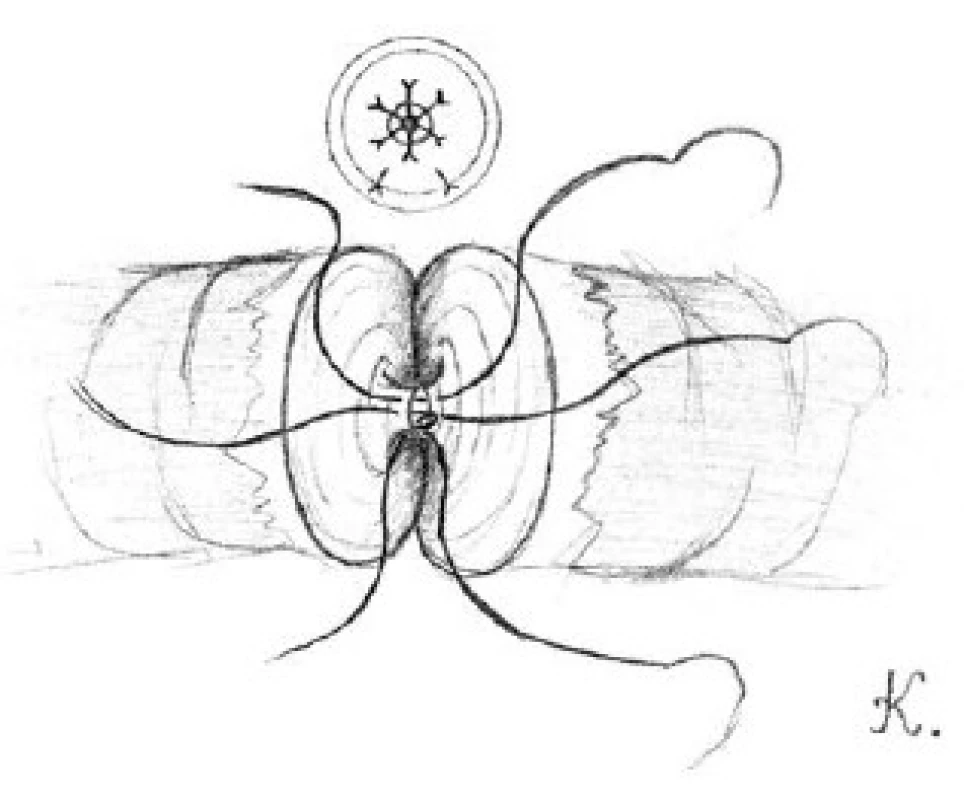
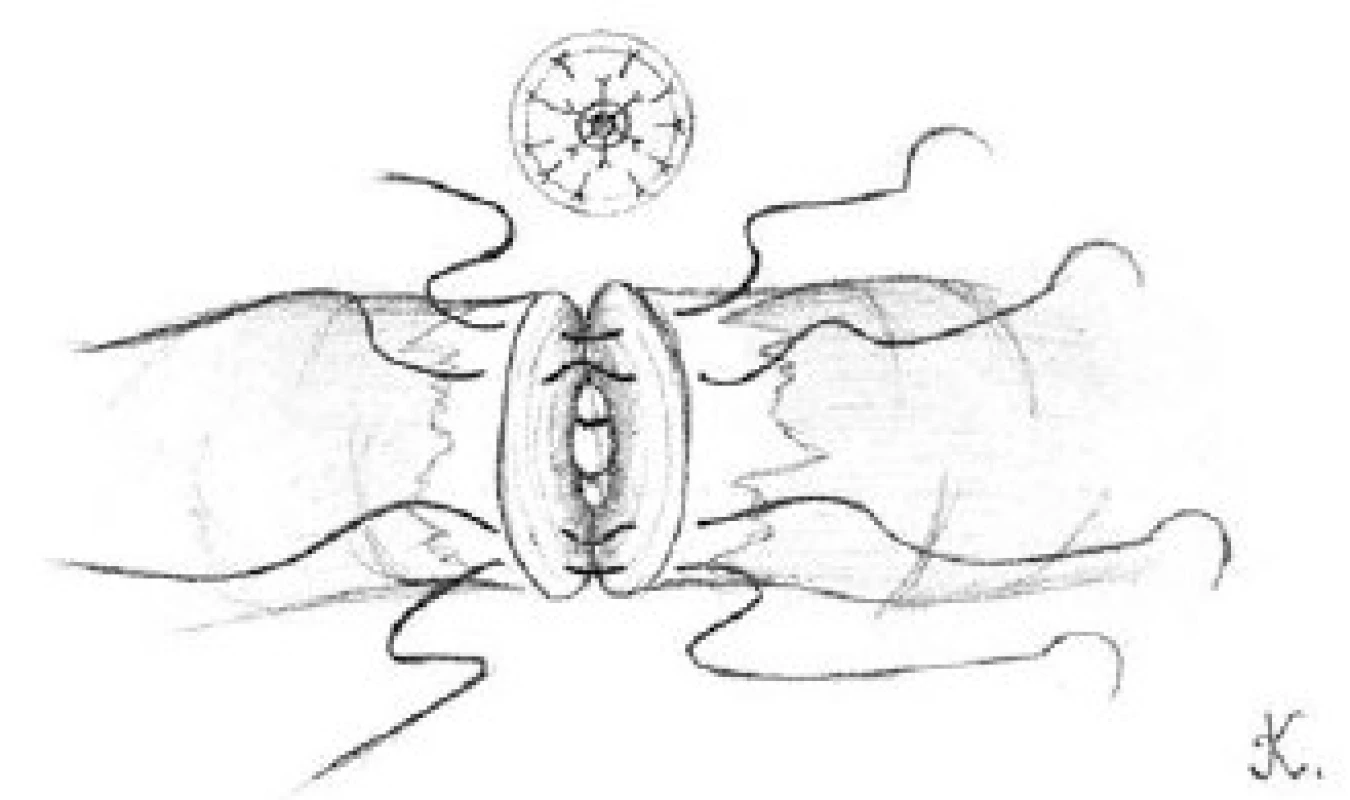
Tuniku varlete uzavřeme pomocí 3-0 chromových stehů a kůži skrota 5-0 vicrylovými stehy. Na ránu aplikujeme Framykoinovou mast a překryjeme ji kompresivním obvazem. Ránu 24 hodin po operaci chladíme (8).
Chirurgická technika roboticky asistované vazoepididymostomie
Roboticky asistovanou vazoepididymostomii provádíme, neobsahuje-li tekutina z proximálního konce chámovodu žádné spermie a výtok je kalný a mazlavý. Skrotální řez rozšíříme o 1–2 centimetry kaudálně. Protětím obalů varlete odhalíme nadvarle. Adventicii nadvarlete nařízneme nad místem překážky (modrošedá zóna s dilatovanými tubuly nadvarlete). Pro přiblížení adventicie chámovodu k obalu nadvarlete použijeme 3-0 prolénový steh a vytvoříme tak anastomózu s volným tahem (obrázek 4). Robotickou platformu umístíme nad operační pole. Mikrokleště umístíme na první i druhé pracovní rameno robota. Robotické rameno pro kameru osadíme přímou optikou. Na třetí robotické rameno umístíme mikrokleště, které drží oční mikroskalpel. Uvedené rameno může být obsazeno i mikronůžkami místo předchozí kombinace (tabulka 1). Na vybraný kanálek nadvarlete podélně umístíme dva 10-0 nylonové stehy se dvěma jehlami. Následně kanálek podélně protneme mezi výše uvedenými naloženými stehy očním mikroskalpelem. Při alternativním osazení robota můžeme k protnutí použít mikronůžky. Vytékající tekutinu poté odsajeme a zkoumáme pomocí fázového kontrastního mikroskopu, obsahuje-li spermie.

Výše uvedenými 10-0 nylonovými stehy se dvěma jehlami, jež jsou umístěny po obou stranách protnutého kanálku, provedeme přiblížení slizniční vrstvy chámovodu k místu protětí kanálku nadvarlete (obrázek 5). Všechny čtyři stehy vedeme zevnitř ven sliznice chámovodu, aby došlo k co nejlepší adaptaci budoucí anastomózy. Svalovinu chámovodu a adventicií tubulu nadvarlete spojíme pěti až šesti 9-0 nylonovými cirkulárně umístěnými stehy (obrázek 6). Varle, nadvarle i anastomózu opatrně uložíme zpět do skrota. Kůži skrota uzavíráme 5-0 vicrylovými stehy. Na ránu aplikujeme Framykoinovou mast a překryjeme ji kompresivním obvazem. Ránu 24 hodin po operaci chladíme (8).
ROBOTICKY ASISTOVANÁ CÍLENÁ DENERVACE SEMENNÉHO PROVAZCE
Chronická orchialgie je definována jako intermitentní nebo konstantní, jednostranná nebo oboustranná bolest varlete, která trvá minimálně tři měsíce. Chronické bolesti varlete se mohou objevit po vazektomii, plastice tříselné kýly, po břišních operačních výkonech, ale i po sportovních úrazech tříselné krajiny, nebo při dráždění ilioinguinálního nebo genitofemorálního nervu. Ne všichni muži, kteří trpí tímto typem bolesti, vyhledají lékařskou pomoc. Je odhadováno, že tyto potíže mohou postihovat až 100 000 mužů ročně (9).
Přesná příčina chronické orchialgie není známa. Genitofemorální a ilioinguinální nervy inervují semenný provazec společně s varletem. Jakákoliv příčina hypersenzitivity nebo dráždění těchto nervů může způsobit chronickou orchialgii. Stavy, které mohou způsobit zánětlivou reakci v periferních nervových vláknech v uvedené lokalitě, jako například infekce, zranění, torze varlete, varikokéla, hydrokéla, operace šourku (často vazektomie) nebo plastika tříselné kýly, mohou vést ke vzniku chronických bolestí varlete – bylo dokázáno, že imunitní odpověď hraje klíčovou roli v patofyziologii vzniku periferních neuropatických bolestí (10). Parekattil a kol. provedli patologicko–anatomickou studii u pacientů s chronickou orchialgií a ve spermatickém provazci těchto pacientů identifikovali specifická abnormální nervová vlákna (vlákna s Wallerovou degenerací) (11).
Chirurgická technika roboticky asistované denervace semenného provazce
Pozice pacienta a počáteční kroky odhalení semenného provazce jsou stejné jako u standardní mikrochirurgické denervace semenného provazce. V subinguinální oblasti provedeme 1–2 cm dlouhý transverzální řez, který by měl dosáhnout až do hloubky semenného provazce. Provazec přesuneme do operačního pole a provedeme jeho zadní, mediální a laterální disekci. Koagulaci provádíme mimo provazec, abychom předešli možnému poranění větví ilioinguinálního a genitofemorálního nervu (v blízkosti bočního okraje stydké kosti).
Robotickou platformu umístíme nad operační pole k provedení vlastního mikrochirurgického výkonu. První, druhé a třetí robotické rameno osadíme mikrokleštěmi, bipolárním mikrograsperem a zahnutými monopolárními mikronůžkami (tabulka 1).
Robotické rameno pro kameru osadíme přímou optikou. Pro další zvětšení operačního pole Parekattil a kol. využili speciální přídatnou VITOM kameru.
Robotická fáze operace začíná šetrnou koagulací a podvazem kremasterové svalové tkáně. Pomocí intraoperační sonografie lokalizujeme arterie, žíly a lymfatické cévy v semenném provazci. Obraz z intraoperační sonografie přenáší robotická platforma operatérovi přímo do konzole pomocí funkce TilePro. Perivaskulární pochvu a zadní tukovou složku velmi opatrně koagulujeme a podvážeme. Reziduální nervová vlákna v okolí vas deferens oddálíme pomocí hydrodisektoru. Semenný provazec následně obalíme speciálním bioinertním materiálem, který zabraňuje vzniku neurogranulomů a dráždění přerušených nervových konců. Bioinertní obal je volně zabezpečen 6-0 prolénovým stehem. Provazec vrátíme zpět do rány, kterou po vrstvách uzavřeme (8).
ROBOTICKY ASISTOVANÁ VARIKOKELEKTOMIE
Podle studie Schauer a kol. vede varikokelektomie ke zlepšení výsledků spermiogramu u pacientů se symptomatickou varikokélou a patologickými hodnotami předoperačního spermiogramu (12). Dle některých studií vykazuje subinguinální mikroskopická varikokelektomie lepší výsledky než jiné typy varikokelektomie. V roce 2008 Shu a kol. poprvé popsali varikokelektomii roboticky asistovanou metodou (systém daVinci S) a porovnali ji s klasickou mikroskopickou metodou. Z výsledků uvedené práce lze konstatovat, že mezi oběma metodami neexistuje významný rozdíl, pokud jde o operační čas (i při zohlednění zaškolení operatéra). Současně uvádějí, že během robotického výkonu je eliminován třes rukou operatéra, a proto je operační výkon subjektivně jednodušší (13). Avšak kontrolovaná randomizovaná studie Parekattil a kol. probíhající na psích modelech poukázala na významně kratší operační čas u roboticky asistované varikokelektomie (systém daVinci Si) oproti klasické mikrochirurgické varikokelektomii (7).
Chirurgická technika roboticky asistované varikokelektomie
Postup roboticky asistované varikokelektomie je podobný jako u klasické mikrochirurgické varikokelektomie. Po provedení řezu v subinguinální oblasti a preparaci semenného provazce umístíme nad operační pole robotickou platformu k provedení samotné varikokelektomie. Pracovní ramena robota osadíme mikrokleštěmi, bipolárním mikrograsperem a zahnutými monopolárními mikronůžkami (tabulka 1). Robotické rameno pro kameru osadíme přímou optikou.
Roboticky asistovaná varikokelektomie začíná naříznutím semenného provazce a preparací kremasterového svalu, pokračuje lokalizací testikulárních tepen pomocí sonografické sondy. Obraz ze sondy je přenášen přímo do robotické konzole pomocí funkce TilePro. Po přesné identifikaci všech struktur semenného provazce provedeme preparaci a podvázání všech testikulárních žil pomocí 3-0 hedvábných stehů. Po jejich podvázání uzavřeme semenný provazec a uložíme ho do operační rány. Po odstranění robotické platformy provedeme suturu rány (8).
ROBOTICKY ASISTOVANÁ TESTIKULÁRNÍ EXTRAKCE SPERMATICKÉ TKÁNĚ
Testikulární extrakce spermatické tkáně je chirurgická metoda k odběru spermií u pacientů s neobstrukční azoospermií. Schlegel a kol. uvedli, že mikrochirurgická testikulární extrakce spermatické tkáně může zlepšit výsledky spermií získaných miniivazivním odběrem testikulární tkáně (14). Parekattil a kol. zdůraznili přínos robotické asistence při testikulární extrakci spermatické tkáně. Nespornou výhodou roboticky asistované testikulární extrakce spermatické tkáně je propojení obrazů z operačního pole a laboratorního mikroskopu přímo do robotické konzole. Díky funkci TilePro může operatér během operace pozorovat přítomnost spermií v odebraném vzorku, aniž by opustil operační pole. Proto se může cíleně zaměřit na odběr nejvhodnější části tkáně. Toto vše vede k lepším výsledkům extrakce spermatické tkáně a k vyššímu počtu získaných spermií (8).
Využitím nových zobrazovacích metod, které umožňují identifikaci spermatických tubulů, jako například multifonotové mikroskopie – se robot stává ideálním pomocníkem operatérovi v tom, že mu umožňuje začlenit víceobrázkový náhled do chirurgické konzole (15).
ZÁVĚR
Využití roboticky asistovaných operačních výkonů v mikrochirurgii se uplatňuje nejen v andrologii, ale také v ostatních lékařských oborech, jako je oční lékařství, chirurgie ruky, plastická a rekonstrukční medicína. Čtyři ramena robota umožňují operatérovi provádět více úkonů najednou pomocí tří nástrojů a trojnásobného zvětšení pomocí robotické kamery. Nástup nových robotických systémů a dalších typů platforem povede k rozvoji robotické chirurgie. Další uplatnění v andrologii by mohlo přinést využití nových přídatných technologií a fluorescenčního zařízení společně s robotem.
Došlo: 15. 3. 2016
Přijato: 1. 5. 2016
Kontaktní adresa:
MUDr. Ing. Milan Čermák
Urologické oddělení, Ústřední vojenská nemocnice – Vojenská fakultní nemocnice Praha
U Vojenské nemocnice 1200, 169 02 Praha 6
e-mail: milan.cermak@uvn.cz
Střet zájmů: žádný
Prohlášení o podpoře: Autor prohlašuje, že zpracování článku nebylo podpořeno žádnou společností.
Sources
1. Dohle GR, Diemer T, Kopa Z, et al. European association of urology guidelines on vasectomy. Eur Urol 2012; 61 : 159–163.
2. O‘Conor VJ. Anastomosis of vas deferens after purposeful division for sterility. JAMA 1948; 136(3): 162–163.
3. Silber SJ, Grotjan HE. Microscopic vasectomy reversal 30 years later: a summary of 4010 cases by the same surgeon. J Androl 2004; 25(6): 845–859.
4. Kuang W, Shin PR, Matin S, Thomas AJJ. Initial evaluation of robotic technology for microsurgical vasovasostomy. J Urol 171(1): 300–303.
5. Schiff J, Li PS, Goldstein M. Robotic microsurgical vasovasostomy and vasoepididymostomy: a prospective randomized study in a rat model. J Urol 2004; 171(4): 1720–1725.
6. Fleming C. Robot-assisted vasovasostomy. Urol Clin North Am 2004; 31(4): 769–772.
7. Parekattil SJ, Gudeloglu A, Brahmbhatt J, Wharton J, Priola KB. Robotic assisted versus pure microsurgical vasectomy reversal: technique and prospective database control trial. J Reconstr Microsurg 2012; 28(07): 435–444.
8. Parekattil SJ, Gudeloglu A. Robotic assisted andrological surgery. Asian J Androl. 2013; 15(1): 67–74.
9. Strom KH, Levine LA. Microsurgical denervation of the spermatic cord for chronic orchialgia: long-term results from a single center. J Urol 2008; 180(3): 949–953.
10. Thacker MA, Clark AK, Marchand F, McMahon SB. Pathophysiology of peripheral neuropathic pain: immune cells and molecules. Anesth Analg 2007; 105(3): 838–847.
11. Parekattil SJ, Priola K, Atalah HN, Cohen MS, Allan RW. Anatomic basis for denervation of the spermatic cord for chronic orchialgia: trifecta of pain. Fertil Steril 2010; 94(4): S129–S30.
12. Schauer I, Madersbacher S, Jost R, Hübner WA, Imhof M. The impact of varicocelectomy on sperm parameters: a meta-analysis. J Urol 2012; 187(5): 1540–1547.
13. Shu T, Taghechian S, Wang R. Initial experience with robot-assisted varicocelectomy. Asian J Androl 2008; 10(1): 146.
14. Schlegel PN. Testicular sperm extraction: microdissection improves sperm yield with minimal tissue excision. Hum Reprod 1999; 14(1): 131–135.
15. Najari BB, Ramasamy R, Sterling J, et al. Pilot study of the correlation of multiphoton tomography of ex vivo human testis with histology. J Urol 2012; 188(2): 538–543.
Labels
Paediatric urologist Nephrology UrologyArticle was published in
Czech Urology

2016 Issue 2
-
All articles in this issue
- LAPAROSKOPICKÁ REIMPLANTACE URETERU – VIDEO
- LAPAROSKOPICKÁ RADIKÁLNÍ CYSTEKTOMIE U MUŽE – VIDEO 2015
- ROBOTICKY ASISTOVANÉ VÝKONY V ANDROLOGII
- NEFROBLASTOM – SOUČASNÁ DIAGNOSTIKA A LÉČBA
- ARTEFICIÁLNÍ SOMATO-CNS-AUTONOMNÍ MIKČNÍ REFLEX – EXPERIMENTÁLNÍ PROVĚŘENÍ
- ČASNÉ PERIOPERAČNÍ KOMPLIKACE U PACIENTŮ PO RADIKÁLNÍ CYSTEKTOMII S ORTOTOPNÍ NÁHRADOU MOČOVÉHO MĚCHÝŘE
- POUŽITÍ DETOUR EXTRAANATOMICKÉHO STENTU PO ROZPADU URETEROINTESTINÁLNÍ ANASTOMÓZY VLEVO
- NÁSLEDKY INJEKČNÍ APLIKACE CIZORODÝCH LÁTEK POD KŮŽI PENISU
- PROFESOR MUDR. TOMÁŠ HANUŠ, DrSc. SLAVÍ ŽIVOTNÍ JUBILEUM
- CONGRESS REPORT – 4TH CZECH VIDEO-TUTORIAL 2016
- THE 2ND UROLOGY-NEUROLOGY SYMPOSIUM IN OSTRAVA
- A REPORT FROM THE 37TH WORKING DAYS OF PAEDIATRIC NEPHROLOGY AND THE 27TH ANNUAL MEETING OF PAEDIATRIC UROLOGISTS
- KNOU 2016 – KOMPLEXNÍ NOVINKY V ONKOUROLOGII
- ZOMREL VÝZNAMNÝ SLOVENSKÝ UROLÓG prof. MUDr. MICHAL HORŇÁK, DrSc.
- STĚŽEJNÍ UROLOGICKÉ OPERAČNÍ VÝKONY V UROLOGII V ČR V LETECH 2009–2014
- ČERNÝ ADENOM NADLEDVINY
- Czech Urology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- NÁSLEDKY INJEKČNÍ APLIKACE CIZORODÝCH LÁTEK POD KŮŽI PENISU
- NEFROBLASTOM – SOUČASNÁ DIAGNOSTIKA A LÉČBA
- ČERNÝ ADENOM NADLEDVINY
- STĚŽEJNÍ UROLOGICKÉ OPERAČNÍ VÝKONY V UROLOGII V ČR V LETECH 2009–2014
