Cytologie synoviální tekutiny
Cytology of synovial fluid
Examination of synovial fluid from swollen and painful joints can contribute substantially to the diagnosis of joint diseases. After a skillful arthrocentesis the sample processing must follow swiftly, because the synovial fluid can not be effectively fixed due to its viscosity. The viscosity test and cellularity assessment with particular reference to the neutrophilic granulocyte fraction, as well as the examination of the native preparation in polarized light, are some specific steps in the processing of these samples. Diagnostic images include traumaticinfectiousand autoimmune arthritides, arthropaties associated with crystals and, least often, with tumors.
Conclusion: The cytological examination of synovial fluid has its own pre-analytical and analytical characteristics. Respecting and supplementing them with nonmorphological examinations can significantly contribute to the successful treatment of pathological joint conditions.
Keywords:
synovial fluid cytology – traumatic arthritis – infectious arthritis – autoimmune arthritis – arthropathies associated with crystals
:
Jaroslava Dušková
:
Ústav patologie 1. LF UK a VFN, Praha
:
Čes.-slov. Patol., 55, 2019, No. 2, p. 84-91
:
Reviews Article
Vyšetření synoviální tekutiny ze zduřelých a bolestivých kloubů může významně přispět k diagnóze kloubních onemocnění. Vyžaduje po správně provedené artrocentéze rychlé zpracování vzorku, který vzhledem k viskozitě nelze účinně fixovat. Test viskozity a stanovení buněčnosti se zvláštním zřetelem k podílu neutrofilních granulocytů představují určitá specifika ve zpracování těchto vzorků, stejně jako vyšetření nativního preparátu v polarizovaném světle. Diagnostické obrazyzahrnují artritidy traumatické, infekční, autoimunní, s krystaly sdružené a nejméně často i nádorové.
Závěr: Cytologické vyšetření synoviální tekutiny má svá specifika ve fázi preanalytické i analytické. Jejich respektování a doplnění vyšetřeními z nemorfologického spektra může významně přispět k úspěšné léčbě patologických kloubních stavů.
Klíčová slova:
cytologie synoviální tekutiny – traumatická artritis – infekční artritis – autoimunní artritis – s krystaly sdružené artropatie
Obsah
Synoviální tekutina (ST) – fyziologický nález
Historická poznámka
Artrocentéza: indikace, kontraindikace, odběr a transport vzorku
Zpracování ST
Základní cytologické obrazy
Formulace cytologického nálezu
Závěr
Synoviální tekutina (ST) je malé množství (1 - 3,5 ml) tekutého viskózního obsahu pravých (synoviálních) kloubů. Vzniká jako ultrafiltrát plazmy, k němuž synoviální buňky a chondrocyty secernují lubrikační tření snižující komponenty – hyaluronan a proteoglykan. Představuje tekuté prostředí pro metabolický obrat v kloubech – výživu kloubních struktur a degradaci odpadových látek. Zprostředkovává působení cytokinů a růstových faktorů (1). Za normálních okolností je ST bezbarvá nebo lehce slámově nažloutlá, silně viskózní tekutina bez zápachu (2). Buněčnost je minimální – ojedinělé makrofágy, lymfocyty, výjimečně neutrofilní granulocyt, synoviální buňky velmi podobné aktivovaným mezoteliím (3). Nárůst objemu ST a změna složení se projeví zduřením a bolestivostí kloubů. Tyto klinické projevy jsou nejčastější indikací k artrocentéze a vyšetření ST, a to jak v rovině nemorfologické (biochemické, mikrobiologické, imunologické), tak cytologické. Většina cytopatologických laboratoří dostává vzorky ST zřídka. Není tedy zpravidla příležitost ustálit příslušné algoritmy zpracování a hodnocení. Těmito charakteristikami - vyšší důraz na komplexní vyšetření cytologické, biochemické, imunologické a další spolu s relativně méně častým výskytem těchto vzorků (nejde-li to specializovanou laboratoř) a někdy i kvantitativním limitem – je problematika vyšetření ST analogická vyšetření mozkomíšního moku.
Cytodiagnostické části ST se věnuje následující text.
Historická poznámka: Vyšetřování synoviální tekutiny se rozvíjí zhruba půl století, a to paralelně v lidské i veterinární patologii (4,5). Pozornost se soustředila zprvu na krystaly (6-8), rychle však převládlo vyšetřování klinicky manifestních artritid u dětí, dospělých (9) i hospodářských a domácích zvířat (5,10-13). Poměrně brzy byly vypracovány první standardy hodnocení (14-16), které jsou dále zdokonalovány a doplňovány o nové metodiky (17-19).
Artrocentéza: indikace, kontraindikace, odběr a transport vzorku
Vzorek synoviální tekutiny odebírá za sterilních podmínek klinický specialista (revmatolog).
Při významnějším zduření kloubu je výkon současně diagnostický i terapeutický. Získanou tekutinu je žádoucí zpracovat co nejdříve (do 24 hod.) s ohledem na autolýzu buněk. Fixace nejsou vzhledem k viskozitě vhodné. Osvědčilo se naopak odebírat do zkumavky se 2 ml lithium heparinu k prevenci koagulace. Indikace již byly uvedeny. Kontraindikací výkonu jsou krvácivé stavy, možnou komplikací potom trauma nitrokloubních struktur – zejména chrupavky – při nesprávném provedení, případně vnesení infekce do kloubní dutiny.
Zpracování vzorku ST
Po kontrole úplnosti údajů ve smyslu akreditovaných standardních operačních postupů laboratoře je:
- Popsána makroskopicky kvantita a kvalita dodaného vzorku ST: množství v ml, barva, zkalení, viskozita, sraženina, příměs krve nebo pevných částek ve vzorku. V rámci makroskopického zhodnocení je užitečné provést i test viskozity: kapka ST vytažená tyčinkou je za normálních okolností schopna vytvořit vlákno delší než 3 cm; v zánětech je viskozita zřetelně snížena.
- Stanovena buněčnost ST jadernými elementy – počítáním ve Fuchsově-Rosenthalově komůrce obdobně jako pro mozkomíšní mok. (příloha č. 1, stanovení buněčnosti ST). Již v této úrovni hodnocení je užitečné vyhodnotit též semikvantitativně přítomnost neutrofilních granulocytů: <25 % ; <50 %; <75 %; >75 %.
- Vyšetřen mikroskopicky s použitím polarizačního mikroskopu vlhký nativní preparát ST pro přítomnost krystalů a tzv. ragocytů – makrofágů (nebo i mikrofágů - neutrofilních granulocytů) obsahujících velká cytoplasmatická granula (např. imunokomplexy u revmatoidní artritidy (20)).
- Vyšetřen mikroskopicky – cytologicky vzorek ST v dalších cytocentrifugovaných preparátech nebo nátěrech s použitím základních (MGG, H&E) případně speciálních (polychrom, Fe, Gram, PAS, olejová červeň) barvení.
- V případě pevných mikročástek (zejména při vzácném, ale nikoli vyloučeném podezření na nádorový proces) volíme zpracování ST metodou cytobloku. Umožní jak aktuální, tak případně odložené vyšetření ST speciálními metodami – např. imunohistochemicky nebo metodami molekulární biologie.
Minimálním standardem dle BSCC (21) je jeden vlhký nativní preparát ST s vyhodnocením v polarizaci a jeden cytocentrifugovaný barvený MGG. Jestliže je k dispozici ST pro další vyšetření, uplatní se samozřejmě dle povahy klinického zadání nejrůznější specializovaná došetření – barvení na železo, bakterioskopická, případně imunocytochemická.
Vyhodnocení vlhkého preparátu si žádá jistou laboratorní pohotovost – nicméně je popsána technika pro odložené hodnocení uchováním preparátu ve vlhké komůrce, kde vydrží v nezměněné kvalitě po dobu 24 hodin (17).
ZÁKLADNÍ CYTOLOGICKÉ OBRAZY
Patologické stavy v kloubních dutinách, jež jsou diagnostikovatelné cytologickým vyšetřením ST, lze etiopatogeneticky rozdělit do několika okruhů:
- traumatické – s projevy krvácení, někdy i infekce
- infekční: bakteriální (tyto většinou hnisavé), tuberkulózní, chlamydiové, virové
- autoimunní: revmatoidní
- reaktivně zánětlivé – s krystaly sdružené: dna, pseudodna, osteoartritis
- nádorové
I zde však platí, že didaktické skupinové členění obrazů odráží realitu jen částečně – kombinace nálezů a diagnóz je častou skutečností.
Pro ST (podobně jako pro mozkomíšní mok) jsou obecně platné tři charakteristiky:
- Nenádorové (zánětlivé a reaktivní) obrazy jsou podstatně významnější diagnostickou skupinou oproti vzácným nálezům nádorovým.
- Součástí vyšetření jsou ukazatele biochemické (koncentrace glukózy, bílkovin), je tedy s výhodou, provádí-li vyšetření ST komplexně orientovaná laboratoř.
- Stanovení buněčnosti kvantitativně je pevnou součástí nálezu (s následnou kvalitativní analýzou).
Očekávatelné hodnoty buněčnosti vzorků formulovala metaanalytickou studií více než 6000 pacientů Margaretten a spoluautoři (22) – tab. 1.
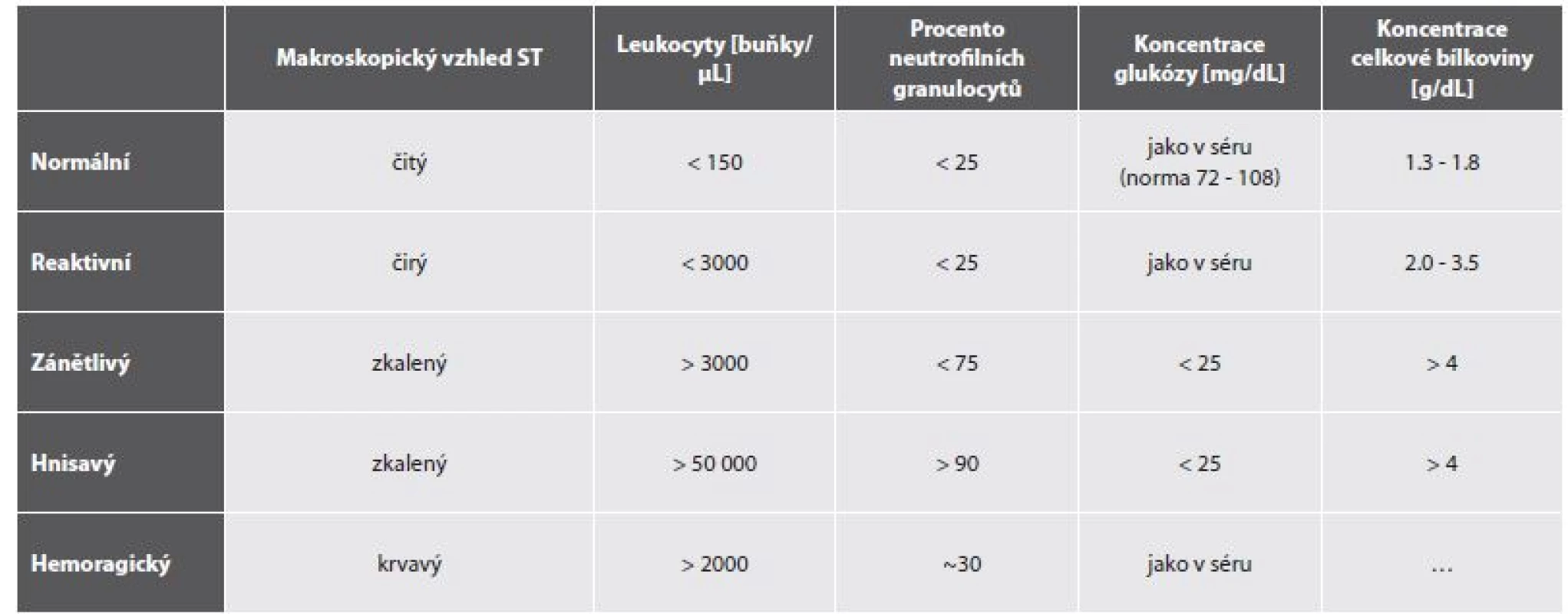
Traumatická arthritis
Podrobný popis traumatické a posttraumatické synovitis s rozvojem kloubních myšek včetně mikroskopického obrazu lze nalézt již před více než 100 lety (23). Poranění kloubu je spojeno s krvácením, někdy i s vnesením infekce a určitým stupněm destrukce kloubních struktur. ST bude makroskopicky zabarvena krví, viskozita snížena, buněčnost vysoká ve složce erytrocytární, zvýšená ve složce jaderných elementů ve vztahu k případné infekci. Podle časového odstupu od traumatické události je vyjádřena různě pokročilá úklidová reakce s přítomností erytrofágů a hemosiderofágů. Podobně jako v mozkomíšním moku může být malá přítomnost čerstvých nenarušených erytrocytů odběrovou kontaminací. Lze zaznamenat detritus, fragmenty vaziva, chrupavky nebo i kosti. Drobné skupinky chondrocytů se vyznačují poměrně objemnou lehce přibarvenou cytoplazmou s lemem v MGG metachromatické mezibuněčné hmoty. Jádra jsou okrouhlá, chromatin homogenně denzní nebo jemný, drobný solitární nukleolus. Chondrocyty mohou být vícejaderné. Obraz posthemoragické úklidové reakce je patologům důvěrně znám z mnoha lokalizací. Doplnit ho může i přítomnost krystalů - cholesterolových a kalciumfosfátových (obr. 3). V chronické fázi mohou obraz doprovázet hojné lipofágy (24). Část traumatických artritid je důsledkem sportovních aktivit a bývají ošetřovány urgentní sterilní aplikací kortizolu pod sonografickou kontrolou (25). Pak lze očekávat při následných vyšetřeních i příměs drobných polymorfních opticky aktivních a týdny přetrvávajících steroidních krystalů.
A, B – první punkce. A: P recipitující pozadí synoviální tekutiny, převaha neutrofi lních granulocytů, příměs makrofágů a jednotlivých synovialocytů,
ojedinělé erytrocyty. B: (HE) zánětlivé elementy lépe hodnotitelné v méně přibarveném pozadí; v barvení dle Grama (vložený obrázek)
ložiskově G+ koky. MGG a HE, 400x.
C, D – Druhá artrocentéza o měsíc později. Klinicky recidivující výpotek. C: Smíšená celulizace, příměs makrofágů. D: Shluk prosáklých narušených
synovialocytů. MGG a PAS,400x.
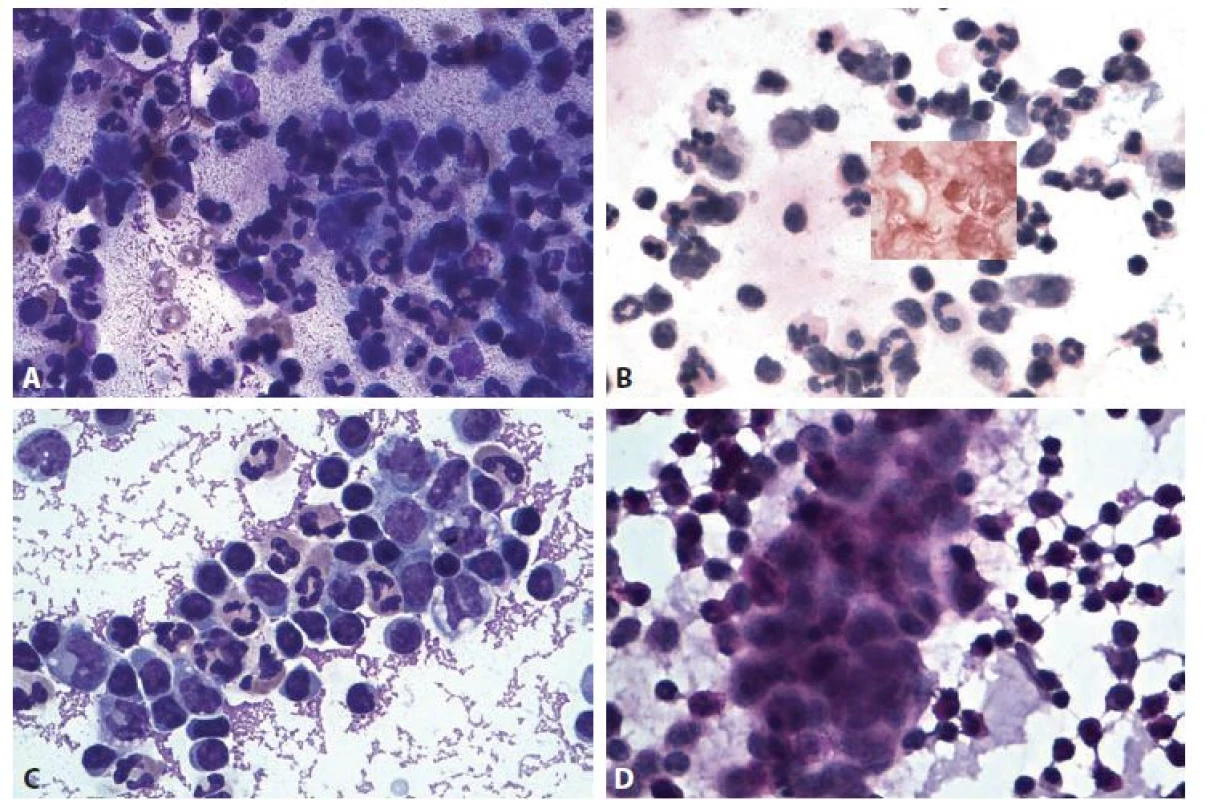
A: Monocyty, eozinofi lní granulocyty, narušené synovialocyty. MGG, 600x.
B: Skupinka synovialocytů, monocyty, makrofágy, lymfocyty, neutrofi lní granulocyt. HE, 600x.
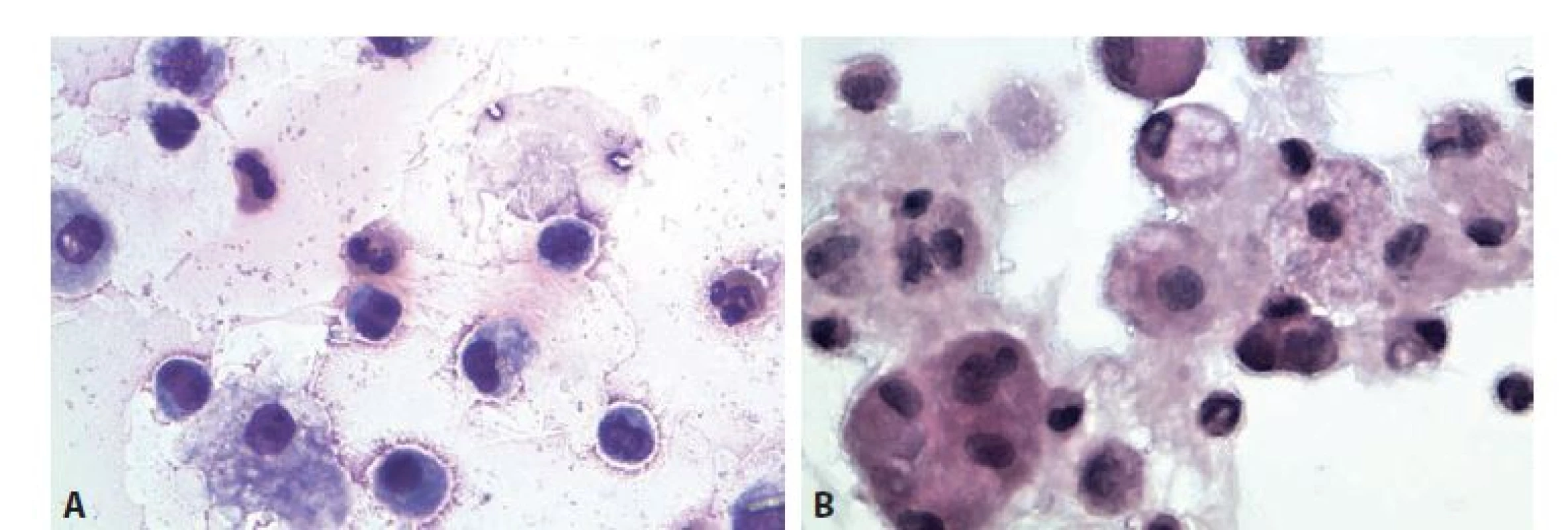
A: MGG, 400x. B: Totéž pole v polarizovaném světle. Optická aktivita krystalů cholesterolu.
Infekční artritis
Bakteriální. K bakteriální infekci patří nejčastěji, nikoli však vždy, obraz septické artritis.
Může komplikovat artritidy traumatické vnesením infekce zvenčí při penetrujícím poranění kloubu, nebo vzniká cestou hematogenní; poraněný kloub však disponuje k infekci i bez penetrujícího traumatu (26). Stejně tak je septická artritis častější u imunokompromitovaných a u seniorů na podkladě osteoartritidy (27-29). U pacientů s revmatoidní artritidou jsou ohroženi zvláště ti, kteří jsou léčeni antagonisty TNFα (30).
Získaný vzorek ST je zkalený až bělavý či žlutobělavý, může zapáchat, viskozita je snížena. Příměs krve není vyloučena, vysoká je však zejména buněčnost neutrofilními granulocyty. (tab. 1). Vývoj a prognóza onemocnění se sice zlepšily od dob zavedení antibiotik do této indikace (31), při narůstající rezistenci však nabývá na významu rychlé určení agens metodami mikrobiologickými, ale i biochemickými. Kultivaci lze prohlásit za negativní až po cca 4 dnech, úspěšnost je při akutní monoartritis pouze zhruba u třetiny pacientů (32).
V obraze dominují na pozadí detritu rozpadající se dystroficky steatotické neutrofilní granulocyty, později makrofágy (obr. 1).
Bakterioskopie ST klasickými barveními (Gram, PAS, Ziehl-Neelsen) je pouze orientační, u gonokoků citlivých k transportu může napomoci; k dispozici jsou, stejně jako pro další agens (tbc, borelie) metody molekulární biologie (33). V mezioborové laboratoři poskytne informaci i významný pokles koncentrace glukózy ve vzorku (34) (tab. 1).
Tuberkulózní monoartritis nebo polyartritis představuje (jako ostatně tbc i v jiných orgánových lokalizacích) diagnostické úskalí, protože zpravidla nebývá v diferenciální diagnóze zvažována (35, 36). Granulomatózní synovitis však cytologicky lze diagnostikovat pomocí FNA (37). Monoartritis se většinou týká nosných kloubů, může probíhat vysloveně protrahovaně za nespecifických příznaků a občasné kazuistické publikace vždy zdůrazňují obtížnou a opožděnou diagnózu (38,39). V ST je infiltrát smíšené povahy, může být příměs kaseózních hmot, fragmenty granulomů. Bakterioskopicky se mykobakterie zpravidla prokázat nepodaří, na diagnózu je potřeba pomýšlet (zejména u imunokompromitovaných) a indikovat citlivější techniky, např. PCR (40).
Boreliová monoatritida a oligoatritida. Oligoartritidy velkých, nejčastěji kolenních kloubů u dětí i dospělých se podílely spolu s erythema migrans na počátku 70. let minulého století na vymezení Lymeské nemoci (41). Velmi podobné artritidy byly současně v dané lokalitě zjišťovány i u psů (42). Borrelia Burgdorferi, jakožto etiologické agens přenášené klíšťaty, byla rozpoznána až o několik let později. V Evropě jsou boreliové artritidy vyvolány zpravidla Borrelia afzelii a Borrelia garinii. Stejně jako u tbc, je především nutno diagnózu zvažovat, zejména u dětí a adolescentů, pátrat po předcházející horečce a erythema migrans (43). ST je hypercelulární s až 75 % neutrofilních granulocytů. Variabilní je příměs eozinofilních granulocytů (44) (obr. 2). V porovnání se septickými artritidami dětí a adolescentů se boreliové artritidy vyznačují klinicky mírnějšími septickými projevy - horečky , leukocytózy a neschopnosti zátěže postiženého kloubu (45). V klinickém i cytologickém nálezu je však překryv se septickými artritidami (46). Komplexně orientovaná laboratoř využije pro synoviální diagnostiku boreliózy metody zavedené pro diagnostiku borelióz meningeálních; ty jsou využitelné i v jiných typech výpotků (47).
Virová etiologie se prokáže u cca 1 % akutních artritid (48). Po desetiletí jsou s nimi prokazatelně spojeny parvovirus B19, viry hepatitidy B a C, alfaviry, retroviry (49), rubella (50,51), nově i Zika. Část akutních virových artritid má krátký parainfekční průběh se spontánní úzdravou, některé však přecházejí do chronicity a indukují tvorbu autoprotilátek (51). Autoprotilátky by měly být vyšetřeny, přetrvávají-li příznaky artritidy déle než 6 týdnů (50). Obraz nehnisavého zánětu s převahou T-lymfocytů doplňují někdy tzv. ragocyty. Jde o neutrofilní granulocyty nebo makrofágy s velkými intracytoplazmatickými inkluzemi tvořenými imunokomplexy nebo fragmenty DNA. U virových artritid nebývají četné; hojné jsou zejména u revmatoidní artritidy a tato skutečnost podporuje uvažovanou patogenetickou souvislost.
Mykotické artritidy jsou v porovnání s bakteriálními i virovými vzácné. Je o nich třeba uvažovat u imunokompromitovaných (52), často i u pacientů s revmatoidní artritidou (53), nebo operačními zákroky na kloubech (54). Cytologický obraz smíšeného infiltrátu se neliší od nálezů např. v coelomových dutinách. Mykotické mikroorganismy lze znázornit technikami PAS, Grocott, viditelné jsou však i v základních barveních. Obdobně jako u ostatních infekčních artritid může nález významně upřesnit paralelní vyšetření serologické a molekulárně biologické užívané v likvorové diagnostice.
Autoimunní artritidy. Záněty této skupiny zahrnují artritidu revmatickou (součást poststreptokokových orgánových komplikací), revmatoidní (s komplexní etiopatogenezí zahrnující genetickou predispozici a přídatné, především mikrobiální antigenní vlivy, nejčastěji virové), i artritidy tvořící součást systémových onemocnění. Klinicky jde o celou řadu vymezených obrazů artritid dětí i dospělých s možným postižením malých i velkých kloubů a někdy i dalšími doprovodnými příznaky (55,56). Morfologicky je vyjádřen serofibrinózní zánět s chronickým a exacerbujícím průběhem. Cytologicky je zánětlivý infiltrát v ST smíšený s převažujícími neutrofilními granulocyty v akutních atakách zánětu (kdy je zpravidla vzorek odebírán). V pozadí je přítomen fibrin a detritus. Přítomné neutrofilní granulocyty obsahují hrubé intracytoplazmatické inkluze až do průměru 1,5 µm tvořené agregovanými IgG, revmatoidním faktorem, fibrinem a komplementem a nazývají se fagocyty (57). Jsou naprosto nepatognomonické; nacházejí se u revmatoidní artritidy ve větším množství, jednotlivě však u mnoha jiných artritid – virových revmatických, SLE a dalších. Lymfocyty se známkami imunitní transformace a plazmocyty převažují v chronické fázi. V aspirační biopsii zduřelé synoviální membrány mohou být zastiženy lymfatické folikuly, ojediněle i granulomy a fibroproduktivní změny. Zánětlivý obraz doplňují synovialocyty a v souvislosti s protrahovanými regresivními změnami mohou být přítomny i cholesterolové krystaly (obr. 3). Pro bližší diagnostické zařazení autoimunní artritidy je cytologický obraz pouze součástí komplexního hodnocení klinického a serologického/ imunologického (58,59).
Artritidy reaktivně zánětlivé – s krystaly sdružené: dna, pseudodna, osteoartritis.
Obecné mechanismy zánětlivého působení krystalů v kloubech byly poměrně podrobně popsány v posledních desetiletích (60-62). Doporučení vyšetřovat ST standardně v polarizaci jsou známa půl století (7), zakotvena ve standardech (21), avšak ne vždy uplatňována.
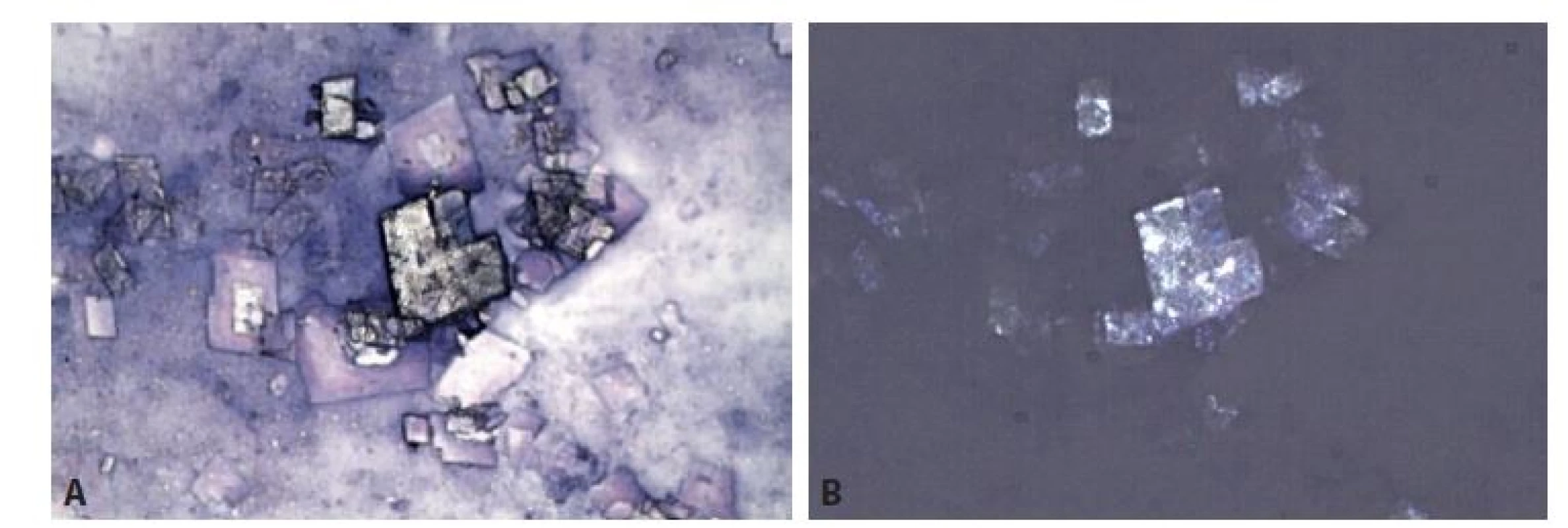
Dna – arthritis uratica je vyvolána akumulací krystalů močanu sodného v ST na podkladě geneticky podmíněné poruchy metabolismu purinů (63), případně sekundární hyperurikémie například při cytostatické léčbě. Probíhá zpravidla chronicky s akutními exacerbacemi. Po určitou dobu může zůstat klinicky němá, v akutní atace je však vysoce bolestivá se všemi klasickými Celsovými znaky zánětu. Zmnožená ST obsahuje variabilní zánětlivý obraz podle toho, zda jde o odběr v akutní atace (hojnější neutrofilní granulocyty) nebo chronické fázi (chudší buněčnost, fragmenty degenerované chrupavky), avšak především jehlicovité krystaly urátů opticky aktivních v polarizovaném světle (obr. 4). Mohou být zčásti fagocytované v neutrofilních granulocytech a také fragmentované – pak jsou méně typické. Výjimečně se i intraartikulárně, častěji extraartikulárně tvoří dnavé tofy – krystalické aglomeráty močanů s granulomatózní reakcí v okolí.
A: Urátové krystaly. HE 400x.
B: Totéž pole v polarizovaném světle.

Chondrokalcinóza – kalciumpyrofosfátová artropatie (pseudodna) se klinickými projevy i makroskopicky dně podobá. Vedle kalciumpyrofosfátu se prokazují i další kalciumfosfátové krystaly s variabilním tvarem tyčinek, obdélníčků, čtverečků (obr. 5). Mohou být intracelulárně a optická aktivita je variabilní, na části může i chybět. Pomocnou metodou v případě pochybností je barvení alizarinovou červení (64). Někteří autoři ho doporučují jako součást protokolu s odůvodněním, že kyselé roztoky hematoxylinu - eozinu redukují množství krystalů. Zánětlivý obraz v synoviální tekutině je podobně variabilní jako při pravé dně.
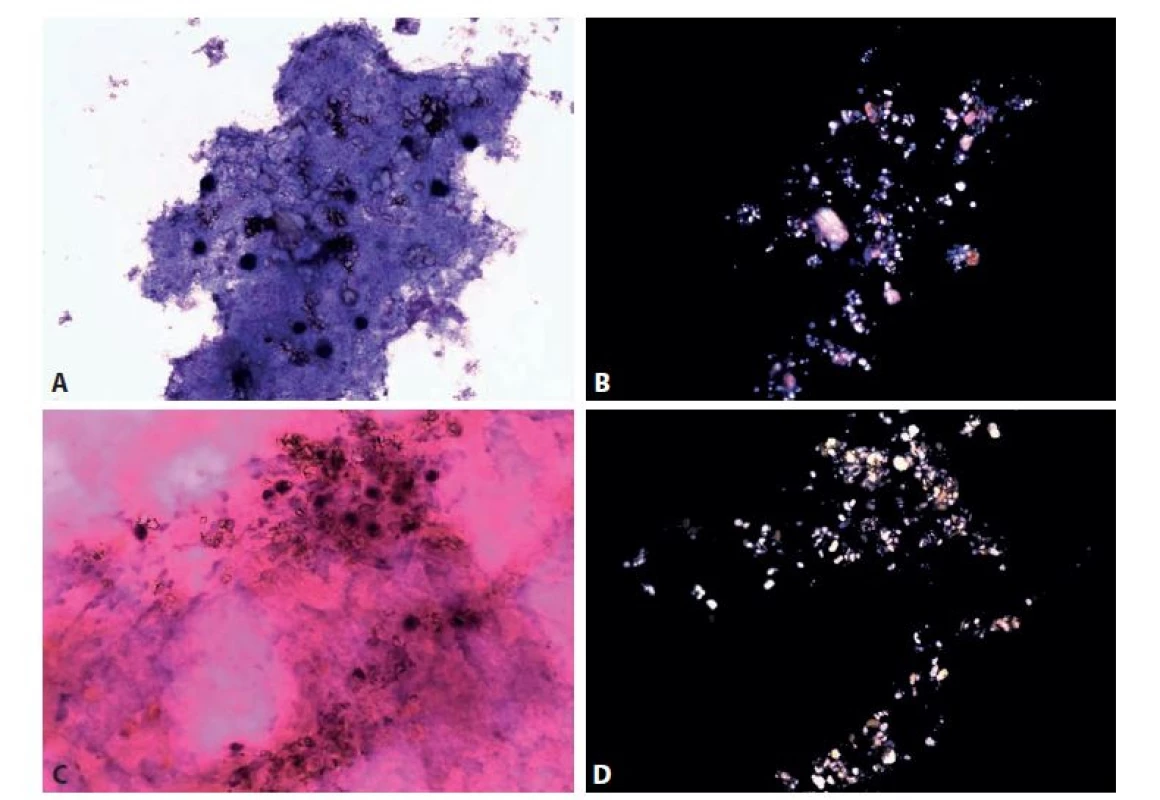
A, C: Chronická zánětlivá celulizace překrytá synoviální tekutinou. Krystaly zřejmé i v základních barveních MGG a HE.
B, D: Odpovídající pole v polarizovaném světle. Hojné krystaly kalciumpyrofosfátu i další kalciumfosfátové krystaly s variabilním tvarem.
Deformující artróza – osteoarthritis degenerativa patří v populaci nad 50 let k nejčastějším zdravotním problémům s klinickou manifestací v nosných kloubech u více než poloviny jedinců (63). V jiných lokalizacích – např. temporomandibulárním kloubu - jde rovněž o mechanické opotřebení (65). Protrahovaný průběh s destrukcí nitrokloubního prostoru a zánětlivými exacerbacemi má pestrý cytologický obraz, v němž mohou být zastoupeny fragmenty destruovaných kloubních struktur (úlomky chrupavky, kosti) i úklidové reakce (lipofágy, hemosiderofágy), reaktivních proliferací (zejména jsou uváděny vícejaderné chondrocyty (66).
U nejméně 60 % pacientů s artrózou jsou přítomny kalciumfosfátové krystaly – především hydroxyapatitu a jeho prekursorů. Podíl však může být i vyšší, protože jsou drobné, nenápadné a mohou uniknout pozornosti. Jejich význam je přitom značný, protože množství koreluje s tíží onemocnění, v jehož patogenezi hrají určitě roli (67). Jednotlivě jsou skutečně nepatrné - rozměry v nanometrech, mohou a bývají však přítomny ve shlucích. Protože nevykazují optickou aktivitu v polarizovaném světle, identifikace je možná v optické mikroskopii pomocí alizarinové červeni – avšak nespecifická a omezená vzhledem k velikosti na shluky. Zde jejich identifikace interferuje s kalciumpyrofosfátovými krystaly pseudodny.
Závěrem lze konstatovat, že i v kategorii s krystaly sdružených artritid existují překryvy diagnostických obrazů a také kombinace – v recentní studii švýcarských autorů měla čtvrtina pacientů s déle trvající dnou i depozita kalciumpyrofosfátu (68)
Nádorové obrazy v cytologii synoviální tekutiny jsou zřídkavým nálezem. Jako kazuistická sdělení jsou popisovány cytologické obrazy lipoma arborescens a pigmentové vilonodulární synovitis (69-72). Podobně jako při vzácných kloubních manifestacích jinak běžných malignit – karcinomu plic (73), prsu, colon (74), nebo leukémie (75), pomůže patologovi znalost histopatologie těchto lézí.
Formulace nálezu při vyšetření ST – cytologická část
- Popis kvantity a kvality dodaného vzorku spolu s lokalizací odběru.
- Test viskozity – provede a na průvodku/do systému zaznamená laborantka.
- Buněčnost ve Fuchsově – Rosenthalově komůrce – provede a zaznamená laborantka.
- Popis přítomnosti/absence opticky aktivních krystalů v nativním preparátu.
- Popis množství zhotovených preparátů a provedených barvení, popř. imunocytochemických průkazů.
- Popis cytologického obrazu (včetně nálezu v polarizovaném světle, pokud nebyl vyšetřen nativní preparát).
Závěr s diagnózou, popř. diferenciální diagnózou
Dle dostupnosti zhodnocení cytologického obrazu ve vztahu k nemorfologickým vyšetřením a/nebo klinickým údajům.
Doporučení klinikovi je nekonstantní součástí nálezu. Může však být užitečné návrhem dalších vyšetření vyplývajících z cytologického nálezu, případným požadavkem na odběr dalšího vzorku ST pro specializovaná došetření.
ZÁVĚR
Cytologické vyšetření synoviální tekutiny má svá specifika ve fázi preanalytické i analytické. Jejich respektování a doplnění vyšetřeními z nemorfologického spektra může významně přispět k úspěšné léčbě patologických kloubních stavů.
PODĚKOVÁNÍ
Podpořeno Univerzitou Karlovou – projekt Progres Q28/LF1. Podpořeno MZ ČR – projekt RVO VFN64165.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
Prof. MUDr. Jaroslava Dušková, CSc., FIAC,
Ústav patologie 1. LF UK a VFN
Studničkova 2, 128 00 Praha 2
tel.: +420224968688
fax: +420224911715
e-mail: jaroslava.duskova@lf1.cuni.cz
Příloha 1.
Stanovení buněčnosti kloubní tekutiny
Stanovení počtu jaderných elementů:
Provádí se nejčastěji z nativního vzorku. Pipetou opatrně naneseme 100 µl vzorku do Fuchsovy-Rosenthalovy počítací komůrky pod umístěné krycí sklíčko.
Jaderné elementy lze počítat i po obarvení – barvení je doporučováno hlavně při vyšší arteficiální krevní příměsi, nebo při zvýšeném množství nečistot. 100 µl vzorku a 10 µl barvicího roztoku promícháme.
Příprava barvicího roztoku:
Viol. methyleni 0.1g
Ac. aceticum 2.02 ml
H20 purif. ad 50.0 ml (vydrží 1 rok)
Stanovení počtu erytrocytů:
Provádí se z nativního vzorku. Zevní stěny F-R komůrky navlhčíme jemně destilovanou vodou a opatrně přiložíme krycí sklíčko. Dobře promíchaný vzorek opatrně pipetou naneseme do komůrky.
Mikroskopický odečet:
Stanovení počtu elementů se provádí mikroskopicky, Stanovuje se počet buněčných elementů v definovaném objemu komůrky (3.1 µl), který je vizuálně ohraničen vyrytou mřížkou na skle komůrky. Počet elementů se zapisuje do LIS ve formátu: počet elementů / mikrolitr objemu vzorku - výsledný počet elementů (ery) / 3.
Sources
1. Hui AY, McCarty WJ, Masuda K, Firestein GS, Sah RL. A systems biology approach to synovial joint lubrication in health, injury, and disease. Wiley Interdiscip Rev Syst Biol Med 2012; 4(1): 15-37.
2. De May RM. The art and science of cytopathology (1st ed.). Chicago: ASCP Press; 1995 : 290.
3. Spieler P, Rössle M. Nongynecologic cytopathology (1st ed.). Berlin - Heidelberg: Springer; 2012 : 314.
4. Ropes MW. Examination of synovial fluid. Bull Rheum Dis 1957; 7(6, Suppl): S 21-22.
5. Hardy J, Marcoux M, Eisenberg H. Osteochondrosis-like lesion of the anconeal process in two horses. J Am Vet Med Assoc 1986; 189(7): 802-803.
6. Mccarty DJ, Hollander JL. Identification of urate crystals in gouty synovial fluid. Ann Intern Med 1961; 54 : 452-460.
7. Currey HL. Examination of joint fluids for crystals. Proc R Soc Med 1968; 61(10): 969-971.
8. Wheeler AP, Graham BS. Pseudogout presenting with low synovial fluid glucose: Identification of crystals by Gram stain. Am J Med Sci 1985; 289(2): 68-69.
9. Gordon D. Management of arthritis and rheumatism. Can Fam Physician 1970; 16(1): 37-42.
10. Rohde C, Anderson DE, Desrochers A, et al. Synovial fluid analysis in cattle: A review of 130 cases. Vet Surg 2000; 29(4): 341-346.
11. Jacques D, Cauzinille L, Bouvy B, Dupre G. A retrospective study of 40 dogs with polyarthritis. Vet Surg 2002; 31(5): 428-434.
12. Pacchiana PD, Gilley RS, Wallace LJ, et al. Absolute and relative cell counts for synovial fluid from clinically normal shoulder and stifle joints in cats. J Am Vet Med Assoc 2004; 225(12): 1866-1870.
13. Constant C, Nichols S, Desrochers A, et al. Clinical findings and diagnostic test results for calves with septic arthritis: 64 cases (2009-2014). J Am Vet Med Assoc 2018; 252(8): 995-1005.
14. Kellner G, Klein G. Richtlinien zur Synovialzytologie. Z Rheumatol 1976; 35(3-4): 141-153.
15. Villanueva TG, Schumacher HR, Jr. Cytologic examination of synovial fluid. Diagn Cytopathol 1987; 3(2): 141-147.
16. Shmerling RH. Synovial fluid analysis. A critical reappraisal. Rheum Dis Clin North Am 1994; 20(2): 503-512.
17. Van Linthoudt D, Kern J, Calame L, Gerster JC. How to keep a wet preparation of synovial fluid. J Clin Rheumatol 2004; 10(1): 10-12.
18. Pollet S, Coiffier G, Albert JD, et al. Concordance between fresh joint fluid analysis by the rheumatologist and joint fluid analysis at the laboratory: Prospective single-center study of 180 samples. Joint Bone Spine 2015; 82(3): 161-165.
19. Krebs JC, Alapan Y, Dennstedt BA, Wera GD, Gurkan UA. Microfluidic processing of synovial fluid for cytological analysis. Biomed Microdevices 2017; 19(2): 20.
20. Freemont AJ, Denton J, Chuck A, Holt PJ, Davies M. Diagnostic value of synovial fluid microscopy: A reassessment and rationalisation. Ann Rheum Dis 1991; 50(2): 101-107.
21. Chandra A, Cross P, Denton K, et al. The BSCC code of practice-exfoliative cytopathology (excluding gynaecological cytopathology). Cytopathology 2009; 20(4): 211-223.
22. Margaretten ME, Kohlwes J, Moore D, Bent S. Does this adult patient have septic arthritis? JAMA 2007; 297(13): 1478-1488.
23. Smith SA. Traumatic arthritis of the knee and its effects. Can Med Assoc J 1912; 2(10): 892-907.
24. Baer AN, Wright EP. Lipid laden macrophages in synovial fluid: A late finding in traumatic arthritis. J Rheumatol 1987; 14(4): 848-851.
25. Fredberg U, Bolvig L. Traumatic arthritis in sport. Scand J Med Sci Sports 2001; 11(4): 251-254.
26. Winroth G, Hedstrom SA, Lidgren L. Posttraumatic bacterial arthritis with luxation of the elbow. A case report. Arch Orthop Trauma Surg 1984; 103(3): 227-229.
27. Cooper C, Cawley MI. Bacterial arthritis in an english health district: A 10 year review. Ann Rheum Dis 1986; 45(6): 458-463.
28. Cooper C, Cawley MI. Bacterial arthritis in the elderly. Gerontology 1986; 32(4): 222-227.
29. Marinho RT, Monteiro J, Tavora I, Ramalho F, De Moura MC. Spontaneous bacterial arthritis in a cirrhotic patient. J Hepatol 2002; 36(3): 444.
30. Curtis JR, Patkar N, Xie A, et al. Risk of serious bacterial infections among rheumatoid arthritis patients exposed to tumor necrosis factor alpha antagonists. Arthritis Rheum 2007; 56(4): 1125-1133.
31. Hirsh HL, Feffer HL, Dowling HF. The treatment of bacterial arthritis with penicillin. N Engl J Med 1946; 234 : 853-856.
32. Balderia PG, Pomerantz S, Fischer R. Acute bacterial arthritis: How long should you wait for culture results? J Clin Rheumatol 2015; 21(4): 196-198.
33. Saur M, Distler O, Muller N. Bakterielle Arthritis? Gonokokken-infektion trotz negativen Kulturen.Praxis (Bern 1994) 2008; 97(18): 977-983.
34. Omar M, Reichling M, Liodakis E, et al. Rapid exclusion of bacterial arthritis using a glucometer. Clin Rheumatol 2017; 36(3): 591-598.
35. Kissling RO. Wie lautet Ihre Diagnose? Tuberkulose Monarthritis des linken Kniegelenks mit Weichteilabszess.Schweiz Rundsch Med Prax 1991; 80(41): 1073-1074.
36. Schuchmann L, Pernice W, Hufschmidt C, Adler CP. Arthritis tuberculosa--eine seltene, aber wichtige Differentialdiagnose zur juvenilen chronischen Arthritis (JCA).Monatsschr Kinderheilkd 1991; 139(4): 244-247.
37. Jacobs JC, Li SC, Ruzal-Shapiro C, et al. Tuberculous arthritis in children. Diagnosis by needle biopsy of the synovium. Clin Pediatr (Phila) 1994; 33(6): 344-348.
38. Erdem H, Baylan O, Simsek I, et al. Delayed diagnosis of tuberculous arthritis. Jpn J Infect Dis 2005; 58(6): 373-375.
39. Triplett D, Stewart E, Mathew S, Horne BR, Prakash V. Delayed diagnosis of tuberculous arthritis of the knee in an air force service member: Case report and review of the literature. Mil Med 2016; 181(3): e306-309.
40. Lertsrisatit P, Nantiruj K, Totemchokchyakarn K, Janwityanujit S. Extraspinal tuberculous arthritis in HIV era. Clin Rheumatol 2007; 26(3): 319-321.
41. Steere AC, Malawista SE, Snydman DR, et al. Lyme arthritis: An epidemic of oligoarticular arthritis in children and adults in three connecticut communities. Arthritis Rheum 1977; 20(1): 7-17.
42. Kornblatt AN, Urband PH, Steere AC. Arthritis caused by borrelia burgdorferi in dogs. J Am Vet Med Assoc 1985; 186(9): 960-964.
43. Eichenfield AH, Goldsmith DP, Benach JL, et al. Childhood lyme arthritis: Experience in an endemic area. J Pediatr 1986; 109(5): 753-758.
44. Kay J, Eichenfield AH, Athreya BH, Doughty RA, Schumacher HR, Jr. Synovial fluid eosinophilia in lyme disease. Arthritis Rheum 1988; 31(11): 1384-1389.
45. Milewski MD, Cruz AI, Jr., Miller CP, Peterson AT, Smith BG. Lyme arthritis in children presenting with joint effusions. J Bone Joint Surg Am 2011; 93(3): 252-260.
46. Deanehan JK, Nigrovic PA, Milewski MD, et al. Synovial fluid findings in children with knee monoarthritis in Lyme disease endemic areas. Pediatr Emerg Care 2014; 30(1): 16-19.
47. Bruyn GA, De Koning J, Reijsoo FJ, Houtman PM, Hoogkamp-Korstanje JA. Lyme pericarditis leading to tamponade. Br J Rheumatol 1994; 33(9): 862-866.
48. Marks M, Marks JL. Viral arthritis. Clin Med (Lond) 2016; 16(2): 129-134.
49. Vassilopoulos D, Calabrese LH. Viral hepatitis: Review of arthritic complications and therapy for arthritis in the presence of active hbv/hcv. Curr Rheumatol Rep 2013; 15(4): 319.
50. Siegel LB, Gall EP. Viral infection as a cause of arthritis. Am Fam Physician 1996; 54(6): 2009-2015.
51. Ytterberg SR. Viral arthritis. Curr Opin Rheumatol 1999; 11(4): 275-280.
52. Cuende E, Barbadillo C, R EM, et al. Candida arthritis in adult patients who are not intravenous drug addicts: Report of three cases and review of the literature. Semin Arthritis Rheum 1993; 22(4): 224-241.
53. Qutre A, Demoux AL, Soussan J, Frances Y, Rossi P. Clinical image: Salmonella mycotic aneurysm in a patient receiving etanercept for rheumatoid arthritis. Arthritis Rheum 2012; 64(3): 942.
54. Falster L, Marin MB, Gomes JL. Histoplasmosis diagnosed after arthroscopy of the knee: Case report. Braz J Infect Dis 2015; 19(5): 546-548.
55. Theodoropoulou K, Georgin-Lavialle S. Arthrite juvenile systemique et maladie de Still de l‘adulte.Rev Med Suisse 2018; 14(594): 372-377.
56. Cimaz R, Von Scheven A, Hofer M. Systemic-onset juvenile idiopathic arthritis: The changing life of a rare disease. Swiss Med Wkly 2012; 142(w13582.
57. Hollander JL, Mccarty DJ, Jr., Rawson AJ. The „r.A. Cell“, „ragocyte“, or „inclusion body cell“. Bull Rheum Dis 1965; 16(1): 382-383.
58. Giacomelli R, Afeltra A, Alunno A, et al. International consensus: What else can we do to improve diagnosis and therapeutic strategies in patients affected by autoimmune rheumatic diseases (rheumatoid arthritis, spondyloarthritides, systemic sclerosis, systemic lupus erythematosus, antiphospholipid syndrome and Sjogren‘s syndrome)?: The unmet needs and the clinical grey zone in autoimmune disease management. Autoimmun Rev 2017; 16(9): 911-924.
59. Mahtani KR, Miller A, Rivero-Arias O, et al. Autoimmune markers for the diagnosis of rheumatoid arthritis in primary care: Primary care diagnostic technology update. Br J Gen Pract 2013; 63(615): 553-554.
60. Weinberger A. Gout, uric acid metabolism, and crystal-induced inflammation. Curr Opin Rheumatol 1995; 7(4): 359-363.
61. Ea HK, Liote F. Calcium pyrophosphate dihydrate and basic calcium phosphate crystal-induced arthropathies: Update on pathogenesis, clinical features, and therapy. Curr Rheumatol Rep 2004; 6(3): 221-227.
62. Ea HK, Chobaz V, Nguyen C, et al. Pathogenic role of basic calcium phosphate crystals in destructive arthropathies. PLoS One 2013; 8(2): e57352.
63. Vanitallie TB. Gout: Epitome of painful arthritis. Metabolism 2010; 59 Suppl 1: S32-36.
64. Paul H, Reginato AJ, Schumacher HR. Alizarin red s staining as a screening test to detect calcium compounds in synovial fluid. Arthritis Rheum 1983; 26(2): 191-200.
65. Dijkgraaf LC, Liem RS, De Bont LG. Temporomandibular joint osteoarthritis and crystal deposition diseases: A study of crystals in synovial fluid lavages in osteoarthritic temporomandibular joints. Int J Oral Maxillofac Surg 1998; 27(4): 268-273.
66. De May RM. The art and science of cytopathology (1st ed.). Chicago: ASCP Press; 1995:
67. Yavorskyy A, Hernandez-Santana A, Mccarthy G, Mcmahon G. Detection of calcium phosphate crystals in the joint fluid of patients with osteoarthritis - analytical approaches and challenges. Analyst 2008; 133(3): 302-318.
68. Ankli B, Kyburz D, Hirschmann A, et al. Calcium pyrophosphate deposition disease: A frequent finding in patients with long-standing erosive gout. Scand J Rheumatol 2018; 47(2): 127-130.
69. Michael RH. Pigmented villonodular synovitis. Orthop Nurs 1997; 16(3): 66-68.
70. Kloen P, Keel SB, Chandler HP, et al. Lipoma arborescens of the knee. J Bone Joint Surg Br 1998; 80(2): 298-301.
71. Gupta S, Mishra RS. Cytologic appearance of pigmented villonodular synovitis. A case report. Acta Cytol 2002; 46(4): 728-730.
72. Ji JH, Lee YS, Shafi M. Spontaneous recurrent hemarthrosis of the knee joint in elderly patients with osteoarthritis: An infrequent presentation of synovial lipoma arborescens. Knee Surg Sports Traumatol Arthrosc 2010; 18(10): 1352-1355.
73. Fam AG, Kolin A, Lewis AJ. Metastatic carcinomatous arthritis and carcinoma of the lung. A report of two cases diagnosed by synovial fluid cytology. J Rheumatol 1980; 7(1): 98-104.
74. Newton P, Freemont AT, Noble J, et al. Secondary malignant synovitis: Report of three cases and review of the literature. Q J Med 1984; 53(209): 135-143.
75. Van Soesbergen RM, Feltkamp-Vroom TM, Feltkamp CA, Somers R, Van Beek WP. T cell leukemia presenting as chronic polyarthritis. Arthritis Rheum 1982; 25(1): 87-91.
Labels
Anatomical pathology Forensic medical examiner ToxicologyArticle was published in
Czecho-Slovak Pathology

2019 Issue 2
-
All articles in this issue
- Cytology of synovial fluid
- Cytopathology of soft tissue tumors
- Hormonal cytology
- Cytology of Ovarian cysts
- Potential use of immunohistochemistry for diagnosis precision in historic paraffin blocks
- Synovial metaplasia of the endometrium: report of two new cases
- Chronic dissecting aneurysm of ascending aorta with a large intramural thrombus and isolated aortic defects
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Hormonal cytology
- Cytology of synovial fluid
- Cytology of Ovarian cysts
- Cytopathology of soft tissue tumors
