Přehled problematiky hodnocení tumor infiltrujících lymfocytů u karcinomu prsu v rutinní diagnostické praxi
Review of tumor infiltrating lymphocytes assessment in breast cancer in routine diagnostic practice
Evaluation of tumor infiltrating lymphocytes (TIL) is gaining importance in many cancers not only because of their prognostic, but also predictive significance. One of the tumors in which the evaluation of TIL is of prognostic importance and has potential predictive impact on the modification of treatment procedures is breast cancer, especially its so-called triple negative, and HER2 positive variants.The aim of this review is to provide an overview of the issue of TIL evaluation in breast cancer, focusing not only on the clinical significance of this evaluation, but especially on the methodological aspects of evaluation and standardized reporting of the results.
Keywords:
breast cancer – tumor infiltrating lymphocytes – Prognosis – prediction
Authors:
Pavel Dundr *1; Mária Gregová 1; Michaela Bártů 1; Martina Zimovjanová 2; Luboš Petruželka 2; Zuzana Bielčiková 2; Pavel Fabian 3; Radoslav Matěj 4,5; Aleš Ryška 6
; Kristýna Němejcová 1
Authors‘ workplace:
Ústav patologie 1. LF UK a VFN v Praze
1; Onkologická klinika 1. LF UK a VFN v Praze
2; Oddělení onkologické patologie, Masarykův onkologický ústav, Brno
3; Ústav patologie, 3. LF UK a FN Královské Vinohrady
4; Ústav patologie a molekulární medicíny, 3. LF UK a Fakultní Thomayerova nemocnice
5; Fingerlandův ústav patologie, LF UK a FN Hradec Králové
6
Published in:
Čes.-slov. Patol., 57, 2021, No. 3, p. 161-166
Category:
Reviews Article
Overview
Hodnocení tumor infiltrujících lymfocytů (TIL) nabývá u řady nádorových onemocnění na důležitosti v souvislosti nejen s ohledem na prognózu, ale i na jejich prediktivní význam. Jedním z nádorů, u kterého má hodnocení TIL kromě stanovení prognózy i potenciální dopad na modifikaci léčebných postupů, je karcinom prsu, zejména jeho tzv. triple negativní a HER2 pozitivní varianta. Cílem následujícího sdělení je podat přehled problematiky hodnocení TIL u karcinomu prsu se zaměřením nejen na praktické uplatnění tohoto hodnocení, ale zejména na metodické aspekty hodnocení a reportování výsledků.
Klíčová slova:
karcinom prsu – tumor infiltrující lymfocyty – prognóza – predikce
Hodnocení přítomnosti a rozsahu kulatobuněčné zánětlivé celulizace (tzv. tumor infiltrujících lymfocytů – TIL) nabývá poslední dobou na významu u diagnóz různých nádorových onemocnění, a to zejména s ohledem na prediktivní a prognostické aspekty (1,2). V rutinní praxi je hodnocení TIL zatím omezeno na několik solidních nádorů zahrnujících zejména melanom, kolorektální karcinom a karcinom prsu (3-8). Obecně však v současné době u žádné diagnózy nepředstavuje hodnocení TIL povinný parametr, jehož stanovení je vyžadováno, spíše se jedná o parametr, jehož hodnocení je u určitých diagnóz doporučené. Hodnocení TIL zahrnuje několik problematických aspektů, mezi které patří zejména metodika hodnocení a praktický klinický význam hodnocení TIL. S ohledem na metodiku je situace odlišná u různých typů nádorů. Např. u melanomu existuje několik způsobů evaluace TIL, přičemž s ohledem na prognostický význam mezi těmito způsoby není úplný překryv (5). Stejně tak u kolorektálního karcinomu existuje více možných přístupů, nicméně u této diagnózy je poměrně intenzivní snaha o standardizaci a zavedení hodnocení TIL do praxe (3,4). Postupy hodnocení TIL se obecně poměrně liší a zahrnují semikvantitativní hodnocení v barvení hematoxylin-eozinem, využití imunohistochemické typizace TIL i postupy využívající softwarové řešení (obrazovou analýzu). Vzhledem k uvedenému je snahou vytvořit jednotný systém, který by byl univerzální pro všechny typy solidních nádorů a dostupný bez potřeby využití speciálního, často nákladného, software a imunohistochemických metod. Takový systém představuje způsob hodnocení navrhovaný „International Immuno-Oncology Biomarker Working Group“ (1,2). Jedná se o systém vycházející ze standardizované metodiky pro hodnocení TIL u karcinomu prsu vypracované stejnou pracovní skupinou v minulosti. Systém hodnotí procentuální rozsah (denzitu) lymfocytární infiltrace samostatně v oblasti nádorového stromatu a vlastního nádoru intraepiteliálně (9,10).
Cílem následujícího sdělení je podat přehled problematiky TIL a jejich hodnocení u karcinomu prsu, a to se zaměřením nejen na klinický význam TIL, ale zejména na praktické aspekty testování využitelné v rutinní bioptické diagnostice.
TIL U INVAZIVNÍHO KARCINOMU PRSU
Hodnocení TIL se u karcinomu prsu stává významnou součástí histologického vyšetření a v současné době se jedná o robustní biomarker, jehož validita byla s ohledem na prognostický i prediktivní význam prokázána ve více studiích i na velkých souborech pacientek (11-13). U časných stádií triple-negativního (TNBC) a HER2-pozitivního karcinomu prsu se jedná o prognostický parametr, u kterého je patrná lineární souvislost mezi úrovní TIL a dobou přežívání pacientek bez nemoci – tzv. DFS („disease-free survival“) a uvedené nádory s výraznou přítomností TIL mají obecně velmi dobrou prognózu (11). TIL lze tedy u TNBC a HER2-pozitivních karcinomů prsu použít jako prognostický parametr. Hodnocení TIL je u časného stádia TNBC uvedeno i v doporučení St. Gallen z roku 2019 (14). V rámci hlasování panelu expertů na poslední koferenci St. Gallen v březnu letošního roku (2021) se však pro rutinní testování TIL u časného TNBC vyslovilo jen 39 % panelistů (dosud nepublikované sdělení) a tato problematika aktuálně není zcela dořešena. Důvodem je nejasná implementace této informace do klinické praxe, kdy nevíme, zda můžeme nemocné, jejichž nádory jsou bohaté na TIL, léčit méně (kratší dobu či vůbec) a jakou léčbou (standardní režimy založené na atracyklinech a taxanech +/ - anti-HER2 léčbě nebo založené na platinové chemoterapii či imunoterapii). Přítomnost TIL je u TNBC spojena se zvýšenou pravděpodobností odpovědi na neoadjuvantní chemoterapii s dosažením kompletní patologické odpovědi, a také s lepší prognózou onemocnění po adjuvantní léčbě antracykliny (12,15-18). Jak je však zdůrazněno v recentním St. Gallen guideline, aktuálně se jedná o prognostický marker. K tomu, aby bylo možné TIL doporučit jako prediktivní test ovlivňující rozhodnutí o (neo)adjuvatní léčbě, nejsou v tuto chvíli dostatečná data (14). Prognostický význam TIL stoupá, zdá se, se stádiem nemoci (19), v retrospektivním hodnocení byla prokázána výborná prognóza i u pacientek s časným TNBC, které nebyly léčeny adjuvantní chemoterapií (20). Jednalo se o pacientky stadia I, u kterých byl při TIL >30 % pětileté období přežití bez metastáz D-DFS (distant disease free survival) 97 % a celkové přežití - overall survival (OS) 98 % bez nutnosti podání adjuvantní chemoterapie. U HER2-pozitivních nádorů byla prokázána souvislost mezi vyšší mírou TIL a lepší odpovědí na anti-HER2 léčbu, což deklaruje kooperaci imunitní odpovědi a monoklonálních protilátek cílících receptory z rodiny HER (11,13,21,22). Další významnou oblastí, ve které může hrát přítomnost TIL roli, je predikce odpovědi na imunoterapii (terapii tzv. check-point inhibitory). V současné době se však nejedná o marker, který by byl v této indikaci validován (23-25). Obecně platí, že TNBC a HER2-pozitivní karcinomy vykazují vyšší intenzitu TIL, která bývá v rozsahu udávaném jako hranice pro tzv. karcinomy prsu s predominancí lymfocytů („lymphocyte - -predominant breast cancer“), tedy 50 % (60 %) TIL, přítomna u 20 % TNBC a 16 % HER2-pozitivních karcinomů, oproti karcinomům hormonálně dependentním, u kterých se vyskytuje jen v asi 6 % případů (26). Praktický význam hodnocení TIL u hormonálně dependentních karcinomů je diskutabilní, prognostický význam TIL u těchto nádorů nebyl ve většině studií prokázán, jiné práce však ukazují, že hodnocení TIL může být prognosticky významné i u těchto nádorů (27-29) a je zjevně zapotřebí dalšího výzkumu. V literatuře je také diskutován i potenciální význam hodnocení TIL u hormonálně dependentních nádorů s ohledem na účinnost adjuvantní léčby tamoxifenem, kdy výsledky některých studií poukazují na lepší efekt této léčby u nádorů s nízkým počtem TIL, tedy jejich negativní prognostický význam (27).
TIL se mohou vyskytovat jak v nádorovém stromatu, tak i přímo v nádorovém epitelu, tedy intratumorózně (v užším a poněkud nepřesném slova smyslu - nádorové stroma je integrální a důležitou součástí nádoru, správnější termín by tedy byl intraepiteliálně)(18). Historicky byly používány různé metodiky skórování TIL, i přesto bylo s ohledem na prognostický i prediktivní význam TIL dosaženo obdobných výsledků při samostatném hodnocení intratumorózních a stromálních TIL (30, 31). Nicméně v multivariantních modelech se ukazuje, že hodnocení intratumorózních lymfocytů nemá další prognosticky významnou přidanou hodnotu (32,33). Z praktických důvodů se proto u karcinomu prsu hodnotí pouze přítomnost stromálních a nikoliv intratumorózních lymfocytů. V současné době používá většina studií při hodnocení TIL u karcinomu prsu metodiku vypracovanou „International Immuno-Oncology Biomarker Working Group“, která je doporučována jako způsob hodnocení TIL i v poslední edici WHO klasifikaci nádorů prsu (34,35). Tato metodika má několik výhod, to zejména v poměrné jednoduchosti, relativně vysoké interpersonální shody při hodnocení a zejména pak v tom, že vychází pouze ze standardního barvení hematoxylinem - eozinem. Klinicky relevantní cut-off, který by rozdělil nádory na „TIL pozitivní“ a „TIL negativní“, však nebyl stanoven a je tedy doporučeno TIL uvádět jako kontinuální proměnnou (tedy konkrétní číselný údaj). Někdy se pro nádory s vysokým množstvím TIL (obvykle je za hranici pokládáno 50 % nebo 60 % stromálních TIL) používá označení „karcinom prsu s lymfocytární predominancí“ (26, 36). Podle terminologie poslední WHO klasifikace nádorů prsu jsou však nádory s hojnými TIL klasifikovány jako „invazivní karcinom NST“ (invazivní duktální karcinom) s medulární úpravou („pattern“)(35). Podle této klasifikace se tedy nejedná o samostatný histologický typ (subtyp), ale pouze o morfologické rysy zahrnující nádory v minulosti klasifikované jako medulární karcinom, atypický medulární karcinom a invazivní (duktální) karcinom NOS s medulárními rysy. V molekulární klasifikaci triple negativního karcinomu prsu byl subtyp bohatý na TILS označen jako imunomodulační (37).
V kontextu testování TIL je důležité si také uvědomit, že mezi primárními nádory a metastázami je poměrně vysoké procento neshodných (diskordantních) případů, které se podle recentní metaanalýzy u karcinomu prsu pohybuje na úrovni 37 % (38). Podstatně častější je změna z vysokého stupně infiltrace TIL na nízký. V současnosti se také studuje význam TIL u pacientek s reziduální chorobou po neoadjuvantní chemoterapii u TNBC a HER2-pozitivních karcinomů prsu, což by v budoucnu mohlo v této klinické situaci ovlivnit volbu další systémové léčby (39).
TIL U DUKTÁLNÍHO KARCINOMU IN SITU (DCIS)
V případě duktálního karcinomu in situ (DCIS), kterému bylo doposud věnováno méně pozornosti, se ukazuje, že TIL pravděpodobně nemají prognostický význam, ale jsou častěji asociovány s určitými klinicko-patologickými znaky, jako jsou zejména vyšší grade, přítomnost komedoniformní nekrózy, větší velikost nádoru a nižší věk (40). V jedné recentní studii však bylo prokázáno, že DCIS s vyšším počtem TIL recidivují dříve a TIL v tomto případě tedy představuje prognosticky nepříznivý faktor (41). Jako problematické se nicméně v této studii ukázalo použití metodiky hodnocení stromálních TIL. Jiná studie se zaměřila na hodnocení tzv. „touching TILs“ (tedy TIL v kontaktu s periferií vývodů osídlených DCIS nebo intraepiteliálně nad bazální membránou, avšak pouze do šíře 1 lymfocytu) a „circumferential TILs“ definovaných jako cirkumferenciální (či téměř cirkumferenciální, tedy > 75 % obvodu) přítomnost lemu lymfocytů a plazmatických buněk v zóně širší než 3 buněčné vrstvy (42,43). Výsledky byly srovnávány s výsledky Oncotype DCIS skóre, vyhodnocení tohoto srovnání však nebylo signifikantní. Data ale poukazují na fakt, že TIL u DCIS mohou být prediktorem rekurence, nutný je však další výzkum.
Postup hodnocení TIL u karcinomu prsu podle „International Immuno-Oncology Biomarker Working Group“
Metodika vychází z původní práce Denkerta et al. z roku 2010, je standardizovaná a vychází z barvení hematoxylinem-eozinem bez nutnosti využití imunohistochemických metod či obrazové analýzy (9, 15). Hodnotí se stromální lymfocyty, konkrétně celkový procentuální rozsah denzity lymfocytární infiltrace stromatu v oblasti vymezené hranicemi invazivního nádoru. Metodika je kromě příslušných publikací přesně popsána na webových stránkách zmíněné pracovní skupiny, kde jsou k dispozici i výukové sady a další materiály (https://www.tilsinbreastcancer. org/).
Základní body hodnocení
1) Preferováno je hodnocení resekátů před punkčními biopsiemi, hodnocení z punkčních biopsií zejména před neoadjuvantní terapií je však možné. Preference resekátů před punkčními (či jinými diagnostickými) biopsiemi primárně souvisí hlavně s heterogenitou distribuce TIL. Studie, které se věnovaly problematice srovnání mezi primárními diagnostickými biopsiemi a následnými resekáty, prokázaly signifikantně vyšší hodnoty TIL v resekátu oproti diagnostické biopsii (44,45). V rámci hodnocení resekátu je však nutné vyloučit oblasti po předchozím odběru, ve kterých se vyšší počet zánětlivých elementů může vyskytovat v souvislosti s reaktivními a následnými reparativními procesy.
2) Obecně je jako dostatečné doporučováno hodnocení 1 řezu při zvětšení 200-400x.
3) TIL se hodnotí pouze ve stromatu invazivního nádoru a udávají se jako % plochy stromatu infiltrované TIL (obr. 1). Při hodnocení se musí zohlednit i to, že lymfocyty u nádorů obvykle nevytvářejí splývající plochy a je mezi nimi určitý prostor, tj. i při 100 % stromálních TIL nebude stroma lymfocyty zcela vyplněno. Stromální TIL z definice představují buňky lokalizované ve stromatu nádoru, které nejsou v přímém kontaktu („cell-to-cell“) s nádorovými buňkami, a to nejen v hnízdech nádorových buněk, ale ani v jejich okolí. Nádorové stroma je omezeno na vlastní nádorové struktury, peritumorální stroma se do hodnocení nezapočítává.
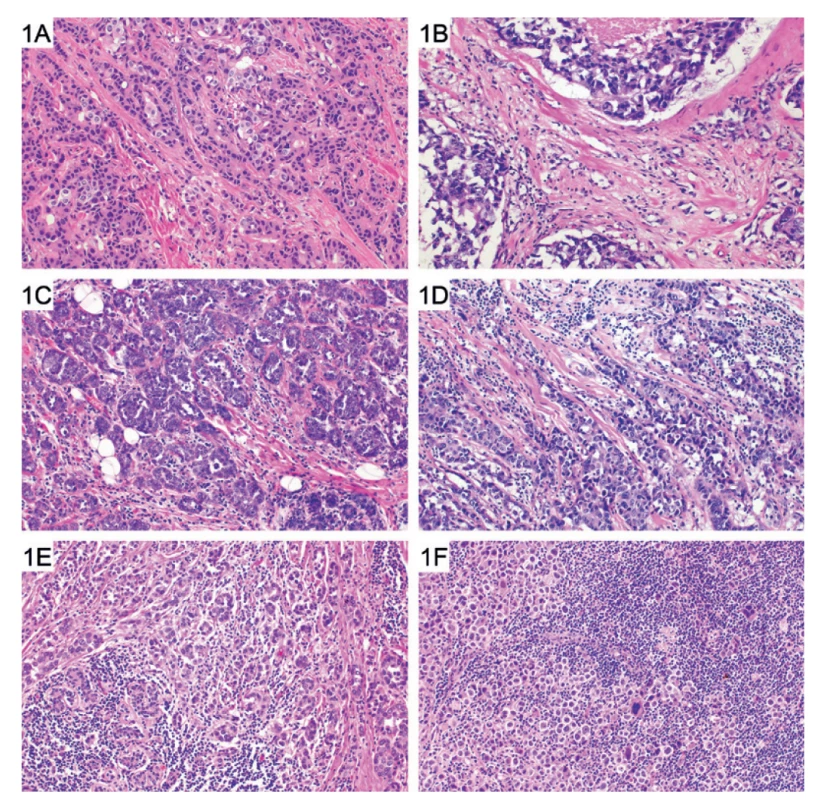
4) TIL v okolí nádoru či v oblasti DCIS a přilehlých benigních strukturách se nehodnotí.
5) Oblasti zhmožděné, nekrotické a regresivně změněné včetně oblastí s hyalinizacemi se nehodnotí.
6) Mezi TIL se počítají všechny tzv. mononukleáry (zahrnující lymfocyty, plazmatické buňky, makrofágy, dendritické buňky). Neutrofilní granulocyty a další elementy (eozinofily, basofily, žírné buňky) se nepočítají.
7) Hodnotí se celý řez, nikoliv pouze oblasti se zvýšenou infiltrací zánětlivých elementů – tzv. „hot spots“.
8) TIL jsou reportovány jako kontinuální parametr a v současné době nejsou přesně stanovené, klinicky relevantní hranice pozitivity. Doporučováno je reportování zcela dle uvážení patologa s tím, že v praxi je obvyklé spíše zaměření se na určité hraniční hodnoty např. s 5% či s 10% rozmezím, než uvádění přesného čísla.
Nejčastější příčiny diagnostických neshod
Do současné doby proběhly dvě větší studie, které se zaměřily na hodnocení diagnostické shody při hodnocení TIL (10). První studie měla 2 kola (se 32 hodnotiteli na 60 případech a se 28 hodnotiteli na 60 případech) s celkovou konkordancí 88 % v prvním kole a 92 % ve druhém kole. Druhá studie probíhala na 100 případech (46). V této studii byla konkordance mezi hlavním hodnotitelem a 6 dalšími patology 90,8 %. V následné recentní reanalýze uvedených studií byly vyhodnoceny nejčastější příčiny diagnostických neshod, na které je vhodné se při hodnocení speciálně zaměřit (47). Tyto příčiny zahrnovaly: nádorovou heterogenitu, technické faktory, zahrnutí pro hodnocení nevhodných oblastí nádoru či hodnocení nesprávných buněk, a případy s malým množstvím stromatu. Jak autoři zdůrazňují, při dodržení všech definovaných základních principů hodnocení se jako klíčové body jeví hodnocení více oblastí u heterogenních nádorů a používání referenčních obrázků usnadňujících správné hodnocení („naprahování“) denzity pozitivity. Tyto referenční obrázky a aplikace, která umožní srovnání vlastních případů s referenčními obrázky, jsou po bezplatné registraci k dispozici na webových stránkách https://www.tilsinbreastcancer.org/. Jednotlivé potenciálně problematické aspekty hodnocení jsou diskutovány níže. Problematické případy a jejich hodnocení jsou také dostupné na již zmíněných stránkách (https://www.tilsinbreastcancer. org/pitfalls/).
Nicméně i při použití referenčních obrázků dochází k diskrepancím, a to zejména u nádorů s nižšími hodnotami TIL, jak ukázaly výsledky evropské studie na 84 vzorcích hodnocených celkem 19 mamárními patology (48).
1. Nádorová heterogenita
Jedná se o faktor, který byl jednou z nejčastějších příčin neshody. Problematické bylo hodnocení nádorů, které vykazovaly heterogenitu TIL v celém rozsahu nádoru - v těchto případech je nutné skórovat odlišné oblasti nádoru a ty pak zprůměrovat. Dalším problémem byly nádory, které měly výrazné množství TIL v oblasti invazivního okraje – u těchto nádorů se hodnotí TIL pouze v případě, že jsou přítomny v periferii nádoru, nikoliv v přilehlém stromatu bez nádorových struktur.
2. Technické faktory
Tyto faktory zahrnovaly špatnou kvalitu histologických preparátů v souvislosti s prolongovanou ischemií, špatnou fixací, a problémy při zpracování tkáně (včetně zalévání a krájení na mikrotomu). Technické aspekty byly významné zejména ve studii 100 případů, které představovaly excizní biopsie z více center. Naopak v dalších 2 srovnávacích studiích tyto faktory nehrály podstatnější roli, což může souviset i s tím, že se jednalo o punkční bioptické vzorky. Na obecné úrovni a v rutinní diagnostické praxi je však s těmito faktory nutné počítat a hodnocení TIL provádět z technicky co nejlepších řezů.
3. Zahrnutí nevhodných oblastí nádoru a hodnocení nesprávných buněk
Hodnocení probíhá pouze v oblastech invazivního karcinomu. Vyloučit je tedy nutné in situ léze, jako je DCIS či opouzdřený papilární karcinom. Problematické může v některých případech být stanovení hranice nádoru, protože dochází k započítání nesprávných oblastí, které jsou mimo vlastní nádorové stroma. Již zmíněná složka DCIS může být zaměněna za invazivní složku a způsobit problémy při hodnocení ať už kvůli vlastnímu hodnocení lymfocytů v této oblasti, nebo chybnému vymezení hranic invazivního nádoru. Stejně tak přítomnost zánětlivých infiltrátů v lobulech a v oblasti reziduálních struktur nenádorového parenchymu prsu může vést k chybnému vymezení hranice nádoru a tím pádem být příčinou chybného vyhodnocení jako TIL v oblasti nádoru. Nutné je v tomto kontextu opět zdůraznit, že se hodnotí pouze TIL ve stromatu, nikoliv tedy TIL v nádorovém epitelu (intraepiteliální TIL) a ani TIL, které jsou na rozhraní stromatu a epitelu v přímém kontaktu s nádorovými buňkami.
Hodnocení nesprávných buněk zahrnuje započítání dalších zánětlivých elementů jiných než mononukleárů. Další elementy, které mohou být chybně započítány, jsou apoptoticky zanikající či regresivně změněné nádorové buňky. S ohledem na správný výběr započítávaných elementů je tedy často nutné použít velké zvětšení, které spolehlivě umožní zhodnocení složení přítomného infiltrátu.
4. Limitovaná přítomnost stromatu pro hodnocení
Výsledky mohou být zkresleny i z tohoto důvodu. Nejčastěji tato situace nastává u nádorů s výraznými regresivními změnami s nekrózami, po jejichž vyloučení zbývá minimum hodnotitelné vitální tkáně. Problematické může být i hodnocení nádoru, který obsahuje minimální množství stromatu i přes absenci regresivních změn, jako jsou například mucinózní karcinomy.
ZÁVĚR
Hodnocení TIL u karcinomu prsu se stává důležitou součástí diagnostického procesu zejména u TNBC a HER2-pozitivního karcinomu prsu, u kterých má prognostický význam, zejména s ohledem na predikci kompletní patologické odpovědi (pCR) po neoadjuvantní terapii a odpovědi na adjuvantní chemoterapii. U ostatních typů invazivního karcinomu prsu je význam hodnocení TIL diskutabilní. Některé recentní studie však prokázaly prognostický význam i u hormonálně dependentních nádorů, zejména těch s vysokou proliferací, na které je vázána přítomnost TIL. Pro efekt hormonální terapie jsou TIL spíše negativním prediktorem (27). Hodnocení TIL je u karcinomu prsu doporučováno dle St. Gallen guideline (2019) u TNBC, kde má prognostický význam, a je doporučováno i podle nové WHO klasifikace nádorů prsu (14,35). Metodicky by se měl používat způsob hodnocení vypracovaný „International Immuno-Oncology Biomarker Working Group“, který je standardizován a aktuálně představuje nejlepší způsob hodnocení TIL. Jeho výhodou je kromě jednoduchosti (vychází pouze z barvení hematoxylinem - -eozinem) a dostupnosti výborných edukačních a tréninkových materiálů i to, že užíváním standardizované metodiky umožňuje srovnatelnost napříč různými studiemi. Aktuálně nejsou přesně definovány hranice pozitivity umožňující jednoznačnou stratifikaci do jakýchsi definovaných kategorií a TIL tedy představuje kontinuální proměnnou. Pro praktické účely je sice možné vyčlenění skupiny nádorů s nízkou přítomností TIL (jako cut-off se v některých studiích používá hranice < 10 %), nutné je však zdůraznit, že toto dělení je arbitrární a některé práce prokázaly jako signifikantní jiné prahové hodnoty (např. > 20 % TIL) (15,22). Obecně platí, že prognostický význam přítomnosti TIL narůstá se zvyšujícím se procentem stromální infiltrace. V několika studiích bylo prokázáno, že s každým zvýšením TIL o 10 % se zlepšují parametry jako je DFS („disease free survival“) a OS („overall survival“) (19). Jako nádory s lymfocytární predominancí („lymphocyte-predominant breast cancer“), které by dle nové WHO klasifikace karcinomů prsu spadaly do kategorie invazivního karcinomu NST s medulárními rysy či úpravou („medullary pattern“), jsou označovány nádory s TIL přesahujícími 50 či 60 %. Hodnocení TIL má svá úskalí, ale při jejich vědomí a standardizaci postupů hodnocení lze dosáhnout vysoké míry interobservační shody. K tomu dopomáhají i výukové a tréninkové materiály zveřejněné on line. I přesto, že hodnocení TIL není v rámci bioptického nálezu mandatorní, jedná se o klinicky významný parametr s prognostickým a potenciálně i prediktivním významem, jehož hodnocení u TNBC a HER2-pozitivního karcinomu prsu by mělo být součástí vyšetření.
PODĚKOVÁNÍ
Práce byla podpořena MZČR (projekt RVO VFN 64165) a Univerzitou Karlovou (projekt Progres Q28/LF1 a SVV 260516).
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
Prof. MUDr. Pavel Dundr, Ph.D.
Ústav patologie 1. LF UK a VFN v Praze
Studničkova 2
128 00, Praha 2
pavel.dundr@mailbox.org
Sources
1. Hendry S, Salgado R, Gevaert T, et al. Assessing tumor-infiltrating lymphocytes in solid tumors: A practical review for pathologists and proposal for a standardized method from the international immuno-oncology biomarkers working group: Part 2: Tils in melanoma, gastrointestinal tract carcinomas, non-small cell lung carcinoma and mesothelioma, endometrial and ovarian carcinomas, squamous cell carcinoma of the head and neck, genitourinary carcinomas, and primary brain tumors. Adv Anat Pathol 2017; 24(6): 311-335.
2. Hendry S, Salgado R, Gevaert T, et al. Assessing tumor-infiltrating lymphocytes in solid tumors: A practical review for pathologists and proposal for a standardized method from the international immunooncology biomarkers working group: Part 1: Assessing the host immune response, tils in invasive breast carcinoma and ductal carcinoma in situ, metastatic tumor deposits and areas for further research. Adv Anat Pathol 2017; 24(5): 235-251.
3. Pages F, Mlecnik B, Marliot F, et al. International validation of the consensus immunoscore for the classification of colon cancer: A prognostic and accuracy study. Lancet 2018; 391(10135): 2128-2139.
4. Mlecnik B, Bifulco C, Bindea G, et al. Multicenter international society for immunotherapy of cancer study of the consensus immunoscore for the prediction of survival and response to chemotherapy in stage iii colon cancer. J Clin Oncol 2020; 38(31): 3638-3651.
5. Nemejcova K, Ticha I, Bartu M, et al. Comparison of five different scoring methods in the evaluation of inflammatory infiltration (tumor-infiltrating lymphocytes) in superficial spreading and nodular melanoma. Pigment Cell Melanoma Res 2019; 32(3): 412-423.
6. Dundr P, Nemejcova K, Bartu M, Ticha I, Jaksa R. Evaluation of inflammatory cells (tumor infiltrating lymphocytes - TIL) in malignant melanoma. Cesk Patol 2018; 54(1): 27-31.
7. Dundr P, Nemejcova K, Bartu M, et al. Evaluation of inflammatory cells (tumor infiltrating lymphocytes) in solid tumors. Klin Onkol 2017; 30(Suppl 3): 10-21.
8. Zavadova E, Spacek J, Vocka M, et al. Immunoscore and its predictive value for colorectal cancer. Klin Onkol 2015; 28 Suppl 4: S82-85.
9. Salgado R, Denkert C, Campbell C, et al. Tumor-infiltrating lymphocytes and associations with pathological complete response and event-free survival in her2-positive early - stage breast cancer treated with lapatinib and trastuzumab: A secondary analysis of the neoaltto trial. JAMA Oncol 2015; 1(4): 448-454.
10. Denkert C, Wienert S, Poterie A, et al. Standardized evaluation of tumor-infiltrating lymphocytes in breast cancer: Results of the ring studies of the international immuno-oncology biomarker working group. Mod Pathol 2016; 29(10): 1155-1164.
11. Loi S, Michiels S, Salgado R, et al. Tumor infiltrating lymphocytes are prognostic in triple negative breast cancer and predictive for trastuzumab benefit in early breast cancer: Results from the finher trial. Ann Oncol 2014; 25(8): 1544-1550.
12. Loi S, Sirtaine N, Piette F, et al. Prognostic and predictive value of tumor-infiltrating lymphocytes in a phase iii randomized adjuvant breast cancer trial in node-positive breast cancer comparing the addition of docetaxel to doxorubicin with doxorubicin - -based chemotherapy: Big 02-98. J Clin Oncol 2013; 31(7): 860-867.
13. Xu T, He BS, Liu XX, et al. The predictive and prognostic role of stromal tumor-infiltrating lymphocytes in her2-positive breast cancer with trastuzumab-based treatment: A meta - analysis and systematic review. J Cancer 2017; 8(18): 3838-3848.
14. Burstein HJ, Curigliano G, Loibl S, et al. Estimating the benefits of therapy for early-stage breast cancer: The st. Gallen international consensus guidelines for the primary therapy of early breast cancer 2019. Ann Oncol 2019; 30(10): 1541-1557.
15. Denkert C, Loibl S, Noske A, et al. Tumor - -associated lymphocytes as an independent predictor of response to neoadjuvant chemotherapy in breast cancer. J Clin Oncol 2010; 28(1): 105-113.
16. Carbognin L, Pilotto S, Nortilli R, et al. Predictive and prognostic role of tumor-infiltrating lymphocytes for early breast cancer according to disease subtypes: Sensitivity analysis of randomized trials in adjuvant and neoadjuvant setting. Oncologist 2016; 21(3): 283-291.
17. Melichar B, Študentova H, Kalábová H, et al. Predictive and prognostic significance of tumor-infiltrating lymphocytes in patients with breast cancer treated with neoadjuvant systemic therapy. Anticancer Res 2014; 34(3): 1115-1125.
18. Hornychova H, Melichar B, Tomsova M, et al. Tumor-infiltrating lymphocytes predict response to neoadjuvant chemotherapy in patients with breast carcinoma. Cancer Invest 2008; 26(10): 1024-1031.
19. Loi S, Drubay D, Adams S, et al. Tumor-infiltrating lymphocytes and prognosis: A pooled individual patient analysis of early-stage triple - negative breast cancers. J Clin Oncol 2019; 37(7): 559-569.
20. Park JH, Jonas SF, Bataillon G, et al. Prognostic value of tumor-infiltrating lymphocytes in patients with early-stage triple - -negative breast cancers (TNBC) who did not receive adjuvant chemotherapy. Ann Oncol 2019; 30(12): 1941-1949.
21. Yoon GY, Chae EY, Cha JH, et al. Imaging and clinicopathologic features associated with pathologic complete response in her2-positive breast cancer receiving neoadjuvant chemotherapy with dual her2 blockade. Clin Breast Cancer 2020; 20(1): 25-32.
22. Yang X, Rao J, Yang W, Shui R. Evaluation of the predictive and prognostic values of stromal tumor-infiltrating lymphocytes in her2-positive breast cancers treated with neoadjuvant chemotherapy. Target Oncol 2018; 13(6): 757-767.
23. Savas P, Salgado R, Denkert C, et al. Clinical relevance of host immunity in breast cancer: From tils to the clinic. Nat Rev Clin Oncol 2016; 13(4): 228-241.
24. Bertucci F, Goncalves A. Immunotherapy in breast cancer: The emerging role of PD-1 and PD-L1. Curr Oncol Rep 2017; 19(10): 64.
25. Schmid P, Salgado R, Park YH, et al. Pembrolizumab plus chemotherapy as neoadjuvant treatment of high-risk, early-stage triple-negative breast cancer: Results from the phase 1b open-label, multicohort keynote - 173 study. Ann Oncol 2020; 31(5): 569-581.
26. Stanton SE, Adams S, Disis ML. Variation in the incidence and magnitude of tumor-infiltrating lymphocytes in breast cancer subtypes: A systematic review. JAMA Oncol 2016; 2(10): 1354-1360.
27. Lundgren C, Bendahl PO, Ekholm M, et al. Tumour-infiltrating lymphocytes as a prognostic and tamoxifen predictive marker in premenopausal breast cancer: Data from a randomised trial with long-term follow-up. Breast Cancer Res 2020; 22(1): 140.
28. Mao Y, Qu Q, Chen X, et al. The prognostic value of tumor-infiltrating lymphocytes in breast cancer: A systematic review and meta - -analysis. PLoS One 2016; 11(4): e0152500.
29. Wang K, Xu J, Zhang T, Xue D. Tumor-infiltrating lymphocytes in breast cancer predict the response to chemotherapy and survival outcome: A meta-analysis. Oncotarget 2016; 7(28): 44288-44298.
30. West NR, Milne K, Truong PT, et al. Tumor - -infiltrating lymphocytes predict response to anthracycline-based chemotherapy in estrogen receptor-negative breast cancer. Breast Cancer Res 2011; 13(6): R126.
31. Ali HR, Provenzano E, Dawson SJ, et al. Association between cd8+ t-cell infiltration and breast cancer survival in 12,439 patients. Ann Oncol 2014; 25(8): 1536-1543.
32. Loi S. Tumor-infiltrating lymphocytes, breast cancer subtypes and therapeutic efficacy. Oncoimmunology 2013; 2(7): e24720.
33. Ibrahim EM, Al-Foheidi ME, Al-Mansour MM, Kazkaz GA. The prognostic value of tumor-infiltrating lymphocytes in triple-negative breast cancer: A meta-analysis. Breast Cancer Res Treat 2014; 148(3): 467-476.
34. Salgado R, Denkert C, Demaria S, et al. The evaluation of tumor-infiltrating lymphocytes (tils) in breast cancer: Recommendations by an international tils working group 2014. Ann Oncol 2015; 26(2): 259-271.
35. Board WCOTE. Breast tumours (5th ed.). Lyon, France: IARC Press; 2019:
36. Wein L, Savas P, Luen SJ, et al. Clinical validity and utility of tumor-infiltrating lymphocytes in routine clinical practice for breast cancer patients: Current and future directions. Front Oncol 2017; 7(156.
37. Lehmann BD, Jovanović B, Chen X, et al. Refinement of Triple-Negative Breast Cancer Molecular Subtypes: Implications for Neoadjuvant Chemotherapy Selection. PLOS ONE 2016; 11(6): e0157368.
38. Zou Y, Hu X, Zheng S, et al. Discordance of immunotherapy response predictive biomarkers between primary lesions and paired metastases in tumours: A systematic review and meta-analysis. EBioMedicine 2021; 63 : 103137.
39. Dieci MV, Radosevic-Robin N, Fineberg S, et al. Update on tumor-infiltrating lymphocytes (tils) in breast cancer, including recommendations to assess tils in residual disease after neoadjuvant therapy and in carcinoma in situ: A report of the international immuno-oncology biomarker working group on breast cancer. Semin Cancer Biol 2018; 52(Pt 2): 16-25.
40. Pruneri G, Lazzeroni M, Bagnardi V, et al. The prevalence and clinical relevance of tumor - infiltrating lymphocytes (tils) in ductal carcinoma in situ of the breast. Ann Oncol 2017; 28(2): 321-328.
41. Darvishian F, Ozerdem U, Adams S, et al. Tumor-infiltrating lymphocytes in a contemporary cohort of women with ductal carcinoma in situ (dcis). Ann Surg Oncol 2019; 26(10): 3337-3343.
42. Komforti M, Badve SS, Harmon B, Lo Y, Fineberg S. Tumor-infiltrating lymphocytes in ductal carcinoma in situ - assessment using three different methodologies and correlation with oncotype dx dcis score. Histopathology 2020; 77(5):749-759.
43. Knopfelmacher A, Fox J, Lo Y, Shapiro N, Fineberg S. Correlation of histopathologic features of ductal carcinoma in situ of the breast with the oncotype dx dcis score. Mod Pathol 2015; 28(9): 1167-1173.
44. Cha YJ, Ahn SG, Bae SJ, et al. Comparison of tumor-infiltrating lymphocytes of breast cancer in core needle biopsies and resected specimens: A retrospective analysis. Breast Cancer Res Treat 2018; 171(2): 295-302.
45. Huang J, Chen X, Fei X, et al. Changes of tumor infiltrating lymphocytes after core needle biopsy and the prognostic implications in early stage breast cancer: A retrospective study. Cancer Res Treat 2019; 51(4): 1336-1346.
46. Kim RS, Song N, Gavin PG, et al. Stromal tumor-infiltrating lymphocytes in nrg oncology/ nsabp b-31 adjuvant trial for early-stage her2-positive breast cancer. J Natl Cancer Inst 2019; 111(8): 867-871.
47. Kos Z, Roblin E, Kim RS, et al. Pitfalls in assessing stromal tumor infiltrating lymphocytes (stils) in breast cancer. NPJ Breast Cancer 2020; 6 : 17.
48. O’loughlin M, Andreu X, Bianchi S, et al. Reproducibility and predictive value of scoring stromal tumour infiltrating lymphocytes in triple-negative breast cancer: A multi-institutional study. Breast Cancer Res Treat 2018; 171(1): 1-9.
Labels
Anatomical pathology Forensic medical examiner ToxicologyArticle was published in
Czecho-Slovak Pathology

2021 Issue 3
-
All articles in this issue
- Next-Generation Pathology
- Cesta k cíli vede přes spolupráci
- 'PATOLOGIE MĚKKÝCH TKÁNÍ
- 'PATOLOGIE ORL OBLASTI
- 'UROPATOLOGIE
- 'GYNEKOPATOLOGIE
- 'NEFROPATOLOGIE
- 'HEPATOPATOLOGIE
- 'KARDIOPATOLOGIE
- 'HEMATOPATOLOGIE
- 'PATOLOGIE MĚKKÝCH TKÁNÍ
- 'PATOLOGIE GIT
- 'CYTODIAGNOSTIKA
- 'LABORATORNÍ METODY
- Sekvenování nové generace – nástroj vědy či rutinní patologie?
- 'PULMOPATOLOGIE
- Sekvenování nové generace a molekulární onkologický multidisciplinární tým z pohledu onkologa
- Možnosti molekulárního testování somatických aberací v nádorové tkáni metodou NGS v rutinní praxi - aktuální situace v České republice
- Sekvenování nové generace a jeho aplikace v diagnostice neuromuskulárních onemocnění
- Využití metylačního profilu v diagnostice a prognostice nádorových onemocnění CNS
- Přehled problematiky hodnocení tumor infiltrujících lymfocytů u karcinomu prsu v rutinní diagnostické praxi
- Nediagnostikovaná kryptokoková meningoencefalitída s rozsiahlymi hypoxickoischemickými zmenami mozgu charakteru tretieho stupňa difúzneho axonálneho poškodenia
- Doporučení pro testování PD-L1: metodika testování a reportování výsledků Verze_1 (17. 5. 2021)
- Molekulární testování u karcinomu endometria (společné doporučení ČOS, onkogynekologické sekce ČGPS, SROBF a SČP ČLS JEP)
- Obrovskobuněčná myokarditida u mladé ženy odhalená při pitvě: kazuistika
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Doporučení pro testování PD-L1: metodika testování a reportování výsledků Verze_1 (17. 5. 2021)
- Sekvenování nové generace – nástroj vědy či rutinní patologie?
- Molekulární testování u karcinomu endometria (společné doporučení ČOS, onkogynekologické sekce ČGPS, SROBF a SČP ČLS JEP)
- Využití metylačního profilu v diagnostice a prognostice nádorových onemocnění CNS
