Sérové protilátky proti endomýziu (AEA) v diagnostickom algoritme celiakie
Serum Anti-Endomysium Antibodies (AEA) in the Diagnostic Algorithm of Coeliac Disease
The diagnostic relevance of serum anti-endomysium antibodies (AEA) in patients with celiac disease is discussed. A group of 23 newly diagnosed patients, i.e. seven patients with mild AEA positivity (+), nine patients with intermediate AEA positivity (++) and seven patients with strong AEA positivity (+++), was selected. The AEA reactivity was evaluated semiquantitatively. Celiac disease and AEA are less than 100% correlated. The final diagnosis has to be confirmed by histopathology of small intestine biopsy specimens. The available targeted screening is an alternative with a potential for the detection of atypical forms of celiac disease. Another alternative for early diagnosis is the detection of intraepithelial lymphocyte activity or of lymphocyte mediators.
Key words:
apoptosis – gluten-free diet – diagnostics – gluten – malabsorption syndrome – small bowel – tissue transglutaminase – TNF family.
Authors:
P. Makovický
Authors‘ workplace:
Czech University of Life Sciences, Praha
Published in:
Epidemiol. Mikrobiol. Imunol. 58, 2009, č. 4, s. 163-166
Overview
Práca pojednáva o význame sérových protilátok proti endomýziu (AEA) u pacientov s celiakiou. V súbore 23 novo diagnostikovaných pacientov je zahrnutá skupina siedmych s pozitivitou na jeden +, deviatich s pozitivitou na dva ++ a siedmych s pozitivitou AEA na +++. Jednotlivé stupne boli posudzované semikvantitatívne. AEA nie sú v kontexte s celiakiou 100%. Záverečná diagnóza sa musí opierať o histologické vyšetrenie biopticky odobratej vzorky z tenkého čreva. Alternatíva vypracovaného cieleného screeningu je potencionálne vhodnou metódou slúžiacou k odhaľovaniu atypických foriem ochorenia. Inou možnosťou rannej diagnostiky je dôkaz aktivity intraepitelových lymfocytov, respektíve detekcia ich mediátorov.
Kľúčové slová:
apoptóza – bezlepková diéta – diagnostika – lepok – malabsorpčný syndróm – tenké črevo – tkanivová transglutamináza – TNF rodina.
Celiakia je ochorenie spojené s permanentnou intoleranciou lepku, ktorý je súčasťou niektorých obilnín. V patogenéze je známy spúšťač, tesná genetická väzba a špecifická autoimunitná odpoveď. Gliadínové peptidy reagujú s HLA–DQ2 a HLA–DQ8 pozitívnymi imunokompetentnými bunkami so zahájením kaskády reakcií, ktorých morfologickým pandantom sú zmeny sliznice tenkého čreva [5, 21]. Tieto zahrňujú zápalovú reakciu a atrofiu klkového reliéfu [17, 19]. Ide o typické, ale nie špecifické zmeny s remisiou po nasadení jedinej kauzálnej terapie, spočívajúcej v prísnej bezlepkovej diéte. V mechanizme účinku toxicity lepku bola preukázaná väzba štiepnych produktov na enterocyt, prienik do lamina propria, reakcia s T i B-lymfocytmi, produkcia autoprotilátok a aktivácia imunologických procesov s uvoľnením cytokínov [29]. V klinickej praxi sa rozlišuje viacero foriem ochorenia [20]. Na jedného pacienta s klasickou celiakiou, pripadá niekoľko nediagnostikovaných s atypickou symptomatológiou. Odhaľovaním nových prípadov sa prevalencia ochorenia zvýšila a podľa zahraničných literárnych údajov sa v súčasnosti pohybuje okolo 1 : 100, 1 : 200 až 1 : 266 [8, 13]. Na našom území by podľa kvalifikovaného odhadu nediagnostikované formy mohli tvoriť skupinu až 70-80% prípadov dospelých [23].
V diagnostike ochorenia ostáva zaužívaným tzv. zlatým štandardom biopsia [18]. V snahe zachytiť ochorenie čo najskôr, hľadajú sa rýchle a predovšetkým menej invazívnejšie vyšetrovacie metodiky. V tomto slova zmysle sa v súčasnosti bežne vyšetrujú sérové autoprotilátky. Ide o relatívne jednoduchú metódu, ktorá prispieva k diagnóze, eventuálne k posúdeniu aktivity ochorenia [10]. Ako prvé boli Bergerom [1] popísané antigliadínové protilátky (AGA). Následne boli zistené vzťahy medzi antiretikulínovými protilátkami (ARA) a ochorením [27]. Neskôr boli aj v spojitosti s kožnou chorobou Herpetiformis dermatitis Dühring autorským kolektívom Chorzelski et al. [11] popísané antiendomyziálne protilátky (AEA). Podobne v priebehu uvedeného kožného ochorenia v kombinácii s celiakiou boli Kárpátiovou et al. [14] popísané antijejunálne protilátky (JAB). Za posledný autoantigén sa považuje tkanivová transglutamináza (t-TG), ktorá bola objavená v roku 1997 Dietrichom et al. [4]. V súčasnosti sú v diagnostickom algoritme, včítane kontroly dodržiavania zásad bezlepkovej diéty využívajú najmä AEA a t-TG. V domácich i zahraničných literárnych údajoch sa udáva, že majú vysokú špecificitu, včítane senzitivity [12, 28]. Vzhľadom k vysokej prevalencii ochorenia začalo sa aj u nás uvažovať o možnostiach zavedenia celoplošného screeningu do klinickej praxe. Bola zložená špeciálna expertní skupina pro celiakální sprue (ESCS), ktorá pripravila program cieleného screeningu pre všetky odborné lekárske spoločnosti. Skupina bola neskôr zrušená, ale jej program ostáva prístupný širokej odbornej i laickej spoločnosti. Aj keď cielený screening nikdy nebol oficiálne prijatý do klinickej praxe, možno konštatovať, že prostredníctvom vyšetrení sérových autoprotilátok bolo odhalených množstvo atypických foriem, včítane iných systémových ochorení [6]. Vzhľadom k ich výpovednej hodnote začalo sa špekulovať, či by k diagnostike nestačili len tieto vyšetrenia [9]. Vychádzajúc z našich laboratórnych možností, rozhodli sme sa preto otestovať výpovednú hodnotu AEA ako možnosť screeningovej metódy pred realizáciou biopsie. V našej práci sme si preto dali za cieľ overiť či majú AEA v diagnostickom algoritme celiakie zmysel.
Materiál a metódy
Náš súbor tvorí skupina vybraných vzoriek pochádzajúcich z retrospektívnej štúdie. Súbor bol tvorený 23 vzorkami. Z toho 15 vzoriek od ženského pohlavia vo vekovom rozmedzí 2–52 rokov (∅ 26,53 rokov) a 8 vzoriek od mužského pohlavia vo vekovom rozmedzí 2–57 rokov (∅ 14,50 rokov). Vzhľadom k veľkému množstvu pozitívnych prípadov v našom materiály, rozhodli sme sa vybrať skupinu rozsiahlejšieho vekového rozmedzia. Kritériá výberu vzoriek spočívajú v selekčnom výbere opierajúc sa o semikvantitatívne hodnoty pozitivity AEA. V snahe o demonštráciu univerzálnosti metódy bola za každú skupinu pozitivity AEA vybraná čo najširšia veková skupina. Ambulantne, respektíve v priebehu hospitalizácie boli mimo základných laboratórnych vyšetrení vykonané aj vyšetrenia na detekciu sérových autoprotilátok AEA formou nepriamej imunofluorescenčnej metódy (NIF). Odobratá vzorka krvi bola spracovaná centrifugáciou najneskôr do 2 hodín po dodaní do laboratória. Sérum bolo odpipetované do vopred označených skúmaviek a takto prakticky okamžite fixované v mraziacom boxe vychladenom na –30 °C. AEA boli stanovované na ľudskom pupočníku. Tkanivo pupočníka sme získali odberom po fyziologickom pôrode. Takto získané tkanivo bolo spracované v tvare mozaiky a zmrazené pri teplote –80 °C v podchladenom acetóne/petroléteri. Z mozaikových foriem boli na zmrazovacom mikrotóme narezané sériové rezy o hrúbke 5 μm, ktoré boli nanesené na čisté, odmastené a označené podložné sklíčka. Sklíčka s rezmi boli pri pokojovej izbovej teplote sušené po dobu 30 min a následne fixované v kyvetách s bezvodým acetónom v chladiacom boxe po dobu 5 min. Po fixácii boli sklíčka krátko ešte sušené a potom uložené do kyviet s obsahom fosfátového pufra o pH 7,6 (PBS) po dobu 5 min. Medzitým rozmrazené sérum bolo odpipetované do vopred označených skúmaviek a riedené 1 : 10 s PBS. Sérum bolo podľa označení na podložných sklíčkach aplikované na kryokatové rezy. Následne boli sklíčka uložené vo vlhkej komôrke k 30-minútovej inkubácii pri pokojovej izbovej teplote. Po inkubácii bolo prebytočné sérum opláchnuté s PBS a sklíčka boli uložené v kyvetách s PBS po dobu 10 min. Po premytí bolo tkanivo prevrstené konjugátom fluoresceínu (SwAHU IgA/FITZ) a sklíčka boli opätovne uložené k inkubácii vo vlhkej komôrke po dobu 30 min. Po inkubácii bol prebytočný konjugát zliaty a sklíčka boli opätovne uložené v kyvetách s PBS po dobu 10 min. Po uplynutí tejto doby boli preparáty opatrne ošetrené suchou gázou a uložené do krabice na preparáty, kde oschli. Takto vyhotovené boli do jedného dňa odčítané v spektre fluorescenčného mikroskopu Nikon s halogénovou lampou 103W. Pri semikvantitatívnom vyhodnotení boli definované 4 stupne (negatívne, +, ++, +++), ktoré boli na výsledkovom liste doplnené popisom patológa. Jednotlivé stupne pozitivity boli posudzované subjektívne. Všetky preparáty boli vyhotovené i hodnotené jedným pracovníkom. Po potvrdení pozitivity boli pacienti odosielaní na odborné vyšetrenie spojené s bioptickým odberom vzoriek z jednotlivých častí duodena. Vzhľadom k semikvantitatívnému hodnoteniu imunofluorescenčných obrazov s cieľom vyjadriť stupeň AEA, sú výsledky histopatologického vyšetrenia uvedené bez popisu charakteru zmien vo svetelno-mikroskopickom obraze.
Výsledky
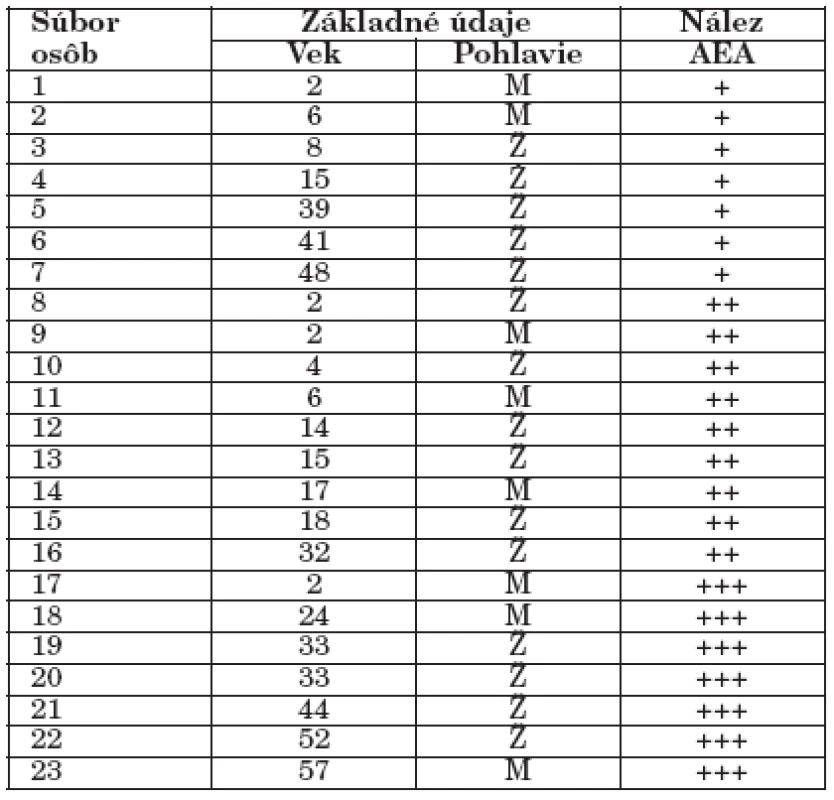
Vzťahy medzi základnými údajmi a nálezmi
Tieto sú zdokumentované v tabulce 1.
Fluorescenčno mikroskopický nález
Ide o rôzne diferencovanú pozitivitu, ktorá sa odráža jasnou žlto-zelenou žiarivou fluorescenciou. Pozitivita je prítomná na periférii buniek, v rôsolovitom väzive, resp. Whartonovom rôsole v reakcii s retikulárnymi vláknami s umelým dojmom obrazu sieťoviny. Pri hodnotení boli posudzované ukazovatele, ako je jasnosť, intenzita, celistvosť a plocha fluorescencie patričných funkčných miest AEA. Tieto ukazovatele determinujú pridelenie jednotlivých stupňov pozitivity.
Diskusia
Sérové autoprotilátky výrazne prispeli k odhaľovaniu atypických foriem celiakie. Odborná verejnosť preto očakávala od celoplošnej realizácie cieleného screeningu, ktorý bol vypracovaný spomínanou ESCS odhalenie ďalších pozitívnych prípadov s atypickou symptomatológiou a zlepšenie diagnostiky. Aj v našej práci venovanej možnostiam jej diagnostiky sme sa vyjadrili, že screening je vhodnou metódou, slúžiacou k odhaľovaniu rôznych foriem celiakie [21]. Pritom AEA (IgA) toho času ostávajú stále štandardným testom v jej diagnostickom algoritme. Tieto protilátky reagujú so štruktúrami intercelulárnej matrix, s retikulínovými vláknami a s endomýziom hladkého svalstva. Ide o reakciu s proteínovou zložkou spojivového tkaniva [22]. Špecificita a senzitivita testu je vysoká a pohybuje sa až do 100 % [16]. Pokiaľ by sa týmto testom skutočne verifikovala diagnóza už v iniciálnom štádiu a to tak v populácií detí ako aj dospelých, zahrňujúc variabilnú symptomatológiu, mohol by test slúžiť ako screeningová metóda pred realizáciou invazívnejších vyšetrovacích metód. Ide o overovacie metódy, ktoré môžu byť pre niektorých pacientov náročnejšie a zaťažujúcejšie. Preto sme v našom materiály zvolili kritérium výberu rozsiahlejšieho vekového súboru pacientov. Chceli sme vedieť či sa pri rovnaké semikvantitatívne hodnotenie odrazí aj v záverečnej diagnóze. Výpovedná hodnota AEA v súvislosti s diagnostikou ochorenia bola pritom predmetom viacerých prác. Výsledky iných autorov sú v zhode s našimi. Ani jeden z testov nemôže plne nahradiť histologické vyšetrenie a diagnóza by nemala byť stanovená, pokiaľ nebola vykonaná biopsia [7, 8]. Autoprotilátky vykazujú totižto v kontexte s ochorením u niektorých prípadov negativitu [30]. V našom súbore sú zaznamenané vzorky, ktoré boli odčítané len na jeden krížik pozitivity AEA pričom biopticky a klinicky bola diagnostikovaná celiakia. Takýto materiál je pritom v rutinnej diagnostike relatívne častý. Výsledky dokumentujú, že AEA nie sú 100%. Aj v práci Salazara et al. [25] sa uvádza, že negativita sérových protilátok je u pacientov s celiakiou častejším nálezom ako sa vôbec predpokladá. Kollárová et al. [15] v tejto súvislosti uvádza, že u pacientov, ktorí mali negatívne vyšetrenie na AEA sa jedná o nešpecifický nález, respektíve malabsorbciu inej etiológie. Náš materiál sme spracovali štandardne v riedení 1 : 10. Možno by v tomto slova zmysle bolo vhodné zrealizovať vyšetrenia tých istých, ale rôzne riedených sér. V práci Salmiho et al. [26] sa uvádza, že pacienti s AEA negatívnymi protilátkami, ale aktívnou formou celiakie mali klinické príznaky typu častejších brušných bolestí, ale histologicky bol detekovaný nižší počet intraepitelových lymfocytov (IEL) v lamina propria. Niekoľkí mali pritom diagnostikované aj lymfómové ochorenie. Práve IEL hrajú kľúčovú úlohu pri slizničných zmenách. Snáď by preto bolo vhodné postaviť včasnú diagnostiku celiakie práve na dôkaze aktivity IEL. Bolo dokázané, že pri neliečenej celiakii ich počet stúpa, pričom signifikantne koreluje so stupňom apoptózy enterocytov [3]. Keďže tieto sú lokalizované v sliznici tenkého čreva, možno by bolo vhodné skúsiť merať ich aktivitu cez mediátory apoptózy akými sú transmembránové proteíny TNF rodiny. V práci Rostamiho a Villanciho [24] je uvedené, že samotné zmeny vo svetelno-mikroskopickom obraze môžu byť nakoniec jemné, resp. len nepatrné a správna diagnóza tak často ostáva prehliadnutá. V tomto procese môže zohrávať dôležitú úlohu mechanizmus apoptózy IEL [17]. Spomínaní autori pritom konštatujú, že prevalencia ochorenia bude pravdepodobne teda ešte vyššia ako sa predpokladá. Diskusie o vyššom výskyte boli oficiálnejšie otvorené článkom autorského kolektívu Catassi et al. [2]. Od toho času uplynulo už niekoľko rokov a rutinná diagnostika odhaľuje neustále nové prípady. Ide predovšetkým o atypickú formu celiakie, ktorá sa manifestuje extraintestinálnou symptomatológiou. Vyhľadávanie týchto foriem je v klinickej praxi problematickejšie a podľa nás si vyžaduje úzku spoluprácu všetkých odborov medicíny.
Záver
Podľa nás je histologické vyšetrenie biopticky odobraných vzoriek z tenkého čreva neodmysliteľnou a nevyhnutnou súčasťou v diagnostickom algoritme celiakie. Pozitivita, či negativita sérových protilátok je len nápomocným vyšetrením. Z výsledkov vyplýva, že AEA nie sú v kontexte s celiakiou vždy 100%. V práci sú však uvedené len hodnoty „true positive“. Komplexné zhodnotenie prínosu metódy si vyžaduje aj hodnoty „true negative“, „false negative“a „false positive“. Tieto sme aj napriek skutočne pomerne širokému spektru pacientov v našej databáze nenašli, eventuálne sme nemali spätnú väzbu na klinického kolegu. Uvádzame, že AEA sú vhodné ako screeningová metóda u rizikovej, eventuálne symptomatologickej skupiny pacientov pred realizáciou biopsie a pri dodržiavaní zásad bezlepkovej diéty.
Do redakce došlo 22.4.2009
Ing. Peter Makovický, PhD.
Czech University of Life Sciences
Kamýcká 129
165 21 Praha 6 – Suchdol
e-mail: pmakovicky@email.cz
Sources
1. Berger, E. Zur allergischen pathogenese der cöliakie. Bibliotheca Paediatrica., 1958, 67, S.1, 55–56.
2. Catassi, C., Rätsch, I.M., Fabiani, E., Rossini, M. et al. Coeliac disease in the year 2000: exploring the iceberg. Lancet. 1994, 343, 8891, 200–203.
3. Ciccocioppo, R., Sabatino, D.I., Parroni, R., Dalo, D. et al. Cytolytic mechanisms of intraepithelial lymphocytes in coeliac disease (CoD). Clin Exp Immunol, 2000, 120, 2, 235–240.
4. Dietrich, W., Ehnis, T., Bauer, M. Donner, P. et al. Identification of tissue transglutaminase as the autoantigen of celiac disease. Nat Med, 1997, 3, 7, 797–801.
5. Frič, P., Zavoral, M. Celiakální sprue dospělých - opojímená choroba. Prakt Lék, 2003, 83, 2, 62–65.
6. Frič, P. Celiakální sprue – současný stav v ČR. Čes a Slov Gastroent a Hepatol, 2005, 59, S.1.
7. Füleová, A., Stanková, S., Halušková, V., Majorová, E. et al. Je črevná biopsia aj v súčasnosti nevyhnutná pre stanovenie diagnózy celiakia? Pediatria (Bratisl.). 2008, 3, 1, 43–47.
8. Guandalini, S., Gupta, P. Do you still need a biopsy to diagnose celiac disease? Curr Gastroenterol Rep, 2001, 3, 5, 385–391.
9. Hill, P.G., Holmes, G.K.T. Coeliac disease a biopsy is not always necessary for diagnosis. Aliment Pharm Ther, 2008, 27, 7, 572–577.
10. Hrdá, P., Šterzl, I. Vyšetření autoprotilátek – současné možnosti. Int Med Prax, 2003, 8, 5, 410–413.
11. Chorselski, T.P., Sulej, J., Tchorsewska, H., Jablonska, S. et al. IgA class endomysium antibodies in dermatitis herpetiformis and celiac disease, 325–334. In: Beutner E.H., Nissengard R.J., Albibi B (eds.): Defined-immunofluorescence and realted cytochemical methods. Ann. N.Y. Acad. Sci., 1983.
12. Janatková, I., Malíčková, K., Fučíková, T., Kožnarová, R. et al. Diagnostický přínos stanovení autoprotilátek u gluten-sensitivní enteropatie. Epidemiol Mikrobiol Imunol, 2002, 51, 3, 125–130.
13. Jankowiak, C., Ludwig, D. Frequent causes of diarrhea: Celiac disease and lactose intolerance. Med Klin (Munich). 2008, 103, 6, 413–422.
14. Kárpáti, S., Török, E., Kósnai, I. IgA class antibody against human jejunum in sera of children with dermatitis herpetiformis. J Invest Dermatol, 1986, 87, 6, 703–706.
15. Kollárová, H., Pektor, R., Šmajstrla, V., Dvořáčková, J. et al. Rutinní biopsie z duodena prováděna během gastroskopie - jedna z možností vyhledávaní asymptomatické celiakie. Čes a Slov Gastroent a Hepatol, 2007, 61, 5, 245–248.
16. Kotalová, R., Nevoral, J., Šmídová, J. Tkáňové protilátky v diagnostice celiakální sprue. Česk-Slov Pediat, 1996, 51, 11, 680–687.
17. Lísová, S., Ehrmann, J., Kolek, A., Sedláková, E. et al. Imunohistochemická studie mechanismů apoptózy a proliferace ve sliznici tenkého střeva u celiakální sprue. Česk-Slov Patol, 2005, 41, 3, 85–93.
18. Lukáš, Z. Histopatologie a diferenciální diagnostika celiakální sprue. Česk-Slov Patol, 2004, 40, 1, 3–6.
19. Makovický, P., Makovický, P., Jílek, F. Od historických názorov a poznatkov až po súčasné úlohy na poli celiakie. Epidemiol Mikrobiol Imunol, 2008, 57, 3, 90–96.
20. Makovický, P., Makovický, P., Maxová, M. Typical and atypical forms of celiac disease from a pathologist viewpoint. Čes a Slov Gastroent a Hepatol, 2008, 62, S.3.
21. Makovický, P., Makovický, P., Maxová, M. Možnosti diagnostiky celiakie v bioptickej praxi. Česk-Slov Patol, 2009, 45, 1, 14-18.
22. Malíčková, K., Janatková, I., Šandová, P., Fučíková, T. Imunologická laboratórní vyšetření při podezření na celiakii. Int Med Prax, 2005, 10, 7, 440–443.
23. Prokopová, L. Celiakie – co má vědět ambulantní internista. Int Med Prax, 2008, 9, 10, 233–239.
24. Rostami, K., Villanacci, V. Microscopic enteritis: novel prospect in coeliac disease clinical and immuno-histogenesis evolution in diagnosis and treatment strategies. Dig Liver Dis, 41, 2009, 4, 245–252.
25. Salazar, L.I.F., Ferrera, N.T., Jiménez, B.V., Colón, M.N. et al. Diagnostic problems in adult celiac disease. Rev Esp Enferm Dig, 2008, 1, 24–28.
26. Salmi, T.T., Collin, P., Korponay-Szabó, I.R., Laurila, K. et al. Endomysial antibody-negative coeliac disease: clinical characteristics and intestinal autoantibody deposits. Gut, 2006, 55, 12, 1746–1753.
27. Seah, P.P., Fry, L., Hofbrand, A.V. Tissue antibodies in dermatitis herpetiformis and adult coeliac disease. Lancet. 1971, 1, 7704, 834–836.
28. Setty, M., Hormaza, L., Guandalini, S. Celiac disease: risk assessment, diagnosis, and monitoring. Mol Diagn Ther, 2008, 12, 5, 289–298.
29. Tlaskalova-Hogenova, H., Šťepánková, R., Tučková, L., Farré, M. A. et al. Autoimmune reactions induced by gliadin. Adv Exp Med Biol, 1995, 371B, 1191–1198.
30. Vécsei, A.K., Graf, U.B., Vogelsang H. Follow-up of adult celiac patients: which nonivasive test reflects mucosal status most a reliably? Endoscopy. 2009, 41, 2, 123–128.
Labels
Hygiene and epidemiology Medical virology Clinical microbiologyArticle was published in
Epidemiology, Microbiology, Immunology

2009 Issue 4
-
All articles in this issue
- Zastoupení různých genotypů glykoproteinu gB u pacientů s vysokým rizikem symptomatické infekce lidským cytomegalovirem (CMV)
- Pseudomonas aeruginosa, její rezistence k vybraným antibiotikům a tvorba biofilmu u kmenů izolovaných od pacientů s infekcí močových cest
- Epidemiologický prehľad hepatitídy C na Klinike infektológie a cestovnej medicíny v Košiciach
- Sérové protilátky proti endomýziu (AEA) v diagnostickom algoritme celiakie
- Dynamika výskytu Creutzfeldtovej -Jakobovej choroby na Slovensku v rokoch 1975-2008
- Studium hypervirulentních komplexů Neisseria meningitidis metodami molekulární biologie a možnosti prevence jejich výskytu v České republice vakcinací
- Přínos stanovení core antigenu v diagnostice infekce hepatitidy C testem firmy Abbott Laboratories
- Diagnostika novovirových infekcí u hospitalizovaných dětí a mladistvých s akutní gastroenteritidou. Plzeňská studie
- Změny meteorologických faktorů a výskyt klíšťové encefalitidy v České republice
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Pseudomonas aeruginosa, její rezistence k vybraným antibiotikům a tvorba biofilmu u kmenů izolovaných od pacientů s infekcí močových cest
- Dynamika výskytu Creutzfeldtovej -Jakobovej choroby na Slovensku v rokoch 1975-2008
- Sérové protilátky proti endomýziu (AEA) v diagnostickom algoritme celiakie
- Přínos stanovení core antigenu v diagnostice infekce hepatitidy C testem firmy Abbott Laboratories
