Endoskopická submukózní disekce v léčbě recidivující high-grade neoplazie v rektu
Endoscopic submucosal dissection in the treatment of recurrent high-grade neoplasia of the rectum
Endoscopic submucosal dissection is a suitable approach to the treatment of early neoplastic lesions that involves the upper gastrointestinal tract. The option to undertake such a procedure in cases of colo-rectal lesion is under continuous review. The aim of the this paper is to present a successful endoscopic submucosal dissection in the treatment of recurrent rectal neoplasia with non-lifting sign.
Key words:
endoscopic submucosal dissection – endoscopic mucosal resection – laterally spreading tumor
Authors:
O. Urban 1,2; P. Fojtík 1; M. Kliment 1; Přemysl Falt 1
; M. Hanousek 1; O. Mikolájek 1; V. Zoundjiekpon 1; P. Holéczy 1,2; J. Örhalmi 1; M. Čegan 3
Authors‘ workplace:
Centrum péče o zažívací trakt, Vítkovická nemocnice, a. s., Ostrava
1; LF Ostravské univerzity, Ostrava
2; CGB laboratoř, Ostrava
3
Published in:
Gastroent Hepatol 2011; 65(2): 80-83
Category:
Digestive Endoscopy: Case Report
Overview
Endoskopická submukózní disekce je metoda vhodná k léčbě některých časných neoplazií v horní části trávicí trubice. Názory na indikaci v colon a rektu se ještě vyvíjejí. Cílem tohoto sdělení je informovat o úspěšné aplikaci metody v léčbě recidivy neoplazie rekta s příznakem non-liftingu.
Klíčová slova:
endoskopická submukózní disekce – endoskopická slizniční resekce – laterally spreading tumor
V léčbě povrchových neoplastických lézí trávicí trubice se v posledních letech stále více prosazují metody endoskopické resekce (ER), jako jsou endoskopická mukózní resekce (EMR) a endoskopická submukózní disekce (ESD).
ER je výhodnou alternativou chirurgické léčby v případech, kdy léze roste intramukózně nebo invaduje maximálně do přilehlé třetiny submukózy (sm).
V colon a rektu se běžně uplatňuje metoda EMR. Podmínkou provedení EMR je přítomnost elevace léze při submukózní injekci tekutiny. Absence elevace, tzv. příznak non-liftingu, je považována za kontraindikaci EMR.
Při recidivě neoplazie v jizvě po EMR je příznak non-liftingu přítomen prakticky vždy. Na rozdíl od situace u intaktní léze však často neznamená masivní neoplastickou invazi, ale je důsledkem jizvení v sm. V těchto případech může endoskopista zvážit ESD jako alternativu chirurgické léčby.
Kazuistika
V listopadu 2010 byl na endoskopickém pracovišti Centra péče o zažívací trakt Vítkovické nemocnice, a. s., v Ostravě ošetřen 68letý muž, u kterého byla diagnostikována recidiva neoplazie po EMR tubulárního adenomu s low-grade intraepiteliální neoplazií v rektu. Původní výkon byl proveden v roce 2009 na jiném pracovišti.
Po obdržení informovaného souhlasu připravujeme nemocného perorálně podaným makrogolovým roztokem. ESD provádíme přístrojem pro horní endoskopii s jedním pracovním kanálem (GIF-Q145, Olympus, Hamburg, Germany) v poloze pacienta vleže na levém boku. K analgosedaci aplikujeme frakcionovaně intravenózní midazolam. Střevo insuflujeme kysličníkem uhličitým. Dodržujeme zásady bezpečné digestivní endoskopie.
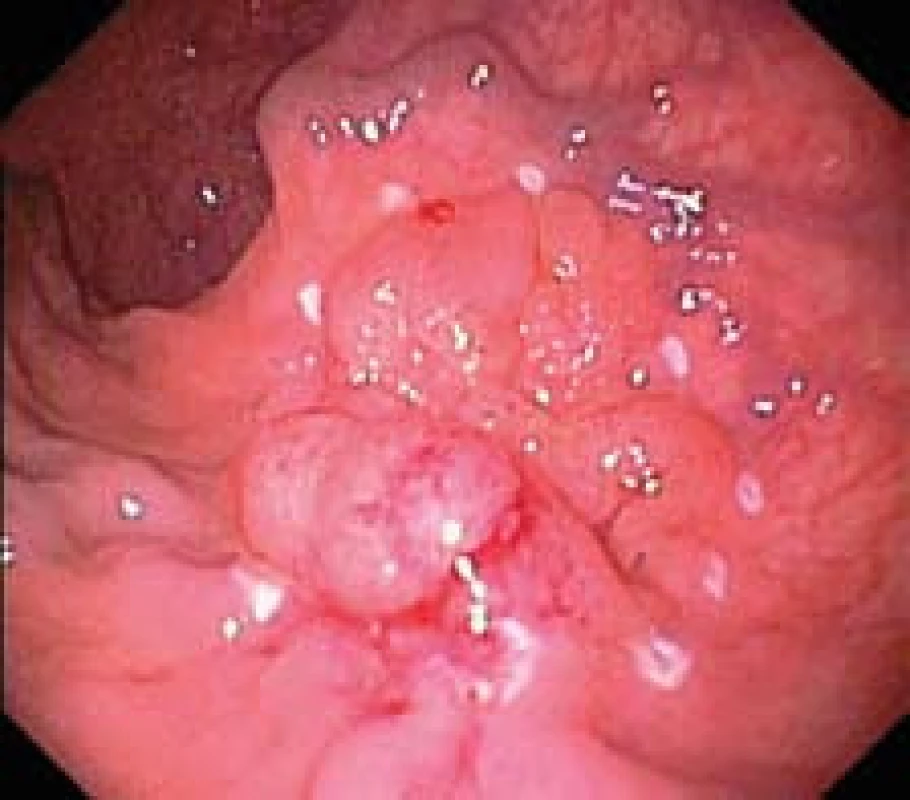
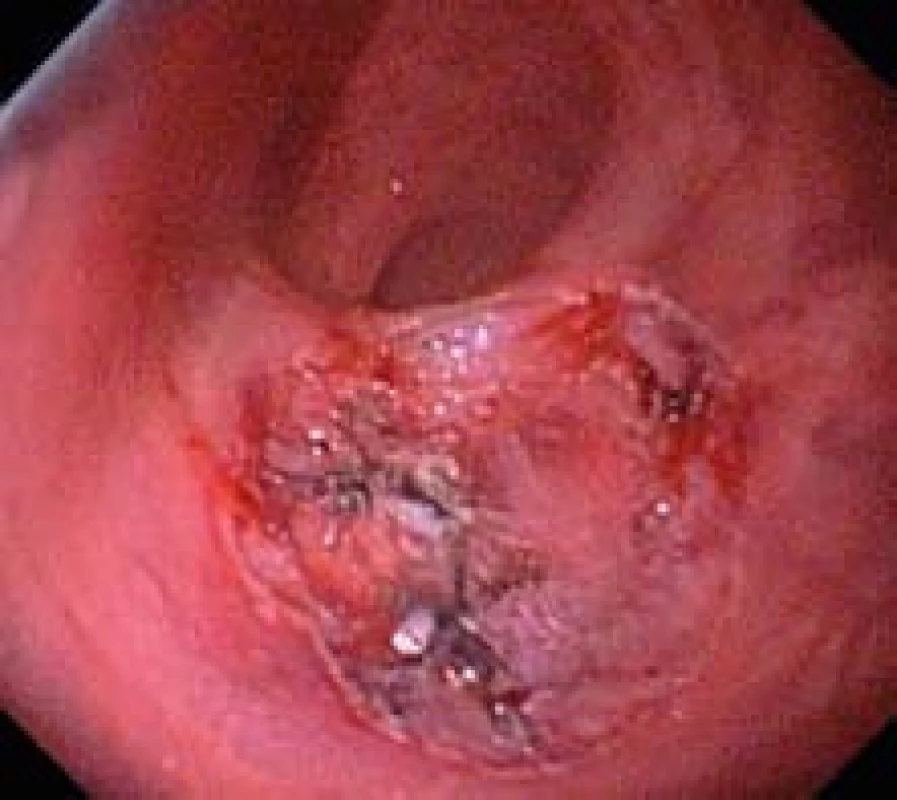
V rektu ve vzdálenosti 3 cm od anokutánního přechodu nacházíme povrchovou neoplastickou lézi typu LST (laterally spreading tumor) o průměru 22 mm s centrální jizvou a rigidními řasami na levém okraji (obr. 1). Provádíme lokální staging pomocí vysokofrekvenční ultrasonografické katetrové sondy (UM-S30-25R, Olympus, Hamburg, Germany) zavedené pracovním kanálem endoskopu. Lézi zobrazujeme jako hypoechogenní homogenní ztluštění I. a II. EUS vrstvy odpovídající sliznici. V průběhu sm injekce fyziologického roztoku pod lézi pozorujeme příznak parciálního non-liftingu.

Výkon provádíme nástrojem flush--knife délky 1,5 mm s ostrým zakončením (DK2618JN, Fujinon optical Co., Ltd, Tokyo Japan), který zavádíme pracovním kanálem endoskopu (obr. 1). Na distální konec endoskopu připevňujeme plastový průhledný nástavec (cap) délky 4 mm.
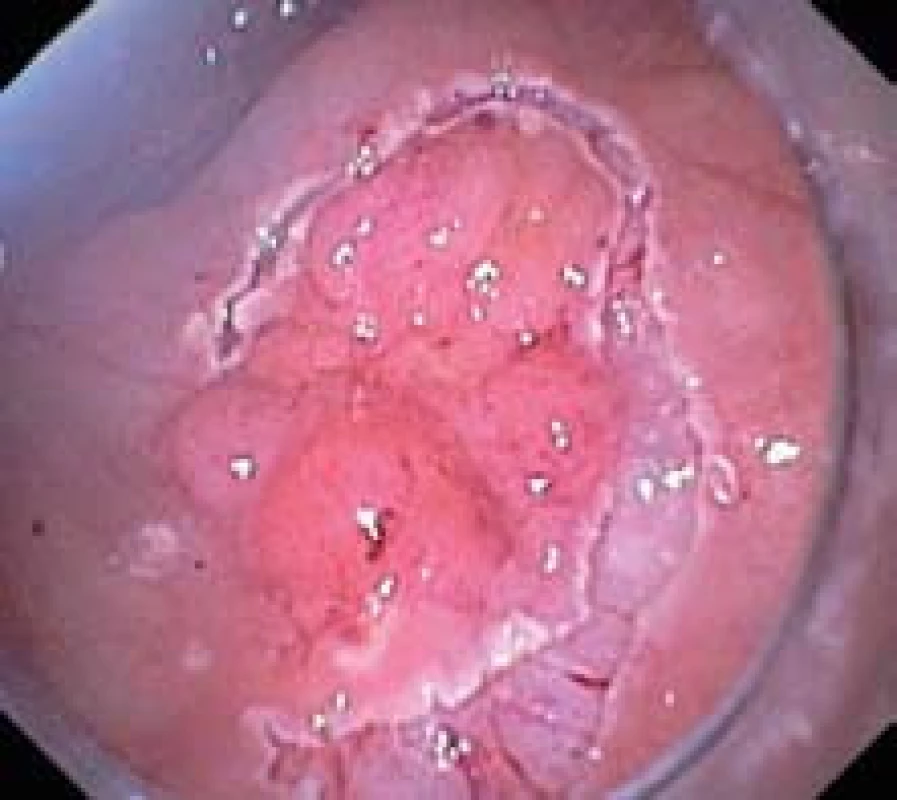
Operaci zahajujeme označením okraje léze koagulačními značkami ve vzdálenosti 1 mm od okraje neoplazie (obr. 2). Poté do sm aplikujeme celkem 20 ml roztoku adrenalinu ve fyziologickém roztoku v ředění 1 : 40 000 z opakovaných vpichů kolem léze ve vzdálenosti 5 mm zevně od koagulačních značek. Elevovanou intaktní sliznici protínáme v rozsahu 360º kolem léze (obr. 3). Používáme proud Endo-cut, 80 W, efekt 2 (elektrokoagulační jednotka Erbe ICC 200). V průběhu incize kontrolujeme hloubku řezu tak, aby byl veden v sm. Přitom se více než polohou kovového hrotu flush-knife řídíme pohybem keramického zakončení sheatu ve směru řezu.
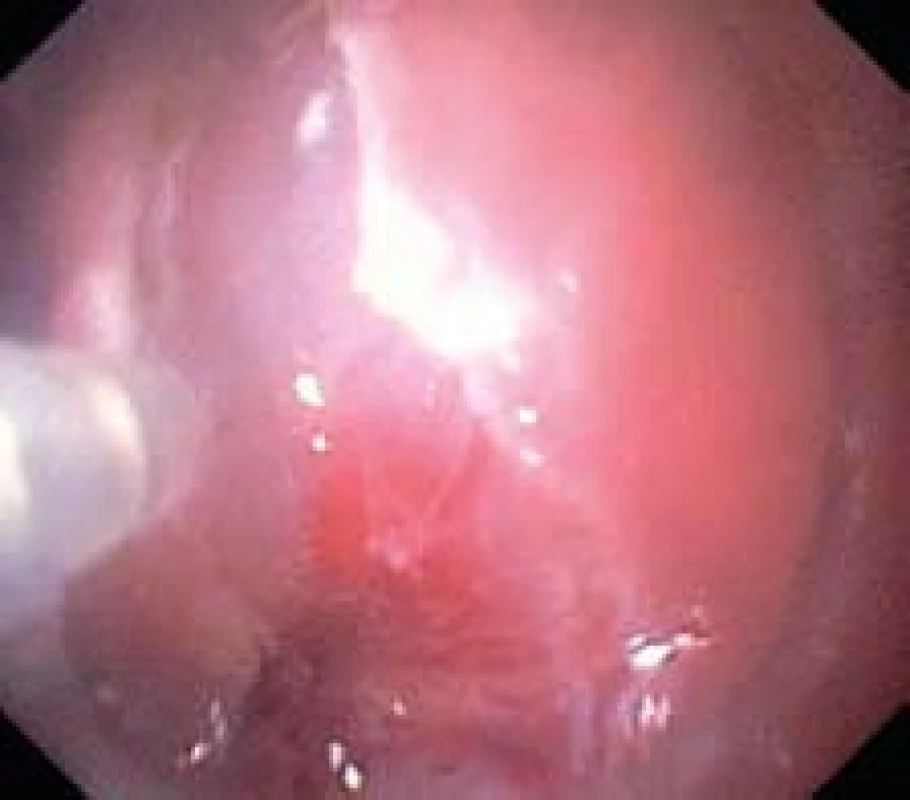
Po dokončení incize přistupujeme k sm disekci. Do sm pod lézi aplikujeme postupně celkem 10 ml výše uvedeného roztoku. K disekci používáme koagulační proud, „forced“, 40 W, efekt 2 (obr. 4). Průvodní krvácení oplachujeme a zastavujeme koagulací pomocí flush--knife. V průběhu výkonu využíváme gravitaci a polohujeme nemocného tak, aby se slizniční lalok odklápěl od svalové vrstvy. Celistvý resekát o průměru 25 mm vybavujeme tripodem a fixujeme na korkové podložce v 10% roztoku formaldehydu (obr. 5). Sm cévy na spodině ošetřujeme kleštěmi pro horkou biopsii a klipem (obr. 6). Výkon ukončujeme po 140 min.
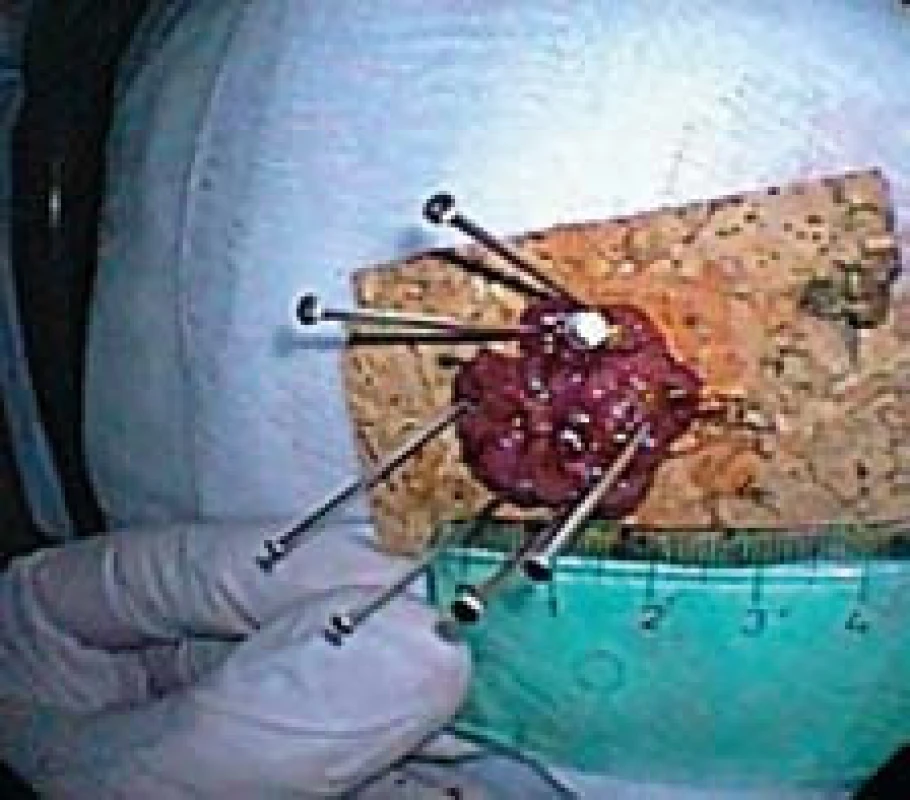
Pacienta po výkonu hospitalizujeme na gastroenterologickém oddělení. V den operace podáváme per os pouze tekutiny. Neindikujeme profylaktické podání antibiotika. Monitorujeme hladinu CRP a počet leukocytů. První pooperační den povolujeme měkkou stravu a třetí pooperační den propouštíme nemocného do domácí péče.
Histologické vyšetření prokazuje high-grade intramukózní neoplazii bez přítomnosti neoplastické tkáně v laterální a horizontální linii řezu. Endoskopickou kontrolu plánujeme za 6 měsíců.
Diskuze
Metodu ESD uvedl do klinické praxe Ohkuwa et al v roce 2001 [1]. V českém písemnictví bylo o aplikaci metody poprvé referováno v roce 2006 [2]. Ve srovnání s metodou EMR je hlavní výhodou ESD možnost resekovat en bloc neoplazie prakticky jakékoli velikosti. Nevýhodami jsou technická náročnost, vyšší riziko komplikací a dlouhý operační čas. V zemích jihovýchodní Asie je ESD standardně používána v terapii definovaných neoplazií jícnu a žaludku. V případě kolorektálních neoplazií nejsou dosud názory na indikaci ESD jednotné. Například Tanaka et al v roce 2008 uvádí tyto indikace [3]:
- léze obtížně resekovatelné en bloc metodou EMR
- léze s fibrózou po biopsii
- lokálně recidivující léze po EMR
- léze na pozadí chronických zánětlivých změn
Kdy využít ESD? V první řadě v případech, kdy je neoplazie podezřelá ze sm invaze a zároveň její průměr přesahuje 20 mm. Riziko sm invaze signalizují morfologie 0-IIc, LST-NG nebo invazivní pit pattern (typy IIIs a V podle Kudovy klasifikace). Je doporučováno resekovat invazivní neoplazie en bloc a fixovat je na korkové podložce. Tento postup umožňuje přesné histopatologické vyšetření s vyloučením přítomnosti neoplastické tkáně v horizontální a laterální resekční linii (R0 resekce) a určením maximální hloubky sm invaze. Metoda EMR je technicky méně náročná, ale má potenciál resekovat en bloc pouze léze o průměru do 20–30 mm. Větší neoplazie lze resekovat metodou EMR po částech (piecemeal EMR, EPMR), ale preparát je fragmentován a histopatologický staging obtížný až nemožný. En bloc resekcí se endoskopista vyhne obtížnému rozhodování, zda nemocného odeslat k chirurgickému zákroku po neprůkazně radikální endoskopické léčbě invazivní neoplazie piecemeal technikou.
Druhou výhodou en bloc resekce je eliminace rizika recidivy neoplazie. Hotta ukázal, že k recidivě po piecemeal resekci dochází ve 23,5 % případů ve srovnání s 0,7 % po resekci en bloc [4]. Výhoda nízkého rizika recidivy je relativizována vyšším rizikem komplikací. V našich podmínkách je v této indikaci na místě zdrženlivost, jelikož recidivu lze většinou endoskopicky odstranit re-EMR nebo argonovou plazmakoagulací.
Třetí typickou indikací ESD je přítomnost jizvy po biopsiích nebo po neúplné EMR. V těchto případech je pravidlem pozitivita příznaku non-liftingu, která je považována za kontraindikaci EMR. Do této indikační skupiny patří i prezentovaný případ. Tito nemocní končí většinou v rukou chirurga.
Výsledky léčby ESD u větších souborů nemocných jsou publikovány prakticky výhradně japonskými autory. Yahagi dosáhl en bloc resekce u 99 % z 268 nemocných a perforoval střevo v 5,1 % a významné krvácení řešil v 0,5 % (UEGW 2009). Niimi resekoval en bloc 90 % z 310 neoplazií u 290 nemocných, perforoval ve 4,5 % s potřebou emergentní operace v jediném případě. V průběhu tříletého sledování se nesetkal s generalizací onemocnění [5]. Saito srovnal výsledky 145 ESD/228 EMR. Operační čas byl 108 ± 71 min / 29 ± 25 min, poměr en bloc resekcí byl 84 % / 33 %, poměr rekurencí 2 % / 14 % a perforací 6,2 % / 1,3 % [6]. Sakamoto léčil 69 rekurentních neoplazií u 60 nemocných. V 58 (87 %) případech použil metodou EMR a dosáhl en bloc resekce ve 38 %. V 9 (13 %) případech použil ESD a dosáhl en bloc resekce v 56 %. Dva nemocní byli řešeni chirurgicky [7].
Nyní uvedeme několik poznámek k technice ESD v kolorektu. Je výhodné využít flexibility pediatrického kolonoskopu nebo gastroskopu. Pacienta vždy připravujeme jako k úplné kolonoskopii. Počítáme s 2–3hodinovým výkonem. Nezbytné je monitorování nemocného a volba vhodné analgosedace. Je vhodné začínat s výkony v rektu, které je nepohyblivé, z větší části extraperitoneálně uložené a má širší stěnu. Požadavek japonských endoskopistů na předchozí zkušenost s desítkami ESD v žaludku je v našich podmínkách obtížně realizovatelný pro nízkou incidenci těchto lézí. Vlastní ESD je provedena v 5 navazujících krocích:
- označení okraje léze
- sumbukózní injekce
- cirkulární incize kolem léze
- submukózní disekce
- ošetření spodiny a vybavení resekátu
- Ad. 1. Označení léze koagulačními body provádíme jehlovým nožem nebo ztaženou kličkou na zdravé sliznici ve vzdálenosti 1–2 mm od okraje. Na rozdíl od horního gastrointestinálního traktu nebývá označení striktně vyžadováno, protože okraj léze je většinou zřetelný i po sm injekci. Podle naší zkušenosti však značky usnadňují orientaci při výkonu.
- Ad. 2. Sm injekci provádíme přes zdravou sliznici jehlou délky 4–5 mm zavedenou směrem pod lézi. V našich podmínkách používáme nejčastěji fyziologický roztok, 40% glukózu nebo koloidní roztoky s malou příměsí adrenalinu (1 : 40 0000) obarvené na světle modrou barvu methylenovou modří. Modře obarvená submukóza usnadňuje orientaci při submukózní disekci.
- Ad. 3. Cirkulární incizi provádíme zevně od koagulačních značek v intaktní sliznici. Používáme různých typů diatermických nožů, jako jsou například flush knife, flex knife, hook knife a další. V našem případě jsme použili nástroj flush-knife, který vynalezl Toyonaga [8]. Je složen ze zaváděcího sheatu o průměru 2,6 mm, ze kterého lze vysunout kovový jehlový nůž o průměru 0,5 mm. Dostupné délky nožů jsou 1, 1,5, 2, 2,5 a 3 mm a jsou dodávány ve dvou modifikacích s ostrým, resp. tupým zakončením. Pro použití v kolorektu jsou určeny délky 1 a 1,5 mm. Výhodou je funkce oplachu, který provádíme s použitím speciální pumpy nebo pomocí stříkačky. Konec endoskopu stabilizujeme transparentním nástavcem délky 4 mm s bočním otvorem pro odsávání střevního obsahu.
- Ad. 4. Submukózní disekce je nejobtížnější fází výkonu. Pomocí diatermického nože disekujeme sm vrstvu. Nůž ovládáme pohybem distálního konce endoskopu, přičemž usilujeme o jeho paralelní polohu vzhledem k lamina muscularis propria. Zásadní je sm injekce dostatečného množství tekutiny. Krvácení ze sm cév ihned ošetřujeme, abychom předešli ztrátě přehledu. Tato fáze výkonu je náročná na soustředění, výkon v délce několika desítek minut si může vyžádat zařazení relaxační přestávky operačního týmu.
- Ad. 5. Po dokončení resekce preparát vybavujeme tripodem a orientujeme na korkové podložce řeznou plochou dolů pomocí špendlíků. Submukózní cévy na spodině ošetříme argonovou plazmakoagualcí, klipy nebo kleštěmi pro horkou biopsii. Případnou perforaci uzavíráme klipy.
Pacienta po výkonu hospitalizujeme. Profylaktické podání antibiotik není běžně doporučováno, někteří zkušení autoři však podávají intravenózně ß-laktamová antibiotika 2. generace po dobu 3 dní [9]. Samozřejmostí je těsná spolupráce s chirurgem. Pacienty endoskopicky sledujeme v individuálně volených intervalech s první kontrolou v intervalu 3–6 měsíců.
Závěr
Metoda ESD je technicky obtížná a na západní polokouli nemá mnoho zastánců. I zkušení terapeutičtí endoskopisté jsou při její aplikaci demotivováni počátečními neúspěchy, které mohou vést k iracionálním úvahám o nedostižné asijské zručnosti. Naše kazuistika demonstruje, že ESD lze provést i v našich podmínkách. Přínos metody v žaludku je v současnosti nezpochybnitelný [10]. Budoucnost ukáže, zda terapeutický potenciál metody využijeme také v colon a rektu.
Autoři deklarují, že
v souvislosti s předmětem studie nemají žádné
komerční zájmy.
The authors declare they have no
potential conflicts of interest concerning drugs, products, or
services used in the study.
Redakční rada potvrzuje, že
rukopis práce splnil ICMJE kritéria pro publikace zasílané do
biomedicínských časopisů.
The Editorial Board declares that
the manuscript met the ICMJE „uniform requirements“ for
biomedical papers.
MUDr. Ondřej Urban, Ph.D.
Vítkovická
nemocnice, a. s.
Zálužanského
1192/15
703
84 Ostrava-Vítkovice
ondrej.urban@nemvitkovice.cz
Sources
1. Ohkuwa M, Hosokawa K, Boku N et al. New endoscopic treatment for intramucosal gastric tumors using an insulated-tip diathermic knife. Endoscopy 2001; 33(3): 221–226.
2. Urban O, Vítek P, Fojtík P et al. Endoscopic submucosal dissection: Initial experience in the Czech Republice. Folia Gastroenterol Hepatol 2006; 4(1): 4–10.
3. Tanaka S, Oka S, Chayama K. Colorectal endoscopic submucosal dissection: present status and future perspective, including its differenciation from endoscopic mucosal resection. J Gastroenterol 2008; 43(9): 641–651.
4. Hotta K, Fujii T, Saito Y et al. Local recurrence after endoscopic resection of colorectal tumors. Int J of Colorectal Disease 2009; 24(2): 225–230.
5. Niimi K, Fujishiro M, Kodashima S et al. Long term outcomes of endosocpic submucosal dissection for colorectal epithelial neoplasms. Endoscopy 2010; 42(4): 723–729.
6. Saito Y, Fukuzawa M, Matsuda T et al. Clicnical outcome of endoscopic sumbucosal dissection versus endoscopic mucosal resection of large colorectal tumors as determined by curative resection. Surg Endoscopy 2009; 24(2): 243–352.
7. Sakamoto T, Saito Y, Matsuda T et al. Treatment strategy for recurrent or residual tumors after endoscopic resection. Surg Endoscopy 2010; 25(1): 255–260.
8. Toyonaga T, Inokuchi H, Man IM. Endoscopic submucosal dissection using water jet short needle knives (Flush knife) for the treatment of gastrointestinal epithelial neoplasms. Acta Endoscopica 2007; 37: 645–656.
9. Toyonaga T, Man IM, Fujita T et al. Retrospective study of technical ascpects and complications of endoscopic submucosal dissection for laterally spreading tumors of the colorectum. Endoscopy 2010; 42(9): 714–722.
10. Urban O, Fojtík P, Kliment M et al. Endoskopická léčba časného karcinomu žaludku: Vlastní výsledky v období let 2000–2009. Endoskopie 2009; 18(4): 156–161.
Labels
Paediatric gastroenterology Gastroenterology and hepatology SurgeryArticle was published in
Gastroenterology and Hepatology

2011 Issue 2
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole vs. Tramadol in Postoperative Analgesia
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Spasmolytic Effect of Metamizole
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
- O čem také psal profesor Mařatka
- Jubilejní rok
- Etiologie a patogeneze ulcerózní kolitidy. Stále více otazníků než jasných odpovědí
- Doporučený postup pro vyšetření tenkého střeva u pacientů s Crohnovou chorobou
- Vliv albuminemie na farmakokinetiku infliximabu u nemocných s idiopatickými střevními záněty
- Biologická léčba nemocné s ulcerózní kolitidou v průběhu gravidity
- 10. výročí založení organizace ECCO a 6. ECCO kongres v Dublinu
- Endoskopická submukózní disekce v léčbě recidivující high-grade neoplazie v rektu
- Odběr bioptického materiálu při endoskopickém vyšetření gastrointestinálního traktu pro vybraná zánětlivá onemocnění
- Kvantitativní test ve screeningu kolorektálního karcinomu – pohled do blízké budoucnosti
- Gastrointestinální manifestace Henoch-Schönleinovy purpury napodobující akutní pankreatitidu
- Ohlédnutí za 15. hradeckými gastroenterologickými a hepatologickými dny
- Rozhovor s prof. dr. Petrem Dítě, DrSc., prezidentem EAGE (European Association for Gastroenterology and Endoscopy) a ředitelem 7. kurzu EAGE pro mladé gastroenterology
- Ostrava live endoscopy 18. 3. 2011
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Odběr bioptického materiálu při endoskopickém vyšetření gastrointestinálního traktu pro vybraná zánětlivá onemocnění
- Doporučený postup pro vyšetření tenkého střeva u pacientů s Crohnovou chorobou
- Kvantitativní test ve screeningu kolorektálního karcinomu – pohled do blízké budoucnosti
- Etiologie a patogeneze ulcerózní kolitidy. Stále více otazníků než jasných odpovědí
