Cílená léčba karcinomu pankreatu – minulost či budoucnost?
Targeted treatment of pancreas carcinoma – past or future?
Pancreas carcinoma is a disease with an increasing occurrence and a devastating prognosis. The main cause of the unfavourable prognosis is late diagnosis which most frequently occurs in the state of generalisation and resistance to the currently used chemotherapy. The currently used chemotherapeutical regimes have a non-specific impact on carcinoma; they are administered with a palliative effect and lead only to a marginal improvement in the survival rate. The lack of a curable treatment means that less than 5% of patients survive five years. The targeted treatment aims to find signal paths, which are only active in the carcinoma and entirely necessary for its occurrence or progression. Progress in our understanding of molecular and biological processes characterising pancreas carcinoma and success in the targeted treatment of other tumour diseases led to an effort to find a targeted treatment for pancreas carcinoma. During the last decade a number of targeted chemotherapeutics were tested. However, their clinical significance has so far been only limited and we are still waiting for an effective targeted treatment. Closer understanding of molecular mechanisms of pathogenesis and identification of new suitable goals and molecules for inhibition in selected patients represent the highest potential for the future treatment of pancreas carcinoma.
Key words:
pancreas carcinoma – signal path – targeted treatment
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Submitted:
27. 8. 2013
Accepted:
1. 10. 2013
Authors:
T. Hucl
Authors‘ workplace:
Klinika hepatogastroenterologie, IKEM, Praha
Published in:
Gastroent Hepatol 2013; 67(5): 366-376
Category:
Gastrointestinal Oncology: Review Article
Overview
Karcinom pankreatu je onemocnění s narůstajícím výskytem a devastující prognózou. Hlavními příčinami nepříznivé prognózy je pozdní diagnóza nejčastěji ve stadiu generalizace a rezistence k současně používané chemoterapii. Současně užívané chemoterapeutické režimy mají vůči karcinomu pankreatu nespecifický účinek, jsou podávány s paliativním efektem, a vedou tak pouze k marginálnímu zlepšení přežití. Důsledkem absence kurabilní léčby je skutečnost, že pět let přežívá méně než 5 % pacientů. Cílená léčba si klade za cíl nalezení signálních drah, které jsou aktivní pouze v nádoru a pro jeho vznik či progresi jsou zcela nezbytné. Pokroky v našem chápání molekulárně biologických dějů charakterizujících karcinom pankreatu a úspěchy v cílené léčbě u jiných nádorových onemocnění vedly ke snaze o nalezení cílené léčby karcinomu pankreatu. V posledním desetiletí byla testována řada cílených chemoterapeutik. Jejich klinický význam byl však doposud omezený, a nalezení účinné cílené léčby je tak stále v očekávání. Bližší pochopení molekulárních mechanizmů patogeneze a identifikace nových vhodných cílů a molekul k jejich inhibici u selektovaných pacientů představují největší potenciál pro budoucí léčbu karcinomu pankreatu.
Klíčová slova:
karcinom pankreatu – signální dráha – cílená léčba
Duktální adenokarcinom pankreatu je onemocnění s dlouhodobě omezenými možnostmi léčby a špatnou prognózou. Jeho výskyt v posledních desetiletích jednoznačně narůstá a dosahuje průměrné incidence v západním světě mezi 10 a 20/100 000 obyvatel za rok. V průměru se jedná o čtvrtou nejčastější příčinu úmrtí na nádorová onemocnění. Incidence onemocnění je téměř totožná s prevalencí, neboť pětileté přežití pacientů je menší než 5 %. Hlavní příčinou špatné prognózy je časná generalizace, která je v době stanovení diagnózy přítomna až u 85 % pacientů [1].
Nádorová onemocnění vznikají v důsledku poškození DNA. Karcinom pankreatu je charakterizován specifickými genetickými abnormalitami jako mutační aktivací KRAS onkogenu a inaktivací tumor supresorových genů CDKN2A, TP53, SMAD4 a BRCA2, rozsáhlými chromozomálními ztrátami, genovými amplifikacemi či zkrácením telomer [2]. Mezi méně často mutované geny patří např. BRAF, MYB, AKT2 a STK11. Jinou specifickou charakteristikou nádorových buněk může být abnormální exprese některých proteinů, jako např. mezotelinu či některých molekul mikro-RNA [3].
Výše uvedené změny vedou k alteraci buněčných signálních drah, v jejichž důsledku pak dochází ke změně biologického chování buněk. Signální dráha představuje kaskádu reakcí jednotlivých proteinů, která se spouští v reakci na impulz a vede většinou k zajištění základních životních funkcí buňky. Součástí těchto signálních drah jsou protoonkogeny a tumor supresorové geny. Mezi nejdůležitější signální dráhy alterované u karcinomu pankreatu patří ty, které regulují apoptózu, opravu DNA, progresi buněčného cyklu, adhezi, invazi či konkrétní signální dráhy KRAS, CDKN2A, P-53, TGFß, Wnt/Notch, NF-kappa B, AKT1-PI3K-MTOR, Fanconiho anemie či Hedgehog [2]. Kompletní genomová analýza 24 karcinomů pankreatu prokázala v průměru 63 genetických alterací na jeden tumor, mutace v jedné z 12 hlavních signálních drah byly přítomny u 63–100 % nádorů [4].
Necílená léčba
Vedle časné generalizace je významným důvodem nepříznivé prognózy karcinomu pankreatu nedostatečná účinnost současné chemoterapie. Přežití po resekci je kolem 10 % a zvyšuje se na 25 % s užitím chemoterapie (ESPAC 01, CONKO 001, RTOG-9704). Gemcitabin a 5-fluorouracil jsou stejně efektivní, 5-fluorouracil má však více vedlejších účinků (ESPAC-3) [5]. U pacientů s generalizovaným nádorem je dlouhodobě standardem monoterapie gemcitabinem. Tato léčba prokazatelně mírně zlepšuje přežití, současně také pozitivně ovlivňuje symptomy nemoci a zlepšuje kvalitu života [6].
Vzhledem k chemorezistenci karcinomu pankreatu na samotný gemcitabin byla zkoušena řada léků v kombinaci. V nedávné době se ukázalo, že kombinace FOLFIRINOX (5-fluorouracil, irinotekan, oxaliplatina) je lepší ve srovnání s monoterapií gemcitabinem ve smyslu přežití pacientů. Ve sledovaném souboru 342 pacientů byl medián přežití ve skupině FOLFIRINOX 11,1 měsíců a 6,8 měsíců ve skupině gemcitabinu. Výskyt nežádoucích účinků byl však vyšší. Užití FOLFIRINOXU je vhodné u pacientů v dobrém klinickém stavu, s normálním sérovým bilirubinem a absencí srdeční ischemie [7].
Nedávná studie MPACT (Metastatic Pancreatic Adenocarcinoma Clinical Trial) srovnávala u 861 pacientů paclitaxel ve formě na albumin vázaných částic (Abraxane) v kombinaci s gemcitabinem proti samotnému gemcitabinu. Užití Abraxanu vedlo ke statisticky významnému zlepšení přežití (medián přežití 8,6 vs 6,7 měsíců, jednoroční přežití 35 % vs 22 %) [8]. Na základě těchto výsledků se stal Abraxane na počátku září 2013 nejnovějším lékem schváleným v USA k léčbě metastazujícího karcinomu pankreatu.
Cílená léčba
Rychlé dělení patří k hlavním charakteristikám nádorových buněk. Protinádorová chemoterapie účinkuje na rychle se dělící buňky. Lze ji považovat za necílenou, neboť poškozuje i zdravé rychle se dělící buňky. Cílená léčba spočívá ve využití konkrétní molekulárně biologické alterace určitého typu nádorového onemocnění k rozvoji specifického, racionálního terapeutického postupu. Cílem jsou pro nádor specifické molekuly, které jsou za růst a progresi nádoru zodpovědné.
Typickým příkladem cílené terapie je využití přítomnosti genetické alterace, která se nachází pouze v nádorových buňkách a vede k aktivaci signální dráhy, na které je nádorová buňka závislá. Konkrétním příkladem může být například BCR-ABL gen (Filadelfský chromozom) u chronické myeloidní leukemie vzniklý reciprokou translokací částí chromozomů 9 a 22. ABL protein patří mezi tyrozinkinázy a je zodpovědný za buněčnou proliferaci. Ve spojení s BCR genem se ABL stává nekontrolovaně a trvale aktivní, což vede k trvalé proliferaci myeloidních buněk a vzniku chronické myeloidní leukemie [9]. Užití tyrozinkinázového inhibitoru imatinib mesylátu (Glivec) vede k potlačení aktivity proteinu, který je abnormálně aktivní pouze v nádorových buňkách, a v konečném důsledku k zániku maligních buněk [10].
Alternativně lze využít absolutního biochemického rozdílu mezi nádorovými a nenádorovými buňkami. V tomto případě není cílem získání nové funkce, ale její absolutní ztráta v důsledku nepřítomnosti proteinu. Výhodou tohoto postupu je to, že rakovinové buňky obsahující inaktivované geny nemohou pod tlakem nádorové terapie vyvinout rezistenci. Například buňky postrádající BRCA2 protein jsou neschopné opravit poškozenou DNA, a tudíž jsou zvýšeně citlivé k látkám způsobujícím poškození DNA [11].
Nalezení chemoterapeutik cíleně inaktivujících vhodné cíle je možné např. pomocí screeningu knihoven chemických látek. Buňky obsahující vhodný cíl jsou vystaveny působení těchto chemických látek a ty látky, které selektivně poškozují tyto buňky ve srovnání s kontrolami, jsou dále upraveny za účelem zvýšení efektivity. Jiným způsobem může být tvorba monoklonálních protilátek. Imunizací zvířat purifikovanou zvolenou cílovou molekulou je získána řada různých protilátek, ze kterých jsou následně vybrány ty nejlepší.
Karcinom pankreatu patří mezi dobře molekulárně biologicky charakterizované nádory. Řada molekul různých signálních drah se stala v nedávné době předmětem cílené léčby u pacientů s pokročilým karcinomem pankreatu a vývoj nových stále pokračuje.
RAS
Rodina RAS proteinů byla identifikována jako lidské homology onkoproteinů kódovaných Harvey a Kirsten retroviry myšího sarkomu. Existují čtyři onkogenní RAS proteiny, mezi kterými hraje nejdůležitější úlohu u karcinomu pankreatu KRAS. Jedná se o protoonkogen, který přenáší impulzy směrem k jádru v odpovědi v reakci na membránový receptor EGFR (epidermal growth factor receptor) (obr. 1). Důsledkem je ovlivnění transkripce a řady buněčných procesů jako migrace, přežití, proliferace či diferenciace. RAS proteiny mají GTPázovou aktivitu, která vede ke konverzi GTP na GDP. Tato změna RAS protein inaktivuje. Naopak disociace GDP vede k vazbě GTP a přepnutí RAS do aktivního stavu. Nádorové mutace vyskytující se téměř výlučně v kodonech 12, 13 a 61 inaktivují GTPázovou aktivitu KRAS, a vedou tak k tomu, že je přítomen v aktivním GTP stavu [12]. KRAS mutace se vyskytují až u 90 % karcinomů pankreatu a 30 % všech lidských nádorů (karcinom plic či kolorekta) [13,14].
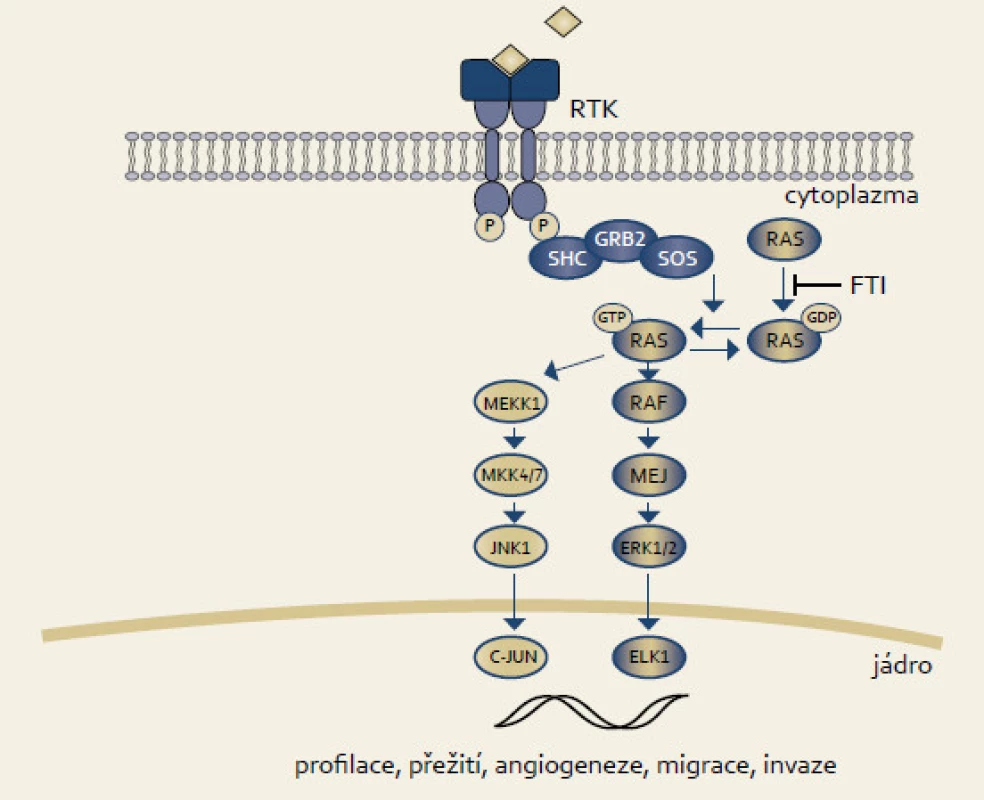
KRAS tak pro svůj vysoký výskyt představuje optimální molekulu jako cíl racionální terapie karcinomu pankreatu. Inhibice KRAS se však nakonec ukázala jako neúspěšná napříč spektrem nádorů. K aktivaci RAS proteinů je nezbytná jejich posttranslační modifikace. Nově syntetizované RAS proteiny se nacházejí v cytosolu a nejsou schopné vazby na membránu, která je pro jejich činnost nutná. Farnesyltransferáza (FT) hraje roli v posttranslační modifikaci RAS. Katalyzuje reakci zvanou prenylace (farnesylace), při které je k proteinům kovalentně přičleněna 15uhlíková hydrofobní fanresylová skupina na cystein na samém C-konci proteinu [12,15]. Tipifarnib (R115777, Zarnestra, Johnson & Johnson Pharmaceutical Research and Development) je farnesyltransferázový inhibitor cílený na KRAS. Preklinické studie prokázaly dobrý efekt inhibitorů farnesyltransferázy v modelech buněčných linií či xenograftech [16] a prvních klinických studiích [17]. V žádné z pozdějších studií s tipifarnibem, ať už v monoterapii či v kombinaci, však nebyl zjištěn pozitivní účinek. Cohen et al nezjistili žádnou odpověď na tipifarnib v primární léčbě 20 pacientů s metastazujícím karcinomem pankreatu [18]. Stejně tak MacDonald et al byli neúspěšní u 53 pacientů [19]. Van Cutsem et al srovnali ve studii fáze III kombinaci gemcitabinu s tipifarnibem oproti kombinaci gemcitabinu s placebem u 688 pacientů. Průměrné přežití bylo 193 vs 182 dnů (p = 0,75) [20]. Toxicita tipifarnibu byla akceptovatelná. Kombinace tipifarnibu s jinými chemoterapeutiky, např. sorafenibem, nebyla taktéž úspěšná [21].
Neúspěch farnesyltransferázových inhibitorů může být z části zapříčiněn alternativní prenylací KRAS pomocí geranylgeranyltransferázou [12]. Současná inhibice obou modifikujících enzymů, farnesyltransferázy a geranylgeranyltransferázy (L-778,123), prokazovala vysokou toxicitu [22].
EGFR
EGFR je membrábnový glykoprotein patřící společně s HER2, HER3 a HER4 do ErbB rodiny receptorů s tyrozinkinázovou aktivitou. EGFR je homolog ptačího v-erbB onkogenu [23]. EGFR je aktivován vazbou ligandu jako např. EGF či TGFα. Dimerizace receptoru navodí vnitřní proteinkinázovou aktivitu, která vede k autofosforylaci tyrozinu. Tato autofosforylace pak vede k aktivaci proteinů jako např. fosfatidylinozitol-3-fosfát kinázy (katalytická subjednotka α, PI3PKCA), jejíž činností se dále aktivují proteiny AKT či mTOR, které svým působením ovlivňují buněčný růst, proliferaci, adhezi či migraci (obr. 2).
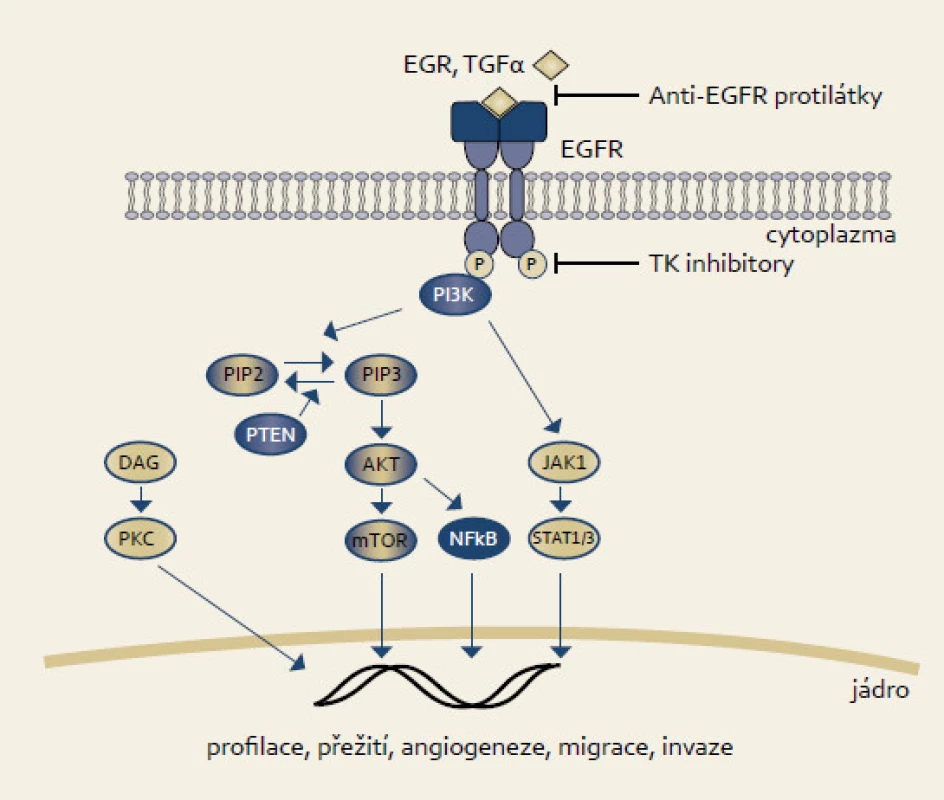
Mutace či abnormální exprese EGFR se nacházejí až u jedné třetiny karcinomů. U karcinomu pankreatu mutace v EGFR neprokazujeme, avšak abnormální exprese se vyskytovala v některých studiích až u dvou třetin karcinomů [24]. Mutace v genu PI3PK jsou nalézány u kolorektálního karcinomu [25]. U nemalobuněčného karcinomu plic koreluje odpověď na léčbu inhibitory EGFR s přítomností mutací [26].
Potlačení funkce proximální části EGFR signální dráhy lze dosáhnout použitím anti-EGFR protilátek či inhibitory tyrozinkinázové aktivity.
Cetuximab
Cetuximab (Erbitux/Merck KGaA) je monoklonální protilátka s vysokou afinitou k EGFR, která blokuje vazbu ligandu na receptor [27]. Cetuximab je s úspěchem používán např. v léčbě kolorektálního karcinomu či spinocelulárního karcinomu hlavy a krku.
Ve studii fáze II bylo léčeno 41 pacientů s karcinomem pankreatu exprimujícím EGFR kombinací gemcitabinu a cetuximabu. Medián přežití byl 7,1 měsíce, jednoroční přežití 31,7 % [28]. V randomizované studii fáze III srovnávající gemcitabin s kombinací gemcitabinu a cetuximabu byl medián přežití byl 5,9 a 6,3 měsíců; p = 0,23 [29]. Kombinace cetuximabu s bevacizumabem, ať už s gemcitabinem či bez něj, také nevedla ke zvýšení terapeutické odpovědi. Na rozdíl od kolorektálního karcinomu nebyla prokázána korelace odpovědi na cetuximab a KRAS genotypu [30]. Na základě výše uvedených zkušeností cetuximab nemůže být doporučen k léčbě pokročilého karcinomu pankreatu v běžné klinické praxi.
Humanizované anti-EGFR protilátky matuzumab, panitumumab a nimotuzumab byly testovány ve studiích fáze I a II. Pozitivní protinádorový efekt matuzumabu pozorovaný v buněčných modelech se nepotvrdil v klinických studiích fáze I [31,32]. Panitumumab byl hodnocen v randomizované studii fáze II v kombinaci s gemcitabinem a erlotinibem s nadějnými předběžnými výsledky. Matuzumab a nimotuzumab jsou předmětem stále probíhajících studií fáze II a randomizované placebem kontrolované studie s gemcitabinem fáze III.
Erlotinib
Erlotinib (Tarceva, Genentech) společně s gefitinebem (Iressa, Astra Zeneca) patří do skupiny inhibitorů tyrozinkinázové aktivity EGFR. V důsledku inhibice je blokována autofosforylace tyrozinkinázové domény, což vede k přerušení signální dráhy [27].
Randomizovaná studie fáze III hodnotila aditivní efekt perorálního erlonitibu přidaného ke gemcitabinu [33]. Medián přežití (6,24 vs 5,91 měsíců) a roční přežití (23 % vs 17 %) byly lepší ve skupině erlotinibu a dosáhly statistické významnosti (p = 0,02). Přítomnost vyrážky v důsledku podávání erlotinibu predikovala úspěšnost léčby. Tato studie je jediná studie fáze III s cílenou terapií, která u karcinomu pankreatu prokázala statisticky významný rozdíl mezi testovanou skupinou a kontrolou. Z tohoto důvodu je jedinou látkou ze skupiny cílených chemoterapeutik, která je v USA schválena k léčbě karcinomu pankreatu. Z klinického hlediska je však nutno zvážit minimální rozdíl v délce přežití, který lze přidáním erlotinibu dosáhnout, a výrazné finanční náklady, které je třeba vynaložit. Erlotinib byl a je testován v kombinaci s řadou dalších chemoterapeutik.
Gefitinib byl testován u pacientů s karcinomem pankreatu ve studiích fáze II [34], avšak randomizovaná studie chybí.
Imatinib
Imatinib mesylát (Glivec) je inhibitor tyrozinkinázové aktivity několika proteinů, především abl, c-kit či PDGFR. V klinické praxi je rutinně užíván v léčbě chronické myeloidní leukemie a gastrointestinálních stromálních nádorů. Imatinib byl testován také u karcinomu pankreatu. Dvě studie s imatinibem zahrnunující 36 pacientů neprokázaly efektivitu imatinibu u karcinomu pankreatu [35,36].
HER2
HER2 (EGF receptor 2) je členem EGF rodiny receptorů s tyrozinkinázovou aktivitou. Jeho aktivace je spojena s dimerizací dvou molekul receptoru a aktivací tyrozinkinázové aktivity, na kterou navazuje kaskáda reakcí distální části signální dráhy. Zvýšená exprese genu, způsobená např. genovou amplifikací, vede k abnormální aktivaci signální dráhy. Abnormální exprese HER2 byla v minulosti popsána až u poloviny karcinomů pankreatu [37].
Trastuzumab
Trastuzumab (Herceptin, Genentech) je monoklonální protilátka proti HER2 receptoru, která se v klinické praxi používá např. u HER2 pozitivního karcinomu prsu či karcinomu žaludku. Ve studii sledující účinek trastuzumabu v kombinaci s gemcitabinem nebylo dosaženo zlepšení přežití [38].
Monoklonální protilátka pertuzumab či inhibitor tyrozinkinázové aktivity HER2 lapatinib byly testovány pouze u malého počtu pacientů ve studiích fáze I či II bez signifikantního efektu na přežití [39,40].
AKT
AKT, protein-kináza B, je serin/treoninkináza, která je distální součástí PI3K signální dráhy. Deregulace AKT byla prokázána u řady nádorů včetně karcinomu pankreatu [41]. Její aktivace je možná také díky inaktivaci tumor supresorového genu PTEN. AKT ovlivňuje řadu klíčových celulárních procesů jako proliferaci, růst, apoptózu či metabolizmus.
Enzastaurin
Enzastaurin je AKT inhibitor. Jeho užití u metastazujícího karcinomu pankreatu bylo neúspěšné [42].
mTOR
mTOR (mammalian target of rapamycin) je serin/treoninkináza, která v reakci na růstové faktory či energetický stav organizmu reguluje buněčný cyklus, proliferaci a přežití buněk [15]. V signální kaskádě se nachází distálně od PI3K a AKT. Rapamycin po vazbě na svůj intracelulární receptor FKBP12 reguluje prostřednictvím inhibice mTOR buněčný cyklus. Role signální dráhy mTOR se vedle onkogeneze předpokládá např. u Alzheimerovy choroby či v procesu stárnutí, terapeutické ovlivnění je využíváno k navození imunosuprese (sirolimus). Aktivovaný mTOR byl prokázán u více než poloviny karcinomů pankreatu [43].
Temsirolimus
Temsirolimus (Torisel, Wyeth) je mTOR inhibitor, který prokázal antiproliferativní účinek na karcinom pankreatu v modelech buněčných linií a xenograftů. Tyto slibné výsledky se však nepotvrdily ve fázi II studie u pacientů s karcinomem [44].
Everolimus
Everolimus (Afinitor, Novartis) je derivát rapamycinu, který inhibuje kinázovou aktivitu mTOR. Jeho aktivita ve fázi II studie u pacientů s metastazujícím karcinomem pankreatu byla nedostatečná a stejně tak byla jeho aktivita nízká v kombinaci s erlotinibem [44].
Sirolimus
Sirolimus (Rapamune, Wyeth) je mTOR inhibitor užívaný k imunosupresivní léčbě po transplantaci orgánů. V klinické studii dosáhlo šestiměsíčního přežití pouze 20 % pacientů s karcinomem pankreatu [45]. Sirolumus tak nelze, stejně jako ostatní mTOR inhibitory, doporučit v léčbě pokročilého karcinomu pankreatu.
VEGF
Angiogeneze je zásadní pro růst a šíření nádoru, a její inhibice tak představuje důležitý cíl protinádorové terapie. VEGF (vascular endothelial groth factor) hraje klíčovou roli v kontrole nádorové angiogeneze. Vazba VEGF na receptory vede k aktivaci signální dráhy, v jejímž důsledku dochází k podpoře růstu a přežití buněk endotelu, jejich permeabilitě a migraci [12]. Inhibice této signální dráhy je s úspěchem užívána např. v léčbě kolorektálního karcinomu, nemalobuněčného karcinomu plic či karcinomu ledviny. Vysoká exprese VEGF se dle některých studií vyskytuje až u 90 % karcinomů pankreatu a negativně koreluje s prognózou [46].
Bevacizumab
Bevacizumab (Avastin, Genentech) je humanizovaná protilátka proti VEGF, která zabraňuje jeho vazbě na receptor a v důsledku toho také jeho činnosti. Bevacizumab byl testován u karcinomu pankreatu v mnoha studiích v monoterapii či v kombinaci s gemcitabinem, platinou, capecitabinem, cetuximabem, erlotinibem či docetaxelem [15]. Dvojitě slepá placebem kontrolovovaná studie fáze III (CALGB 80303) hodnotila účinek přidání bevacizumabu ke gemtamicinu u 602 pacientů s pokročilým karcinomem. Medián přežití byl 5,8 měsíců pro kombinaci vs 5,9 měsíců pro samotný gemcitabin [47]. V podobné studii s metastazujícím karcinomem byl testován účinek přidání bevacizumabu k dvojkombinaci gemcitabin a erlotinib u 607 pacientů. Přidání bevacizumabu neovlivnilo medián přežití (7,1 měsíců pro bevacizumab vs 6,0 pro placebo; p = 0,2087). Pacienti s bevacizumabem však měli statisticky významně delší čas přežití bez progrese [48].
Sorafenib
Sorafenib (Nexavar, Bayer) patří do skupiny inhibitorů tyrozinkinázové aktivity VEGFR. V klinické praxi je užíván v léčbě karcinomu ledviny či jater. Slibné předběžné výsledky z probíhající studie ukázaly 62% půlroční přežití u pacientů léčených capecitabinem, oxaliplatinou a sorafenibem [49].
Sunitinib a axitinib
Sunitinib malát (SUTENT, Pfizer) a axitinib jsou dalšími tyrozinkinázovými inhibitory receptorů růstových faktorů VEGF. Sunitinib nebyl dostatečně aktivní u pacientů po předchozí léčbě gemcitabinem pro metastazující karcinom pankreatu [50]. Axitinib s gemcitabinem byl pouze srovnatelný se samotným gemcitabinem ve studii fáze III [51].
Matrix metaloproteinázy
Matrix metaloproteinázy (MMP) jsou peptidázy degradující extracelulární matrix. Narušení extracelulární matrix jako bariéry mezi nádorem a okolní tkání je dáváno do souvislosti s procesem metastazování. Předpokladem terapeutické inhibice matrix metaloproteináz je potlačení invazivity a metastazování [15].
Marimastat
Inhibitor MMP-1, marimastat, byl testován ve dvou randomizovaných studiích fáze III. V první studii bylo 414 pacientů randomizováno mezi marimastat a gemtamicin. Rozdíl v účinnosti obou terapií nebyl zjištěn [52]. Ve druhé studii byla testována kombinace marimastatu s gemtamicinem proti samotnému gemtamicinu. Obě skupiny vykázaly srovnatelné přežití [53].
Cyklooxygenáza 2
Cyklooxygenázy (COX-1, COX-2) přeměňují kyselinu arachidonovou na prostaglandiny a jejich primární role je v procesech zánětu. U některých nádorů se předpokládá jejich účinek v podpoře nádorového růstu a inhibici apoptózy. Enzym cyklooxygenáza 2 je exprimován u většiny karcinomů pankreatu [54]. V buněčných modelech vedla inhibice cyklooxygenázy 2 k inhibici růstu nádorových buněk [55].
Celecoxib
Celecoxib patří mezi specifické inhibitory COX-2. Celecoxib byl u karcinomu pankreatu testován v mnoha studiích v kombinaci s řadou chemoterapeutik. Kombinace celecoxibu s gemcitabinem byla testována u 20 pacientů s metastazujícím karcinomem pankreatu. Medián přežití byl 6,2 měsíce [56]. V jiné studii vedlo přidání celecoxibu ke gemtamicinu k mediánu přežití 9,1 měsíce [57]. Poslední studie s touto kombinací však neprokázala významný benefit [58]. Studie hodnotící efekt celecoxibu v kombinaci s 5-FU [59] či dalšími látkami přinesly neuspokojivé výsledky [15].
Mezotelin
Mezotelin je protein, který se vyskytuje jen velmi omezeně ve zdravých tkáních, avšak abnormálně je exprimován buňkami některých nádorů včetně karcinomu pankreatu (obr. 3). Funkce mezotelinu pro nádorové buňky není známa a nejspíše není zásadní. Jeho specifická abnormální exprese pouze v nádorových buňkách z něj však dělá vhodný cíl pro diagnostiku či terapii [3].
Morab 009
Morab 009 je chimérická myší a lidská monoklonální protilátka proti mezotelinu. Její efekt byl prokázán v experimentálních buněčných modelech a ve fázi I studie, kde potencovala účinnost gemcitabinu [60]. Další studie s touto protilátkou teprve probíhají.
NFκB
Transkripční faktor NFκB se účastní regulace imunitních a zánětlivých procesů a současně se podílí na regulaci proliferace, přežití či chemorezistence. Abnormální exprese NFκB byla nalezena v buněčných liniích karcinomu pankreatu i samotných nádorech [61]. Níže uvedené látky mají inhibiční aktivitu na NFκB.
Bortezomib
Bortezomib (Velcade, Millennium) je látka s nespecifickou aktivitou proti NFκB. Řada buněčných linií karcinomu pankreatu a nádorové xenografty se vyznačovala citlivostí vůči bortezomibu [62]. Klinické studie fáze II však neprokázaly efekt bortezomibu v monoterapii či v kombinaci s gemcitabinem [63].
Curcumin
Curcumin je nespecifický inhibitor řady molekul včetně NFκB. Curcumin podávaný s gemcitabinem, či bez něj prokázal biologickou aktivitu u pacientů s karcinomem [64]. V současné době probíhá studie, kde se podává curcumin společně s gemcitabinem a celecoxibem.
Fanconiho anemie
Fanconiho anemie je vzácné autozomálně recesivní onemocnění způsobující kongenitnální růstové abnormality, postižení kostní dřeně a nádorovou predispozici. Onemocnění vzniká v důsledku bialelických mutací v jednom z genů signální dráhy Fanconiho anemie. Proteiny uspořádané v signální dráze jsou zodpovědné za opravu DNA. Typickým buněčným fenotypem je hypersenzitivita k látkám způsobujícím meziřetězové můstky jako mitomycin C či cisplatina. V signální dráze Fanconiho anemie spolupracuje celkem 13 genů. V reakci na poškození DNA vzniká komplex osmi proximálních proteinů (FANC A, B, C, E, F, G, L), jejichž úkolem je ubiquitinace FANCD2 a FANCI. Tento ubuqitinovaný komplex FANCD2/FANCI přechází do jádra, kde se váže na chromatin a atrahuje další proteiny (D1-BRCA2, N, J) včetně BRCA1 (obr. 4). Členové dolní části signální dráhy participují v opravě DNA homologní rekombinací [65].
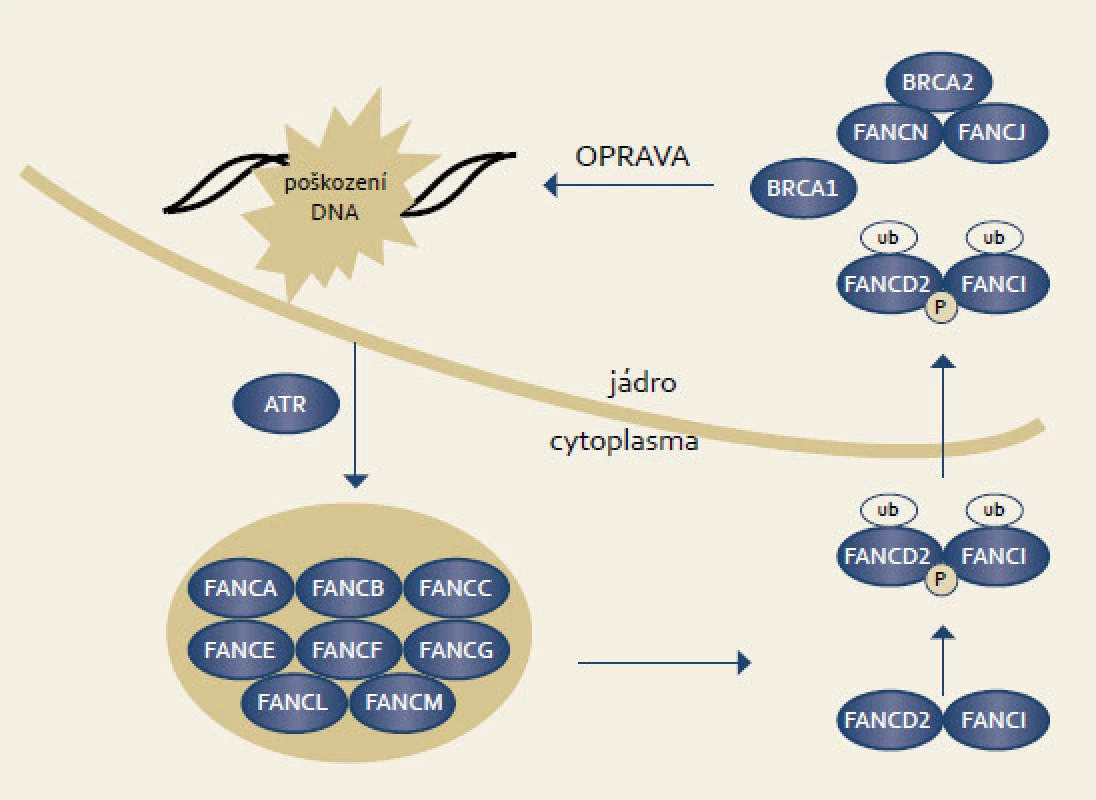
Bialelické mutace ve FA genech způsobují Fanconiho anemii [66]. Heterozygotní mutace, somatické mutace a epigenetické změny se nacházejí u pacientů s řadou nádorů. Nositelé heterozygotních mutací v BRCA2 genu mají zvýšenou predispozici ke vzniku karcinomu ovarií, prsu ale také pankreatu [67]. Až 20 % pacientů s familiárním karcinomem pankreatu je v Evropě nositelem BRCA2 [68]. Somatické a germinální mutace FANCC a FANCG byly nalezeny u pacientů s časným karcinomem pankreatu [69]. Mutace v BRIP1/BACH1 (FANCJ) a PALB2 (FANCN) jsou nalézány u karcinomu pankreatu [65,70,71].
Mitomycin C
Mitomycin C je přírodním produktem některých bakterií z rodu streptomycet. Pomocí alkylace vede k tvorbě meziřetězových můstků, které v případě, že nejsou opraveny, vedou k zástavě replikace a smrti buňky. Experimentální práce v buněčných a zvířecích modelech jednoznačně potvrdily, že v nádorových buňkách nesoucích mutace v genech Fanconiho anemie je oprava DNA poškozena. V důsledku toho pak budou zvýšeně citlivé k mitomycinu C (obr. 5) [11].
![Selektivní citlivost experimentálních nádorových BRCA2 deficitních buněk k látkám poškozujícím DNA jako mitomycinu C, melfalanu, etopozidu či k PARP inhibitorům (NU 1025). Modifikováno dle Hucl et al [11].
Fig. 5. Selective sensitivity of experimental BRCA2 deficient cancer cells to DNA damaging agents such as mitomycin C, melphalan, etoposide or PARP inhibitors (NU 1025). Modified from Hucl et al [11].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/bd849bfb9a89d3d2d68c6f024b793955.jpg)
V retrospetivní studii Tuinmanna et al bylo hodnoceno 55 pacientů s pokročilým karcinomem pankreatu léčených kombinací gemtamicinu a mitomycinu C. Průměrný čas do progrese onemocnění byl 4,7 měsíce a medián přežití byl 7,25 měsíců. Mitomycin C byl dobře tolerován, avšak nevedl k zásadnímu zlepšení přežití [72]. Když však byl mitomycin C podáván selektivně u pacienta s pozitivní rodinnou anamnézou karcinomu pankreatu a prokázanou vrozenou BRCA2 mutací, bylo dosaženo dlouhodobého přežití [73]. Podávání mitomycinu C u selektované skupiny pacientů s BRCA2 mutací je předmětem klinických studií.
Veliparib
Veliparib je ihnibitorem enzymu poly-(ADP)-ribóza polymerázy 1 (PARP-1). PARP-1 polymeráza je zodpovědná za opravu DNA pomocí excize bází (base excision repair). Tento mechanizmus se užívá k opravě jednořetězcových zlomů DNA. V nepřítomnosti PARP-1 nemohou být přirozeně se vyskytující jednořetězcové zlomy opraveny a vznikají z nich dvouřetězcové zlomy. Buňky defektní v homologní rekombinaci, kam patří např. buňky nesoucí mutace v BRCA2 genu, nemohou tyto dvouřetězcové zlomy opravit a umírají. PARP-1 aktivita je tak pro tyto buňky esenciální. Tomuto vztahu říkáme vztah syntetické letality. Buňka defektní v jedné funkci je životně závislá na jiné funkci. Vzhledem k tomu, že v každé buňce vzniká denně asi 104 jednořetězcových zlomů, dává inhibice PARP-1 možnost k selektivnímu usmrcení buněk defektních v homologní rekombinaci, a to dokonce bez přítomnosti látky poškozující DNA [65]. Bryant et al a Farmer et al ukázali, že PARP-1 inhibice vede k usmrcení BRCA2 deficitních tumorů v myších modelech [74,75]. Klinické studie fáze II hodnotící efekt PARP ihibitoru, veliparibu, podávaného buď samostatně, či společně s gemcitabinem a cisplatinou, právě probíhají [76].
Hedgehog
Hedgehog signální dráha je významná v embryonálním období pro adekvátní vývoj organizmu. Její abnormální aktivita je přítomna např. u baziliomu či karcinomu pankreatu [77].
Pro karcinom pankreatu je charakteristická výrazná přítomnost vazivového stromatu. Interakce mezi stromálními fibroblasty (stelárními buňkami) a neoplastickými buňkami přispívá k nádorové iniciaci, progresi a metastazování. Tato interakce se odehrává na molekulární úrovni. Nádorové stroma však také představuje fyzickou bariéru zabraňující chemoterapeutikům dosáhnout k nádorovým buňkám. Potlačení jeho růstu je jedním z mechanizmů, jak zvýšit dostupnost a efektivitu protinádorových léků [78]. Zajímavostí hedgehog signální dráhy u karcinomu pankreatu je její aktivace jak v nádoru, tak v okolním stromatu. Hedgehog ligandy, pocházející z nádorových buněk, stimulují stromální fibroblasty exprimující receptory hedgehog signální dráhy. Fibroblasty s aktivovanou hedgehog signální dráhou pak tvoří vazivo a parakrinně stimulují nádorové buňky k růstu [79]. Inhibice hedgehog signální dráhy vedla v experimentálním modelu k depleci tumor asociovaných fibroblastů, vzestupu prokrvení nádoru, vzestupu koncentrace gemcitabinu v tumoru a stabilizaci choroby [78].
Saridegib
Saridegib je ihnibitor receptoru hedgehog sigmální dráhy smoothened (SMO). Klinická studie srovnávající efekt kombinace saridegibu s gemcitabinem oproti gemcitabinu samotnému byla předčasně ukončena pro lepší přežití v kontrolní skupině [80].
Imunoterapie
Předpoklad účasti imunitního systému v progresi karcinomu pankreatu vychází např. z pozorování pozitivního terapeutického účinku inhibice T regulačních lymfocytů (buňky potlačující protinádorovou imunitní odpověď). Jiným příkladem je potlačení nádorového růstu při použití vakcín obsahujících ozářené nádorové buňky či jejich antigeny [81]. Několik různých vakcín je v současné době v klinickém testování.
Úskalí cílené léčby
V současné době lze považovat užití cílené léčby u karcinomu pankreatu za neúspěch. Srovnání s takovými výsledky, které přineslo např. užití imatinibu do léčby chronické myeloidní leukemie, není možné. Užití imatinibu u chronické myeloidní leukemie zcela změnilo prognózu pacientů a stalo se novým paradigmatem v protinádorové léčbě. Užití erlotinibu, jediného v USA doposud schváleného cíleného přípravku k léčbě karcinomu pankreatu, prodloužilo přežití pacientů o méně než dva týdny. Jeho benefit je o to menší, vezmeme-li v úvahu jeho cenu.
Příčiny selhání cílené léčby jsou různorodé. Základní podmínkou úspěchu je volba vhodného cíle. Nejlepším prediktorem úspěchu léčby je robustní přítomnost aktivující mutace či jiné genetické alterace ve zvoleném cíli. Příkladem je již zmíněný imatinib (Glivec) u pacientů s BCR-ABL fúzí u chronické myeloidní leukemie, trastuzumab (Herceptin) u HER2 pozitivních karcinomů prsu či gefinitib (Iressa) a erlotinib (Tarceva) u pacientů s mutací či amplifikací EGFR u karcinomu plic. Jednoznačně nejvíce robustním geneticky alterovaným cílem je u karcinomu pankreatu signální dráha KRAS aktivovaná mutací, její inhibice však byla doposud neúspěšná.
Samotná přítomnost zvoleného cíle není dostatečná. Experimentální studie prokázaly dostatečnou expresi HER2 u karcinomu pankreatu, klinické užití inhibitorů však nevedlo k žádnému úspěchu. Tento cíl musí být v daném nádoru nejen dostatečně exprimován, ale musí být také pro růst a přežití nádorových buněk zásadní. Exprese HER2 je u karcinomu pankreatu nejen méně robustní ve srovnání s karcinomem prsu, ale také nejspíše méně funkčně významná. Inhibice pak nevede k dostatečnému efektu.
Inhibovaná signální dráha může být nahrazena aktivitou jiné dráhy nebo alespoň nezávisle regulovanou aktivitou distální části stejné dráhy. Jako příklad lze uvést neúspěch neúspěch inhibitorů EGFR u karcinomu pankreatu, u kterých je stejná signální dráha aktivována o stupeň níže na úrovni KRAS. Přítomnost KRAS mutace či nízká exprese EGFR však negativní odpověď na erlotinib u karcinomu pankreatu přesto nepredikuje [82]. Souhrnně lze říci, že molekulárně biologické opodstatnění řady výše uvedených cílů je u karcinomu pankreatu sporné a stejně tak je sporný i výsledek.
Příčinou nízké efektivity cílené léčby může spočívat také v nedokonalém výběru testované populace. V případě, že zvolený cíl není přítomen ve své patologické formě u všech či alespoň velké většiny pacientů s chorobou, efekt se nepodaří prokázat. Typickým příkladem může být zjištění, že pouze ti pacienti, jejichž nádor nenese mutovanou alelu KRAS, odpovídají na léčbu cetuximabem [83]. Nezbytnou podmínkou dotýkající se samotného principu cílené léčby je tak její individualizace. Ve většině případů nestačí charakterizovat nádorové onemocnění na molekulárně biologické úrovni jako celek, ale je nezbytné charakterizovat nádor konkrétního pacienta. Takovouto charakteristiku je možné udělat mutační analýzou, funkčními testy, imunohistochemicky či pomocí vystavení nádorových buněk daného pacienta v ex vivo modelu spektru chemoterapeutik. Výsledkem je pak chemogram, profil citlivosti a rezistence nádorových buněk pacienta k jednotlivým chemoterapeutikům, analogie antibiotikogramu v případě testování citlivosti infekčního agens k antibiotikům. Tento plán představuje jednu z možných přístupů k onkologické léčbě v budoucnosti.
Příkladem takového přístupu může být zkušenost z Johns Hopkins University v Baltimore. Část nádoru operovaných pacientů je propagována v myším modelu. Vytvořený xenograft je dále vystaven působení celé řady chemoterapeutik. Mimořádně zajímavý je případ 61letého pacienta s T3N1M0 tumorem kaudy, který podstoupil distální hemipankreatektomii. Následovala léčba gemcitabinem, po které došlo k progresi onemocnění včetně vzdálených metastáz. U xenograftu jeho tumoru byla zjištěna dobrá odpověď na mitomycin C. Byla zahájena léčba mitomycinem C, která vedla k významné regresi onemocnění. Při další progresi byl pacient znovu úspěšné léčen dalšími cykly mitomycinu C a cisplatinou a bylo dosaženo dlouhodobého přežití. Mutační analýza jeho tumoru prokázala bialelickou mutaci v genu PALB2 [84].
Jinou příčinou nedostatečného efektu cílené léčby může být vznik rezistence. Důvodem rezistence může být např. mutace či amplifikace některých distálních členů signální dráhy. Ztráta PTEN u HER2 pozitivních tumorů způsobí rezistenci na trastuzumab. Jinou příčinou může být mutace samotného cíle, která znemožní vazbu inhibitoru.
Závěr
Selhání současné terapie karcinomu pankreatu je hlavním důvodem naší zoufalé snahy o nalezení nových způsobů léčby. Cílená chemoterapie však u tohoto onemocnění prozatím zůstává zklamáním, neboť desítky studií testující desítky cílených preparátů u tisíců pacientů nedoznaly úspěchu. Čtenář by tak mohl nabýt dojmu, že cílená léčba karcinomu pankreatu je minulostí. Avšak získané zkušenosti, ať už z neúspěšných studií s karcinomem pankreatu či z úspěšných studií u jiných chorob, jsou velkým příslibem do budoucna. Bude to právě bližší poznání biologie nádoru včetně identifikace signálních drah, nalezení molekul, které tyto dráhy účinně inhibují, a vhodná selekce pacientů, kdo bude mít největší naději na úspěch v budoucí léčbě tohoto časně systémového onemocnění.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 27. 8. 2013
Přijato: 1. 10. 2013
MUDr. Tomáš Hucl, Ph.D.
Klinika hepatogastroenterologie, IKEM
Vídeňská 1958/9, 140 21 Praha 4
tomas.hucl@ikem.cz
Sources
1. Lowenfels AB, Maisonneuve P. Epidemiology and risk factors for pancreatic cancer. Best Pract Res Clin Gastroenterol 2006; 20(2): 197–209.
2. Hucl T. Karcinom pankreatu. Gastroent Hepatol 2012; 66(5): 350–356.
3. Hucl T, Brody JR, Gallmeier E et al. High cancer-specific expression of mesothelin (MSLN) is attributable to an upstream enhancer containing a transcription enhancer factor dependent MCAT motif. Cancer Res 2007; 67(19): 9055–9065.
4. Jones S, Zhang X, Parsons DW et al. Core signaling pathways in human pancreatic cancers revealed by global genomic analyses. Science 2008; 321(5897): 1801–1806.
5. Van Laethem JL, Verslype C, Iovanna JL et al. New strategies and designs in pancreatic cancer research: consensus guidelines report from a European expert panel. Ann Oncol 2012; 23(3): 570–576.
6. Burris HA 3rd, Moore MJ, Andersen J et al. Improvements in survival and clinical benefit with gemcitabine as first-line therapy for patients with advanced pancreas cancer: a randomized trial. J Clin Oncol 1997; 15(6): 2403–2413.
7. Conroy T, Desseigne F, Ychou M et al. FOLFIRINOX versus gemcitabine for metastatic pancreatic cancer. N Engl J Med 2011; 364(19): 1817–1825.
8. Von Hoff DD et al. Randomized phase III study of weekly nab-paclitaxel plus gemcitabine versus gemcitabine alone in patients with metastatic adenocarcinoma of the pancreas (MPACT). J Clin Oncol 2012; 30: LBA148.
9. Druker BJ, Sawyers CL, Kantarjian H et al. Activity of a specific inhibitor of the BCR-ABL tyrosine kinase in the blast crisis of chronic myeloid leukemia and acute lymphoblastic leukemia with the Philadelphia chromosome. N Engl J Med 2001; 344(14): 1038–1042.
10. Druker BJ, Talpaz M, Resta DJ et al. Efficacy and safety of a specific inhibitor of the BCR-ABL tyrosine kinase in chronic myeloid leukemia. N Engl J Med 2001; 344(14): 1031–1037.
11. Hucl T, Rago C, Gallmeier E et al. A syngeneic variance library for functional annotation of human variation: application to BRCA2. Cancer Res 2008; 68(13): 5023–5030.
12. Danovi SA, Wong HH, Lemoine NR. Targeted therapies for pancreatic cancer. Br Med Bull 2008; 87 : 97–130.
13. Almoguera C, Shibata D, Forrester K et al. Most human carcinomas of the exocrine pancreas contain mutant c-K-ras genes. Cell 1988; 53(4): 549–554.
14. Bos JL. Ras oncogenes in human cancer: a review. Cancer Res 1989; 49(17): 4682–4689.
15. Zagouri F, Sergentanis TN, Chrysikos D et al. Molecularly targeted therapies in metastatic pancreatic cancer: a systematic review. Pancreas 2013; 42(5): 760–773.
16. End DW, Smets G, Todd AV et al. Characterization of the antitumor effects of the selective farnesyl protein transferase inhibitor R115777 in vivo and in vitro. Cancer Res 2001; 61(1): 131–137.
17. Crul M, de Klerk GJ, Swart M et al. Phase I clinical and pharmacologic study of chronic oral administration of the farnesyl protein transferase inhibitor R115777 in advanced cancer. J Clin Oncol 2002; 20(11): 2726–2735.
18. Cohen SJ, Ho L, Ranganathan S et al. Phase II and pharmacodynamic study of the farnesyltransferase inhibitor R115777 as initial therapy in patients with metastatic pancreatic adenocarcinoma. J Clin Oncol 2003; 21(7): 1301–1306.
19. Macdonald JS, McCoy S, Whitehead RP et al. A phase II study of farnesyl transferase inhibitor R115777 in pancreatic cancer: a Southwest oncology group (SWOG 9924) study. Invest New Drugs 2005; 23(5): 485–487.
20. Van Cutsem E, van de Velde H, Karasek P et al. Phase III trial of gemcitabine plus tipifarnib compared with gemcitabine plus placebo in advanced pancreatic cancer. J Clin Oncol 2004; 22(8): 1430–1438.
21. Hong DS, Sebti SM, Newman RA et al. Phase I trial of a combination of the multikinase inhibitor sorafenib and the farnesyltransferase inhibitor tipifarnib in advanced malignancies. Clin Cancer Res 2009; 15(22): 7061–7068.
22. Lobell RB, Liu D, Buser CA et al. Preclinical and clinical pharmacodynamic assessment of L-778,123, a dual inhibitor of farnesyl: protein transferase and geranylgeranyl:protein transferase type-I. Mol Cancer Ther 2002; 1(9): 747–758.
23. Downward J, Yarden Y, Mayes E et al. Close similarity of epidermal growth factor receptor and v-erb-B oncogene protein sequences. Nature 1984; 307(5951): 521–527.
24. Bloomston M, Bhardwaj A, Ellison EC et al. Epidermal growth factor receptor expression in pancreatic carcinoma using tissue microarray technique. Dig Surg 2006; 23(1–2): 74–79.
25. Samuels Y, Velculescu VE. Oncogenic mutations of PIK3CA in human cancers. Cell Cycle 2004; 3(10): 1221–1224.
26. Lynch TJ, Bell DW, Sordella R et al. Activating mutations in the epidermal growth factor receptor underlying responsiveness of non-small-cell lung cancer to gefitinib. N Engl J Med 2004; 350(21): 2129–2139.
27. Mendelsohn J. Targeting the epidermal growth factor receptor for cancer therapy. J Clin Oncol 2002; 20 (18 Suppl): 1S–13S.
28. Xiong HQ, Rosenberg A, LoBuglio A et al. Cetuximab, a monoclonal antibody targeting the epidermal growth factor receptor, in combination with gemcitabine for advanced pancreatic cancer: a multicenter phase II Trial. J Clin Oncol 2004; 22(13): 2610–2616.
29. Philip PA, Benedetti J, Corless CL et al. Phase III study comparing gemcitabine plus cetuximab versus gemcitabine in patients with advanced pancreatic adenocarcinoma: Southwest Oncology Group-directed intergroup trial S0205. J Clin Oncol 2010; 28(22): 3605–3610.
30. Kullmann F, Hartmann A, Stöhr R et al. KRAS mutation in metastatic pancreatic ductal adenocarcinoma: results of a multicenter phase II study evaluating efficacy of cetuximab plus gemcitabine/oxaliplatin (GEMOXCET) in first-line therapy. Oncology 2011; 81(1): 3–8.
31. Graeven U, Kremer B, Südhoff T et al. Phase I study of the humanised anti-EGFR monoclonal antibody matuzumab (EMD 72000) combined with gemcitabine in advanced pancreatic cancer. Br J Cancer 2006; 94(9): 1293–1299.
32. Vanhoefer U, Tewes M, Rojo F et al. Phase I study of the humanized antiepidermal growth factor receptor monoclonal antibody EMD72000 in patients with advanced solid tumors that express the epidermal growth factor receptor. J Clin Oncol 2004; 22(1): 175–184.
33. Moore MJ, Goldstein D, Hamm J et al. Erlotinib plus gemcitabine compared with gemcitabine alone in patients with advanced pancreatic cancer: a phase III trial of the National Cancer Institute of Canada Clinical Trials Group. J Clin Oncol 2007; 25(15): 1960–1966.
34. Fountzilas G, Bobos M, Kalogera-Fountzila A et al. Gemcitabine combined with gefitinib in patients with inoperable or metastatic pancreatic cancer: a phase II Study of the Hellenic Cooperative Oncology Group with biomarker evaluation. Cancer Invest 2008; 26(8): 784–793.
35. Gharibo M, Patrick-Miller L, Zheng L et al. A phase II trial of imatinib mesylate in patients with metastatic pancreatic cancer. Pancreas 2008; 36(4): 341–345.
36. Chen J, Röcken C, Nitsche B et al. The tyrosine kinase inhibitor imatinib fails to inhibit pancreatic cancer progression. Cancer Lett 2006; 233(2): 328–337.
37. Yamanaka Y, Friess H, Kobrin MS et al. Overexpression of HER2/neu oncogene in human pancreatic carcinoma. Hum Pathol 1993; 24(10): 1127–1134.
38. Safran H, Iannitti D, Ramanathan R et al. Herceptin and gemcitabine for metastatic pancreatic cancers that overexpress HER-2//neu. Cancer Invest 2004; 22(5): 706–712.
39. Agus DB, Gordon MS, Taylor C et al. Phase I clinical study of pertuzumab, a novel HER dimerization inhibitor, in patients with advanced cancer. J Clin Oncol 2005; 23(11): 2534–2543.
40. Safran H, Miner, T, Bahary N et al. Lapatinib and gemcitabine for metastatic pancreatic cancer: a phase II study. ASCO Meeting Abstracts 2009; 27: e15653.
41. Cheng JQ, Ruggeri B, Klein WM et al. Amplification of AKT2 in human pancreatic cells and inhibition of AKT2 expression and tumorigenicity by antisense RNA. Proc Natl Acad Sci U S A 1996; 93(8): 3636–3641.
42. Richards DA, Kuefler PR, Becerra C et al. Gemcitabine plus enzastaurin or single--agent gemcitabine in locally advanced or metastatic pancreatic cancer: results of a phase II, randomized, noncomparative study. Invest New Drugs 2011; 29(1): 144–153.
43. Ito D, Fujimoto K, Mori T et al. In vivo antitumor effect of the mTOR inhibitor CCI-779 and gemcitabine in xenograft models of human pancreatic cancer. Int J Cancer 2006; 118(9): 2337–2343.
44. Javle MM, Shroff RT, Xiong H et al. Inhibition of the mammalian target of rapamycin (mTOR) in advanced pancreatic cancer: results of two phase II studies. BMC Cancer 2010; 10 : 368.
45. Garrido-Laguna I, Rudek M, Tan A et al. Preclinical identification of biomarkers of response to mTOR inhibitors and subsequent application in a phase II trail of sirolimus in pancreatic cancer patients refractory to gemcitabine. ASCO Meeting Abstracts 2009; 27 : 4612.
46. Seo Y, Baba H, Fukuda T et al. High expression of vascular endothelial growth factor is associated with liver metastasis and a poor prognosis for patients with ductal pancreatic adenocarcinoma. Cancer 2000; 88(10): 2239–2245.
47. Kindler HL, Niedzwiecki D, Hollis D et al. Gemcitabine plus bevacizumab compared with gemcitabine plus placebo in patients with advanced pancreatic cancer: phase III trial of the Cancer and Leukemia Group B (CALGB 80303). J Clin Oncol 2010; 28(22): 3617–3622.
48. Van Cutsem E, Vervenne WL, Bennouna J et al. Phase III trial of bevacizumab in combination with gemcitabine and erlotinib in patients with metastatic pancreatic cancer. J Clin Oncol 2009; 27(13): 2231–2237.
49. Lubner SJ, Schelman WR, Mulkerin D et al. Phase II study of oxaliplatin, high-dose capecitabine, and sorafenib in patients with advanced pancreatic cancer. ASCO Meeting Abstracts 2010; 28 : 4143.
50. O'Reilly EM, Niedzwiecki D, Hall M et al. A Cancer and Leukemia Group B phase II study of sunitinib malate in patients with previously treated metastatic pancreatic adenocarcinoma (CALGB 80603). Oncologist 2010; 15(12): 1310–1319.
51. Kindler HL, Ioka T, Richel DJ et al. Axitinib plus gemcitabine versus placebo plus gemcitabine in patients with advanced pancreatic adenocarcinoma: a double--blind randomised phase 3 study. Lancet Oncol 2011; 12(3): 256–262.
52. Bramhall SR, Rosemurgy A, Brown PD et al. Marimastat as first-line therapy for patients with unresectable pancreatic cancer: a randomized trial. J Clin Oncol 2001; 19(15): 3447–3455.
53. Bramhall SR, Schulz J, Nemunaitis J et al. A double-blind placebo-controlled, randomised study comparing gemcitabine and marimastat with gemcitabine and placebo as first line therapy in patients with advanced pancreatic cancer. Br J Cancer 2002; 87(2): 161–167.
54. Tucker ON, Dannenberg AJ, Yang EK et al. Cyclooxygenase-2 expression is up-regulated in human pancreatic cancer. Cancer Res 1999; 59(5): 987–990.
55. Molina MA, Sitja-Arnau M, Lemoine MG et al. Increased cyclooxygenase-2 expression in human pancreatic carcinomas and cell lines: growth inhibition by nonsteroidal anti-inflammatory drugs. Cancer Res 1999; 59(17): 4356–4362.
56. Xiong HQ, Plunkett W, Wolff R et al. A pharmacological study of celecoxib and gemcitabine in patients with advanced pancreatic cancer. Cancer Chemother Pharmacol 2005; 55(6): 559–564.
57. Ferrari V, Valcamonico F, Amoroso V et al. Gemcitabine plus celecoxib (GECO) in advanced pancreatic cancer: a phase II trial. Cancer Chemother Pharmacol 2006; 57(2): 185–190.
58. Dragovich T, Burris H 3rd, Loehrer P et al. Gemcitabine plus celecoxib in patients with advanced or metastatic pancreatic adenocarcinoma: results of a phase II trial. Am J Clin Oncol 2008; 31(2): 157–162.
59. Milella M, Gelibter A, Di Cosimo S et al. Pilot study of celecoxib and infusional 5-fluorouracil as second-line treatment for advanced pancreatic carcinoma. Cancer 2004; 101(1): 133–138.
60. Armstrong DK, Laheru, D, Ma WW et al. A phase I clinical study of MORAb-009, a monoclonal antibody against mesothelin in pancreatic cancer, mesothelioma and ovarian adenocarcinoma. ASCO Meeting Abstracts 2007; 25 : 14041.
61. Wang W, Abbruzzese JL, Evans DB et al. The nuclear factor-kappa B RelA transcription factor is constitutively activated in human pancreatic adenocarcinoma cells. Clin Cancer Res 1999; 5(1): 119–127.
62. Shah SA, Potter MW, McDade TP et al. 26S proteasome inhibition induces apoptosis and limits growth of human pancreatic cancer. J Cell Biochem 2001; 82(1): 110–122.
63. Alberts SR, Foster NR, Morton RF et al. PS-341 and gemcitabine in patients with metastatic pancreatic adenocarcinoma: a North Central Cancer Treatment Group (NCCTG) randomized phase II study. Ann Oncol 2005; 16(10): 1654–1661.
64. Dhillon N, Aggarwal BB, Newman RA et al. Curcumin and pancreatic cancer: Phase II clinical trial experience. ASCO Meeting Abstracts 2007; 25 : 4599.
65. Hucl T, Gallmeier E. DNA repair: exploiting the Fanconi anemia pathway as a potential therapeutic target. Physiol Res 2011; 60(3): 453–465.
66. Howlett NG, Taniguchi T, Olson S et al. Biallelic inactivation of BRCA2 in Fanconi anemia. Science 2002; 297(5581): 606–609.
67. Ford D, Easton DF, Stratton M et al. Genetic heterogeneity and penetrance analysis of the BRCA1 and BRCA2 genes in breast cancer families. The Breast Cancer Linkage Consortium. Am J Hum Genet 1998; 62(3): 676–689.
68. Hahn SA, Greenhalf B, Ellis I et al. BRCA2 germline mutations in familial pancreatic carcinoma. J Natl Cancer Inst 2003; 95(3): 214–221.
69. Van der Heijden MS, Yeo CJ, Hruban RH et al. Fanconi anemia gene mutations in young-onset pancreatic cancer. Cancer Res 2003; 63(10): 2585–2588.
70. Tischkowitz MD, Sabbaghian N, Hamel N et al. Analysis of the gene coding for the BRCA2-interacting protein PALB2 in familial and sporadic pancreatic cancer. Gastroenterology 2009; 137(3): 1183–1186.
71. Jones S, Hruban RH, Kamiyama M et al. Exomic sequencing identifies PALB2 as a pancreatic cancer susceptibility gene. Science 2009; 324(5924): 217.
72. Tuinmann G, Hegewisch-Becker S, Zschaber R et al. Gemcitabine and mitomycin C in advanced pancreatic cancer: a single-institution experience. Anticancer Drugs 2004; 15(6): 575–579.
73. Chalasani P, Kurtin S, Dragovich T. Response to a third-line mitomycin C (MMC)-based chemotherapy in a patient with metastatic pancreatic adenocarcinoma carrying germline BRCA2 mutation. JOP 2008; 9(3): 305–308.
74. Bryant HE, Schultz N, Thomas HD et al. Specific killing of BRCA2-deficient tumours with inhibitors of poly(ADP-ribose) polymerase. Nature 2005; 434(7035): 913–917.
75. Farmer H, McCabe N, Lord CJ et al. Targeting the DNA repair defect in BRCA mutant cells as a therapeutic strategy. Nature 2005; 434(7035): 917–921.
76. O’Reilly EM LA, Yu KH et al. Randomized phase II study of gemcitabine (G), cisplatin (C) with or without veliparib (V) (arms A, B) and a phase II single-arm study of single-agent veliparib (arm C) in patients with BRCA or PALB2-mutated pancreas adenocarcinoma (PC). J Clin Oncol 2013; 31: TPS4144.
77. Thayer SP, di Magliano MP, Heiser PW et al. Hedgehog is an early and late mediator of pancreatic cancer tumorigenesis. Nature 2003; 425(6960): 851–856.
78. Olive KP, Jacobetz MA, Davidson CJ et al. Inhibition of Hedgehog signaling enhances delivery of chemotherapy in a mouse model of pancreatic cancer. Science 2009; 324(5933): 1457–1461.
79. Hidalgo M, Maitra A. The hedgehog pathway and pancreatic cancer. N Engl J Med 2009; 361(21): 2094–2096.
80. Sandhiya S, Melvin G, Kumar SS et al. The dawn of hedgehog inhibitors: Vismodegib. J Pharmacol Pharmacother 2013; 4(1): 4–7.
81. Thomas AM, Santarsiero LM, Lutz ER et al. Mesothelin-specific CD8(+) T cell responses provide evidence of in vivo cross-priming by antigen-presenting cells in vaccinated pancreatic cancer patients. J Exp Med 2004; 200(3): 297–306.
82. Da Cunha Santos G, Dhani N, Tu D et al. Molecular predictors of outcome in a phase 3 study of gemcitabine and erlotinib therapy in patients with advanced pancreatic cancer: National Cancer Institute of Canada Clinical Trials Group Study PA.3. Cancer 2010; 116(24): 5599–5607.
83. Lievre A, Bachet JB, Le Corre D et al. KRAS mutation status is predictive of response to cetuximab therapy in colorectal cancer. Cancer Res 2006; 66(8): 3992–3995.
84. Villarroel MC, Rajeshkumar NV, Garrido-Laguna I et al. Personalizing cancer treatment in the age of global genomic analyses: PALB2 gene mutations and the response to DNA damaging agents in pancreatic cancer. Mol Cancer Ther 2011; 10(1): 3–8.
Labels
Paediatric gastroenterology Gastroenterology and hepatology SurgeryArticle was published in
Gastroenterology and Hepatology
2013 Issue 5
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
- Gastrointestinální onkologie
- Metodika adresného zvaní občanů do českého programu screeningu nádorů tlustého střeva a konečníku
- Vliv klinických a molekulárních faktorů na odhad rekurence kolorektálních adenomů u dlouhodobě sledovaných pacientů
- Postavenie neoadjuvantnej terapie v multimodálnej liečbe karcinómu rekta – klinické výsledky
- Hereditárny difúzny karcinóm žalúdka
- Cílená léčba karcinomu pankreatu – minulost či budoucnost?
- Lymfomy tenkého střeva
- Stav onkochirurgické péče a vzdělávání v onkochirurgii v České republice
- Multidisciplinární přístup v diagnostice a léčbě karcinomu žaludku
- Prvních 1 000 transplantací jater v IKEM
- Transplantace jater pro chronickou hepatitidu C, význam protivirové léčby
- Transplantace jater pro primární sklerozující cholangitidu
- Méně časté indikace k ortotopické transplantaci jater
- Vývoj postupů v léčbě akutního selhání jater
- Endosonograficky navigovaná tenkoihlová aspiračná biopsia zo solídnych pankreatických más – presnosť a impakt na liečbu u 358 pacientov
-
XXII. jarní setkání Loket 2013 – Neoplazie žaludku
3. postgraduální kurz společnosti pro gastrointestinální onkologii - Životní jubileum prof. Miroslava Zavorala
- Picoprep – očistný prostředek s dvojím účinkem
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Picoprep – očistný prostředek s dvojím účinkem
- Lymfomy tenkého střeva
- Transplantace jater pro primární sklerozující cholangitidu
- Hereditárny difúzny karcinóm žalúdka
