Dlouhodobé výsledky po radikálních resekcích pro adenokarcinom žaludku
Long-term results after radical resection for gastric adenocarcinoma
Background:
Gastric cancer is a serious disease with a generally poor prognosis. Because systemic anticancer treatment is not sufficiently effective, only complete removal of the tumor gives patients a chance of a cure.
Aim:
The study evaluated the long-term treatment outcomes of patients after radical resections for gastric adenocarcinoma.
Methods:
The study group included 48 patients who had undergone radical gastrectomy for adenocarcinoma. The results of statistical analyses of prospectively collected data were evaluated for 30-day overall patient survival (OS) and disease free survival (DFS), and 90-day postoperative mortality and morbidity. Further, the study evaluated the relationship between survival of patients in different clinical stages and the extent of lymphadenectomy, adjuvant effect of cancer treatment on survival and DFS, and the potential impact of early postoperative complications on OS.
Results:
Twenty-one patients (43.8%) survived five years. Postoperative surgical complications occurred in 12.5% of patients and non-surgical complications occurred in 12.5% of patients. The extent of lymphadenectomy D1 vs. D2 did not affect survival of patients neither overall nor in individual stages of the disease (p = 0.189). Conversely, a significant difference in long-term survival was found in cases where the number of histologically negative nodes among the total number of examined lymph nodes was greater than 60% (p < 0.0001). The extent of gastric resection or postoperative complications in our cohort had no impact on OS (p = 0.625; p = 0.268). Adjuvant therapy did not extend the OS of patients but prolonged DFS (FUFA combination with radiotherapy; p < 0.033).
Conclusion:
Gastric adenocarcinoma remains a serious disease with a prognosis that depends mainly on the stage of disease at the time of diagnosis. In our group, we did not find a positive effect of D2 lymphadenectomy on OS. A statistically significant difference in long-term survival was found in cases where the number of histologically negative nodes among the total number of examined lymph nodes was greater than 60%. Adjuvant cancer treatment had no effect on OS but prolonged DFS.
Key words:
carcinoma – stomach – treatment – prognosis – survival
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Submitted:
4. 8. 2016
Accepted:
18. 9. 2016
Authors:
F. Pazdírek 1; J. Leffler 1; L. Štěpánek 2
; D. Kostrouch 1; J. Votava 1; M. Šimša 3
Authors‘ workplace:
Chirurgická klinika 2. LF UK a FN v Motole, Praha
1; Fakulta biomedicínského inženýrství ČVUT v Praze
2; Chirurgická klinika 1. LF UK a Thomayerova nemocnice, Praha
3
Published in:
Gastroent Hepatol 2016; 70(5): 402-407
Category:
Gastrointestinal Oncology: Original Article
doi:
https://doi.org/10.14735/amgh2016402
Overview
Úvod:
Adenokarcinom žaludku je onemocnění s vážnou a obvykle nepříznivou prognózou. Systémová protinádorová léčba není dostatečně účinná, pouze kompletní odstranění nádoru dává pacientům šanci na vyléčení.
Cíl:
Zhodnocení dlouhodobých léčebných výsledků pacientů po radikálních resekčních výkonech provedených pro adenokarcinom žaludku.
Sestava a metoda:
Do sestavy bylo zařazeno 48 pacientů, kteří podstoupili radikální resekci žaludku pro adenokarcinom. Statistickou analýzou prospektivně získaných dat bylo hodnoceno celkové přežití nemocných (OS – overall survival), doba do průkazu recidivy onemocnění (DFS – disease free survival), 30denní, resp. 90denní pooperační mortalita a morbidita. Dále byl sledován vztah mezi přežitím nemocných v jednotlivých klinických stadiích a rozsahem lymfadenektomie, vliv adjuvantní onkologické léčby na délku přežití a na DFS a případný vliv časných pooperačních komplikací na OS.
Výsledky:
Pět let přežilo celkem 21 nemocných (43,8 %). Pooperační chirurgické komplikace se vyskytly u 12,5 % pacientů, nechirurgické komplikace se vyskytly u 12,5 % pacientů. Rozsah lymfadenektomie D1 vs. D2 neměl v našem souboru vliv na OS celkově a ani v jednotlivých stadiích nemoci (p = 0,189). Naopak, statisticky významný rozdíl v dlouhodobém přežití byl nalezen v případech, kdy podíl histologicky negativních uzlin z celkového počtu vyšetřených uzlin byl vyšší než 60 % (p < 0,0001). Rozsah resekce žaludku ani pooperační komplikace neměly v našem souboru vliv na OS (p = 0,625; p = 0,268). Adjuvantní léčba neprodloužila OS, ale prodloužila DFS (kombinace FUFA s radioterapií; p < 0,033).
Závěr:
Adenokarcinom žaludku zůstává nadále nemocí s vážnou prognózou, která je závislá především na stadiu nemoci v době určení diagnózy. V našem souboru jsme neprokázali pozitivní vliv D2 lymfadenektomie na OS. Naopak statisticky významný rozdíl v dlouhodobém přežití byl nalezen v případech, kdy podíl histologicky negativních uzlin z celkového počtu vyšetřených uzlin byl vyšší než 60 %. Adjuvantní onkologická léčba neměla vliv na OS, ale prodloužila DFS.
Klíčová slova:
karcinom – žaludek – léčba – prognóza – přežití
Úvod
Adenokarcinom žaludku je onemocnění s vážnou a obvykle nepříznivou prognózou. Incidence onemocnění se pohybuje nyní okolo 15 případů na 100 000 osob za rok. Karcinom žaludku tvoří 5 % nádorových onemocnění u mužů a 3 % u žen. Systémová protinádorová léčba není dostatečně účinná a pouze kompletní odstranění nádoru dává pacientům šanci na vyléčení. Rozsah chirurgického výkonu závisí na lokalizaci nádoru a histopatologické klasifikaci. Chirurgickým výkonem je totální či subtotální gastrektomie. Nedílnou součástí výkonu je lymfadenektomie en bloc 1. a 2. lymfatického kompartmentu. Naším cílem bylo zhodnotit dlouhodobé léčebné výsledky po radikálních resekčních výkonech provedených pro adenokarcinom žaludku.
Sestava a metodika
Jedná se o prospektivní soubor 48 pacientů, kteří podstoupili radikální resekci žaludku pro adenokarcinom na Chirurgické klinice 2. LF UK a FN v Motole v období od ledna 2005 do prosince 2010. Soubor tvořilo 31 mužů a 17 žen. Věkový průměr pacientů byl 63,7 let. Pacienti byli pravidelně kontrolováni klinicky po třech měsících v prvním roce, dále po půl roce. CT vyšetření bylo prováděno jednou na šest měsíců, jednou ročně bylo provedeno endoskopické vyšetření. Statistickou analýzou prospektivně získaných dat bylo zhodnoceno celkové přežití (OS – overall survival) nemocných, doba do průkazu recidivy onemocnění (DFS – disease free survival), pooperační morbidita, 30denní, resp. 90denní pooperační mortalita. Sledovali jsme vliv rozsahu chirurgické resekce, typu lymfadenektomie (D1 vs. D2), počtu odebraných uzlin, vliv časných pooperačních komplikací na OS. Adjuvantní onkologická léčba byla indikována od stadia IB a výše. Poté jsme hodnotili i vliv adjuvantní onkologické léčby na délku přežití a na DFS. Statistické výpočty byly provedeny programem R.
Výsledky
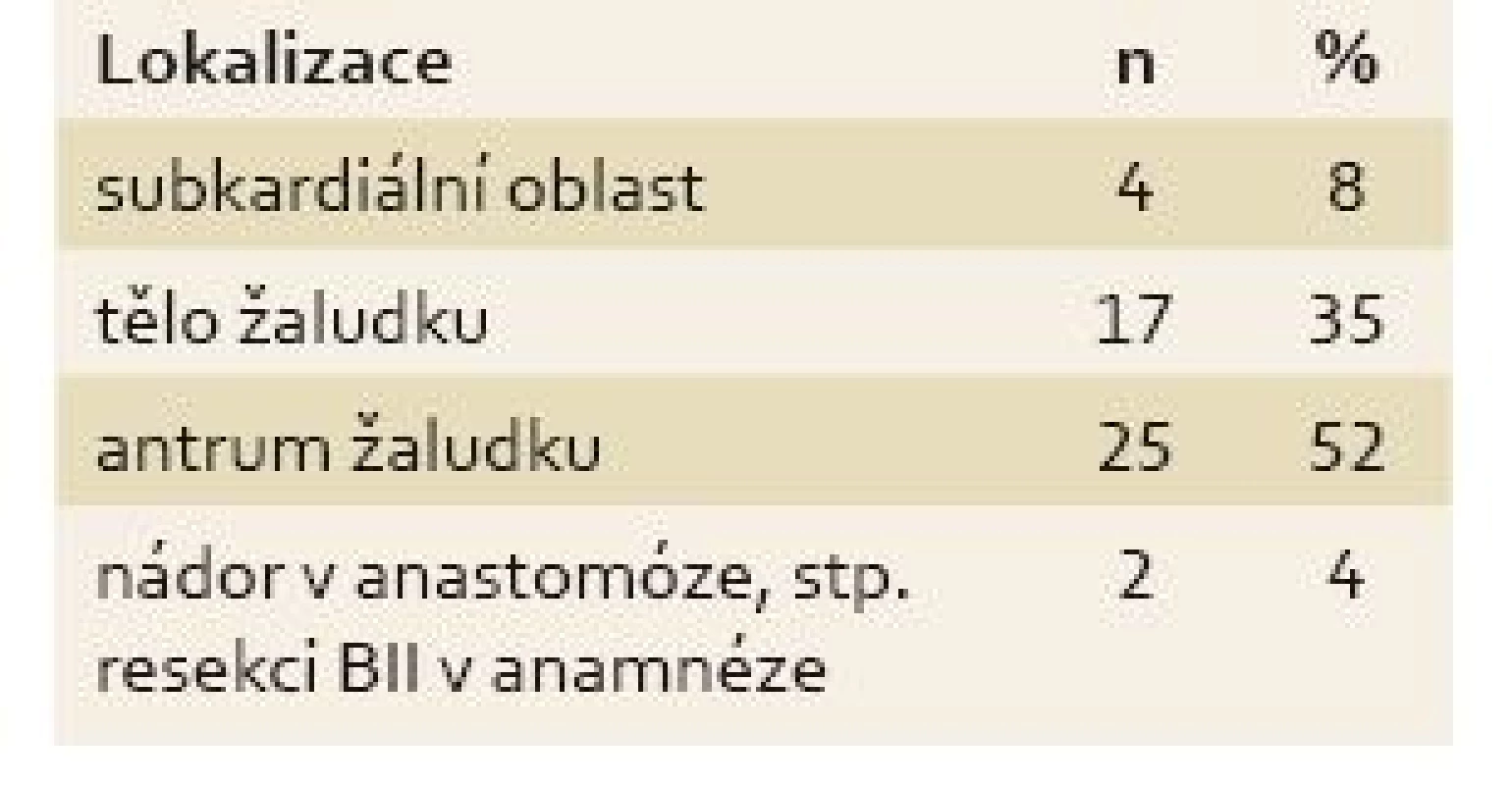
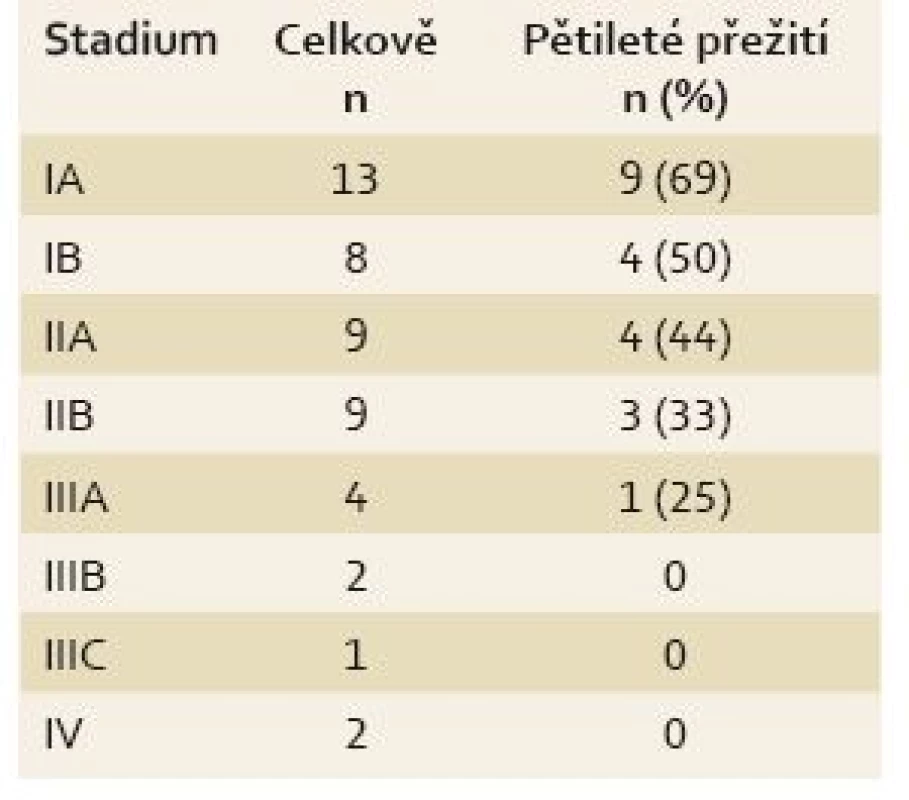
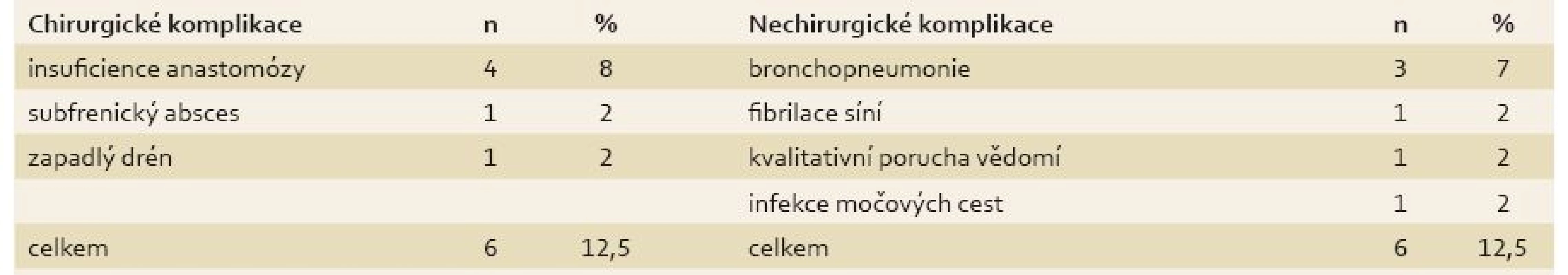
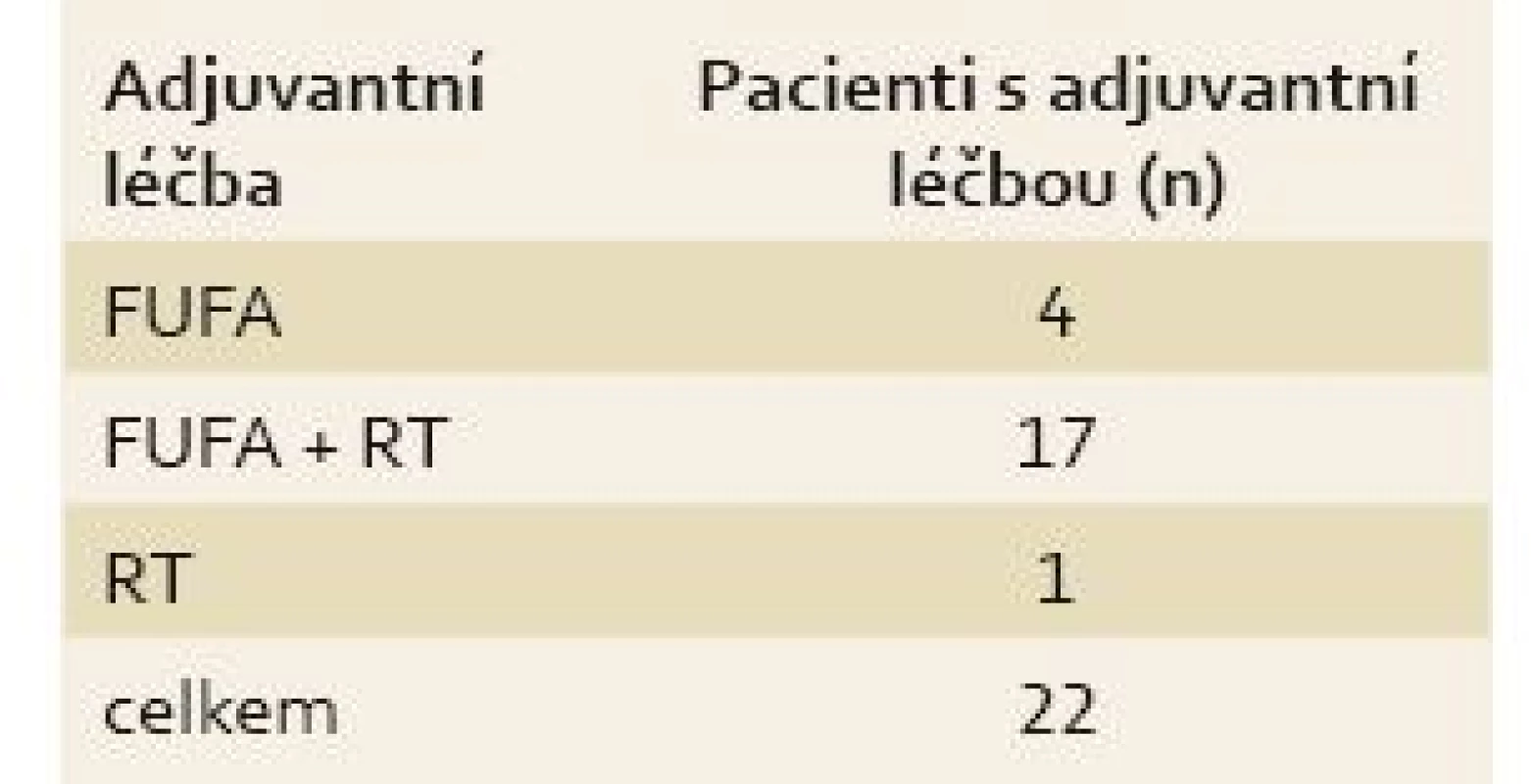
U všech pacientů byla provedena radikální operace. Lokalizaci nádorů udává tab. 1. Totální gastrektomie byla provedena u 23 pacientů, subtotální u 25 pacientů. V sedmi případech byla resekce žaludku doplněna splenektomií, ve dvou případech resekcí kaudy pankreatu. Ve dvou případech byla současně provedena extraanatomická resekce jater. Typů rekonstrukcí zažívacího traktu bylo užito několik, nejčastěji za pomoci ezofagojejuno - či gastrojejunoanastomózy Roux-en-Y. Histologicky se jednalo vždy o adenokarcinom. Intestinální typ nádoru byl patologem popsán 9×, difuzní typ 19×, u zbývajících nádorů nebyl takto specifikován. Zastoupení jednotlivých klinických stadií nemoci udává tab. 2. Dva pacienti měli současně metastázu jater, která byla odstraněna společně s primárním nádorem žaludku. Celkově pět let přežilo 21 nemocných (43,7 %). Medián přežití ve sledovaném období je 37,6 měsíce (graf 1). Přežití pacientů v jednotlivých klinických stadiích je uvedeno v tab. 2. Prokázali jsme vztah mezi klinickým stadiem nemoci a přežitím – stadium IA vs. IV (p < 0,032). DFS medián 17,2 měsíce, průměr 2,1 roku, 95% CI 1,1; 3,8 let. Mortalita 30denní je 0,022 (0,020; 0,024). Mortalita 90denní je 0,044 (0,040; 0,050). Pooperační chirurgické komplikace se vyskytly u 12,5 % pacientů, nechirurgické komplikace u 12,5 % pacientů (tab. 3). D1 lymfadenektomie byla provedena u 30 pacientů, D2 u 18 pacientů. Při D1 lymfadenektomii bylo odstraněno průměrně 14,5 uzlin, při D2 15,8 uzlin. Rozsah lymfadenektomie D1 vs. D2 neměl v našem souboru vliv na délku přežití nemocných celkově a ani v jednotlivých stadiích nemoci (p = 0,189) (graf 2). Naopak, statisticky významný rozdíl v dlouhodobém přežití byl nalezen v případech, kdy podíl histologicky negativních uzlin z celkového počtu vyšetřených uzlin byl vyšší než 60 % (p < 0,0001). Rozsah resekce žaludku ani pooperační komplikace neměly v našem souboru vliv na OS (p = 0,625; p = 0,268). Adjuvantní onkologická léčba byla indikována u 73 %, nakonec podána a dokončena u 22 (46 %) pacientů, u zbývajících pacientů nebyla léčba podána či dokončena pro jejich nesouhlas či nežádoucí účinky (tab. 4). Adjuvantní léčba neprodloužila OS, ale prodloužila DFS (kombinace FUFA s radioterapií; p < 0,033).


Diskuze
Adenokarcinom žaludku je onemocnění s vážnou a obvykle nepříznivou prognózou. Přestože incidence adenokarcinomu žaludku poklesla proti roku 1970 téměř o polovinu, morbitida zůstává v poměru k incidenci na stejné úrovni (graf 3). Důvod pro razantní pokles incidence není zcela jasný, ale nesporně se na něm podílí změna životního stylu (vyšší podíl čerstvé stravy, konzervace mrazem spíše než uzením, solením apod.). Nelze opominout ani zvyšující se eradikaci infekce Helicobacter pylori, případně jiné, dosud nepoznané faktory zevního prostředí. Incidence karcinomu žaludku tak sleduje v našich podmínkách zcela opačný trend než kolorektální karcinom, jehož výskyt trvale narůstá. Incidence adenokarcinomu žaludku dosahuje maxima po sedmém decenniu. Pokud sledujeme podrobně incidenci dle stadií nemoci v době diagnózy, narůstá mírně v posledních letech zastoupení stadia I a II, což je dáno nepochybně zlepšením diagnostiky (graf 4). Pětileté přežití pacientů se udává ve 30,4 % [1]. Data v našem souboru ukazují o něco lepší výsledky, což je zajisté způsobeno malým počtem nemocných a relativně vysokým počtem pacientů v nižších klinických stadiích. Přežití pacientů v jednotlivých stadiích je prakticky ve shodě s literárními údaji (tab. 5). Pro upřesnění dat by bylo vhodné soubor rozšířit o více pacientů a připojit výsledky i z jiných pracovišť. Délka přežití je závislá na stadiu nemoci, a proto je včasné určení diagnózy pro pacienta rozhodující. Systémová protinádorová léčba není dostatečně účinná a pouze kompletní odstranění nádoru (R0 resekce) dává pacientům šanci na vyléčení. Odstranění nádorů je v současnosti možné endoskopickou cestou u lézí Tis a T1a, u ostatních stadií je nutný chirurgický výkon, konvenční či laparoskopický [2–4]. Onkologická radikalita a prognóza nemocných je srovnatelná u laparoskopické i konvenční operace. Laparoskopická resekce prodlužuje operační čas [5,6]. Z histopatologického hlediska se rozlišuje intestinální a difuzní typ adenokarcinomu žaludku (Laurenova klasifikace). U nádorů intestinálního typu lokalizovaných ve výtokové části žaludku je doporučena subtotální resekce žaludku. V ostatních případech je doporučena totální gastrektomie [7–9]. Resekce má být provedena s dostatečným lemem zdravé tkáně, více než 4 cm u nádorů intestinálního typu, nad 8 cm u difuzního typu. Resekční výkon by měl být doplněn D2 lymfadenektomií (odstranění spádových lymfatických uzlin při truncus ceoliacus, podél arteria hepatica communis, arteria lienalis a arteria gastrica sinistra). Mělo by být odebráno minimálně 15 lymfatických uzlin. D2 lymfadenektomie přináší lepší přežití nemocným ve stadiu II a IIIA, v ostatních stadiích nemoci lepší výsledky nepřinesla [10]. V našem souboru jsme neprokázali rozdíl v přežití nemocných u D1 vs. D2 lymfadenektomie, což může být způsobeno malým rozdílem v počtu odebraných uzlin při D1 vs. D2 lymfadenektomii. Uvádí se, že D2 lymfadenektomie je spojena s větším množstvím komplikací, zejména poraněním pankreatu, a prodlužuje operační čas [11–13]. V našem souboru jsme větší počet komplikací po D2 lymfadenektomii neměli. Splenektomie není doporučena, pokud nádor nezasahuje do hilu sleziny [14]. Možností rekonstrukce kontinuity gastrointestinálního traktu je několik, v naší sestavě byla nejčastěji užita rekonstrukce typu Roux-en-Y. Výskyt chirurgických pooperačních komplikací je nízký [15]. V literatuře se často uvádí negativní vliv pooperačních komplikací na přežití nemocných, v našem souboru jsme tento vliv nepotvrdili [16]. Systémová protinádorová léčba spočívá v podání chemoterapie a radioterapie. Neoadjuvantní léčba zvyšuje procento resekabilních nádorů, ale neprokázal se zatím vliv na OS [17]. U žádného pacienta v našem soboru nebyla neoadjuvantní léčba podána. Adjuvantní léčba snižuje počet lokálních recidiv, prodlužuje DFS i OS [18–20]. Dle studie ARTIST je efekt systémové léčby zřejmý u intestinálního typu adenokarcinomu a při pozitivních uzlinách [20]. V našem souboru prodloužila adjuvantní léčba DFS, ale nevedla k prodloužení OS.


![Stadium nemoci a pětileté přežití, databáze SEER, 7. edice AJCC manuál [10].
Tab. 5. Stage of the disease and 5-year survival rate, the SEER database, 7<sup>th</sup> edition AJCC manual [10].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/cb1d5abfde9a83a891b5d0aab4e5d525.jpg)
Závěr
Adenokarcinom žaludku představuje nemoc s vážnou prognózou závislou především na stadiu nemoci. Podmínkou léčebného úspěchu je časné určení diagnózy. Pouze kompletní odstranění nádoru dává pacientům šanci na vyléčení. V současnosti je výkonem volby totální či subtotální gastrektomie doplněná D2 lymfadenektomií. V našem souboru jsme neprokázali pozitivní vliv D2 lymfadenektomie na OS. Naopak statisticky významný rozdíl v dlouhodobém přežití byl nalezen v případech, kdy podíl histologicky negativních uzlin z celkového počtu vyšetřených uzlin byl vyšší než 60 %. Pooperační morbidita i mortalita je relativně nízká. Adjuvantní onkologická léčba neměla vliv na OS, ale prodloužila DFS.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 4. 8. 2016
Přijato: 18. 9. 2016
as. MUDr. Filip Pazdírek
Chirurgická klinika 2. LF UK a FN v Motole
V Úvalu 84
150 06 Praha 5
filip.pazdirek@gmail.com
Sources
1. Washington K. 7th edition of the AJCC cancer staging manual: stomach. Ann Surg Oncol 2010; 17 (12): 3077–3079. doi: 10.1245/s10434-010-1362-z.
2. Ono H, Kondo H, Gotoda T et al. Endoscopic mucosal resection for treatment of early gastric cancer. Gut 2001; 48 (2): 225–229.
3. Soetikno R, Kaltenbach T, Yeh R et al. Endoscopic mucosal resection for early cancers of the upper gastrointestinal tract. J Clin Oncol 2005; 23 (20): 4490–4498.
4. Tanaka M, Ono H, Hasuike N et al. Endoscopic submucosal dissection of early gastric cancer. Digestion 2008; 77 (Suppl 1): 23–28. doi: 10.1159/000111484.
5. Cheng Q, Pang TC, Hollands MJ et al. Systematic review and meta-analysis of laparoscopic versus open distal gastrectomy. J Gastrointest Surg 2014; 18 (6): 1087–1099. doi: 10.1007/s11605-014-2519-z.
6. Xiong JJ, Nunes QM, Huang W et al. Laparoscopic vs open total gastrectomy for gastric cancer: a meta-analysis. World J Gastroenterol 2013; 19 (44): 8114–8132. doi: 10.3748/wjg.v19.i44.8114.
7. Songun I, Putter H, Kranenbarg EM et al. Surgical treatment of gastric cancer: 15-year follow-up results of the randomized nationwide Dutch D1D2 trial. Lancet Oncol 2010; 11 (5): 439–449. doi: 10.1016/ S1470-2045 (10) 70070-X.
8. Šimša J, Smejkal P. Chirurgická léčba karcinomu žaludku. Rozhl Chir 2012; 91 (8): 446–448.
9. Orditura M, Galizia G, Sforza V et al. Treatment of gastric cancer. World J Gastroenterol 2014; 20 (7): 1635–1649. doi: 10.3748/wjg.v20.i7.1635.
10. Siewert JR, Böttcher K, Stein HJ et al. Relevant prognostic factor in gastric cancer: ten-year results of the German Gastric Cancer Study. Ann Surg 1998; 228 (4): 449–461.
11. Schwarz RE, Smith DD. Clinical impact of lymphadenectomy extent in resectable gastric cancer of advanced stage. Ann Surg Oncol 2007; 14 (2): 317–328.
12. McCulloch P, Nita ME, Kazi H et al. Extended versus limited lymph nodes dissection technique for adenocarcinoma of the stomach. Cochrane Database Syst Rev 2012; 1: CD001964. doi: 10.1002/146 51858.CD001964.pub3.
13. Mocellin S, Nitti D. Lymphadenectomy extent and survival of patients with gastric carcinoma: a systematic review and meta-analysis of time-to-event data from randomized trials. Cancer Treat Rev 2015; 41 (5): 448–454. doi: 10.1016/j.ctrv.2015.03.003.
14. Yu W, Choi GS, Chung HY. Randomized clinical trial of splenectomy versus splenic preservation in patients with proximal gastric cancer. Br J Surg 2006; 93 (5): 559–563.
15. Bartlett EK, Rose RE, Kelz RR et al. Morbidity and mortality after total gastrectomy for gastric malignancy using the American College of Surgeons National Surgical Quality Improvement Program database. Surgery 2014; 156 (2): 298–304. doi: 10.1016/j.surg.2014.03. 022.
16. Li QG, Li P, Tang D, Chen J et al. Impact of postoperative complications on long-term survival after radical resection for gastric cancer. World J Gastroenterol 2013; 19 (25): 4060–4065.
17. Liao Y, Yang ZL, Peng JS et al. Neoadjuvant chemotherapy for gastric cancor. a meta-analysis of randomized, controlled trials. J Gastroenterol Hepatol 2013; 28 (5): 777–782. doi: 10.1111/jgh.12152.
18. Macdonald JS, Smalley SR, Benedetti J et al. Chemoradiotherapy after surgery compared with surgery alone for adenocarcinoma of the stomach or gastroesophageal junction. N Engl J Med 2001; 345 (10): 725–730.
19. Bang YE, Kim YW, Yang HK et al. Adjuvant capecitabine and oxaliplatin for gastric cancer after D2 gastrectomy (CLASSIC): a phase 3 open-label, randomised controlled trial. Lancet 2012; 379 (9813): 315–321. doi: 10.1016/S0140-6736 (11) 61 873-4.
20. Xu AM, Huang L, Liu W et al. Neoadjuvant chemotherapy followed by surgery versus surgery alone for gastric carcinoma: systematic review and meta-analysis of randomized controlled trials. Plos One 2014; 9 (1): e86941. doi: 10.1371/journal.pone.0086941.
Labels
Paediatric gastroenterology Gastroenterology and hepatology SurgeryArticle was published in
Gastroenterology and Hepatology
2016 Issue 5
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
- Současné principy screeningu kolorektálního karcinomu – od oportunního k populačnímu screeningovému programu
-
Mezioborová spolupráce ve screeningu kolorektálního karcinomu
Čekací doba na kolonoskopii - „Full-thickness“ endoskopická resekce lokální reziduální neoplazie v hepatální flexuře – videokazuistika
- Dlouhodobé výsledky po radikálních resekcích pro adenokarcinom žaludku
- Totální pankreatektomie a její současné místo v léčbě onemocnění pankreatu
- Modifikovaný FOLFIRINOX v léčbě karcinomu pankreatu – účinnost a toxicita
- Metastazující maligní melanom do trávicího traktu bez známého primárního ložiska
- Vzácná komplikace koloskopie – cholelitiáza s komplikacemi
- Prehepatální portální hypertenze
- Extraezofageální a gastroezofageální reflux – vztah k astma bronchiale
- 48th Annual Meeting of the European Pancreatic Club in Liverpool, 6–9th July 2016
- Zpráva z odborné stáže
- Výběr z mezinárodních časopisů
- Ursodeoxycholová kyselina
- „Watermelon stomach” jako první příznak cirhózy jater
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Modifikovaný FOLFIRINOX v léčbě karcinomu pankreatu – účinnost a toxicita
- Prehepatální portální hypertenze
- Extraezofageální a gastroezofageální reflux – vztah k astma bronchiale
- Totální pankreatektomie a její současné místo v léčbě onemocnění pankreatu
