Význam fekálního kalprotektinu v diagnostice a sledování dospělých a dětských pacientů s idiopatickými střevními záněty
Importance of faecal calprotectin in screening and clinical assessment of adult and pediatric patients with inflammatory bowel diseases
Inflammatory bowel diseases (IBDs) – Crohn’s disease, ulcerative colitis, and IBD unclassified – are chronic diseases affecting the gastrointestinal tract. Their incidence, especially in the pediatric population, is growing at an alarming rate. Patients with IBD have nonspecific symptoms such as abdominal pain and chronic diarrhea. Endoscopy with sampling for histological processing is needed for diagnosis. However, this approach is invasive and requires general anesthesia in children. Additionally, endoscopy is also required during monitoring of patients with IBD to elucidate the intestinal inflammatory activity. Consequently, there is a great need for a non-invasive and sensitive marker. Fecal calprotectin is a protein that is released from the cytoplasm of activated neutrophils, and its fecal level increases during bowel inflammation. It is an ideal non-invasive biomarker with high sensitivity and specificity that enables differentiation of IBD from functional conditions such as irritable bowel syndrome, monitoring of inflammatory activity, and prediction of clinical relapse of IBD. Especially in non-symptomatic IBD, a low concentration of calprotectin in stools predicts the persistence of clinical remission. This article provides an overview of the important role of fecal calprotectin in screening and monitoring of IBD, in addition to its limitations.
Key words:
diagnosis – faecal calprotectin – monitoring – variability – inflammatory bowel diseases
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Submitted:
20. 10. 2016
Accepted:
29. 11. 2016
:
I. Čopová; O. Hradský; K. Zárubová; L. Gonsorčíková; J. Bronský
:
Pediatrická klinika 2. LF UK a FN Motol, Praha
:
Gastroent Hepatol 2016; 70(6): 480-484
:
prolekare.web.journal.doi_sk:
https://doi.org/doi: 10.14735/amgh2016480
Idiopatické střevní záněty (IBD – inflammatory bowel disease) – Crohnova choroba, ulcerózní kolitida a nezařaditelná IBD – jsou chronická onemocnění postihující gastrointestinální trakt. Jejich incidence zvláště v pediatrické populaci alarmujícím způsobem roste. Manifestují se nespecifickými příznaky, jako je bolest břicha a chronický průjem. K diagnóze je nutné endoskopické vyšetření s odběrem vzorků k histologickému zpracování. Nevýhodou je invazivita vyšetření a nutnost provádění v celkové anestezii u dětí. Navíc jsou dané metody potřebné i v průběhu sledování pacientů s IBD k ozřejmění aktivity zánětu. Potřeba neinvazivního a dostatečně senzitivního markeru je vzhledem k výše uvedeným faktům značná. Kalprotektin je protein uvolňovaný především z cytoplazmy aktivovaných neutrofilů. Ke zvýšení jeho hladiny ve stolici dochází během zánětu ve střevě. Pro svou vysokou citlivost je považován za dobrý neinvazivní biomarker střevního zánětu. Umožňuje rozlišení zánětlivých onemocnění střev od funkčních poruch a sledování jejich aktivity. Do jisté míry jej lze využít také k predikci klinické recidivy IBD. U asymptomatických pacientů ukazuje nízká koncentrace kalprotektinu ve stolici trvání klinické remise. Následující přehledový článek pojednává o možnostech využití fekálního kalprotektinu jako neinvazivního markeru v diagnostice a sledování pacientů s IBD.
Klíčová slova:
diagnóza – fekální kalprotektin – sledování – variabilita – idiopatické střevní záněty
Úvod
Idiopatické střevní záněty (IBD – inflammatory bowel disease) zahrnují dvě základní formy chronických střevních zánětů – Crohnovou nemoc (CD – Crohn’s disease) a ulcerózní kolitidu (UC – ulcerative colitis). V dospělé i dětské populaci incidence IBD stoupá [1,2] a ačkoli se v dětském věku stále jedná o poměrně vzácná onemocnění, u každého pacienta s dlouhodobými nebo opakovanými bolestmi břicha a průjmy bychom měli na tato onemocnění pomýšlet. Za nejpřesnější metodu v objektivizaci střevního zánětu je považována endoskopie s histologií [3]. Vzhledem k obtížnému rozlišení funkčních gastrointestinálních poruch a střevních zánětů je však nutné mít k dispozici marker, který pomůže neinvazivně s dostatečnou mírou pravděpodobnosti vyčlenit ty pacienty, u nichž není nutné endoskopické vyšetření provádět.
Výsledek endoskopického a histologického vyšetření je také používán k hodnocení aktivity onemocnění u pacientů s IBD [4,5]. Slizniční hojení (MH – mucosal healing) vypovídá o příznivém průběhu léčby CD i UC a je v současnosti považováno za jeden z cílů terapie dospělých i dětských pacientů s IBD [6–8]. Dosud jediným nástrojem ke zjištění MH je endoskopické vyšetření. Neinvazivní marker, který by byl schopen detekovat MH, by tedy snížil počet nutných endoskopických vyšetření.
Klíčové body:
- Co je fekální kalprotektin (FC) a jak jej měřit?
- Jak FC koreluje s endoskopickou a histologickou aktivitou IBD?
- Jak používat FC v detekci a diagnostice IBD?
- Jak používat FC ve sledování pacientů s IBD?
Co je FC a jak jej měřit?
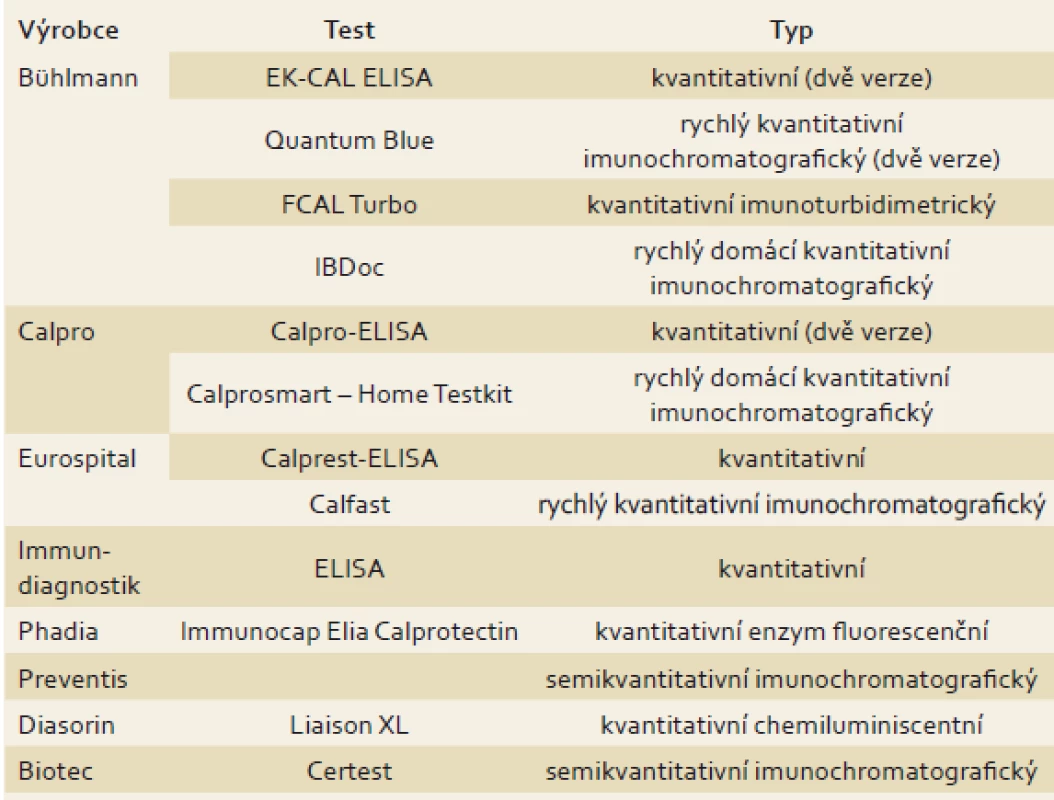
Kalprotektin je kalcium a zinek vázající protein patřící do rodiny S100 proteinů a představuje přibližně 5 % celkové buněčné bílkoviny a 60 % bílkoviny obsažené v cytozolu lidských neutrofilů [9]. Uvolňuje se především z neutrofilů, v menší míře také z monocytů a aktivovaných makrofágů [10]. Kalprotektin je odolný vůči bakteriální degradaci a jeho plazmatická hladina se může v průběhu zánětu zvýšit 5–40× [11]. U pacientů se střevními záněty se hladina FC zvyšuje proporčně se stupněm zánětu ve střevě [12]. Stavy vedoucí ke zvýšenému průniku neutrofilů přes střevní stěnu do lumen střeva způsobují elevaci FC ve stolici [13–15], FC lze tedy považovat za vysoce senzitivní, avšak nespecifický marker střevního zánětu. Výhodou FC je jeho odolnost vůči degradaci střevními bakteriemi a stálost při pokojové teplotě po dobu tří dnů [16], přičemž výsledky z jednorázového odběru vzorku jsou srovnatelné s výsledky z 24hodinového sběru stolice (r = 0,90) [9]. V roce 1992 byla představena první metoda k vyhodnocování FC – ELISA (enzyme-linked immunosorbent assay) s použitím králičí protilátky proti kalprotektinu [9]. Od té doby byly vyvinuty zdokonalené, komerčně dostupné a jednodušší ELISA metody, kterým ke zjištění výsledku stačí malé množství vzorku stolice (0,1 g) [17]. Navíc nejnovější eseje vykazují přesnější výsledek než třídenní exkrece 111indiem-značených granulocytů (r = 0,87) někdy považované za marker střevního zánětu [12]. Koncentrace FC je většinou udávána v mikrogramech na gram, někdy také v miligramech na litr, což byla původně používaná jednotka (50 µg/ g = 10 mg/ l). Vzhledem k tomu, že ELISA testování je časově náročnou metodou s dlouhou dobou zpracování a potřebou vysoce specializovaného personálu, byly vyvinuty nové metody – Q-POCT (point-of-care test) nebo bed-side FC testy, které se stávají dostupné a přinášejí řadu výhod, zejména v podmínkách primární péče nebo při potřebě rychlého výsledku (výsledek dostupný za < 30 min) [18–22]. Navíc nedávno uvedený domácí test na FC je založený na zpracování obrázku z „Lateral flow device“ pořízeného mobilním telefonem, který je následně odeslán přes mobilní telefon na cílový server, a výsledek se objeví po 15 s [23]. Využití rychlého semikvantitativního testu by mohlo být do budoucna výhodné v různých klinických situacích, jednak v diagnostice IBD a odlišení IBD od syndromu dráždivého tračníku (IBS – irritable bowel syndrome), zejména v rámci primární péče, dále v predikci relapsu u pacientů v remisi a hodnocení odpovědi na léčbu u pacientů s aktivní formou IBD. K hodnocení výsledků je nutné přistupovat vždy s ohledem na navržené cut-off hladiny, které je nutné ověřit v rozsáhlejších prospektivních studiích [24]. Přehled jednotlivých testů je uveden v tab. 1. Korelace mezi koncentracemi FC získanými pomocí použití jednotlivých testů se zdá být dobrá [21,25,26]. Hladiny FC by měly být vždy interpretovány vzhledem k použité metodě analýzy vzorku a stanovených cut-off hladin, které se u jednotlivých testů liší. Navíc dle nedávno publikovaných studií byla zjištěna významná intraindividuální variabilita FC u pacientů s aktivní formou IBD [16,27,28]. Proto je doporučeno opakování FC testu v případě výsledků neodpovídajících klinickému stavu.
Souhrn: FC je kalcium a zinek vázající protein obsažený v cytozolu neutrofilů, který je detekovatelný ve vzorku stolice v množství odpovídajícím stupni zánětu ve střevě. Výhodou FC je jeho odolnost vůči bakteriální degradaci a stálost při pokojové teplotě po dobu tří dnů. Hladina FC ve stolici je analyzována pomocí komerčně vyráběných ELISA metod. V současnosti jsou dostupné nové rychlé FC testy, a to semikvantitativní i kvantitativní, navíc také pro domácí použití s možností rychlého výsledku. Hladiny FC by měly být vždy interpretovány vzhledem k použité metodě analýzy vzorku a stanovených cut-off hladin, které se u jednotlivých testů liší. Byla zjištěna významná intraindividuální variabilita FC u pacientů s aktivní formou IBD, proto je doporučeno opakování FC testu v případě výsledků neodpovídajících klinickému stavu.
Jak FC koreluje s endoskopickou a histologickou aktivitou IBD?
Endoskopické vyšetření s odběrem bioptických vzorků zůstává „zlatým standardem“ v hodnocení střevního zánětu [29,30]. Toto vyšetření umožňuje stanovit rozsah a závažnost onemocnění a získat vzorky sliznice k histologickému vyšetření. Nevýhodou je invazivita vyšetření a potřeba důkladné přípravy, navíc u dětí probíhá vyšetření v celkové anestezii [29,30]. Proto pediatři často hodnotí aktivitu onemocnění pomocí klinických indexů, které zahrnují symptomy pacienta, klinické vyšetření a laboratorní parametry [31–33]. Pro hodnocení aktivity CD byly vyvinuty různé indexy, jako je index aktivity Crohnovy nemoci (CDAI, u dětí PCDAI) a Harvey-Bradshawův index [31,34], avšak několik studií potvrdilo, že hodnota FC je přesnější v hodnocení závažnosti střevního zánětu v porovnání s těmito indexy, zejména u dětské populace [35,36]. Jiná je situace u UC, kde na rozdíl od CD klinické obtíže více korespondují s endoskopickým nálezem. Příkladem je velmi dobrá korelace pediatrického indexu aktivity ulcerózní kolitidy (PUCAI) s endoskopickým nálezem, která dokonce převyšuje korelaci endoskopického nálezu s FC [37,38]. Zvyšující se zájem o roli FC v monitorování choroby vedl k četným studiím dokazujícím, že FC, zvláště u CD, lépe koreluje s histologickým než endoskopickým nálezem u dospělých i dětských pacientů [39–43].
U dětí s IBD popisují Fagerberg et al [44] významnou korelaci mezi FC a makroskopickou i mikroskopickou aktivitou střevního zánětu. Práce z našeho pracoviště [45] poukazuje na to, že FC lépe vypovídá o histologickém nálezu, a to i u pacientů s normálním endoskopickým nálezem, a proto může sloužit k detekci mikroskopického zánětu. Ačkoli některé ze studií ukazují, že FC je více zvýšen u kolických forem CD, vzhledem k rozporuplným výsledkům zatím není možné definitivně uzavřít, zda lokalizace zánětu významně ovlivňuje koncentrace FC [42,46].
Souhrn: Hodnota FC těsně koreluje s klinickým, endoskopickým a nejvýznamněji s histologickým nálezem u dospělých i dětských pacientů s IBD, a to se týká jak závažnosti, tak i rozsahu postižení střeva. U ileální formy CD mohou normální hodnoty FC vést k mylnému zhodnocení aktivity zánětu, a v této oblasti bude třeba dalších studií.
Jak používat FC v diagnostice IBD?
IBD se manifestuje nespecifickými příznaky, jako je chronická nebo recidivující břišní bolest a průjem. Přibližně 1/ 3 pacientů s IBD splňuje také Římská kritéria pro IBS [47]. Proto bývá odlišení IBD od IBS obtížné a může vést k prodlení v diagnóze IBD nebo naopak k nepotřebným endoskopiím u non-IBD pacientů nebo u pacientů s kombinací IBD a IBS [48,49]. Protože IBD může mít negativní dopad na růst a dospívání, je zejména u dětí důležitá včasná diagnóza [50]. Opakovaně bylo zkoumáno, zda je FC vhodný jako neinvazivní marker k rozpoznání organických střevních onemocnění od funkčních poruch, a to jak pro dospělou, tak i dětskou populaci [46,47,51–57], a později byla získaná data hodnocena v metaanalýzách [58,59]. V metaanalýze zaměřené na vytipování pacientů, kteří musí podstoupit endoskopické vyšetření s podezřením na IBD pomocí FC, byla senzitivita 97,8 % (95% CI 94,7–99,6), avšak specificita byla jen 68,2 % (95% CI 50,2–86,3) při použití cut-off hladiny FC 50 µg/ g [59]. Nedávno publikovaná metaanalýza zahrnující šest studií u dospělých a sedm pediatrických prospektivních studií analyzovala senzitivitu a specificitu FC v odlišení IBD od non-IBD diagnóz [58]. Za použití cut-off hladiny FC 50 µg/ g byla zjištěna senzitivita 93 % (95% CI 0,85–0,97) a specificita 96 % (95% CI 79–99) u dospělých pacientů a 92 % (95% CI 84–96) a 76 % (95% CI 62–86) u dětí a adolescentů. Počet indikovaných endoskopických vyšetření by se tímto snížil o 67 % u dospělých a o 35 % u dětí.
Interpretace výsledků FC by měla být vztažena k použité metodě a konkrétnímu cut-off daného kitu. Obecně lze říci, že hladiny pod 50 µg/ g lze s vysokou pravděpodobností považovat za negativní. Ve vyšších hodnotách již ubývá přesnost a lze akceptovat, že s přihlédnutím k dalším okolnostem, v případě hodnot 50–300 µg/ g, bychom měli zopakovat vyšetření FC a u pacientů s hladinou FC opakovaně nad 300 µg/ g spíše již provést endoskopii. Je třeba upozornit, že jakákoli příměs krve např. z hemoroidu či pouhé drobné ragády může hodnotu FC zvýšit nad 300 µg/ g.
Diferenciální diagnostika zvýšených hodnot FC je široká. Kromě IBD může být hladina FC zvýšena u střevních infekcí, celiakie, cystické fibrózy, neoplazií nebo polypů a při užívání nesteroidních antiflogistik. U pacientů s IBD nejsme schopni rozlišit CD a UC nebo postižení tenkého či tlustého střeva jen na základě hladin FC [15], i když některé studie předpokládají vyšší hladiny FC u pacientů s UC způsobené přítomností hlenu a krve ve stolici [42,46].
Souhrn: FC je senzitivním neinvazivním biomarkerem k odlišení IBD od IBS. Jeho používání vede k optimalizaci indikace endoskopického vyšetření.
Jak používat FC ve sledování pacientů s IBD?
Pacienti s IBD se liší průběhem choroby, někteří mají chronicky aktivní onemocnění, jiní trpí opakovanými relapsy, ale jsou i pacienti v dlouhodobé remisi. Avšak většina pacientů v klinické remisi má určitý stupeň reziduálního slizničního zánětu [60]. V monitorování aktivity IBD v denní praxi je gastroenterology považováno hodnocení FC (74 %) za relevantnější v rozhodování o terapeutickém postupu než vyhodnocení klinické aktivity onemocnění (70 %), endoskopické aktivity (24 %) nebo laboratorních parametrů (6 %) [61]. V posledních letech je FC stále významněji používán jako důležitý biomarker střevního zánětu a informací o jeho využití v monitorování aktivity onemocnění přibývá [62–65]. Nicméně dosud nebyla publikována kontrolovaná randomizovaná studie, která by porovnávala terapeutický přístup založený na FC a bez použití FC, proto nelze jednoznačně potvrdit, že se s hodnocením FC kvalita péče o pacienty s IBD zlepšuje.
Níže je zmíněno několik studií, které v průběhu léčby pacientů s IBD sledovaly i hladinu FC. V průběhu indukční léčby pomocí výlučné enterální výživy se hladina FC snižovala a byla nalezena asociace mezi všemi markery zánětu, klinickými i systémovými, a FC [66]. Existuje několik studií zobrazujících změny v hladinách FC u pacientů léčených anti-TNF-α preparáty [62–65]. V jedné prospektivní studii dosáhlo 58 % dospělých pacientů s UC léčených infliximabem (IFX) v indukčním režimu kompletní endoskopické remise a současně poklesu FC < 50 µg/ g nebo alespoň o 80 % výchozí hodnoty [63]. Významný pokles FC byl doprovázen úplným MH u 1/ 3 dětí léčených IFX v období dvou týdnů od zahájení terapie [62]. Jiné studie zaměřené na predikci dlouhodobé remise ukázaly, že hladiny FC mezi druhým a šestým týdnem odrážejí dlouhodobou prognózu léčby IFX [67,68].
U dospělých IBD pacientů v remisi byly v průběhu 12 měsíců sledování nalezeny významné rozdíly v hladinách FC mezi relabující skupinou pacientů a pacienty bez relapsu, navíc u UC byl FC silnějším prediktorem klinického relapsu než u pacientů s CD [69,70]. Gisbert et al [71] prezentovali studii zahrnující 163 IBD pacientů s remisí trvající alespoň šest měsíců a prokázali 69% senzitivitu a 69% specificitu FC (cut-off hladina > 150 µg/ g) v predikci relapsu v průběhu jednoho roku pravidelného sledování. Metaanalýza šesti prospektivních studií s celkem 672 pacienty s IBD prokázala senzitivitu a specificitu FC 78 % (95% CI 72–83) a 73 % (95% CI 68–77) u pacientů s klinicky klidným IBD v predikci relapsu do jednoho roku (cut-off hladina > 150 µg/ g) [72]. Ve srovnání s pacienty bez relapsu měli relabující 3× vyšší předpoklad zvýšené hladiny FC (positive likelihood ratio 2,81). Pro pacienty s normální hodnotou FC (< cut-off) byla pravděpodobnost relapsu 31 % dle negative likelihood ratio. Některé studie byly také cílené na detekci relapsu u pacientů léčených biologickými preparáty [73–75]. Laharie et al [73] prospektivně sledovali 65 dospělých pacientů s aktivní luminální CD, kterým byl podáván IFX v indukčním režimu, po navození remise byla ponechána udržovací imunosupresivní léčba v monoterapii. Ve 14. týdnu studie byla zjištěna senzitivita 61 % a specificita 48 % FC (cut-off hladina > 130 µg/ g) v predikci relapsu v průběhu jednoho roku léčby. Navíc se zdá, že zvýšené hladiny FC po ukončení terapie IFX predikují hrozící relaps u pacientů s CD jako např. ve studii STORI [74], kde hladina FC > 300 µg/ g v době zařazení do studie byla nezávislým faktorem asociovaným s relapsem onemocnění do 4–6 týdnů od jeho vzestupu. Další studie prezentovala 52 IBD pacientů v hluboké remisi (FC < 100 µg/ g) po ukončení anti-TNF-α biologické léčby. V průběhu sledování zrelabovalo 31 % pacientů a ukázalo se, že jejich hladina FC byla konstantně zvýšena s mediánem 94 dnů před klinickým relapsem [76]. Zajímavá studie ukazuje sérii měření FC u pacientů s UC v klinické remisi na udržovací léčbě IFX se zjištěním, že pacienti, kteří zrelabovali, měli zvýšenou hladinu FC > 300 µg/ g již tři měsíce před relapsem [77].
V pediatrické populaci jsou data o používání FC v průběhu léčby IBD pacientů nedostatečná [37,78–80]. Sipponen et al [80] publikovali studii zahrnující 72 dětí s kolickou formou IBD v klinické remisi. V průběhu jednoho roku sledování došlo k relapsu v 35 % a pozitivní prediktivní hodnota FC (cut-off < 100 µg/ g) byla 0,39 a negativní prediktivní hodnota byla 0,75. Souhrnem lze říci, že když hladina FC zůstane v průběhu léčby nízká, je vysoká pravděpodobnost udržení klinické remise v následujícím roce.
I přesto, že je FC užitečným ukazatelem MH a byl použitý v monitorování odpovědi na léčbu IBD v klinické praxi i v několika studiích vč. klinického testování léčiv [42,67,81,82], doporučují členové pediatrického výboru ECCO v designu budoucích studií použít FC jen jako sekundární výstup vzhledem k jeho vysoké variabilitě vedoucí k nízké přesnosti a nedostatečně definovanému cut-off [83,84]. Při sledování IBD pacientů značí hladiny FC < 50–100 µg/ g s vysokou pravděpodobností MH. Na druhé straně vyšší hodnoty FC se stěží interpretují z důvodu velkého rozptylu hodnot [51,85]. Proto je důležité posuzovat nejenom aktuální hladiny FC, ale také trend vývoje v průběhu léčby. K zodpovězení těchto otázek bude třeba studií využívajících sériová měření FC při odpovědi na léčbu IBD a dokud nebudou k dispozici výsledky více takto zaměřených studií, nedoporučuje se u těchto pacientů eskalovat léčbu pouze na základě hladin FC. Jak již bylo zmíněno, tyto otázky by zodpověděla kontrolovaná randomizovaná studie porovnávající management bez použití FC a s použitím FC. Provedení takovéto studie komplikuje fakt, že je sporné, zda je v současné době etické řídit léčbu zcela bez použití FC.
Souhrn: Koncentrace FC < 150 μg/ g je známkou remise s nízkým rizikem relapsu u pacientů s IBD. Sledování vývoje hladin FC ukazuje jeho prediktivní význam pro dosažení terapeutického cíle, ale chybí intervenční studie k potvrzení užitečnosti FC v dlouhodobém sledování a v současnosti se nedoporučuje eskalovat terapii jen na základě hladin FC.
Závěr
Měření FC se ukázalo být vhodné k odlišení střevního onemocnění od funkčních poruch, zejména IBD od IBS. FC není specifický biomarker pro IBD a může být zvýšený za různých podmínek vedoucích k přestupu neutrofilů přes stěnu střeva do střevního lumen. FC se pro svou vysokou negativní prediktivní hodnotu hodí pro identifikaci symptomatických pacientů, u kterých je třeba provést endoskopické vyšetření pro podezření na IBD. FC také těsně koreluje s aktivitou onemocnění, a to jak u CD, tak i UC, a to přesněji než parametry zánětu v séru nebo klinické indexy u CD. FC proto umožňuje neinvazivní sledování aktivity onemocnění. Omezením při použití FC je složitá interpretace výsledků a nejednota v cut-off hodnotách. Pokud tedy nemáme k dispozici výsledky studie užívající stejný test, pak je rozumné řídit se doporučenými limity výrobce testu [39,57,86–89]. Další limitací je velká biologická variabilita, a to především u pacientů s aktivním onemocněním. Přes zmíněná omezení je v současné gastroenterologii, a především v péči o pacienty s IBD role kalprotektinu nezastupitelná.
Vznik publikace byl podpořen Grantovou agenturou UK v Praze, projekt číslo: 136215 a 246216 a Ministerstvem zdravotnictví ČR pro koncepční rozvoj výzkumných organizací 00064203 (FN Motol, Praha, ČR).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 20. 10. 2016
Přijato: 29. 11. 2016
MU Dr. Ivana Čopová
Pediatrická klinika
2. LF UK a FN Motol
V Úvalu 84
150 06 Praha 5
ivana.copova@fnmotol.cz
Sources
1. Molodecky NA, Soon IS, Rabi DM et al. Increasing incidence and prevalence of the inflammatory bowel diseases with time, based on systematic review. Gastroenterology 2012; 142 (1): 46–54. doi: 10.1053/j.gastro.2011.10.001.
2. Loftus EV Jr. Clinical epidemiology of inflammatory bowel disease: incidence, prevalence, and environmental influences. Gastroenterology 2004; 126 (6): 1504–1517.
3. Levine A, Koletzko S, Turner D et al. ESPGHAN revised porto criteria for the diag - nosis of inflammatory bowel disease in children and adolescents. J Pediatr Gastroenterol Nutr 2014; 58 (6): 795–806. doi: 10.1097/MPG.0000000000000239.
4. Sipponen T, Savilahti E, Kolho KL et al. Crohn’s disease activity assessed by fecal calprotectin and lactoferrin: correlation with Crohn’s disease activity index and endoscopic findings. Inflamm Bowel Dis 2008; 14 (1): 40–46.
5. Van Assche G, Dignass A, Panes J. The second European evidence-based consensus on the diagnosis and management of Crohn’s disease: definitions and diagnosis. J Crohns Colitis 2010; 4 (1): 7–27. doi: 10.1016/j.crohns.2009.12.003.
6. Neurath MF, Travis SP. Mucosal healing in inflammatory bowel diseases: a systematic review. Gut 2012; 61 (11): 1619–1635.
7. Vatn MH. Mucosal healing: impact on the natural course or therapeutic strategies. Dig Dis 2009; 27 : 470–475.
8. Pineton de Chambrun G, Peyrin-Biroulet L, Lémann M et al. Clinical implications of mucosal healing for the management of IBD. Nat Rev Gastroenterol Hepatol 2010; 7 (1): 15–29. doi: 10.1038/nrgastro. 2009.203.
9. Røseth AG, Fagerhol MK, Aadland E et al. Assessment of the neutrophil dominating protein calprotectin in feces. A methodologic study. Scand J Gastroenterol 1992; 27 (9): 793–798.
10. Bjerke K, Halstensen TS, Jahnsen F et al. Distribution of macrophages and granulocytes expressing L1 protein (calprotectin) in human Peyer’s patches compared with normal ileal lamina propria and mesenteric lymph nodes. Gut 1993; 34 (10): 1357–1363.
11. Bunn SK, Bisset WM, Main MJ et al. Fecal calprotectin: validation as a noninvasive measure of bowel inflammation in childhood inflammatory bowel disease. J Pediatr Gastroenterol Nutr 2001; 33 (1): 14–22.
12. Røseth AG, Schmidt PN, Fagerhol MK. Correlation between faecal excretion of indium-111-labelled granulocytes and calprotectin, a granulocyte marker protein, in patients with inflammatory bowel disease. Scand J Gastroenterol 1999; 34 (1): 50–54.
13. Sipponen T. Diagnostics and prognostics of inflammatory bowel disease with fecal neutrophil-derived biomarkers calprotectin and lactoferrin. Dig Dis 2013; 31 (3–4): 336–344. doi: 10.1159/000354689.
14. Sipponen T, Kolho KL. Fecal calprotectin in diagnosis and clinical assessment of inflammatory bowel disease. Scand J Gastroenterol 2015; 50 (1): 74–80. doi: 10.3109/00365521.2014.987809.
15. Shaoul R, Sladek M, Turner D et al. Limitations of fecal calprotectin at diagnosis in untreated pediatric Crohn’s disease. Inflamm Bowel Dis 2012; 18 (8): 1493–1497. doi: 10.1002/ibd.21875.
16. Lasson A, Stotzer PO, Öhman L et al. The intra-individual variability of faecal calprotectin: a prospective study in patients with active ulcerative colitis. J Crohns Colitis 2015; 9 (1): 26–32. doi: 10.1016/j.crohns. 2014.06.002.
17. Tøn H, Brandsnes, Dale S et al. Improved assay for fecal calprotectin. Clin Chim Acta 2000; 292 (1–2): 41–54.
18. Kolho KL, Turner D, Veereman-Wau - ters G et al. Rapid test for fecal calprotectin levels in children with Crohn disease. J Pediatr Gastroenterol Nutr 2012; 55 (4): 436–439.
19. Vestergaard TA, Nielsen SL, Dahlerup JF et al. Fecal calprotectin: assessment of a rapid test. Scand J Clin Lab Invest 2008; 68 (4): 343–347.
20. Lobatón T, Rodríguez-Moranta F, Lopez A et al. A new rapid quantitative test for fecal calprotectin predicts endoscopic activity in ulcerative colitis. Inflamm Bowel Dis 2013; 19 (5): 1034–1042. doi: 10.1097/MIB.0b013e3182802b6e.
21. Sydora MJ, Sydora BC, Fedorak RN. Validation of a point-of-care desk top device to quantitate fecal calprotectin and distinguish inflammatory bowel disease from irritable bowel syndrome. J Crohns Colitis 2012; 6 (2): 207–214. doi: 10.1016/j.crohns.2011.08.008.
22. Lobatón T, López-García A, Rodríguez-Moranta F et al. A new rapid test for fecal calprotectin predicts endoscopic remission and postoperative recurrence in Crohn’s disease. J Crohns Colitis 2013; 7 (12): e641–e651. doi: 10.1016/j.crohns. 2013.05.005.
23. Beyer A, Reinhard C, Weber J et al. P0320 Usability study of a smartphone-based calprotectin home test. Presented at: United European Gastroenterology Week 2015. 26–28th October 2015, Barcelona. Abstr. UEG15-ABS-2894.
24. Rogler G, Aldeguer X, Kruis W et al. Concept for a rapid point-of-care calprotectin diagnostic test for diagnosis and disease activity monitoring in patients with inflammatory bowel disease: expert clinical opinion. J Crohns Colitis 2013; 7 (8): 670–677. doi: 10.1016/j.crohns.2013.02.014.
25. Coorevits L, Baert FJ, Vanpoucke HJ. Faecal calprotectin: Comparative study of the quantum blue rapid test and an established ELISA method. Clin Chem Lab Med 2013; 51 (4): 825–831.
26. Elkjaer M, Burisch J, Voxen Hansen V et al. A new rapid home test for faecal calprotectin in ulcerative colitis. Aliment Pharmacol Ther 2010; 31 (2): 323–330. doi: 10.1111/j.1365-2036.2009.04164.x.
27. Calafat M, Cabré E, Mañosa M et al. High within-day variability of fecal calprotectin levels in patients with active ulcerative colitis: what is the best timing for stool sampling? Inflamm Bowel Dis 2015; 21 (5): 1072–1076. doi: 10.1097/MIB. 0000000000000349.
28. Kristensen V, Malmstrøm GH, Skar V et al. Clinical importance of faecal calprotectin variability in inflammatory bowel disease: intra-individual variability and standardisation of sampling procedure. Scand J Gastroenterol 2016; 51 (5): 548–555. doi: 10.3109/00365521.2015. 1117650.
29. Gisbert JP, McNicholl AG, Gomollon F. Questions and answers on the role of fecal lactoferrin as a biological marker in inflammatory bowel disease. Inflamm Bowel Dis 2009; 15 (11): 1746–1754. doi: 10.1002/ibd.20920.
30. Vieira A, Fang CB, Rolim EG et al. Inflammatory bowel disease activity assessed by fecal calprotectin and lactoferrin: correlation with laboratory parameters, clinical, endoscopic and histological indexes. BMC Res Notes 2009; 2 : 221. doi: 10.1186/1756-0500-2-221.
31. Hyams JS, Ferry GD, Mandel FS et al. Development and validation of a pediatric Crohn’s disease activity index. J Pediatr Gastroenterol Nutr; 12 (4): 439–447.
32. Turner D, Otley AR, Mack D et al. Development, validation, and evaluation of a pediatric ulcerative colitis activity index: a prospective multicenter study. Gastroenterology 2007; 133 (2): 423–432.
33. Malíčková K, Bortlík M, Ďuricová D et al. Fekální kalgranulin C u nemocných s idiopatickými střevními záněty. Gastroent Hepatol 2014; 68 (1): 10–13.
34. Bennebroek Evertsz’ F, Hoeks CC, Nieuwkerk PT et al. Development of the patient Harvey Bradshaw index and a comparison with a clinician-based Harvey Bradshaw index assessment of Crohn’s disease activity. J Clin Gastroenterol 2013; 47 (10): 850–856. doi: 10.1097/MCG.0b013e 31828b2196.
35. Jones J, Loftus EV Jr, Panaccione R, Chen LS et al. Relationships between disease activity and serum and fecal biomarkers in patients with Crohn’s disease. Clin Gastroenterol Hepatol 2008; 6 (11): 1218–1224. doi: 10.1016/j.cgh.2008.06. 010.
36. Tibble J, Teahon K, Thjodleifsson B et al. A simple method for assessing intestinal inflammation in Crohn’s disease. Gut 2000; 47 (4): 506–513.
37. Walkiewicz D, Werlin SL, Fish D et al. Fecal calprotectin is useful in predicting disease relapse in pediatric inflammatory bowel disease. Inflamm Bowel Dis 2008; 14 (5): 669–673. doi: 10.1002/ibd.20376.
38. Turner D, Griffiths AM, Veerman G et al. Endoscopic and clinical variables that predict sustained remission in children with ulcerative colitis treated with infliximab. Clin Gastroenterol Hepatol 2013; 11 (11): 1460–1465. doi: 10.1016/j.cgh.2013.04.049.
39. Schoepfer AM, Beglinger C, Straumann A et al. Fecal calprotectin correlates more closely with the Simple endoscopic score for Crohn’s disease (SES-CD) than CRP, blood leukocytes, and the CDAI. Am J Gastroenterol 2010; 105 (1): 162–169. doi: 10.1038/ajg.2009.545.
40. Xiang JY, Ouyang Q, Li GD et al. Clinical value of fecal calprotectin in determining disease activity of ulcerative colitis. World J Gastroenterol 2008; 14 (1): 53–57.
41. Langhorst J, Elsenbruch S, Mueller T et al. Comparison of 4 neutrophil-derived proteins in feces as indicators of disease activity in ulcerative colitis. Inflamm Bowel Dis 2005; 11 (12): 1085–1091.
42. Sipponen T, Kärkkäinen P, Savilahti E et al. Correlation of faecal calprotectin and lactoferrin with an endoscopic score for Crohn’s disease and histological findings. Aliment Pharmacol Ther 2008; 28 (10): 1221–1229. doi: 10.1111/j.1365-2036. 2008.03835.x.
43. Aomatsu T, Yoden A, Matsumoto K et al. Fecal calprotectin is a useful marker for disease activity in pediatric patients with inflammatory bowel disease. Dig Dis Sci 2011; 56 (8): 2372–2377. doi: 10.1007/ s10620-011-1633-y.
44. Fagerberg UL, Lööf L, Lindholm J et al. Fecal calprotectin: a quantitative marker of colonic inflammation in children with inflammatory bowel disease. J Pediatr Gastroenterol Nutr 2007; 45 (4): 414–420.
45. Hradsky O, Ohem J, Mitrova K et al. Fecal calprotectin levels in children is more tightly associated with histological than with macroscopic endoscopy findings. Clin Lab 2014; 60 (12): 1993–2000.
46. Schröder O, Naumann M, Shastri Y et al. Prospective evaluation of faecal neutrophil-derived proteins in identifying intestinal inflammation: combination of parameters does not improve diagnostic accuracy of calprotectin. Aliment Pharmacol Ther 2007; 26 (7): 1035–1042.
47. Tibble JA, Sigthorsson G, Foster R et al. Use of surrogate markers of inflammation and Rome criteria to distinguish organic from nonorganic intestinal disease. Gastroenterology 2002; 123 (2): 450–460.
48. Lasson A, Kilander A, Stotzer PO. Diag - nostic yield of colonoscopy based on symptoms. Scand J Gastroenterol 2008; 43 (3): 356–362.
49. Hillilä MT, Färkkilä MA. Prevalence of irritable bowel syndrome according to different diagnostic criteria in a non-selected adult population. Aliment Pharmacol Ther 2004; 20 (3): 339–345.
50. Berni Canani R, Terrin G, Borrelli O et al. Short - and long-term therapeutic efficacy of nutritional therapy and corticosteroids in paediatric Crohn’s disease. Dig Liver Dis 2006; 38 (6): 381–387.
51. Henderson P, Casey A, Lawrence SJ et al. The diagnostic accuracy of fecal calprotectin during the investigation of suspected pediatric inflammatory bowel disease. Am J Gastroenterol 2012; 107 (6): 941–949. doi: 10.1038/ajg.2012.33.
52. Otten CM, Kok L, Witteman BJ et al. Diagnostic performance of rapid tests for detection of fecal calprotectin and lactoferrin and their ability to discriminate inflammatory from irritable bowel syndrome. Clin Chem Lab Med 2008; 46 (9): 1275–1280. doi: 10.1515/CCLM.2008. 246.
53. Wright EK. Calprotectin or lactoferrin: do they help. Dig Dis 2016; 34 (1–2): 98–104. doi: 10.1159/000442935.
54. Carroccio A, Iacono G, Cottone M et al. Diagnostic accuracy of fecal calprotectin assay in distinguishing organic causes of chronic diarrhea from irritable bowel syndrome: a prospective study in adults and children. Clin Chem 2003; 49 (6 Pt 1): 861–867.
55. Diamanti A, Panetta F, Basso MS et al. Diagnostic work-up of inflammatory bowel disease in children: the role of calprotectin assay. Inflamm Bowel Dis 2010; 16 (11): 1926–1930. doi: 10.1002/ibd.21257.
56. Limburg PJ, Ahlquist DA, Sandborn WJ et al. Fecal calprotectin levels predict colorectal inflammation among patients with chronic diarrhea referred for colonoscopy. Am J Gastroenterol 2000; 95 (10): 2831–2837.
57. Schoepfer AM, Trummler M, Seeholzer P et al. Discriminating IBD from IBS: comparison of the test performance of fecal markers, blood leukocytes, CRP, and IBD antibodies. Inflamm Bowel Dis 2008; 14 (1): 32–39.
58. Van Rheenen PF, Van de Vijver E, Fidler V. Faecal calprotectin for screening of patients with suspected inflammatory bowel disease: diagnostic meta-analysis. BMJ 2010; 341: c3369. doi: 10.1136/bmj.c3369.
59. Henderson P, Anderson NH, Wilson DC. The diagnostic accuracy of fecal calprotectin during the investigation of suspected pediatric inflammatory bowel disease : a systematic review and meta-analysis. Am J Gastroenterol 2014; 109 (5): 637–645. doi: 10.1038/ajg.2013.131.
60. Saverymuttu SH, Camilleri M, Rees H et al. Indium 111-granulocyte scanning in the assessment of disease extent and disease activity in inflammatory bowel disease. A comparison with colonoscopy, histology, and fecal indium 111-granulocyte excretion. Gastroenterology 1986; 90 (5 Pt 1): 1121–1128.
61. Schoepfer AM, Vavricka S, Zahnd-Straumann N et al. Monitoring inflammatory bowel disease activity: Clinical activity is judged to be more relevant than endoscopic severity or biomarkers. J Crohns Colitis 2012; 6 (4): 412–418. doi: 10.1016/j.crohns.2011.09.008.
62. Hämäläinen A, Sipponen T, Kolho KL. Infliximab in pediatric inflammatory bowel disease rapidly decreases fecal calprotectin levels. World J Gastroenterol 2011; 17 (47): 5166–5171. doi: 10.3748/wjg.v17.i47.5166.
63. De Vos M, Dewit O, D’Haens G et al. Fast and sharp decrease in calprotectin predicts remission by infliximab in anti-TNF naïve patients with ulcerative colitis. J Crohns Colitis 2012; 6 (5): 557–562. doi: 10.1016/j.crohns.2011.11.002.
64. Molander P, af Björkesten CG, Mustonen H et al. Fecal calprotectin concentration predicts outcome in inflammatory bowel disease after induction therapy with TNF blocking agents. Inflamm Bowel Dis 2012; 18 (11): 2011–2017. doi: 10.1002/ibd.22863.
65. Sipponen T, Savilahti E, Kärkkäinen P et al. Fecal calprotectin, lactoferrin, and endoscopic disease activity in monitoring anti-TNF-alpha therapy for Crohn’s disease. Inflamm Bowel Dis 2008; 14 (10): 1392–1398. doi: 10.1002/ibd.20490.
66. Gerasimidis K, Nikolaou CK, Edwards CA et al. Serial fecal calprotectin changes in children with Crohn’s disease on treatment with exclusive enteral nutrition: associations with disease activity, treatment response, and prediction of a clinical relapse. J Clin Gastroenterol 2011; 45 (3): 234–239. doi: 10.1097/MCG.0b013e3181f39 af5.
67. Kolho KL, Sipponen T. The long-term outcome of anti-tumor necrosis factor- therapy related to fecal calprotectin values during induction therapy in pediatric inflammatory bowel disease. Scand J Gastroenterol 2014; 49 (4): 434–441. doi: 10.3109/00365521.2014.886719.
68. Mooiweer E, Severs M, Schipper ME et al. Low fecal calprotectin predicts sustained clinical remission in inflammatory bowel disease patients: a plea for deep remission. J Crohns Colitis 2015; 9 (1): 50–55. doi: 10.1093/ecco-jcc/jju003.
69. Burri E, Beglinger C. Faecal calprotectin – a useful tool in the management of inflammatory bowel disease. Swiss Med Wkly 2012; 142: w13557. doi: 10.4414/smw.2012.13557.
70. Costa F, Mumolo MG, Ceccarelli L et al. Calprotectin is a stronger predictive marker of relapse in ulcerative colitis than in Crohn’s disease. Gut 2005; 54 (3): 364–368.
71. Gisbert JP, Bermejo F, Pérez-Calle JL et al. Fecal calprotectin and lactoferrin for the prediction of inflammatory bowel disease relapse. Inflamm Bowel Dis 2009; 15 (8): 1190–1198. doi: 10.1002/ibd.20933.
72. Mao R, Xiao YL, Gao X et al. Fecal calprotectin in predicting relapse of inflammatory bowel diseases: a meta-analysis of prospective studies. Inflamm Bowel Dis 2012; 18 (10): 1894–1899. doi: 10.1002/ ibd.22861.
73. Laharie D, Mesli S, El Hajbi F et al. Prediction of Crohn’s disease relapse with faecal calprotectin in infliximab responders: A prospective study. Aliment Pharmacol Ther 2011; 34 (4): 462–469. doi: 10.1111/j.1365-2036.2011.04743.x.
74. Louis E, Mary JY, Vernier-Massouille G et al. Maintenance of remission among patients with Crohn ’ s disease on antimetabolite therapy after infliximab therapy is stopped. Gastroenterology 2012; 142 (1): 63–70. doi: 10.1053/j.gastro.2011.09. 034.
75. Molander P, Färkkilä M, Ristimäki A et al. Does fecal calprotectin predict short-term relapse after stopping TNF-blocking agents in inflammatory bowel disease patients in deep remission? J Crohns Colitis 2015; 9 (1): 33–40. doi: 10.1016/j.crohns.2014.06.012.
76. Molander P, Björkesten CG, Mustonen H et al. Fecal calprotectin concentration predicts outcome in inflammatory bowel disease after induction therapy with TNF blocking agents. Inflamm Bowel Dis 2012; 18 (11): 2011–2017. doi: 10.1002/ibd.22863.
77. De Vos M, Louis EJ, Jahnsen J et al. Consecutive fecal calprotectin measurements to predict relapse in patients with ulcerative colitis receiving infliximab maintenance therapy. Inflamm Bowel Dis 2013; 19 (10): 2111–2017. doi: 10.1097/ MIB.0b013e31829b2a37.
78. Diamanti A, Colistro F, Basso MS et al. Clinical role of calprotectin assay in determining histological relapses in children affected by inflammatory bowel diseases. Inflamm Bowel Dis 2008; 14 (9): 1229–1235. doi: 10.1002/ibd.20472.
79. Van Rheenen PF. Role of fecal calprotectin testing to predict relapse in teenagers with inflammatory bowel disease who report full disease control. Inflamm Bowel Dis 2012; 18 (11): 2018–2025. doi: 10.1002/ibd.22896.
80. Sipponen T, Kolho KL. Faecal calprotectin in children with clinically quiescent inflammatory bowel disease. Scand J Gastroenterol 2010; 45 (7–8): 872–877. doi: 10.3109/00365521003782389..
81. Rutgeerts P, Vermeire S, Van Assche G. Mucosal healing in inflammatory bowel disease: impossible ideal or therapeutic target? Gut 2007; 56 (4): 453–455.
82. Hämäläinen A, Sipponen T, Kolho KL. Infliximab in pediatric inflammatory bowel disease rapidly decreases fecal calprotectin levels. World J Gastroenterol 2011; 17 (47): 5166–5171. doi: 10.3748/wjg.v17.i47.5166.
83. Ruemmele FM, Hyams JS, Otley A et al. Outcome measures for clinical trials in paediatric IBD: an evidence-based, expert-driven practical statement paper of the paediatric ECCO committee. Gut 2015; 64 (3): 438–446. doi: 10.1136/ gutjnl - 2014-307008.
84. Letkovský J, Hlavatý T. Význam fekálneho kalprotektínu v diagnostike a liečbe nešpecifických črevných zápalových ochorení. Gastroent Hepatol 2015; 69 (1): 43–49. doi: 10.14735/amgh2015543.
85. Canani RB, Terrin G, Rapacciuolo L et al. Faecal calprotectin as reliable non-invasive marker to assess the severity of mucosal inflammation in children with inflammatory bowel disease. Dig Liver Dis 2008; 40 (7): 547–553. doi: 10.1016/j.dld. 2008.01. 017.
86. Kolho KL, Raivio T, Lindahl H et al. Fecal calprotectin remains high during glucocorticoid therapy in children with inflammatory bowel disease. Scand J Gastroenterol 2006; 41 (6): 720–725.
87. Day AS, Whitten KE, Sidler M et al. Systematic review: nutritional therapy in paediatric Crohn’s disease. Aliment Pharmacol Ther 2008; 27 (4): 293–307.
88. Costa F, Mumolo MG, Bellini M et al. Role of faecal calprotectin as non-invasive marker of intestinal inflammation. Dig Liver Dis 2003; 35 (9): 642–647.
89. Bunn SK, Bisset WM, Main MJ et al. Fecal calprotectin: validation as a noninvasive measure of bowel inflammation in childhood inflammatory bowel disease. J Pediatr Gastroenterol Nutr 2001; 33 (1): 14–22.
Labels
Paediatric gastroenterology Gastroenterology and hepatology SurgeryArticle was published in
Gastroenterology and Hepatology

2016 Issue 6
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole vs. Tramadol in Postoperative Analgesia
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Spasmolytic Effect of Metamizole
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
- Pediatric gastroenterology and hepatology
- Bariatrics
- Some genetic determinants of celiac disease, the role of HLA haplotyping in clinical settings and HLA-DQ haplotypes in a group of 306 pediatric patients
- Importance of faecal calprotectin in screening and clinical assessment of adult and pediatric patients with inflammatory bowel diseases
- Recent bariatric-metabolic surgery
- The duodenal-jejunal bypass liner (EndoBarrier®) for the treatment of type 2 diabetes mellitus in obese patients – efficacy and factors predicting optimal effects
- Results of interferon-free hepatitis C therapy in the Czech Republic in real-life
- Budesonide MMX (Cortiment® 9 mg) in the treatment of ulcerative colitis in real clinical practice
- Czech Society of Gastroenterology guidelines for diagnostic and therapeutic colonoscopy
- Echoes from Vienna
- 1st National Congress of Gastrointestinal Oncologywith international participation
- The selection from international journals
- Combination of sofosbuvir and velpatasvir (Epclusa®)
- Biosimilar infliximab in anti-TNF-naïve IBD patients – 1-year clinical follow-up
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Importance of faecal calprotectin in screening and clinical assessment of adult and pediatric patients with inflammatory bowel diseases
- Budesonide MMX (Cortiment® 9 mg) in the treatment of ulcerative colitis in real clinical practice
- Czech Society of Gastroenterology guidelines for diagnostic and therapeutic colonoscopy
- The duodenal-jejunal bypass liner (EndoBarrier®) for the treatment of type 2 diabetes mellitus in obese patients – efficacy and factors predicting optimal effects
