Ustekinumab – nová biologická léčba pro pacienty s Crohnovou chorobou
:
M. Lukáš
:
Klinické a výzkumné centrum pro střevní záněty ISCARE I. V. F. a. s., Praha
:
Gastroent Hepatol 2017; 71(2): 178-180
:
Drug Profile
prolekare.web.journal.doi_sk:
https://doi.org/doi: 10.14735/amgh2017178
Charakteristika
Ustekinumab je kompletně humánní, monoklonální IgG1 protilátka, která je složena z těžkých a lehkých řetězců kappa. Biologický poločas ustekinumabu je v průměru 3 týdny s individuální variabilitou (15–32 dnů). Při intravenózním podání indukční dávky byla vrcholová hodnota léku v týdnu 8 v průměru 125,2 ± 33,6 µg/ml, při podávání udržovací terapie 90 mg s.c. každých 8 týdnů byl rovnovážný stav dosažen po druhém podání subkutánní dávky a plazmatické hodnoty dosahovaly v průměru 2,51 ± 2,02 µg/ml. Nebyla prokázána sérová kumulace koncentrace ustekinumabu při udržovací terapii podávané v 8týdenních intervalech [1].
Farmakodynamický efekt
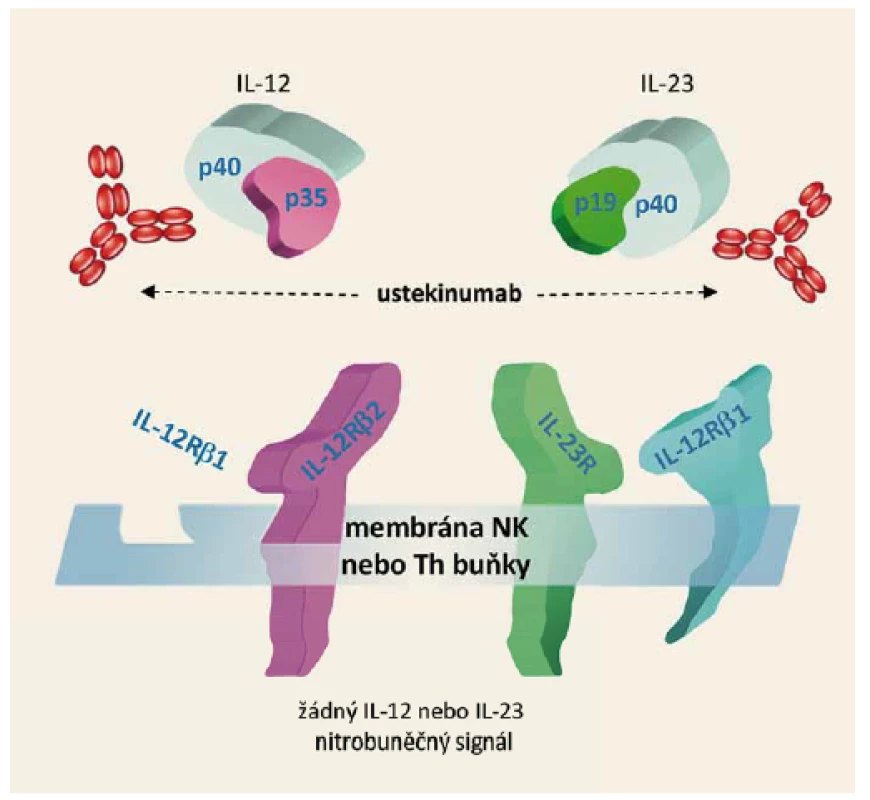
Farmakodynamický efekt spočívá ve vazbě ustekinumabu na proteinovou podjednotku p40, která je společná pro dva interleukiny IL-12 a IL-23. IL-12 a IL-23 jsou přirozeně se vyskytující cytokiny, které mají velký význam v zánětlivé a imunitní odpovědi. Jsou odpovědné za aktivaci tzv. NK buněk a diferenciaci CD4+ lymfocytů do Th1 a Th17 klonů. Po navázání ustekinumabu na podjednotku p40 je přerušena interakce těchto interleukinů s povrchovými receptory IL-12Rβ1, IL-12Rβ2 a IL-23Rβ1. Výsledkem je zablokování prozánětlivé signální dráhy IL-12/IL-23, s následným snížením aktivity Th1 a Th17 lymfocytů a potlačení tvorby dalších prozánětlivých cytokinů (obr. 1).
Klinické zkušenosti
Klinická studie na menším počtu nemocných prokázala dobrou účinnost ustekinumabu v porovnání s placebem u nemocných, kteří byli převážně biologicky naivní. Klinická odpověď v týdnu 8, jež byla definována snížením hodnoty CDAI o > 70 bodů, byla zaznamenána u 53 % pacientů na terapii ustekinumabem a u 30 % nemocných, kteří dostávali placebo (p = 0,02). Jestliže se porovnala efektivita subkutánního a intravenózního podání léčiva, potvrdilo se, že intravenózní aplikace je účinnější (43, resp. 54 % odpovědí) [2]. Ve druhé studii fáze IIb byl ustekinumab použit pouze u nemocných, kteří selhali na předcházející terapii min. jednou anti-TNF-α monoklonální protilátkou. Probandi byli randomizováni do jednoho z ramen dostávajících ustekinumab v dávce 1, 3 a 6 mg/kg nebo placebo. Výsledky ukázaly, že v týdnu 6 je poměr pacientů s prokazatelnou odpovědí na vyšším dávkování (6 mg/kg) nejvyšší, dosahoval 40 %. Nemocní, kteří odpověděli v týdnu 6, byli následně rerandomizováni na udržovací terapii podávanou subkutánně v dávce 90 mg s.c. nebo k placebu v týdnu 8 a 16. Opět se potvrdilo, že pacienti, kteří dostávali ustekinumab, měli významně lepší výsledky, vyjádřené v termínech remise (CDAI < 150) 41,7 vs. 27,4 % (p = 0,03) a klinické odpovědi (pokles CDAI o ≥ 100 bodů) 69,4 vs. 42,5 % (p < 0,001) [3].
Výsledky fáze III klinického hodnocení (UNITI) byly publikovány před několika měsíci [2]. Ve studii UNITI-1 se jednalo o randomizovanou, placebem kontrolovanou a dvojitě zaslepenou studii u nemocných s Crohnovou chorobou (CD – Crohn’s disease), kteří selhali na předcházející léčbě min. jednou monoklonální anti-TNF protilátkou. S ohledem na primární cíl (podíl nemocných s klinickou odpovědí v týdnu 6 – pokles CDAI o ≥ 100 bodů) se ukázalo, že ustekinumab je významně efektivnější než placebo. V rameni probandů, kteří dostali dávku ustekinumabu 6 mg/kg, byl počet významných klinických odpovědí zjištěn u 33,7 % z nich; u pacientů, u kterých byla indukční dávka 130 mg i.v. bez ohledu na tělesnou hmotnost, byla u 34,3 % z nich zjištěna klinická odpověď. Klinická remise (CDAI < 150) v týdnu 8 byla zjištěna u 20,9 % pacientů s indukční dávkou ~6 mg/kg tělesné hmotnosti. Významné rozdíly byly také zaznamenány u klinické odpovědi v týdnu 8 (37,8 vs. 33,5 vs. 20,2 %; p ≤ 0,001). Ve druhé indukční, randomizované, placebem kontrolované studii UNITI-2 zaměřené na pacienty se střední až vysokou aktivitou CD, kteří neodpověděli na léčbu konvenčními medikamenty – glukokortikoidy a/nebo imunosupresivy nebo měli při této léčbě závažné projevy intolerance nebo nežádoucí účinky, a dále pacienty, kteří mohli již dříve užívat ≥ 1 antagonistů TNF-α za předpokladu, že neměli nepřijatelné nežádoucí účinky antagonistů TNF-α a nebyli primárními nebo sekundárními nonrespondéry na anti-TNF-α. Klinická odpověď (pokles CDAI o ≥ 100 bodů) v týdnu 6 byla v rameni s adjustovaným dávkováním (~6 mg/kg i.v.) zjištěna u 55,5 % probandů, ve skupině s konstantní dávkou (130 mg i.v.) u 51,7 % a v rameni používající placebo u 28,7 %. Rozdíl oproti placebu byl statisticky významný (p < 0,01). V týdnu 8 byla klinická remise (CDAI < 150) dosažena u nemocných s adjustovanou léčbou ustekinumabem u 40,2 %; v rameni s konstantní dávkou u 30,6 % léčených. V placebové skupině byla remise potvrzena pouze u 19,6 % pacientů. Rozdíl byl statisticky vysoce signifikantní (p < 0,001). Dosažení odpovědi v týdnu 8 ve studiích UNITI-1 a UNITI-2 bylo podmínkou proto, aby byli nemocní rerandomizováni do udržovací fáze. Celkem bylo 397 nemocných zařazeno do tří udržovacích větví. V první dostávali probandi udržovací léčbu ustekinumab v dávce 90 mg s.c. 1× za 8 týdnů, ve druhé skupině ustekinumab 90 mg s.c. 1× za 12 týdnů subkutánně a ve třetí větvi dostávali léčení probandi placebo. Významně větší podíl nemocných na udržovací léčbě ustekinumabem v porovnání s placebem dosáhlo klinické remise v týdnu 44, celkem 53,1, resp. 48,8 % z nich. U nemocných na placebu byla klinická remise detekována u 35,9 % z nich. Rozdíl oproti skupinám dostávajícím účinnou látku byl statisticky signifikantní. V týdnu 44 celkem 46,9 % nemocných na ustekinumabu dosáhlo klinické remise bez nutnosti podávat glukokortikoidy, což byl významně vyšší poměr v porovnání s placebovou skupinou (29,8 %; p = 0,004). Diference v dosažení remise na ustekinumabu dávkovaného 1× za 8 týdnů byl oproti placebu 17,2 % a v režimu 1× za 12 týdnů 12,9 % [1].
Nežádoucí účinky
Výskyt závažných nežádoucích účinků byl ve studii IM-UNITI v porovnání s placebem nižší (9,9 vs. 15,0 %). Nebyly pozorovány žádné imunitně zprostředkované komplikace, jako jsou psoriáza, roztroušená skleróza nebo systémový lupus erythematodes. Imunogenicita ustekinumabu je nízká a detekce neutralizačních protilátek se pohybovala ve studiích s CD od 2,3 do 3,9 %. Sérové koncentrace léčiva korelovaly s počtem remisí. Hladina (trough) ustekinumabu v týdnu 8 vyšší než 4,5, resp. 5 µg/ml korelovala s klinickou, biologickou a endoskopickou odpovědí [4].
Lékové interakce
Nebyly zjištěny žádné závažné lékové interakce in vivo. V průběhu léčby ustekinumabem je kontraindikováno podávání živých vakcín. U pacientů s CD nebyla ovlivněna farmakokinetika ustekinumabu současným podáváním metotrexátu, nesteroidních antirevmatik, 6-merkaptopurinu, azathioprinu, perorálních kortikosteroidů nebo předchozí expozicí anti-TNF-α léky [5].
Slizniční hojení
Post hoc analýza pacientů léčených v udržovací fázi v týdnu 44 v projektu IM-UNITI ukázala, že při dávkování 90 mg s.c. 1× za 8 týdnů vykazuje 48,6 % snížení indexu SES-CD o > 3 body; 33,8 % má významnou endoskopickou odpověď a 21,6 % dosáhlo slizničního zhojení.
Odpověď pacientů s píštělemi
V podskupině pacientů s odtékajícími píštělemi při vstupu do studie (8,8 %; n = 26), dosáhlo za 44 týdnů 12 z 15 (80 %) ustekinumabem léčených pacientů reakce píštěle (definováno jako ≥ 50% snížení výchozích hodnot počtu odtékajících píštělí z indukční studie) v porovnání s 5 z 11 (45,5 %) pacienty exponovanými placebu [5].
Indikace a dávkování
Ustekinumab je indikován k léčbě nemocných s aktivní CD ve stadiu střední až vysoké aktivity, kteří:
- nereagují na konvenční terapii,
- nebo na ni dostatečně neodpověděli,
- nebo selhali na terapii anti-TNF preparáty,
- nebo u pacientů, kteří mají závažné nežádoucí účinky nebo projevy intolerance konvenční nebo anti-TNF terapie.
Indukční dávka ustekinumabu spočívá v intravenózním podání v závislosti na tělesné hmotnosti – u pacientů s hmotnosti ≤ 55 kg se podává intravenózní infuze v dávce 260 mg (dvě ampule à 130 mg); u osob s váhou 55 až ≤ 85 kg je doporučena dávka 390 mg (tři ampule à 130 mg) a pro pacienty s váhou > 85 kg dávka 520 mg i.v. (čtyři ampule i.v. à 130 mg). Udržovací terapie spočívá v subkutánním podávání 90 mg ustekinumabu. První dávku je doporučeno aplikovat v týdnu 8 a dále podle odpovědi a stavu pacienta ve 12-, resp. 8týdenních intervalech [5].
Tento článek vznikl s podporou společnosti Janssen-Cilag s.r.o.
prof. MUDr. Milan Lukáš, CSc.
Klinické a výzkumné centrumpro střevní záněty
ISCARE I.V.F. a. s.
Jankovcova 1569/2c
170 00 Praha
milan.lukas@email.cz
Sources
1. Feagan BG, Sandborn WJ, Gasink C et al. Ustekinumab as induction and maintenance therapy for Crohn’s disease. N Engl J Med 2016; 375 (20): 1946–1960.
2. Sandborn WJ, Feagan BG, Fedorak RN et al. A randomized trial of ustekinumab a human interleukin 12/23 monoclonal antibody in patients with moderate to severe Crohn’s disease. Gastroenterology 2008; 135 (4): 1130–1141. doi: 10.1053/j.gastro.2008.07.014.
3. Sandborn WJ, Gasink C, Gao LL et al. Ustekinumab induction and maintenance therapy in refractory Crohn’s disease. N Engl J Med 2012; 367 (16): 1519–1528. doi: 10.1056/NEJMoa1203572.
4. Battat R, Kopylov U, Bessissow T et al. Association of ustekinumab trough concentration with clinical, biochemical and endoscopic outcome. Presented at: 11th Congress of ECCO, Amsterdam 2016.
5. European medicines agency. Stelara®. [online]. Available from: http: //www.ema.europa.eu.
Labels
Paediatric gastroenterology Gastroenterology and hepatology SurgeryArticle was published in
Gastroenterology and Hepatology
2017 Issue 2
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
- Hepatology
- Czech Society of Hepatology guidelines for diagnosis and treatment of acute porphyrias
- Clinical practice guidelines for chronic hepatitis C virus infection
- Direct-acting antivirals in the treatment of HCV-associated malignant lymphomas
- Dysphagia after anterior cervical discectomy and interbody fusion
- A first case of electrical stimulation therapy of lower esophageal sphincter indicated in the Czech Republic for implantation
- The selection from international journals
- Picoprep® – a clearing agent with a new dosing schedule
- Ustekinumab – a new biological therapy for patients with Crohn’s disease
- Formation process of motor-evacuatory disorders in patients with gastroesophageal reflux disease and concomitant obesity
-
Developments in digestive endoscopy
Andrea May, Marco Bruno and Bjorn Rembacken Lectures – Gastro Update Europe 2016, Prague
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Ustekinumab – a new biological therapy for patients with Crohn’s disease
- Czech Society of Hepatology guidelines for diagnosis and treatment of acute porphyrias
- Picoprep® – a clearing agent with a new dosing schedule
- Dysphagia after anterior cervical discectomy and interbody fusion
