Migrace samoexpandibilního metalického stentu do drénované pseudocysty po endoskopické pseudocystogastrostomii a jeho endoskopická extrakce
Migration of a self-expandable metallic stent into a drained pseudocyst after endoscopic pseudocystogastrostomy and its endoscopic extraction
Pancreatic pseudocysts and walled-off pancreatic necrosis are local complications of acute and chronic pancreatitis. Their treatment, if indicated, consists of percutaneous, surgical or endoscopic drainage. In recent years, the increasingly preferred option is endoscopic ultrasound-guided transmural drainage for fluid collection. A relatively rare complication is the migration of an introduced stent after endoscopic drainage. We present a 52-year-old patient with chronic pancreatitis and a symptomatic pseudocyst, for which treatment by endoscopic pseudocystogastrostomy with a fully covered self-expanding metal stent was complicated by the development of a pneumoperitoneum. After surgical revision, the presence of an originally introduced stent in the residual pseudocyst was detected by imaging techniques and was subsequently successfully extracted by endoscopy through the newly introduced metallic stent.
Key words:
pancreatic pseudocyst – endoscopic ultrasound-guided transmural drainage – fully covered self-expanding metalic stent – stent migration
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Submitted: 15. 3. 2018
Accepted: 24. 4. 2018
Authors:
Martin Štěpán 1
; O. Urban 2,3,4; P. Fojtík 1; Přemysl Falt 1,3,4
Authors‘ workplace:
Centrum péče o zažívací trakt, Vítkovická nemocnice, a. s., Ostrava
1; II. interní klinika – gastroenterologická a hepatologická LF UP a FN Olomouc
2; LF OU v Ostravě
3; LF UK v Hradci Králové
4
Published in:
Gastroent Hepatol 2018; 72(3): 221-224
Category:
doi:
https://doi.org/10.14735/amgh2018221
Overview
Pankreatická pseudocysta a ohraničená pankreatická nekróza patří mezi lokální komplikace akutní a chronické pankreatitidy. Jejich léčba, pokud je indikovaná, spočívá v provedení perkutánní, chirurgické nebo endoskopické drenáže. V posledních letech je stále více upřednostňována endosonograficky navigovaná transmurální drenáž těchto tekutinových kolekcí. Mezi relativně vzácnou komplikaci řadíme migraci zavedeného stentu po provedené endoskopické drenáži. V naší kazuistice prezentujeme 52letého pacienta s chronickou pankreatitidou a symptomatickou pseudocystou, u kterého bylo indikováno provedení endoskopické pseudocystogastrostomie pomocí celopotaženého samoexpandibilního metalického stentu, která byla komplikována rozvojem pneumoperitonea. Po chirurgické revizi byla pomocí zobrazovacích metod zjištěna přítomnost původně zavedeného stentu v reziduální pseudocystě, který byl následně endoskopicky, skrze nově zavedený metalický stent, úspěšně extrahován.
Klíčová slova:
pseudocysta – endosonograficky navigovaná transmurální drenáž – celopotažený samoexpandibilní metalický stent – migrace stentu
Úvod
Mezi lokální komplikace akutní pankreatitidy řadíme, dle revidované Atlantské klasifikace z roku 2012, akutní peripankreatickou kolekci tekutiny, akutní nekrotickou kolekci, pankreatickou pseudocystu a ohraničenou pankreatickou nekrózu (WOPN – walled of pancreatic necrosis) [1,2]. Endosonograficky navigovaná drenáž je dnes již široce užívaná modalita v léčbě pankreatických tekutinových kolekcí. Komplikace této metody můžeme rozdělit na komplikace související s procedurou (krvácení, infekce, pankreatitida, perforace) a komplikace spojené se zavedením stentu (migrace, okluze a následná infekce) [3]. V endoskopickém managementu se uplatňuje široká škála akcesorní. K endoskopické drenáži pseudocyst se využívají především plastové double pigtail stenty. K drenáži WOPN se dříve rovněž nejčastěji využívaly plastové double pigtail stenty, které v těchto případech, díky svému tvaru, minimalizovaly riziko migrace stentu, ale kvůli úzkému lumen drenáže se vyskytovala okluze stentu až v 18 % případů, což vedlo k častým výměnám nebo zavedením dalších stentů [4,5]. Později vyvinuté samoexpandibilní metalické stenty měly sice širší lumen, a poskytovaly tak účinnější drenáž, avšak kvůli svému tubulárnímu tvaru byly spojeny s vyšším rizikem migrace [6]. Nově vyvinuté samoexpandibilní metalické stenty, speciálně navržené pro drenáž především WOPN (Niti-S NAGI™ a SPAXUS™ stenty od Tae Woong Medical, Jižní Korea; AXIOS™ stent od Boston Scientific, USA), mají upravené konce, které mají zabránit migraci stentu. Jejich výhodou je rychlé rozvinutí, spontánní vyprázdnění eventuálních nekrotických hmot a možnost endoskopické nekrektomie skrze široké lumen stentu. Jejich nevýhodou je vysoká cena, riziko migrace, k čemuž došlo i u našeho pacienta, krvácení při arozi cév uvnitř WOPN, perforace a superinfekce [7,8]. V našem případě pak byla provedena, jako zcela ojedinělá dle dostupných publikací [9,10], endoskopická extrakce migrovaného Niti-S NAGI™ stentu skrze následně zavedený stent AXIOS™, který migroval do dutiny pseudocysty po endosonograficky navigované drenáži.
Popis případu
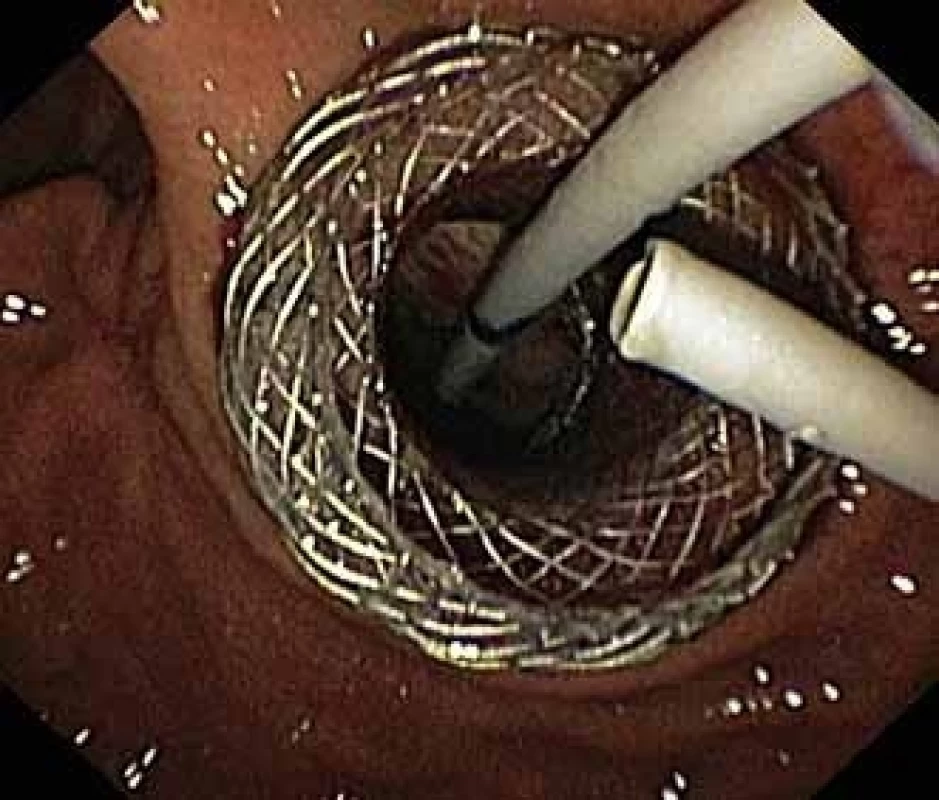
Pacient, 52 let, s anamnézou opakovaných exacerbací chronické alkoholické pankreatitidy, po splenektomii po traumatu, byl přijat na spádové gastroenterologické pracoviště pro nauzeu a bolesti břicha. Po jeho přijetí bylo provedeno CT břicha, které mimo známek chronické pankreatitidy (kalcifikace, atrofie pankreatu) prokázalo na rozhraní hlavy a těla pankreatu pseudocystu o průměru 10 cm naléhající a komprimující zadní stěnu antra žaludku. Laboratorně pak vstupně dominovaly vyšší jaterní enzymy (alaninaminotransferáza 2,87 µkat/l; aspartátaminotransferáza 4,63 µkat/l; alkalická fosfatáza 2,95 µkat/l; γ-glutamyltransferáza 9,49 μkat/l), lehce vyšší pankreatické enzymy (alfa-amyláza – AMS 3,40 µkat/l; lipáza 3,03 µkat/l) a nízké zánětlivé parametry (leukocytóza 8,68 × 10⁹/l; C reaktivní protein – CRP 11 mg/l). Vzhledem k přítomnosti symptomatické pseudocysty byla indikována endoskopická pseudocystogastrostomie. Výkon byl proveden v celkové anestezii, na zadní stěně těla žaludku bylo patrno vyklenutí tlakem pseudocysty, endosonograficky nebyla zjištěna přítomnost velkých cév mezi stěnou žaludku a pseudocystou. Následně byl mediogastricky proveden pokus o punkci pseudocysty cystotomem COOK, který však byl neúspěšný pro nestabilní pozici cystotomu a zdařil se až druhý pokus na rozhraní těla a antra žaludku. Nejdříve byla aspirována serózní nažloutlá tekutina s vysokou hladinou pankreatických enzymů a CA 19-9 (AMS 124 µkat/l; lipáza 639 µkat/l; CA 19-9 26 120 kU/l), cytologie byla bez nálezu maligních buněk. Vzhledem k tomu, že stěna pseudocysty a žaludku na sebe nenaléhaly, byla zvolena a provedena drenáž samoexpandibilním metalickým stentem Niti-S NAGI™ 20 × 16 mm. V den výkonu, ve večerních hodinách, došlo k rozvoji prudkých bolestí břicha. Následoval prostý snímek břicha, který prokázal pneumoperitoneum. Nález byl konzultován s chirurgem a bylo rozhodnuto o chirurgické revizi. Operace byla nejprve vedena laparoskopicky, pro četné srůsty s nemožností laparoskopické adheziolýzy bylo rozhodnuto o otevřené operaci. Na zadní stěně žaludku byla zjištěna drobná perforace a provedena její sutura. Vzhledem k mnohočetným adhezím a rozsáhlému peripankreatickému plastronu a nemožnosti dosažení samotné pseudocysty nebyl vlastní stent extrahován. Pacient byl poté zajištěn dvojkombinací antibiotik (amoxicilin a kyselina, metronidazol). Pooperační průběh byl nekomplikovaný a pacient byl 20. pooperační den dimitován. S odstupem 2 a 4 týdnů bylo provedeno kontrolní CT břicha s nálezem cystoidu pankreatu v průměru 47 mm s patrným migrovaným stentem (obr. 1). Na základě tohoto nálezu, předpokládané obtížnosti další operace, které navíc pacient nebyl nakloněn, bylo rozhodnuto o pokusu o endoskopickou extrakci migrovaného metalického stentu. Výkon byl proveden lineárním echoendoskopem, který lokalizoval cystoid s patrným stentem za zadní stěnou žaludku. Za pomoci endosonografické a skiaskopické kontroly byl do dutiny zaveden stent HOT AXIOS™ 10 × 15 mm (obr. 2). Poté byla provedena balonová dilatace kanálu stentu balonem Boston CRE 12–15 mm a do dutiny pseudocysty bylo proniknuto gastroskopem a migrovaný stent byl extrahován kleštěmi typu „krysího zubu“ (obr. 3 a 4). Do dutiny byl přes metalický stent na závěr zaveden ještě pojistný plastový double pigtail stent 10 Fr 5 cm (obr. 5). S odstupem dalších 2 měsíců byla patrna regrese pseudocysty na kontrolním CT břicha a stent HOT AXIOS™ jsme následně gastroskopicky extrahovali.
Fig. 1. Computer tomography of the abdomen showing a migrating Niti-S NAGI™ stent in a cystoid.
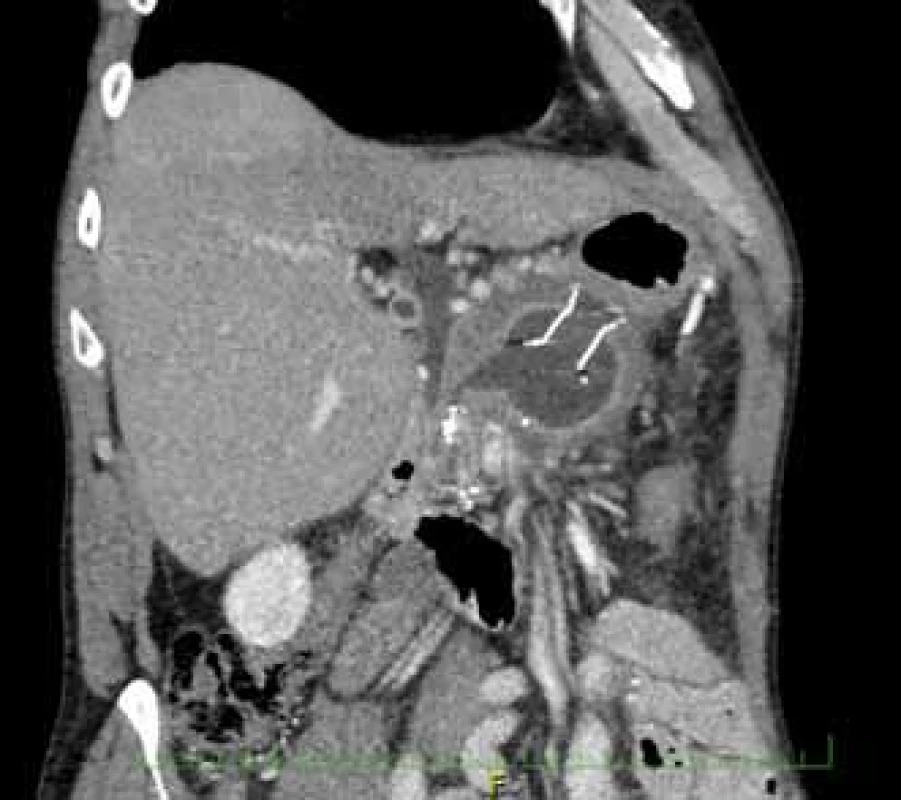
Fig. 2. Pseudocyst cavity with a HOT AXIOS™ stent and visible fibres of a Niti-S NAGI™ stent.
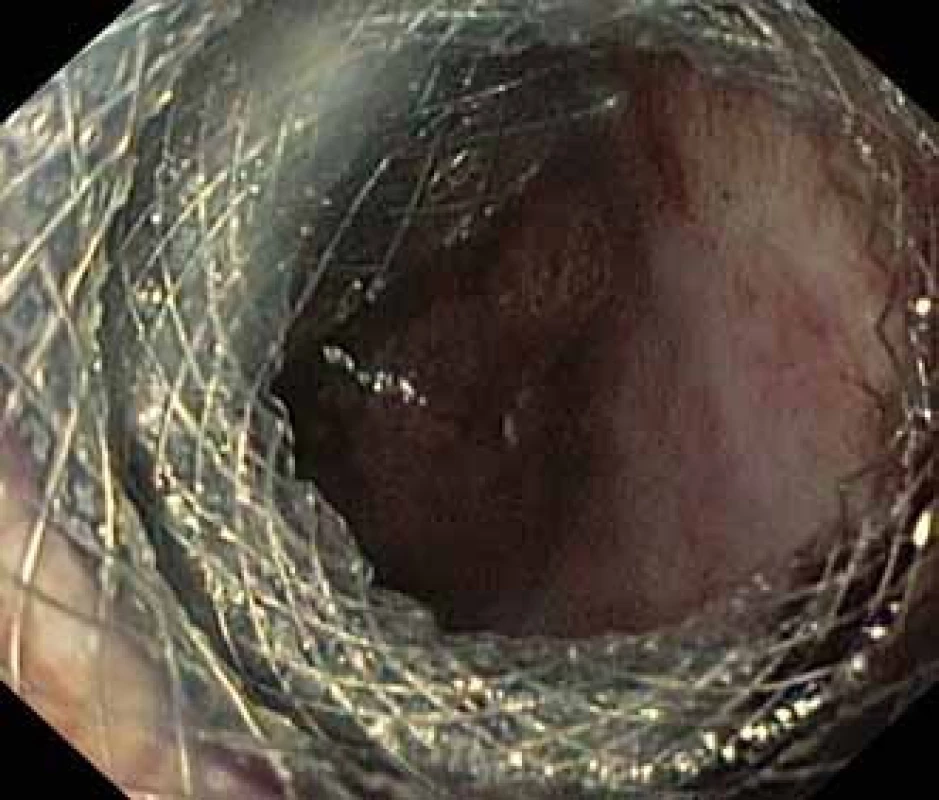
Fig. 3. Extraction of the Niti-S NAGI™ stent using a rat-tooth forceps.
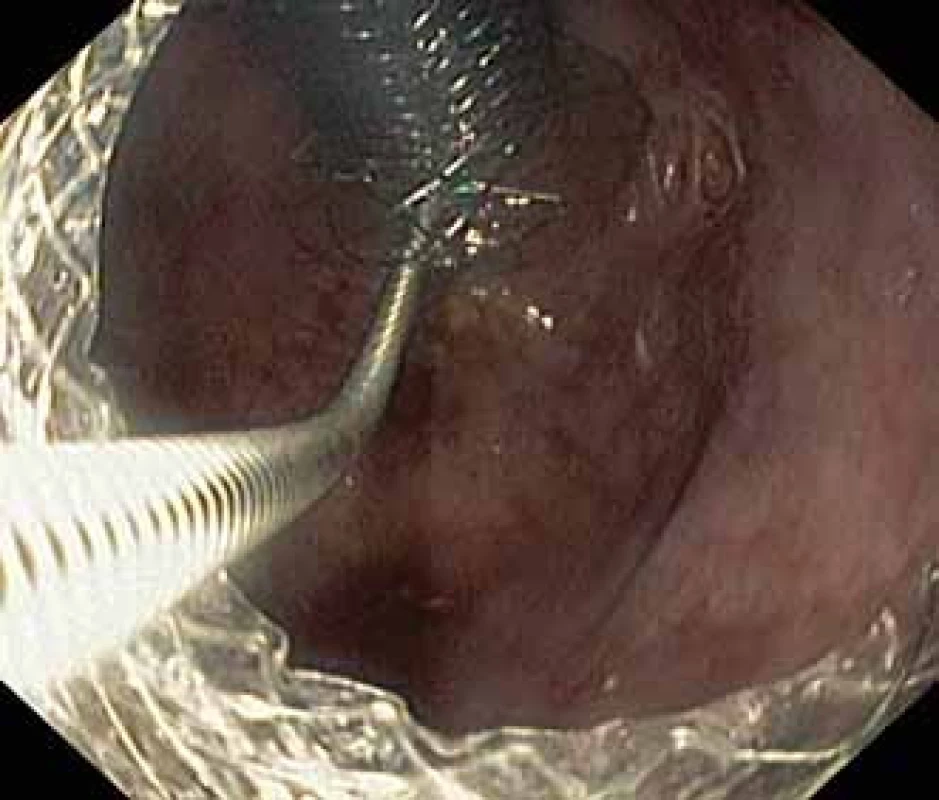
Fig. 4. Niti-S NAGI™ stent exctracted.
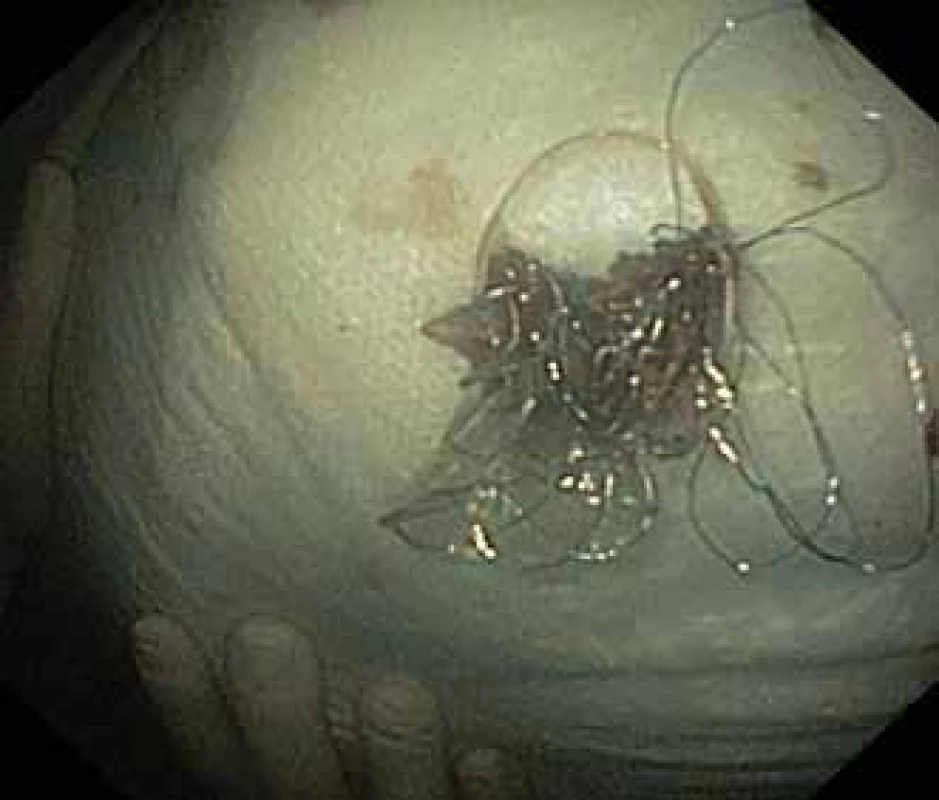
Fig. 5. A HOT AXIOS™ stent and a security plastic double pigtail stent.
Diskuze
Mezi komplikace endosonograficky navigované drenáže pseudocysty patří opožděná infekce (0–8 %), krvácení (0–9 %), retroperitoneální perforace (0–5 %) a dislokace stentu (4–6,5 %) [11]. Migrace stentu do drénované pankreatické tekutinové kolekce v průběhu provedené endoskopické drenáže nebo po ní je relativně vzácná komplikace. Nové samoexpandibilní metalické stenty, které byly vyvinuty k drenáži pseudocyst a WOPN, mají speciálně upravené konce tak, aby bylo riziko migrace stentu sníženo na minimum. I přes toto opatření se tato komplikace, při použití nových metalických stentů, raritně vyskytuje, jak prezentujeme i v našem případě. Tato komplikace je pak v závislosti na lokalizaci migrovaného stentu řešitelná chirurgicky, endoskopicky a byl popsán i případ kombinované gastroskopické transgastrické laparoskopické rendez-vous techniky [9,10].
V našem popisovaném případě došlo k časné migraci zavedeného stentu, pravděpodobně kvůli nepříznivé pozici cystoidu a zadní stěny žaludku. Při následné chirurgické revizi indikované pro rozvoj pneumoperitonea byla uzavřena perforace zadní stěny žaludku, ale nepříznivé anatomické poměry neumožnily revizi dutiny cystoidu a extrakci migrovaného stentu. Proto byl později zvolen endoskopický přístup se zpřístupněním dutiny cystoidu přechodným zavedením dalšího metalického stentu a extrakcí původního migrovaného stentu. K minimalizaci rizika migrace a traumatizace stěny cystoidu byl zaveden i pojistný plastový double pigtail stent [12].
Závěr
V našem sdělení prezentujeme endoskopickou extrakci migrovaného metalického stentu po pseudocystogastrostomii symptomatické pseudocysty, u pacienta s chronickou pankreatitidou, zavedením dalšího metalického stentu. Tento miniinvazivní postup může být ve specifických situacích výhodnější oproti operačnímu řešení, které je pravděpodobně zatíženo vyšším rizikem pooperačních komplikací.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 15. 3. 2018
Přijato: 24. 4. 2018
MUDr. Michal Štěpán
Centrum péče o zažívací trakt
Vítkovická nemocnice, a. s.
Zalužanského 1192/ 15, 703 84 Ostrava
Sources
1. Andrašina T, Bohatá Š. Zobrazovací metody u akutní pankreatitidy. In: Trna J, Kala Z. Klinická pankreatologie. 1. vyd. Praha: Mladá fronta 2016 : 43–54.
2. Banks PA, Bollen TL, Dervenis C et al. Classification of acute pankreatitis-2012: revision of the Atlanta classification and definitions by international consensus. Gut 2013; 62 (1): 102–111. doi: 10.1136/gutjnl-2012-302 779.
3. Chung IH, Kim HW, Lee DK. Endoscopic removal of a migrated cystogastrostomy double pigtail stent through a pancreatico-duodenal fistula tract. J Interv Gastroenterol 2011; 1 (3): 142–144. doi: 10.4161/jig.1.3.18515.
4. Singhal S, Rotman SR, Gaidhane M et al. Pancreatic fluid collection drainage by endoscopic ultrasound: an update. Clin Endosc 2013; 46 (5): 506–514. doi: 10.5946/ce.2013.46.5.5 06.
5. Lopes CV, Pesenti C, Bories E et al. Endoscopic-ultrasound-guided endoscopic transmural drainage of pancreatic pseudocysts and abscesses. Scand J Gastroenterol 2007; 42 (4): 524–529. doi: 10.1080/00365520601065 093.
6. Patil R, Ona MA, Papafragkakis C et al. Endoscopic ultrasound-guided placement of AXIOS stent for drainage of pancreatic fluid collections. Ann Gastroenterol 2016; 29 (2): 168–173. doi: 10.20524/aog.2016.0008.
7. Kliment M, Urban O, Fojtík P et al. Endoscopic drainage of pancreatic fluid collections – 6 years’ experience at a tertiary referral gastroenterological center in a period 2006–2012. Gastroent Hepatol 2017; 71 (3): 199–207. doi: 10.14735/amgh2017199.
8. Walter D, Vleggaar FP, Siersema PD. Self-expandable metal stents for endoscopic ultrasound-guided drainage of peripancreatic fluid collections. Gastrointest Interv 2013; 2 (1): 24–29. doi: 10.1016/j.gii.2013.01. 002.
9. Patrzyk M, Dierzek P, Glitsch A et al. Retrieval of a self-expanding metal stent after migration and incorporation in the omental bursa, using a gastroscopic-transgastric laparoscopic rendezvous technique. J Minim Access Surg 2015; 11 (3): 207–209. doi: 10.4103/0972-9941.147 365.
10. Lakhtakia S, Basha J, Nabi Z et al. Salvaging a malpositioned fully covered self-expanding metal stent for pancreatic fluid collection drainage. Endoscopy 2016; 48 (Suppl 1): E180–E181. doi: 10.1055/s-0042-106966.
11. Wang GX, Liu X, Wang S et al. Stent diplacement in endoscopic pancreatic pseudocyst drainage and endoscopic management. World J Gastroenterol 2015; 21 (7): 2249–2253. doi: 10.3748/wjg.v21.i7.2249.
12. Tarantino I, Di Pisa M, Barresi L et al. Covered self expandable metallic stent with flared plastic one inside for pancreatic pseudocyst avoiding stent dislodgement. World J Gastrointest Endosc 2012; 4 (4): 148–150. doi: 10.4253/wjge.v4.i4.148.
Labels
Paediatric gastroenterology Gastroenterology and hepatology SurgeryArticle was published in
Gastroenterology and Hepatology
2018 Issue 3
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
- Editorial šéfredaktora časopisu
- Digestivní endoskopie
- Cholangiopankreatoskopie – doporučený postup České gastroenterologické společnosti ČLS JEP
- Endoskopická transmurální resekce v léčbě lokálních reziduálních neoplazií tlustého střeva – analýza souboru 19 pacientů
- Případ maligního melanomu metastazujícího do pankreatu
- Úspěšná léčba krvácení z aortoezofageální píštěle metalickým samoexpandibilním stentem
- Migrace samoexpandibilního metalického stentu do drénované pseudocysty po endoskopické pseudocystogastrostomii a jeho endoskopická extrakce
- Adenóm Brunnerových žliaz – zriedkavá príčina krvácania z gastrointestinálneho traktu
- Příspěvek k problematice hepatorenálního poškození a selhání
- Naše zkušenosti s léčbou masivního krvácení u Crohnovy nemoci pomocí anti-TNF terapie
- Intoxikácia Amanita phalloides – stále aktuálny problém?
- Tumorózní atrioezofageální píštěl jako neobvyklý zdroj sepse
- Nový člen redakční rady časopisu
- 40th Czech and Slovak Endoscopic Days 19th Endoscopic Day IKEM
- Výběr z mezinárodních časopisů
- Vistaprep – standard přípravy střeva před koloskopickým vyšetřením
- Srovnání endoskopické slizniční resekce a endoskopické submukózní disekce při léčbě plochých neoplastických lézí konečníku
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Vistaprep – standard přípravy střeva před koloskopickým vyšetřením
- Tumorózní atrioezofageální píštěl jako neobvyklý zdroj sepse
- Intoxikácia Amanita phalloides – stále aktuálny problém?
- Naše zkušenosti s léčbou masivního krvácení u Crohnovy nemoci pomocí anti-TNF terapie
