Inhibítory protónovej pumpy vo svetle klinických štúdií a bezpečnostný profil ich dlhodobého užívania
Proton pump inhibitors in the light of clinical studies and the safety profile of long-term use
Proton pump inhibitors are currently one of the most frequently used medicinal drugs. However, although they were initially used primarily for the treatment of gastroesophageal reflux disease and peptic ulcer disease, their indications have considerably widened recently. With the rising prescription rate, the potential adverse effects of long-term treatment with these drugs, described in a growing number of recent reports, is contributing to the increasing concern doctors have about prescribing these drugs and to patient anxiety related to their use, despite clear-cut and correct indications. In this article, we describe the most common undesirable effects of long-term treatment with proton pump inhibitors. The individual effects are supplemented with potential pathophysiological base of origin and quotation of principal studies and interpretations of their results. In the context of recent studies, we conclude that these drugs are safe and when indications for their use are clear, their benefits exceed their possible risks.
Key words:
proton pump inhibitors – safety – risks – adverse effects
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
Submitted: 6. 5. 2018
Accepted: 7. 9. 2018
:
Martin Ďuriček
; Peter Bánovčin
; R. Hyrdel
:
Interná klinika – gastroenterologická JLF UK a UNM
:
Gastroent Hepatol 2018; 72(5): 432-440
:
Clinical and Experimental Gastroenterology: Review Article
prolekare.web.journal.doi_sk:
https://doi.org/10.14735/amgh2018432
Inhibítory protónovej pumpy (PPI) sú v súčasnosti jednými z najčastejšie užívaných liekov. Hoci sa úvodne používali hlavne na liečbu pažerákovej refluxovej choroby a peptickej vredovej choroby, ich indikácie sa medzičasom významne rozšírili. S narastajúcou preskripciou vzrastajú aj obavy z nežiaducich účinkov dlhodobého užívania, zvlášť s ohľadom na rastúce množstvo štúdií, ktoré ich popisujú. Môžu prispievať k obavám z predpisovania zo strany lekárov a tiež z užívania zo strany pacientov, a to aj napriek jednoznačnej a správnej indikácii. V prehľadovom článku sa venujeme nežiaducim účinkom, ktoré sú najčastejšie spájané z dlhodobou liečbou PPI. K jednotlivým uvádzame možný patofyziologický podklad ich vzniku, citujeme zásadné štúdie a interpretácie ich výsledkov. V prípade, že sú dostupné, uvádzame aj odporučenia v sledovaní a v manažmente nežiaducich účinkov. Aj v kontexte výsledkov štúdií možno povedať, že sa jedná o lieky bezpečné, dobre preštudované a v prípade jasnej indikácie ich benefity jasne prevyšujú prípadné riziká.
Kľúčové slová:
inhibítory protónovej pumpy – bezpečnosť – riziká – nežiaduce účinky
Úvod
Inhibítory protónovej pumpy (PPI – proton pump inhibitors) sa dostali do klinickej praxe koncom 80. rokov 20. storočia a znamenali zásadnú zmenu v manažmente ochorení súvisiacich s produkciou žalúdkovej kyseliny. Odvtedy sa stali jednými z najčastejšie predpisovaných liekov vo svete a ich odbyt neustále rastie.
V súčasnosti sa PPI už zďaleka neodporúčajú len na liečbu pažerákovej refluxovej choroby a peptickej vredovej choroby. Indikácie sa medzičasom značne rozšírili a rámcovo ich možno deliť na profylaktické a terapeutické (tab. 1).
Tab. 1. Overview of PPI indications.
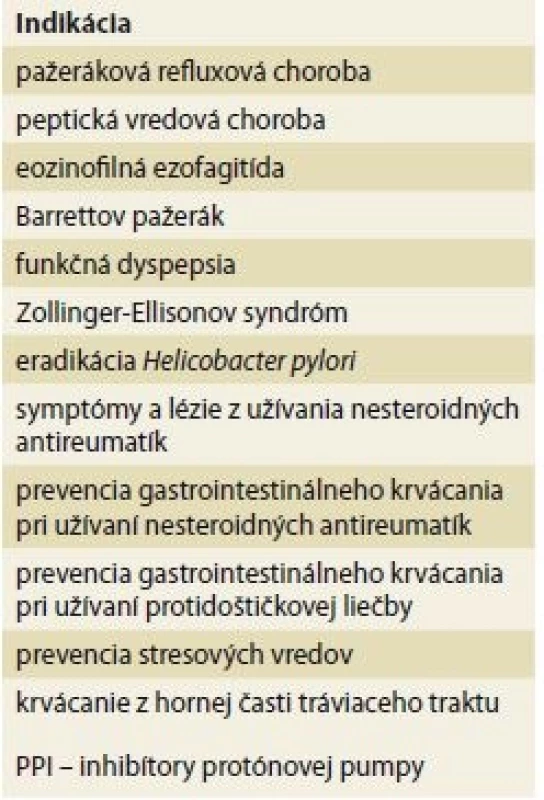
V súčasnosti je veľmi aktuálny problém nadužívania PPI, za ktorý je spoluzodpovedné ich predpisovanie v rámci manažmentu širokého spektra funkčných porúch tráviaceho traktu (funkčná dyspepsia a i.) a tiež v rámci manažmentu predpokladaných mimopažerákových prejavov pažerákovej refluxovej choroby. Všetky tieto indikácie sa vyznačujú veľmi nešpecifickými symptómami, čo prispieva k celkovo nadmernému užívaniu PPI. Problematická je aj iniciácia PPI v rámci hospitalizácie. Ukázalo sa totiž, že v prípade, že sa dlhodobá PPI liečba začala v nemocnici, až v 43 % išlo o nesprávnu indikáciu [1].
Navyše, preskripcia PPI nie je zďaleka len doménou gastroenterológov, ale viacerých lekárskych špecializácií, vrátane lekárov prvého kontraktu. Okrem toho niektoré PPI sú dostupné aj bez preskripcie, v rámci voľného predaja, pričom tento problém je ešte výraznejší napr. v USA.
Nadmerná preskripcia na druhej strane vedie k obavám z hľadiska dlhodobej bezpečnosti liečby. Uskutočnilo sa veľké množstvo štúdií, mnohokrát s protichodnými závermi, čo v konečnom dôsledku zatiaľ nie vždy umožňuje ustanovenie definitívnych a jednoznačných odporučení v rámci prevencie či sledovania nežiaducich účinkov. Informácie o týchto nežiaducich účinkoch bývajú často prezentované s veľkou intenzitou, čo môže prispievať jednak k neistote pri odporúčaní PPI zo strany lekárov, jednak k obavám z užívania PPI zo strany pacientov.
V tomto prehľade sa budeme venovať najviac relevantným nežiaducim účinkom dlhodobého užívania PPI. V niektorých prípadoch sme sa zamerali aj na aspekt kauzálneho vzťahu medzi užívaním PPI a jeho dôsledkami. V tomto kontexte sme vychádzali z tzv. Hillových kritérií [2], ktorých uplatnenie v niektorých prípadoch môže napomôcť správnej interpretácii výsledkov realizovaných štúdií. Kritériá publikoval sir Bernard Hill s cieľom odlíšiť asociáciu príčiny (v našom prípade dlhodobé užívanie PPI) a následku (nežiaduci účinok) od kauzality. Štúdie totiž často prichádzajú s asociáciami, ktoré ale nevyhnutne nemusia znamenať kauzálny vzťah. Závery sa môžu následne „senzačne“ publikovať, čo môže prispievať k neistote užívania PPI, a v konečnom dôsledku až k prerušeniu užívania, a to aj napriek správnej indikácii.
Na druhej strane, nálezy asociácií prispeli k uvedomeniu si nadužívania PPI v nesprávnych indikáciách a k dôslednejšiemu prehodnocovaniu potreby dlhodobej PPI liečby.
Bezpečnostný profil dlhodobého užívania
Výrazná väčšina potenciálnych nežiaducich účinkov je dôsledkom zníženia tvorby žalúdočnej kyseliny. Nežiaduce účinky sa preto pripisujú: a) poruche absorpcie nutrientov, b) zníženej bariérovej schopnosti žalúdočnej šťavy a zmenám mikrobioty, c) trofickému efektu hypergastrinémie. Okrem toho, PPI vstupujú do interakcií s inými liečivami s ďalšími možnými neželanými dôsledkami.
Deficit vitamínu B12 a súvisiace komplikácie
Vitamín B12 je vo vode rozpustný vitamín, ktorý je viazaný na proteíny v strave. Pri normálnej acidite žalúdka je jeho uvoľnenie z týchto väzieb katalyzované pepsínom, čo mu v konečnom dôsledku umožňuje naviazať sa na intrinsic factor. Tento komplex umožňuje absorpciu v terminálnom ileu. Keďže sa ale aktivita pepsínu pri pH > 4 znižuje, objavili sa pochybnosti o dostatočnej absorpcii B12 pri znížení žalúdočnej acidity. Ďalším potenciálnym faktorom je, že samotné parietálne bunky sú zdrojom intrinsic faktora, pričom vysoké dávky PPI sa môžu podieľať na jeho zníženej tvorbe [3].
Jednou z najdôležitejších prác v problematike je case-control štúdia [4], v ktorej užívanie PPI počas dvoch a viacerých rokov bolo asociované s vyšším rizikom deficitu vitamínu B12. Relevanciu tomuto zisteniu pridáva aj fakt, že efekt sa javil byť závislý od dávky a miera tejto asociácie sa znížila po prerušení užívania PPI. Štúdia ale nebrala do úvahy napr. diétne faktory a možnosť užívania PPI v rámci voľného predaja. Iné štúdie nenašli medzi deficitom B12 a užívaním PPI asociáciu [5]. V detailnej analýze štúdií LOTUS a SOPRAN (porovnávajúce dlhodobú liečbu esomeprazolom resp. omeprazolom s antirefluxnou operáciou) sa nenašli signifikantné rozdiely v hladinách vitamínu B12 medzi pacientmi na liečbe PPI a kontrolami [6].
V interpretácii výsledkov ale zohráva úlohu spoľahlivosť hladiny B12 ako markera zásob. Pre hodnoty B12 < 200 pg/ml sa udáva senzitivita len cca 65–95 % a špecificita cca 50 % [7].
Všeobecný skríning hladiny B12 pre všetkých pacientov na chronickej PPI liečbe sa preto neodporúča. Osobitný prístup ale možno uplatniť u starších ľudí, hlavne s rizikovými faktormi deficitu B12 ako Crohnova choroba, perniciózna anémia, malnutrícia, stav po chirurgických zákrokoch na žalúdku a čreve, kde je stanovenie zásob B12 po 2–3 rokoch od začiatku liečby PPI vhodné, aj so sledovaním každé 2–3 roky od začiatku liečby [8]. Iní autori navrhujú stanovenie hladín B12 1× za 2 roky pri dlhodobej liečbe PPI, a to zvlášť pri vysokých dávkach a pri diétnej reštrikcii (vegetariáni a vegáni) [9].
Demencia
Deficit kognitívnych funkcií pri užívaní PPI sa dával do súvislosti deficitom B12 [10,11]. Experimentálne sa ale pozoroval aj iný možný mechanizmus. U myší sa pozorovali vyššie hladiny beta-amyloidu v mozgu, čo môže byť dôsledkom inhibície vakuolárnej H+ ATPázy, ktorá vedie k zvýšeniu pH a v konečnom dôsledku k zníženému klírensu beta-amyloid peptidov.
Riziko demencie na PPI sa udávalo vo veľkej prospektívnej nemeckej štúdii [12] u pacientov nad 75 rokov, ktorí nemali demenciu v čase zaradenia do štúdie. Užívanie PPI malo ale podobnú mieru asociácie s poškodením kognitívnych funkcií ako vek, depresia či polypragmázia. Aj po vyradení týchto faktorov ostala asociácia PPI s demenciou u starších ľudí štatisticky signifikantná. Aj v ďalšej štúdií u pacientov nad 75 rokov boli PPI asociované so zvýšením rizika demencie o 38 % [13]. Naproti tomu, vo veľkej case-control štúdii u pacientov s demenciou boli PPI asociované s nižším rizikom demencie [14].
Rozdielne výsledky medzi štúdiami ale veľmi pravdepodobne vysvetľujú skresľujúce faktory, ako napr. charakteristika pacientov, komorbidity či polypragmázia. Nedávny prehľad preto uzatvára, že výsledky doposiaľ realizovaných štúdií na pacientoch s demenciou vo vyššom veku by nemali viesť k obavám ohľadne užívania PPI [9].
Deficit magnézia
Pravdepodobným patofyziologickým mechanizmom vzniku hypomagenzémie spojenej s PPI liečbou je nižšia absorpcia Mg2+ v dôsledku inhibície paracelulárneho transportéra TRPM6 a TRPM7 (transient receptor potential melastatin) v čreve [15]. Predpokladá sa, že pacienti s vrodenou mutáciou TRPM môžu byť predisponovaní k hypomagnezémii, ale tá sa môže prejaviť len na liečbe PPI [16,17]. Zvýšené riziko hypomagnezémie majú aj pacienti s chronickou renálnou insuficienciou (CHRI) alebo hemodialyzovaní pacienti, kde je poškodená aj renálna exkrécia a metabolizmus Mg2+ sa uskutočňuje len reguláciou vstrebávania črevom [18].
Veľké štúdie naznačujú, že hypomagnezémia môže byť asociovaná s PPI, a to hlavne u pacientov s CHRI a na diuretickej liečbe [19–22]. U pacientov bez CHRI a bez diuretickej liečby sa takáto asociácia nepreukázala [23]. Štúdie ale nezohľadňovali diétu pacientov [20]. Navyše, sérové koncentrácie nereflektujú celkové zásoby Mg2+ v organizme. Systematický prehľad a metaanalýza z roku 2014 odhalila asociáciu medzi chronickým užívaním PPI a hypomagenzémiou, avšak rôznorodosť štúdií neumožnila určiť definitívne závery [24].
Napriek tomu, že prevalencia hypomagnezémie nie je známa, Food and Drug Administration (FDA) odporúča monitoring hladiny Mg2+ na začiatku dlhodobej liečby PPI a v jej priebehu, a to zvlášť pri súčasnom užívaní diuretík alebo digoxínu, ďalej u starších pacientov či pri chronickom ochorení obličiek [8]. Malfertheiner et al taktiež odporúčajú monitoring hypomagnezémie len u pacientov s ďalšími rizikovými faktormi a v prítomnosti symptómov, ktoré možno hypomagnezémii pripísať [9].
PPI a hypokalcémia
Jednoznačný patofyziologický mechanizmus hypokalcémie indukovanej PPI nie je známy. Experimentálne dáta naznačujú, že PPI môžu blokovať paracelulárny transport kalcia v dôsledku zvýšenia intraluminálneho pH [25].
Hypokalcémia asociovaná s užívaním PPI sa popisovala v kazuistikách, ktoré súviseli s hypomagnezémiou asociovanou s PPI [26,27]. V randomizovanej placebom kontrolovanej štúdii na 12 zdravých dobrovoľníkoch ale krátkodobé užívanie PPI neovplyvnilo absorpciu kalcia [28]. Ani analýza kohort LOTUS a SOPRAN porovnávajúca skupinu pacientov s antirefluxnou operáciou oproti pacientom na dlhodobej PPI liečbe (počas 5, resp. 12 rokov) neukázala rozdiely hladín kalcia ani vitamínu D medzi skupinami [6]. Doterajšie dôkazy preto nepodporujú vzťah PPI a zhoršenej absorpcie kalcia.
PPI a zvýšené riziko fraktúr
Vzťah medzi PPI a zvýšeným rizikom fraktúr je založený na niekoľkých potenciálnych mechanizmoch – porucha vstrebávania kalcia pri hypochlórhydrii, gastrínom navodená hyperplázia paratyroidey či inhibícia osteoklastickej vakuolárnej protónovej pumpy [29].
Zvýšené riziko osteoporózy so zlomeninami krčka sa popisovalo v observačných štúdiách z Dánska a z Veľkej Británie [30]. U pacientov nad 65 rokov, na aspoň 1 ročnej PPI liečbe sa zistilo upravené OR 1,44 [31], čo svedčí pre slabú asociáciu. Efekt ale bol závislý na dávke aj na čase. Naproti tomu, v retrospektívnej kanadskej štúdii sa zvýšené riziko osteoporotických fraktúr u pacientov užívajúcich PPI počas viac ako 6 rokov nezistilo [32]. Metaanalýza potvrdila hranične vyššie riziko fraktúr krčka u starších pacientov na dlhodobej liečbe PPI (OR 1,25) [33]. V rámci nej ale šesť štúdií ukázalo pozitívnu asociáciu PPI a fraktúr krčka, štyri neukázali žiadnu asociáciu a z nich dve zistili dokonca nižšiu incidenciu fraktúr na liečbe PPI oproti kontrolám bez liečby PPI. Ďalšie štúdie v neprítomnosti iných rizikových faktorov asociáciu PPI a zvýšeného rizika fraktúr nepozorovali [34,35].
Výsledky sú nekonzistentné aj ohľadne efektu závislého na dávke PPI a na dĺžke podávania. V súlade s Hillovými kritériami [2] je pravdepodobnosť kauzálneho vzťahu vyššia v prípade, že sa navrhované asociácie pozorujú konzistentne. Podľa ďalšieho kritéria pravdepodobnosť kauzálneho vzťahu tiež zvyšuje aj koherencia medzi epidemiologickými a laboratórnymi nálezmi. Hoci sa z epidemiologického hľadiska pozorovala asociácia PPI a osteoporózy, nezistili sa signifikantné rozdiely medzi kostnou denzitou u žien na PPI a bez PPI počas dlhodobého užívania [32]. Ani prospektívne štúdie u žien na dlhodobej PPI liečbe nedemonštrovali zníženie kostnej denzity [36].
Usudzuje sa preto, že asociácia PPI a fraktúry krčka môže byť dôsledkom skresľujúceho faktora [36]. Prvá štúdia v tejto problematike zistila asociáciu fraktúry krčka s PPI, ale aj s inými liekmi, napr. anxiolytikami a antikonvulzívami [31]. Keďže sedovaní pacienti majú vyššie riziko pádov a úrazov vrátane fraktúr krčka, potenciálny význam tohto faktora sa javí byť relevantný.
Všetky štúdie majú retrospektívny a observačný charakter. Prospektívne štúdie, ktoré by vyhodnotili farmakologický efekt PPI na faktúry krčka, neexistujú [9].
Hoci fraktúry kostí spojené s osteoporózou majú výrazné socio-ekonomické následky, len 1–5 % z nich možno pripísať PPI [37]. Klinická relevancia sa preto javí byť nízka. Vzhľadom na to FDA poukazuje, že nie sú dostačujúce dôkazy na odporučenie hradenia kalcia alebo pravidelnú kostnú denzitometriu na dlhodobej PPI liečbe [38]. PPI sú asociované s vyšším rizikom fraktúr kostí, ale zatiaľ o tejto asociácii nemožno hovoriť ako o kauzálnej. Lekári predpisujúci PPI by mali o tejto asociácii vedieť a v individuálnych prípadoch, zvlášť u pacientov s viacerými komorbiditami, zvažovať, či je kostná denzitometria alebo substitučná liečba potrebná. Dôkazy zatiaľ neumožňujú v rámci prevencie kostných fraktúr odporučiť prerušenie užívania PPI.
Poškodenie obličiek
PPI sa asociovali s akútnou intersticiálnou nefritídou (AIN), pravdepodobne v dôsledku idiosynkratickej reakcie [39]. Ide o humorálnu a bunkovo mediovanú hypersenzitívnu reakciu, ktorá vedie k zápalu interstícia a tubulov [36]. Epidemiologické štúdie naznačujú aj asociáciu medzi PPI a rozvojom chronického obličkového ochorenia, a to pri rekurentných epizódach AIN [40,41].
V sérii kazuistík na 133 pacientoch s biopticky potvrdenou AIN bolo 12 % indukovaných PPI [42]. Case-control štúdia na viac ako 500 000 pacientoch bez obličkového ochorenia ukázala, že riziko AKI je 5× vyššie v prípade PPI liečby, a to zvlášť u starších pacientov [43]. V prospektívnej štúdii bolo užívanie PPI asociované so zvýšeným rizikom CHRI, a to až o 50 %, v retrospektívnej o 17 % [40,41]. Štúdie skúmajúce vzťah PPI a CHRI sa síce realizovali na veľkých kohortách pacientov, mali však limitácie. Skreslenie mohlo nastať kvôli selekcii pacientov, sprievodnou medikáciou či kardiovaskulárnymi komorbiditami. Nemožno teda s istotou tvrdiť, že ich nálezy sú jednoznačne vysvetliteľné užívaním PPI a nie rozdielnymi charakteristikami pacientov, ktorí užívali PPI, oproti tým, ktorí ich neužívali. Asociácia chronického ochorenia obličiek s PPI má síce nízku silu, ale nadobúda dôležitosť pri širokej preskripcii PPI [44].
U pacientov s novozisteným akútnym poškodením obličiek (AKI – acute kidney injury) pri AIN sa odporúča včasné vysadenie PPI. U pacientov s vyšším rizikom AKI indukovaným PPI je potrebné zvážiť monitorovanie renálnych funkcií počas prvých mesiacov liečby [9].
Myopatia
Užívanie PPI spolu s nesteroidnými antireumatikami (NSA) alebo so statínmi môže viesť k rabdomyolýze [45]. Statíny sú obvykle metabolizované cez enzym CYP3A4, ktorý môžu PPI v rôznej miere inhibovať. Pravdepodobným mechanizmom je teda inhibícia metabolizmu statínov prostredníctvom PPI.
Podľa databázy Svetovej zdravotníckej organizácie (WHO) nežiaducich účinkov liekov PPI môžu zriedkavo spôsobovať myopatiu, vrátane rabdomyolýzy. V cca jednej tretine prípadov boli PPI jedinými podávanými liekmi. Silu tejto asociácii dodáva aj časová súvislosť vzniku myopatie pri užívaní PPI. Vo väčšine prípadov došlo k tejto komplikácii do 1 týždňa od začiatku užívania PPI, u ostatných od 2 týždňov po 3 mesiace. Rovnako u väčšiny pacientov sa zaznamenalo súčasné užívanie statínov.
Poliekový lupus erythematosus
PPI boli signifikantne asociované s vývojom subakútneho kožného lupus erythematosus (SCLE – subacute cutaneous lupus erythematosus) [46]. Prerušenie užívania PPI viedlo k remisii SCLE, pričom opätovné nasadenie viedlo k znovuobjaveniu SCLE. Rizikovými faktormi rozvoja SCLE je ženské pohlavie (zvlášť v plodnom veku), predchádzajúce liekové alergie, citlivá pokožka a expozícia UV žiareniu. V tejto súvislosti European Medicines Agency (EMA) vydala varovanie, že SCLE je pravdepodobne „class effect“ PPI.
Komunitné pneumónie
In vitro štúdie ukázali, že zníženie tvorby žalúdočnej kyseliny môže viesť k prerastaniu aeróbnych baktérii v žalúdku a následnej mikroaspirácii a kolonizácii pľúc. PPI tiež môžu interferovať s funkciou neutrofilov. [47].
U kriticky chorých pacientov bola profylaxia stresových vredov asociovaná s vyšším rizikom pneumónie [48]. Táto asociácia sa ale neukázala konzistentne. Pozitívna asociácia sa pozorovala v retrospektívnej štúdii na pacientoch s GERD (gastroesophageal reflux disease) [49]. Naproti tomu kanadská multicentrická štúdia na viac ako 4 miliónoch pacientov túto asociáciu nepotvrdila [50,51].
Na Hillovom kritériu dočasnosti je možné poukázať na niektoré aspekty asociácie PPI a komunitnej pneumónie (CAP – community acquired pneumonia). U väčšiny nežiaducich účinkov PPI je ich indukčná doba dlhá. V prípade PPI a CAP je ale situácia odlišná. Pozoroval sa totiž trend vyššieho rizika komunitnej pneumónie u tých pacientov, ktorí začali liečbu PPI počas predchádzajúcich 14–30 dní [49,52]. Riziko komunitnej pneumónie bolo pritom výrazne vyššie u tých, ktorí liečbu PPI začali pred menej ako 14, resp. 2 dňami (OR 3,16, resp. 6,53) [51]. Je to v rozpore s očakávaním, že PPI indukujú CAP navodením hypochlórhydrie a imunosupresie. Dramatický vzrast rizika počas 2 dní od nasadenia PPI by mal byť výraznejšie vyjadrený v prípade dlhodobejšieho užívania PPI.
Pravdepodobne sa teda jedná o situáciu, keď sa liek (PPI) používa na liečbu včasných známok príslušného nežiaduceho výsledku (pneumónia), čo vytvára dojem, že je s výsledkom liek kauzálne asociovaný. Včasné symptómy rozvíjajúcej sa pneumónie, ako napr. kašeľ a hrudný dyskomfort, sa preto pravdepodobne nesprávne vyhodnotili ako symptómy v dôsledku kyseliny a empiricky liečili PPI tesne predtým, než sa diagnóza pneumónie definitívne ustanovila.
PPI a ich vplyv na tráviaci trakt
Pri dlhodobejšom užívaní PPI dochádza znížením tvorby žalúdočnej kyseliny k narušeniu spätnoväzbových vzťahov v hormonálnej aj parakrinnej regulácii, čoho najdôležitejším dôsledkom je zvýšenie hladiny gastrínu. Trofický efekt gastrínu zapríčiňuje hypertrofiu a hyperpláziu parietálnych buniek [53], ako aj enterochromaffin-like (ECL) buniek, ktoré produkujú chromogranín A (CgA).
Klinický význam hyperplázie parietálnych buniek na PPI spočíva v tzv. rebound fenoméne. Náhle vysadenie PPI liečby, ktorá je sústavná, aspoň počas 8 týždňov, môže mať za následok prudký relaps symptómov spojených s produkciou kyseliny (napr. pálenie záhy, kyslá regurgitácia) [54]. Hyperplázia ECL buniek zase vedie k nadprodukcii CgA, čo môže prispievať k rozpakom pri diferenciálnej diagnostike neuroendokrinných nádorov. Hladina CgA začína stúpať na 5. deň PPI liečby [55] a vracia sa do normy tiež pomerne rýchlo, v priebehu niekoľkých dní od vysadenia. Progresia hyperplázie ECL buniek do neoplázie je mimoriadne zriedkavá. Doteraz sa popísalo len 11 prípadov karcinoidov v dôsledku antisekrečnej liečby [56].
Existujú obavy z potenciálneho karcinogénneho efektu PPI, a to kvôli vyššej incidencii karcinómu žalúdka u pacientov na vysokých dávkach PPI a pri ich dlhodobom užívaní [57]. V tejto štúdii bola ale incidencia vyššia u tých pacientov, ktorí podstúpili eradikačnú liečbu Helicobacter pylori infekcie, avšak bez informácie o jej úspešnosti. Okrem toho chýbajú aj informácie o tom, či sa u pacientov už nachádzali preneoplastické alebo včasné neoplastické zmeny. Vplyv H. pylori ako hlavného skresľujúceho faktora sa nebral do úvahy vo väčšine observačných štúdií, táto asociácia by toho času nemala byť dôvodom obáv [58]. Experimentálne štúdie ukázali skôr anti-karcinogénne účinky PPI [59].
U pacientov na stredne a dlhodobej liečbe PPI sa zistila aj signifikantná pozitívna asociácia s pankreatickým karcinómom [60]. Podobne ako u komunitných pneumónií sa vyššia mortalita ukázala pri krátkodobom užívaní PPI, čo svedčí pre reverznú kauzalitu – PPI boli nasadené zhruba v čase ustanovenia diagnózy karcinómu [9].
PPI ovplyvňujú priebeh H. pylori infekcie. PPI vyžadujú obvykle pacienti s predominantne antrálnou gastritídou. Pri dlhodobom užívaní PPI sa stupeň zápalu a kolonizácia antra zmierni a zvýrazní sa kolonizácia tela a fundu [61]. Tento proces môže viesť k rýchlejšiemu úbytku oxyntických žliaz, k rozvoju atrofickej gastritídy, kolonizácii žalúdka inými baktériami a k dysregulácii žalúdočných hormónov [62]. U pacientov s potrebou dlhodobej PPI liečby sa preto odporúča eradikácia H. pylori, a to v rámci prevencie rozvoja abnormalít žalúdočnej sliznice a progresie do atrofickej gastritídy [63].
Zvýšenie pH v žalúdku je tiež jedným z predpokladaných mechanizmov vzniku syndrómu bakteriálneho prerastania v tenkom čreve (SIBO – small intestinal bacterial overgrowth). Pri vyššom pH sa pravdepodobne zvyšuje množstvo baktérií prechádzajúcich žalúdkom, ktoré kolonizujú tenké črevo.
Pri užívaní PPI sa udávalo vyššie riziko vzniku SIBO [64], niektoré štúdie ale túto asociáciu nepotvrdili [65]. Väčšina štúdií bola ale založená na výsledku dychového testu, ktorý je menej presný ako stanovenie za pomoci duodenálneho aspirátu. Štúdie s použitím duodenálneho aspirátu demonštrovali vyššiu prevalenciu bakteriálneho a mykotického prerastania u pacientov na PPI, pričom užívanie PPI bolo nezávislým rizikovým faktorom pre toto prerastanie [66,67].
Črevné infekcie
Keďže mikrobiálna kolonizácia tenkého a hrubého čreva podlieha acidite žalúdka, podkladom vzniku črevných infekcií pri užívaní PPI je pravdepodobne znižovanie mikrobiálnej diverzity a dysbióza, ktorá predisponuje k črevným infekciám. U zdravých dobrovoľníkov liečba PPI viedla ku kolonizácii dolnej časti tráviaceho traktu predominantne baktériami asociovanými s Clostridium difficile [29]. Ku klostrídiovej infekcii pravdepodobne prispievajú aj vegetatívne formy, ktoré by boli normálne zničené žalúdočnou kyselinou a prežívajú v menej kyslom prostredí [68].
Štúdie udávajú nárast infekcie Salmonella enterica, a to aj počas krátkodobého užívania PPI [69], rovnako ako aj vyššie riziko hnačky spôsobenej Campylobacter jejuni. Inhibícia tvorby kyseliny môže facilitovať aj cestovateľské hnačky indukované aj bežnými enteropatogénami (napr. E. coli, Shigella sp.) [70]. Metaanalýzy ukázali mierne zvýšené riziko klostrídiovej infekcie u pacientov na PPI [71,72], pričom riziko nozokomiálnej klostrídiovej infekcie sa zvyšuje takmer dvojnásobne. Najvyššie riziko klostrídiovej infekcie predstavuje spoločné užívanie PPI a antibiotík [73].
Slabá asociácia sa ukázala aj medzi H2 blokátormi a črevnými infekciami [50], čo svedčí pre na dávke závislý vzťah medzi znížením tvorby žalúdočnej kyseliny a rizikom bakteriálnej črevnej infekcie.
Odporúča sa preto obozretnosť v pred-pisovaní PPI u pacientov s rizikovými faktormi klostrídiovej infekcie a u pacientov s rekurentnou klostrídiovou infekciou je potrebné sa im úplne vyhnúť [74]. FDA odporúča zvažovať diagnózu klostrídiovej infekcie u pacientov s pretrvávajúcimi hnačkami na PPI a predpisovať najnižšie efektívne dávky PPI počas čo najkratšieho času [75].
Mikroskopická kolitída
Užívanie PPI bolo identifikované ako rizikový faktor mikroskopickej kolitídy, a to v retrospektívnej analýze jej 95 prípadov [76]. Signifikantné riziko mikroskopickej kolitídy existuje aj pri súčasnej liečbe nesteroidnými antireumatikami a PPI [77].
Liekové interakcie
Principiálne možno liekové interakcie PPI rozdeliť na dve skupiny. V prvej skupine ide o zmenu absorpcie iných liečiv v dôsledku zníženia tvorby žalúdočnej kyseliny. Druhá skupina interakcií spočíva v priamej interferencii metabolizmu PPI s metabolizmom iných liečiv.
Efekt zmeny absorpcie liečiv v dôsledku zníženia tvorby žalúdočnej kyseliny je len zriedka klinicky významný [78]. Relevantná je interakcia s antimykotikom ketokonazolom, ktorého absorpcia je v neprítomnosti kyslého prostredia nedostatočná, a tiež s inhibítorom reverznej transkriptázy rilpivirínom, kde súčasná liečba PPI vedie k zníženiu plazmatických koncentrácií rilpivirínu, zvýšeniu rizika zlyhania liečby a k rozvoju rezistencie [79]. Z tohoto dôvodu je podávanie PPI súčasne s rilpivirínom kontraindikované. Naopak, v prípade digoxínu je situácia opačná – alkalizácia žalúdočného obsahu má za následok zvyšovanie absorpcie z tenkého čreva, čoho dôsledkom sú vyššie plazmatické koncentrácie digoxínu a vyšší toxický účinok [78]. Užívanie PPI je navyše rizikový faktor oneskorenej eliminácie metotrexátu s jeho následnými vyššími plazmatickými hladinami a rizikom dysfunkcie obličiek a pečene [80].
V poslednej dobe sa diskutuje o interakcii PPI a nových antikoagulancií, ktorá môže prispieť k zníženiu efektivity antitrombotickej liečby [81]. Keďže rozpustnosť dabigatranu sa znižuje pri pH > 4, absorpcia dabigatranu sa môže u pacientov na PPI znižovať. Plazmatické hladiny dabigatranu sú skutočne signifikantne nižšie u pacientov na PPI liečbe [82]. Napriek tomu, že klinický význam tejto interakcie je ešte potrebné stanoviť, subanalýza RE-LY štúdie ukázala, že ischemické náhle cievne mozgové príhody aj krvácavé príhody korelovali práve s plazmatickými hladinami dabigatranu [83].
Z liekových interakcií v dôsledku priamej interferencie metabolizmu jednotlivých liečiv budí najväčšiu pozornosť interakcia PPI a tienopyridínov. Vzhľadom na rozsiahlosť problematiky a veľké množstvo doteraz realizovaných štúdií sa budeme venovať výsledkom len vybraných štúdií a niektorých metaanalýz.
Užívanie tienopyridínov vedie k inhibícii trombocytov, čo zvyšuje riziko gastrointestinálneho krvácania, a to zvlášť u pacientov s peptickým vredom alebo anamnézou peptickej vredovej choroby. Napriek tomu, že klopidogrel nie je primárne ulcerogénny, zvyšuje riziko krvácania z preexistujúcich lézií. Klopidogrel zvyšuje riziko krvácania dvojnásobne oproti bežnej populácii a tiež dvojnásobne zvyšuje riziko dané podávaním aspirínu [84]. Klopidogrel konvertuje na aktívny metabolit cez izoenzýmy cytochrómu p450 – CYP2C19 a CYP3A4, kde dochádza ku kompetícii s PPI, v dôsledku čoho môže dochádzať k zníženiu účinku antiagregačnej liečby.
Dôležitým faktorom je aj genetická variabilita CYP2C19. Existuje niekoľko mutácií génu CYP2C19 so stratou jej funkcie [85], ktorých prevalencia je v jednotlivých etnikách odlišná. Metabolizmus PPI je u väčšiny bielej populácie rýchly, prevalencia týchto mutácií u bielych Európanov je do 15 % [86].
Štúdia COGENT porovnávala u pacientov s akútnym koronárnym syndrómom alebo po revaskularizácii myokardu užívanie klopidogrelu samotného s klopidogrelom a omeprazolom. Medzi skupinami sa rozdiely v kardiovaskulárnych príhodách nezistili, ale v skupine s omeprazolom bola nižšia incidencia gastrointestinálneho krvácania [87]. Štúdia TRITON-TIMI nepreukázala vzťah medzi užívaním PPI a kardiovaskulárnym rizikom [88]. V štúdii PLATO autori zistili vyššie kardiovaskulárne riziko u pacientov na PPI. Vzhľadom na to, že tento efekt sa prejavil aj pri iných liekoch, autori usúdili, že PPI môžu byť skôr markerom vyššieho kardiovaskulárneho rizika než jeho príčinou [89].
Miera interakcie s CYP2C19 je vyššia pre omeprazol než pre pantoprazol [90]. U pacientov s akútnym koronárnym syndrómom sa pri liečbe pantoprazolom nezistili zmeny reaktivity trombocytov, a to ani pri súčasnej liečbe klopidogrelom, ani novšími blokátormi adenozíndifosfátovych receptorov.
Vo všeobecnosti, výsledky observačných štúdií hovoria v prospech interakcie PPI – klopidogrel, avšak v randomizovaných kontrolovaných štúdiách sa táto interakcia klinicky neidentifikovala [8]. Ex vivo analýzy taktiež poukazujú na to, že omeprazol inhibuje protidoštičkové účinky klopidogrelu, retrospektívne štúdie hovoria o vyššom kardiovaskulárnom riziku u pacientov s klopidogrelom a prospektívne štúdie takúto interakciu nenachádzajú [9].
EMA vydala v r. 2010 upozornenie, že klopidogrel môže byť menej efektívny u pacientov na PPI, čo môže zvyšovať riziko nežiaducich kardiovaskulárnych príhod [91]. FDA prišla s podobným varovaním v r. 2010. Európska kardiologická spoločnosť odporúčala v r. 2013 používanie PPI s nižšou mierou inhibície CYP2C19 u pacientov s klopidogrelom a vysokým rizikom krvácania z horného gastrointestinálneho traktu [92]. Miera interakcie medzi klopidogrelom je najvyššia pre omeprazol a esomeprazol, nižšia je pre pantoprazol a lanzoprazol, pričom pre rabeprazol sú dáta limitované [93]. V r. 2016 FDA varovala pred súčasným podávaním klopidogrelu a omeprazolu s dôrazom na to, že odporučenie sa týka len omeprazolu, nie ostatných PPI [9]. Vo svetle súčasných dôkazov sa preto odporúča pacientom s klopidogrelom predpisovať iné PPI ako omeprazol, a to v najnižších možných dávkach.
Záver
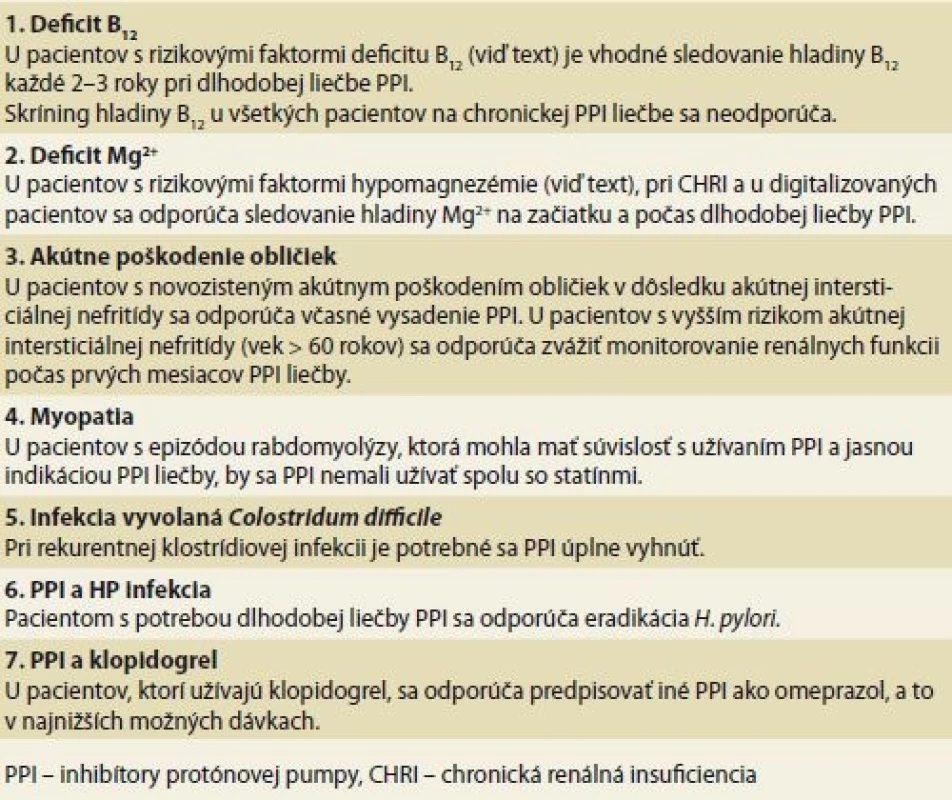
Napriek tomu, že počet štúdií zaoberajúcich sa negatívnymi dôsledkami dlhodobej inhibície tvorby žalúdočnej kyseliny narastá, v niektorých aspektoch nie je pravdepodobne možné v krátkodobom horizonte očakávať jasné a jednoznačné odpovede. Súhrn relevantných odporúčaní na základe doteraz dostupných dát uvádzame v prehľadnej tabuľke (tab. 2). Podobne, nepredpokladá sa, že v diagnostike funkčnej dyspepsie alebo mimopažerákových prejavov GERD dôjde k tak zásadnému diagnostickému posunu, že bude možné ľahko identifikovať tzv. PPI responderov. V rámci ich neprehľadných a nešpecifických symptómov budú pacienti aj v budúcnosti pravdepodobne dlhodobo liečení PPI, či už s výrazným efektom alebo benefitom porovnateľným s placebom.
Tab. 2. Summary of the most important recommendations for management of
adverse eff ects of the PPI treatment.
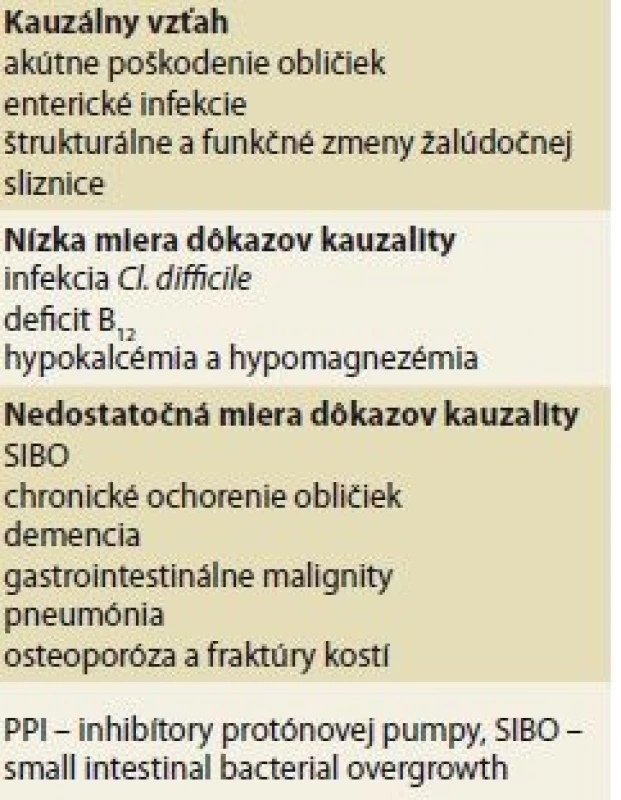
Naďalej ale platí, že PPI sú jednými z najbezpečnejších liekov v histórii medicíny [80]. Napriek širokému spektru nežiaducich účinkov má len málo z nich jasne potvrdenú kauzalitu (tab. 3). V prípade, že sú vhodne predpisované, ich benefit určite prevažuje nad rizikami. V prípade, že je indikácia užívania nesprávna, aj mierne riziko nadobúda význam, pretože neexistuje potenciálny benefit.
Tab. 3. Undesirable effects of PPIs
with confirmed and unconfirmed
causality. The complications associated
with PPI treatment are common.
We present the distribution of the
complication by the level of evidence
supporting the causal relationship.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Doručeno: 6. 5. 2018
Přijato: 7. 9. 2018
prof. Mudr. Peter Bánovčin, CSc.
Interná klinika – gastroenterologická JLF v Martine a UK v Bratislave
JLF v Martine a UK v Bratislave
Kollárova 2, 036 59 Martin
Sources
134. doi: 10.1177/1060028016670414.
2. Hill AB. The environment and disease: association or causation? 1965. J R Soc Med 2015; 108 (1): 32–37. doi: 10.1177/0141076814562718.
3. Venerito M, Varbanova M, Röhl FW et al. Oxyntic gastric atrophy in Helicobacter pylori gastritis is distinct from autoimmune gastritis. J Clin Pathol 2016; 69 (8): 677–685. doi: 10.1136/jclinpath-2015-203405.
4. Lam JR, Schneider JL, Zhao W et al. Proton pump inhibitor and histamine 2 receptor antagonist use and vitamin B12 deficiency. JAMA 2013; 310 (22): 2435–2442. doi: 10.1001/jama.2013.280490.
5. Hirschowitz BI, Worthington J, Mohnen J. Vitamin B12 deficiency in hypersecretors during long-term acid suppression with proton pump inhibitors. Aliment Pharmacol Ther 2008; 27 (11): 1110–1121. doi: 10.1111/j.1365-2036.2008.03658.x.
6. Attwood SE, Ell C, Galmiche JP et al. Long-term safety of proton pump inhibitor therapy assessed under controlled, randomised clinical trial conditions: data from the SOPRAN and LOTUS studies. Aliment Pharmacol Ther 2015; 41 (11): 1162–1174. doi: 10.1111/apt.13194.
7. Stabler SP. Clinical practice. Vitamin B12 deficiency. N Engl J Med 2013; 368 (2): 149-60.
8. de la Coba Ortiz C, Argüelles Arias F, Martín de Argila de Prados C et al. Proton-pump inhibitors adverse effects: a review of the evidence and position statement by the Sociedad Española de Patologia Digestiva. Rev Esp Enferm Dig 2016; 108 (4): 207–224. doi: 10.17235/reed.2016.4232/2016.
9. Malfertheiner P, Kandulski A, Venerito M. Proton-pump inhibitors: understanding the complications and risks. Nat Rev Gastroenterol Hepatol 2017; 14 (12): 697–710. doi: 10.1038/nrgastro.2017.117.
10. O‘Leary F, Allman-Farinelli M, Samman S. Vitamin B12 status, cognitive decline and dementia: a systematic review of prospective cohort studies. Br J Nutr 2012; 108 (11): 1948–1961. doi: 10.1017/S0007114512004175.
11. Reynolds E. Vitamin B12, folic acid, and the nervous system. Lancet Neurol 2006; 5 (11): 949–960. doi: 10.1016/S1474-4422 (06) 70598-1.
12. Gomm W, von Holt K, Thomé F et al. Association of proton pump inhibitors with risk of dementia: A pharmacoepidemiological claims data analysis. JAMA Neurol 2016 73 (4): 410–406. doi: 10.1001/jamaneurol.2015.4791.
13. Haenisch B, von Holt K, Wiese B et al. Risk of dementia in elderly patients with the use of proton pump inhibitors. Eur Arch Psychiatry Clin Neurosci 2015 265 (5): 419–428. doi: 10.1007/s00406-014-0554-0.
14. Booker A, Jacob LE, Rapp M et al. Risk factors for dementia diagnosis in German primary care practices. Int Psychogeriatr 2016; 28 (7): 1059–1065. doi: 10.1017/S1041610215002082.
15. Voets T, Nilius B, Hoefs S et al. TRPM6 forms the Mg2+ influx channel involved in intestinal and renal Mg2+ absorption. J Biol Chem 2004; 279 (1): 19–25. doi: 10.1074/jbc.M311201200.
16. Toh JW, Ong E, Wilson R. Hypomagnesaemia associated with long-term use of proton pump inhibitors. Gastroenterol Rep (Oxf) 2015; 3 (3): 243–253. doi: 10.1093/gastro/gou054.
17. Faulhaber GA, Ascoli BM, Lubini A et al. Serum magnesium and proton-pump inhibitors use: a cross-sectional study. Rev Assoc Med Bras (1992) 2013; 59 (3): 276–279. doi: 10.1016/j.ramb.2012.12.007.
18. Schlingmann KP, Weber S, Peters M et al. Hypomagnesemia with secondary hypocalcemia is caused by mutations in TRPM6, a new member of the TRPM gene family. Nat Genet 2002; 31 (2): 166–170. doi: 10.1038/ng889.
19. Zipursky J, Macdonald EM, Hollands S et al. Proton pump inhibitors and hospitalization with hypomagnesemia: a population-based case-control study. PLoS Med 2014; 11 (9): e1001736. doi: 10.1371/journal.pmed.1001736.
20. Sumukadas D, McMurdo ME, Habicht D. Proton pump inhibitors are associated with lower magnesium levels in older people with chronic kidney disease. J Am Geriatr Soc 2012; 60 (2): 392–393. doi: 10.1111/j.1532-5415.2011.03808.x.
21. Danziger J, William JH, Scott DJ et al. Proton-pump inhibitor use is associated with low serum magnesium concentrations. Kidney Int 2013; 83 (4): 692–699. doi: 10.1038/ki.2012.452.
22. Misra PS, Alam A, Lipman ML et al. The relationship between proton pump inhibitor use and serum magnesium concentration among hemodialysis patients: a cross-sectional study. BMC Nephrol 2015; 16 : 136. doi: 10.1186/s12882-015-0139-9.
23. Sharara AI, Chalhoub JM, Hammoud N et al. Low prevalence of hypomagnesemia in long-term recipients of proton pump inhibitors in a managed care cohort. Clin Gastroenterol Hepatol 2016; 14 (2): 317–321. doi: 10.1016/j.cgh.2015.10.012.
24. Park CH, Kim EH, Roh YH et al. The association between the use of proton pump inhibitors and the risk of hypomagnesemia: a systematic review and meta-analysis. PLoS One 2014; 9 (11): e112558. doi: 10.1371/journal.pone.0112558.
25. Thongon N, Krishnamra N. Apical acidity decreases inhibitory effect of omeprazole on Mg (2+) absorption and claudin-7 and -12 expression in Caco-2 monolayers. Exp Mol Med 2012; 44 (11): 684–693. doi: 10.3858/emm.2012.44.11.077.
26. Negri AL, Valle EE. Hypomagnesaemia/hypokalemia associated with the use of esomeprazole. Curr Drug Saf 2011; 6 (3): 204–206.
27. Deroux A, Khouri C, Chabre O et al. Severe acute neurological symptoms related to proton pump inhibitors induced hypomagnesemia responsible for profound hypoparathyroidism with hypocalcemia. Clin Res Hepatol Gastroenterol 2014; 38 (5): e103-5. doi: 10.1016/j.clinre.2014.03.005.
28. Wright MJ, Sullivan RR, Gaffney-Stomberg E et al. Inhibiting gastric acid production does not affect intestinal calcium absorption in young, healthy individuals: a randomized, crossover, controlled clinical trial. J Bone Miner Res 2010; 25 (10): 2205–2011. doi: 10.1002/jbmr.108.
29. Freedberg DE, Kim LS, Yang YX. The risks and benefits of long-term use of proton pump inhibitors: expert review and best practice advice from the American Gastroenterological Association. Gastroenterology 2017; 152 (4): 706–715. doi: 10.1053/j.gastro.2017.01.031.
30. Vestergaard P, Rejnmark L, Mosekilde L. Proton pump inhibitors, histamine H2 receptor antagonists, and other antacid medications and the risk of fracture. Calcif Tissue Int 2006; 79 (2): 76–83. doi: 10.1007/s00223-006-0021-7.
31. Yang YX, Lewis JD, Epstein S et al. Long-term proton pump inhibitor therapy and risk of hip fracture. JAMA 2006; 296 (24): 2947–2953. doi: 10.1001/jama.296.24.2947.
32. Targownik LE, Lix LM, Metge CJ et al. Use of proton pump inhibitors and risk of osteoporosis-related fractures. CMAJ 2008; 179 (4): 319–326. doi: 10.1503/cmaj.071330.
33. Ngamruengphong S, Leontiadis GI, Radhi S et al. Proton pump inhibitors and risk of fracture: a systematic review and meta-analysis of observational studies. Am J Gastroenterol 2011; 106 (7): 1209–1218. doi: 10.1038/ajg.2011.113.
34. Corley DA, Kubo A, Zhao W et al. Proton pump inhibitors and histamine-2 receptor antagonists are associated with hip fractures among at-risk patients. Gastroenterology 2010; 139 (1): 93–101. doi: 10.1053/j.gastro.2010.03.055.
35. Kaye JA, Jick H. Proton pump inhibitor use and risk of hip fractures in patients without major risk factors. Pharmacotherapy 2008; 28 (8): 951–959. doi: 10.1592/phco.28.8.951.
36. Vaezi MF, Yang YX, Howden CW. Complications of proton pump inhibitor therapy. Gastroenterology 2017; 153 (1): 35–48. doi: 10.1053/j.gastro.2017.04.047.
37. Moayyedi P, Yuan Y, Leontiadis G et al. Canadian Association of Gastroenterology position statement: hip fracture and proton pump inhibitor therapy-a 2013 update. Can J Gastroenterol 2013; 27 (10): 593–595.
38. U.S. Food & Drug Administration. FDA Drug Safety Communication: Possible increased risk of fractures of the hip, wrist, and spine with the use of proton pump inhibitors. [online]. Dostupné z: https: //www.fda.gov/Drugs/DrugSafety/PostmarketDrugSafetyInformationforPatientsandProviders/ucm213206.htm.
39. Perazella MA, Markowitz GS. Drug-induced acute interstitial nephritis. Nat Rev Nephrol 2010; 6 (8): 461–470. doi: 10.1038/nrneph.2010.71.
40. Lazarus B, Coresh J, Grams ME. Adverse effects of proton pump inhibitors in chronic kidney disease-reply. JAMA Intern Med 2016; 176 (6): 869–870. doi: 10.1001/jamainternmed.2016.1863.
41. Lazarus B, Chen Y, Wilson FP et al. Proton pump inhibitor use and the risk of chronic kidney disease. JAMA Intern Med 2016; 176 (2): 238–246. doi: 10.1001/jamainternmed.2015.7193.
42. Muriithi AK, Leung N, Valeri AM et al. Biopsy-proven acute interstitial nephritis, 1993–2011: a case series. Am J Kidney Dis 2014; 64 (4): 558–566.
43. Blank ML, Parkin L, Paul C et al. A nationwide nested case–control study indicates an increased risk of acute interstitial nephritis with proton pump inhibitor use. Kidney Int 2014; 86 (4): 837–844. doi: 10.1038/ki.2014.74.
44. Moledina DG, Perazella MA. Proton pump inhibitors and CKD. J Am Soc Nephrol 2016; 27 (10): 2926–2928. doi: 10.1681/ASN.2016020192.
45. Clark DW, Strandell J. Myopathy including polymyositis: a likely class adverse effect of proton pump inhibitors? Eur J Clin Pharmacol 2006; 62 (6): 473–479.
46. Aggarwal N. Drug-induced subacute cutaneous Lupus Erythematosus associated with proton pump inhibitors. Drugs Real World Outcomes 2016; 3 (2): 145–154. doi: 10.1007/s40801-016-0067-4.
47. Wandall JH. Effects of omeprazole on neutrophil chemotaxis, super oxide production, degranulation, and translocation of cytochrome b–245. Gut 1992; 33 (5): 617–621.
48. Fohl AL, Regal RE. Proton pump inhibitor-associated pneumonia: Not a breath of fresh air after all? World J Gastrointest Pharmacol Ther 2011; 2 (3): 17–26. doi: 10.4292/wjgpt.v2.i3.17.
49. Laheij RJ, Sturkenboom MC, Hassing RJ et al. Risk of community-acquired pneumonia and use of gastric acid-suppressive drugs. JAMA 2004; 292 (16): 1955–1960. doi: 10.1001/jama.292.16.1955.
50. Filion KB, Chateau D, Targownik LE et al. Proton pump inhibitors and the risk of hospitalisation for community-acquired pneumonia: replicated cohort studies with meta-analysis. Gut 2014; 63 (4): 552–558. doi: 10.1136/gutjnl-2013-304738.
51. Sarkar M, Hennessy S, Yang YX. Proton-pump inhibitor use and the risk for community-acquired pneumonia. Ann Intern Med 2008; 149 (6): 391–398.
52. Gulmez SE, Holm A, Frederiksen H et al. Use of proton pump inhibitors and the risk of community-acquired pneumonia: a population-based case-control study. Arch Intern Med 2007; 167 (9): 950–955. doi: 10.1001/archinte.167.9.950.
53. Lundell L. The physiological background behind and course of development of the first proton pump inhibitor. Scand J Gastroenterol 2015; 50 (6): 680–684. doi: 10.3109/00365521.2015.1013981.
54. Reimer C, Søndergaard B, Hilsted L et al. Proton-pump inhibitor therapy induces acid-related symptoms in healthy volunteers after withdrawal of therapy. Gastroenterology 2009; 137 (1): 80–87. doi: 10.1053/j.gastro.2009.03.058.
55. Sanduleanu S, De Bruïne A, Stridsberg M et al. Serum chromogranin A as a screening test for gastric enterochromaffin-like cell hyperplasia during acid-suppressive therapy. Eur J Clin Invest 2001; 31 (9): 802–811.
56. Savarino V, Dulbecco P, Savarino E. Are proton pump inhibitors really so dangerous? Dig Liver Dis 2016; 48 (8): 851–859. doi: 10.1016/j.dld.2016.05.018.
57. Poulsen AH, Christensen S, McLaughlin JK et al. Proton pump inhibitors and risk of gastric cancer: a population-based cohort study. Br J Cancer 2009; 100 (9): 1503–1507. doi: 10.1038/sj.bjc.6605024.
58. Tran-Duy A, Spaetgens B, Hoes AW et al. Use of proton pump inhibitors and risks of fundic gland polyps and gastric cancer: systematic review and meta–analysis. Clin Gastroenterol Hepatol 2016; 14 (12): 1706–1719.e5. doi: 10.1016/j.cgh.2016.05.018.
59. Han YM, Park JM, Kangwan N et al. Role of proton pump inhibitors in preventing hypergastrinemia-associated carcinogenesis and in antagonizing the trophic effect of gastrin. J Physiol Pharmacol 2015; 66 (2): 159–167.
60. Kearns MD, Boursi B, Yang YX. Proton pump inhibitors on pancreatic cancer risk and survival. Cancer Epidemiol 2017; 46 : 80–84. doi: 10.1016/j.cane 2016.12.006.
61. Logan RP, Walker MM, Misiewicz JJ et al. Changes in the intragastric distribution of Helicobacter pylori during treatment with omeprazole. Gut 1995; 36 (1): 12–16.
62. Malfertheiner P, Chan FK, McColl KE. Peptic ulcer disease. Lancet 2009; 374 (9699): 1449–1461. doi: 10.1016/S0140-6736 (09) 60938-7.
63. Malfertheiner P, Megraud F, O‘Morain CA et al. Management of Helicobacter pylori infection-the Maastricht V/Florence consensus Report. Gut 2017; 66 (1): 6–30. doi: 10.1136/gutjnl-2016-312288.
64. Lombardo L, Foti M, Ruggia O et al. Increased incidence of small intestinal bacterial overgrowth during proton pump inhibitor therapy. Clin Gastroenterol Hepatol 2010; 8 (6): 504–8. doi: 10.1016/j.cgh.2009.12.022.
65. Ratuapli SK, Ellington TG, O‘Neill MT et al. Proton pump inhibitor therapy use does not predispose to small intestinal bacterial overgrowth. Am J Gastroenterol 2012; 107 (5): 730–735. doi: 10.1038/ajg.2012.4.
66. Lewis SJ, Franco S, Young G et al. Altered bowel function and duodenal bacterial overgrowth in patients treated with omeprazole. Aliment Pharmacol Ther 1996; 10 (4): 557–61.
67. Jacobs C, Coss Adame E, Attaluri A et al. Dysmotility and proton pump inhibitor use are independent risk factors for small intestinal bacterial and/or fungal overgrowth. Aliment Pharmacol Ther 2013; 37 (11): 1103–1111. doi: 10.1111/apt.12304.
68. Jump RL, Pultz MJ, Donskey CJ. Vegetative Clostridium difficile survives in room air on moist surfaces and in gastric contents with reduced acidity: a potential mechanism to explain the association between proton pump inhibitors and C. difficile-associated diarrhea? Antimicrob Agents Chemother 2007; 51 (8): 2883–2887. doi: 10.1128/AAC.01443-06.
69. Doorduyn Y, Van Den Brandhof WE, Van Duynhoven YT et al. Risk factors for Salmonella Enteritidis and Typhimurium (DT104 and non-DT104) infections in The Netherlands: predominant roles for raw eggs in Enteritidis and sandboxes in Typhimurium infections. Epidemiol Infect 2006; 134 (3): 617–626.
70. Bavishi C, Dupont HL. Systematic review: the use of proton pump inhibitors and increased susceptibility to enteric infection. Aliment Pharmacol Ther 2011; 34 (11–12): 1269–1281. doi: 10.1111/j.1365-2036.2011.04874.x.
71. Kwok CS, Arthur AK, Anibueze CI et al. Risk of Clostridium difficile infection with acid suppressing drugs and antibiotics: meta-analysis. Am J Gastroenterol 2012; 107 (7): 1011–1019. doi: 10.1038/ajg.2012.108.
72. Tleyjeh IM, Bin Abdulhak AA, Riaz M et al. Association between proton pump inhibitor therapy and clostridium difficile infection: a contemporary systematic review and meta-analysis. PLoS One 2012; 7 (12): e50836. doi: 10.1371/journal.pone.0050836.
73. Kandel CE, Gill S, McCready J et al. Re-ducing co-administration of proton pump inhibitors and antibiotics using a computerized order entry alert and prospective audit and feedback. BMC Infect Dis 2016; 16 : 355. doi: 10.1186/s12879-016-1679-8.
74. McDonald EG, Jones J, Green L et al. Reduction of inappropriate exit prescriptions for proton pump inhibitors: A before-after study using education paired with a web-based quality-improvement tool. J Hosp Med 2015; 10 (5): 281–286. doi: 10.1002/jhm.2330.
75. U.S. Food & Drug Administration. FDA Drug Safety Communication: Clostridium difficile associated diarrhea can be associated with stomach acid drugs known as proton pump inhibitors (PPIs) 2012. [online]. Dostupné z: https: //www.fda.gov/Drugs/DrugSafety/ucm290510.htm.
76. Keszthelyi D, Jansen SV, Schouten GA et al. Proton pump inhibitor use is associated with an increased risk for microscopic colitis: a case-control study. Aliment Pharmacol Ther 2010; 32 (9): 1124–1128. doi: 10.1111/j.1365-2036. 2010.04453.x.
77. Verhaegh B, de Vries F, Masclee AA et al. High risk of drug-induced microscopic colitis with concomitant use of NSAIDs and proton pump inhibitors. Aliment Pharmacol Ther 2016; 43 (9): 1004–1013. doi: 10.1111/apt.13583.
78. Martínek J, Lukáš M. Inhibitory protonové pumpy – up to date. Gastroent Hepatol 2011; 65 (6): 331-342.
79. Crauwels H, van Heeswijk RP, Stevens M et al. Clinical perspective on drug-drug interactions with the non-nucleoside reverse transcriptase inhibitor rilpivirine. AIDS Rev 2013; 15 (2): 87–101.
80. Suzuki K, Doki K, Homma M et al. Co-administration of proton pump inhibitors delays elimination of plasma methotrexate in high-dose methotrexate therapy. Br J Clin Pharmacol 2009; 67 (1): 44–49. doi: 10.1111/j.1365-2125.2008.03303.x.
81. Ollier E, Delavenne X. Direct oral anticoagulant, useful pharmacological characteristics in clinical practice. Therapie 2015; 70 (3): 243–249. doi: 10.2515/therapie/2014206.
82. Bolek T, Samoš M, Stančiaková L et al. The impact of proton pump inhibition on dabigatran levels in patients with atrial fibrillation. Am J Ther 2017. doi: 10.1097/MJT.0000000000000599.
83. Reilly A, Lehr T, Haertter S et al. The effect of dabigatran plasma concentrations and patient characteristics on the frequency of ischemic stroke and major bleeding in atrial fibrillation patients: the RE-LY Trial (randomized evaluation of long-term anticoagulation therapy). J Am Coll Cardiol 2014; 63 (4): 321–8. doi: 10.1016/j.jacc.2013.07.104.
84. Špičák J. Inhibitory protonové pumpy: vedlejší účinky a interakce. Gastroent Hepatol 2013; 67 (4): 289-297.
85. Simon T, Verstuyft C, Mary-Krause M et al. Genetic determinants of response to clopidogrel and cardiovascular events. N Engl J Med 2009; 360 (4): 363–375. doi: 10.1056/NEJMoa0808227.
86. Venerito M, Kandulski A, Malfertheiner P. Dilemma between gastroprotection and cardiovascular prevention. Dtsch Med Wochenschr 2010; 135 (44): 2193–2198. doi: 10.1055/s-0030-1267498.
87. Bhatt DL, Cryer BL, Contant CF et al. Clopidogrel with or without omeprazole in coronary artery disease. N Engl J Med 2010; 363 (20): 1909–1917. doi: 10.1056/NEJMoa1007964.
88. O‘Donoghue ML, Braunwald E, Antman EM et al. Pharmacodynamic effect and clinical efficacy of clopidogrel and prasugrel with or without a proton-pump inhibitor: an analysis of two randomised trials. Lancet 2009; 374 (9694): 989–997. doi: 10.1016/S0140-6736 (09) 61525-7.
89. Goodman SG, Clare R, Pieper KS et al. Association of proton pump inhibitor use on cardiovascular outcomes with clopidogrel and ticagrelor: insights from the platelet inhibition and patient outcomes trial. Circulation 2012; 125 (8): 978–986. doi: 10.1161/CIRCULATIONAHA.111.032912.
90. Li XQ, Andersson TB, Ahlström M et al. Comparison of inhibitory effects of the proton pump-inhibiting drugs omeprazole, esomeprazole, lansoprazole, pantoprazole, and rabeprazole on human cytochrome P450 activities. Drug Metab Dispos 2004; 32 (8): 821–827.
91. European Medicines Agency. Public statement: Interaction between clopidogrel and proton pump inhibitors 2010. [online]. Dostupné z: https: //www.ema.europa.eu/documents/public-statement/public-statement-interaction-between-clopidogrel-proton-pump-inhibitors_en.pdf.
92. Agewall S, Cattaneo M, Collet JP et al. Expert position paper on the use of proton pump inhibitors in patients with cardiovascular disease and antithrombotic therapy. Eur Heart J 2013; 34 (23): 1708–1713. doi: 10.1093/eurheartj/eht042.
93. Wedemeyer RS, Blume H. Pharmacokinetic drug interaction profiles of proton pump inhibitors: an update. Drug Saf 2014; 37 (4): 201–211. doi: 10.1007/s40264-014-0144-0.
Labels
Paediatric gastroenterology Gastroenterology and hepatology SurgeryArticle was published in
Gastroenterology and Hepatology
2018 Issue 5
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
- Gastrointestinal oncology
- Evaluation of colorectal cancer screening centers in the Czech Republic
- Pancreatic cancer from the patients’s point of view
- Therapy of colorectal carcinoma liver metastases
- Comparison of sulfate-based solution and polyethylene glycol solution for bowel cleansing before colonoscopy – randomized, single-blind study
- Self-expanding duodenal stents, palliative treatment of gastric outlet obstruction in malignant disease
- Six years of the National program for colorectal cancer screening in Slovakia
- Proton pump inhibitors in the light of clinical studies and the safety profile of long-term use
- Gastrointestinal tract involvement in hereditary kidney diseases
- The selection from international journals
- Laparoscopic pancreaticoduodenectomy for ampullary adenocarcinoma – a case report
- А case of fulminant hepatitis against a background of paucity of the interlobular bile ducts
-
Novel developments in small bowel diseases and intestinal microbiota,
Sherine Khater (France) – Gastro Update Europe 2018, Prague
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Proton pump inhibitors in the light of clinical studies and the safety profile of long-term use
- Self-expanding duodenal stents, palliative treatment of gastric outlet obstruction in malignant disease
- Laparoscopic pancreaticoduodenectomy for ampullary adenocarcinoma – a case report
- Pancreatic cancer from the patients’s point of view
