Čtyřleté zkušenosti s monitorováním farmakokinetiky infliximabu a adalimumabu u pacientů s idiopatickými střevními záněty
Four-year experience of infliximab and adalimumab pharmacokinetics monitoring in patients with inflammatory bowel disease
Introduction: This study was designed to measure infliximab (IFX) and adalimumab (ADM) levels in patients with non-specific inflammatory bowel disease, to evaluate the influence of pharmacokinetics monitoring on optimization of treatment, to correlate the concentrations of these biologics with selected parameters, and to compare two laboratory methods of measuring IFX concentrations.
Methods: Patients with Crohn’s disease and ulcerative colitis, who were treated with IFX or ADM at the University Hospital of Ostrava between 1/2016 and 10/2019, were evaluated. Concentrations of biologics were measured in all patients using immunochromatographic methods, including enzyme-linked immunosorbent assay (ELISA) and point of care testing (POCT). Other demographic and clinical characteristics were measured, as were antibodies to IFX and ADM.
Results: Of the patients evaluated, 43.9% had IFX concentrations < 3 mg/l, 17.5% had IFX concentrations > 7 mg/l, and 7% had anti-IFX antibodies. Moreover, 18.5, 52.6, and 28.9% had ADM concentrations < 4 mg/l, 4–8 mg/l, and > 8 mg/l, resp. with 5.2% being positive for anti-ADM antibodies. Patient weight and duration of biological therapy showed statistically significant negative correlations with ADM concentration. Therapy was optimized in 56% of patients by intensification, in 12% by switching, in 8% by swapping, in 8% by adjustment of concomitant therapy, by dose reduction in 4% and by treatment termination in 12%. Clinical remission was achieved in 47.6% of patients and therapeutic responses in an additional 33.3%. Patients who completed treatment remained in remission, whereas de-escalation led to relapse. Concentrations measured by POCT and ELISA methods did not show statistically significant differences, with occasional casuistic clinically significant differences probably due to human error.
Conclusion: Reactive pharmacokinetic monitoring has become a regular part of the clinical practice and is widely applied, representing a rational foundation for biological therapy optimization. The future use of proactive monitoring is still open to discussion, dependent in particular on the health care payers’ attitudes.
Keywords:
infliximab – Ulcerative colitis – pharmacokinetics – adalimumab – Crohn’s disease
Authors:
Svoboda P. 1,2; Kupka T. 1,2; Krnáčová A. 3
Authors‘ workplace:
Interní klinika, FN Ostrava
1; Katedra interních oborů, LF OU, Ostrava
2; Ústav laboratorní diagnostiky, Oddělení klinické biochemie, FN Ostrava
3
Published in:
Gastroent Hepatol 2020; 74(2): 139-147
Category:
doi:
https://doi.org/10.14735/amgh2020139
Overview
Úvod: Cílem práce bylo měření hladin infliximabu (IFX) a adalimumabu (ADM) u pacientů s idiopatickými střevními záněty, zhodnocení vlivu měření farmakokinetiky na způsob optimalizace léčby, korelace hladin biologik s vybranými parametry a porovnání dvou laboratorních metod ke stanovení hladin IFX.
Metody: Do souboru pacientů byli zařazeni pacienti s Crohnovou nemocí a ulcerózní kolitidou léčení IFX nebo ADM ve FN Ostrava v období od 1/2016 do 10/2019. U všech pacientů byla stanovena hladina biologika a případný výskyt protilátek proti němu, dále byly hodnoceny důležité klinické a laboratorní ukazatele. Pro měření hladin biologických léčiv byla využita metoda ELISA (enzyme-linked immunosorbent assay) a imunochromatografická metoda v režimu POCT (point of care testing). Získaná data byla podrobena statistické analýze.
Výsledky: Hladina IFX < 3 mg/ l byla přítomna u 43,9 %, v rozmezí 3–7 mg/ l u 38,6 % a > 7 mg/ l u 17,5 % pacientů. Protilátky proti IFX byly přítomny u 7 % pacientů. U ADM byla situace příznivější – hladina < 4 mg/ l byla u 18,5 %, mezi 4 a 8 mg/ l u 52,6 %, > 8 mg/ l u 28,9 % pacientů a protilátky proti ADM byly nalezeny jen u 5,3 % pacientů. Analýza byla zaměřena na zjištění závislosti mezi sledovanými faktory a hladinou léku v krvi pacienta. Statisticky významný negativní vliv na hladinu ADM měla hmotnost pacienta, negativní vliv na hladinu biologik vykazovala i délka jejich podávání. Podíly optimalizací léčby byly následující: intenzifikace 56 %, switch 12 %, swap 8 %, úprava konkomitantní terapie 8 %, ukončení terapie 12 %, deeskalace dávky 4 %. Úpravou léčby bylo dosaženo klinické remise ve 47,6 %, dalších 33,3 % získalo terapeutickou odpověď. Pacienti s ukončenou terapií setrvávají v remisi, pacientka po deeskalaci dospěla k relapsu. Nebyly shledány statisticky významné rozdíly hladin získaných imunochromatografickou POCT a ELISA metodou. Případné kazuistické klinicky významné rozdíly byly dány pravděpodobně lidským faktorem.
Závěr: Reaktivní terapeutické monitorování koncentrace léčiv (TDM – therapeutic drug monitoring) se stalo již nedílnou součástí naší klinické praxe a je široce využíváno. Představuje racionální základ optimalizace biologické léčby. Otázkou zůstává budoucnost proaktivního TDM, zejména ochota plátců zdravotní péče akceptovat tento přístup.
Klíčová slova:
ulcerózní kolitida – Crohnova nemoc – infliximab – adalimumab – farmakokinetika
Úvod
Mezi idiopatické střevní záněty (IBD – inflammatory bowel disease) řadíme Crohnovu nemoc (CD – Crohn’s disease) a ulcerózní kolitidu (UC – ulcerative colitis). Jak z označení vyplývá, jsou to záněty, jejichž příčinu neznáme. Dlouhou dobu byla k dispozici pouze tzv. konvenční terapie, ke které řadíme mesalazin, kortikoidy a klasická imunosupresiva jako azathioprin (AZA), 6-merkaptopurin a metotrexát. V roce 1999 byl do léčebných postupů zařazen infliximab (IFX), v roce 2008 byl uvolněn k léčbě CD a následně v roce 2012 i k léčbě UC adalimumab (ADM), oba dva léky patří k tzv. biologické léčbě (BL), blokátorům tumor nekrotizujícího faktoru alfa (anti-TNF-α). Terapeutické monitorování koncentrace léčiv (TDM – therapeutic drug monitoring) představuje strategii pro optimalizaci BL. Podstatou TDM je měření hladiny léčiva před jeho dalším podáním (TL – trough level, TLI pro IFX, TLA pro ADM), kdy je hladina nejnižší, a detekce případných protilátek (ADA – antidrug antibody) proti němu. Cílem je zvolit optimální způsob úpravy léčby tak, aby byla pro pacienta bezpečná a zároveň maximálně účinná.
Cíl práce
- Měření farmakokinetiky u tzv. TDM naivního souboru pacientů, tedy pacientů, kteří do té doby neměli optimalizovanou léčbu na základě TDM.
- Hledání případných korelací mezi TL a věkem pacienta, jeho body mass indexem (BMI), délkou podávání biologika, aktivitou nemoci vyjádřenou klinickými indexy, hladinou C-reaktivního proteinu (CRP) a albuminu, kalprotektinem a zjištění vlivu TDM na způsob optimalizace léčby.
- Porovnání hodnot TLI změřených POCT (point of care testing) přístrojem s metodou ELISA (enzyme-linked immunosorbent assay).
Soubor pacientů a metodika
Do studie byli zařazováni pacienti s CD nebo UC léčení IFX nebo ADM v Centru biologické terapie IBD Fakultní nemocnice Ostrava, kteří podepsali informovaný souhlas. TDM bylo v rámci prvního cíle provedeno v období 1/ 2016–9/ 2017 metodou ELISA, v rámci druhého cíle 3/ 2018–6/ 2019 metodou ELISA a v rámci třetího cíle 1/ 2019–10/ 2019 metodou POCT i ELISA. Odběr krve za účelem farmakokinetického měření byl proveden těsně před aplikací biologika. Současně byl zhodnocen i klinický stav pacientů. Aktivita nemoci (remise / mírně aktivní choroba / aktivní choroba) byla u UC stanovena dle parciálního Mayova skóre (pMayo), u pacientů s CD na základě Harvey-Bradshawova indexu (HBI) aktivity nemoci a CDAI (Crohn’s disease activity index) (tab. 1). Bylo-li zařazení do příslušné kategorie aktivity nemoci na základě indexů HBI a CDAI rozdílné, bylo přiřazení ke kategorii aktivity nemoci provedeno na základě expertního posouzení lékařem. Dále byly provedeny odběry krve za účelem posouzení biochemické aktivity nemoci (kalprotektin, CRP, hematokrit, hemoglobin, trombocyty, albumin). Do protokolu se zaznamenával i druh BL, její dávkování, délka podávání, zda byla v úvodu konkomitantní léčba AZA, byla zjištěna hmotnost a výška pacientů a vypočítán jejich BMI. Součástí byl i údaj o indikaci TDM, zda bylo provedeno v rámci indukční léčby, u pacienta v remisi, při chronické aktivitě, resp. relapsu choroby. Na základě znalosti klinické a laboratorní aktivity nemoci a výsledků měření farmakokinetiky byla případně reaktivně optimalizována BL a po uplynutí 6 měsíců byla stejným způsobem přehodnocena aktivita nemoci.
Tab. 1. Assignment of disease activity category according to activity indexes.

V rámci třetího cíle byly měřeny hodnoty TLI paralelně imunochromatografickou metodou kazetového typu (RIDA®QUICK IFX) s následnou kvantitativní detekcí přístrojem (RIDA®QUICK SCAN II) firmy R-Biopharm v režimu POCT ve FN Ostrava a sendvičovou ELISA metodou v externí laboratoři (ImmunoGuide® IFX ELISA mAb-based). Diskrepantní výsledky byly opakovaně přeměřeny oběma metodami a navíc jinou ELISA soupravou (RIDASCREEN Monitoring, R-Biopharm) v Německu. Všechny použité metody používají specifické monoklonální protilátky proti IFX (R-Biopharm, MA-IFX6B7 a u ImmunoGuide, Peri-1).
K porovnání jednotlivých měření v čase jsme hodnotili terapeutickou TLI 3–7 mg/ l a TLA 4–8 mg/ l. Součástí analýzy byla popisná statistika kvantitativních (spojitých) i kvalitativních faktorů. Vzhledem k tomu, že spojité faktory nešlo považovat za výběr z normálního rozdělení (ověřeno Shapiro-Wilkovým testem), byly pro jejich popis použity medián (míra polohy) a interkvartilové rozpětí – dolní a horní kvartil (míra variability). Pro popis kvalitativních faktorů byly použity absolutní a relativní četnosti. V další analýze pak bylo předpokládáno, že analyzovaný výběr pacientů je náhodným výběrem vzhledem k onemocnění pacientů a podávanému léku. Vzhledem k výše uvedenému nesplnění předpokladu normality byly pro statistickou indukci použity neparametrické metody. Jako míra závislosti mezi hladinou léku a spojitými faktory byl použit Spearmanův korelační koeficient doplněný o příslušný test významnosti korelačního koeficientu. Vliv kvalitativních faktorů na hladinu léku byl posuzován na základě Mann-Whitneyova testu v případě, že se jednalo o dichotomický kvalitativní faktor, a Kruskal-Wallisův test v případě, že se jednalo o kvalitativní faktor s více než dvěma variantami. V případě nízkého počtu subjektů (n < 5) ve srovnávaných skupinách nebyly metody statistické indukce aplikovány.
Výsledky
V rámci prvního cíle bylo TDM provedeno u 95 pacientů, 52 mužů (55 %) a 43 (45 %) žen, věkové rozpětí bylo 18–66 let, průměr činil 38 let. S 66 (69,5 %) případy převažovala CD, ve 29 (30,5 %) případech šlo o UC. Celkem 57 (60 %) pacientů bylo léčeno IFX, 38 (40 %) bylo léčeno ADM. Převažovali pacienti v klinické remisi 65 (68 %), u 13 (14 %) bylo měření provedeno po indukční léčbě, u 17 (18 %) v rámci chronické aktivity nemoci či při jejím relapsu, což odpovídá reaktivnímu měření. Jednalo se o nemocné, u nichž zatím nebyla léčba optimalizována na základě TDM, jednalo se tedy o tzv. TDM naivní soubor. TLI < 3 mg/ l byla přítomna u 25 (43,9 %), v rozmezí 3–7 mg/ l u 22 (38,6 %), > 7 mg/ l u 10 (17,5 %) pacientů. Protilátky proti IFX (ATI) byly přítomny u čtyř (7 %) pacientů, 50 (87,7 %) pacientů užívalo konkomitantně prvních 6–12 měsíců s IFX i AZA. U ADM byla situace příznivější. TLA < 4 mg/ l byla u 7 (18,5 %), mezi 4 a 8 mg/ l u 20 (52,6 %), > 8 mg/ l u 11 (28,9 %) pacientů, protilátky proti ADM byly nalezeny jen u dvou (5,3 %) pacientů, konkomitantní léčba ADM + AZA v prvních 6–12 měsících BL byla u devíti (23,7 %) pacientů. Grafické rozložení hladin IFX a ADM u TDM naivního souboru znázorňuje graf 1.
Graph 1. Graphical percentage distribution of infliximab and adalimumab levels
(mg/L) in the TDM naive population.

V rámci druhého cíle bylo TDM provedeno u pacientů, z nichž část již měla v minulosti optimalizovanou BL na základě reaktivního TDM, nejednalo se tedy již o tzv. TDM naivní soubor. Měření bylo provedeno u 104 nemocných. Následná analýza se vztahuje k 95 pacientům, u nichž byly evidovány kompletní údaje. Do výběru bylo zařazeno 69 pacientů s CD (21 pacientů, tj. 30 % léčených ADM, 48 pacientů, tj. 70 % léčených IFX) a 26 pacientů s UC (3 pacienti, tj. 12 % léčení ADM, 23 pacientů, tj. 88 % léčených IFX). Základní struktura výběrového souboru pacientů je popsána v tab. 2.
Tab. 2. Basic aggregate statistics for observed numerical factors (median, lower and upper quartiles in brackets).
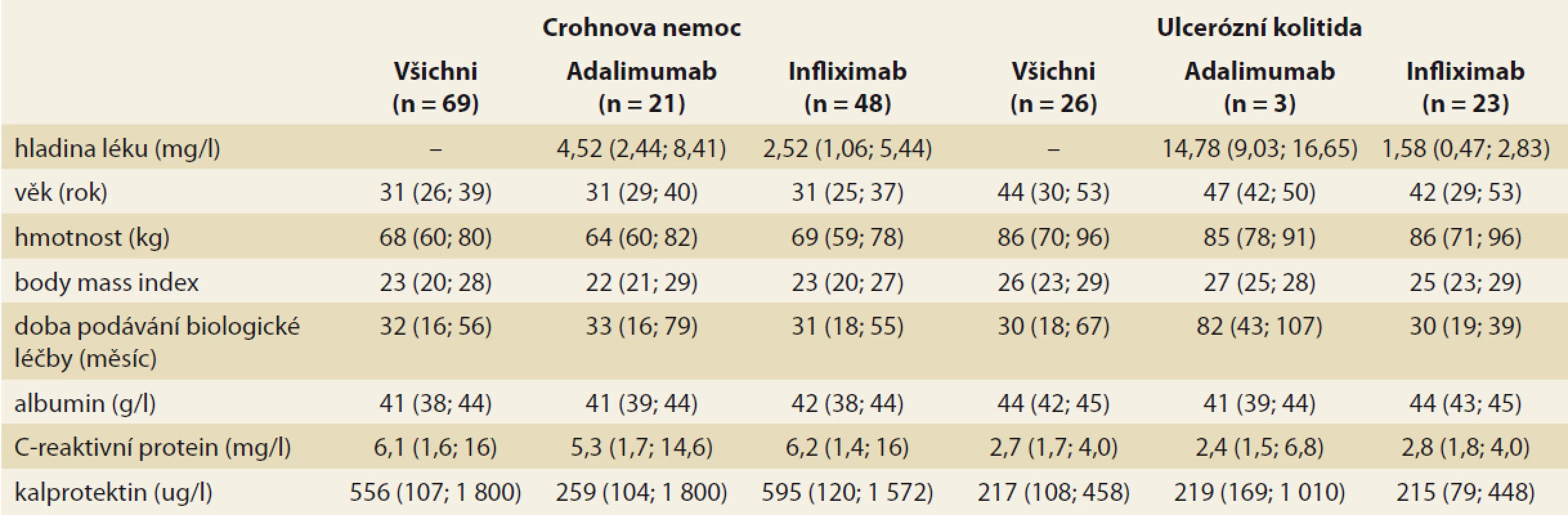
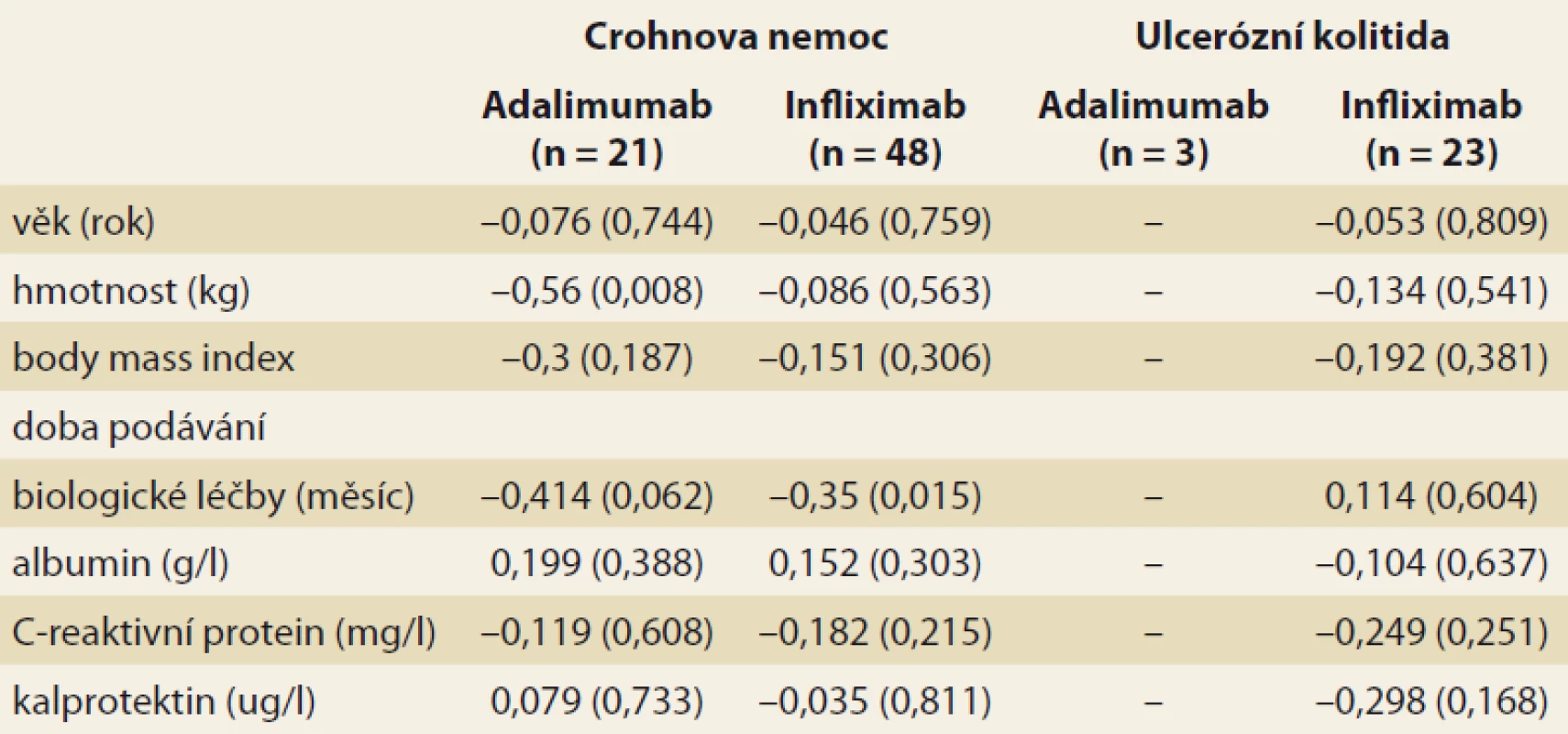
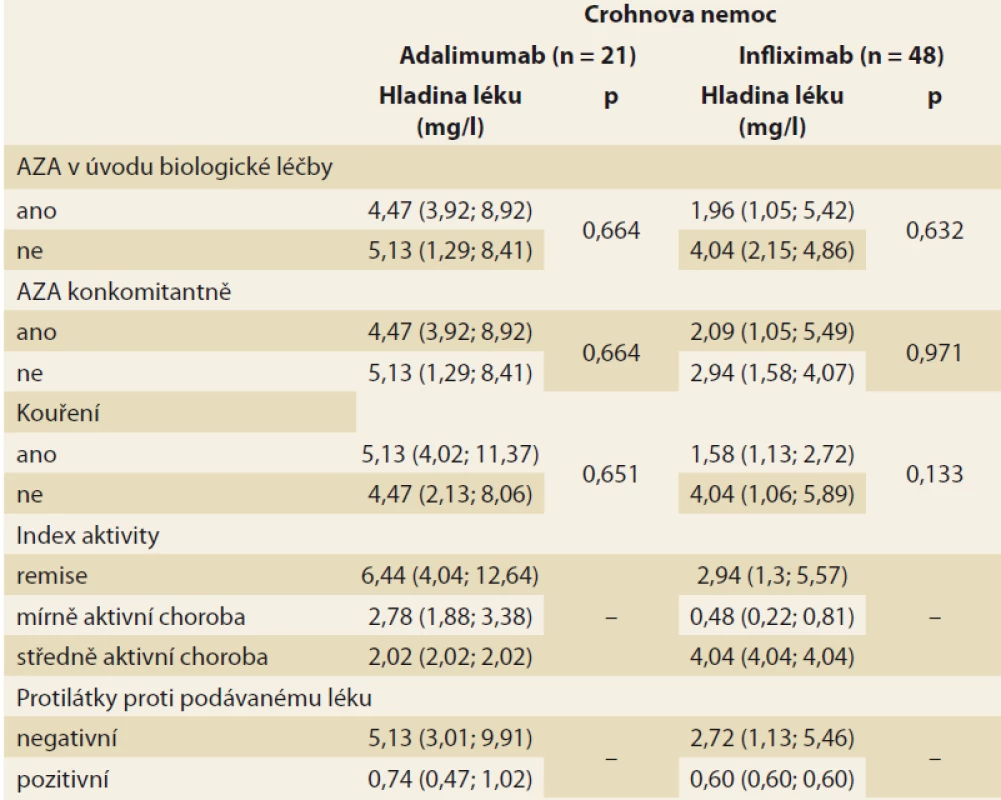
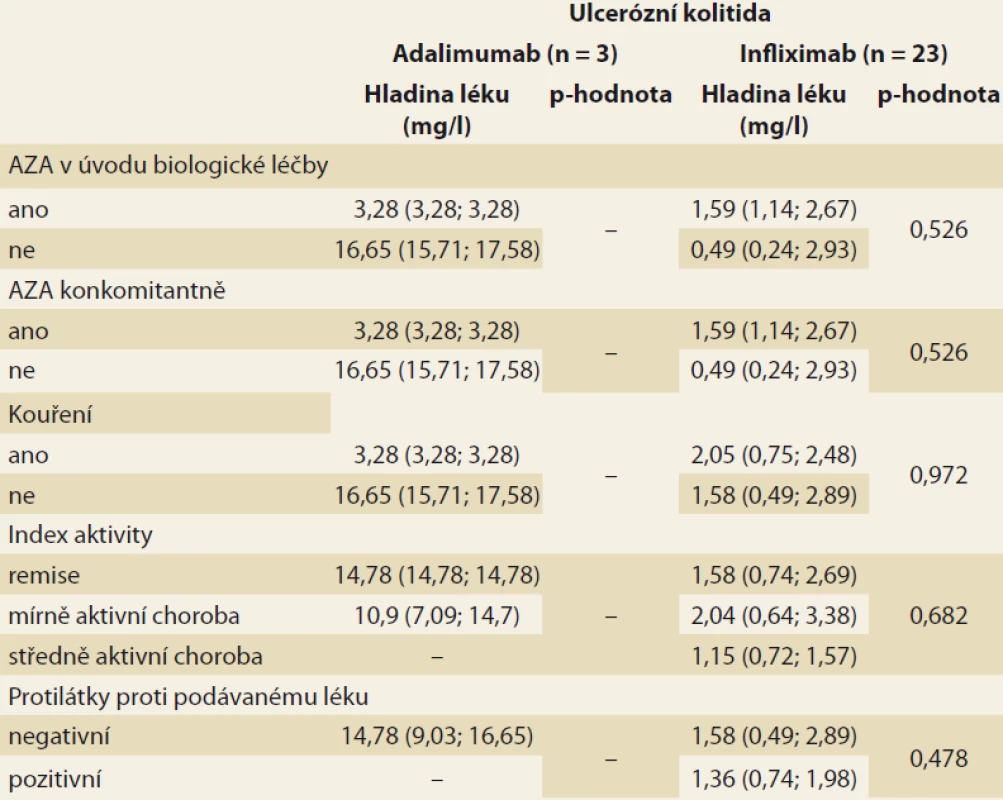
Analýza byla zaměřena na zjištění závislosti mezi sledovanými faktory a hladinou léku v krvi pacienta. V případě spojitých faktorů byla tato závislost hodnocena pomocí Spearmanova korelačního koeficientu (tab. 3). Jako statisticky významný vliv na hladinu léku v krvi byl v případě pacientů s CD hodnocen vliv hmotnosti (u pacientů užívajících ADM) a vliv doby podávání BL (u pacientů užívajících IFX). Vyšší hmotnost, obdobně jako vyšší doba podávání BL, statisticky významně souvisí s poklesem hladiny daného léku v krvi pacienta. U pacientů s CD se v případě ostatních spojitých faktorů neprokázala statisticky významná souvislost s hladinou léku v krvi pacienta. U pacientů s UC užívajícími IFX se u žádného ze spojitých faktorů neprokázal statisticky významný vliv na hladinu léku v krvi. U pacientů s UC užívajícími ADM nebylo vyhodnocení provedeno z důvodu nízkého počtu těchto pacientů (n = 3). Vliv kategoriálních faktorů na hladinu léku v krvi byl popsán pomocí základních měr polohy pro hladinu léku v krvi pacienta (medián, dolní a horní kvartil) a jeho statistická významnost byla hodnocena na základě výsledku Mann-Whitneyova testu v případě faktorů nabývajících dvou variant a na základě Kruskal-Wallisova testu v případě faktoru nabývajícího tří variant (kategorizovaný index aktivity) (tab. 4 a 5). V případě nízkého počtu subjektů ve skupinách testy prováděny nebyly. U žádného ze sledovaných faktorů nebyl prokázán statisticky významný vliv na hladinu léku v krvi.
Tab. 3. Correlation (Spearman’s correlation coefficient) among the observed continuous
factors and the blood level of the drug. The p-value of the correlation coefficient significance test is shown in brackets.
Tab. 4. Summary statistics for drug levels in the blood of a Crohn’s disease
patient according to monitored categorical factors (median, lower and upper
quartile in brackets), the p-value corresponds to the corresponding Mann-Whitney
test, resp. Kruskal-Wallis test for activity index.
Tab. 5. Basic statistics for drug levels in the blood of a patient with ulcerative colitis
according to observed categorical factors (median, lower and upper quartile
in brackets); the p-value corresponds to the corresponding Mann-Whitney test,
resp. Kruskal-Wallis test for activity index.
Ze souboru 95 nemocných byla optimalizace léčby na základě TDM provedena u 25 (26,3 %) z nich. Ve většině případů, u 21 (84 %) pacientů, byla provedena v rámci nedosažení remise či relapsu onemocnění, tedy v rámci reaktivního TDM. V rámci skupiny optimalizovaných pacientů se nejčastěji jednalo o intenzifikaci léčby, tj. navýšení dávkování již podávaného biologika, a to ve 14 případech (56 %). Méně byl proveden tzv. switch, tj. záměna biologik v rámci jedné terapeutické skupiny, a to u tří (12 %) pacientů, dále ve dvou (8 %) případech tzv. swap, tj. změna biologika za biologický lék s jiným mechanizmem účinku, a 2× (8 %) byla upravena jen konkomitantní léčba, tj. přidáno imunosupresivum nebo navýšena jeho dávka. U čtyř (16 %) pacientů v dlouhodobé hluboké remisi bylo přistoupeno k deeskalaci terapie. Třem pacientům (12 %) byla léčba IFX ukončena pro velmi nízké TLI a pozitivní ATI a IFX byl nahrazen AZA, u jednoho (4 %) pacienta se supraterapeutickou TLA byla jeho dávka redukována. Všichni pacienti, kteří podstoupili optimalizaci léčby, byli nadále sledováni a po 6 měsících byl přezkoumán jejich stav. Z 21 pacientů, kteří byli optimalizováni ve smyslu eskalace terapie, dosáhlo klinické remise deset (47,6 %) pacientů, dalších sedm (33,3 %) získalo terapeutickou odpověď, která byla definována jako pokles HBI nebo pMayo aspoň o jeden stupeň. Pouze u čtyři (16 %) pacientů se klinický stav nezlepšil. Všichni tři pacienti, kterým byla léčba biologikem za výše uvedených podmínek ukončena, setrvávají po 19, resp. 16, resp. 14 měsících v remisi. Naproti tomu u pacientky v hluboké remisi se supraterapeutickou TL došlo po deeskalaci dávky během 3 měsíců k relapsu UC a ani opětovná intenzifikace léčby s dosažením terapeutické TL již nevedla k remisi a pacientka musela podstoupit swap.
Od ledna 2019 jsme měli možnost měřit TLI také imunochromatografickou metodou v režimu POCT. Pro porovnání výsledků jsme se rozhodli u 50 pacientů změřit TLI současně POCT i ELISA metodou. Pozorované výsledky jsou zaznamenány v grafu 2. Mezi TLI zjištěnými jednotlivými metodami nebyl pozorován statisticky významný rozdíl (Wilcoxonův párový test; p = 0,128). Přesto z grafu vyplynulo, že výsledky TLI změřené na POCT přístroji byly zpravidla lehce vyšší. Klinicky signifikantní rozdíl byl pozorován u 6 (12 %) paralelních měření, kdy ELISA metodou byly naměřeny velmi nízké TL, kdežto v režimu POCT byly hodnoty v terapeutickém rozmezí, což je diskrepance mající zásadní vliv na způsob optimalizace léčby, a tím na klinický stav nemocných. U všech 6 pacientů byla provedena kontrolní opakovaná měření (stabilita zmraženého séra při –20 °C je 6 měsíců) oběma metodami jak v externí, tak i v naší laboratoři a jinou ELISA soupravou v Německu. Z tab. 6 vyplývá nízká interassay variabilita měření ve FN Ostrava a v Německu a naopak velká interassay variabilita měření v externí laboratoři. V následujícím období bylo provedeno dalších 44 paralelních měření a z grafu 3je patrné, že obě měření si již více odpovídají, zásadní diskrepance se objevila jen ve dvou (4,5 %) případech.
Graph 2. Comparison of ELISA and POCT results for the period 1/2019–6/2019; x-axis – patient number, y-axis – drug level.

Tab. 6. Comparison of TLI results (mg/l) between POCT in University Hospital Ostrava, ELISA in external laboratory and
POCT and ELISA in Germany.
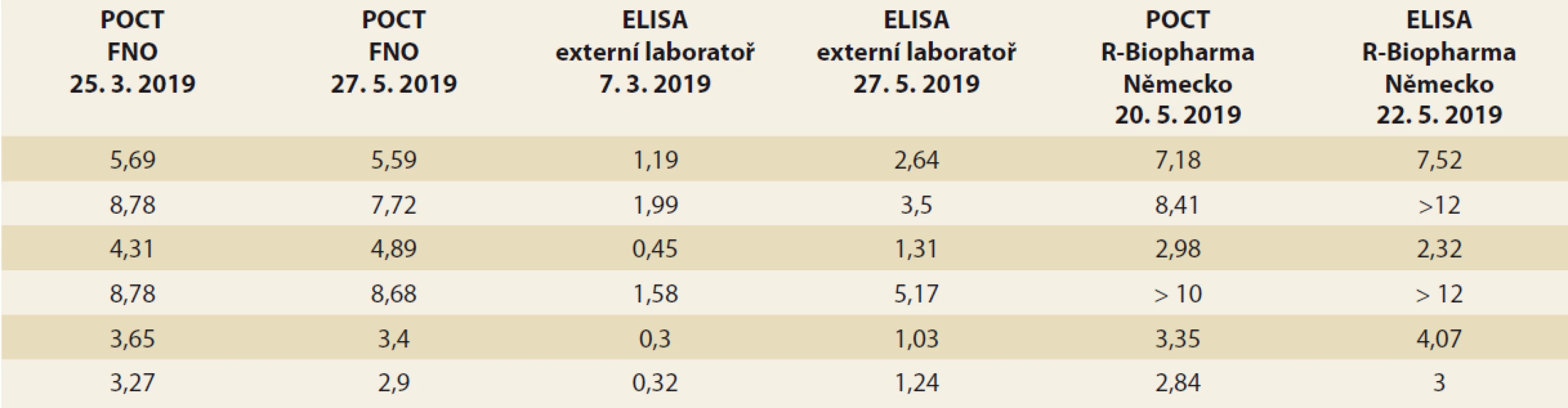
Graph 3. Comparison of ELISA and POCT results for the period 7/2019–10/2019; x-axis – patient number, y-axis – drug level in mg/l.

Diskuze
Jak bylo řečeno, základem TDM je měření hladin léku v séru a detekce případných protilátek proti němu. Námi zjištěné TL odrážejí situaci běžné klinické praxe do té doby nedotčené měřením farmakokinetiky, tedy léčby řízené pouze na základě hodnocení klinického stavu pacientů. Můžeme hovořit o tzv. TDM naivním souboru pacientů.
Pro nás tehdy překvapujícím zjištěním bylo, jak velká část našich pacientů nemá terapeutickou hladinu biologika. U IFX jí dosáhlo jen 38,6 %, u ADM byla situace o něco příznivější, ale i tak byla terapeutická hladina zjištěna jen u 52,6 % pacientů. Podobné měření bylo provedeno ve studii TAXIT, ve které TLI 3–7 mg/ l vykazovalo 44 % pacientů, což odpovídá našim měřením. Náš výsledek může být ovlivněn menší velikostí souboru, kdy jsme TLI měřili u 57 pacientů, kdežto ve studii TAXIT bylo zahrnuto 263 měření. V současné době neexistuje žádná jasná mezní hodnota TL, která by vedla k jisté klinické odpovědi [1]. V té době jsme vycházeli z terapeutických TLI 3–7 mg/ l, podobně jako Van de Castele et al ve svých farmakokinetických studiích [1]. Na druhou stranu např. Imaeda et al určili TLI důležitou pro dosažení slizničního zhojení u CD na 4 mg/ l [2]. Je známo, že k dosažení slizničního zhojení bývá potřeba vyšší TLI (6–10 mg/ l) než k dosažení klinické remise [3,4]. Perianální nemoc však vyžaduje ještě vyšší TLI 10–20 mg/ l [5,6]. American Gastroenterology Association (AGA) doporučuje cílové TLI ≥ 5 mg/ l a TLA ≥ 7,5 mg/ l [7]. Co se týče biosimilárního IFX a ADM, má se za to, že se neliší od originálních léčiv farmakokinetikou, farmakodynamikou ani imunogenicitou [8–11].
Součástí TDM je i měření protilátek proti biologikům. Každý biologický lék indukuje tvorbu protilátek bez ohledu na to, jestli se jedná o chimérickou, humanizovanou nebo plně humánní protilátku. U IFX jsme zjistili přítomnost ATI v 7 %, u ADM jen v 5,3 %. Je známo, že zejména u IFX snižuje kombinační terapie s AZA v prvních 6–12 měsících léčby výskyt ATI, tuto kombinační terapii mělo v našem souboru 87,7 % pacientů. U ADM je situace odlišná, v úvodu léčby se jeví kombinační terapie s AZA mírně efektivnější, ale v udržovací terapii se rozdíl stírá. V našem souboru mělo terapii ADM + AZA v úvodu jen 23,7 % pacientů. Ve studii SONIC byl výskyt ATI u pacientů na monoterapii IFX 14,6 %, zatímco u pacientů na kombinované terapii IFX + AZA 0,9 % [12]. K podobným výsledkům, ale u UC, dospěla i studie SUCCESS.
Další analýza získaných výsledků byla zaměřena na zjištění závislosti mezi sledovanými faktory a hladinou léku v krvi pacienta. Jako statisticky významný vliv na hladinu léku v krvi byl v případě pacientů s CD hodnocen vliv hmotnosti u pacientů užívajících ADM a vliv doby podávání BL u pacientů užívajících IFX. Vyšší hmotnost, obdobně jako delší doba podávání BL, statisticky významně souvisí s poklesem hladiny daného léku v krvi pacienta. Další statisticky významná korelace mezi TLI, TLA a sledovanými parametry (věk, hladina albuminu, CRP, fekální kalprotektin, index CDAI a pMayo, kombinační terapie s AZA) nebyla zjištěna. Zajímavým zjištěním byla souvislost mezi klesající TLA a rostoucí hmotností pacientů, neboť dle SPC se ADM nedávkuje dle hmotnosti pacienta, na rozdíl od IFX. Z literatury vyplývá vztah TL k BMI, hladině albuminu, aktivitě zánětu a kombinační terapii s imunomodulátory [13–15].
Vzhledem k tomu, že princip optimalizace léčby vychází z podstaty sekundárního selhání, které může být na podkladě farmakokinetickém (FK) při nízké TL nebo farmakodynamickém (FD) při terapeutické TL [16,17], a k tomu, že častěji byly při selhání terapie zjištěny subterapeutické hladiny a negativní protilátky, je logické, že nejčastějším krokem byla intenzifikace stávající terapie, a to v 56 % případů. Z toho můžeme odvodit, že v případě, kdy bychom neměli k dispozici možnost TDM u selhávající terapie, by prvním krokem měla být její intenzifikace, která se provádí u neimunitně podmíněného FK selhání charakterizovaného nedostatečnou TL a absencí ADA. U těchto pacientů bývá právě výhodné zvýšit koncentraci původního anti-TNF léku. Imunitně zprostředkované FK selhání s nízkou TL a pozitivními ADA bylo v našem souboru ve 12 %. Tento typ selhání se zpravidla řeší výměnou (switch) biologik v rámci jedné terapeutické skupiny, např. IFX za ADM. FD selhání (TL v terapeutickém rozmezí a ADA negativní) bylo přítomno v 8 %. V tomto případě se doporučuje záměna (swap) biologika za lék z jiné terapeutické skupiny, který má jiný mechanizmus účinku. U těchto pacientů by intenzifikace biologika či jeho změna v rámci jedné skupiny byla stejně efektivní jako jeho vysazení nebo symptomatická léčba, zatímco změna za biologikum jiné skupiny je pro pacienta přínosná [18–25]. Celkem u 12 % pacientů v dlouhotrvající hluboké remisi byla léčba IFX ukončena pro velmi nízké TLI a pozitivní ATI, IFX byl nahrazen AZA. Je otázkou, zda remise u těchto pacientů byla závislá na expozici biologika nebo byla důsledkem přirozeného vývoje nemoci. Z literatury vyplývá, že pokud u takových pacientů léčbu ukončíme, mají nízké riziko relapsu [26–28]. BL by se však neměla přerušovat u pacientů v klinické remisi, pokud mají vysoké riziko relapsu. To znamená, že mají potřebu kortikosteroidů, elevaci CRP, kalprotektinu, přetrvává u nich slizniční nález, remise má krátké trvání, jsou po chirurgické resekci, dále u kuřáků a u mužů. Ve 4 % byla dávka biologika redukována pro supraterapeutickou TLA na základě studie TAXIT a jiných zdrojů, které uvádějí, že redukce biologika u pacientů v klinické remisi se supraterapeutickou TL nemá vliv na klinický stav pacienta [4, 29–31]. Sledování pacientů s optimalizovanou léčbou na podkladě výsledků reaktivního TDM shledalo, že téměř polovina z nich dosáhla klinické remise a další třetina vykázala klinické zlepšení. Pouze u 16 % pacientů se klinický stav během 6 měsíců nezměnil. Pacient v hluboké remisi se supraterapeutickou TL bohužel po redukci dávky bilogika dospěl k relapsu navzdory předpokladům závěrů studie TAXIT. Naštěstí všichni pacienti s ukončenou BL za výše uvedených podmínek nadále setrvávají v remisi.
Existuje několik metod k měření TL a ADA. Měření TDM ELISA metodou je nejčastější, bohužel jí nedisponujeme v naší nemocnici, proto od počátku využíváme služeb externí laboratoře. V lednu 2019 jsme získali POCT přístroj určený pro kvantitativní detekci TLI stanoveného imunochromatografickou metodou. Na základě kontrolních měření se domníváme, že popsané diskrepantní výsledky jsou dány chybou externí laboratoře. I když interassay variabilita je dle údajů výrobců nižší u ELISA metody oproti chromatografické metodě vyhodnocené na našem POCT (10, resp. 16 %), výsledky ELISA metody externí laboratoře dosahovaly mnohem větší variability než výsledky POCT měření v naší laboratoři. S největší pravděpodobností bylo zdrojem této nečekaně velké interassay variability lidské pochybení vycházející z použití poloautomatu, kde nejdůležitější krok analytické fáze – ředění séra, kalibrátorů a kontrol – je připravován manuálně. Externí laboratoř navíc požádala výrobce o kontrolní materiál s nižšími hladinami IFX pro ověření kalibrační křivky. Toto podporuje i fakt, že po diskuzi s externí laboratoří docházelo k mnohem menším rozdílům mezi oběma metodami. Vzhledem k tomu, že POCT metoda a konfirmační metoda v Německu byly od jednoho výrobce, pro ucelenější analytický pohled by bylo vhodné zařadit do srovnání i soupravy jiných výrobců. Nicméně absence referenčního materiálu, která by umožnila standardizaci měření hladin IFX a ADM, může vést k nesourodým až neporovnatelným výsledkům a právě to představuje velký problém v klinické praxi [32].
Závěr
V naší práci jsme potvrdili, že pacienti s IBD léčení biologiky na základě klinického obrazu vykazují velmi často subterapeutické hladiny. V době jejich měření jsme vycházeli z doporučovaných hladin pro IFX ≥ 3 mg/ l a pro ADM ≥ 4 mg/ l. Pokud bychom vycházeli z dnes doporučených hladin pro IFX ≥ 5 mg/ l a pro ADM ≥ 7,5 mg/ l, pak by byl podíl pacientů se subterapeutickými hladinami ještě větší. Reaktivní TDM se stalo již nedílnou součástí naší klinické praxe a je široce využíváno. Představuje racionální základ optimalizace BL. Otázkou zůstává budoucnost proaktivního TDM, zejména ochota plátců zdravotní péče akceptovat tento přístup.
Teoreticky lze z naší práce odvodit, že pokud bychom neměli možnost TDM, pak statisticky nejpravděpodobnějším způsobem optimalizace léčby je její intenzifikace.
Také jsme prokázali, že hmotnost pacienta léčeného ADM negativně koreluje s jeho hladinou a že delší doba podávání anti-TNF-α statisticky významně souvisí s poklesem hladiny daného léku v krvi pacienta.
V rámci celého procesu TDM doporučujeme důslednou kontrolu jak pacientů, tak laboratoře, protože chyba může nastat na obou stranách – pacient se nedostaví na odběr TL ve správném intervalu, případně dojde k neoptimální přípravě séra. Výsledná hodnota hladiny léku může být nesprávná, což může mít zásadní klinický význam.
Doručeno/ Submitted: 16. 1. 2020
Přijato/ Accepted: 1. 3. 2020
MU Dr. Pavel Svoboda, Ph.D.
Interní klinika, FN Ostrava
17. listopadu 1790/ 5
708 52 Ostrava-Poruba
Konflikt zájmů: Autoři deklarují, že text článku odpovídá etickým standardům, byla dodržena anonymita pacientů a prohlašují, že v souvislosti s předmětem článku nemají finanční, poradenské ani jiné komerční zájmy.
Publikační etika: Příspěvek nebyl dosud publikován ani není v současnosti zaslán do jiného časopisu pro posouzení. Autoři souhlasí s uveřejněním svého jména a e-mailového kontaktu v publikovaném textu.
Dedikace: Práce byla podpořena studentským grantovým projektem Lékařské fakulty Ostravské univerzity SGS02/ LF/ 2018–2019.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Conflict of Interest: The authors declare that the article/ manuscript complies with ethical standards, patient anonymity has been respected, and they state that they have no financial, advisory or other commercial interests in relation to the subject matter.
Publication Ethics: This article/ manuscript has not been published or is currently being submitted for another review. The authors agree to publish their name and e-mail in the published article/ manuscript.
Dedication: The article/ manuscript was supported by a student grant project of the Faculty of Medicine of the University of Ostrava SGS02 / LF / 2018–2019.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Sources
1. Vande Casteele N, Ferrante M, Van Assche G et al. Trough concentrations of infliximab guide dosing for patients with inflammatory bowel disease. Gastroenterology 2015; 148(7): 1320–1329. doi: 10.1053/ j.gastro.2015.02.031.
2. Imaeda H, Bamba S, Takahashi K et al. Relationship between serum infliximab trough levels and endoscopic activities in patients with Crohn’s disease under schedule maintenance treatment. J Gastroenterol 2014; 49(4): 674–682. doi: 10.1007/ s00535-013-0829-7.
3. Mitrev N, Leong RW. Therapeutic drug monitoring of anti-tumour necrosis factor-αagents in inflammatory bowel disease. Expert Opin Drug Saf 2017; 16(3): 303–317. doi: 10.1080/ 14740338.2017.1269169.
4. Ungar B, Levy I, Yavne Y et al. Optimizing anti-TNF-α therapy: serum levels of infliximab and adalimumab are associated with mucosal healing in patients with inflammatory bowel diseases. Clin Gastroenterol Hepatol 2016; 14(4): 550–557. doi: 10.1016/ j.cgh.2015.10.025.
5. Yarur AJ, Kanagala V, Stein DJ et al. Higher infliximab trough levels are associated with perianal fistula healing in patients with Crohn’s disease. Aliment Pharmacol Ther 2017; 45(7): 933–940. doi: 10.1111/ apt.13970.
6. Mitrev N, Kariyawasam V, Leong RW. Infliximab trough cut-off for perianal Crohn’s disease – another piece of the therapeutic drug monitoring-guided infliximab dosing puzzle. Aliment Pharmacol Ther 2017; 45(9): 1279–1280. doi: 10.1111/ apt.14020.
7. Feuerstein JD, Nguyen GC, Kupfer SS et al. American Gastroenterological Association Institute guideline on therapeutic drug monitoring in inflammatory bowel disease. Gastroenterology 2017; 153(3): 827–834. doi: 10.1053/ j.gastro.2017.07.032.
8. Kolar M, Duricova D, Bortlik M et al. Biosimilar infliximab in anti-TNF-naïve IBD patiens – 1-year clinical follow-up. Gastroent Hepatol 2016; 70(6): 514–522. doi: 10.14735/ amgh2016514.
9. Malíčková K, Ďuricová D, Bortlík M et al. Serum trough infliximab levels: a comparison of three different immunoassays for monitoring of CT-P13 (infliximab) treatment in patients with inflammatory bowel disease. Biologicals 2016; 44(1): 33–36. doi: 10.1016/ j.biologicals.2015.09.005.
10. Ben-Horin S, Vande Casteele N, Schreiber S et al. Biosimilars in inflammatory bowel disease: facts and fears of extrapolation. Clin Gastroenterol Hepatol 2016; 14(12): 1685–1696. doi: 10.1016/ j.cgh.2016.05.023.
11. Hlavaty T, Krajcovicova A, Sturdik I. Biosimilar infliximab CT-P13 treatment in patients with inflammatory bowel diseases – a one-year, single-centre retrospective study. Gastroent Hepatol 2016; 70(1): 27–36. doi: 10.14735/ amgh201627.
12. Colombel JF, Sandborn WJ, Reinisch W et al. Infliximab, azathioprine, or combination therapy for Crohn’s disease. N Eng J Med 2010; 362(15): 1383–1395. doi: 10.1056/ NEJMoa0904492.
13. Melmed GY, Irving PM, Jones et al. Appropriateness of testing for anti-tumor necrosis factor agent and antibody concentrations ad interpretation of results. Clin Gastroenterol Hepatol 2016; 14(9): 1302–1309. doi: 10.1016/ j.cgh.2016.05.010.
14. Dotan I, Roy Y, Yanai H et al. Patient factors that increase infliximab clearance and shorten half-life in inflammatory bowel disease: a population pharmacokinetic study. Inflamm Bowel Dis 2014; 20(12): 2247–2259. doi: 10.1097/ MIB.0000000000000212.
15. Yarur AJ, Jain A, Sussman DA et al. The association of tissue anti-TNF drug levels with serological and endoscopic disease activity in inflammatory bowel disease: the ATLAS study. Gut 2016; 65(2): 249–255. doi: 10.1136/ gutjnl-2014-308099.
16. Vande Casteele N, Feagan BG, Gils A et al. Therapeutic drug monitoring in inflammatory bowel disease: current state and future perspectives. Curr Gastroenterol Rep 2014; 16(4): 378. doi: 10.1007/ s11894-014-0378-0.
17. Vande Casteele N, Herfarth H, Katz J et al. American Gastroenterological Association Institute technical review on the role of therapeutic drug monitoring in the management of inflammatory bowel diseases. Gastroenterology 2017; 153(3): 835–857. doi: 10.1053/ j.gastro.2017.07.031.
18. Roblin X, Rinaudo M, Del Tedesco E et al. Development of an algorithm incorporating pharmacokinetics of adalimumab in inflammatory bowel diseases. Am J Gastroenterol 2014; 109(8): 1250–1256. doi: 10.1038/ ajg.2014.146.
19. Yanai H, Lichtenstein L, Assa A et al. Levels of drug and antidrug antibodies are associated with outcome of interventions after loss of response to infliximab or adalimumab. Clin Gastroenterol Hepatol 2015; 13(3): 522–530. doi: 10.1016/ j.cgh.2014.07.029.
20. Feuerstein JD, Nguyen GC, Kupfer SS et al. American Gastroenterological Association Institute guideline on therapeutic drug monitoring in inflammatory bowel disease. Gastroenterology 2017; 153(3): 827–834. doi: 10.1053/ j.gastro.2017.07.032.
21. Strik AS, Bots SJ, D’Haens G et al. Optimization of anti-TNF therapy in patients with inflammatory bowel disease. Expert Rev Clin Pharmacol 2016; 9(3): 429–439. doi: 10.1586/ 17512433.2016.1133288.
22. Ding NS, Hart A, de Cruz P. Systematic review: predicting and optimising response to anti-TNF therapy in Crohn’s disease – algorithm for practical management. Aliment Pharmacol Ther 2016; 43(1): 30–51. doi: 10.1111/ apt.13445.
23. Karmiris K, Paintaud G, Noman M et al. Influence of trough serum levels and immunogenicity on long-term outcome of adalimumab therapy in Crohn’s disease. Gastroenterology 2009; 137(5): 1628–1640. doi: 10.1053/ j.gastro.2009.07.062.
24. Minar P, Saeed SA, Afreen M et al. Practical use of infliximab concentration monitoring in pediatric Crohn disease. J Pediatr Gastroenterol Nutr 2016; 62(5): 715–722. doi: 10.1097/ MPG.0000000000001029.
25. Viola F, Civitelli F, Di Nardo G et al. Efficacy of adalimumab in moderate-to-severe pediatric Crohn’s disease. Am J Gastroenterol 2009; 104(10): 2566–2571. doi: 10.1038/ ajg.2009.372.
26. Flamant M, Roblin X. Could therapeutic drug monitoring of anti-TNF-α be useful to consider a de-escalation of treatment? Expert Opin Biol Ther 2015; 15(11): 1657–1660. doi: 10.1517/ 14712598.2015.1069273.
27. Louis E, Mary JY, Vernier-Massouille G et al. Maintenance of remission among patients with Crohn’s disease on antimetabolite therapy after infliximab therapy is stopped. Gastroenterology 2012; 142(1): 63–70. doi: 10.1053/ j.gastro.2011.09.034.
28. Papamichael K, Vande Casteele N, Gils A et al. Long-term outcome of patients with Crohn’s disease who discontinued infliximab therapy upon clinical remission. Clin Gastroenterol Hepatol 2015; 13(6): 1103–1110. doi: 10.1016/ j.cgh.2014.11.026.
29. Steenholdt C, Brynskov J, Thomsen OØ et al. Individualised therapy is more cost-effective than dose intensification in patients with Crohn’s disease who lose response to anti-TNF treatment: a randomised, controlled trial. Gut 2014; 63(6): 919–927. doi: 10.1136/ gutjnl-2013-305279.
30. Steenholdt C, Brynskov J, Thomsen OØ et al. Individualized therapy is a long-term cost-effective method compared to dose intensification in Crohn’s disease patients failing infliximab. Dig Dis Sci 2015; 60(9): 2762–2770. doi: 10.1007/ s10620-015-3581-4.
31. Vande Casteele N, Khanna R, Levesque BG et al. The relationship between infliximab concentrations, antibodies to infliximab and disease activity in Crohn’s disease. Gut 2015; 64(10): 1539–1545. doi: 10.1136/ gutjnl-2014-307883.
32. Jalali Y, Krajcovicova A, Hlavaty T et al. Therapeutic drug monitoring in the treatment of imflammatory bowel dinase with infliximab. Gastroent Hepatol 2018; 72(1): 41–46. doi: 10.14735/ amgh201841.
Labels
Paediatric gastroenterology Gastroenterology and hepatology SurgeryArticle was published in
Gastroenterology and Hepatology
2020 Issue 2
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Spasmolytic Effect of Metamizole
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
- Covid-19 a játra
- Editorial
- Doporučený postup České hepatologické společnosti ČLS JEP pro diagnostiku a léčbu nealkoholové tukové choroby jater
- Doporučení pro léčbu idiopatických střevních zánětů v době pandemie covid-19
- Odporúčania slovenskej Pracovnej skupiny pre IBD pri SGS pre liečbu biosimilárnymi anti-TNF biologikami u dospelých a detských pacientov
- Endoskopická drenáž infikované ohraničené pankreatické nekrózy s komplikovaným průběhem – kazuistika
- Čtyřleté zkušenosti s monitorováním farmakokinetiky infliximabu a adalimumabu u pacientů s idiopatickými střevními záněty
- Vedolizumab v léčbě Crohnovy choroby ve světle nových poznatků
- Laserová litotripse zaklíněného biliárního konkrementu v tlustém střevě
- Anderson-Fabryho choroba a postižení gastrointestinálního traktu
- Gastroenterologie a gastrointestinální endoskopie v podmínkách pandemie viru SARS-CoV-2
- Devadesátiny doc. MU Dr. Miloše Sedláčkové, CSc.
- Životní jubileum As. MU Dr. Hany Dvořákové, CSc.
- Komentář k článku: Caha M, Politová P, Vlk R et al. Překvapivá příčina úmrtí pacienta s krvácením do horního trávicího traktu. Gastroent Hepatol 2020; 74(1): 50–53. doi: 10.14735/ amgh202050.
- Výběr z mezinárodních časopisů
- Kreditovaný autodidaktický test
- Infekcie u pacientov hospitalizovaných s pokročilým chronickým ochorením pečene (cirhóza) – skúsenosti jedného centra
- De novo nealkoholová tuková choroba pečene po transplantácii pečene – diagnostikovaná pomocou magnetickej rezonancie
-
Novel Pancreatic Developmentsprof. Peter Layer – Gastro Update Europe 2019, Budapest
Nové poznatky o pankreatu -
Biliopancreatic endoscopy
prof. Marco Bruno – Gastro Update Europe 2019, Budapest - Nové poznatky ve střevní endoskopii
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Covid-19 a játra
- Endoskopická drenáž infikované ohraničené pankreatické nekrózy s komplikovaným průběhem – kazuistika
- Doporučený postup České hepatologické společnosti ČLS JEP pro diagnostiku a léčbu nealkoholové tukové choroby jater
- Doporučení pro léčbu idiopatických střevních zánětů v době pandemie covid-19
