Autoimunní hepatitida po očkování proti covidu-19
Autoimmune hepatitis after vaccination against COVID-19
In this case report, we present a 61-year-old patient admitted to the hospital because of tiredness and jaundice less than three weeks after vaccination against SARS-CoV-2 with the first dose of the Comirnaty vaccine (Pfizer/BioNTech). Based on the patient’s medical history, laboratory data, imaging methods and liver biopsy, we diagnosed autoimmune hepatitis. The patient developed acute liver failure, and his liver function did not improve after corticosteroid administration. Therefore, the patient was enrolled in the waiting list and underwent a successful orthotopic liver transplantation.
Keywords:
vaccination – liver failure – COVID-19 – autoimmune hepatitis
Authors:
V. Pítová 1; J. Šperl 1
; P. Taimr 1; O. Fabián 2,3; T. Miřejovský 2; L. Janoušek 4; J. Chlupáč 4,5; J. Špičák 1; S. Fraňková 1
Authors‘ workplace:
Klinika hepatogastroenterologie IKEM, Praha
1; Pracoviště klinické a transplantační patologie IKEM, Praha
2; Ústav patologie a molekulární medicíny 3. LF UK a FTN, Praha
3; Klinika transplantační chirurgie IKEM, Praha
4; Ústav anatomie 2. LF UK, Praha
5
Published in:
Gastroent Hepatol 2023; 77(1): 52-56
Category:
Hepatology: case report
doi:
https://doi.org/10.48095/ccgh202352
Overview
V této kazuistice popisujeme případ 61letého muže, který byl přijat k hospitalizaci pro únavu a ikterus < 3 týdny po očkování proti viru SARS-CoV-2 první dávkou vakcíny Comirnaty (Pfizer/BioNTech). Z provedených vyšetření (anamnéza, laboratorní vyšetření, zobrazovací metody, jaterní biopsie) byla diagnostikována autoimunní hepatitida. U pacienta se rozvinulo akutní jaterní selhání a nezareagoval na podání kortikoidů. Byl zařazen na čekací listinu a podstoupil transplantaci jater, která vedla k záchraně života pacienta.
Klíčová slova:
jaterní selhání – očkování – COVID-19 – autoimunní hepatitida
Úvod
Autoimunní hepatitida (AIH) je zánětlivé onemocnění jater charakterizované zvýšenými hodnotami sérových aminotransferáz (ALT, AST), přítomností autoprotilátek, hypergamaglobulinemií a typickým histologickým nálezem. Klinicky se může manifestovat akutním jaterním selháním, častější je však chronický průběh vedoucí ke vzniku jaterní fibrózy až jaterní cirhózy. Základem dlouhodobé léčby je podávání kortikoidů a/nebo azathioprinu. V případě akutního jaterního selhání či dekompenzované jaterní cirhózy má být zvážena možnost transplantace jater.
Popis případu
Popisujeme případ 61letého muže, který byl přijat do okresní nemocnice ve Středočeském kraji 24. 5. 2021 pro únavu a ikterus. Pacient byl obézní (BMI 37 kg/m2), léčil se s arteriální hypertenzí trojkombinací antihypertenziv (ACE inhibitor, betablokátor, diuretikum) a pro hyperurikemii užíval allopurinol. V posledním roce u něj nedošlo k žádné změně farmakoterapie. Před 2 roky mu byla zjištěna mírná elevace aktivit jaterních enzymů v rámci interního předoperačního vyšetření před náhradou pravého kolenního kloubu, blíže však vyšetřen nebyl. Dne 2. 5. 2021 byl pacient očkovaný proti viru SARS-CoV-2 první dávkou vakcíny Comirnaty (Pfizer/BioNTech). Již po očkování pociťoval zvýšenou únavu, která neustupovala, a 21. 5. 2021 jeho manželka poprvé zpozorovala zežloutnutí kůže a sklér. Při příchodu do nemocnice měl bilirubin 482,3 µmol/l, AST 16,46 µkat/l, ALT 23 µkat/l, ALP 3 µkat/l, GGT 2 µkat/l, albumin 33 g/l, INR 1,3, negativní sérologii hepatitidy A, B a C. Byl mu proveden ultrazvuk a CT břicha, které byly bez zjevné patologie žlučových cest, nebylo prokázáno ložiskové postižení jater, byla zjištěna cholecystolitiáza a jaterní steatóza. Přesto byla provedena endoskopická retrográdní cholangiopankreatografie (ERCP) s papilotomií a zavedením biliárního stentu, konkrementy ve žlučových cestách prokázány nebyly. Při dalším pátrání po příčině jaterního onemocnění byla zjištěna hypergamaglobulinemie a bylo vysloveno podezření na autoimunní hepatitidu. Pacient byl referován do IKEM a 11. 6. 2021 byl přijat na lůžko Kliniky hepatogastroenterologie. Vyloučili jsme: virové hepatitidy (A, B, C, E), deficit a1-antitrypsinu, hladina ceruloplasminu byla v normě, negativní byla sérologie HIV, CMV, EBV a HSV, negativní protilátky anti-AMA, anti-LKM, anti-SMA, ANCA. Byla zjištěna pozitivita antinukleárních (ANA) protilátek (titr 1 : 2 560) a elevace IgG (45 g/l; norma 5,40–18,2 g/l). Vybrané laboratorní výsledky jsou uvedeny v tab. 1.
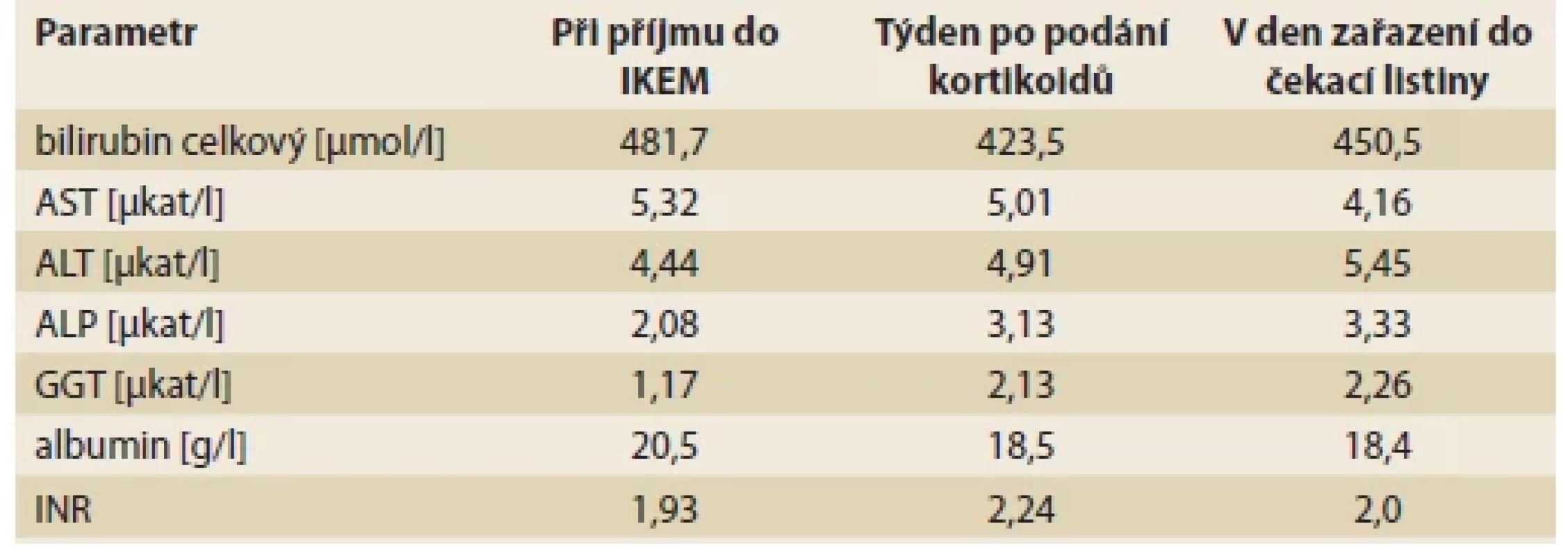
Tab. 1. Laboratory results.
Vzhledem ke koagulopatii jsme provedli jaterní biopsii transjugulární cestou. Histologické vyšetření (obr. 1a a 1b) bylo v souladu s klinicky zvažovanou diagnózou AIH (zánětlivá jaterní léze s lobulární aktivitou zánětu, plazmocyty a centrolobulární nekrózou) a byla popsána již septální fibróza. Zahájili jsme léčbu kortikoidy (prednison 80 mg/den), která vedla pouze k mírnému poklesu bilirubinu, avšak nedošlo ke zlepšení syntetické funkce jater. Rozhodli jsme se zahájit protokolární vyšetření před transplantací jater, která neshledala kontraindikaci k výkonu, a pacient byl 25. 6. 2021 zařazen do čekací listiny (WL) k ortotopické transplantaci jater. V průběhu hospitalizace došlo k rozvoji jaterní encefalopatie a anasarky. Dne 22. 7. 2021 pacient podstoupil ortotopickou transplantaci jater. Výkon byl chirurgicky nekomplikovaný kromě vyšší krevní ztráty (8 litrů) s nutností náhrady krevními deriváty, z toho důvodu bylo rozhodnuto o ponechání 4 longet (tzv. packing) a naplánování revize břišní dutiny. Dne 24. 7. 2021 byla provedena operační revize, odstranění longet a definitivní sutura rány. Extubace byla následována kvalitativní poruchou vědomí přetrvávající do 27. 7. 2021. Imunosuprese byla podávána ve standardní trojkombinaci tacrolimus, mykofenolát mofetil a prednison. Rozvoj funkce jaterního štěpu byl rychlý, jaterní testy postupně klesaly až na normální hodnoty. Pacient byl propuštěn do domácí péče 23. pooperační den. V explantátu jater byla zjištěna cirhotická přestavba, vysoká zánětlivá aktivita v septech a uzlech jaterního parenchymu (interface aktivita). Místy byly přítomny i plošné nekrózy a početnější plazmocyty, tedy změny typické pro AIH. Histologické vyšetření explantátu jater je na obr. 2a a 2b.
Fig. 1. a, b) Transjugular liver biopsy.
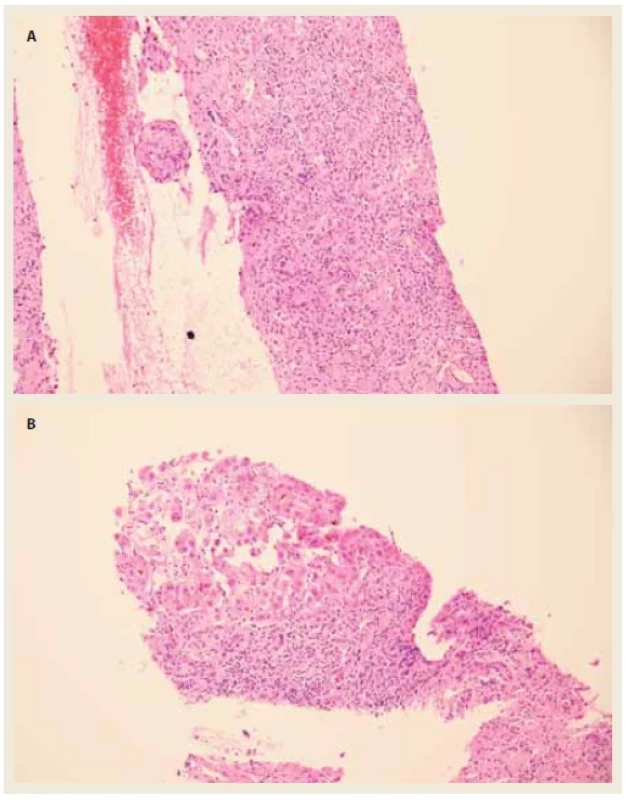
Infl ammatory liver lesion with interface and lobular activity of infl ammation and widespread
destruction of hepatocytes. Vital hepatocytes are hydroptically altered, with signs of hepatocanalicular
cholestasis (hematoxylin and eosin, 200×).
Fig. 2. a, b) Liver explant histopathology.
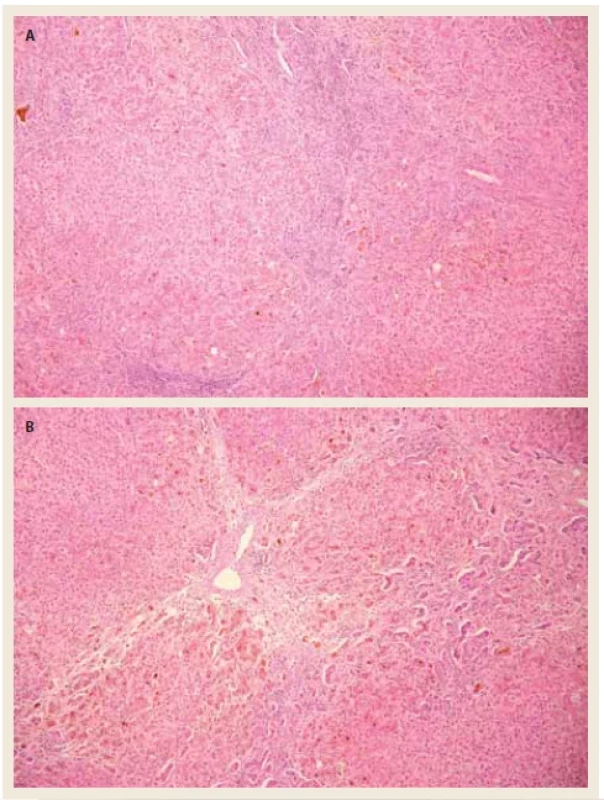
Liver parenchyma with an image of nodular remodeling. There is signifi cant infl ammatory activity
in the fi brous septa, which penetrates into the liver parenchyma with widespread destruction
of hepatocytes. Conspicuous intracanalicular cholestasis persists (hematoxylin and eosin,
200×).
Diskuze
Rozvoj AIH po očkování mRNA vakcínou proti covidu-19 bylo v literatuře doposud popsáno v několika kazuistických sděleních. První případ popsali Bril et al již v březnu 2021 [1]. Jednalo se o 35letou ženu, zdravotnici z Alabamy (USA), 3 měsíce po porodu. Během těhotenství se u ní rozvinula gestační hypertenze, pro kterou byla zahájena léčba labetalolem. Dne 4. 1. 2021 byla očkována první dávkou vakcíny Comirnaty. Týden po očkování došlo k rozvoji pruritu, následně ikteru a 13. den po vakcinaci byla přijata k hospitalizaci. Na základě laboratorních a histologických výsledků byla stanovena diagnóza AIH a nasazena léčba kortikoidy. Dva měsíce po nasazení kortikoidů s postupným snižováním dávek u ní došlo k normalizaci jaterních testů a bilirubinu. V reakci na vydání tohoto článku bylo publikováno několik dalších případů rozvoje AIH po vakcinaci různými vakcínami proti covidu-19. Jejich souhrn je uveden v tab. 2.
Tab. 2. Characteristics of patients with AIH after vaccination against COVID-19.
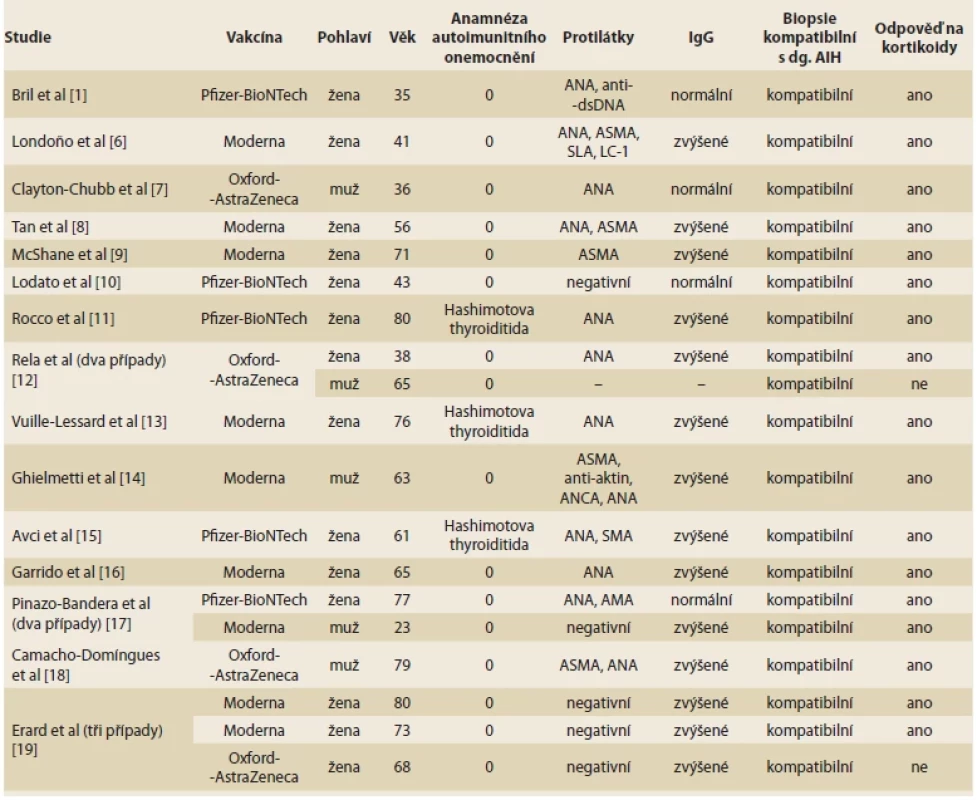
V naprosté většině případů došlo ke zlepšení klinického stavu a laboratorního nálezu pacientů po zahájení léčby kortikoidy. Ve dvou z publikovaných zahraničních případů také došlo k rozvoji jaterního selhání. První pacient transplantaci jater odmítl a druhá pacientka byla sice zařazena na čekací listinu k transplantaci jater, ale do 3 dnů zemřela. I v našem případě došlo k rozvoji jaterního selhání, které však neskončilo fatálně díky možnosti a provedení ortotopické transplantace jater. Z explantátu zjištěná jaterní cirhóza mohla být způsobena dříve nediagnostikovanou AIH, v úvahu rovněž připadá nealkoholická steatohepatitida jako preexistující onemocnění jater (pacient byl obézní, negoval nadměrný přísun alkoholu). Mohlo tedy jít o tzv. flare AIH navozený očkováním či o de novo vzniklou AIH způsobující akutní jaterní selhání nasedající na chronické selhání jater při jaterní cirhóze (ACLF – acute-on-chronic liver failure). Histologické vyšetření explantátu jater v této otázce nebylo diagnosticky přínosné, ve stadiu jaterní cirhózy obvykle steatóza, která je jinak nedílnou součástí histologické diagnózy nealkoholické steatohepatitidy, není přítomna, neboť vymizí s pokročilým jaterním onemocněním. V literatuře jsou popsány případy rozvoje autoimunitní hepatitidy po očkování proti viru chřipky a viru hepatitidy A [2,3]. Přesný mechanizmus vzniku není jasný, ale roli pravděpodobně hraje genetická predispozice, expozice cizím antigenům homologním s lidskými antigeny (tzv. molekulární mimikry) a stimulace imunitního systému složkami vakcíny [4]. Vojdani et al zjistili, že protilátky proti spike proteinu viru SARS-CoV-2 mají také vysokou afinitu k proteinům lidských tkání, mimo jiné i nukleárnímu antigenu. mRNA vakcíny od firem Pfizer/BioNTech a Moderna vedoucí k tvorbě protilátek proti covidu-19 mohou u predisponovaných jedinců vést k rozvoji autoimunitního onemocnění [5]. K rozvoji AIH může dojít nejen po mRNA vakcínách, ale i po vektorových či jiných vakcínách. Adjuvans vakcín mohou přispět k jejich imunogenicitě [6]. Přesný mechanizmus vzniku autoimunitních onemocnění po vakcinaci různými vakcínami proti covidu-19 zatím není zcela jasný.
Závěr
Očkování mRNA vakcínou proti viru SARS-CoV-2 bylo následováno rozvojem akutního jaterního selhání při AIH krátce po podání první dávky vakcíny. Mohlo se jednat o velmi vzácný nežádoucí účinek vakcinace, přesto je zřejmé, že přínosy vakcinace jsou mnohonásobně vyšší než její potenciální rizika.
Doručeno/Submitted: 29. 8. 2022
Přijato/Accepted: 3. 11. 2022
MUDr. Veronika Pítová
Klinika hepatogastroenterologie
Institut klinické a experimentální medicíny
Vídeňská 1958/9
140 21 Praha 4
Konflikt zájmů: Autoři deklarují, že text článku odpovídá etickým standardům, byla dodržena anonymita pacientů a prohlašuji, že v souvislosti s předmětem článku nemají finanční, poradenské ani jiné komerční zájmy.
Publikační etika: Příspěvek nebyl dosud publikován ani není v současnosti zaslán do jiného časopisu pro posouzení. Autoři souhlasí s uveřejněním svého jména a e-mailového kontaktu v publikovaném textu.
Dedikace: Práce byla podpořena Nadačním fondem IBD-Comfort. Děkujeme Bc. Janě Horutové a Mgr. Lee Čermákové za vynikající spolupráci při sběru dat. Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bio medicínských časopisů.
Conflict of Interest: The authors declare that the article/ manuscript complies with ethical standards, patient anonymity has been respected, and they state that they have no
financial, advisory or other commercial interests in relation to the subject matter.
Publication Ethics: This article/ manuscript has not been published or is currently being submitted for another review. The authors agree to publish their names and e-mails
in the published article/ manuscript.
Dedication: The work was supported by the IBD-Comfort Foundation. Thank you Bc. Jana Horutová and Mgr. Lea Čermáková for excellent cooperation in data collection.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Gastroent Hepatol 2023; 77(1): 52 – 56
Sources
1. Bril F, Al Diffalha S, Dean M et al. Autoimmune hepatitis developing after coronavirus disease 2019 (COVID-19) vaccine: Causality or casualty? J Hepatol 2021; 75 (1): 222–224. doi: 10.1016/j.jhep.2021.04.003.
2. Sasaki T, Suzuki Y, Ishida K et al. Autoimmune hepatitis following influenza virus vaccination: Two case reports. Medicine (Baltimore) 2018; 97 (30): e11621. doi: 10.1097/MD.000000 0000011621.
3. Berry PA, Smith-Laing G. Hepatitis A vaccine associated with autoimmune hepatitis. World J Gastroenterol 2007; 13 (15): 2238–2239. doi: 10.3748/wjg.v13.i15.2238.
4. Segal Y, Shoenfeld Y. Vaccine-induced autoimmunity: the role of molecular mimicry and immune crossreaction. Cell Mol Immunol 2018; 15 (6): 586–594. doi: 10.1038/cmi.2017.151.
5. Vojdani A, Kharrazian D. Potential antigenic cross-reactivity between SARS-CoV-2 and human tissue with a possible link to an increase in autoimmune diseases. Clin Immunol 2020; 217 : 108480. doi: 10.1016/j.clim.2020.108 480.
6. Londoño MC, Gratacós-Ginès J, Sáez-Peñataro J. Another case of autoimmune hepatitis after SARS-CoV-2 vaccination – still casualty? J Hepatol 2021; 75 (5): 1248–1249. doi: 10.1016/ j.jhep.2021.06.004.
7. Clayton-Chubb D, Schneider D, Freeman E et al. Autoimmune hepatitis developing after the ChAdOx1 nCoV-19 (Oxford-AstraZeneca) vaccine. J Hepatol 2021; 75 (5): 1249–1250. doi: 10.1016/j.jhep.2021.06.014.
8. Tan CK, Wong YJ, Wang LM et al. Autoimmune hepatitis following COVID-19 vaccination: True causality or mere association? J Hepatol 2021; 75 (5): 1250–1252. doi: 10.1016/j.jhep.2021.06.009.
9. McShane C, Kiat C, Rigby J et al. The mRNA COVID-19 vaccine – A rare trigger of autoimmune hepatitis? J Hepatol 2021; 75 (5): 1252–1254. doi: 10.1016/j.jhep.2021.06.044.
10. Lodato F, Larocca A, D‘Errico A et al. An unusual case of acute cholestatic hepatitis after m-RNABNT162b2 (Comirnaty) SARS-CoV-2 vaccine: Coincidence, autoimmunity or drug-related liver injury. J Hepatol 2021; 75 (5): 1254–1256. doi: 10.1016/j.jhep.2021.07.005.
11. Rocco A, Sgamato C, Compare D et al. Autoimmune hepatitis following SARS-CoV-2 vaccine: May not be a casualty. J Hepatol 2021; 75 (3): 728–729. doi: 10.1016/j.jhep.2021.05.038.
12. Rela M, Jothimani D, Vij M et al. Auto-immune hepatitis following COVID vaccination. J Autoimmun 2021; 123 : 102688. doi: 10.1016/j.jaut.2021.102688.
13. Vuille-Lessard É, Montani M, Bosch J et al. Autoimmune hepatitis triggered by SARS-CoV-2 vaccination. J Autoimmun 2021; 123 : 102710. doi: 10.1016/j.jaut.2021.102710.
14. Ghielmetti M, Schaufelberger HD, Mieli-Vergani G et al. Acute autoimmune-like hepatitis with atypical anti-mitochondrial antibody after mRNA COVID-19 vaccination: A novel clinical entity? J Autoimmun 2021; 123 : 102706. doi: 10.1016/j.jaut.2021.102706.
15. Avci E, Abasiyanik F. Autoimmune hepatitis after SARS-CoV-2 vaccine: New-onset or flare-up? J Autoimmun 2021; 125 : 102745. doi: 10.1016/j.jaut.2021.102745.
16. Garrido I, Lopes S, Simões MS et al. Autoimmune hepatitis after COVID-19 vaccine – more than a coincidence. J Autoimmun 2021; 125 : 102741. doi: 10.1016/j.jaut.2021.102741.
17. Pinazo-Bandera JM, Hernández-Albújar A, García-Salguero AI et al. Acute hepatitis with autoimmune features after COVID-19 vaccine: coincidence or vaccine-induced phenomenon? Gastroenterol Rep (Oxf) 2022; 10: goac014. doi: 10.1093/gastro/goac014.
18. Camacho-Domínguez L, Rodríguez Y, Polo F et al. COVID-19 vaccine and autoimmunity. A new case of autoimmune hepatitis and review of the literature. J Transl Autoimmun 2022; 5 : 100140. doi: 10.1016/j.jtauto.2022.100140.
19. Erard D, Villeret F, Lavrut PM et al. Autoimmune hepatitis developing after COVID 19 vaccine: Presumed guilty? Clin Res Hepatol Gastroenterol 2022; 46 (3): 101841. doi: 10.1016/ j.clinre.2021.101841.
Labels
Paediatric gastroenterology Gastroenterology and hepatology SurgeryArticle was published in
Gastroenterology and Hepatology

2023 Issue 1
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
- Biological therapy of ulcerative colitis during pregnancy
- Complicated course of IBD in pregnancy
- On the question of the interchangeability of monoclonal bio similar antibodies in the treatment of immune-mediated infl ammatory diseases
- Gastrointestinal dysfunctions and their influence on the quality of life in aging adults with spinal cord injury
- Autoimmune hepatitis after vaccination against COVID-19
- The selection from international journals
- Therapeutic monitoring of biologics: on the way to personalized medicine
- 17th educational and discussion gastroenterology days
- Professor Ryska has passed away, his legacy remains
- Assoc. Prof. Igor Kajaba, MD, PhD.
- Kreditovaný autodidaktický test
- Overview of the most common skin adverse reactions of biological treatment in patients with inflammatory bowel disease – part 1
- Tofacitinib – is it time for a change in treatment in ulcerative colitis?
- Fatal course of an infl ammatory disease
- Two years of the COVID-19 pandemic in the population of Czech patients with infl ammatory bowel disease treated with bio logical therapy – experience of the tertiary IBD center
- Primary signet ring cell adenocarcinoma as a rare cause of colonic stenosis in a young patient with Crohn’s disease – the case report
- Editorial
- Epidemiological and demographic characteristics of individuals with irritable bowel syndrome based on the Rome III vs. Rome IV criteria in the Northern part of Serbia
- Editorial
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Autoimmune hepatitis after vaccination against COVID-19
- Primary signet ring cell adenocarcinoma as a rare cause of colonic stenosis in a young patient with Crohn’s disease – the case report
- Gastrointestinal dysfunctions and their influence on the quality of life in aging adults with spinal cord injury
- Fatal course of an infl ammatory disease
