Hepatogenní diabetes u kandidátů transplantace jater: prevalence, rizikové faktory a potransplantační vývoj – prospektivní studie
Hepatogenous diabetes in liver transplant candidates: prevalence, risk factors and posttransplant outcome – prospective study
Introduction: Diabetes mellitus (DM) associated with liver cirrhosis (hepatogenous DM) has several differences from classical DM type 2 (T2DM), data about its prevalence, risk factors and outcome after liver transplantation (LT) are limited. The aim of this study was to evaluate the prevalence, risk factors and posttransplant outcome of DM diagnosed during the pretransplant investigation in a prospectively followed cohort of LT candidates. Methods: The study included 122 adult patients who were listed for LT in the period from 5/2015 to 4/2017. Presence of DM was evaluated by standard criteria including oral glucose tolerance test (OGTT). Results: DM was present in 54 patients (44.3%) pretransplant, of whom 26 patients (21.3%) had long-term history of DM before they were listed for LT (classical T2DM), and in other 28 patients (23.0%) DM was diagnosed during the pretransplant investigation based on pathological results of OGTT (hepatogenous DM). In 13 patients, de novo DM after LT was diagnosed. On the multivariate analysis, patients with hepatogenous DM had significantly lower BMI (P = 0.015), lower fasting glucose (P = 0.002) and lower glycated hemoglobin (P = 0.010), compared to classical T2DM. In comparison to patients without DM, patients with hepatogenous DM had more frequent occurrence of metabolic syndrome (P = 0.033). Patients with hepatogenous DM were less frequently treated with insulin at 1 month (32.0% vs. 76.2%; P = 0.002), 6 months (20.0% vs. 76.2%; P <0.001), 1 year (20.0% vs. 75.0%; P <0.001) and 2 years after LT (23.8% vs. 66.7%; P = 0.007) than patients with classical T2DM; but they were more frequently treated with insulin than patients without pretransplant DM 1 month after LT (32.0% vs. 7.7%; P = 0.015) and 2 years after LT (23.8% vs. 9.1%; P = 0.029). Conclusion: Hepatogenous DM is frequent in LT candidates (23.0%), it regresses in the majority of patients after LT unlike the classical T2DM, however, insulinotherapy is still necessary up to one quarter of patients even 2 years after LT.
Keywords:
liver transplantation – type 2 diabetes mellitus – insulinotherapy – hepatogenous diabetes
Authors:
Irena Míková 1
; D. Erhartová Kyselová 1
; K. Dvořáková 1; M. Dezortová 2
; M. Hájek 2
; V. Lánská 3
; Julius Špičák 1
; Pavel Trunečka 1
Authors‘ workplace:
Klinika hepatogastroenterologie IKEM, Praha
1; Pracoviště radiodiagnostiky a intervenční radiologie, IKEM, Praha
2; Oddělení datových analýz, statistik a umělé inteligence OI, IKEM, Praha
3
Published in:
Gastroent Hepatol 2023; 77(4): 280-288
Category:
Clinical and Experimental Gastroenterology: Original Article
doi:
https://doi.org/10.48095/ccgh2023280
Overview
Úvod: Diabetes mellitus (DM) asociovaný s cirhózou jater (tzv. hepatogenní DM) má od klasického DM 2. typu (T2DM) řadu odlišností, data o jeho prevalenci, rizikových faktorech a vývoji po transplantaci jater (LT) jsou však omezená. Cílem této studie bylo posoudit prevalenci, rizikové faktory a potransplantační vývoj DM diagnostikovaného v rámci předtransplantačního vyšetření u prospektivně sledované kohorty kandidátů LT. Metody: Do studie bylo zařazeno 122 dospělých pacientů, kteří byli v období 5/2015 až 4/2017 zařazeni na čekací listinu (WL) k LT. Přítomnost DM byla hodnocena na základě standardních kritérií včetně orálního glukózového tolerančního testu (OGTT). Výsledky: U 54 pacientů (44,3 %) byl před LT přítomen DM, z nichž u 26 pacientů (21,3 %) byl známý již dlouho před zařazením na WL (klasický T2DM) a u dalších 28 pacientů (23,0 %) byl DM diagnostikován v průběhu předtransplantačního vyšetření na základě patologických hodnot OGTT (hepatogenní DM). U 13 pacientů byl zjištěn de novo DM po LT. Dle multivariantní analýzy měli pacienti s hepatogenním DM oproti klasickému T2DM významně nižší BMI (p = 0,015), nižší lačnou glykemii (p = 0,002) a nižší glykovaný hemoglobin (p = 0,010). Oproti pacientům bez diabetu měli pacienti s hepatogenním DM častější výskyt metabolického syndromu (p = 0,033). Pacienti s hepatogenním DM byli méně často léčeni inzulinem 1 měsíc po LT (32,0 vs. 76,2 %; p = 0,002), 6 měsíců (20,0 vs. 76,2 %; p < 0,001), 1 rok (20,0 vs. 75,0 %; p < 0,001) a 2 roky po LT (23,8 vs. 66,7 %; p = 0,007) než pacienti s klasickým T2DM; oproti skupině bez předtransplantačního DM byli častěji léčeni inzulinem 1 měsíc po LT (32,0 vs. 7,7 %; p = 0,015) a 2 roky po LT (23,8 vs. 9,1 %; p = 0,029). Závěr: Hepatogenní DM je u kandidátů LT častý (23,0 %), u většiny pacientů po LT na rozdíl od klasického T2DM regreduje, nicméně inzulinoterapie je nutná až u jedné čtvrtiny pacientů i 2 roky po LT.
Klíčová slova:
diabetes mellitus 2. typu – transplantace jater – inzulinoterapie – hepatogenní diabetes
Úvod
Vztah mezi cirhózou jater a diabetes mellitus (DM) je znám již dlouhou dobu. Odhady prevalence DM u pacientů s jaterním onemocněním jsou velmi variabilní a dosahují od 20 do 70 % v závislosti na stadiu a etiologii jaterního onemocnění a použité metodě hodnocení [1,2], což je významně víc než přibližně 8% prevalence DM v obecné populaci [3]. Prevalence DM je vyšší u pokročilejších stadií jaterního onemocnění a dále v případě cirhózy v důsledku nealkoholové tukové nemoci jater (NAFLD), kryptogenní cirhózy, alkoholové nemoci jater (ALD) a chronické hepatitidy C (HCV) [1,4]. Přítomnost DM je nezávislým rizikovým faktorem nepříznivé prognózy u pacientů s cirhózou [5], DM byl u pacientů s cirhózou asociován s častějším rozvojem ascitu, renální dysfunkce, jaterní encefalopatie, bakteriálních infekcí, se zvýšeným rizikem hepatocelulárního karcinomu (HCC) [6,7] a variceálního krvácení [8]. U diabetiků s jaterní cirhózou může být lačná glykemie a glykovaný hemoglobin (HbA1c) normální v důsledku poruchy metabolizmu glukózy při jaterní dysfunkci a snížené životnosti erytrocytů při hypersplenizmu [1]. K detekci poruchy glukózového metabolizmu může být nezbytné provést orální glukózový toleranční test (OGTT) [6].
U pacientů s cirhózou se může jednat buď o klasický DM 2. typu (T2DM), nebo o tzv. hepatogenní diabetes, který je následkem jaterní insuficience a portální hypertenze [7]. Ačkoli není hepatogenní DM samostatnou nozologickou jednotkou, z klinického hlediska má oproti klasickému T2DM řadu odlišností. Hepatogenní DM je často doprovázen normálními hodnotami lačné glykemie a HbA1c, méně často je vázán na klasické rizikové faktory, jako jsou rodinná anamnéza, věk a body mass index (BMI) [9], a má nižší výskyt mikro - a makrovaskulárních komplikací [9,10].
Patofyziologie hepatogenního diabetu je komplexní a ne zcela objasněná. Porucha glukózové tolerance u cirhózy může vyplývat ze dvou současně se vyskytujících abnormalit. Roli hraje jednak inzulinová rezistence ve svalech a současně neadekvátní odpověď β-buněk v dostatečné míře vylučovat inzulin, která by za normálních okolností mohla nahradit jeho nedostatečný účinek [6,11]. Inzulin je metabolizován a degradován převážně v hepatocytech. Pokles množství funkčních hepatocytů, a tím snížená clearance inzulinu, a dále portosystémové žilní kolaterály vedoucí k poklesu prvního průchodu játry mají za následek vysoké hladiny inzulinu. Hyperinzulinemie může vést k inzulinové rezistenci v důsledku down regulace inzulinových receptorů [7]. Rozlišení hepatogenního DM od T2DM může být obtížné. V jedné studii měli pacienti s hepatogenním DM vyšší lačné inzulinemie a HOMA-inzulin rezistence index (HOMA-IR) než pacienti s T2DM, což by mohlo svědčit pro vyšší stupeň inzulinové rezistence a poruchy jaterní degradace inzulinu s následnou hyperinzulinemií u pacientů s hepatogenním DM [12]. Po úspěšné transplantaci jater (LT) dochází většinou k regresi nebo zmírnění hepatogenního DM, normalizaci glukózové tolerance, korekci chronické hyperinzulinemie a periferní inzulinové rezistence, což svědčí pro přímou vazbu hepatogenního diabetu na poruchu jaterní funkce [13,14].
Až u 30 % příjemců LT byl popsán vznik de novo DM po LT. Na jeho vzniku se významně podílí léčba kalcineurinovými inhibitory (CNI) cyklosporinu a takrolimu, které způsobují poruchu sekrece inzulinu [15].
Cílem této studie bylo posoudit prevalenci, rizikové faktory a potransplantační vývoj diabetu diagnostikovaného v rámci předtransplantačního vyšetření u prospektivní kohorty kandidátů LT.
Soubor pacientů a metodika
Soubor pacientů
Tato prospektivní studie zahrnula dospělé pacienty, kteří na našem pracovišti v období 5/2015 až 4/2017 podstoupili předtransplantační vyšetření a podepsali informovaný souhlas se studií. Tato práce byla součástí rozsáhlejšího projektu sledování vývoje NAFLD po LT, mezi vyřazovací kritéria patřilo akutní jaterní selhání, jaterní encefalopatie a kontraindikace vyšetření magnetickou rezonancí (MR). Studie zahrnula 122 pacientů zařazených na čekací listinu (WL) k LT, 69 (56,6 %) mužů, s průměrným věkem 56,6 ± 10,3 let. Indikací k LT byla nejčastěji alkoholická cirhóza (34,4 %), biliární cirhóza (17,2 %), HCV cirhóza (12,3 %) a NASH cirhóza (9,8 %). Průměrné Child-Pugh skóre bylo 8,6 ± 2,2, průměrné MELD skóre 14,1 ± 4,4. Vstupní charakteristika souboru je uvedena v tab. 1. Ze 122 pacientů podstoupilo 105 pacientů plánovanou LT, 3 pacienti zemřeli na WL, 14 pacientů bylo z WL vyřazeno. Pacienti byli vyšetřeni před LT v době předtransplantačního vyšetření (V0; n = 122), 6 měsíců po LT (V1; n = 98), 1 rok po LT (V2; n = 96) a 2 roky po LT (V3; n = 83).
Tab. 1. Baseline characteristics of the study group pre-transplant (N = 122).
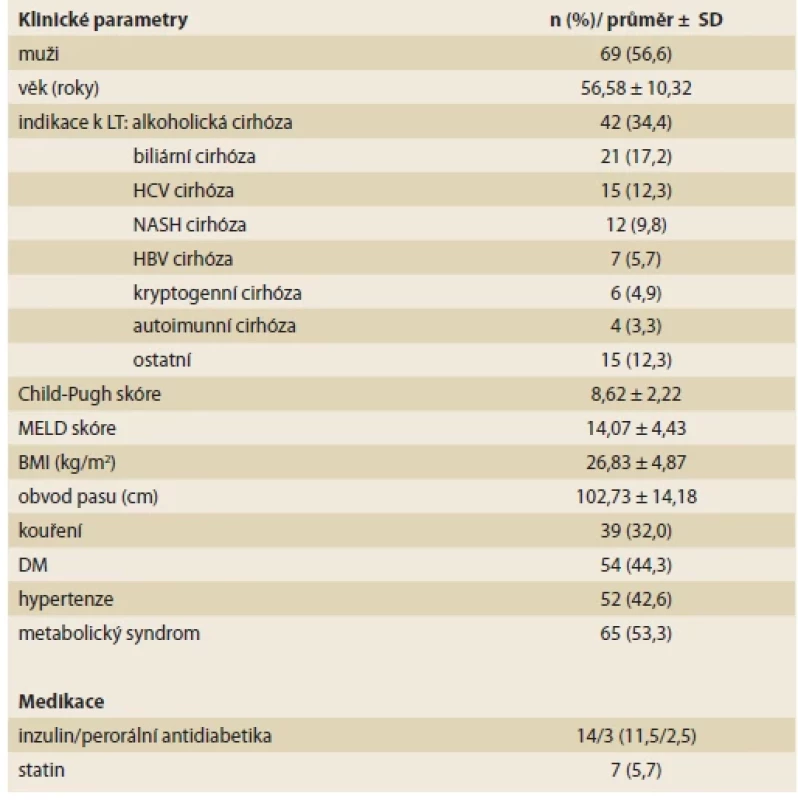
U všech pacientů byla navíc hodnocena terapie antidiabetiky 1 měsíc po LT a přežívání 3 a 5 let po LT.
Klinické a laboratorní vyšetření
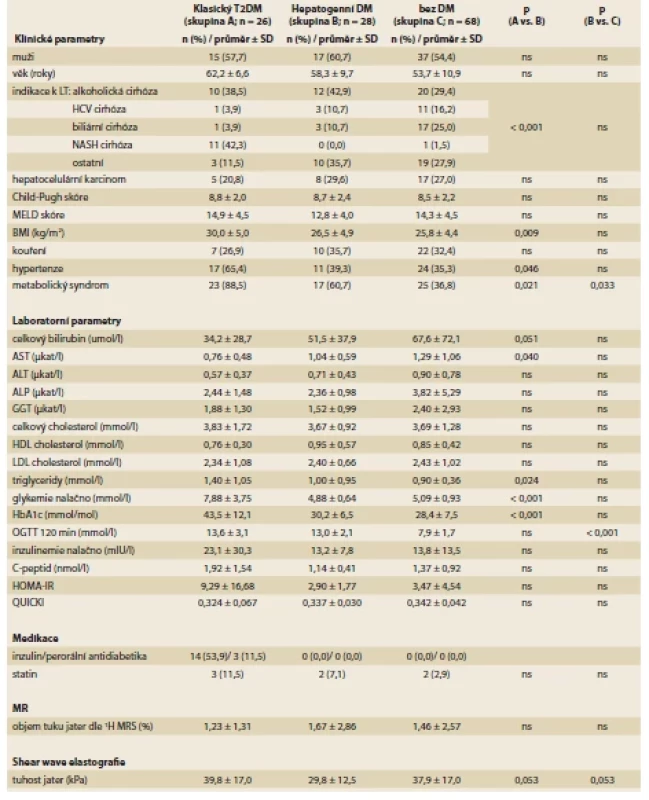
Při každé kontrole byla zhodnocena klinická a laboratorní data uvedená v tab. 2. Pacientům byla po celonočním lačnění odebrána krev na stanovení glykemie, HbA1c, C-peptidu a inzulinemie. Z hodnot lačné glykemie a lačné inzulinemie byl vypočten HOMA-IR [lačný inzulin (μU/ml) × lačná glykemie (mmol/l) / / 22,5] a QUICKI index [1/log lačný inzulin (μU/ml) + log lačná glykemie (mg/dl) ] [16]. U pacientů, kteří nebyli léčeni inzulinem, byl po celonočním lačnění proveden OGTT s podáním roztoku 75 g glukózy a byla hodnocena glykemie po 120 minutách.
Tab. 2. Pretransplant parameters in patients with classical TDM, patients with hepatogenous DM and patient without DM. Univariate
analysis.
Diabetes mellitus byl definován jako lačná glykemie v plazmě ≥7,0 mmol/l (minimálně při dvou různých měřeních v posledních 6 měsících), koncentrace glukózy v plazmě při OGTT po 120 minutách ≥ 11,1 mmol/l nebo léčba antidiabetiky (inzulinem (INZ) nebo perorálními antidiabetiky (PAD)). DM, který byl u pacientů známý již delší dobu před zahájením předtransplantačního vyšetření, byl definován jako klasický T2DM, zatímco DM diagnostikovaný až v jeho průběhu byl definován jako hepatogenní DM. Vzhledem k tomu, že u většiny pacientů nebylo možné určit dobu trvání cirhózy, byli všichni pacienti s dříve známou diagnózou DM zahrnuti do skupiny s klasickým T2DM. Hypertenze byla definována jako krevní tlak ≥ 130/85 mmHg nebo léčba antihypertenzivy. Metabolický syndrom byl definován jako přítomnost alespoň 3 z 5 následujících faktorů:
- obvod pasu ≥ 102 cm u mužů a ≥ 88 cm u žen;
- hypertenze;
- glykemie nalačno ≥ 5,6 mmo/l nebo přítomnost DM;
- hypertriglyceridemie ≥ 1,7 mmol/l;
- HDL cholesterol < 1,0 mmol/l u mužů a < 1,3 mmol/l u žen.
Vyšetření MR a elastografie
Při každé kontrole bylo po alespoň 3hodinovém lačnění stanoveno metodou 1H MR spektroskopie procento objemu tuku v játrech, toto měření bylo prováděno ve třech standardizovaných částech jater. Vyšetření se prováděla na 3T celotělovém tomografu Trio (Siemens, Německo). Při každé kontrole byla pacientům provedena shear wave elastografie s měřením tuhosti jater (kPa).
Statistické hodnocení
Kategorické proměnné jsou udávány v absolutních počtech a procentech, spojité proměnné jako průměr a směrodatná odchylka. Rozdíly veličin mezi skupinami byly hodnoceny podle typu rozložení buď Studentovým t-testem, nebo Kruskal-Wallisovým testem pro spojité veličiny a Fisherovým testem (pokud jsou očekávané počty v buňce < 5) anebo Pearsonovým chí-kvadrát testem pro diskrétní veličiny. K hodnocení rozdílů mezi skupinami pro více proměnných najednou jsme použili logistickou regresi. Za statisticky významnou byla použita hodnota p < 0,05, všechny testy byly oboustranné. Pro statistické hodnocení jsme použili JMP 16.2.0 statistický software, SAS Institute Inc. 2020–2021.
Výsledky
U 54 pacientů souboru (44,3 %) byl před LT přítomen DM, z nichž u 26 pacientů (21,3 %) byl DM známý již dlouho před zařazením na WL k LT (skupina s klasickým T2DM) s průměrnou dobou trvání 8,8 ± 5,1 let, u dalších 28 pacientů (23,0 %) byl DM diagnostikován při V0 na základě patologických hodnot OGTT (skupina s hepatogenním DM). U zbývajících 68 pacientů (55,7 %) nebyl DM přítomen. Před LT bylo 14 pacientů s klasickým DM (53,9 %) léčeno inzulinem a 3 pacienti (11,5 %) PAD, žádný pacient s hepatogenním DM neměl před LT zavedenu léčbu antidiabetiky. Z 68 pacientů bez DM před LT byl u 13 pacientů (19,1 %) zjištěn de novo DM po LT.
NASH cirhóza tvořila 42,3 % indikací u pacientů s klasickým T2DM oproti 0,0 % ve skupině s hepatogenním DM (p < 0,001; tab 2). Pacienti s hepatogenním DM měli oproti pacientům s klasickým T2DM nižší BMI (p = 0,009), nižší výskyt metabolického syndromu (p = 0,021) a hypertenze (p = 0,046), dále u nich byly nižší hladiny lačné glykemie (p < 0,001), HbA1c (p < 0,001), sérových triglyceridů (p = 0,024) a vyšší hladiny aspartátaminotransferázy (AST; p = 0,040). V multivariantní analýze byl hepatogenní DM oproti klasickému T2DM významně spojen s nižším BMI (odds ratio (OR) 0,81; 95% konfidenční interval (CI) 0,68–0,97; p = 0,015), nižší lačnou glykemií (OR 0,38; 95% CI 0,17––0,84; p = 0,002) a nižším HbA1c (OR 0,88; 95% CI 0,78–0,98; p = 0,010). Pacienti s hepatogenním DM měli oproti pacientům bez DM častější výskyt metabolického syndromu (p = 0,033), jiné významné rozdíly v univariantní analýze jsme neprokázali (tab. 2).
Při srovnání potransplantačního vývoje DM u jednotlivých skupin (tab. 3, graf 1) jsme zjistili, že pacienti s hepatogenním DM byli oproti klasickému T2DM méně často léčeni INZ 1 měsíc po LT (32,0 vs. 76,2 %; p = 0,002), 6 měsíců (20,0 vs. 76,2 %; p < 0,001), 1 rok (20,0 vs. 75,0 %; p < 0,001) a 2 roky po LT (23,8 vs. 66,7 %; p = 0,007). U pacientů s hepatogenním DM byl oproti skupině pacientů bez DM častěji podáván INZ 1 měsíc po LT (32,0 vs. 7,7 %; p = 0,015) a 2 roky po LT (23,8 vs. 9,1 %; p = 0,029).
Tab. 3. Postransplant evolution of diabetes and associated factors in patients with classical TDM, patients with hepatogenous DM
and patients without DM
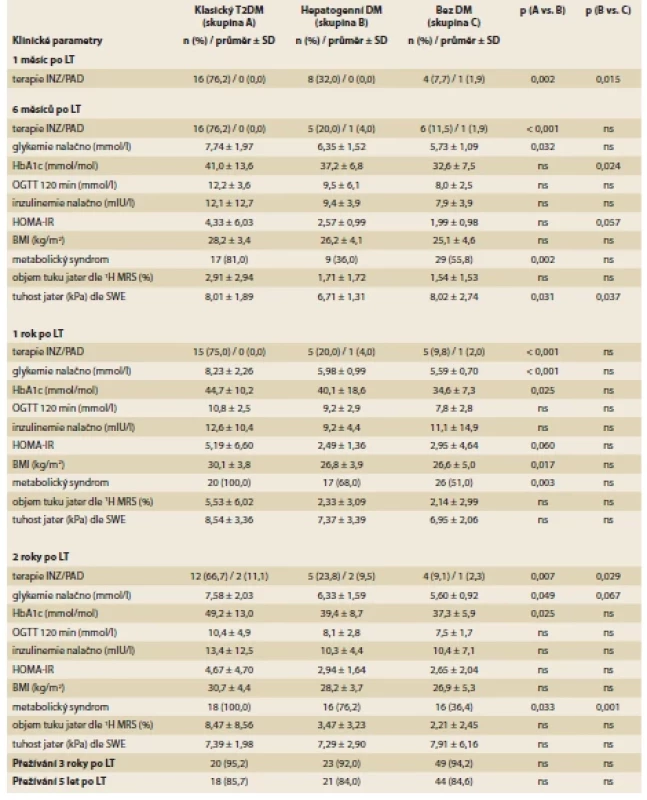

Při porovnání vývoje dalších potransplantačních parametrů (tab. 3) měli pacienti s hepatogenním DM oproti pacientům s klasickým T2DM nižší lačné glykemie (6M, 1R a 2R po LT), nižší HbA1c (1R a 2R po LT), nižší BMI (1R po LT), nižší výskyt metabolického syndromu (6M, 1R a 2R po LT) a nižší hodnoty tuhosti jater dle shear wave elastografie 6M po LT. Mezi skupinami jsme nenalezli významné rozdíly v HOMA-IR, v objemu jaterního tuku dle 1H MRS a v hodnotách tuhosti jater 1 a 2 roky po LT.
Po LT měli pacienti s hepatogenním DM oproti pacientům bez DM vyšší výskyt metabolického syndromu (2R po LT), vyšší HbA1c (6M po LT) a nižší hodnoty tuhosti jater dle shear wave elastografie 6M po LT, ostatní parametry se mezi skupinami nelišily včetně HOMA IR, objemu jaterního tuku dle 1H MRS a hodnot tuhosti jater dle shear wave elastografie 1 a 2 roky po LT.
Z pacientů, kteří podstoupili LT, bylo naživu 92 pacientů 3 roky po LT a 83 pacientů 5 let po LT, přežívání se mezi skupinami nelišilo (tab. 3).
Diskuze
V naší prospektivně sledované kohortě kandidátů transplantace jater (LT) jsme zjistili vysokou (23 %) prevalenci hepatogenního DM, který byl oproti klasickému T2DM spojen s nižším BMI, nižšími hodnotami lačné glykemie a glykovaného hemoglobinu. Potransplantační vývoj DM byl u většiny pacientů s hepatogenním DM na rozdíl od klasického T2DM příznivý, nicméně přibližně u jedné čtvrtiny pacientů byla i 2 roky po LT nutná inzulinoterapie, což bylo významně častěji než u pacientů bez DM před LT.
Vysoká celková prevalence DM (44,3 %) u našich pacientů na WL k LT je v souladu s daty z literatury, která uvádějí výskyt DM u 20 až 70 % pacientů s cirhózou v závislosti na stadiu a etiologii jaterního onemocnění [1]. Vysoká prevalence DM je typická zejména pro pacienty s nealkoholovou steatohepatitidou (NASH) [17]. Přítomnost T2DM zvyšuje riziko progrese fibrózy u NAFLD [18,19] a virových hepatitid B [20] a C [21].
Vysoká prevalence hepatogenního DM v naší kohortě (23 %) odpovídá údajům z literatury. Dvě studie u pacientů s cirhózou bez předchozí anamnézy DM udávají ještě vyšší prevalenci hepatogenního DM 48,6 % [1] a 55,4 % [8]. V obou těchto studiích [1,8] byl k diagnostice DM podobně jako v naší práci použit OGTT vzhledem k často normálním hodnotám lačné glykemie u těchto pacientů. Přechod z poruchy glukózové tolerance do DM je primárně způsoben progredující dysfunkcí β-buněk. Sekrece inzulinu se zhoršuje spolu s tíží jaterního onemocnění, což svědčí pro významný vliv jaterního selhání na funkci pankreatických ostrůvků [1].
Pacienti s hepatogenním DM měli v naší studii oproti pacientům s T2DM nižší BMI, nižší lačnou glykemii a glykovaný hemoglobin, což odpovídá i výsledkům dalších prací [1,9]. Mezi skupinami jsme neprokázali rozdíly v pokročilosti jaterního onemocnění hodnocené pomocí Child-Pugh nebo MELD skóre. Literární data o odlišnostech T2DM a hepatogenního DM u pacientů s cirhózou jsou velmi omezená, řada odborných společností a autorů navíc tyto dvě kategorie DM u cirhózy nerozlišuje [22,23]. V jedné studii měli pacienti s hepatogenním DM vyšší lačné inzulinemie a HOMA-IR než pacienti s T2DM [12]. V naší práci jsme naopak pozorovali trend k vyšším hodnotám lačné inzulinemie a HOMA-IR u pacientů s T2DM. Inzulinová rezistence je hlavním patofyziologickým mechanizmem T2DM. Na patofyziologii hepatogenního DM se kromě svalové inzulinové rezistence významně podílí i neschopnost β-buněk pankreatu dostatečně vylučovat inzulin, čímž by bylo možné za normálních okolností nahradit defekt v účinnosti inzulinu [6]. Kromě častějšího výskytu metabolického syndromu před LT jsme nenalezli žádné další významné rozdíly mezi pacienty s hepatogenním DM a pacienty bez DM.
Z pacientů bez DM před LT byl u 13 (19,1 %) zjištěn de novo DM po LT. De novo DM po LT je častou komplikací LT, jeho rozvoj byl popsán až u 30 % příjemců LT. Na jeho vzniku se významně podílí léčba CNI, která má negativní vliv na sekreci inzulinu [15,24].
Z naší práce vyplývají významné rozdíly v potransplantačním vývoji DM u pacientů s T2DM a hepatogenním DM. Zatímco ve skupině s T2DM byla u většiny pacientů po LT nutná inzulinoterapie (76,2 % 1M po LT; 76,2 % 6M po LT; 75,0 % 1R po LT a 66,7 % 2R po LT), u pacientů s hepatogenním DM byla potransplantační inzulinoterapie podstatně méně častá (32,0 % 1M po LT; 20,0 % 6M po LT; 20,0 % 1R po LT a 23,8 % 2R po LT), rozdíly mezi skupinami byly významné ve všech sledovaných obdobích. Naše výsledky svědčí pro příznivý potransplantační průběh hepatogenního DM u většiny pacientů v důsledku obnovy jaterní funkce úspěšnou transplantací jater. To odpovídá literárním údajům, která uvádějí vyléčení hepatogenního DM po LT u 67 % pacientů [13,25]. U třetiny pacientů s hepatogenním DM z naší kohorty DM přetrvával i 2 roky po LT, což potvrzuje i jiná studie [25], která tuto skutečnost vysvětluje přetrvávající poruchou funkce β-buněk.
Přítomnost a typ DM před LT neměly v naší práci vliv na přežívání 3 a 5 let po LT. Podobně i v jiné práci zahrnující 2 209 příjemců LT neměla přítomnost DM před LT vliv na přežívání pacientů 1 až 20 let po LT [26]. Zatímco řada studií uvádí, že přítomnost DM je nezávislým faktorem nepříznivé prognózy u pacientů s cirhózou [5–8], po úspěšné LT již negativní vliv DM na prognózu pacientů nemusí být jednoznačný. Doba sledování v naší práci však mohla být příliš krátká k posouzení vlivu DM na mortalitu.
Nález hepatogenního DM na základě patologických hodnot OGTT nevedl u našich pacientů k zahájení terapie antidiabetiky před LT zejména z důvodu již nízkých hodnot lačné glykemie a obav z polékové hypoglykemie nebo toxicity. Problematika indikace a typu vhodné farmakoterapie DM u pacientů se současnou cirhózou je velmi obtížná. Žádné klinické studie necílily na skupinu pacientů se současným DM a cirhózou [7]. Terapii DM u pacientů s cirhózou a jaterním selháním se nevěnuje recentní doporučení Evropské společnosti pro studium diabetu (EASD) a Americké společnosti pro diabetes (ADA) týkající se léčby hyperglykemie u pacientů s T2DM [27] ani doporučení Evropské společnosti pro studium jater (EASL) týkající se léčby dekompenzované cirhózy [28] nebo transplantace jater [29]. Dříve převládal názor, že inzulin by měl být v přítomnosti těžké dysfunkce jater lékem volby. To již nemusí platit v éře nových antidiabetik, která mohou zajistit adekvátní kontrolu glykemie bez současného rizika hypoglykemie. U pacientů s cirhózou lze ponechat terapii metforminem s výjimkou poruchy renální funkce nebo stavů dehydratace nebo tkáňové hypoxie. U pacientů s cirhózou jsou pravděpodobně bezpečné inhibitory dipeptidyl peptidázy-4 (gliptiny) s výjimkou vildagliptinu. Vhodnou terapií může být i terapie agonisty GLP-1 receptoru (GLP-1RA), které však pro častou nauzeu nemusí být vhodné pro pacienty se špatným stavem výživy. U pokročilého jaterního onemocnění by se terapie inzulinem měla co nejdéle odkládat, alternativou může být i kombinovaná terapie bazálním inzulinem a GLP-1RA [17]. Nové klinické studie hodnotící léčbu DM u této specifické populace jsou více než žádoucí.
Domníváme se, že by vzhledem k vysoké prevalenci DM u kandidátů LT mělo být OGTT vyšetření standardní součástí předtransplantačního vyšetření, byť vzhledem k absenci doporučení není zcela jasné, zda a jakým způsobem léčit typicky vysoké postprandiální glykemie při současných nízkých lačných glykemiích typických pro pacienty s hepatogenním DM. Spolupráce se zkušeným diabetologem je zde nezbytná.
Hepatogení diabetes není samostatnou nozologickou jednotkou a tento pojem není v aktuálních doporučeních zmiňován [27,30], nicméně existence DM jako přímého následku ztráty jaterní funkce je v odborné literatuře dobře popsaná [1,25]. Prevalence hepatogenního DM v naší studii mohla být podhodnocena vzhledem k tomu, že do skupiny s hepatogenním DM byli zařazeni pouze pacienti bez předchozí anamnézy DM, u kterých byl DM diagnostikován až na základě patologických hodnot OGTT testu v průběhu předtransplantačního vyšetření. Pacienti s DM známým již několik let, byť se mohl vyvinout až po rozvoji cirhózy, byli zařazeni do skupiny s klasickým T2DM. Naopak u části pacientů ze skupiny s hepatogenním DM se mohlo jednak o dříve nepoznaný T2DM, pro což by mohla svědčit i skutečnost, že ne u všech pacientů došlo k vymizení hepatogenního DM po LT i při dobré funkci jaterního štěpu.
Závěr
Hepatogenní DM je u kandidátů LT častý (23,0 %), oproti klasickému T2DM je spojen s nižším BMI a nižšími hodnotami lačné glykemie a glykovaného hemoglobinu. U většiny pacientů po LT hepatogenní DM na rozdíl od T2DM regreduje, což svědčí pro odlišnosti v jejich patofyziologii, především ve vazbě hepatogenního diabetu na přítomnost poruchy jaterní funkce. Doporučení pro léčbu DM u pacientů se současnou cirhózou a jaterní dysfunkcí nejsou k dispozici, kromě inzulinu je pravděpodobně možné v terapii využít metformin nebo některá nová antidiabetika, což však vyžaduje další hodnocení v klinických studiích.
ORCID autorů
I. Míková ORCID 0000-0001-7928-7558,
D. Kyselová ORCID 0000-0001-6652-653X,
M. Dezortová ORCID 0000-0003-0194-1200,
M. Hájek ORCID 0000-0003-4704-6164,
V. Lánská ORCID 0000-0002-2832-5689,
J. Špičák ORCID 0000-0002-3823-2881,
P. Trunečka ORCID 0000-0002-4753-4419.
Doručeno/Submitted: 27. 7. 2023
Přijato/Accepted: 1. 8. 2023
MUDr. Mgr. Irena Míková, Ph.D.
Klinika hepatogastroenterologie
Institut klinické a experimentální medicíny
Vídeňská 1958/9
140 21 Praha 4
Konflikt zájmů: Autoři deklarují, že text článku odpovídá etickým standardům, byla dodržena anonymita pacientů a prohlašuji, že v souvislosti s předmětem článku nemají finanční, poradenské ani jiné komerční zájmy.
Publikační etika: Příspěvek nebyl dosud publikován ani není v současnosti zaslán do jiného časopisu pro posouzení. Autoři souhlasí s uveřejněním svého jména a e-mailového kontaktu v publikovaném textu.
Dedikace: Tato práce byla fi nančně podpořena grantem č. 15-26906A Ministerstva zdravotnictví České republiky.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bio medicínských časopisů.
Conflict of Interest: The authors declare that the article/ manuscript complies with ethical standards, patient anonymity has been respected, and they state that they have no fi nancial, advisory or other commercial interests in relation to the subject matter.
Publication Ethics: This article/ manuscript has not been published or is currently being submitted for another review. The authors agree to publish their names and e-mails in the published article/ manuscript.
Dedication: This work was fi nancially supported by grant No. 15-26906A of the Ministry of Health of the Czech Republic.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for bio medical papers.
Gastroent Hepatol 2023; 77(4): 280 – 288
Sources
Literatura
1. Grancini V, Trombetta M, Lunati ME et al. Contribution of b-cell dysfunction and insulin resistance to cirrhosis-associated diabetes: Role of severity of liver disease. J Hepatol 2015; 63 (6): 1484–1490. doi: 10.1016/j.jhep.2015.08.011.
2. Wlazlo N, Beijers HJBH, Schoon EJ et al. High prevalence of diabetes mellitus in patients with liver cirrhosis. Diabet Med 2010; 27 (11): 1308–1311. doi: 10.1111/j.1464-5491.2010.03093.x.
3. Hosseini Z, Whiting SJ, Vatanparast H. Type 2 diabetes prevalence among Canadian adults – dietary habits and sociodemographic risk factors. Appl Physiol Nutr Metab 2019; 44 (10): 1099–1104. doi: 10.1139/apnm-2018 - 0567.
4. Lee WG, Wells CI, McCall JL et al. Prevalence of diabetes in liver cirrhosis: A systematic review and meta-analysis. Diabetes Metab Res Rev 2019; 35 (6): e3157. doi: 10.1002/dmrr.3157.
5. Nishida T, Tsuji S, Tsujii M et al. Oral glucose tolerance test predicts prognosis of patients with liver cirrhosis. Am J Gastroenterol 2006; 101 (1): 70–75. doi: 10.1111/j.1572-0241.2005.00307.x.
6. Garcia-Compean D, Jaquez-Quintana JO, Gonzalez-Gonzalez JA et al. Liver cirrhosis and diabetes: risk factors, pathophysiology, clinical implications and management. World J Gastroenterol 2009; 15 (3): 280–288. doi: 10.3748/wjg. 15.280.
7. Elkrief L, Rautou P-E, Sarin S et al. Diabetes mellitus in patients with cirrhosis: clinical implications and management. Liver Int 2016; 36 (7): 936–948. doi: 10.1111/liv.13115.
8. Jeon HK, Kim MY, Baik SK et al. Hepatogenous diabetes in cirrhosis is related to portal pressure and variceal hemorrhage. Dig Dis Sci 2013; 58 (11): 3335–3341. doi: 10.1007/s10 620-013-2802-y.
9. Holstein A, Hinze S, Thiessen E et al. Clinical implications of hepatogenous diabetes in liver cirrhosis. J Gastroenterol Hepatol 2002; 17 (6): 677–681. doi: 10.1046/j.1440-1746.2002.02 755.x.
10. Kuriyama S, Miwa Y, Fukushima H et al. Prevalence of diabetes and incidence of angiopathy in patients with chronic viral liver disease. J Clin Biochem Nutr 2007; 40 (2): 116–122. doi: 10.3164/jcbn.40.116.
11. Imano E, Kanda T, Nakatani Y et al. Impaired splanchnic and peripheral glucose uptake in liver cirrhosis. J Hepatol 1999; 31 (3): 469–473. doi: 10.1016/s0168-8278 (99) 80039-7.
12. Kim MG, Choi WC. Differential diagnosis of diabetes mellitus caused by liver cirrhosis and other type 2 diabetes mellitus. Korean J Hepatol 2006; 12 (4): 524–529.
13. Merli M, Leonetti F, Riggio O et al. Glucose intolerance and insulin resistance in cirrhosis are normalized after liver transplantation. Hepatology 1999; 30 (3): 649–654. doi: 10.1002/hep.510300306.
14. Grancini V, Trombetta M, Lunati ME et al. Central role of the b-cell in driving regression of diabetes after liver transplantation in cirrhotic patients. J Hepatol 2019; 70 (5): 954–962. doi: 10.1016/j.jhep.2019.01.015.
15. Pelaez-Jaramillo MJ, Cardenas-Mojica AA, Gaete P V et al. Post-Liver Transplantation Diabetes Mellitus: A Review of Relevance and Approach to Treatment. Diabetes Ther 2018; 9 (2): 521–543. doi: 10.1007/s13300-018-03 74-8.
16. Muniyappa R, Lee S, Chen H, Quon MJ. Current approaches for assessing insulin sensitivity and resistance in vivo: advantages, limitations, and appropriate usage. Am J Physiol Endocrinol Metab 2008; 294 (1): E15–E26. doi: 10.1152/ajpendo.00645.2007.
17. Brodosi L, Petta S, Petroni ML et al. Management of Diabetes in Candidates for Liver Transplantation and in Transplant Recipients. Transplantation 2022; 106 (3): 462–478. doi: 10.1097/TP.0000000000003867.
18. McPherson S, Hardy T, Henderson E et al. Evidence of NAFLD progression from steatosis to fibrosing-steatohepatitis using paired biopsies: Implications for prognosis and clinical management. J Hepatol 2015; 62 (5): 1148–1155. doi: 10.1016/j.jhep.2014.11.034.
19. Huang DQ, Wilson LA, Behling C et al. Fibrosis Progression Rate in Biopsy-Proven Nonalcoholic Fatty Liver Disease Among People With Diabetes Versus People Without Diabetes: A Multicenter Study. Gastroenterology 2023; 165 (2): 463–472. doi: 10.1053/j.gastro.2023.04. 025.
20. Huang YW, Wang TC, Lin SC et al. Increased risk of cirrhosis and its decompensation in chronic hepatitis B patients with newly diagnosed diabetes: a nationwide cohort study. Clin Infect Dis 2013; 57 (12): 1695–1702. doi: 10.1093/ cid/cit603.
21. Huang YW, Yang SS, Fu SC et al. Increased risk of cirrhosis and its decompensation in chronic hepatitis C patients with new-onset diabetes: a nationwide cohort study. Hepatology 2014; 60 (3): 807–814. doi: 10.1002/hep.27 212.
22. Kumar R, García-Compeán D, Maji T. Hepatogenous diabetes: Knowledge, evidence, and skepticism. World J Hepatol 2022; 14 (7): 1291–1306. doi: 10.4254/wjh.v14.i7.1291.
23. Orsi E, Grancini V, Menini S, et al. Hepatogenous diabetes: Is it time to separate it from type 2 diabetes? Liver Int 2017; 37 (7): 950–962. doi: 10.1111/liv.13337.
24. Andrade AR, Bittencourt PL, Codes L et al. New Onset Diabetes and Non-Alcoholic Fatty Liver Disease after Liver Transplantation. Ann Hepatol 2017; 16 (6): 932–940. doi: 10.5604/01. 3001.0010.5285.
25. Perseghin G, Mazzaferro V, Sereni LP et al. Contribution of reduced insulin sensitivity and secretion to the pathogenesis of hepatogenous diabetes: effect of liver transplantation. Hepatology 2000; 31 (3): 694–703. doi: 10.1002/ hep.510310320.
26. Aravinthan AD, Fateen W, Doyle AC et al. The Impact of Preexisting and Post-transplant Diabetes Mellitus on Outcomes Following Liver Transplantation. Transplantation 2019; 103 (12): 2523–2530. doi: 10.1097/TP.0000000000002 757.
27. Davies MJ, Aroda VR, Collins BS et al. Management of hyperglycaemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetologia 2022; 65 (12): 1925–1966. doi: 10.1007/s00125-022-05787-2.
28. EASL Clinical Practice Guidelines for the management of patients with decompensated cirrhosis. J Hepatol 2018; 69 (2): 406–460. doi: 10.1016/j.jhep.2018.03.024.
29. EASL Clinical Practice Guidelines: Liver transplantation. J Hepatol 2016; 64 (2): 433–485. doi: 10.1016/j.jhep.2015.10.006.
30. Rydén L, Grant PJ, Anker SD et al. ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD: the Task Force on diabetes, pre-diabetes, and cardiovascular diseases of the European Society of Cardiology (ESC) and developed in collaboration with the European Association for the Study of Diabetes (EASD). Eur Heart J 2013; 34 (39): 3035–3087. doi: 10.1093/eurheartj/eht108.
Labels
Paediatric gastroenterology Gastroenterology and hepatology SurgeryArticle was published in
Gastroenterology and Hepatology
2023 Issue 4
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Spasmolytic Effect of Metamizole
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
- Clinical and experimental gastroenterology
- Hepatogenous diabetes in liver transplant candidates: prevalence, risk factors and posttransplant outcome – prospective study
- Robotic pancreatic surgery in a high-volume pancreatic cancer surgery center – first experience
- Chest pain as an atypical symptom of acute cholecystitis
- Impact of the COVID-19 pandemic on acute pancreatitis in the Czech Republic – pilot data PANACOTA study (PANcreatitis Acuta in COVid Time Analysis)
- Changing epidemiology of Clostridioides difficile infection – increasing number of community-acquired forms and infections in children
- Why should we and should we not use ChatGPT in gastroenterology?
- EUS guided drainage of gallbladder: own cohort of 66 patients for the period 2016–2022 from the Hospital Jablonec nad Nisou
- Switch from biosimilar infliximab CT-P13 to biosimilar infliximab SB-2 in the long-term maintenance therapy in IBD patients – prospective observational study
- Dosage forms of oral mesalazine and their clinical use
- Subkutánní infliximab – poznatky z praxe a další možnosti využití u pacientů s IBD
- The selection from international journals
- Správná odpověď na předchozí kvíz
- 44. české a slovenské endoskopické dny a Olomouc Live Endoscopy 2023
- Kreditovaný autodidaktický test: Klinická a experimentální gastroenterologie
- Biofeedback assisted deep breathing training in refractory disorders of gut-brain interaction – our first experience, impressions and suggestions for further clinical practice
- 12th Club Symposium on Portal Hypertension April, 14th–15th 2023, Banská Štiavnica
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Changing epidemiology of Clostridioides difficile infection – increasing number of community-acquired forms and infections in children
- Robotic pancreatic surgery in a high-volume pancreatic cancer surgery center – first experience
- EUS guided drainage of gallbladder: own cohort of 66 patients for the period 2016–2022 from the Hospital Jablonec nad Nisou
- Dosage forms of oral mesalazine and their clinical use

