Mikrometastáza v sentinelové uzlině – nutnost disekce axilárních uzlin?
Micrometastases in the sentinel lymph node – necessity of axillar lymph node dissection?
Either radical mastectomy with axillar lymphadenectomy or conservative surgery with axillar lymph node dissection are the standard treatments for patients with breast carcinoma. Sentinel lymph node biopsy is a new method that – if negative – allows axillar lymph node preservation and so minimizes major complications associated with this operation (especially lymphedema of the upper extremity). However, the development of the diagnostic means gave rise to new clinical entities – micrometastases and findings of clusters or solitary cells in the sentinel lymph node. Even though the probability of non-sentinel lymph node metastasis is only 10 %, all patients with the finding of micrometastases in the sentinel lymph node are currently indicated for axillar lymph node dissection. Based on the present retrospective study involving 398 females with breast carcinoma, the authors define a risk group for non-sentinel lymph node metastases. The other patients may be spared from successive axillar dissection.
Key words:
breast carcinoma, sentinel lymph node, micrometastasis axillar dissection.
:
J. Kotoč 1; K. Kotočová 1; J. Gatěk 1
; J. Duben 1; P. Vážan 2; J. Bakala 3
:
Chirurgické oddělení Nemocnice Atlas a. s., Zlín
Univerzita Tomáše Bati, Zlín
Primář: MUDr. Jiří Gatěk, Ph. D.
1; Bioptická a cytologická laboratoř, Zlín
Vedoucí lékař: MUDr. Josef Velecký
2; Oddělení nukleární medicíny, Krajská nemocnice Tomáše Bati, Zlín
Primář: MUDr. Jiří Bakala
3
:
Prakt. Lék. 2009; 89(10): 587-590
:
Of different specialties
Pacientky s karcinomem prsu jsou standardně léčeny mastektomií s exenterací axilárních uzlin nebo konzervativním výkonem se zachováním prsu a disekcí axilárních uzlin. Biopsie sentinelové uzliny je novou metodou, která umožňuje v negativních případech pacientku ušetřit disekce axily a minimalizuje závažné komplikace tohoto výkonu (především lymfedém horní končetiny). S rozvojem diagnostiky se však vynořily nové klinické jednotky – mikrometastázy, clustery a nálezy jednotlivých buněk v sentinelové uzlině. V současnosti jsou všechny pacientky s nálezem mikrometastázy v sentinelové uzlině indikovány k disekci axily, i když je pravděpodobnost postižení non-sentinelových uzlin jen 10 %. Autoři na základě retrospektivní studie 398 pacientek s karcinomem prsu definují rizikovou skupinu pro výskyt další metastázy v non-sentinelové uzlině. Ostatní pacientky by pak mohly být následné disekce axily ušetřeny.
Klíčová slova:
karcinom prsu, sentinelová uzlina, mikrometastáza, disekce axily.
Úvod
Standardní chirurgická léčba invazivního karcinomu prsu spočívá v kompletním odstranění nádoru s negativními okraji. Součástí této léčby je disekce axilárních uzlin. Biopsie sentinelové uzliny (SLN) je považována za ekvivalent axilární disekce u karcinomu prsu do 3 cm (1). V případě nálezu metastázy v sentinelové uzlině je dle současných doporučení indikována disekce prvních dvou etáží axilárních uzlin.
Metastázy karcinomu prsu v lymfatických uzlinách dělíme na
- makrometastázy,
- mikrometastázy, a
- submikrometastázy.
Jako makrometastáze označujeme metastázy větší než 2 mm.
Mikrometastázy karcinomu prsu v sentinelové uzlině jsou definovány velikostí 0,2–2 mm (2, 3).
Zvláštní jednotku tvoří submikrometastázy, což jsou samostatné buňky (ITC – isolated tumor cells), nebo shluky buněk (clustery) menší než 0,2 mm. Klinický význam submikrometastáz není v současnosti stanoven (4).
Přibližně 20–30 % (5, 6) pacientek má vyšetřovanou SLN pozitivní a musí podstoupit disekci axilárních uzlin. Komplikace, které provázejí disekci axily vedly ke snaze stanovit kritéria, kdy je postižení non-SLN nepravděpodobné. SLN je totiž často jediná uzlina postižená metastázou. Se snižující se velikostí tumoru a metastázy v SLN klesá pravděpodobnost postižení axilárních non-SLN.
U nálezu mikro - či submikrometastází v SLN je riziko postižení non-SLN pouze 10–15 % (7, 8). Proto je možné u pacientek se solitérní mikrometastázou v SLN a s tumorem nízkého metastatického potenciálu uvažovat o upuštění od disekce axily. Metastatický potenciál tumoru je určen zejména jeho velikostí, gradingem a přítomností lymfangioinvaze. Riziko postižení axilárních non-SLN uzlin se zvyšuje také s počtem metastaticky postižených SLN.
Při správném stanovení těchto kritérií by bylo možno nedisekovat axilu u definované skupiny pacientek a předcházet tak komplikacím, které jsou s disekcí axily spojeny – lymfedém končetiny, omezení hybnosti ramene či senzorický deficit.
Cílem retrospektivní studie bylo zhodnotit výskyt mikrometastáz v SLN a následně výskyt metastáz v non-SLN uzlinách disekované axily a stanovit skupinu pacientek, u kterých by bylo možno od disekce axily upustit (obr. 1).
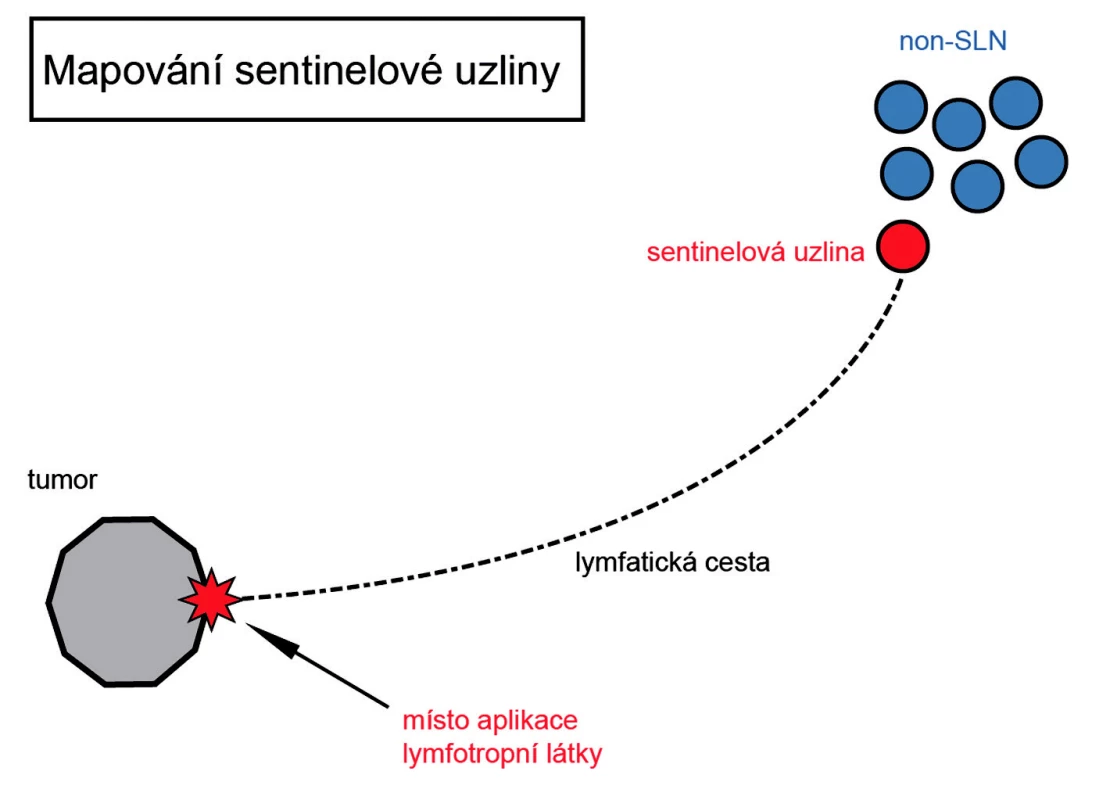
Soubor a metoda
Za období 2004–2008 bylo provedeno na chirurgickém oddělení Nemocnice Atlas a.s. Zlín 398 operací prsu pro karcinom s biopsií SLN. Biopsie SLN byla provedena u 85 % pacientek kombinací barvení Patent Blue a radiokoloidem (Nanocoll). Lymfoscintigrafie a následná biopsie SLN byly provedeny ve dvoudenním protokolu. Hodnotili jsme velikost a typ tumoru, přítomnost lymfangioinvaze, grading score a přítomnost hormonálních receptorů.
Průměrný věk v době diagnózy byl 60,0 roku (min. 25 let, max. 88 let). Duktální karcinom byl diagnostikován v 72,4 %, duktální karcinom in situ v 6,03 %, lobulární karcinom ve 2,27 %, jiný karcinom byl popsán v 19,3 %. Průměrná velikost tumoru byla 17,3 mm.
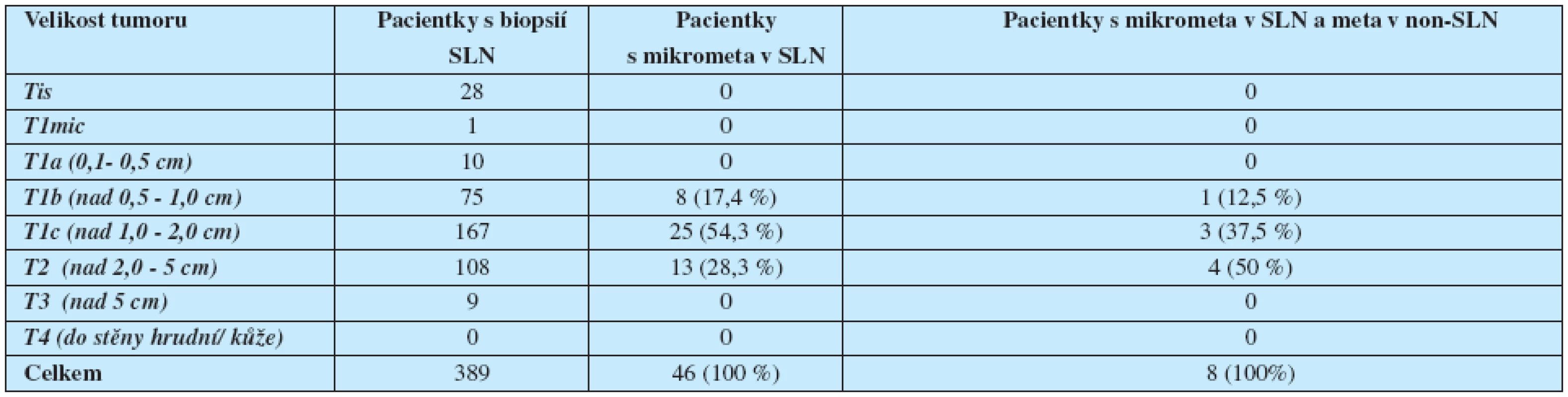
Z celého souboru 398 pacientek bylo 28x Tis (tumor in situ), 1x T1mic, 10x T1a, 75x T1b, 167x T1c, 108x T2, 9x T3.
Metastázy v SLN mělo 124 pacientek (31,6 %). U těchto pacientek s pozitivní SLN byla v druhé době provedena exenterace axily. Průměrně bylo vyšetřeno 11,2 non-SLN uzlin. Metastázy v non-SLN uzlinách mělo 49 pacientek (12,3 %).
Ze 124 pacientek s metastázou v SLN mělo 46 pacientek mikrometastázu v SLN. Průměrný věk v době diagnózy u pacientek s mikrometastázou byl 62,6 roku (min. 36 let, max. 85 let).
Duktální karcinom byl diagnostikován v 80,4 %, lobulární karcinom ve 4,4%, jiný karcinom byl popsán ve 15,2 %. Průměrná velikost tumoru byla 17,6 mm.
Tumor T1b mělo 8 pacientek (17,4%), T1c 25 pacientek (54,3%), T2 13 pacientek (28,3%).
Mikrometastáza pouze v 1 SLN byla nalezena u 40 pacientek, mikrometastáza ve 2 SLN byla nalezena u 6 pacientek.
Všechny SLN byly peroperačně vyšetřeny cytologicky „na zmrzlo“ a následně hematoxylin-eozinem v parafinovém bloku (řezy 2 x 50 ∝m a dále po 150 až 200 ∝m). U všech mikrometastáz v SLN byla v druhé době provedena exenterace axily. Průměrně bylo vyšetřeno 11.1 non-SLN uzlin (min. 5, max. 24) (tab. 1).
Výsledky
V souboru 46 pacientek s mikrometastázou v SLN bylo 38 pacientek (82,6 %), které měly všechny axilární non-SLN uzliny negativní.
Osm pacientek (17,4 %) mělo po disekci axily metastázu v non-SLN uzlině. Duktální karcinom se vyskytoval v 6 případech (75 %), lobulární karcinom ve 2 případech (25 %). Průměrná velikost tumoru byla 19,9 mm.
Tumor T1b měla 1 pacientka (12,5 %), T1c 3 pacientky (37,5 %) a T2 4 pacientky (50 %).
Mikrometastáza v 1 SLN byla nalezena u 7 pacientek (87,5 %), ve dvou SLN u 1 pacientky (12,5 %). Při disekci axily bylo průměrně vyšetřeno 12,4 non-SLN uzlin. Mikrometastáza v 1 non-SLN byla u jedné pacientky, u ostatních pacientek byly makrometastázy. Rozbor jednotlivých pacientek s mikrometastázou v SLN a metastázou v non-SLN dle typu tumoru a jeho parametrů je uveden v tabulce 2.
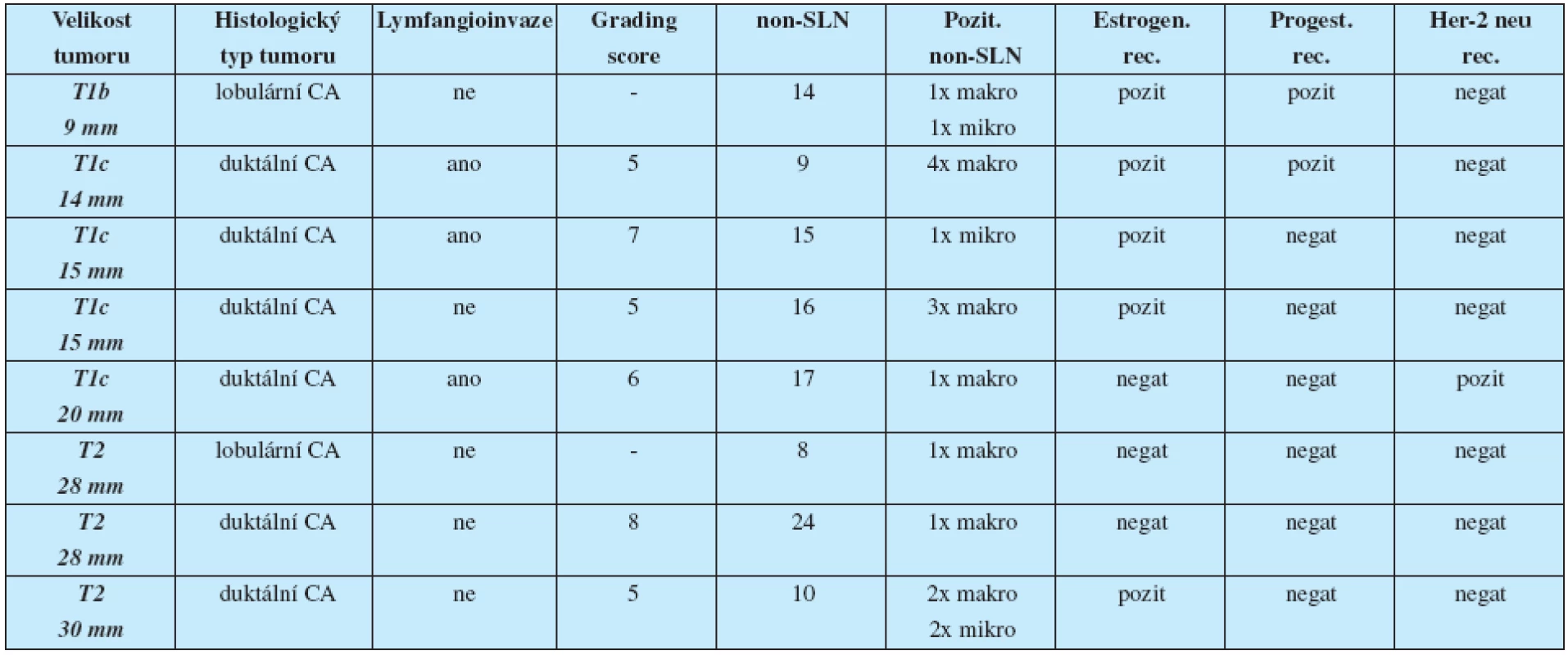
Výskyt axilárních metastáz byl častější u tumorů velikosti nad 2 cm, s vyšším grading score (v našem souboru průměrně 6) a u tumorů s lymfangioinvazí (37,5 % pacientek). U lobulárního karcinomu byly metastázy v axile přítomny ve 25 %, což u všech pacientek s mikrometastázou v SLN bylo pouze 4,4 %. Přítomnost hormonálních receptorů a HER-2 neu byla v obou souborech téměř identická.
Diskuse
Ze všech pacientek, které na našem pracovišti podstoupily biopsii SLN, měla přibližně každá devátá nález mikrometastázy v SLN (46 pacientek, t.j. 11,6 % z 398 pacientek) a u všech byla následně disekována axila. Pozitivní axilární non-SLN byla pouze u 8 pacientek, u ostatních 38 pacientek by disekce axily nemusela být provedena.
V literatuře jsou uváděny různé rizikové faktory tumoru a mikrometastázy, kdy je při mikrometastáze v SLN postižení axilárních non-SLN nepravděpodobné, a tudíž by bylo možné axilární uzliny nedisekovat. Většina autorů uvádí jako rizikový faktor postižení non-SLN velikost tumoru nad 2 cm (9, 10, 11, 12), u kterého již doporučuje provést axilární disekci.
Z dalších charakteristik je to zejména přítomnost lymfovaskulární invaze tumoru (9, 12) a vyšší histologické grading score tumoru (9), které zvyšuje pravděpodobnost postižení non-SLN. Rizikovější je rovněž postižení více než jedné SLN mikrometastázou (9).
Diskutována je i samotná velikost mikrometastázy (v rozpětí 0,2–2 mm) v SLN, kde při větší mikrometastáze je postižení non-SLN pravděpodobnější (13). Dle některých autorů i poloha mikrometastázy v SLN v rámci uzliny má vliv na postižení non-SLN. Intranodální lokalizace mikrometastázy je rizikovější než sinusová (13) (obr. 2).
V celém souboru 398 pacientek bylo 85 tumorů T1a a T1b. Z těchto 85 pacientek mělo pouze 8 pacientek mikrometastázu v SLN a pouze 1 pacientka měla postiženu non-SLN uzlinu. Tyto výsledky jsou důkazem minimální pravděpodobnosti postižení non-SLN uzlin u tumorů T1a a T1b.
Pacientek s tumorem T1c bylo celkem 167. Z tohoto počtu mělo 25 pacientek mikrometastázu v SLN a 3 pacientky měly zároveň postiženu non-SLN uzlinu. U tumorů velikosti 1–2 cm (T1c) je již pravděpodobnost postižení non-SLN uzlin vyšší, proto u těchto pacientek můžeme od disekce axily upustit seletivně, po zhodnocení ostatních rizikových faktorů.
V souboru 8 pacientek s metastázou v non-SLN byl vyšší výskyt tumorů T2, tumorů s vyšším grading score a tumorů s přítomností lymfangioinvaze v porovnání se všemi pacientkami s mikrometastázou v SLN. Vyšší výskyt metastázy v non-SLN u pacientek s lobulárním karcinomem prsu v porovnání s duktálním karcinomem nelze spolehlivě hodnotit pro nízký počet pacientek s diagnózou lobulárního karcinomu (2 pacientky v souboru s metastázou v non-SLN).
U vybraných pacientek s mikrometastázou v SLN, u kterých nebyla provedena disekce axily, je riziko vzniku axilárních metastáz nízké, protože všechny pacientky po prs záchovném chirurgickém výkonu podstupují standardně radioterapii prsu a lůžka tumoru, přičemž je zachycena i „dolní axila“. Případné mikrometastázy v non-SLN uzlinách mohou být touto radioterapii eliminovány.
Pacientky mohou také podstoupit zajišťovací adjuvantní chemoterapii, která se rovněž podílí na eliminaci možných mikrometastáz v non-SLN uzlinách. Adjuvantní chemoterapie se u nás standardně nepodává u všech mikrometastáz v SLN, neboť kritériem podání chemoterapie je zejména velikost a typ tumoru. Některá světová pracoviště již chemoterapii podávají vždy při nálezu mikrometastáze ve spádových uzlinách (15).
Výskyt axilární recidivy u pacientek, kterým nebyla provedena disekce axily, by při dlouhodobém sledování neměl být častější, než u kompletní axilární disekce (0–2 %) (14). Hodnocení výskytu recidiv u pacientek s mikrometastázou v SLN, u kterých nebude provedena disekce axily, bude vyžadovat delší sledování po operaci. Recidiva onemocnění v axile může podle některých studií ovlivnit délku přežívání nemocných (14, 16) a je významným faktorem morbidity. Tato skutečnost by proto rovněž neměla být opomíjena ve snaze o provedení konzervativního výkonu.
Závěr
Zavedení biopsie SLN do praxe znamenalo významný krok v miniinvazivním operování karcinomu prsu s přímým vlivem na kvalitu života pacientky. Při negativní SLN není již nutná disekce axilárních uzlin. Disekci axilárních uzlin u velké části pacientek s mikrometastázou v SLN můžeme hodnotit jako „overtreatment“. V našem souboru pacientek s mikrometastázou v SLN mělo 82,6 % všechny axilární non-SLN uzliny negativní.
Tumory T1 s mikrometastázou v SLN mají nízkou pravděpodobnost metastazování do non-SLN. U tumorů T1a, T1b a selektivně T1c s mikrometastázou pouze v jedné SLN, bez lymfangioinvaze a s grading score do 5 (grade I) můžeme proto upustit od exenterace axily s minimálním rizikem.
MUDr. Július Kotoč
Chirurgické oddělení Nemocnice Atlas
Třída Tomáše Bati 5135
760 01 Zlín
E-mail: jkotoc@seznam.cz
Sources
1. Fait, V. Sentinel node biopsy and possibilities of use in current surgical oncology. (Sentinelová biopsie a možnosti využití v současné onkochirurgii). Klinická onkologie, 2008, 21(1), p. 5-19.
2. Dowlatshahi, K., Fan, M., Snider, H.C., Habib, F.A. Lymph node micrometastases from breast carcinoma. Reviewing the dilema. Cancer 1997, 80(7), p. 1188-1197.
3. Fournier, K., Schiller, A., Perry, R.R., Laronga, Ch. Micrometastasis in the sentinel lymph node of breast cancer does not mandate completion axillary dissection. Ann. Surg., 2004, 239(6), p. 859-865.
4. Susnik, B., Frkovic-Grazio, S., Bracko, M. Occult micrometastases in axillary lymph node predict subsequent distant metastases in stage I breast cancer: a case-control study with 15-year follow-up. Ann. Surg. Oncol., 2004, 11(6), p. 586-572.
5. Cox, Ch.E., Pendas, S., Cox, J.M., et al. Guidelines for sentinel node biopsy and lymphatic mapping of patients with breast cancer. Ann. Surg. 1998, 227(5), p. 645-653.
6. Goyal, A., Douglas-Jones, A., Newcombe, R.G., Mansel, R.E. Predictor of non-sentinel lymph node metastasis in breast cancer patients. Eur. J. Cancer 2004, 40(11), p. 1731-1737.
7. Chu, K.Y., Turner, R.R., Hansen, N.M. et al. Do all patients with sentinel node metastasis from breast carcinoma need complete axillary node dissection? Ann. Surg. 1999, 229(4), p. 536-541.
8. Cserni, G., Gregori. D., Merletti, F. et al. Meta-analysis of non-sentinel node metastases associated with micrometastatic sentinel nodes in breast cancer. Br. J. Surg. 2004, 91(10), p. 1245-1252.
9. Rutledge, H., Davis, J., Chiu, R. et al. Sentinel node micrometastasis in breast carcinoma may not by an indication for complete axillary dissection. Mod. Pathol., 2005, 18, p. 762-768.
10. Bear, H.D. Sentinel node micrometastases and non-sentinel nodes in breast cancer: how much do we need to know? J. Clin. Onc. 2006, 24(12), p. 1788-1790.
11. Den Bakker, M.A., Van Weeszenberg, A., De Kanter, A.Y. et al. Non-sentinel lymph node involvement in patients with breast cancer and sentinel node micrometastasis; too early to abandon axillary clearance. J. Clin. Pathol. 2002, 55, p. 932-935.
12. Houvenaeghel, G., Nos, C., Mignotte, H. et al. Micrometastases in sentinel lymph node in a multicentric study: predictive factors of non-sentinel lymph node involvement. J. Clin. Onc. 2006, 24(12), p. 1-9.
13. Di Tommaso, L., Arizzi, C., Rahal, D. et al. Anatomic location of breast cancer micrometastasis in sentinel lymph node predicts axillary status. Ann. Surg. 2006, 243(5), p. 706-707.
14. Langer, I., Marti, W.R., Guller, U. et al. Axillary recurrence rate in breast cancer patients with negative sentinel lymph node (SLN) or SLN micrometastases. Prospective analysis of 150 patients after SLN biopsy. Ann. Surg. 2005, 241(1), p. 152–158.
15. Chagpar, A., Middleton, L.P., Sahin, A.A. et al. Clinical outcome of patients with lymph node-negative breast carcinoma who have sentinel lymph node micrometastases detected by immunohistochemistry. Cancer 2005, 103(8), p. 1581-1586.
16. Fredrikkson, I., Liljegren, G., Arnesson, L.-G. et al. Consequences of axillary recurrence after conservative breast surgery. Brit. J. Surg. 2002, 89, p. 902-908.
Labels
General practitioner for children and adolescents General practitioner for adultsArticle was published in
General Practitioner

2009 Issue 10
- Advances in the Treatment of Myasthenia Gravis on the Horizon
- Hope Awakens with Early Diagnosis of Parkinson's Disease Based on Skin Odor
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Memantine Eases Daily Life for Patients and Caregivers
-
All articles in this issue
- Advance directives in the USA
- Pathophysiology, symptomatology and diagnosis of an overactive urinary bladder
- A new clinical unit DSD – disorders of sexual development and their consequences
- Group cognitive behavioural therapy of obesity in the primary prevention of metabolic syndrome
- Role of ambroxol in therapeutic interaction of mucociliary clearance in the “bronchitic phenotype” of COPD
- Recombinant human erythropoietin treatment
- Accreditation of general practitioners‘ surgeries in the Czech Republic
- Micrometastases in the sentinel lymph node – necessity of axillar lymph node dissection?
- An unusual case report of multiple substance dependence on prescription drugs
- Health state assessment and rate of working capacity in oncological patients
- Ambulatory phlebectomy in patients with a factor V Leiden mutation
- General Practitioner
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Recombinant human erythropoietin treatment
- A new clinical unit DSD – disorders of sexual development and their consequences
- Accreditation of general practitioners‘ surgeries in the Czech Republic
- Micrometastases in the sentinel lymph node – necessity of axillar lymph node dissection?
