Záchrana ischemickej končatiny terapeutickou angiogenézou
The Salvage of Ischaemic Limb by Therapeutical Angiogenesis
Background:
Critical limb ischaemia (CLI) is defined as a chronic rest pain, lasting more than 2 weeks, requiring analgesics and/or with present skin defects. Autologous transplantation of bone marrow mononuclear cells has been used successfully in CLI.
Aim:
The salvage of critically ischaemic limb by endotel progenitory cells (EPCs) from patient’s bone marrow. To assess efficacy and safety of critical lower limb ischaemia treatment with marrow stem cell autotransplantation.
Methods:
9 patients suffering from CLI have been enrolled. They did not require emergency amputation and had previously been unsuccessfully treated with conventional therapy. Mononuclear cells were isolated from the bone marrow taken from illiac crest and injected in the gastrocnemius muscle and pedal region of the affected limb. Patients have had evaluated: local finding, pain index, quality of life index, ABI, fotopletysmography, markers of endothelium and trombocytes’ activation and digital subtractive angiography.
Results:
Pain severity decreased in all of patients. Three of them are with no pain and no claudication. Lesions resolved in two patients, partially in three patients. Crural amputation was required in two patients, amputation of leg in 1 patient. No side effects of the therapy were observed. One patient died without connection with procedure.
Conclusions:
Marrow stem cell autotransplantation into the ischaemic lower limb seems to be a potentially effective method of peripheral perfusion enhancement. Further studies are needed to clarify the underlying mechanisms of such improvement.
Key words:
critical limb ischemia – bone marrow stem cells – therapeutical angiogenesis
Authors:
R. Talapková 1; J. Hudeček 2; I. Šinák 1; P. Kubisz 2; Ľ. Laca 1; Ľ. Hlinka 1; K. Zeleňák 3
Authors‘ workplace:
Klinika transplantačnej a cievnej chirurgie Jesseniovej lekárskej fakulty UK a MFN Martin, Slovenská republika, prednosta doc. MUDr. Ľudovít Laca, Ph. D., mim. prof.
1; Klinika hematológie a transfuziológie Jesseniovej lekárskej fakulty UK a MFN Martin, Slovenská republika, prednosta prof. MUDr. Peter Kubisz, DrSc.
2; Klinika rádiologie Jesseniovej lekárskej fakulty UK a MFN Martin, Slovenská republika, prednosta MUDr. Hubert Poláček, Ph. D.
3
Published in:
Vnitř Lék 2009; 55(3): 179-183
Category:
15th Parizek's Days
Overview
Úvod:
Kritická končatinová ischémia (CLI) je definovaná ako chronická ischemická bolesť končatín vyžadujúca pravidelnú analgetickú liečbu v trvaní minimálne 2 týždne, a/alebo s prítomnými kožnými defektmi. U pacientov s CLI je veľká pravdepodobnosť potreby vysokej amputácie končatiny do 6–12 mesiacov, ak nedôjde k zlepšeniu perfúzie. V početných prácach bol zdokumentovaný priaznivý efekt autológnej transplantácie kmeňových buniek z kostnej drene u pacientov s vyčerpanými možnosťami chirurgickej, resp. endovaskulárnej rekonštrukcie.
Cieľ:
Záchrana končatiny u pacientov s CLI s využitím endotelových progenitorových buniek (EPC) z kostnej drene pacienta a zhodnotenie účinnosti a bezpečnosti terapeutickej angiogenézy u pacientov s CLI.
Materiál a metodika:
Do štúdie sú priebežne zaraďovaní pacienti s CLI bez možnosti chirurgickej, resp. endovaskulárnej rekonštrukcie. Autori prezentujú výsledky 9 odliečených pacientov. EPC boli izolované z autológnej kostnej drene odobratej z lopaty bedrovej kosti a po separácii aplikované intramuskulárne do svalov predkolenia a nohy postihnutej končatiny. Pacienti mali vyšetrené: lokálny nález, index bolesti, index kvality života, potrebu a dávku analgetík, členkovo-ramenný index (ABI), fotopletyzmografiu, markery aktivácie endotelu a trombocytov, digitálnu subtrakčnú angiografiu (DSA).
Výsledky:
Intenzita bolesti sa znížila u všetkých pacientov, 3 pacienti majú trvalý analgetický efekt bez klaudikácií, 2 pacienti úplne zhojený defekt, 3 pacienti parciálne zhojený defekt, 2 pacienti podstúpili amputáciu na predkolení, 1 pacient na úrovni nohy, 1 pacient exitoval bez súvisu s výkonom. Nezaznamenali sme žiadne nežiaduce účinky, resp. komplikácie.
Záver:
Autológna transplantácia kmeňových buniek v liečbe CLI sa javí ako potenciálne úspešná a bezpečná metóda na zlepšenie prekrvenia u pacientov so zlyhanými možnosťami chirurgickej a konzervatívnej terapie.
Kľúčové slová:
kritická končatinová ischémia – kmeňové bunky kostnej drene – terapeutická angiogenéza
Úvod
Ochorenia periférnych tepien (PAO), postihujúce prevažne dolné končatiny, sú závažným celosvetovým problémom. Vo svojom terminálnom štádiu, ktorému je vyhradený pojem kritická končatinová ischémia (CLI), ohrozujú pacienta amputáciou. Transatlantický konsenzus liečby PAO (TASC II.), prijatý v roku 2006, definuje CLI ako štádium PAO, ktoré je charakterizované chronickou ischemickou kľudovou bolesťou a/alebo ischemickou kožnou léziou vo forme ulkusu alebo gangrény. Termín je vyhradený len pre prípady chronickej ischemickej choroby s prítomnosťou uvedených symptómov, trvajúcich viac ako 2 týždne. Diagnózu CLI verifikujú hodnoty členkového systolického tlaku, prstového systolického tlaku alebo transkutánneho tlaku kyslíka. Pre ischemickú kľudovú bolesť svedčia členkové tlaky pod 50 mm Hg alebo prstové tlaky nižšie ako 30 mm Hg alebo transkutánny kyslík nižší ako 30 mm Hg.
Incidencia CLI sa v Európe a severnej Amerike odhaduje asi na 500–1 000 nových prípadov na 1 milión obyvateľov. Po stanovení diagnózy sa asi polovica pacientov s CLI podrobí určitému typu revaskularizácie. Približne 25 % prípadov vyžaduje primárnu amputáciu a zvyšok pacientov s nerekonštruovateľnými pomermi zostáva na medikamentóznej liečbe. V podskupine pacientov s nerekonštruovateľnými pomermi alebo so zlyhaním revaskularizácie do 6 mesiacov približne 40 % stratí končatinu a asi 20 % zomrie.
Z uvedeného vyplýva, že prognóza pacientov s CLI je veľmi nepriaznivá, pričom počty amputovaných pacientov sú vysoké. Incidencia veľkých amputácií sa pohybuje od 120 do 500/milión obyvateľov a rok.
Úspešná chirurgická alebo endovaskulárna revaskularizácia zachraňuje končatinu, zmierňuje bolesti a zlepšuje kvalitu života, ale často nie je možná pre nerekonštruovateľné arteriálne pomery.
V prípade nedostupnosti revaskularizácie alebo v prípade zlyhania chirurgickej a endovaskulárnej liečby je potrebné hľadať nové alternatívy a postupy. Terapeutická angiogenéza, realizovaná transplantáciou autológnych kmeňových buniek kostnej drene (KD), je nádejnou alternatívnou možnosťou [1].
Angiogenéza je fyziologický proces nevyhnutný na hojenie rán. Nastupuje prakticky ihneď po vzniku poranenia. Je iniciovaný mnohými molekulárnymi signálmi, ako sú faktory hemostázy, zápalu, cytokíny, rastové faktory a interakcie medzi bunkovými matrix. Nové kapiláry proliferujú kaskádou biologických procesov za účelom vytvorenia granulačného tkaniva. Tento proces trvá až do zhojenia rany, kedy je angiogenéza zastavená zníženou hladinou rastových faktorov, ústupom zápalu, stabilizáciou bunkovej matrix a endogénnymi inhibítormi angiogenézy [2].
Kmeňové bunky získané z dospelej kostnej drene významnou mierou prispievajú k angiogenéze. Tieto bunky, známe ako endotelové progenitorové bunky (EPC), môžu byť izolované aj z periférnej krvi zdravých jedincov, avšak tu je ich záchyt extrémne nízky. Po vzniku poranenia sú EPC mobilizované do cirkulácie, usadia sa v mieste potrebnej neovaskularizácie a tu sa diferencujú na zrelé endotelové bunky.
Pluripotentné kmeňové bunky (KB) majú schopnosť sebaobnovy vlastnej bunkovej populácie, klonálnej multilineárnej diferenciácie a obnovy rôznorodých tkanív. Produkujú množstvo cytokínov (IL‑6, GM‑CSF, G‑CSF a ďalšie), tlmia imunitnú reakciu (T-bunky).
Na novotvorbe ciev sa podieľajú 3 procesy:
- Angiogenéza hrá úlohu v postnatálnej neovaskularizácii, vzniká aktiváciou preexistujúcich endotelových buniek in situ (proliferácia endometria, postischemické zotavenie tkaniva, hojenie rán, rast karcinómu).
- Vaskulogenéza je tvorba ciev de novo v postnatálnom období, ide o neovaskularizáciu spúšťanú ischémiou, poranením, rakovinou. Úlohu v nej hrajú EPC z kostnej drene.
- Arteriogenéza zaisťuje zväčšenie kolaterál, je podnietená „shear“ stresom, nie hypoxiou.
Vaskulárna regresia dáva pokyn na zastavenie novotvorby ciev, keď je už dosiahnutá dostatočná perfúzia [3,4]. Predklinické a početné klinické štúdie ukazujú, že implantácia EPC buniek do ischemickej končatiny zlepšuje tvorbu kolaterálnych ciev [5–11].
Cieľ
Hlavným cieľom našej práce je záchrana ischemickej končatiny pred vysokou amputáciou s využitím EPC z autológnej kostnej drene a zhodnotenie účinnosti terapeutickej angiogenézy u pacientov s kritickou končatinovou ischémiou. Okrem toho sledujeme bezpečnosť danej liečebnej modality (výskyt angina pectoris, cievnej mozgovej príhody, akútnej arteriálnej, resp. venóznej trombózy DK, infekčných komplikácií na postihnutej dolnej končatine apod.).
Materiál a metodika
Do klinického experimentu sú priebežne zaraďovaní pacienti s PAO dolných končatín v III. a IV. štádiu podľa Fontaina, t. j. pacienti s kľudovými bolesťami a/alebo defektom na dolnej končatine. Sú to kandidáti na amputáciu dolnej končatiny z dôvodu nemožnosti chirurgickej, resp. endovaskulárnej revaskularizácie alebo uzáveru predchádzajúcej revaskularizácie.
Exklúzne kritériá pre zaradenie do štúdie sú: ťažký mozgový deficit, imobilita, demencia, závažná komorbidita, predpokladaná limitovaná dĺžka života (< 6 mesiacov), stav vyžadujúci amputáciu pre záchranu života pacienta, nádorové ochorenia krvotvorby, trofické lézie s panikulitídou, perifokálnou lymfangoitídou, diabetická noha bez známok ischémie, chronická renálna insuficiencia v hemodialyzačnom programe, neoplastický proces v posledných 5 rokoch.
Pacient je vyšetrený pred výkonom, pred prepustením z nemocnice a následne o 1, 3, 6 a 12 mesiacov po výkone.
Sledované kritériá: subjektívne – klaudikačný interval, intenzita bolesti (index bolesti 0–10), druh a dávka analgetík, zmena kvality života vo vzťahu k terapii, objektívne – hojenie lézií, záchrana končatiny pred amputáciou, členkovo-ramenný index (ABI), fotopletyzmografia a markery aktivácie endotelu (TM, t-PA, PAI‑1,vWF) a trombocytov (CD 52) [12], stupeň neoformácie kolaterál digitálnou subtrakčnou angiografiou (DSA).
Štúdia je realizovaná na základe grantu Ministerstva zdravotníctva Slovenskej republiky (MZSR) a jej protokol bol odsúhlasený etickou komisiou MZSR. Každý pacient má podpísaný informovaný písomný súhlas so zaradením do štúdie.
Výsledky
Charakteristika pacientov
Do štúdie bolo doteraz zaradených 9 pacientov (7 mužov, 2 ženy) vo veku od 44 do 83 rokov (tab. 1). Všetci pacienti mali nerekonštruovateľné arteriálne pomery a zlyhanie komplexnej konzervatívnej liečby, pričom všetci boli bezprostredne ohrození vysokou amputáciou. Všetci mali kľudové bolesti DK, 6 z nich mali trofické zmeny v zmysle defektu, resp. gangrény nohy. Jeden pacient má Burgerovu chorobu. Traja pacienti majú diabetes mellitus. Všetci pacienti mali antitrombotickú a vazodilatačnú liečbu. Všetci boli nútení užívať analgetiká z dôvodu ischemickej bolesti (obr. 1–4).
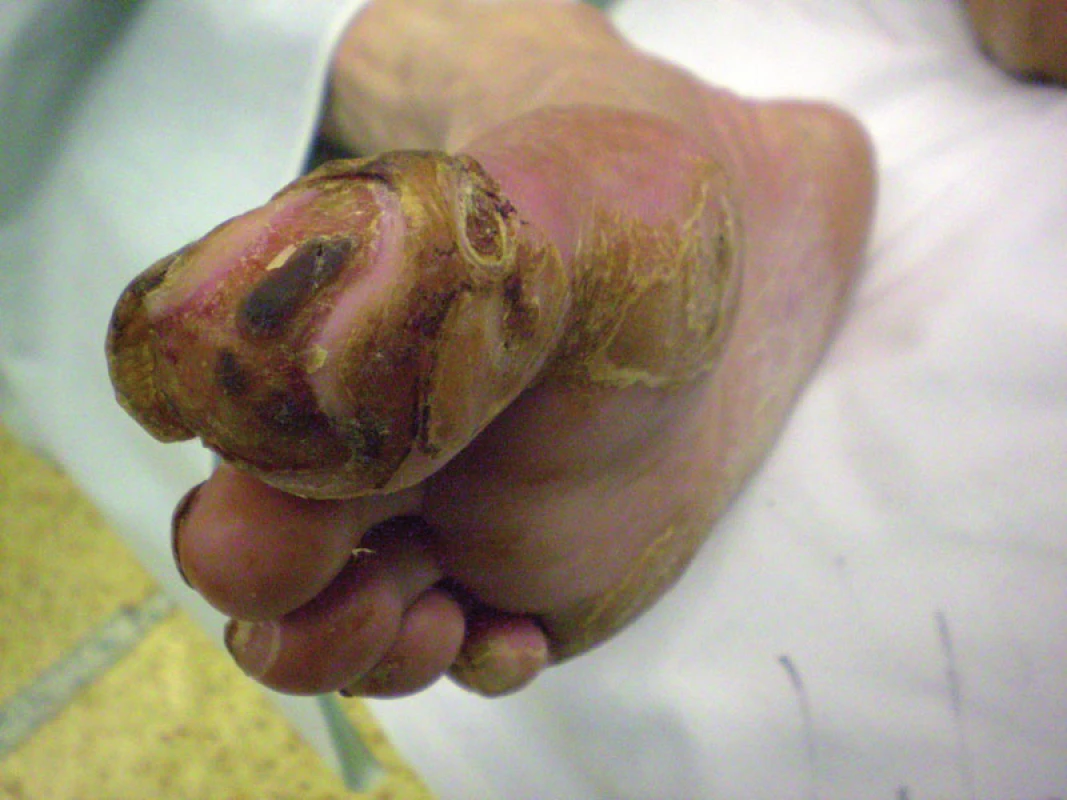
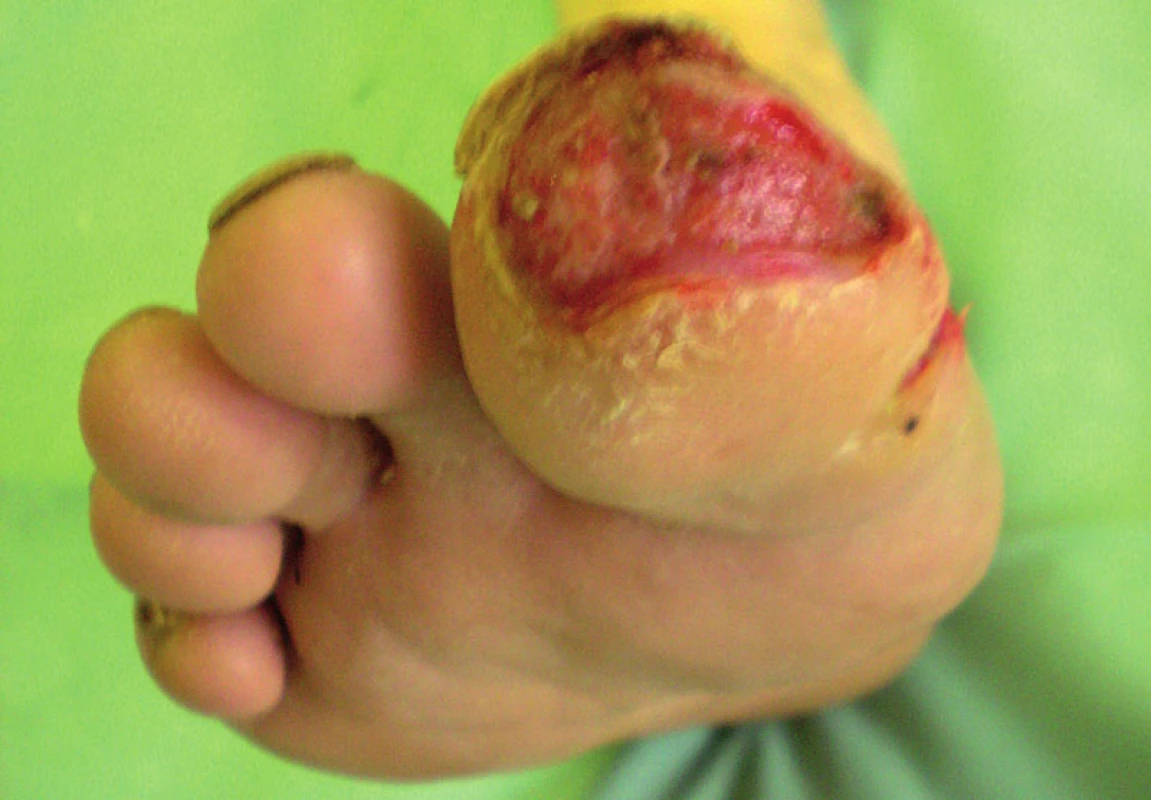
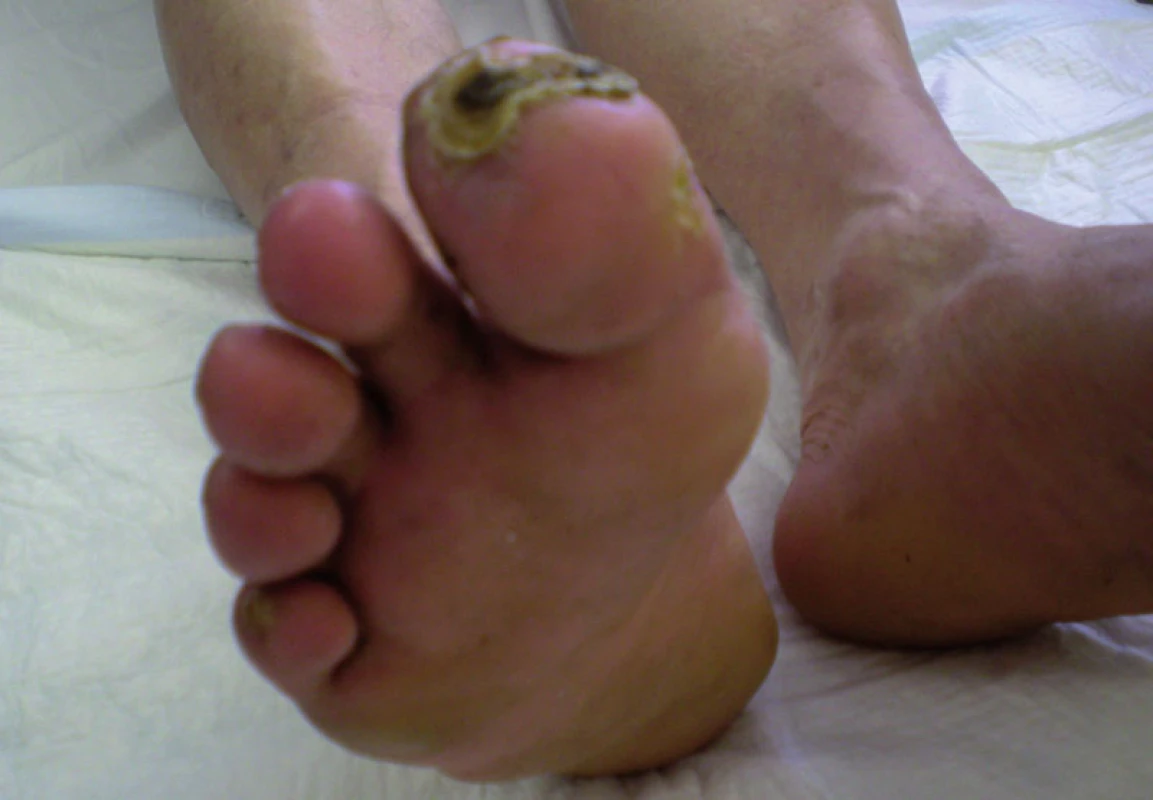
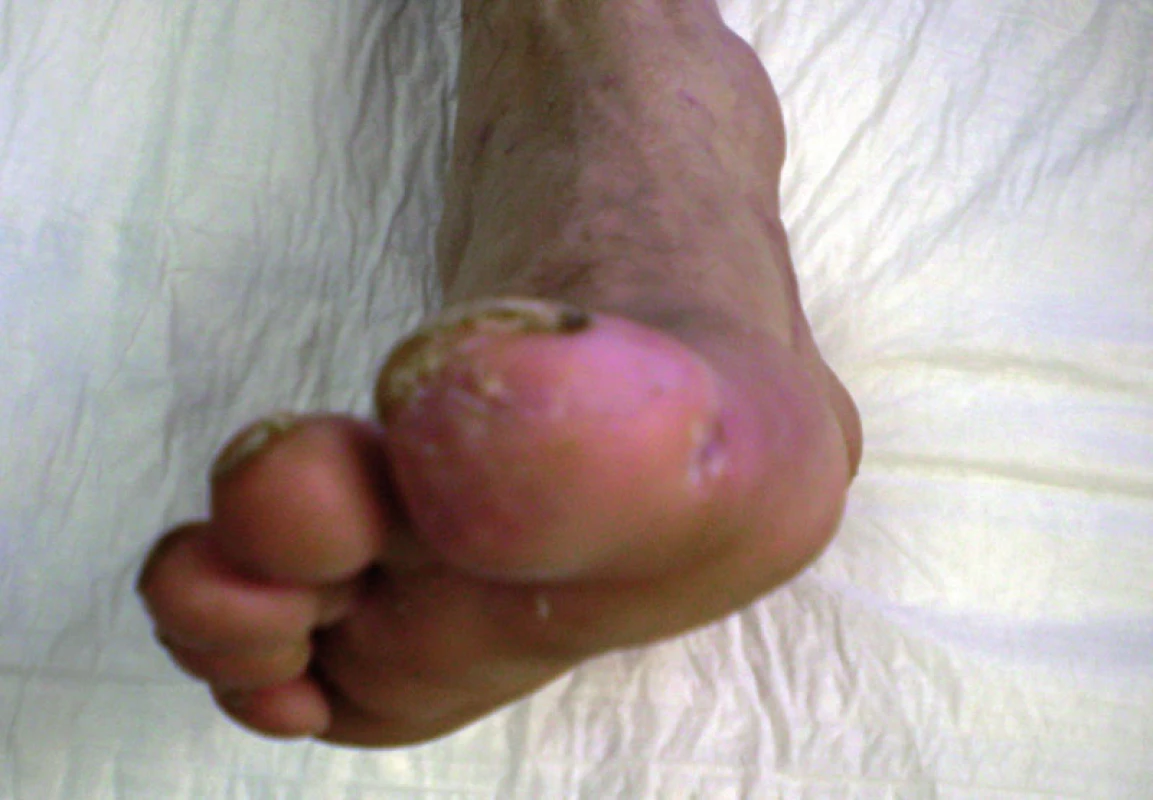
U všetkých pacientov bola zaznamenaná dobrá tolerancia procedúry. Bezprostredný analgetický účinok, v niektorých prípadoch nevysvetliteľne výrazný, udalo 7 pacientov. Zlepšená trofika končatiny sa prejavila u 5 pacientov. Zlepšenie pohybovej aktivity nastalo u 4 pacientov.
U ani jedného pacienta sme nezaznamenali veľké kardiovaskulárne komplikácie ani iné periprocedurálne komplikácie (infekcia, renálne zlyhanie, výskyt angina pectoris, cievnej mozgovej príhody, akútnej arteriálnej, resp. venóznej trombózy DK apod.) (tab. 2).
Diskusia
Dobrá tolerancia procedúry zo strany pacienta, absencia nežiadúcich účinkov, dostupnosť autológnej kostnej drene sú faktory, vďaka ktorým sa aplikácia kmeňových buniek v liečbe kritickej končatinovej ischémie javí ako perspektívna metóda, rozširujúca paletu výkonov v prípadoch, kedy sú možnosti cievnej rekonštrukčnej chirurgie, resp. endovaskulárne výkony vyčerpané. V blízkej budúcnosti je potrebné realizovať randomizované, dvojito zaslepené štúdie. Keďže štúdia nemá kontrolnú skupinu, nemožno klinický efekt pripísať jednoznačne a jedine na vrub podania autológnych kmeňových buniek. Ďalšími potenciálnymi faktormi ovplyvňujúcimi klinické zlepšenie by mohli byť:
- spontánne zlepšenie
- placebo efekt
- medikamentózna terapia
Ad 1.
V skutočnosti je viac než zriedkavé, že by sa PAO DK spontánne zmiernilo, resp. zlepšilo bez intervencie alebo intenzívneho tréningu. Okrem toho nebol v štúdii pozorovaný signifikantný nárast ABI na kontralaterálnej (neliečenej) končatine.
Ad 2.
Placebo efekt hrá významnú úlohu v prípade subjektívnych parametrov, na druhej strane však hojenie rán, ABI a pletyzmografia sú parametrami objektívnymi.
Ad 3.
Medikamentózna liečba základného ako aj pridružených ochorení nebola periprocedurálne menená, takže nemožno zlepšenie u pacientov vysvetľovať medikamentóznou liečbou.
Vo svetovej literatúre je publikovaných viacero štúdií o využití terapeutickej angiogenézy v liečbe CLI v prípadoch nerekonštruovateľných cievnych pomerov na postihnutej končatine. Podanie kmeňových buniek je realizované dvoma rôznymi spôsobmi. Prvým je intraarteriálna aplikácia [13]. Druhým spôsobom je multilokulárna injekcia do svalov ischemického predkolenia a nohy [5,11]. V našej štúdii realizujeme metodiku intramuskulárnej aplikácie, ktorá je technicky nenáročná, pacientmi veľmi dobre tolerovaná. Zabezpečuje pritom dostatočný transport pluripotentných progenitorových buniek na miesto potreby a ich primeranú koncentráciu v ischemickom svale, teda na mieste ich určenia, kde očakávame terapeutický efekt angiogenézy.
Záver
Autológna transplantácia EPC z kostnej drene pacienta by mohla byť bezpečnou a efektívnou metódou na zaistenie terapeutickej angiogenézy. Autológna kostná dreň poskytuje endotelové progenitorové bunky, ktoré majú schopnosť sa diferencovať na endotelové bunky a zároveň produkovať množstvo cytokínov.
Poďakovanie
Štúdia je realizovaná na základe grantu Ministerstva zdravotníctva Slovenskej republiky MZ SR.
Doručeno do redakce: 9. 2. 2009
MUDr. Renáta Talapková, Ph.D.
www.jfmed.uniba.sk
e‑mail: rtalapkova@post.sk
Sources
1. Norgren L, Hiatt WR, Dormandy JA et al. TASC II Working Group (2007). Inter-Society Consensus for the Management of Peripheral Arterial Disease (TASC II). Eur J Vasc Endovasc Surg 2007; 33 (Suppl 1): S1–S75.
2. Li WW, Li VW, Tsakayannis D. Angiogenesis in Wound Healing. Cont Surg 2003; (Suppl): 36.
3. Madeddu P. Therapeutic angiogenesis and vasculogenesis for tissue regeneration. Exp Physiol 2005; 90 : 315–326.
4. Rissanen TT, Vajanto I, Yia-Hertuula S. Gene therapy for therapeutic angiogenesis in critically ischaemic lover limb – on way to the clinic. Eur J Clin Invest 2001; 31 : 651–666.
5. Tateishi-Yuyama E, Matsubara H, Murohara T et al. Therapeutic angiogenesis for patients with limb ischaemia by autologous transplantation of bone-marrow cells: a pilot study and a randomised controlled trial. Lancet 2002; 360 : 427–435.
6. De Vriese AS, Billiet J, Van Droogenbroeck J et al. Autologous transplantation of bone marrow mononuclear cells for limb ischemia in a caucasian population with atherosclerosis obliterans. J Int Med 2008; 263 : 395–403.
7. Nizankowski R, Petriczek T, Skotnicki Aet al. The treatment of advanced chronic lower limb ischaemia with marrow stem cell autotransplantation. Kardiol Pol 2005; 63 : 351–360; discussion 361.
8. Semenza GL. Therapeutic angiogenesis. Another Passing Phase? Circ Res 2006; 98 : 1115–1116.
9. Matsuda H. The Current Trends and Future Prospects of Regenerative Medicine in Cardiovascular Diseases. Asian Cardiovasc Thorac Ann 2005; 13 : 101–102.
10. Soda T, Suzuki H, Kusuama T et al. Improvement of severe ulcer of buerger’s disease by bone-marrow mononuclear cell transplantation: a case report. In: New Frontiers in Regenerative Medicine. Springer Japan 2007 : 95–100.
11. Wester T, Jørgensen TT, Stranden E et al. Treatment with autologous bone marrow mononuclear cells in patients with critical lower limb ischaemia. A pilot study. Scand J Surg 2008; 97 : 56–62.
12. Dimmeler S. Platelet-Derived Growth Factor CC – A Clinically Useful Angiogenic Factor at Last? N Engl J Med 2005; 352 : 1815–1816.
13. Lenk K, Adams V, Lurz P et al. Therapeutical potential of blood-derived progenitor cells in patients with peripheral arterial occlusive disease and critical limb ischaemia. Eur Heart J 2005; 26 : 1903–1909.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2009 Issue 3
-
All articles in this issue
- Prevence žilní tromboembolické nemoci v ortopedii a traumatologii
- Antitrombotická profylaxe v těhotenství
- Profylaxe venózního tromboembolizmu v gynekologii
- Operace srdce jako závažný zásah do koagulačního stavu pacienta
- Péče o pacienty s nemocí chladových protilátek, kryoglobulinemií a kryofibrinogenemií před kardiochirurgickými zákroky
- Trombofilní stavy: význam pro prevenci a léčbu žilního tromboembolizmu
- Antifosfolipidový syndrom v roce 2009
- Metabolické a aktivační děje v krevních destičkách a možnosti jejich inhibice
- Úloha kaválních filtrů v prevenci plicní embolie
- Příprava pacientů s antikoagulační léčbou k invazivním zákrokům
- Krvácivé komplikace antikoagulační léčby
- Laboratorní postup při nálezu trombocytopenie
- Pokroky v antitrombotickej liečbe – antitrombotiká s anti‑Xa účinkom
- Molekulární metody v diagnostice trombofilních stavů
- Záchrana ischemickej končatiny terapeutickou angiogenézou
- Užití adultních humánních kmenových buněk kostní dřeně při terapii míšního poranění
- Naše první zkušenosti s transplantací autologních kmenových buněk kostní dřeně v léčbě pakloubů, opožděného hojení zlomenin a defektních zlomenin dlouhých kostí
- Profylaxe tromboembolické nemoci ve vnitřním lékařství
- Prevence žilního tromboembolizmu v chirurgii, laparoskopické chirurgii, urologii
- Profylaxe a léčba tromboembolické nemoci v onkologii
- Transplantace autologních kmenových buněk kostní dřeně u pacientů s chronickou kritickou končetinovou ischemií a diabetickou nohou
- Trombotické komplikace u dětí s onkologickým onemocněním
- Léčba trombózy u dětí pomocí kontinuální intravenózní infuze – možná alternativa k subkutánnímu podání tam, kde je třeba
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Laboratorní postup při nálezu trombocytopenie
- Péče o pacienty s nemocí chladových protilátek, kryoglobulinemií a kryofibrinogenemií před kardiochirurgickými zákroky
- Prevence žilní tromboembolické nemoci v ortopedii a traumatologii
- Antitrombotická profylaxe v těhotenství


