Účinnost terapie pegylovaným interferonem a ribavirinem u pacientů s chronickou HCV infekcí
Efficacy of combination treatment with pegylated interferon plus ribavirin in patients chronically infected with HCV
The aim of the study:
To evaluate the efficacy of combined antiviral treatment with pegylated interferon α plus ribavirin in patients with chronic HCV infection who have not yet been treated with antivirals (treatment-naive patients). To compare the treatment effect in patients with low (< 600,000 IU/ml) and high (≥ 600,000 IU/ml) initial viremia.
Methods and treatment regime:
Treatment-naive patients with chronic HCV infection treated with the combination therapy of pegylated interferon-α2a plus ribavirin. Treatment response was evaluated at weeks 12, 24 and 48 when treatment was ongoing and at weeks 12, 24 and 48 after the treatment was finished. Commercially available sets from various manufacturers were used for serum and molecular genetic diagnostics of HCV infection.
Patient sample:
Antiviral treatment was initiated in 175 patients between 2001 and 2007. The complete data sets suitable for statistical analysis were available for 143 patients. End of treatment response and sustained viral response analyses were conducted separately for HCV genotype 1 (n = 124) and genotype 2 + 3 (n = 7).
Results:
In the genotype 1 group, 76% of patients achieved end of treatment response and 59% of patients achieved sustained viral response. Both types of response were observed in 100% of the genotype 2 and 3 infected patients. When a correlation between initial viremia and sustained viral response was analysed, no statistically significant difference was observed between patients with low (< 600,000 IU/ml) and high (≥ 600 000 IU/ml) initial viremia.
Conclusion:
The results observed in the present study are generally slightly better than comparable results from large registration studies. In contrary to the published literature, the threshold of 600,000 IU/ml for initial viremia did not correlate statistically significantly with SVR.
Key words:
hepatitis C – pegylated interferon – ribavirin
Authors:
P. Urbánek 1; I. Subhanová 2; E. Janoušová 3; L. Dušek 3; Z. Mareček 1; R. Brůha 4; J. Petrtýl 4; M. Brodanová 5
Authors‘ workplace:
Interní klinika 1. lékařské fakulty UK a ÚVN Praha, přednosta pplk. prof. MUDr. Miroslav Zavoral, Ph. D.
1; Ústav klinické biochemie a laboratorní diagnostiky 1. lékařské fakulty UK a VFN Praha, přednosta prof. MUDr. Tomáš Zima, DrSc., MBA
2; Institut biostatistiky a analýz Lékařské fakulty MU Brno, přednosta doc. RNDr. Ladislav Dušek, Ph. D.
3; IV. interní klinika 1. lékařské fakulty UK a VFN Praha, přednosta prof. MUDr. Aleš Žák, DrSc.
4; I. interní klinika hematoonkologie 1. lékařské fakulty UK a VFN Praha, přednosta doc. MUDr. Marek Trněný, CSc.
5
Published in:
Vnitř Lék 2009; 55(5): 474-479
Category:
Original Contributions
Overview
Cíle studie:
Zhodnotit účinnost kombinované protivirové léčby pegylovaným interferonem α a ribavirinem u pacientů s chronickou HCV infekcí, kteří nebyli nikdy léčeni protivirovou terapií (léčebně naivní pacienti). Srovnat účinnost léčby u pacientů s nízkou (< 600 000 IU/ml) a vysokou (≥ 600 000 IU/ml) vstupní viremií.
Použité metody a léčebné schéma:
Pacienti s chronickou HCV infekcí, kteří nikdy nebyli léčeni, byli léčeni kombinační terapií pegylovaný interferon-α2a a ribavirin. V průběhu léčby byla ve 12., 24. a 48. týdnu hodnocena jejich léčebná odpověď. Po skončení léčby byla odpověď hodnocena ve 24. a 48. týdnu léčby. K sérologické a molekulárně genetické diagnostice HCV infekce byly užity komerčně dostupné sety různých výrobců.
Soubor pacientů:
V období let 2001–2007 byla protivirová léčba zahájena u celkem 175 osob. Kompletní data vhodná ke statistickému zpracování byla dostupná u 143 osob. Analýzy odpovědi na konci léčby a setrvalé virologické odpovědi byly provedeny samostatně pro genotyp HCV 1 (n = 124) a genotyp 2 + 3 (n = 7).
Dosažené výsledky:
Odpovědi na konci léčby bylo ve skupině osob s genotypem 1 dosaženo ve 76 % případů, setrvalé virologické odpovědi v 59 % případů. U pacientů s infekcí genotypem 2 a 3 bylo obou typů odpovědi dosaženo ve 100 % případů. Při hodnocení vztahu mezi výchozí viremií a setrvalé virologické odpovědi nebylo dosaženo statisticky významného rozdílu pro pacienty s nízkou (< 600 000 IU/ml) a vysokou (≥ 600 000 IU/ml) vstupní viremií.
Závěr:
Výsledky dosažené v prezentovaném souboru jsou celkově mírně lepší nežli srovnatelné výsledky v rozsáhlých registračních studiích. Na rozdíl od literárních údajů hranice výchozí viremie 600 000 IU/ml statisticky významně nekorelovala s dosažením SVR.
Klíčová slova:
hepatitida C – pegylovaný interferon – ribavirin
Úvod
Chronická infekce virem hepatitidy C (HCV) představuje celosvětový zdravotní problém. Odhaduje se, že v současné době je virem infikováno kolem 170 milionů osob [1]. Prevalence infekce je v České republice 0,2 % [2]. Standardním terapeutickým postupem chronické HCV infekce je od počátku 21. století podání kombinace pegylovaných interferonů a ribavirinu [3]. Od vydání prvních standardních doporučení byl postup několikrát modifikován, nicméně i v aktuálních doporučeních je uvedená kombinace postupem první volby [4].
V následující práci autoři prezentují dosavadní léčebné výsledky ve vlastním souboru pacientů z let 2001 až 2007.
Cíl studie
Zhodnotit účinnost kombinované protivirové léčby pegylovaným interferonem α (PEG-IFN) a ribavirinem u pacientů s chronickou HCV infekcí, kteří nebyli nikdy léčeni protivirovou terapií (léčebně naivní pacienti). Srovnat účinnost léčby u pacientů s nízkou (< 600 000 IU/ml) a vysokou (≥ 600 000 IU/ml) vstupní viremií.
Použité metody a terapeutické schéma
K sérologické detekci protilátek anti-HCV byly v průběhu let 2001–2007používány v Sérologické laboratoři Ústavu klinické biochemie a laboratorní diagnostiky 1. LF UK a VFN komerčně dostupné kity mikroenzymo-imunoanalýzy (MEIA) II. a III. generace (AxSYM ABBOTT). Ke stanovení sérové ribonukleové kyseliny viru HCV (HCV RNA) byly v daném období postupně použity metodiky Cobas Amplicor (Roche), HCV Quantitative ASR (Abbott), m2000rt (Abbott), Cobas Ampliprep/TaqMan (Roche). Ke genotypizaci byla použita technika reverzní hybridizace LiPA (Bayer). Detekční limity jednotlivých provedení polymerázové řetězové reakce (PCR) byly: 50 (plazma)/60 (sérum) IU/ml (Cobas Amplicor kvalitativně), 600 IU/ml (Cobas Amplicor kvantitativně), 50 IU/ml (HCV Quantitative ASR), 12 IU/ml (m2000rt) a 15 IU/ml (Cobas TaqMan).
K prezentaci primárních dat byly využity běžné metody statistické sumarizace, tedy odhad mediánu, aritmetického průměru a odpovídajících intervalů spolehlivosti. Srovnání vztahu 2 nebo více binárních a kategoriálních proměnných byl využit χ2 test dobré shody, případně Fisherův exaktní test. Hodnoty viremie mezi různými kategoriemi léčebného výsledku byly srovnávány pomocí modelu ANOVA jednocestného třídění. Jelikož vstupní viremie vykazovala silně asymetrické rozdělení hodnot log-normálního typu, dosáhli jsme normalizace pomocí standardní logaritmické transformace: Xtr = ln(X + 1). Logaritmická transformace rovněž efektivně vedla k homogenitě rozptylu v jednotlivých srovnávaných variantách (Levenův test).
K terapii byla použita kombinace PEG-IFN α-2a (Pegasys, výrobce Hoffmann‑LaRoche) a ribavirinu (Copegus, výrobce Hoffmann‑LaRoche). Dávkování jednotlivých preparátů vycházelo z platných standardů a z textů souhrnu informací o daném preparátu (SPC):
- PEG-IFN α-2a 180 μg s.c. 1krát týdně a ribavirin 1 000 mg p.o. denně při tělesné hmotnosti do 75 kg, při hmotnosti vyšší potom 1 200 mg p.o. denně. Ribavirin byl podáván vždy ve 2 dávkách (ráno a večer).
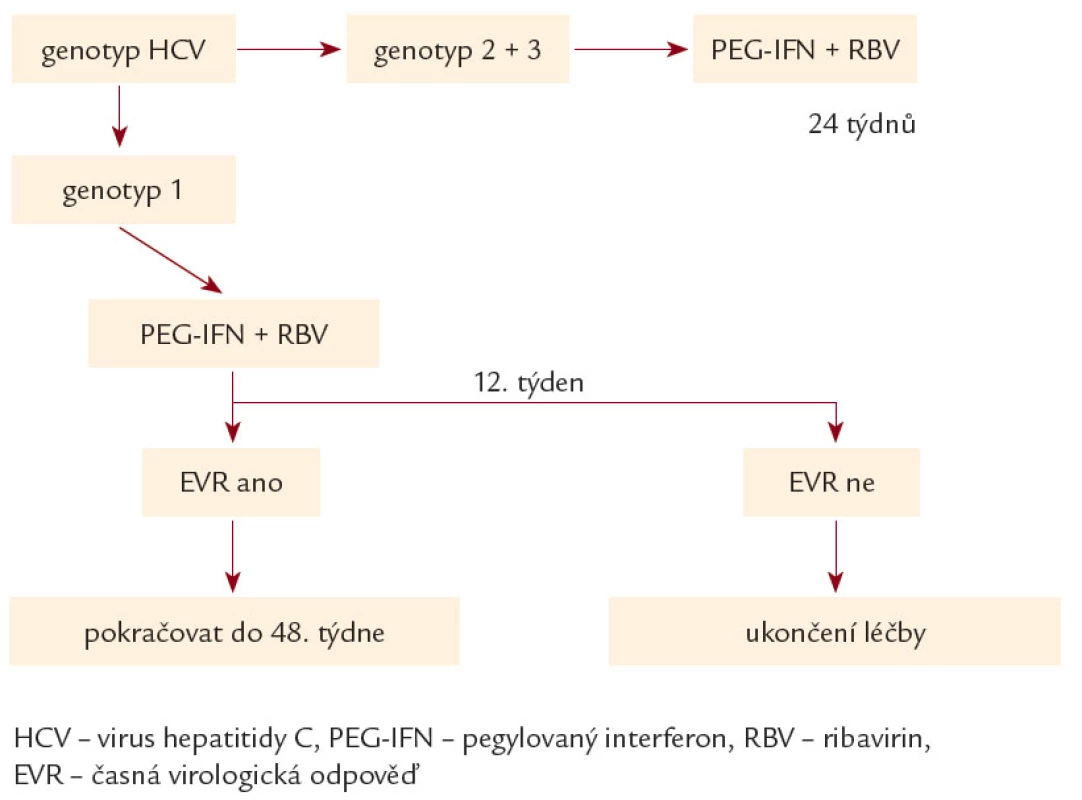
- Délka léčby byla definována genotypem a dosaženou odpovědí v prvních 12 týdnech léčby (obr. 1). K hodnocení odpovědi na protivirovou léčbu byla použita terminologie uvedená v tab. 1. Sérová HCV RNA byla stanovována ve 2., 4., 8., 12., 24., 48. týdnu léčby (k hodnocení v rámci předkládané studie budou použita hodnocení pouze ve 12., 24. a 48. týdnu) a dále po skončení léčby v týdnech 4., 8., 12., 24. a 48. (předvedena budou data ze 24. a 48. týdne). V uvedených týdnech byl pacientům vždy kontrolován krevní obraz a standardní biochemie, v intervalu 12 týdnů byly kontrolovány hladiny tyreoideu stimulujícího hormonu (TSH). Ve stejných týdnech byli pacienti kontrolováni i klinicky.
Redukce dávek obou preparátů se řídily platným SPC pro jednotlivé preparáty.
Vstupní kritéria
- chronická HCV infekce definovaná jako pozitivní sérová HCV RNA metodou PCR nebo PCR v reálném čase (RT‑PCR) po dobu minimálně 6 měsíců nebo pravděpodobný vznik infekce před tímto časovým limitem (anamnéza i.v. aplikace, krevních převodů apod.)
- pacient nebyl dosud nikdy léčen žádnou protivirovou terapií
- absence extrahepatálních manifestací chronické HCV infekce
- pacient není současně léčen jakoukoliv imunosupresivní terapií
- HBsAg negativní
Soubor nemocných
V letech 2001-2007 bylo na pracovištích prvního autora (I. a IV. interní klinika 1. LF UK a VFN a Interní klinika 1. LF UK a ÚVN Praha) léčeno celkem 175 nemocných s chronickou HCV infekcí, kteří splnili základní kritéria uvedená výše. Ke konečnému podrobnému hodnocení byla použita data celkem 143 pacientů. Důvody k vyřazení 32 pacientů byly následující:
- vyšetření HCV RNA nebyla opakovaně provedena v požadovaných týdnech léčby s tolerancí méně než 7 dnů
- vyšetření HCV RNA byla provedena jinými technikami v jiné laboratoři než v Ústavu klinické biochemie a laboratorní diagnostiky (ÚKBLD)
- terapie byla vedena jiným typem pegylovaného interferonu α
Výsledky
Ze skupiny 143 osob bylo 55 % mužů (n = 79) a 45 % žen (n = 64). Průměrný věk ve skupině mužů byl 35 let (rozmezí 21–62), ve skupině žen 34,5 roku (rozmezí 17–70). Rizikové faktory přenosu HCV ukazuje graf 1. Jaterní cirhóza byla histologicky verifikována nebo byla klinicky nepochybná u 6 % osob (9/143). Rozložení genotypů v souboru ukazuje graf 2, zastoupení pacientů s nízkou a vysokou viremií ukazuje graf 3. SVR při hodnocení celého souboru pacientů bylo dosaženo v 62,2 % případů.



Účinek protivirové léčby byl dále hodnocen v závislosti na genotypu HCV, a to pouze u pacientů, u kterých se genotyp podařilo určit.
Genotyp HCV 1
Infekce genotypem HCV 1 (1a + 1b) byla prokázána u 124 osob, 71 mužů (57,3 %) a 53 žen 42,7 %). Složení souboru podle věku v okamžiku zahájení léčby ukazuje graf 4. 49 osob (39,5 %) mělo viremii < 600 000 IU/ml, 75 (60,5 %) osob mělo viremii ≥ 600 000 IU/ml. Průběh léčby a období sledování po léčbě ukazuje graf 5.


V týdnu 12 je hodnoceno 123 osob, protože u jednoho pacienta se nepodařilo viremii stanovit. Z grafu 5 je patrno, že v tomto týdnu splnilo 69,4 % osob kritérium cEVR. 12,9 % pacientů splnilo kritérium pEVR a 12,9 % (n = 16) léčených osob bylo na léčbu rezistentních. U 12 osob z této skupiny byla léčba ukončena, u 4 osob byla léčba vedena i nadále, protože v době léčby těchto osob nebyla striktní doporučení k ukončení léčby ve 12. týdnu. Všichni tito pacienti byli pozitivní i v týdnu 24 a 48 (zde jsou přirazeni do skupiny osob rezistentních, jejichž léčba byla ukončena v týdnu 12). Ze sloupce pro 48. týden je dále patrno, že celkově byla léčba pro nežádoucí účinky ukončena v 5,6 % (n = 7) a u 1,6 % (n = 2) byl pozorován breakthrough fenomén. ETVR bylo dosaženo v 75,8 % případů. Sloupec pro 24. týden po skončení léčby ukazuje negativitu HCV RNA v 58,9 % případů, což odpovídá SVR. Relaps HCV byl v průběhu 24 týdnů po skončení léčby pozorován u 16,9 % pacientů. Při srovnání sloupců pro 24. a 48. týden po skončení léčby je patrno, že v tomto období nebyl pozorován žádný relaps HCV infekce.
Hodnocení vztahu mezi výchozí viremií a efektem protivirové terapie ukazuje graf 6. Zde jsou hodnoceni pouze pacienti, kteří dosáhli ETVR (n = 96). Z grafu je patrno, že jednoznačně statisticky významný vztah mezi výchozí viremií (a to ani pro kategorie při výše definovaných hranicích) nebylo dosaženo. Přesto nelze vztah zcela vyloučit, neboť dosažená hladina statistické významnosti je hraniční (p = 0,061), u pacientů s relapsem, a zejména u s breakthrough fenoménem, byla počáteční hodnota viremie vyšší než ve skupině pacientů s SVR.

Genotyp HCV 2 + 3
Z pacientů infikovaných genotypem 2 či 3 (n = 7) byla EVR i ETVR dosažena u všech (100 %) a stejně tak všichni tito pacienti splnili kritérium setrvalé virologické odpovědi. Úspěšnost léčby v našem souboru těchto genotypů je proto 100 %. Podrobnější analýzu jako pro pacienty s genotypem 1 nebylo možno provést.
Diskuze
Autoři si dobře uvědomují skutečnost, že největší nedostatky jsou v oblasti metodiky provádění studie. Přestože byl od samého počátku zavádění kombinované terapie pegylovanými interferony a ribavirinem uplatňován určitý protokol celého postupu, nešlo přirozeně o protokol se striktními pravidly tak, jak je tomu obvyklé v definovaných klinických studiích II. či III. fáze. Předkládaný soubor vlastně představuje pacienty léčené v běžném, rutinním režimu hepatologické ambulance terciárního hepatologického centra.
Metodická nedokonalost je i v tom, že v průběhu let došlo opakovaně ke změnám používaných molekulárně genetických metod (viz použité metody). Jejich zdokonalováním v průběhu sledovaného období se významným způsobem snižoval detekční limit až na současných 15 IU/ml při použití RT‑PCR. Je proto pravděpodobné, že někteří pacienti z počátků hodnoceného období, jejichž HCV RNA byla v některém okamžiku hodnocena jako negativní, byli ve skutečnosti pacienti pozitivní, i když třeba s minimální viremií.
Další nepřesnosti mohou být dány skutečností, že okamžiky odběru PCR byly definovány týdnem léčby, nikoliv dnem aplikace. Podle současných doporučení by v kritických okamžicích léčby měla být viremie vyšetřována vždy těsně před aplikací PEG-IFN, tj. na konci týdenního období mezi dvěma aplikacemi. V našem případě si většina pacientů aplikovala PEG-IFN v pátek večer a odběry HCV RNA byly realizovány v celém průběhu předepsaného týdne, po změně pracoviště prvního autora dokonce vždy v úterý, takže 4. den po aplikaci (technické důvody spojené s transportem vzorků). Z technických důvodů také nebylo v praxi realizovatelné doporučení ukončit terapii ve 12. týdnu, a to již se znalostí výsledků stanovení PCR v tomto týdnu. Vzorky jsou rutinně zpracovávány 2 dny a kapacitně nebylo možné tento požadavek zajistit. Léčba tak byla ukončena reálně po 13. či 14. aplikaci.
Srovnání dosažené ETVR a SVR ve skupině pacientů s genotypem HCV 1 s obdobnými výsledky publikovanými v práci Frieda et al [5] a Hadzyiannise et al [6] ukazuje graf 7. V registrační studii nebyly prezentovány samostatně výsledky ETVR pro pacienty s genotypem HCV 1, proto je na tomto místě uvedena hodnota ETVR pro všechny genotypy. Srovnání ETVR a SVR pro pacienty bez rozdílu genotypů ukazuje graf 8. Je patrno, že v obou parametrech bylo v našem souboru dosaženo mírně lepších výsledků. Příčin může být celá řada (rasová pestrost americké populace, mírně vyšší věk pacientů v registrační studii apod.). Podrobnější analýzu nelze provést především pro nesrovnatelně nižší počet léčených osob v našem vlastním souboru (143 vs 453).


Pro hodnocení vztahu SVR a výchozí viremie jsme zvolili 2 kategorie: nízká viremie (HCV RNA < 600 000 IU/ml) a vysoká viremie (≥ 600 000 IU/ml). V literatuře je jako prognosticky významná hranice pro dosažení SVR s vyšší pravděpodobností opakovaně hodnocena viremie 800 000 IU/ml. S ohledem na některé podrobnější analýzy virové kinetiky po zahájení léčby, které nejsou v této práci prezentovány, jsme pro naši prvotní analýzu zvolili hranici nižší. Hranice 600 000 IU/ml se v literatuře objevuje např. v souvislosti se zkrácením terapie na 24 týdnů [7].
Naše hypotéza tedy byla, že při přísnějším kritériu by na menším souboru pacientů mohlo být dosaženo významného rozdílu při hodnocení SVR v takto definovaných kategoriích.
Mezi pacienty s genotypem 1 a nízkou viremií (n = 49) bylo dosaženo SVR ve 69,4 % případů (n = 34, graf 6), mezi pacienty s genotypem 1 a vysokou viremií (n = 75) ve 52,0 % případů (n = 39). Při tomto hodnocení tedy nebylo dosaženo statisticky významného výsledku (p = 0,061).
V hodnoceném souboru je překvapením pouze jediný pacient s genotypem 2. Minimální zastoupení pacientů s tímto genotypem potvrzují i další autoři [8]. Ve shodě s těmito daty je i častější zastoupení genotypu 3 než genotypu 2 v populaci ČR. V našem souboru byli všichni pacienti s genotypem 2 + 3 léčeni úspěšně, dosáhli SVR. Literární úspěšnost v této skupině je významně vyšší nežli ve skupině s genotypem 1, ale nedosahuje 100 %. Fried et al dosáhli SVR v této skupině genotypů non‑1 v 76 % případů.
Nežádoucí účinky byly příčinou ukončení protivirové léčby celkem v 6 % případů. Fried udává ukončení léčby z důvodů vedlejších reakcí v 7 % případů. Ukončení léčby před dosažením 48. týdne terapie je pak popsáno ve 22 % případů. Sem jsou řazeny případy nespolupráce, porušení protokolu, vystoupení ze studie z vůle pacienta apod. V našem souboru bychom se dostali ke 23 %, pokud bychom do této skupiny započítali pacienty rezistentní na podávanou terapii. Výskyt vážných nežádoucích účinků vedoucích k ukončení léčby je tedy podobný v našem souboru i v souboru z registrační studie. Výsledky dále svědčí i pro skutečnost, že spolupráce pacientů je v ČR pravděpodobně na vyšší úrovni nežli v americké populaci.
V našem souboru byli dva pacienti, u kterých byl zaznamenán v posledním měsíci léčby breakthrough fenomén. Vyšetření HCV RNA bylo v těchto případech indikováno mimo protokol ve 44. týdnu léčby pro minimální elevaci aktivity sérové ALT, která byla u obou pacientů do této doby zcela v mezích normy. Oba pacienti jsou přes tento fakt zařazeni ve skupině, která ukončila léčbu až ve 48. týdnu, protože výsledek stanovení HCV RNA nebyl znám včas a pacienti přišli na kontrolu až po aplikaci 48. dávky léčby.
Závěr
Autoři předkládají vlastní data účinnosti terapie chronické HCV infekce kombinací PEG-IFN a ribavirin. Základní parametry, dosažení ETVR (76 %) a SVR (59 %) u pacientů s genotypem HCV 1 jsou mírně vyšší, nežli jsou srovnatelná data udávaná v literatuře. Na prezentovaném souboru se nepodařilo ověřit, že pacienti infikovaní genotypem 1 s viremií < 600 000 IU/ml mají větší pravděpodobnost dosažení SVR než pacienti s viremií přesahující tuto hranici. Protivirová terapie byla z důvodu výskytu nežádoucích účinků ukončena pouze v 6 % případů, což je hodnota opět srovnatelná s literaturou.
Doručeno do redakce: 24. 11. 2008
Přijato po recenzi: 27. 12. 2008
doc. MUDr. Petr Urbánek, CSc.
www.uvn.cz
e‑mail: petr.urbanek@uvn.cz
Sources
1. World Health Organization. Hepatitis C. World Health Organization: 13. dostupné z: http://www.who.int/ mediacentre/factsheets/fs164/en.
2. Němeček V. Sérologický přehled ČR v roce 2001 – virová hepatitida A, B, C. Zprávy CEM 003 12 (příloha 1): 55–61.
3. Strader DB, Wright T, Thomas DL et al. Diagnosis, management and treatment of hepatitis C. AASLD Practice Guideline. Hepatology 2004; 39 : 1147–1171.
4. Urbánek P, Husa P, Galský J et al. Standardní diagnostický a terapeutický postup chronické infekce virem hepatitidy C (HCV). Čas Lék Čes 2008; 147: příloha 12 stran.
5. Fried MW, Shiffman ML, Reddy KR et al. Peginterferon alfa‑2a plus ribavirin for chronic hepatitis C virus infection. N Engl J Med 2002; 347 : 975–982.
6. Hadziyannis SJ, Sette H, Morgan TR et al. Peginterferon‑alfa2a and ribavirin combination therapy in chronic hepatitis C. Ann Intern Med 2004; 140 : 346–355.
7. Zeuzem S, Buti M, Ferenci P et al. Efficacy of 24 weeks treatment with peginterferon alfa‑2b plus ribavirin in patients with chronic hepatitis C infected with genotype 1 and low pretreatment viremia. J Hepatol 2006; 4 : 97–103.
8. Husa P, Šlesinger P, Štroblová H et al. Závislost účinnosti léčby chronické hepatitidy C pegylovaným interferonem -2a a ribavirinem na vstupních parametrech a virové kinetice v počátcích léčby. Klin Mikrobiol Inf Lék 2008; 14 : 65–71.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2009 Issue 5
-
All articles in this issue
- Algoritmus léčby glukokortikoidy indukované osteoporózy – hledání východisek – editorial
- Srovnání různých metod pro stanovení množství tuku v těle u žen s nadváhou a obezitou
- Srovnání tělesného složení diabetiků 1. typu, obézních jedinců a zdravých dobrovolníků metodou bioelektrické impedanční analýzy
- Vplyv bazálnej koncentrácie prolaktínu na výskyt komplikácií a na prognózu pacientov s cirhózou pečene
- Účinnost terapie pegylovaným interferonem a ribavirinem u pacientů s chronickou HCV infekcí
- Exogénna alergická alveolitída – zriedkavo diagnostikovaná choroba
- Turnerův syndrom vyžaduje multidisciplinární přístup
- Algoritmus liečby glukokortikoidmi indukovanej osteoporózy
- Ivabradin u nemocných se stabilní ischemickou chorobou srdeční a systolickou dysfunkcí levé srdeční komory: výsledky studie BEAUTIFUL
- Je farmakologická léčba chronické tromboembolické plicní hypertenze nadějná?
- Infarkt myokardu – příčina předčasné smrti u Turnerova syndromu
-
CORD: COmparsi on of Recommended Doses of ACE inhibitors and angi otensin II receptor blockers.
Porovnání doporučených dávek ACE inhibitorů a antagonistů receptoru angi otensinu II.
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Exogénna alergická alveolitída – zriedkavo diagnostikovaná choroba
- Turnerův syndrom vyžaduje multidisciplinární přístup
- Srovnání různých metod pro stanovení množství tuku v těle u žen s nadváhou a obezitou
- Infarkt myokardu – příčina předčasné smrti u Turnerova syndromu

