Androgenní deficit a diabetes
Androgen deficit and diabetes
Low testosterone level is common in obese men and even more frequent in the presence of type 2 diabetes mellitus. Low testosterone level is probably not caused by increased aromatization of testosterone to estradiol in fat tissue. Increase of inflammation mediators, insulin and leptin resistance and low SHBG level may play more important role. Low testosterone level may manifest with low libido, erectile dysfunction, fatigue and depressive mood; it has a role in development of anaemia, osteoporosis, worsening of insulin resistance and it is probably marker of increased all-case and cardiovascular mortality. Routine investigation of testosterone level is indicated in every man with type 2 diabetes mellitus. As in non-diabetic men of middle and higher age substitution is indicated only in presence of clinical symptoms of hypogonadism. The substitution improves mainly libido, erectile dysfunction is influenced less. However, the phosphodiasterase-5 inhibitors efficiency is markedly improved. Metabolic changes during testosterone substitution are small.
Key words:
testosterone – type 2 diabetes mellitus – metabolic syndrome – substitution
Authors:
J. Čáp
Authors‘ workplace:
II. interní klinika Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MUDr. Jaroslav Malý, CSc.
Published in:
Vnitř Lék 2012; 58(3): 228-231
Category:
Reviews
Overview
Nízká hladina testosteronu je častá u obézních mužů a ještě častější při současné přítomnosti diabetu 2. typu. Příčinou pravděpodobně není zvýšená aromatizace testosteronu na estradiol v tukové tkáni, důležitější roli hraje vzestup mediátorů zánětu, rezistence k účinku inzulinu a leptinu a také nízká hladina SHBG. Nízká hladina testosteronu se může projevit snížením libida, erektilní dysfunkcí, únavou a depresivním laděním, podílí se na vzniku anémie, osteoporózy, zhoršení inzulinové rezistence a je zřejmě ukazatelem zvýšené celkové a kardiovaskulární úmrtnosti. Vyšetření hladiny testosteronu je indikováno u všech mužů s diabetem 2. typu. Analogicky jako u mužů středního a vyššího věku bez diabetu je substituce indikována jen tam, kde jsou přítomny klinické příznaky hypogonadizmu. Substituce zlepšuje především libido, méně poruchy erekce. Zvyšuje však účinnost inhibitorů fosfodiesterázy 5. Metabolické účinky jsou při substituci malé.
Klíčová slova:
testosteron – diabetes mellitus 2. typu – metabolický syndrom – substituce
Předneseno na 13. celostátním diabetologickém sympoziu „Diabetes a specifická životní období“ v Hradci Králové ve dnech 3.–4. června 2011
Úvod
Hladina testosteronu se u mužů s věkem fyziologicky snižuje [1]. Nejde o rychlý pokles v určitém časovém období, ale o postupné a plynulé snižování. Na rozdíl od menopauzy u žen je tato „andropauza“ postupná. Navíc je toto snižování velmi individuální. Při longitudinálním sledování velké skupiny mužů se ukázalo, že u některých nedošlo k poklesu vůbec, zatímco u jiných se testosteron snižoval významně [2]. Kromě věku se na snížení testosteronu podílely významně další faktory. Např. zvýšení indexu tělesné hmoty (BMI) o 4–5 kg/m2 nebo ztráta partnera vedly ke snížení celkového testosteronu, odpovídajícímu asi 10 letům věku.
Více než celkový testosteron klesá s věkem testosteron volný, protože současně dochází ke vzestupu vazebné bílkoviny globulinu vázajícího sexuální hormony (SHBG) [3]. U starších mužů je proto výskyt nízké hladiny testosteronu (při hodnocení pomocí norem u mladých mužů) vysoký, okolo 40 % ve věku nad 60 let a 80 % nad 80 let [3], v jiném velkém souboru 40 % ve věku nad 65 let a 50 % ve věku nad 85 let [4]. Hladinu testosteronu negativně ovlivňovala obezita, přítomnost diabetu a hypertenze. Vysoký výskyt hypogonadizmu u mužských diabetiků 2. typu popsal Kapoor et al. Celkový testosteron byl nižší u 1/2 a volný testosteron u 40–60 % v závislosti na věku [5]. Ve studii Hypogonadism in Males byl stanoven volný testosteron přesnou metodou ekvilibrační dialýzy u 1 451 nediabetických a 398 diabetických mužů starších 45 let. Volný testosteron byl statisticky významně nižší u mužů diabetických, a to i po korekci na věk a BMI. U obou skupin negativně koreloval s BMI, věkem a hladinou SHBG [6]. Celkem 44 % diabetiků a 33 % obézních mužů bez diabetu mělo nízký volný testosteron. U obézních bylo procento hypogonádních 40 % u osob bez diabetu a 50 % u nemocných s diabetem. K nízkému testosteronu tedy vede sama obezita a diabetes 2. typu tuto situaci zhoršuje. Nízký testosteron se však vyskytuje i u mladých diabetiků 2. typu. U nemocných ve věku 18–35 let byl zjištěn v 33 % [7]. U nemocných s diabetem 1. typu je hypogonadizmus poměrně vzácný, takže jeho příčinou nemůže být diabetes nebo hyperglykemie jako taková [8].
Příčiny hypogonadizmu
Hypogonadizmus u diabetu 2. typu, metabolického syndromu a obezity je hypogonadotropní. Nemocní mají (vzhledem k nízké hladině testosteronu) nepřiměřeně nízké hladiny LH. Odpověď LH a FSH na podání GnRH je normální [9]. Jednou z hypotéz, vysvětlující nízkou hladinu testosteronu u obezity, je zpětnovazebná suprese LH vyšší hladinou estradiolu v důsledku zvýšené aktivity aromatázy v tukové tkáni, konvertující testosteron na estradiol. Ukázalo se však, že hladina estradiolu je u hypogonádních mužů o 25 % nižší a volný estradiol koreluje s hladinou volného testosteronu. Hladiny estradiolu jsou tak důsledkem snížené hladiny substrátu pro aromatizaci, a ne příčinou nízkého testosteronu [10]. Důležitější je pravděpodobně úloha mediátorů zánětu. Cytokiny TNF-α a interleukin-1β mohou in vivo i in vitro suprimovat sekreci GnRH a LH [11]. Pacienti s diabetem 2. typu a nízkou hladinou testosteronu měli téměř dvojnásobné hladiny CRP než nemocní s normální hladinou testosteronu [12]. Je tak možné, že přítomnost zánětu se podílí nejen na vzniku inzulinové rezistence, ale také hypogonadizmu. Sama inzulinová rezistence může přispívat ke snížení hladiny testosteronu. Selektivní odstranění inzulinového receptoru na neuronech vede u myší k výraznému poklesu hladin LH a testosteronu. Naproti tomu inkubace neuronů s inzulinem zvyšuje sekreci GnRH [13]. Dalším faktorem je rezistence k leptinu, předpokládaná u obézních. Leptin stimuluje sekreci GnRH a LH. Na GnRH neuronech ovšem chybí příslušný receptor a je pravděpodobné, že účinek inzulinové a leptinové rezistence je zprostředkován působením na neuron kisspetinový (obr. 1) [14].
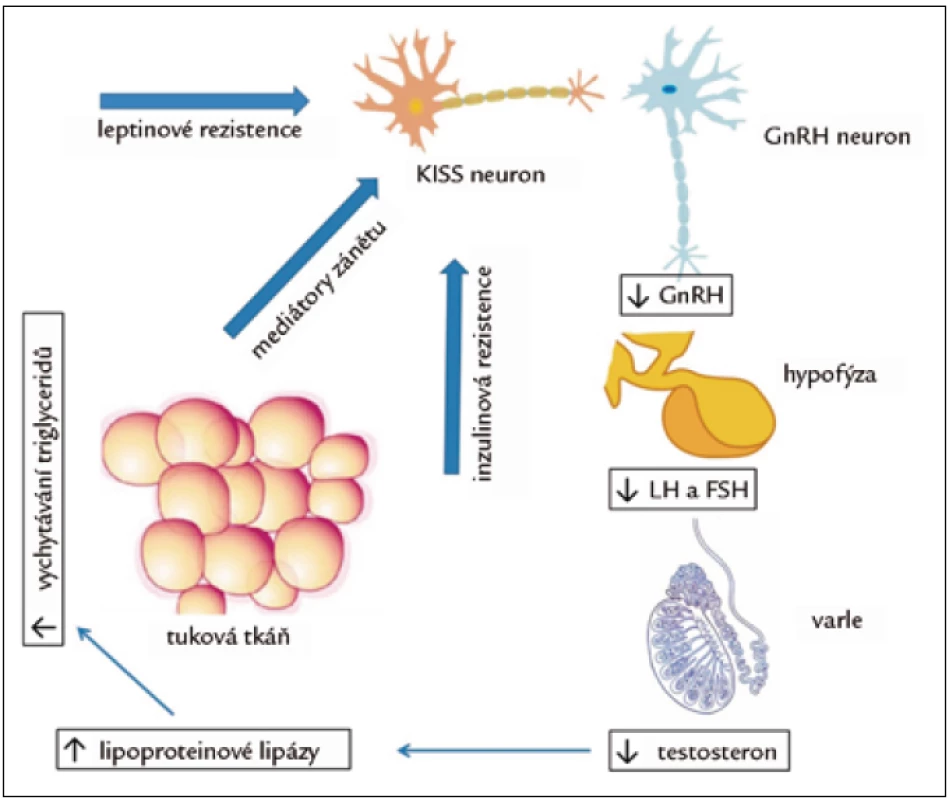
Hladina testosteronu závisí významně na hladině jeho vazebného proteinu SHBG. Tato hladina je u nemocných s diabetem a metabolickým syndromem nižší. Ve všech sestavách předpovídala nízká hladina SHBG vznik diabetu lépe než celkový testosteron [15] a v jedné sestavě při korekci na hladinu SHBG přestal mít celkový testosteron význam [16]. Tyto poznatky potvrzují genetické práce dokazující, že polymorfizmy genu pro SHBG vedoucí k jeho vyšší hladině jsou protektivní, a naopak ty, které hladinu snižují, zvyšují riziko vzniku diabetu 2. typu [17,18]. Příčina tohoto vztahu však zůstává nejasná.
Klinické příznaky hypogonadizmu u diabetiků
Příznaky hypogonadizmu u mužů středního a vyššího věku jsou nenápadné. Ke specifičtějším patří snížené libido a sexuální aktivita, erektilní dysfunkce a návaly horka. Nespecifická je únava, depresivní ladění, ztráta koncentrace, snížení tělesné výkonnosti a poruchy spánku [19]. Erektilní dysfunkce je u diabetiků častá. V průřezové studii bylo přítomné snížení libida u 64 %, erektilní dysfunkce u 74 % a únava u 63 % diabetiků 2. typu s nízkou hladinou testosteronu [5]. Příčiny erektilní dysfunkce jsou ovšem komplexní a podílí se na nich také autonomní neuropatie, angiopatie a endoteliální dysfunkce.
Další důsledky nízké hladiny testosteronu
Inzulinová rezistence je nedostatkem mužských hormonů zhoršována. Je to jednak proto, že hypogonadizmus vede ke vzestupu tukové hmoty a úbytku hmoty svalové. To je dáno působením na pluripotentní mezenchymovou kmenovou buňku, u které testosteron stimuluje vývoj směrem ke svalové linii a inhibuje diferenciaci na linii tukovou [20]. Testosteron ale také reguluje zralé tukové a svalové buňky. Zvyšuje katecholaminy stimulovanou lipolýzu, snižuje aktivitu lipoproteinové lipázy a snižuje vychytávání triglyceridů v tukové tkáni (obr. 1).
Následky snížení hladiny testosteronu byly prokázány v řadě sestav mužů léčených pro karcinom prostaty androgen deprivační léčbou. Za 12 měsíců po snížení testosteronu se zvýšila tuková hmota o 14 % a svalová hmota poklesla o 3,6 %. Index inzulinové rezistence HOMA-IR stoupnul o 12 % [21]. Androgen deprivační terapie byla také v některých sestavách spojena se zvýšeným výskytem diabetu [22]. Ke zhoršení citlivosti k inzulinu došlo ale již před vývojem změn tělesného složení u mužů s kongenitálním hypogonadotropním hypogonadizmem po krátkodobém vysazení terapie [23].
Pacienti s diabetem 2. typu a nízkou hladinou testosteronu měli nižší hladinu hemoglobinu. U hypogonádních diabetiků byla přítomna normocytární, normochromní anémie ve 23 %, zatímco u diabetiků s normální hladinou testosteronu jen ve 3 % [24]. Ve velkém souboru nemocných s diabetem byl zjištěn nezávislý vztah mezi hladinou testosteronu a sníženou hladinou hemoglobinu [25].
Hypogonadizmus je u mužů spojen s poklesem kostní hmoty. V jedné sestavě mužů s diabetem 2. typu korelovala pozitivně hladina volného testosteronu s kostní hmotou na předloktí, ale ne na femuru a páteři [26]. V jiné sestavě běloruských diabetických mužů korelace mezi kostní hmotou na páteři a hladinou volného testosteronu prokázána byla [27].
Nízký testosteron byl v celé řadě retrospektivních, průřezových sestavách spojen se zvýšením celkové a kardiovaskulární úmrtnosti. V prospektivně sledovaných souborech se výsledky lišily, zřejmě v důsledku heterogenity zařazených nemocných co do věku a přidružených onemocnění, ale nedávno publikovaná metaanalýza potvrdila vyšší celkovou a kardiovaskulární úmrtnost u mužů s nižší hladinou testosteronu [28].
Efekt substituce testosteronu u diabetických mužů
Substituce testosteronem vede u diabetických i nediabetických mužů s nízkou hladinou testosteronu k příznivým změnám tělesného složení, tj. poklesu tukové hmoty a vzestupu svalové hmoty. U nediabetických mužů přesto ve většině intervenčních studií nebyl prokázán vliv na hladinu inzulinu a glukózy, a tedy na citlivost k inzulinu [29]. U diabetiků 2. typu a nemocných s metabolickým syndromem prokázaly 3 recentní randomizované studie malý, ale statisticky významný pokles inzulinové rezistence [30–32]. V některých sestavách byl zjištěn i pokles hladin glykovaného hemoglobinu [30,33]. Substituce testosteronu u nemocných s metabolickým syndromem a diabetem 2. typu vede také k poklesu hladin triglyceridů, celkového a LDL-cholesterolu a ke zmenšení objemu pasu [34]. HDL-cholesterol může také poklesnout.
Celkově lze shrnout, že změny v metabolizmu glukózy jsou při substituci testosteronem nekonzistentní a kvantitativně menší, než jakých je možné docílit změnou životního stylu [35], metforminem [36] nebo glitazony [37]. Nadto redukce hmotnosti, ať už byla dosažena změnou životního stylu, nebo chirurgickým zákrokem, vede u obézních mužů ke vzestupu hladiny testosteronu, a to tím více, čím větší byl váhový úbytek [15]. V jedné práci byli nemocní s nově diagnostikovaným diabetem 2. typu a nízkou hladinou testosteronu léčeni dietou a režimovými opatřeními s tím, že 1/2 dostala také substituci testosteronem [38]. Hladiny glykovaného hemoglobinu byly v substituované skupině statisticky významně nižší.
Sexuální funkce se při substituci zlepšuje. Kapoor et al zjistili zlepšení pomocí dotazníku ADAM [33]. Ve studii TIMES2 [31] došlo ke zlepšení skóre erektilních funkcí, především díky zlepšení libida. Ostatní příznaky se neměnily. Testosteron stimuluje jak syntézu, tak odbourávání cyklického guanosinfosfátu. Jeho substituce proto více ovlivňuje libido než kvalitu erekce. Při substituci testosteronem jsou ovšem účinnější inhibitory fosfodiesterázy 5 [39].
Metaanalýza dvojitě slepých intervenčních studií, zkoumající vliv substituce testosteronu u starších mužů, nezjistila žádný vliv na celkovou a kardiovaskulární úmrtnost, výskyt infarktu myokardu nebo revaskularizačních procedur [40]. Ve studii TIMES2 se vyskytovaly kardiovaskulární příhody méně často ve skupině užívající testosteron (4,6 %) než ve skupině placebové (10,7 %), rozdíl však nedosahoval statistické významnosti [31].
Doporučení pro praxi
Nízká hladina testosteronu je u diabetiků 2. typu častá a podle současných guidelines by měla být rutinně v této skupině pacientů vyšetřena [19]. Stanovení hladiny testosteronu v séru má řadu úskalí. Přímé metody stanovení volného testosteronu jsou nespolehlivé [41]. Optimální metodou je zřejmě stanovení celkového testosteronu a zároveň jeho vazebného proteinu SHBG. Z těchto hodnot je možné hodnotu volného a biologicky dostupného testosteronu vypočítat [1,42]. Hraniční hodnoty jsou kontroverzní; jistě i proto, že se liší v závislosti na použité metodě stanovení. Měly by být určeny pro danou metodu a laboratoř [43].
Samotná snížená hladina testosteronu však není u asymptomatických nemocných indikací k substituci. Metabolické příznivé účinky jsou malé a není jasné, zda tento prospěch převáží možná rizika substituce [15]. Indikace k substituci je tak stejná jako u mužů bez diabetu a je vyhrazena pro muže s přítomnými příznaky hypogonadizmu [19]. Největší zlepšení je možné očekávat v oblasti libida, vliv na erektilní dysfunkci je menší, ale substituce výrazně zlepšuje efekt inhibitorů fosfodiesterázy 5 [44].
Podpořeno projektem „Výzkumné záměry“ MSM 0021620820.
prof. MUDr. Jan Čáp, CSc.
www.fnhk.cz
e-mail: capj@lfhk.cuni.cz
Doručeno do redakce: 5. 12. 2011
Sources
1. Starka L, Pospisilova H, Hill M. Free testosterone and free dihydrotestosterone throughout the life span of men. J Steroid Biochem Mol Biol 2009; 116 : 118–120.
2. Travison TG, Araujo AB, Kupelian V et al. The Relative Contributions of Aging, Health, and Lifestyle Factors to Serum Testosterone Decline in Men. J Clin Endocrinol Metab 2007; 92 : 549–555.
3. Harman SM, Metter EJ, Tobin JD et al. Baltimore Longitudinal Study of Aging. Longitudinal Effects of Aging on Serum Total and Free Testosterone Levels in Healthy Men. Baltimore Longitudinal Study of Aging. J Clin Endocrinol Metab 2001; 86 : 724–731.
4. Mulligan T, Frick MF, Zuraw QC et al. Prevalence of hypogonadism in males aged at least 45 years: the HIM study. Int J Clin Pract 2006; 60 : 762–769.
5. Kapoor D, Aldred H, Clark S et al. Clinical and Biochemical Assessment of Hypogonadism in Men With Type 2 Diabetes: correlations with bioavailable testosterone and visceral adiposity. Diabetes Care 2007; 30 : 911–917.
6. Dhindsa S, Miller MG, McWhirter CL et al. Testosterone Concentrations in Diabetic and Nondiabetic Obese Men. Diabetes Care 2010; 33 : 1186–1192.
7. Chandel A, Dhindsa S, Topiwala S et al. Testosterone Concentration in Young Patients With Diabetes. Diabetes Care 2008; 31 : 2013–2017.
8. Tomar R, Dhindsa S, Chaudhuri A et al. Contrasting Testosterone Concentrations in Type 1 and Type 2 Diabetes. Diabetes Care 2006; 29 : 1120–1122.
9. Tripathy D, Dhindsa S, Garg R et al. Hypogonadotropic hypogonadism in erectile dysfunction associated with type 2 diabetes mellitus: a common defect? Metab Syndr Relat Disord 2003; 1 : 75–80.
10. Dhindsa S, Furlanetto R, Vora M et al. Low Estradiol Concentrations in Men With Subnormal Testosterone Concentrations and Type 2 Diabetes. Diabetes Care 2011; 34 : 1854–1859.
11. Watanobe H, Hayakawa Y. Hypothalamic Interleukin-1β and Tumor Necrosis Factor-α, But Not Interleukin-6, Mediate the Endotoxin-Induced Suppression of the Reproductive Axis in Rats. Endocrinology 2003; 144 : 4868–4875.
12. Grossmann M, Thomas MC, Panagiotopoulos S et al. Low Testosterone Levels Are Common and Associated with Insulin Resistance in Men with Diabetes. J Clin Endocrinol Metab 2008; 93 : 1834–1840.
13. Dandona P, Dhindsa S. Update: Hypogonadotropic Hypogonadism in Type 2 Diabetes and Obesity. J Clin Endocrinol Metab 2011; 96 : 2643–2651.
14. George JT, Millar RP, Anderson RA. Hypothesis: kisspeptin mediates male hypogonadism in obesity and type 2 diabetes. Neuroendocrinology 2010; 91 : 302–307.
15. Grossmann M. Low Testosterone in Men with Type 2 Diabetes: Significance and Treatment. J Clin Endocrinol Metab 2011; 96 : 2341–2353.
16. Lakshman KM, Bhasin S, Araujo AB. Sex hormone-binding globulin as an independent predictor of incident type 2 diabetes mellitus in men. J Gerontol A Biol Sci Med Sci 2010; 65 : 503–509.
17. Ding EL, Song Y, Manson JE et al. Sex Hormone–Binding Globulin and Risk of Type 2 Diabetes in Women and Men. N Engl J Med 2009; 361 : 1152–1163.
18. Perry JRB, Weedon MN, Langenberg C et al. Genetic evidence that raised sex hormone binding globulin (SHBG) levels reduce the risk of type 2 diabetes. Hum Mol Genet 2010; 19 : 535–544.
19. Bhasin S, Cunningham GR, Hayes FJ et al. Task Force, Endocrine Society. Testosterone Therapy in Men with Androgen Deficiency Syndromes: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab 2010; 95 : 2536–2559.
20. Singh R, Artaza JN, Taylor WE et al. Androgens Stimulate Myogenic Differentiation and Inhibit Adipogenesis in C3H 10T1/2 Pluripotent Cells through an Androgen Receptor-Mediated Pathway. Endocrinology 2003; 144 : 5081–5088.
21. Hamilton EJ, Gianatti E, Strauss BJ et al. Increase in visceral and subcutaneous abdominal fat in men with prostate cancer treated with androgen deprivation therapy. Clin Endocrinol (Oxf) 2011; 74 : 377–383.
22. Grossmann M, Zajac JD. Androgen deprivation therapy in men with prostate cancer: how should the side effects be monitored and treated? Clin Endocrinol (Oxf) 2011; 74 : 289–293.
23. Yialamas MA, Dwyer AA, Hanley E et al. Acute sex steroid withdrawal reduces insulin sensitivity in healthy men with idiopathic hypogonadotropic hypogonadism. J Clin Endocrinol Metab 2007; 92 : 4254–4259.
24. Bhatia V, Chaudhuri A, Tomar R et al. Low Testosterone and High C-Reactive Protein Concentrations Predict Low Hematocrit in Type 2 Diabetes. Diabetes Care 2006; 29 : 2289–2294.
25. Grossmann M, Panagiotopolous S, Sharpe K et al. Low testosterone and anaemia in men with type 2 diabetes. Clin Endocrinol (Oxf) 2009; 70 : 547–553.
26. Dhindsa S, Bhatia V, Dhindsa G et al. The Effects of Hypogonadism on Body Composition and Bone Mineral Density in Type 2 Diabetic Patients. Diabetes Care 2007; 30 : 1860–1861.
27. Vasilkova O, Mokhort T, Sanec I et al. Testosterone is an independent determinant of bone mineral density in men with type 2 diabetes mellitus. Clin Chem Lab Med 2011; 49 : 99–103.
28. Araujo AB, Dixon JM, Suarez EA et al. Clinical review: Endogenous Testosterone and Mortality in Men: A Systematic Review and Meta-Analysis. J Clin Endocrinol Metab 2011; 96 : 3007–3019.
29. Grossmann M, Gianatti EJ, Zajac JD. Testosterone and type 2 diabetes. Curr Opin Endocrinol Diabetes Obes 2010; 17 : 247–256.
30. Aversa A, Bruzziches R, Francomano D et al. Effects of Testosterone Undecanoate on Cardiovascular Risk Factors and Atherosclerosis in Middle-Aged Men with Late-Onset Hypogonadism and Metabolic Syndrome: Results from a 24-month, Randomized, Double-Blind, Placebo-Controlled Study. J Sex Med 2010; 7 : 3495–3503.
31. Jones TH, Arver S, Behre HM et al. Testosterone Replacement in Hypogonadal Men With Type 2 Diabetes and/or Metabolic Syndrome (the TIMES2 Study). Diabetes Care 2011; 34 : 828–837.
32. Kalinchenko SY, Tishova YA, Mskhalaya GJ et al. Effects of testosterone supplementation on markers of the metabolic syndrome and inflammation in hypogonadal men with the metabolic syndrome: the double-blinded placebo-controlled Moscow study. Clin Endocrinol (Oxf) 2010; 73 : 602–612.
33. Kapoor D, Goodwin E, Channer KS et al. Testosterone replacement therapy improves insulin resistance, glycaemic control, visceral adiposity and hypercholesterolaemia in hypogonadal men with type 2 diabetes. Eur J Endocrinol 2006; 154 : 899–906.
34. Corona G, Monami M, Rastrelli G et al. Testosterone and Metabolic Syndrome: A Meta-Analysis Study. J Sex Med 2011; 8 : 272–283.
35. Belalcazar LM, Reboussin DM, Haffner SM et al. Look AHEAD Research Group. A 1-Year Lifestyle Intervention for Weight Loss in Individuals With Type 2 Diabetes Reduces High C-Reactive Protein Levels and Identifies Metabolic Predictors of Change: from the Look AHEAD (Action for Health in Diabetes) study. Diabetes Care 2010; 33 : 2297–2303.
36. Saenz A, Fernandez-Esteban I, Mataix A et al. Metformin monotherapy for type 2 diabetes mellitus. Cochrane Database Syst Rev 2005: CD002966.
37. Mayerson AB, Hundal RS, Dufour S et al. The Effects of Rosiglitazone on Insulin Sensitivity, Lipolysis, and Hepatic and Skeletal Muscle Triglyceride Content in Patients With Type 2 Diabetes. Diabetes 2002; 51 : 797–802.
38. Heufelder AE, Saad F, Bunck MC et al. Fifty-two-Week Treatment With Diet and Exercise Plus Transdermal Testosterone Reverses the Metabolic Syndrome and Improves Glycemic Control in Men With Newly Diagnosed Type 2 Diabetes and Subnormal Plasma Testosterone. J Androl 2009; 30 : 726–733.
39. Wang C, Jackson G, Jones TH et al. Low Testosterone Associated With Obesity and the Metabolic Syndrome Contributes to Sexual Dysfunction and Cardiovascular Disease Risk in Men With Type 2 Diabetes. Diabetes Care 2011; 34 : 1669–1675.
40. Fernández-Balsells MM, Murad MH, Lane M et al. Clinical review 1: Adverse Effects of Testosterone Therapy in Adult Men: A Systematic Review and Meta-Analysis. J Clin Endocrinol Metab 2010; 95 : 2560–2575.
41. Vermeulen A, Verdonck L, Kaufman JM. A Critical Evaluation of Simple Methods for the Estimation of Free Testosterone in Serum. J Clin Endocrinol Metab 1999; 84 : 3666–3672.
42. Sartorius G, Ly LP, Sikaris K et al. Predictive accuracy and sources of variability in calculated free testosterone estimates. Ann Clin Biochem 2009; 46 : 137–143.
43. Vesper HW, Bhasin S, Wang C et al. Interlaboratory comparison study of serum total testosterone [corrected] measurements performed by mass spectrometry methods. Steroids 2009; 74 : 498–503.
44. Garcia JA, Sanchez PE, Fraile C et al. Testosterone undecanoate improves erectile dysfunction in hypogonadal men with the metabolic syndrome refractory to treatment with phosphodiesterase type 5 inhibitors alone. Andrologia 2011; 43 : 293–296.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2012 Issue 3
-
All articles in this issue
- Zmeny krvného tlaku u chronicky hemodialyzovaných pacientov
- Přínos centralizace péče o pacienty s akutním krvácením do horního trávicího traktu
- Vitamin D – připomínka známých a přehled méně známých skutečností
- Oxidační stres u pacientů s onemocněním ledvin
- Gen pro FTO a jeho role v genetické determinaci obezity
- Castlemanova choroba
- Sekundárne dyslipidémie
- Androgenní deficit a diabetes
- Doporučení pro léčbu alemtuzumabem u chronické lymfocytární leukemie (CLL)
- Doporučený postup péče o nemocné s prediabetem
- Přínos PET-CT vyšetření pro rozhodování o léčbě lokalizované nodulární formy plicní AL-amyloidózy
- Vývoj séroprevalencie hepatitídy C v rizikovej skupine drogovo závislých jedincov v rokoch 2004–2008 na Slovensku
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Castlemanova choroba
- Přínos PET-CT vyšetření pro rozhodování o léčbě lokalizované nodulární formy plicní AL-amyloidózy
- Gen pro FTO a jeho role v genetické determinaci obezity
- Zmeny krvného tlaku u chronicky hemodialyzovaných pacientov
