Epigenetická cytostatika a jejich role v protinádorové léčbě
Epigenetic cancer drugs and their role in anticancer therapy
Epigenetic modification have been causally linked to cancer development and progression, and are potentially reversible by treatments with epigenetic cancer drugs. The aim of this review is to give an overview of the basic current knowledge on molecular mechanisms of epigenetic cancer drugs and their possible clinical use. Many of them are in inclinical trials. However only two demethylating agents ie. inhibitors of DNA methyltransferase (5 - azacytidin and decitabin) are approved in the treatment of myelodysplastic syndrome and a few inhibitors of histonacetylase (vorinostat, romidepsin and panobinostat) are approved in the treatment of hematological malignancies, particularly in refractory or relapsed cutaneous T ‑ cell lymhoma.
Key words:
epigenetic cancer drugs – inhibitors of DNA methyltransferase – inhibitors of histondeacetylase
Authors:
P. Klener
Authors‘ workplace:
I. interní klinika 1. lékařské fakulty UK a VFN v Praze, přednosta prof. MU Dr. Marek Trněný, CSc., a Ústav hematologie a krevní transfuze Praha, ředitel prof. MU Dr. Marek Trněný, CSc.
Published in:
Vnitř Lék 2013; 59(6): 463-465
Category:
80th birthday prof. MUDr. Karla Horkého, DrSc., FACP (Hon.)
Overview
Epigenetické změny jsou úzce spjaty s rozvojem a progresí nádorového onemocnění a lze je korigovat aplikací epigenetických cytostatik. Cílem tohoto sdělení je podat přehled o molekulárních mechanizmech epigenetických cytostatik a o jejich možném klinickém použití. Většina těchto chemoterapeutik je předmětem klinických studií. Jen 2 demetylující látky, t.j. inhibitory DNA metyltransferáz (5 - azacytidin a decitabin) jsou schváleny k léčbě myelodysplastického syndromu a několik cytostatik ze skupiny inhibitorů histondeacetyláz (vorinostat, romidepsin a panobinostat) lze použít v léčbě hematologických malignit, zejména k léčbě refrakterních a relabujích kožních T lymfomů.
Klíčová slova:
epigenetická cytostatika – inhibitory DNA metyltransferáz – inhibitory histondeacetyláz
Úvod
Trvale narůstající incidence nádorových onemocnění poněkud kontrastuje s relativně stabilní či dokonce klesající mortalitou některých malignit. To nepochybně znamená, že se výrazně zdokonalily naše léčebné možnosti a že některá nádorová onemocnění lze dnes úspěšně léčit či vyléčit. Jednou z novějších léčebných metod je i použití epigenetických cytostatik [1].
Nádorová onemocnění jsou charakterizována nejen alterací genetické, ale i epigenetické struktury genomu [2].Zatímco konvenční chemoterapie je cílena především na genetické změny, epigenetická cytostatika nevyvolávají cytostatický účinek inkorporací do DNA či indukcí zlomů v DNA molekule, ale působí změnu struktury chromatinu [3]. Rozdíl v účinku konvenčních a epigenetických cytostatik je na obr. 1.
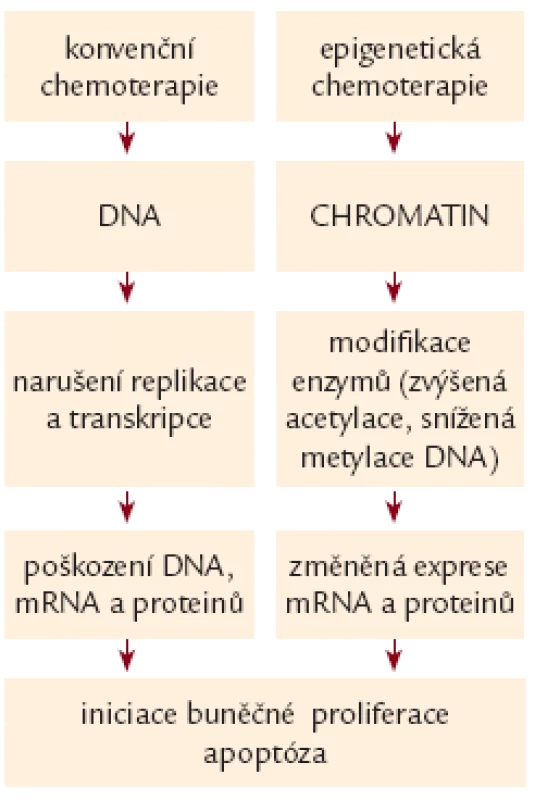
Mechanizmus účinku epigenetických cytostatik
Epigenetické úpravy zahrnují metylaci DNA, modifikaci histonů a remodelaci chromatinu [4,5]. Mezi látky s epigenetickým mechanizmem účinku patří inhibitory hlavních fyziologických epigenetických regulátorů, t.j. inhibitory DNA metyltransferáz (DNMTi) a inhibitory histondeacetyláz (HDACi).
Metylace DNA znamená navázání metylové skupiny na C5 cytosinů nacházejících se v sousedství guaninů. Tyto úseky dinukleotidů se nazývají CpG ostrůvky, kde „p“ znamená fosfodiesterový můstek mezi cytosinem a guaninem. CpG ostrůvky se hojně nacházejí v oblastech promotorů genů, tedy v regulačních úsecích DNA. Zvýšená metylace promotorů DNA blokuje vazbu transkripčního faktoru k promotoru [6].Metylace/ demetylace DNA hraje tudíž významnou úlohu v kontrole aktivity genové exprese. U řady nádorů byla popsána specifická hypermetylace promotorů tumor supresorových genů (zejména retinoblastomového genu RB1, genu von Hippel Lindau VHL a DNA reparačních genů – MLH1 a BRCA1). Hypermetylace těchto genů vede k umlčení jejich transkripce (silencing), což znemožní opravy genetických chyb, působí deregulaci průchodu buňky buněčným cyklem a otvírá cestu k neoplastické transformaci [7].
Dalším epigenetickým mechanizmem je modifikace histonů a remodelace chromatinu [8]. Základní stavební jednotkou chromatinu je nukleosom. Nukleosomy jsou tvořeny molekulami bazických histonů, tvořících jádro, kolem kterého se jako kolem cívky obtáčí dvojvlákno DNA (obr. 2). Zdárný průběh genové exprese vyžaduje změnu prostorového uspořádání chromatinu (z heterochromatinu na euchromatin), která umožní fyzický průchod transkripčního komplexu rozevřenou vidlicí DNA [9]. Deacetylace histonů způsobí prostorové uzamčení přilehlých genů do heterochromatinové struktury. V normální buňce jsou oba pochody v rovnováze, v nádorové buňce převažuje deacetylace. Ta může být jednak výsledkem zvýšené aktivity histondeacetyláz, jednak snížením aktivity histon-acetyltransferáz (HAT). Následkem vystupňované deacetylace dochází ke snížené expresi celé řady tumor supresorových a proapoptotických genů, např. p53, p21CIP1, BAX, DR5/ TRAILR2, FAS/ CD95. Kromě histonů jsou substrátem HDAC i nehistonové proteiny a další regulační proteiny, které mají důležitou roli v onkogenezi, např. p53, α ‑ tubulin, HIF1 - α, hsp90 aj. Deacetylace tumor supresorového transkripčního faktoru p53 na specifických lyzinových zbytcích vede k jeho nestabilitě, zrychlené degradaci a ke snížení jeho transaktivační a proapoptotické aktivity. Hyperacetylace vyvolaná HDACi způsobí stabilizaci a funkční obnovení proapoptotické funkce p53. Deacetylace α ‑ tubulinu naruší funkci mikrotubulů, základních elementů cytoskeletu. Destabilizace tubulinu u nádorových onemocnění je provázena zvýšenou buněčnou motilitou a s tím spojenou invazivitou a sklonem k metastazování. HDACi tyto porušené funkce obnoví. Deacetylace HIF1α působí jeho stabilizaci, a má tudíž význam pro stimulaci angiogeneze, prostřednictvím zvýšeného výdeje VEGF. Inhibice deacetylace vede k destabilizaci HIF1a, a tím k omezení angiogeneze. Antiangiogenní účinky HDACi se testují u karcinomu ledviny nebo maligního melanomu. Deacetylace hsp90 je důležitá pro aktivitu tohoto proteinu. Inhibice deacetylace vede k destabilizaci asociací mezi hsp90 a mnoha onkoproteiny, což přispívá k omezení proliferace a k indukci apoptózy. Příznivý účinek HDACi by se tak mohl uplatnit zejména u CML, u karcinomu prsu, prostaty, popř. u mnohočetného myelomu, kde se předpokládá synergní účinek s inhibitory proteasomu. Inhibice deacetylace působí dále též indukci proapoptotických proteinů Bim, Bax a potlačuje produkci antiapoptotických proteinů rodiny Bcl ‑ 2. Je evidentní, že účinek HDACi je značně komplexní [10].
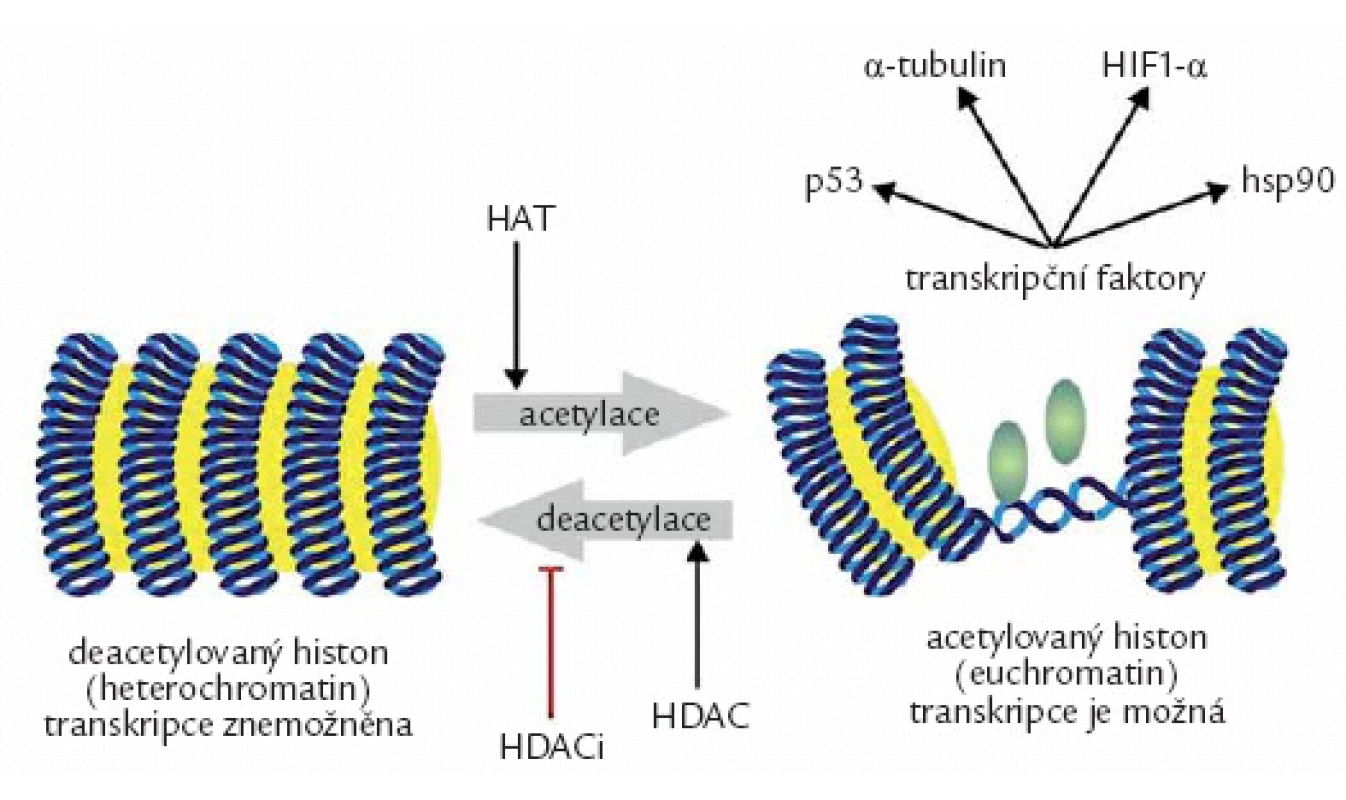
Širokým spektrem cílových proteinů pro HDACi lze vysvětlit široké spektrum účinků těchto látek. Patří mezi ně indukce apoptózy, indukce autofagie, zástava buněčného cyklu, indukce diferenciace, indukce ROS (Reactive Oxigen Species), změněná exprese mikroRNA (miRNA), resensitizace rezistentních nádorových buněk vůči konvenčním chemoterapeutikům či synergický cytotoxický a antiproliferační účinek s jinými antineoplastickými molekulami.
Přípravky s epigenetickým mechanizmem účinku
Inhibitory DNA metyltransferáz. Mezi DNMTi patří analoga cytidinu 5 - azacytidin a 2’deoxy ‑ 5-azacytidin. 5-azacytidin (Vidaza) je ribonukleotidový analog, který je aktivován cytidin/ uridinkinázou a značná část aza ‑ CTP je inkorporována do RNA. Ribonukleotid ‑ reduktáza (RR) však katabolizuje přeměnu azacytidinu na deoxyazacytidin a vzniklý azacytidin‑trifosfát je inkorporován do DNA, kde nevede k zástavě replikace, ale k inhibici metylace DNA blokádou DNA ‑ metyltransferázy (DNMT) [11]. Metylace deoxycytidinu představuje klíčovou modifikaci DNA regulující genovou expresi. Podobně působí jeho derivát 5 - aza ‑ 2’ - deoxycytidin, decitabin (Dacogen), používá se v léčbě MDS a některých AML. Oba přípravky našly uplatnění v léčbě myelodysplastického syndromu [12,13]. V preklinickém testování je nový inhibitor DNMT zebularin, nukleotidový analog s výraznou demetylační aktivitou [14].
Inhibitory histon deacetyláz. Acetylace histonů, k níž vede inhibice histon ‑ deacetyláz, působí otevření chromatinové struktury a umožní průchod transkripčního komplexu rozvolněnou DNA vidlicí. Podle chemické struktury se HDACi dělí do 4 skupin, jak je uvedeno v tab. 1.
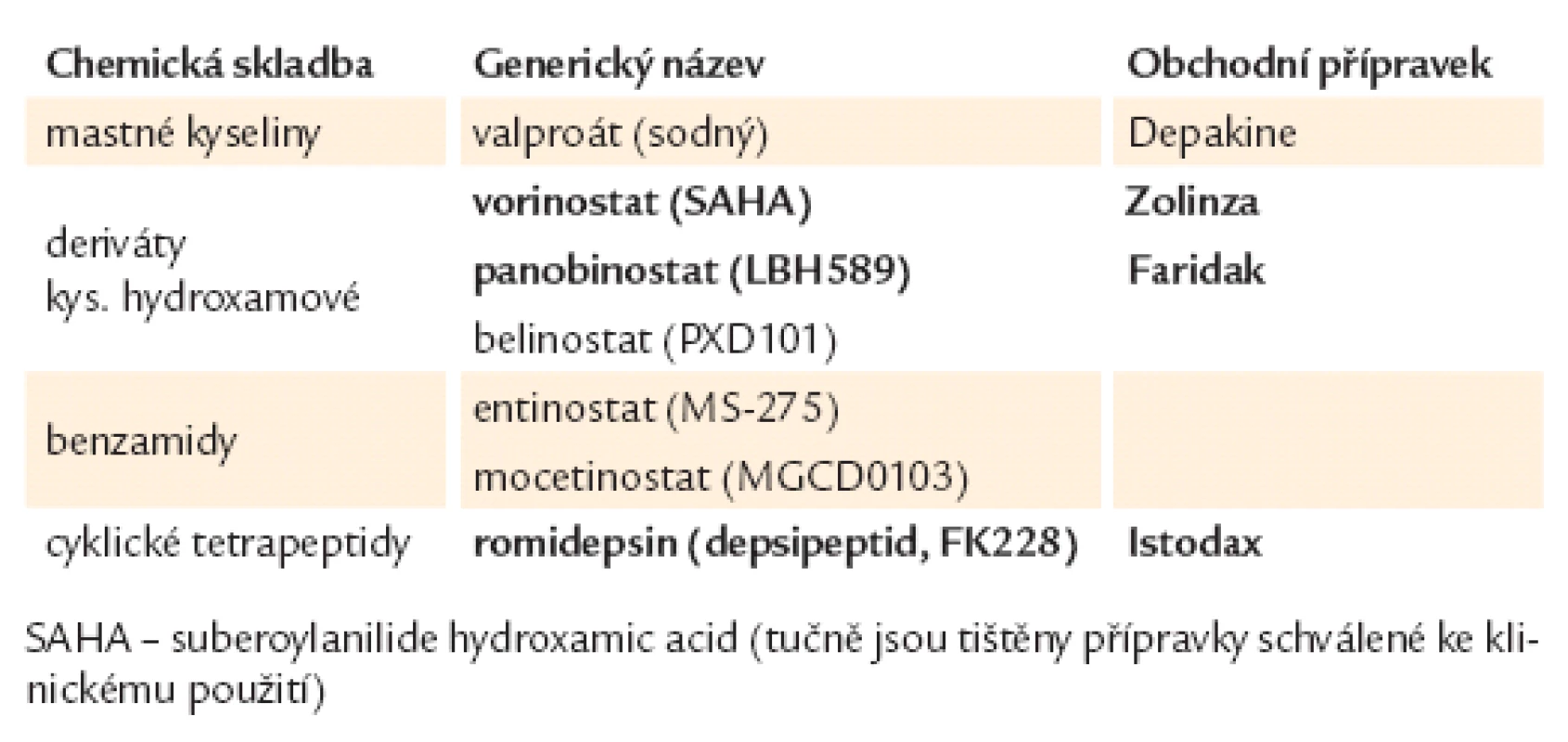
Mnohé HDACi jsou v současnosti testovány u různých typů malignit, obvykle v kombinaci s monoklonálními protilátkami či konvenčními cytostatiky [15]. Dva již dříve schválené HDACi pro klinické použití jsou vorinostat (Zolinza) a romidepsin (Istodax), oba pro terapii relabujících kožních T lymfomů. Vorinostat se kromě toho zkouší u mnohočetného myelomu a AML a v kombinaci s klasickými cytostatiky u solidních tumorů (např. u nemalobuněčného karcinomu plic v kombinaci s karboplatinou a paclitaxelem) [16].Romidepsin se testuje v terapii nehodgkinských lymfomů, mnohočetného myelomu, AML a solidních tumorů. Panobinostat (Faridak ‑ LBH 589) byl schválen v roce 2010 Evropskou komisí jako „orphan drug“ pro terapii Hodgkinova lymfomu a zkouší se u dalších hematologických malignit. Belinostat se testuje u pacientů s refrakterním Hodgkinovým lymfomem a CML. Mocetinostat jeví nadějné výsledky u pacientů s refrakterními B ‑ NHL [17]. Zkouší se i v léčbě Hodgkinova lymfomu. Valproát (Depakin) se běžně používá v neurologii pro léčbu epilepsie, v onkologii se testuje v kombinaci s hypometylačními látkami (s 5 - azacytidinem) v terapii MDS a AML [18].
Závěr
Epigenetická chemoterapeutika se dají kombinovat jak mezi sebou navzájem (tzv. kombinovaná epigenetická terapie), tak spolu s konvenčními cytostatiky, inhibitory proteasomu, monoklonálními protilátkami, hormonální terapií či radioterapií. Inhibitory DNA metyltransferáz našly své uplatnění v léčbě MDS, kdežto u HDACi navzdory nadějným výsledkům mnoha časných fází klinických studií zůstává jejich využití v onkologické praxi omezené prakticky jen na kožní T lymfomy. Hlavním limitujícím faktorem širšího klinického využití HDACi (včetně kombinací s jinými protinádorovými látkami) zůstává jejich značná hematologická a gastrointestinální toxicita. Syntéza nových HDACi další generace by mohla vést ke zlepšení toxického profilu a zvýšení protinádorové aktivity.
prof. MUDr. Pavel Klener, DrSc.
www.vfn.cz
www.Klener.cz
e‑mail: pavel.klener@ruk.cuni.cz
Doručeno do redakce: 26. 3.2013
Sources
1. Esteller M. Epigenetics in cancer. N Engl J Med 2008; 358 : 1148 – 1159.
2. Grønbaek K, Hother C, Jones PA. Epigenetic changes in cancer. APMIS 2007; 115 : 1039 – 1059.
3. Dawson MA, Kouzarides T. Cancer epigenetics: from mechanism to therapy. Cell 2012; 150 : 12 – 27.
4. Gilbert J, Gore SD, Herman JG et al. The clinical application of targeting cancer through histone acetylation and hypomethylation. Clin Cancer Res 2004; 15 : 4589 – 4596.
5. van Vierken LE, Hurt EM, Hollingswort RE. The role of epigenetic regulation in stem cell and cancer. J Mol Med (Berl) 2012; 90 : 791 – 801.
6. Brueckner B, Kuck D, Lyko F. DNA methyltransferase inhibitors for cancer therapy. Cancer J 2007; 13 : 17 – 22.
7. Mani S, Herceg Z. DNA demethylating agents and epigenetic therapy of cancer. Adv Genet 2010; 70 : 327 – 340.
8. Billam M, Sobolewski D, Davidson N. Effect of a novel DNA methyltransferase inhibitor zebularine on human breast cancer cells. Breast Cancer Res Treat 2010; 120 : 581 – 592.
9. Lee MJ, Kim SY, Kummar S et al. Histone deacetylase inhibitors in cancer therapy. Cur Opin Oncol 2008; 20 : 639 – 649.
10. Martinez ‑ Iglesias O, Ruiz ‑ Liorente L, Sánchez ‑ Martinez R et al. Histone deacetylase inhibitors: mechanism of action and therapeutic use in cancer. Clin Transl Oncol 2008; 10 : 395 – 398.
11. Min‑Jung L, Yeong Sang K, Ku Shivani K et al. Histone deacetylase inhibitors in cancer therapy. Curr Opin Oncol 2008; 20 : 639 – 649.
12. Garcia ‑ Manero G. Demethylating agents in myeloid malignancies. Curr Opin Oncol 2008; 20 : 705 – 710.
13. Garcia ‑ Manero G, Fenaux P. Hypomethylating agents and other novel strategies in myelodysplastic syndromes. J Clin Oncol 2011; 29 : 516 – 523.
14. Quintás ‑ Cardama A, Ravandi F, Liu ‑ Dumlao Tet al. Epigenetic therapy is associated with similar survival compared with intensive chemotherapy in older patients with newly diagnosed acute myeloid leukemia. Blood 2012; 120 : 4840 – 4845.
15. Khan O, LaThangue NB. Drug insight: histone deacetylase inhibitor‑based therapies for cutaneous T ‑ cell lymphomas. Nat Clin Pract Oncol 2008; 5 : 714 – 726.
16. Szyf M. Epigenetis, DNA methylation, and chromatin modyfying drugs. Ann Rev Pharmacol Toxicol 2009; 49 : 243 – 263.
17. Younes A, Oki Y, Bociek RG et al. Mocetinostat for relapsed classical Hodgkin’s lymphoma: an open ‑ label, single‑arm, phase 2 trial. Lancet Oncol 2011; 13 : 1222 – 1228.
18. Hřebáčková J, Hraběta J, Eckschlager T. Valproic acid in the complex therapy of malignant tumors. Curr Drug Targets 2010; 11 : 361 – 379.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2013 Issue 6
-
All articles in this issue
- Adherence a perzistence se zaměřením na léčbu hypertenzních pacientů
- Diuretika v monoterapii a v kombinaci s diuretiky a nediuretiky v léčbě hypertenze
- Hypertenze u pacientů s polycystickými ledvinami – incidence, patogeneze, prognóza, terapie
- Primární hyperaldosteronizmus: častá forma sekundární hypertenze s vyšším kardiovaskulárním rizikem
- Chronická obstrukční plicní nemoc pohledem nových doporučení – souhrn aktuálního fenotypově zaměřeného standardu České pneumologické a ftizeologické společnosti pro internisty
- Účinnost léčby anagrelidem u nemocných s Ph‑ negativními myeloproliferativními chorobami: ovlivnění výskytu trombózy ve výstupech Registru pacientů s diagnózou esenciální trombocytemie a trombocytemie provázející jiné myeloproliferativní onemocnění léčených Thromboreductinem® ke konci roku 2012
- Počátky České kardiologické společnosti a české kardiologie
- Moderní trendy v inzulinoterapii
- Vplyv tuhosti aorty na centrálnu hemodynamiku a na kardiovaskulárny systém
- Lipidy a veľkosť lipoproteínových častíc u pacientov s novozisteným a doposiaľ neliečeným diabetes mellitus 2. typu
- Metabolický syndróm a prediabetické stavy
- Rezistentná hypertenzia v staršom veku
- Epigenetická cytostatika a jejich role v protinádorové léčbě
- Environmentálny estrogén bisfenol A a jeho účinky na organizmus človeka
- Jak ovlivňuje gravidita onemocnění hypofýzy
- Diferenciálna diagnóza a liečba hyponatriémie
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Diferenciálna diagnóza a liečba hyponatriémie
- Jak ovlivňuje gravidita onemocnění hypofýzy
- Diuretika v monoterapii a v kombinaci s diuretiky a nediuretiky v léčbě hypertenze
- Environmentálny estrogén bisfenol A a jeho účinky na organizmus človeka
