Diferenciální diagnostika eozinofilie
Differential diagnostics of hypereosinophilia
Hypereosinophilia is characterized by chronic increase of peripheral blood eosinophiles with common damage to various organs due to eosinophilic infiltration and release of mediators. Hypereosinophilia should be both reactive and clonal, and accompanies group of heterogeneous disorders (infectious, pulmonary, immunologic, malignant). Based on recent advances in molecular and genetic diagnostic techniques and increasing experience with differences in clinical features and prognosis, some subtypes of clonal hypereosinophilic syndromes have been defined, such as myeloproliferative variants, including chronic eosinophilic leukemia, and lymphocytic variants, but other subtypes remain undefined. Differential diagnostics oh hypereosinophilie therefore remains one of very important medical issues.
Key words:
differential diagnostics – hypereosinophilia
:
Michael Doubek 1; Yvona Brychtová 1; Jarmila Kissová 2; Miroslav Tomíška 1; Zdeněk Adam 1
:
Interní hematologická a onkologická klinika LF MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jiří Mayer, CSc.
1; Oddělení klinické hematologie FN Brno, přednosta prof. MUDr. Miroslav Penka, CSc.
2
:
Vnitř Lék 2014; 60(Suppl 2): 21-27
:
70th Birthday - prof. MUDr. Jiří Vorlíček, CSc.
Hypereozinofilie je charakterizována chronickým zmnožením eozinofilů v periferní krvi, které často provází poškození různých orgánů způsobené eozinofilní infiltrací a uvolňováním různých mediátorů. Hypereozinofilie provází řadů různých onemocnění (infekční, plicní, imunologické, maligní) a může být neklonální i klonální. Na základě molekulárně genetických analýz i různých klinických projevů může být klonální hypereozinofilie rozdělena na několik podtypů, u nichž dominuje buď myeloproliferativní složka, nebo je původcem eozinofilie proliferace lymfocytů. U řady podtypů klonální eozinofilie ale stále primární porucha není známa. Z hlediska diferenciální diagnostiky představuje eozinofilie velmi důležitou problematiku.
Klíčová slova:
diferenciální diagnostika – hypereozinofilie
Úvod
Eozinofilie je častým nálezem u řady onemocnění, včetně onemocnění onkologických či interních. Klonální hypereozinofilie však sama o sobě může mít zhoubný průběh. Diferenciální diagnostika eozinofilie je problematikou komplikovanou, se kterou se ale na druhou stranu setkává řada lékařů. Z tohoto důvodu jsme se rozhodli ji připomenout v tomto čísle Vnitřního lékařství, které by mělo propojovat problematiku interní a onkologickou.
Incidence
Údaje o incidenci eozinofilie v české či slovenské populaci neznáme. Podle zahraničních dat je eozinofilie přítomna u < 0,2 % pacientů s normálními parametry krevního obrazu. Incidence život ohrožujícího idiopatického hypereozinofilního syndromu je pak asi 0,5 případů na 100 000 obyvatel a rok [1–3].
Fyziologické počty eozinofilních granulocytů
Eozinofilní granulocyty se před migrací do tkání nacházejí v krevním oběhu. Ve tkáních je jich minimálně 100krát více než v krvi. V krevním oběhu zůstávají jen 6–12 hod. Nejvíce eozinofilů lze nalézt v orgánech s epiteliálním povrchem, který se dostává do styku se zevními alergeny (respirační, gastrointestinální a distální genitouretrální trakt). Zde mohou eozinofily přežívat řádově týdny.
Počet eozinofilů v krvi kolísá v závislosti na věku pacienta, denní době, námaze a na vlivech okolního prostředí se sezonními alergeny. Počet eozinofilů je nejnižší ráno a nejvyšší v noci. Tyto rozdíly jsou způsobeny kolísáním hladiny kortizolu. Horní hranice normálního počtu eozinofilů je 0,65 × 109/l. Za jejich patologický vzestup lze považovat počet eozinofilů nad 0,7 × 109/l. Absolutní počet eozinofilů je podstatně důležitější údaj než jejich relativní počet. Hranice normálních a zvýšených hodnot eozinofilů se ale mohou v různých publikacích mírně lišit.
Tvorba eozinofilů v kostní dřeni je regulována četnými faktory. Stimulována je cytokiny produkovanými T-lymfocyty, z nichž nejúčinnější je interleukin 5, interleukin 3 a granulocyte monocyte-colony stimulating factor (GM-CSF). Tyto látky jsou hlavními faktory odpovědnými za proliferaci eozinofilů a jsou také chemotaktickými faktory, které stimulují migraci eozinofilů do tkání. Jejich geny jsou lokalizovány na chromozomu 5q31-q33.
Eozinofilie je tedy fyziologicky reakce na specifickou T-buněčnou imunitní odezvu, obvykle na zevní alergeny nebo na parazitární (helmintickou) infekci, výjimečně na jiné infekce (mykotické nebo bakteriální). Hlavním stimulem eozinofilní proliferace je však IL3 produkovaný Th2 lymfocyty [2–4].
Základní dělení eozinofilií
Eozinofilie se dělí na:
- sekundární eozinofilie – cytokiny indukovaný reaktivní fenomén
- primární (klonální) eozinofilie – přítomny histologické, cytogenetické nebo molekulární známky klonality
- idiopatická eozinofilie – není prokázána neklonální či klonální příčina
Hypereozinofilní syndrom je pak podmnožinou idiopatické eozinofilie, při níž je přítomno > 1,5 × 109/l eozinofilů a je prokázáno poškozování orgánů a tkání eozinofily [3,4].
Přehled příčin eozinofilie uvádí tab. 1. Morfologické odlišnosti reaktivně zmnožených a klonálních eozinofilů ukazují obr. 1–3.
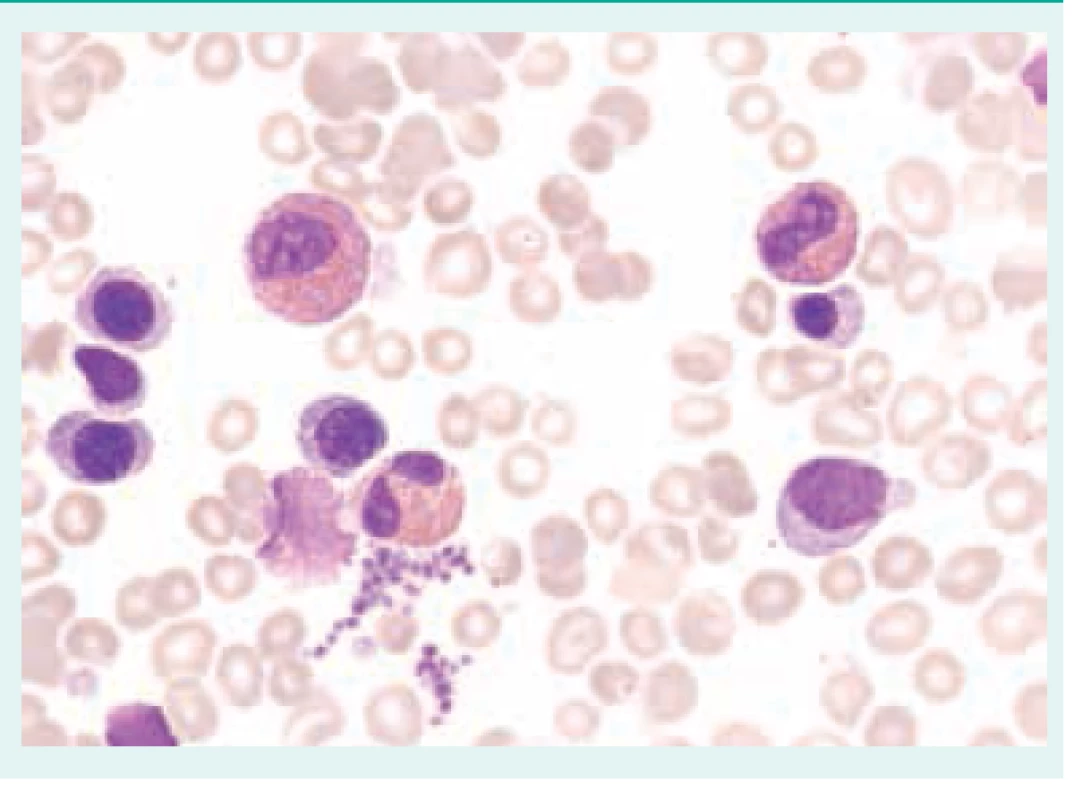
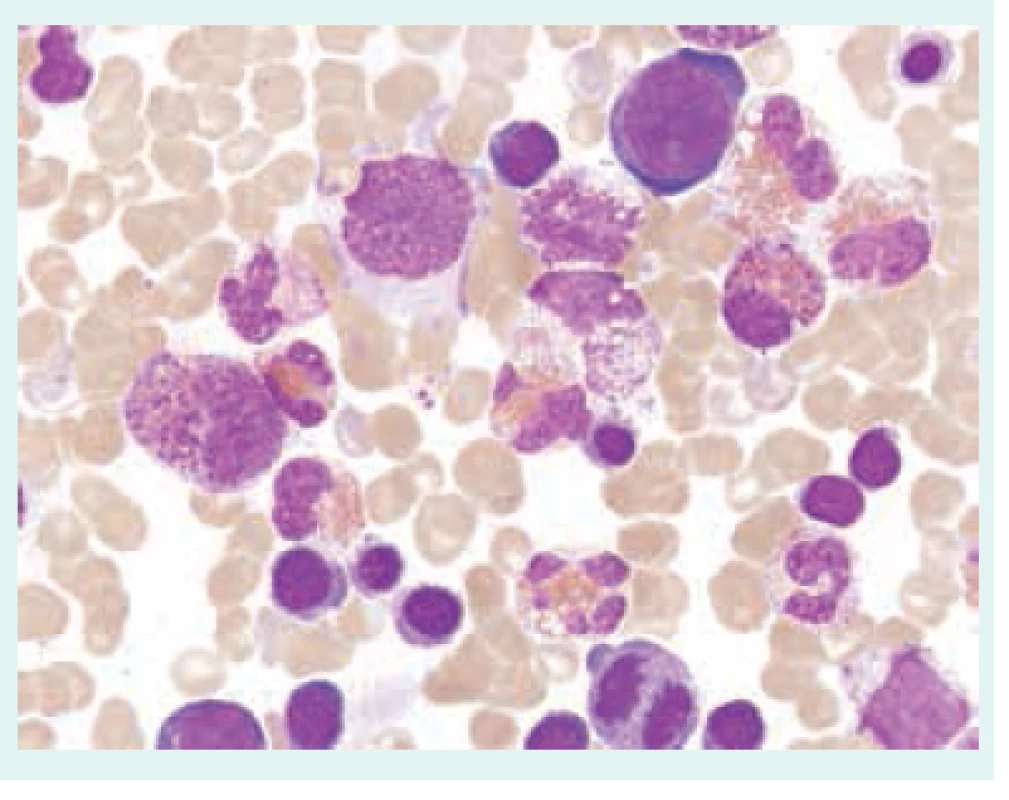
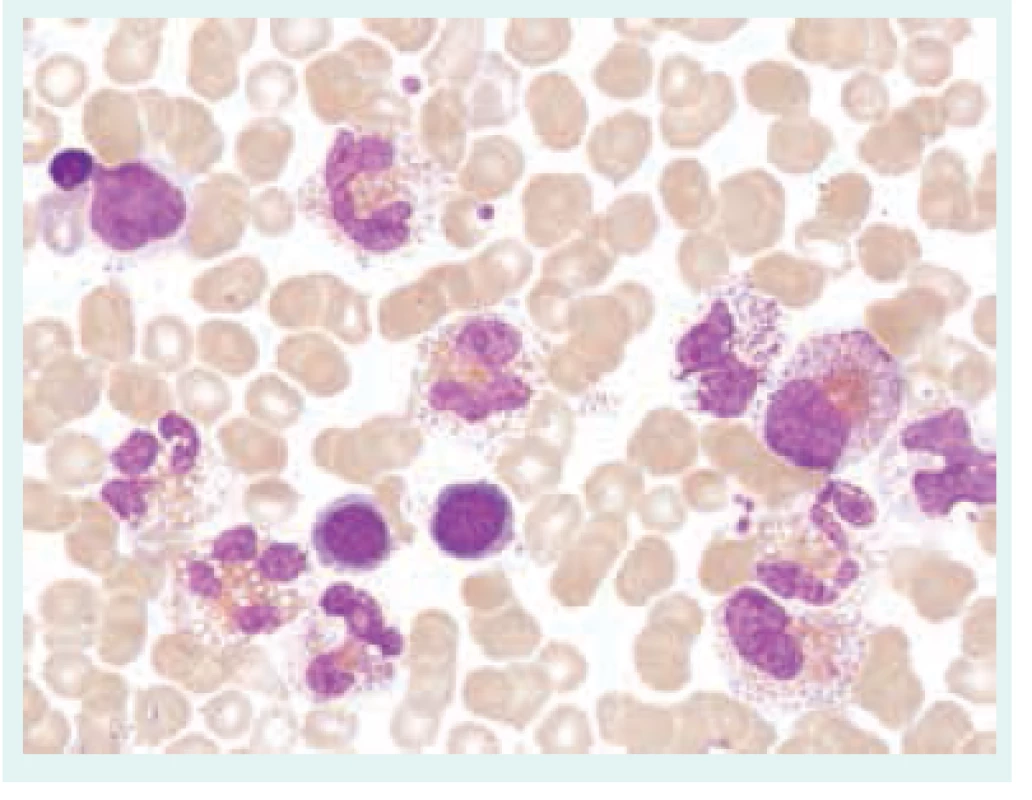
Při diferenciální diagnostice eozinofilie je vhodné přihlédnout i k absolutnímu počtu eozinofilů v periferní krvi (tab. 2), i když pravděpodobnost ireverzibilního orgánového postižení při eozinofilii nezávisí na absolutním počtu všech eozinofilů [3,4,6,7].
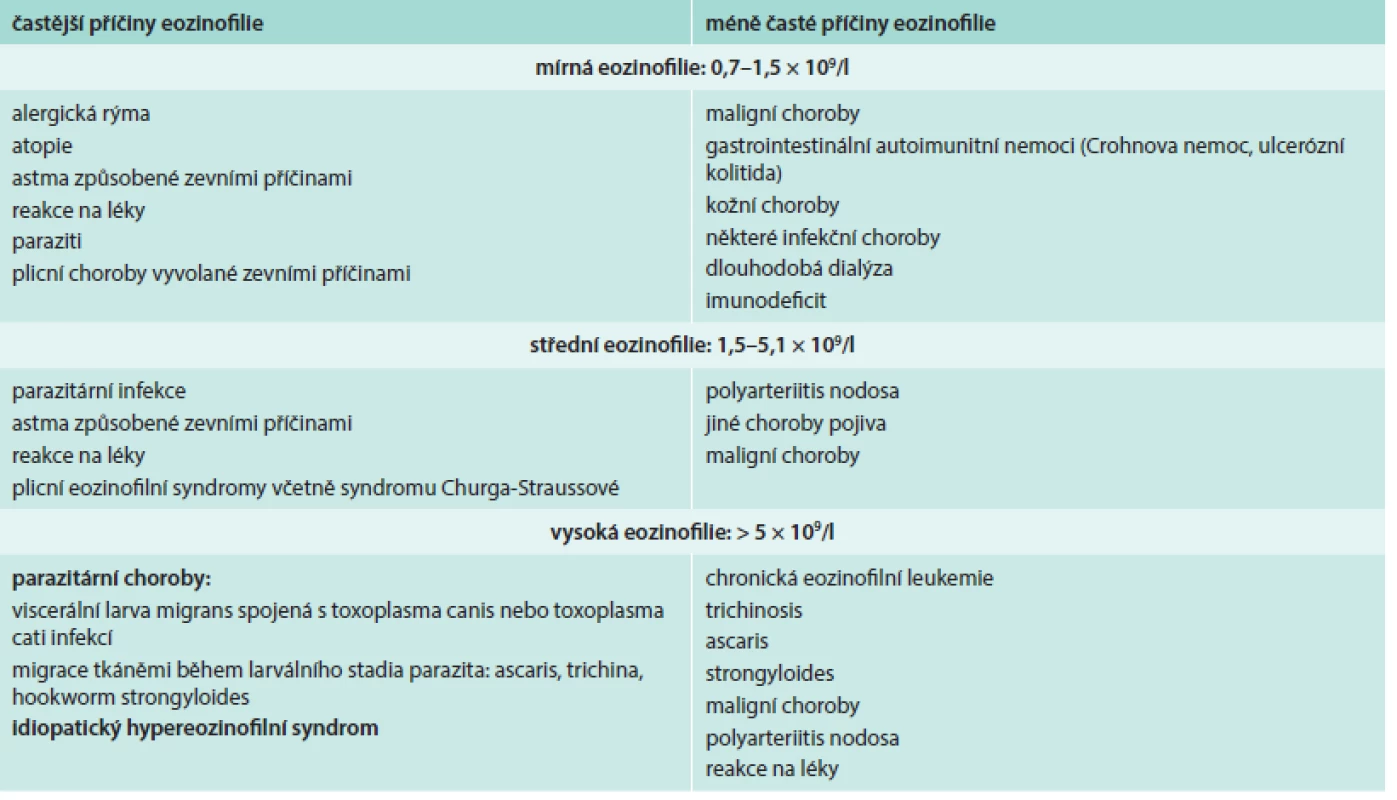
Vybrané příčiny eozinofilie podrobněji shrnuje následující text.
Infekce
Parazitární infekce
Parazitární choroby lze nomenklaturně rozdělit na parazitující prvoky (protozoa) a na parazitující červy (vermes), pro které se v lékařství používá termínu helminti.
Při vyšetřování přítomnosti parazitární infekce je extrémně důležitá přesná cestovatelská anamnéza. Netýká se to jen cest mimo kontinent, ale i v Evropě jsou endemické oblasti pro určité parazitární choroby. Např. v některých přímořských zemích Evropy (Nizozemí, Bretaňské pobřeží, Skotsko, Německo, Belgie a Dánsko) lze při konzumaci nevařených mořských ryb získat parazitární infekci nazývající se anisakóza (Anisaka simplex). Ve Francii lze získat při konzumaci salátu z řeřišnice potoční helmintózu vyvolanou motolicí Fasciola hepatica.
Základním vyšetřením je opakovaný odběr stolice na vyšetření přítomnosti vajíček helmintů či jejich částí. Dále se vyšetřuje krev na sérologický průkaz titru protilátek. Výjimečně se vyšetřuje moč a případně tkáňová biopsie. V určitých případech jsou přínosem také zobrazovací metody, např. ultrazvuk a CT v diagnostice echinokokózy.
Rozsah sérologického vyšetření člověka, který neopustil Českou republiku, by měl zahrnovat: larvární toxokarózu, trichinelózu, askariózu, trichuriózu, enterobiózu, strongyloidózu, teniózu, ankylostomatózu, hidatidózu (echinokózu) a při nejasných kožních příznacích cerkariovou dermatitidu způsobenou ptačími motolicemi. V případě, že vyšetřovaný pacient cestoval, je vhodné na žádanku vypsat data a místa pobytu, nebo přímo s parazitologem domluvit rozsah požadovaných sérologických vyšetření [2–4,8].
Další infekce
Fungální infekce, hlavně kokcidiomykóza a aspergilóza, mohou způsobit eozinofilii. Eozinofilie může být patrná i v některé fázi infekční nemoci (nejčastěji při brucelóze, mykobakteriální infekci a chlamydiální pneumonii). U záškrtu dosahuje počet eozinofilů maxima ve 3. týdnu a pak se rychle snižuje [3,4].
Alergické choroby
V průmyslových zemích jsou alergie nejčastější příčinou eozinofilie (senná rýma, alergická rýma, astma, reakce na léky či jiné látky, alergická cystitida). Tyto alergie však způsobují nejčastěji jen mírný (0,5–0,7 × 109/l), výjimečně střední vzestup počtu eozinofilů.
K alergickým eozinofiliím patří rovněž tzv. DRESS syndrom (drug rash with eosinophilia and systemic symptomes), který je formou alergické reakce na léky. Z léků mohou vyvolat eozinofilii antibiotika, antituberkulotika, antimykotika, antiflogistika, antipsychotické léky, fenotiaziny, chlorpromazin, antiepileptika, hydantoináty, barbituráty, antidiabetika, antikoagulancia a protinádorové léky. Nejčastějšími reakcemi, doprovázejícími lékovou alergickou reakci, je kožní raš, makulopapulózní exantém, výjimečně jiná forma postižení kůže až exfoliativní dermatitis, často i teplota s bolestmi kloubů a svalů. Méně častá je hmatná lymfadenopatie. Interval mezi zahájením užívání léku a vznikem polékové alergické reakce je nejčastěji 2–6 týdnů [2–4].
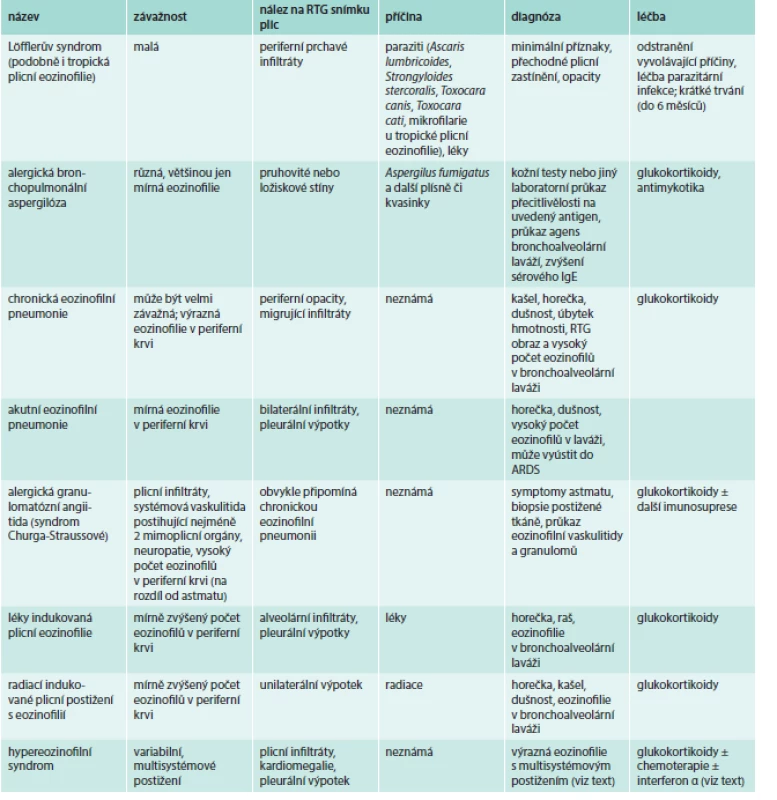
Eozinofilní syndromy s plicní manifestací a další plicní nemoci
Eozinofilie provází často řadu plicních onemocnění – plicní karcinomy, sarkoidózu či astma (viz alergické choroby). Může jít jak o důsledek plicního postižení, tak i o jeho příčinu [2–4,9].
Plicní eozinofilní syndromy shrnuje tab. 3.
Maligní choroby
Mnoho maligních chorob je provázeno vzestupem počtu eozinofilů. Nejčastěji jde o pokročilé malignity s metastázami. Často je eozinofilie nalézána u pacientů s plicními tumory nebo hematologickými chorobami (neklonální eozinofilie u Hodgkinova lymfomu, nonhodgkinských lymfomů obzvláště T-typu, akutní lymfoblastické leukemie). V případech maligních lymfoproliferativních onemocnění může eozinofilie předcházet roky jejich další manifestaci. Po úspěšné léčbě maligního lymfoproliferativního onemocnění může eozinofilie vymizet a relabovat může opět až měsíce před zřetelným relapsem maligní choroby [1,2].
Imunologické příčiny eozinofilie
Imunologické příčiny eozinofilie zahrnují hyper-IgE syndrom, izolovaný deficit IgA nebo Wiskottův-Aldrichův syndrom.
Hypereozinofilní syndrom vyvolaný T-lymfocyty
T-lymfocyty stojí v pozadí všech reaktivních eozinofilií. V některých případech známe příčinu, a pak je eozinofilie klasifikována dle této příčiny (léky, paraziti apod), nebo příčinu neznáme, a pak jednotka spadá do kategorie idiopatického hypereozinofilního syndromu, pokud splňuje jeho kritéria uvedená výše. Na hypereozinofilní syndrom mediovaný T-lymfocyty lze usuzovat v případech neprokázané klonální eozinofilie, nebo při prokázané klonální populaci T-lymfocytů, produkujících vysoké koncentrace výše uvedených interleukinů, signalizujících Th2 profil těchto buněk. Pacienti s hypereozinofilií způsobenou T-lymfocyty mají častěji vysokou koncentraci imunoglobulinu IgE a polyklonální hypergamaglobulinemii. Za fyziologických okolností dochází k T-lymfocyty mediované eozinofilii při parazitárních infekcích. Za patologických okolností dochází k této reakci u alergických stavů, autoimunitních onemocnění a nakonec i u maligních lymfomů, obzvláště T typu [2,3,10].
Další stavy spojené s eozinofilií
Mezi eozinofilní syndromy ne zcela jasné etiologie, ale pravděpodobně rovněž související s T-buněčnou imunitní odezvou, patří následující choroby: idiopatický epizodický angioedém s eozinofilií, hypereozinofilní dermatitida, eozinofilní celulitida (Wellsův syndrom), eozinofilní myozitidy, eozinofilní fasciitida, eozinofilní gastroenteritidy či Crohnova nemoc nebo ulcerózní kolitida spojené s eozinofilií. Tyto relativně benigní nemoci s eozinofilií obvykle poškozují jen jeden orgán a počet eozinofilů v krvi může a nemusí být zvýšený.
Eozinofilie může provázet i revmatoidní artritidu a další kolagenózy. Odborná literatura popisuje tzv. eozinofilní myopatii.
Syndrom eozinofilní fasciitidy (Schulmanův syndrom) je příbuzný sklerodermii, které se značně podobá makroskopickým postižením kůže a podkoží a odlišuje se eozinofilií, infiltrací podkoží eozinofily a přítomností hypergamaglobulinemie.
Kimurova choroba je podobné onemocnění mladých mužů. Projevuje se podkožními infiltráty v oblasti hlavy a krku a je spojena s regionální lymfadenopatií. Histologický obraz zahrnuje folikulární hyperplazii a eozinofilní infiltráty [2–4].
Klonální eozinofilie
Klonální eozinofilie jsou způsobeny primární poruchou v kostní dřeni. Klonalitu lze pak prokázat cytogeneticky nebo molekulárně genetickými metodami. Klonální eozinofilie spadá do skupiny myeloproliferativních nemocí. Ke klonálním eozinofiliím patří podle klasifikace Světové zdravotnické organizace chronická eozinofilní leukemie (CEL) a myeloidní a lymfoidní neoplazie spojené s eozinofilií a abnormalitami genů PDGFRA, PDGFRB nebo FGFR1 [1–3].
Chronická eozinofilní leukemie
Ke kritériím CEL patří:
- zvýšený počet nezralých eozinofilů v krvi (> 1,5 × 109/l) a v kostní dřeni, která navíc může obsahovat až do 20 % blastů
- infiltrace tkání nezralými eozinofily
- jsou přítomny hematologické abnormality: degranulace, vakuolizace, hyposegmentace, hypersegmentace eozinofilů, hepatomegalie, splenomegalie, zvýšená koncentrace vitaminu B12, abnormální skóre leukocytární alkalické fosfatázy, které bývá spíše zvýšené než snížené, myelofibróza, myeloidní dysplazie a bazofilie
- je vyloučena abnormalita genů PDGFRA, PDGFRB, FGFR1 či BCR-ABL1 (bývá u chronické myeloidní leukemie). V literatuře jsou popsány i morfologické odchylky patologických eozinofilů od jejich fyziologických protějšků při vyšetření elektronovou mikroskopií. Odlišení CEL od idiopatického hypereozinofilního syndromu může být ale někdy komplikované. K odlišení může pomoc průkaz chromozomálních abnormalit v buňkách eozinofilní řady u CEL, které u HES přítomny nebývají, nebo zmožení blastů v kostní dřeni nebo periferní krvi.
Kardiální, neurologické a další komplikace (viz níže) se mohou vyvinout v případě CEL stejně jako u idiopatického HES s polyklonálními eozinofily, nebo při parazitární chorobě, a proto nepředstavují rozlišovací ukazatel [1–3].
Diagnostická kritéria CEL jsou přesně uvedena v tab. 4.
![Kritéria chronické eozinofilní leukemie a hypereozinofilního syndromu podle Světové zdravotnické organizace [1]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/75625f8aa0a6602b18be1bf10a521ef4.png)
Myeloidní a lymfoidní neoplazie spojené s eozinofilií a abnormalitami genů PDGFRA, PDGFRB nebo FGFR1
Eozinofilní myeloproliferace spojené s přestavbou genů PDGFRA nebo PDGFRB
V některých případech lze prokázat souvislost klonální eozinofilie s mutacemi či přestavbami genů pro tzv. platelet derived growth factor receptor α (PDGFRA) a β (PDGFRB). Klinickými projevy se tyto případy eozinofilie podobají HES (viz níže), systémové mastocytóze nebo CEL. Z klinického průběhu nelze tedy na přítomnost mutace PDGFRA usuzovat.
Gen PDGFRA kóduje tyrozinkinázový receptor PDGFRA a je lokalizován na chromozomu 4 (4q12). Jako první byla popsána translokace t(1;4)(q44;q12), která má za následek fúzi genu PDGFRA s genem FIP1L1 za vzniku fúzního genu FIP1L1-PDGFRA. K aktivaci PDGFRA může dojít také v důsledku dalších chromozomálních translokací. Např. t(4;22)(q12;q11), která má za následek vznik fúzního genu BCR-PDGFRA. Postupně byly rozeznávány další geny, které fúzují s genem PDGFRA: KIF5B, CDK5RAP2, STRN nebo ETV. Každá z výše uvedených cest vede ke konstitutivní aktivaci genu PDGFRA.
Fúzní gen FIP1L1 byl nalezen asi u 12–14 % všech pacientů s eozinofilií, většinou u mužů.
Gen PDGFRB je lokalizován na chromozomu 5, v oblasti 5q33. K jeho aktivaci dochází různými chromozomálními translokacemi, např. t(5;12)(q33;p13), která vede ke vzniku fúzního genu ETV6-PDGFRB. Popsáno bylo dalších několik genů, které mohou být fúzními partnery genu PDGFR.
Velmi významným faktem, který se týká tohoto podtypu eozinofilie, je fakt, že zde existuje velmi účinná terapeutická možnost tyrozinkinázovými inhibitory, např. imatinibem [1–3,11–13].
Eozinofilní myeloproliferativní syndrom 8p11 (FGFR1 eozinofilní myeloproliferativní syndrom)
Myeloproliferativní syndrom 8p11 je známý pod označením human stem cell leukemie/lymphoma syndrome. Je asociován s mutací či translokací receptoru 1 fibroblastového růstového faktoru (fibroblast growth factor receptor 1 – FGFR1).
Klinicky se tato myeloproliferace projevuje eozinofilií, myeloproliferativními a myelodysplastickými znaky, lymfadenopatií, zvýšeným výskytem současného maligního T lymfomu. Nemoc má agresivní průběh [1–3,14].
Idiopatický hypereozinofilní syndrom (HES)
Termín idiopatický HES je vyhrazen pro případy zvýšeného počtu eozinofilů, u nichž nebyl prokázán klonální ani reaktivní původ. Definice HES je následující:
- počet eozinofilů v periferní krvi je ≥ 1,5 × 109/l po dobu 6 měsíců, nebo do smrti způsobené důsledky eozinofilie
- není přítomna jiná rozpoznatelná příčina hypereozinofilie
- jsou příznaky orgánového poškození, např. kardiomyopatie, hepatosplenomegalie, plicní poruchy, horečky, anémie, ale i neurologické poruchy
Incidence hypereozinofilního syndromu je poměrně malá. Chorobou průměrně ročně onemocní 1 člověk z 200 000 obyvatel. Muži jsou postiženi 9krát častěji než ženy. Nejvíce se manifestuje u lidí ve věku 20–50 let.
Častým nálezem u HES je postižení řady tkání a orgánů. Nejčastější je postižení srdce (58 %), případně mozku a periferních nervů (54 %). K příznakům HES tedy patří:
- eozinofilní endomyokardiální choroba (k poškození srdečního svalu dochází ve 3 stadiích (1) akutní nekrotické, (2) pozdější trombotické, (3) pozdní fibrotické stadium; první zánětlivé stadium je charakterizováno eozinofilní infiltrací endomyokardu; vznik poškození srdce není závislý na počtu eozinofilů) [13,14]
- postižení centrálního nervového systému
- tromboembolická nemoc
- plicní projevy (plicní infiltráty, které jsou prchavé, trvají od několika hodin do několika dní)
- postižení zažívacího traktu
- postižení pohybového aparátu (bolesti svalů a kloubů)
- kožní postižení (např. kopřivkovitý výsev)
- postižení ledvin
- postižení zraku (suché konjunktivitidy, episkleritidy a abnormality cév sítnice)
- imunologické poruchy (někdy extrémně zvýšené hladiny imunoglobulinu E) [1–3]
Eozinofilie provázející další myeloproliferativní choroby
Eozinofilie může provázet chronickou myeloidní leukemii (CML), pravou polycytemii (PV), esenciální trombocytemii (ET) i primární myelofibrózu (PMF). Dále se může vyskytovat u chronické neutrofilní leukemie (CNL), neklasifikovatelných myeloproliferací, chronické myelomonocytární leukemie (CMML) i systémové mastocytózy (častá mutace genu KIT) [1,17].
Závěr
Zvýšený počet eozinofilů může provázet velký počet chorob, z nichž některé jsou dobře, jiné hůře léčebně ovlivnitelné. V některých případech je eozinofilie zcela asymptomatická a je otázkou, zda se příznaky nemoci neobjeví až po několika letech trvání eozinofilie.
Každopádně každý nález zvýšeného počtu eozinofilů vyžaduje pečlivé vyšetření, a pokud je rozpoznán patologický podklad tohoto zvýšení, tak i odpovídající léčbu.
prof. MUDr. Michael Doubek, Ph.D.
mdoubek@fnbrno.cz
Interní hematologická a onkologická klinika LF MU a FN, Brno
www.fnbrno.cz
Doručeno do redakce 15. 8. 2014
Přijato po recenzi 5. 9. 2014
Sources
1. Swerdlow SH, Campo E, Harris NL et al. WHO classification of tumours of haematopoietic and lymphoid tissues. International Agency for Research on Cancer.4th ed. IARC Press: Lyon 2008. ISBN 9789283224310.
2. Tefferi A, Gotlib J, Pardanani A. Hypereosinophilic syndrome and clonal eosinophilia: point-of-care diagnostic algorithm and treatment update. Mayo Clin Proc 2010; 85(2): 158–164.
3. Tefferi A, Patnaik MM, Pardanani A. Eosinophilia: secondary, clonal and idiopatic. Br J Haematol 2006; 133(5): 468–492.
4. Adam Z, Elbl L, Buliková A et al. Eozinofilie, idiopatický hypereozinofilní syndrom. Postgrad Med 2003; 5(5): 471–487.
5. Lombardi C, Passalacqua G. Eosinophilia and diseases: clinical revision of 1862 cases. Arch Intern Med 2003; 163(11): 1371–1373.
6. Méndez-Sánchez N, Chávez-Tapia NC, Vazquez-Elizondo G et al. Eosinophilic gastroenteritis: a review. Dig Dis Sci 2007; 52(11): 2904–2911.
7. Kobayashi S, Inokuma S, Setoguchi K et al. Incidence of peripheral blood eosinophilia and the threshold eosinophile count for indicating hypereosinophilia-associated diseases. J Allergy 2002; 57(10): 950–956.
8. Chrobák L, Voglová J. Idiopatický hypereozinofilní syndrom a chronická eozinofilní leukemie. Vnitřní Lék 2005; 51(12):1385–1393.
9. Campos LE, Pereira LF. Pulmonary eosinophilia. J Bras Pneumol 2009; 35(6): 561–573.
10. Simon HU, Plotz SG, Dummer R et al. Abnormal clones of T cells producing interleukin-5 in idiopathic eosinophilia. N Engl J Med 1999; 341(15): 1112–1120.
11. Yoo TJ, Orman SV, Patil SR et al. Evolution to eosinophilic leukemia with a t(5 : 11) translocation in a patient with idiopathic hypereosinophilic syndrome. Cancer Genet Cytogenet 1984; 11(4): 389–394.
12. Cools J, DeAngelo DJ, Gotlib J et al. A tyrosine kinase created by fusion of the PDGFRA and FIP1L1 genes as a therapeutic target of imatinib in idiopathic hypereosinophilic syndrome. N Engl J Med 2003; 348(13): 1201–1214.
13. Pardanani A, Brockman SR, Paternoster SF et al. FIP1L1-PDGFRA fusion: prevalence and clinicopathologic correlates in 89 consecutive patients with moderate to severe eosinophilia. Blood 2004; 104(10): 3038–3045.
14. Cross NC, Reiter A .Fibroblast growth factor receptor and platelet-derived growth factor receptor abnormalities in eosinophilic myeloproliferative disorders. Acta Haematol 2008; 119(4): 199–206.
15. Ommen SR, Seward JB, Tajik AJ. Clinical and echocardiographic features of hypereosinophilic syndromes. Am J Cardiol 2000; 86(1): 110–113.
16. Blatt PM, Rothstein G, Miller HL et al. Loffler’s endomyocardial fibrosis with eosinophilia in association with acute lymphoblastic leukemia. Blood 1974; 44(4): 489–493.
17. Doubek M, Kozák T, Vašků V et al. Systémová mastocytóza. Vnitř Lék 2010; 56(Suppl 2): 2S188–2S194.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2014 Issue Suppl 2
-
All articles in this issue
- Testicular malignit tumors – are we in the end of the road?
- Patient follow-up after treatment of breast, colorectal and prostate cancer
- Differential diagnostics of hypereosinophilia
- Clinical evaluation of new drugs against orphan diseases in oncology – the current situation in Europe and in our country
- Palliative care and chronic heart failure
- Development and current utility of infobases in Czech cancer care
- About pain – otherwise
- New antibiotics: do we need new molecules or new strategies?
- Geriatric patient in oncology
- New aspects of impact of papillomavirus status in the therapy of head/neck cancer
- Ph-negative myeloproliferative diseases with thrombocythemia in the context of Thromboreductin® treatment, data from registry 2013
- Diabetes mellitus and malignancies
- Palliative medicine and the „good death“
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Differential diagnostics of hypereosinophilia
- Palliative medicine and the „good death“
- Patient follow-up after treatment of breast, colorectal and prostate cancer
- Ph-negative myeloproliferative diseases with thrombocythemia in the context of Thromboreductin® treatment, data from registry 2013

![Příčiny eozinofilie [5]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/a09f4d5c78579863c6a7c1ae946e2af8.png)