Klinické dôsledky syndrómu polycystických ovárií
Clinical implications of polycystic ovary syndrome
Polycystic ovary syndrome (PCOS) is a heterogeneous and complex endocrine disease which among the female population belongs to the most widespread endocrinopathies and it is the most frequent cause of hyperthyroidism, anticoagulation and infertility. Insulin resistance is one of the important diabetology factors impacting hyperglycaemia in a majority of women with PCOS (60–80 %). Clinical expressions of PCOS include reproduction disorders, metabolic characteristics and psychological implications. Reproduction disorders include hyperthyroidism, menstruation cycle disorders, infertility and pregnancy complications as well as early abortions, gestational diabetes and pregnancy induced hypertension. Long-term metabolic risks of PCOS include type 2 diabetes mellitus, dyslipidemia, arterial hypertension and endothelial dysfunction. The available data confirms higher incidence of cardiovascular diseases in women with PCOS. In particular among obese women PCOS is more frequently associated with non-alcoholic hepatic steatosis, sleep apnoea syndrome and endometrial cancer. The literature includes some controversial data about the relationship between PCOS and autoimmunity. Women with PCOS are more prone to suffer from insufficient confidence with higher incidence of anxiety, depression, bipolar disorder and eating disorders.
Key words:
autoimmunity – diabetes mellitus – pregnancy – insulin resistance – metabolic syndrome – menstrual disorders – polycystic ovary syndrome
Authors:
Ingrid Dravecká
Authors‘ workplace:
I. interná klinika LF UPJŠ a UN L. Pasteura Košice, Slovenská republika
Published in:
Vnitř Lék 2016; 62(5): 392-397
Category:
Reviews
Overview
Syndróm polycystických ovárií (PCOS) je heterogénne a komplexné endokrinné ochorenie, ktoré v ženskej populácii patrí medzi najrozšírenejšie endokrinopatie a je najčastejšou príčinou hyperandrogenizmu, oligoanovulácie a infertility. Inzulínová rezistencia patrí medzi dôležité patogenetické faktory ovplyvňujúce hyperandrogenémiu u väčšiny žien s PCOS (60–80 %). Medzi klinické prejavy PCOS patria reprodukčné poruchy, metabolické črty a psychologické dôsledky. Reprodukčné poruchy zahŕňajú hyperandrogenizmus, menštruačné poruchy, infertilitu a tehotenské komplikácie ako včasné potraty, gestačný diabetes a tehotenstvom indukovanú hypertenziu. K neskorým metabolickým rizikám PCOS patria diabetes mellitus 2. typu, dyslipidémia, artériová hypertenzia a porucha funkcie endotelu. Dostupné dáta potvrdzujú u žien s PCOS častejší výskyt kardiovaskulárnych ochorení. Hlavne u obéznych žien je PCOS častejšie asociovaný s nealkoholovou steatózou pečene, syndrómom spánkového apnoe a endometriálnym karcinómom. Literatúra uvádza kontroverzné údaje o asociácii medzi PCOS a autoimunitou. Ženy s PCOS sú viac náchylné k nedostatočnému sebavedomiu s častejším výskytom úzkosti, depresie, bipopárnej poruchy, anxiety a porúch príjmu potravy.
Kľúčové slová:
autoimunita – diabetes mellitus – gravidita – inzulínová rezistencia – metabolický syndróm – poruchy menštruačného cyklu – syndróm polycystických ovárií
Úvod
Syndróm polycystických ovárií (PCOS) je heterogénne a komplexné endokrinné ochorenie, ktoré v ženskej populácii patrí medzi najrozšírenejšie endokrinopatie a je najčastejšou príčinou hyperandrogenizmu, oligoanovulácie a infertility [1,2]. Pacientky majú zvýšené riziko rozvoja diabetes mellitus 2. typu (DM2T), kardiovaskulárnych ochorení, gestačného diabetes mellitus (GDM) a endometriálneho karcinómu schéma [3,4].

Syndróm, popísaný v roku 1935 Steinom a Leventhalom, sa vyznačoval morfologicky polycystickými ováriami (PCO), klinickými poruchami cyklu a fertility, príznakmi hyperandrogenémie a obezitou [5]. PCOS bol historicky považovaný za gynekologické ochorenie komplikované sprievodnou obezitou. Až v posledných desaťročiach vyšla najavo jeho jasná súvislosť s metabolickými ochoreniami vrátane DM2T. Okrem gynekológov patrí teda aj do starostlivosti internistov, diabetológov, endokrinológov a obezitológov [6].
Prevalencia a diagnostické kritériá fenotypov PCOS na základe rôznych kritérií
PCOS je pravdepodobne kontinuum fenotypov od ovulujúcich žien s laboratórne dokázanou hyperandrogenémiou a morfologickým nálezom PCO bez inzulínovej rezistencie cez ženy s rôznymi klinickými prejavmi hyperandrogenémie ako hirzutizmus, alopécia alebo akné relatívne bez porúch menštruačného cyklu až po ženy s chronickou anovuláciou, infertilitou a ťažkou inzulínovou rezistenciou [7]. Prevalencia PCOS sa líši v závislosti od kritérií hodnotenia. Podľa Rotterdamských kritérií je 2–3-krát vyššia (15–25 %) ako podľa NIH/NICHD (National Institute of Health/National Institute of Child Health and Human Disease) 6–8 % žien v kaukazskej populácii, kým podľa AES (Androgen Excess Society) odporúčaní je to 10–15 % [5,8]. Prevalencia v černošskej a hispánskej populácii je vyššia ako v kaukazskej [6].
Definícia PCOS je založená na prítomnosti hyperandrogenizmu, menštruačných porúch (chronickej oligo-anovulácie) a ultrasonografickom náleze PCO po vylúčení iných príčin hyperandrogenizmu [2,5,9]. Inzulínová rezistencia a s ňou asociovaná hyperinzulinémia patria medzi dôležité patogenetické faktory ovplyvňujúce hyperandrogenémiu u väčšiny žien s PCOS, hlavne obéznych, aj keď môžu byť prítomné aj u neobéznych žien s PCOS [9].
Diagnostické kritériá PCOS boli navrhnuté tromi skupinami: NIH/NICHD, ESHR/ASRM (European Society for Human Reproduction and Embryology/American Society for Reproductive Medicine) a AES tab. 1 [3,4,10]. Porovnanie rozdielnych diagnostických kritérií PCOS s následnými rozdielnymi fenotypmi uvádza tab. 2.
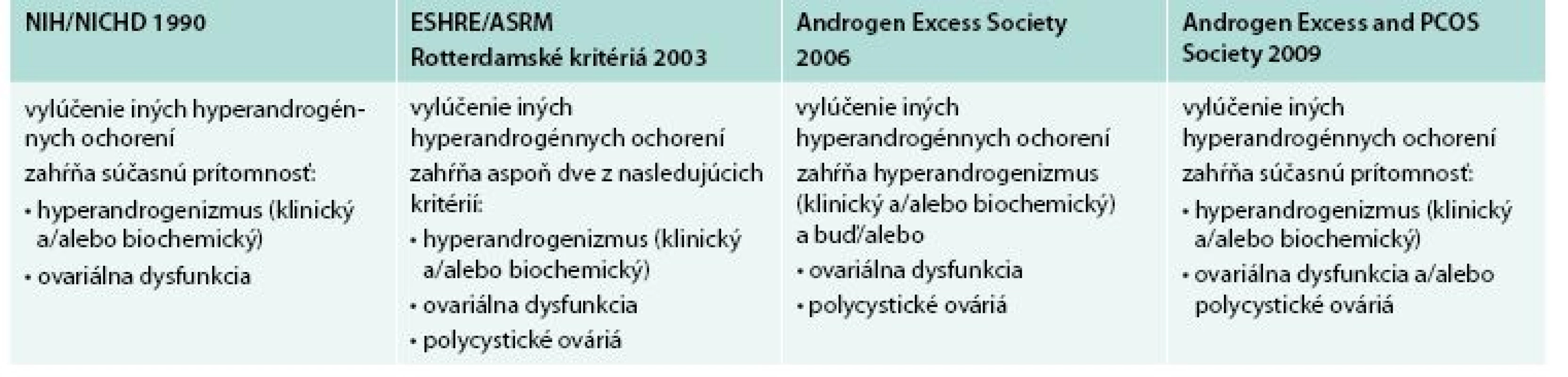
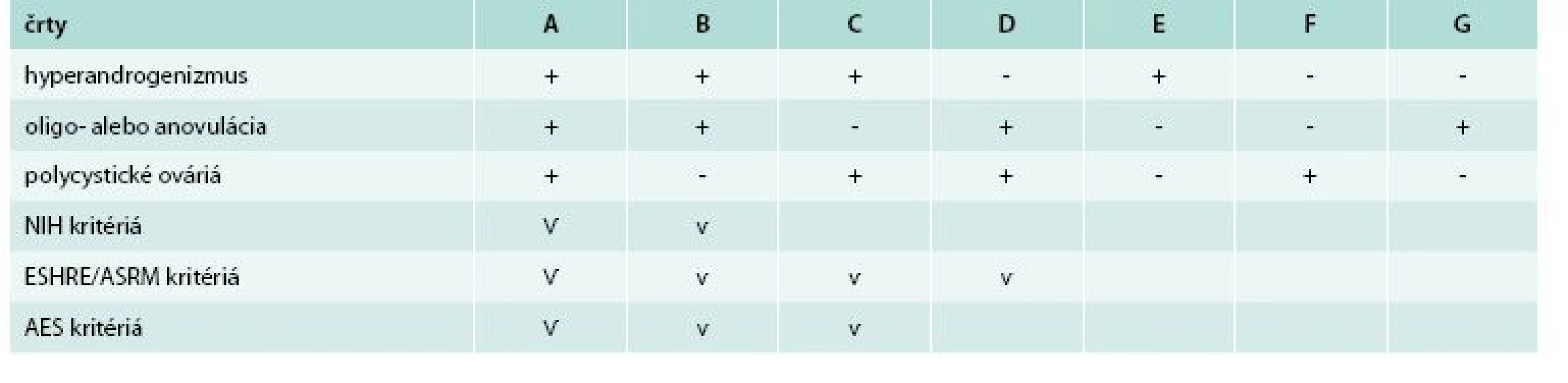
Pre zjednodušenie môže byť PCOS rozdelený na 4 reprodukčné fenotypy: PCOS s PCO (fenotyp A) alebo bez PCO (fenotyp B), biochemický/klinický hyperandrogenizmus s PCO, ale bez oligo/anovulácie (fenotyp C), alebo bez hyperandrogenizmu s PCO a oligo/anovuláciou (fenotyp D). Ostatné fenotypy zahŕňajú izolovanú prítomnosť hyperandrogenizmu (fenotyp E), PCO (fenotyp F) alebo oligo/anovulácie (fenotyp G) [11]. Hoci obezita a inzulínová rezistencia nie sú univerzálne a nie sú súčasťou definície, vyskytujú sa pri tomto syndróme veľmi často [12,13].
Klinické prejavy PCOS môžu byť rozdelené na 3 oblasti: reprodukčné poruchy, metabolické črty a psychologické dôsledky.
Reprodukčné poruchy PCOS
Reprodukčné poruchy zahŕňajú hyperandrogenizmus, menštruačné poruchy, infertilitu a tehotenské komplikácie ako včasné potraty, GDM, tehotenstvom indukovanú hypertenziu a novorodenecké komplikácie [11]. Ovariálna dysfunkcia, ktorá je prítomná u 70–80 % žien s PCOS, sa manifestuje ako oligomenorea a amenorea, čo je dôsledok chronickej anovulácie [14]. Oligomenorea je definovaná ako menštruačné cykly dlhšie ako 35 dní alebo menej ako 5 cyklov ročne, pričom cykly sú anovulačné. Primárna amenorea je definovaná ako chýbanie menštruácie od veku 15 rokov pri normálnom raste a vývoji sekundárnych pohlavných znakov [15]. Hoci 60 % žien s PCOS je fertilných, čas ku koncepcii je predĺžený. Obezita je nezávislý rizikový faktor infertility. Znižuje úspešnosť liečby infertility a zvyšuje tehotenské komplikácie vrátane potratov. Preto sa pred otehotnením odporúča pokles hmotnosti [14].
Metabolické črty reprodukčných fenotypov PCOS
V poslednom období vystupuje do popredia otázka súvislosti PCOS s metabolickými poruchami, predovšetkým s inzulínovou rezistenciou a obezitou. Keďže samotná etiopatogenéza PCOS nie je stále úplne objasnená, tým menej je jasné, koho a ako postihujú neskoré riziká PCOS, ku ktorým patrí DM2T, dyslipidémia, artériová hypertenzia, elevácia CRP a homocysteínu, porucha funkcie endotelu a hrubšia stena intima media. Nie je celkom jasné, či sa u žien s PCOS vyskytujú častejšie aj kardiovaskulárne príhody. Hlavne u obéznych žien je PCOS častejšie asociovaný s nealkoholovou steatohepatitídou, syndrómom spánkového apnoe a endometriálnym karcinómom [16,26].
Inzulínová rezistencia sa vyskytuje u 60–80 % žien s PCOS a u 95 % obéznych žien s PCOS. Tieto ženy majú inzulínovú rezistenciu nezávislú od obezity, ale obezita ju potencuje. Odhadovaná prevalencia metabolického syndrómu v populácii žien s klasickým PCOS v USA je 33–47 %, čo je 2–3-krát vyššie než u vekovo podobných kontrol. V ostatných krajinách je prevalencia metabolického syndrómu v populácii žien s PCOS nižšia, okolo 8–25 %, hoci po adjustácii na BMI je nižšia u neobéznych žien s PCOS [17].
PCOS je výrazný rizikový faktor poruchy glukózovej tolerancie a diabetes mellitus 2. typu. Inzulín-rezistentné pacientky s PCOS si udržiavajú svoju glykémiu vďaka kompenzačnej hypersekrécii inzulínu, čo vedie k riziku vyčerpania B-buniek [18,19]. PCOS je asociovaný s 5–8-násobným rizikom DM2T v porovnaní s vekovo a hmotnostne podobnými kontrolami bez ohľadu na etnicitu a geografickú polohu [18,20]. DM2T sa častejšie vyskytuje u obéznych žien s PCOS [9]. Konverzia z porušenej glukózovej tolerancie (PGT) na DM2T je u žien s PCOS 5–10-krát vyššia v porovnaní s vekovo porovnateľnou skupinou. Vyšší výskyt PGT a DM2T bol pozorovaný aj u štíhlych žien s PCOS [15]. Na druhej strane inzulínová rezistencia a DM2T sa nevyskytujú u všetkých žien s PCOS [21]. U 40 % žien s klasickým PCOS sa vyvinie PGT alebo DM2T do 4. dekády života [17]. Alarmujúci je výskyt PGT a DM2T už u 15 až 20-ročných dievčat s PCOS [17,21].
Ženy s PCOS majú vyššiu prevalenciu artériovej hypertenzie (10–40 %) v porovnaní s bežnou populáciou [5,18,22]. Retrospektívne štúdie potvrdili 4 až 11-krát signifikantne zvýšené riziko hypertenzie u žien s PCOS [20]. Avšak štúdie väčšinou nezohľadňovali obezitu ako rizikový faktor hypertenzie [18]. V niektorých štúdiách po adjustácii na BMI nebola asociácia medzi PCOS a hypertenziou jednoznačná [22]. Potenciálny mechanizmus hypertenzie pri PCOS zahŕňa endotelovú dysfunkciu so zvýšenou hladinou endotelínu 1 [5] a sekundárne potencovanú retenciu sodíka pri inzulínovej rezistencii s hyperinzulinémiou. Hyperandrogenémia je pri PCOS asociovaná s hypertenziou nezávisle od obezity a hyperinzulinémie. Zvýšená sympatiková aktivita taktiež prispieva k etiológii hypertenzie v tejto populácii žien. U žien s PCOS bola potvrdená signifikantná priama korelácia medzi aldosterónom a inzulinémiou nalačno, HOMA IR (index inzulínovej rezistencie), hsCRP (vysoko senzitívny C reaktívny proteín), hrúbkou intima media a priemerným krvným tlakom [22].
Dyslipidémia je najbežnejšou metabolickou abnormalitou u žien s PCOS, hoci jej typ a rozsah je variabilný [20,23]. Lipidové abnormality sa najčastejšie vyskytujú vo 4. dekáde života, čím prispievajú k faktorom zvýšeného kardiovaskulárneho rizika týchto žien. U žien s PCOS vekom výraznejšie stúpa hladina celkového a LDL-cholesterolu [24]. Paradoxné je, že väčšie rozdiely v porovnaní so zdravými kontrolami sú prítomné u mladých žien s PCOS, kým po 40.–45. roku sa rozdiely stierajú [16]. Najčastejšie sa vyskytuje tzv. aterogénny lipoproteínový fenotyp zahŕňajúci nízky HDL-cholesterol, zvýšené hladiny TAG a LDL-cholesterolu [5]. U žien s PCOS sú v porovnaní s kontrolami zvýšené malé denzné LDL-častice [25]. Prítomnosť malých denzných LDL častíc dokonca aj pri normálnom LDL-cholesterole je asociovaná s vyššou incidenciou koronárnej choroby srdca [24].
U žien s PCOS bola taktiež popísaná zvýšená prevalencia nealkoholovej steatózy pečene a steatohepatitídy [26,27]. Hlavnými faktormi steatózy u týchto žien sú obezita, inzulínová rezistencia a sprievodná hyperandrogenémia, ktorá je hlavnou črtou PCOS. Medzi dôležité terapeutické intervencie pri steatóze pečene u žien s PCOS patria zmena životného štýlu, pokles hmotnosti a z farmakologických modalít metformín, hoci stále neexistuje efektívna liečba nealkoholovej steatózy pečene [27].
PCOS je asociovaný s oxidačným stresom, pri ktorom je zvýšená produkcia voľných radikálov nasledovaná zníženou hladinou antioxidantov. Oxidačný stres sa pokladá za jeden z predispozičných faktorov rozvoja kardiovaskulárnych ochorení. Zvýšený oxidačný stres bol dokonca popísaný aj u štíhlych žien s PCOS. Pri nerovnováhe medzi oxidačnými a antioxidačnými faktormi v prospech prooxidačného stavu dochádza ku kumulácii ROS (reactive oxygen species) [24].
Dostupné dáta potvrdzujú u žien s PCOS častejší výskyt kardiovaskulárnych ochorení (KVO) [17]. Retrospektívne štúdie u žien s PCOS potvrdili 4 až 11-krát zvýšené riziko KVO [20]. U žien s PCOS sa udáva 5 až 7-násobné riziko rozvoja infarktu myokardu oproti vekovo porovnateľným kontrolám [18]. Ženy s nepravidelným menštruačným cyklom majú vyššie riziko nonfatálnej a fatálnej koronárnej choroby srdca. Nediabetické ženy s črtami PCOS majú signifikantne vyššiu prevalenciu KVO v porovnaní so ženami bez tohto fenotypu. Avšak väčšina súčasných dát je kontroverzná [22]. Podľa Wanga et al asociácia medzi nepravidelným menštruačným cyklom a zvýšeným rizikom kardiovaskulárnej mortality nebola po adjustácii na BMI štatisticky významná [28]. Tieto dáta sú v rozpore s metaanalýzou de Groota et al, ktorí popísali 2-násobne vyššie riziko koronárnej choroby srdca a cievnej mozgovej príhody u žien s PCOS v porovnaní so ženami bez PCOS aj po adjustácii na BMI [29]. Schmidt et al na základe prospektívnej 21-ročnej štúdie 35 žien s PCOS potvrdili vyššiu prevalenciu hypertenzie a vyššie hladiny triacylglycerolov (TAG). Prevalencia infarktu, cievnej mozgovej príhody, DM, karcinómov a mortality bola podobná ako u kontrolných žien s podobným BMI [30]. Na druhej strane Shaw et al v štúdii 104 postmenopauzálnych žien s klinickými črtami PCOS potvrdili, že boli častejšie diabetické, obézne, mali metabolický syndróm a častejšie angiograficky potvrdenú koronárnu chorobu srdca v porovnaní so ženami bez klinických prejavov PCOS [31].
Spánkové apnoe je nezávislým rizikovým faktorom KVO. Syndróm je asociovaný s inzulínovou rezistenciou, hypertenziou a zvýšenou hladinou proinflamačných a protrombotických faktorov, ktoré sú zahrnuté do aterogénneho procesu [22,26]. Je známa jeho nezávislá asociácia s inzulínovou rezistenciou a DM2T. U žien s PCOS sa popisuje jeho zvýšená prevalencia v porovnaní so ženami bez PCOS s podobnou hmotnosťou a vekom [26,32]. Podľa niektorých autorov je syndróm spánkového apnoe kľúčovým determinantom inzulínovej rezistencie a glukózovej intolerancie pri PCOS. Napriek vysokej prevalencii tohto syndrómu u žien s PCOS nie je známe, či jeho liečba môže upraviť kardiometabolické dôsledky a znížiť riziko skoršieho nástupu DM2T a KVO v tejto populácii [33].
Psychologické dôsledky PCOS
Dôsledky vyplývajúce z fenotypových zmien pri PCOS (akné, hirzutizmus, alopécia, obezita) spolu s infertilitou ovplyvňujú kvalitu života a majú nepriaznivý vplyv na psychické zdravie týchto žien. Ženy s PCOS sú viac náchylné k nedostatočnému sebavedomiu s častejším výskytom úzkosti, depresie, bipopárnej poruchy, anxiety a porúch príjmu potravy [6,14,26]. Pribúdajú dôkazy, že poruchy správania, predovšetkým ťažká depresia, sú nezávislými rizikovými faktormi KVO so zvýšenou prevalenciou u žien s PCOS. Štúdie popisujú zvýšený výskyt depresie a anxiety u žien s PCOS, u ktorých zhoršená kvalita života kvôli telesnému vzhľadu spôsobuje únavu, poruchy spánku, fóbiu, zmeny apetítu a prejedanie. Depresívne ženy s PCOS majú vyšší BMI a inzulínovú rezistenciu než ženy s PCOS bez depresie a bez nadbytku androgénov. Pokles hmotnosti môže viesť k úprave depresie a kvality života [17].
PCOS a gravidita
Glukózový metabolizmus je počas tehotenstva fyziologicky zmenený. Pri analýze tehotenstiev žien s PCOS a známou inzulínovou rezistenciou so ženami s PCOS bez inzulínovej rezistencie a ženami po asistovanej reprodukcii bola incidencia hypertenzie signifikantne vyššia u všetkých pacientok s PCOS, kým incidencia preeklampsie bola zvýšená len u žien s PCOS a inzulínovou rezistenciou. U pacientok s PCOS sa častejšie rozvinul GDM. Ženy s PCOS častejšie rodili sekciou a ich novorodenci častejšie vyžadovali intenzívnu starostlivosť. PCOS rovnako ako BMI nad 25 kg/m2 sú prediktormi GDM. Na druhej strane prevalencia PCOS je signifikantne vyššia u žien s anamnézou GDM [18]. Metaanalýza 27 štúdií zahŕňajúcich 4 982 žien s PCOS a 119 692 kontrol potvrdila signifikantne vyššie riziko rozvoja GDM, tehotenstvom indukovanej hypertenzie, preeklampsie, predčasného pôrodu a sekcie v porovnaní s kontrolami. Ich deti mali hranične signifikantne nižšiu pôrodnú hmotnosť [34]. U žien s PCOS, predovšetkým obéznych, sa uvádza zvýšený výskyt spontánnych potratov (30–50 %) [18]. Medzi potenciálne mechanizmy asociácie inzulínovej rezistencie a zvýšeného rizika včasných potratov patria zvýšená hladina PAI1 (riziko trombózy, čo môže viesť k placentárnej insuficiencii) a znížené hladiny glykodelínu, ktorý podporuje implantáciu embrya. Zvýšená placentárna inzulínová rezistencia priamo poškodzuje nutričnú výživu plodu a vedie k reštrikcii rastu plodu [35].
Asociácia PCOS s inými ochoreniami
Štúdie sledujúce ženy vo fertilnom veku poukázali na vyšší výskyt systémových autoimunitných ochorení. Hyperandrogenémia pozorovaná u žien s PCOS by ich teda mohla chrániť pred rozvojom autoimunitných ochorení. Stimulačný účinok estrogénov na imunitný systém by mohol byť inhibovaný progesterónom. Pacientky s PCOS majú v dôsledku oligo/anovulácie znížené hladiny progesterónu, čo by mohlo viesť k zvýšenej stimulácii imunitného systému s produkciou autoprotilátok. Literatúra uvádza kontroverzné údaje o asociácii medzi PCOS a autoimunitou [36]. U žien s PCOS bola dokumentovaná vyššia prevalencia autoimunitnej tyreoiditídy. Janssen et al v prospektívnej štúdii 175 pacientok s PCOS potvrdili 3-násobne vyššiu prevalenciu autoimunitnej tyreoiditídy (26,9 %) oproti kontrolám (8,3 %). Vyšetrenie antiovariálnych protilátok priamo v humánnych ováriách potvrdilo signifikantne vyššie koncentrácie u žien s PCOS než v kontrolnom súbore. Opakované punkcie ovariálneho tkaniva a mikrotraumatické zmeny môžu odhaliť ovariálne antigény, doteraz neznáme pre imunitný systém a indukovať odpoveď. U žien s PCOS boli popísané aj signifikantne vyššie hladiny protilátok proti FSH [37].
U žien s PCOS sa zistila normálna alebo zvýšená kostná minerálová denzita [38]. Nie sú údaje o tom, že by hirzutické ženy mali zvýšené riziko fraktúr [20]. Zvýšené hladiny estradiolu a testosterónu u žien s PCOS môžu viesť k vyššiemu píku kostnej masy a chrániť pred kostnou stratou. Štúdie potvrdili pozitívnu asociáciu medzi testosterónom, estradiolom a kostnou minerálovou denzitou [20,38]. Pri PCOS bola potvrdená od BMI nezávislá korelácia medzi inzulínom a kostnou minerálovou denzitou [20].
Ženy s PCOS majú 3 až 5-násobne vyššie riziko endometriálneho karcinómu [32,39,43]. Haoula et al na základe systematického prehľadu 14 komparatívnych a non-komparatívnych štúdií uvádzajú u žien s PCOS 3-násobne zvýšené riziko karcinómu (OR 2,89) [40]. PCOS zahŕňa väčšinu endokrinných rizikových faktorov endometriálneho karcinómu: chronickú hyperinzulinémiu, nízky IGFBP1 (insulin growth factor binding protein 1), nízky SHBG (sex hormone binding protein), zvýšené androgény a deficit progesterónu v luteálnej fáze, ktorý je hlavným rizikovým faktorom endometriálneho karcinómu u premenopauzálnych žien. Hoci PCOS zohráva kľúčovú úlohu pri rozvoji endometriálneho karcinómu, karcinóm sa môže vyskytovať aj u žien bez PCOS. V premenopauzálnom období to môžu byť iné príčiny chronickej anovulácie a deficitu progesterónu. V postmenopauzálnom období, keď je zastavená ovariálna produkcia progesterónu u žien s/bez PCOS, stúpa riziko karcinómu v dôsledku vzostupu estrogénov asociovaného s obezitou a poklesu IGFBP1 nezávisle od ovariálneho hyperandrogenizmu [41]. Nie je jasné, či samotná inzulínová rezistencia zohráva úlohu v rozvoji endometriálneho karcinómu, avšak niektoré štúdie to potvrdzujú. Hoci dáta štúdií s inzulínovými senzitizérmi sú limitujúce, potvrdzujú, že podávanie týchto liekov zvyšuje frekvenciu ovulácie s navodením menštruačného krvácania, čo vedie k najmenej 6 ovulačným menštruačným cyklom ročne u 55–85 % liečených žien s PCOS. Aj keď nebola realizovaná žiadna prospektívna štúdia sledujúca efekt inzulínových senzitizérov na prevenciu endometriálneho karcinómu, táto frekvencia ovulácie je konzistentná so súčasnými štandardami v prevencii endometriálneho karcinómu u žien s PCOS [39]. V štúdii Galazisa et al boli proteínové biomarkery u žien s PCOS podobné ako u žien s endometriálnym karcinómom. Patria sem transgelín, pyruvátkináza, glutatión S-transferáza P, leucín aminopeptidáza, peptidil-prolyl cis-transimzomeráza a cyklofilín A [42]. Intermitetntná indukcia ovulácie rôznymi preparátmi (progestagénmi, orálnou antikoncepciou) cyklicky alebo kontinuálne vedie k prevencii abnormálnej proliferácii endometria [43].
Ženy s PCOS sú už v mladom veku vystavené zvýšenému riziku rozvoja DM2T a KVO. Toto riziko je potencované prehlbujúcou sa periférnou inzulínovou rezistenciou a poruchou sekrécie inzulínu. Hlavnou abnormalitou v účinku inzulínu pri PCOS je postreceptorový defekt v inzulínovej signalizácii [15]. Výsledky štúdií potvrdzujú, že nie všetky tkanivá sú inzulín-rezistentné. Hoci molekulárne mechanizmy účinku inzulínu nie sú stále úplne objasnené, je známe, že zahŕňajú nielen klasické inzulín-senzitívne tkanivá (pečeň, tukové a kostrové tkanivo), ale aj ováriá, u ktorých sa potvrdila poškodená inzulínová signalizácia [44]. Kompenzačná hyperinzulinémia zohráva dôležitú úlohu pri nadmernej produkcii androgénov. Avšak pribúdajú dôkazy, že samotný nadbytok androgénov naopak prispieva k rozvoju inzulínovej rezistencie prostredníctvom fosforylácie intracelulárnych signálnych proteínov, čo vysvetľuje bludný kruh medzi hyperandrogenémiou a inzulínovou rezistenciou pri rozvoji hormonálneho a metabolického fenotypu PCOS [21].
MUDr. Ingrid Dravecká, PhD.
ingrid.dravecka@upjs.sk
I. interná klinika LF UPJŠ a UN L. Pasteura,
Košice,
Slovenská republika
www.fnlp.sk
Doručeno do redakce 21. 12. 2015
Přijato po recenzi 14. 2. 2015
Sources
1. de Melo AS, Dias SV, Cavalli Rde C et al. Pathogenesis of polycystic ovary syndrome: multifactorial assessment from the foetal stage to menopause. Reproduction 2015; 150(1): R11-R24.
2. Ben-Shlomo I, Younis JS. Basic research in PCOS: are we reaching new frontiers? Reprod Biomed Online 2014; 28(6): 669–683.
3. Jayasena CN, Franks S. The management of patients with polycystic ovary syndrome. Nat Rev Endocrinol 2014; 10(10): 624–638.
4. Moran LJ, Norman RJ, Teede HJ et al. Metabolic risk in PCOS: phenotype and adiposity impact. Trends Endocrinol Metab 2015; 26(3): 136–143.
5. Sirmans SM, Pate KA. Epidemiology, diagnosis, and management of polycystic ovary syndrome. Clin Epidemiol 2013; 6 : 1–13.
6. Svačina Š. Metabolické aspekty syndromu polycystických ovárií. Vnitř Lék 2002; 48(12): 1142–1146.
7. Stárka L, Cermáková I, Dusková M et al. Hormonal Profile of Men with Premature Balding. Exp Clin Endocrinol Diabetes 2004; 112(1): 24–28.
8. Livadas S, Diamanti-Kandarakis E. Polycystic Ovary Syndrome: Definitions, Phenotypes and Diagnosis Approach. Front Horm Res 2013; 40 : 1–21.
9. Pasquali R, Gamberini A. Targeting insulin sensitivity in the treatment of polycystic ovary syndrome. Expert Opin Ther Targets 2009; 13(10): 1205–1226.
10. [The Rotterdam ESHRE/ASRM-sponsored PCOS consensus Workshop Group]. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome (PCOS). Human Reprod 2004; 19(1): 41–47.
11. Moran L, Teede H. Metabolic features of the reproductive phenotypes of polycystic ovary syndrome. Human Reprod Update 2009; 15(4): 477–488.
12. Evidence-based Methology Workshop on Polycystic Ovary Syndrome. National Institutes of Health (NIH). 3–5.12. 2012. Dostupné z WWW: <https://prevention.nih.gov/programs-events/pathways-to-prevention/past-workshops/pcos>.
13. Badawy A, Elnashar A. Treatment options for polycystic ovary syndrome. Int J Womens Health 2011; 3 : 25–35.
14. Nandi A, Chen Z, Patel R et al. Polycystic Ovary Syndrome. Endocrinol Metab Clin N Am 2014; 43(1): 123–147.
15. Diamanti-Kandarakis E, Dunaif A. Insulin Resistance and the Polycystic Ovary Syndrome Revisited: An Update on Mechanisms and Implications. Endocrine Reviews 2012; 33(6): 981–1030.
16. Vrbíkova J. Sexageny a lipidy u žen. Interní Med Prax 2005; 7(10): 430–432.
17. Wild RA, Carmina E, Diamanti-Kandarakis E et al. Assessment of Cardiovascular Risk and Prevention of Cardiovascular Disease in Women with the Polycystic Ovary Syndrome: A Consensus Statement by the Androgen Excess and Polycystic Ovary Syndrome (AE-PCOS) Society. J Clin Endocrinol Metab 2010; 95(5): 2038–2049.
18. Schröder AK, Tauchert S, Ortmann O et al. Insulin resistance in patients with polycystic ovary syndrome. Ann Med 2004; 36(6): 426–439.
19. Goodarzi MO, Korenman SG. The importance of insulin resistance in polycystic ovary syndrome. Fertil Steril 2003; 80(2): 255–258.
20. Glintborg D, Andersen M. An update on the pathogenesis, inflammation, and metabolism in hirsutism and polycystic ovary syndrome. Gynecol Endocrinol 2010; 26(4): 281–296.
21. Čermáková I, Vrbíková J, Dušková M et al. Sexuální steroidy a inzulinová rezistence. DMEV 2003; 6(3): 143–148.
22. Bajuk Studen K, Jensterie Sever M, Pfeifer M. Cardiovascular risk and subclinical cardiovascular disease in polycystic ovary syndrome. Front Horm Res 2013; 40 : 64–82.
23. Rocha MP, Marcondes JA, Barcellos CR et al. Dyslipidemia in women with polycystic ovary syndrome: incidence, pattern and predictors. Gynecol Endocrinol 2010; 27(10): 814–819.
24. Macut D, Bjekiuć-Macut J, Savić-Radjević A. Dyslipidemia and oxidative stress in PCOS. Front Horm Res 2013; 40 : 51–63.
25. Kim JJ, Choi YM. Dyslipidemia in women with polycystic ovary syndrome. Obstet Gynecol Sci 2013; 56(3): 137–142.
26. Vrbíková J. Syndrom polycystických ovarií. Vnitř Lék 2015; 61(10): 886–895.
27. Vassilatou E. Nonalcoholic fatty liver disease and polycystic ovary syndrome. World J Gastroenterol 2014; 20(26): 8351–8363.
28. Wang ET, Cirillo PM, Vittinghoff E et al. Menstrual Irregularity and Cardiovascular Mortality. J Clin Endocrinol Metab 2011; 96(1): E114-E118.
29. de Groot PC, Dekkers OM, Romijn JA et al. PCOS, coronary heart disease, stroke and the influence of obesity: a systematic review and meta-analysis. Human Reprod Update 2011; 17(4): 495–500.
30. Schmidt J, Landin-Wilhelmsen K, Brännström M et al. Cardiovascular Disease and Risk Factors in PCOS Women of Postmenopausal Age: A 21-Year Controlled Follow-Up Study. J Clin Endocrinol Metab 2011; 96(12): 3794–3803.
31. Shaw LJ, Bairey Merz CN, Azziz R et al. Postmenopasual women with a history of irregular menses and elevated androgen measurements at high risk for worsening cardiovascular event-free survival: results from the National Institutes of Health – National Heart, Lung, and Blood Institute sponsored Women´s Ischemia Syndrome Evaluation. J Clin Endocrinol Metab 2008; 93(4): 1276–1284.
32. Setji TL, Brown AJ. Polycystic Ovary Syndrome: Update on Diagnosis and Treatment. AMJMED 2014; 127(10): 912–919.
33. Tasali E, Chapotot F, Leproult R et al. Treatment of Obstructive Sleep Apnea Improves Cardiometabolic Function in Young Obese Women with Polycystic Ovary Syndrome. J Clin Endocrinol Metab 2011; 96(2): 365–374.
34. Qin JZ et al. Obstetric complications in women with polycystic ovary syndrome: a systematic review and meta-analysis. Reprod Biol Endocrinol 2013; 11 : 56.
35. Diamanti-Kandarakis E, Christakou CD, Kandaraki E et al. Metformin: an old medication of new fashion: evolving new molecular mechanisms and clinical implications in polycystic ovary syndrome. Eur J Endocrinol 2010; 162(2): 193–212.
36. Petríková J, Lazúrová I, Yehuda S. Polycystic ovary syndrome and autoimmunity. EJIM 2010; 21(5): 369–371.
37. Janssen OE1, Mehlmauer N, Hahn S et al. High prevalence of autoimmune thyroiditis in patients with polycystic ovary syndrome. Eur J Endocrinol 2004; 150(3): 363–369.
38. Glintborg D, Andersen M, Hagen C et al. Association of Pioglitazone Treatment with Decreased Bone Mineral Density in Obese Premenopausal Patients with Polycystic Ovary Syndrome: A Randomized, Placebo-Controlled Trial. J Clin Endocrinol Metab 2008; 93(5): 1696–1701.
39. Diamanti-Kandarakis E, Baillargeon JP, Iuorno MJ et al. A Modern Medical Quandary: Polycystic Ovary Syndrome, Insulin Resistance, and Oral Contraceptive Pills. J Clin Endocrinol Metab 2003; 88(5): 1927–1932.
40. Haoula Z, Salman M, Atiomo W. Evaluating the Association Between Endometrial Cancer and Polycystic Ovary Syndrome. Hum Reprod 2012; 27(5): 1327–1331.
41. Kaas R, Lukanova A, Kurzer MS. Obesity, Endogenous Hormones and Endometrial Cancer Risk: A Synthetic Review. Cancer Epidemiol Biomarkers Prev 2002; 11(12): 1531–1543.
42. Galazis N, Afxentiou T, Xenophontos M et al. Proteomic biomarkers of type 2 diabetes mellitus risk in women with polycystic ovary syndrome. Eur J Endocrinol 2013; 168(2): R33-R43.
43. Saha L, Kaur S, Saha PK. Pharmacotherapy of polycystic ovary syndrome – an update. Fundam Clin Pharmacol 2012; 26(1): 54–62.
44. Diamanti-Kandarakis E, Papavassiliou AG. Molecular mechanisms of insulin resistance in polycystic ovary syndrome. Trends Mol Med 2006; 12(7): 324–332.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2016 Issue 5
-
All articles in this issue
- Význam merania obehových časov a elasticity pečene v porovnaní s MELD pri odhade jednoročného rizika nepriaznivého priebehu klinicky diagnostikovanej cirhózy
- Diagnostika cystické fibrózy u dospělých
- Hyperkalcemie, příznaky, diferenciální diagnostika a léčba aneb důležitost vyšetřování kalcia
- Idiopatické střevní záněty jako protrombotický stav
- Klinické dôsledky syndrómu polycystických ovárií
- Léčba rituximabem jako výzva k prevenci infekčních komplikací
- Dokáže rybí olej zlepšit hojení ran v chirurgii?
- Využití nových léků v primoterapii mnohočetného myelomu
- Účinnost léčby lokální reziduální neoplazie za standardizovaných podmínek
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Hyperkalcemie, příznaky, diferenciální diagnostika a léčba aneb důležitost vyšetřování kalcia
- Diagnostika cystické fibrózy u dospělých
- Dokáže rybí olej zlepšit hojení ran v chirurgii?
- Význam merania obehových časov a elasticity pečene v porovnaní s MELD pri odhade jednoročného rizika nepriaznivého priebehu klinicky diagnostikovanej cirhózy
