Současné možnosti sledování efektivnosti terapie hyponatremie
Present possibilities of monitoring the effectiveness of hyponatremia therapy
Changes to the overall volume of body water and acid base equilibrium can be reflected in the values of differences and ratios relating to serum concentrations of natrium and chlorides. Both these quantities can be used for patients with hyponatremia in the hyponatremia differential diagnosis. This paper presents a case study which is an example of the clinical use of differences in and ratios of serum concentrations of natrium and chlorides when monitoring effectiveness of the therapy.
Key words:
acid base equilibrium – depletion hyponatremia – differential diagnosis of hyponatremia – dilution hyponatremia
Authors:
Miroslava Horáčková; Lenka Vítová; Ondřej Pátek; Otto Schück
Authors‘ workplace:
Interní klinika 2. LF UK a FN v Motole, Praha
Published in:
Vnitř Lék 2016; 62(Suppl 6): 106-111
Category:
Case Reports
Overview
Změny celkového objemu tělesné vody a acidobazické rovnováhy se mohou současně projevovat v hodnotách diference a poměru sérových koncentrací natria a chloridů. Obou těchto veličin lze využít u pacientů s hyponatremií v diferenciální diagnóze hyponatremie. V předkládané práci uvádíme kazuistiku, která je příkladem klinického využití diference a poměru sérových koncentrací natria a chloridů při monitorování efektivity terapie.
Klíčová slova:
acidobazická rovnováha – depleční hyponatremie – diferenciální diagnóza hyponatremie – diluční hyponatremie
Úvod
Hyponatremie často vyžaduje rychlé rozhodnutí o způsobu terapie, zejména je-li provázena neurologickými příznaky svědčícími pro mozkový edém. Biochemická hodnota natremie se nemusí nutně krýt s klinickou závažností této elektrolytové poruchy. Efektivitu zvolené terapie je třeba často vyhodnocovat, přičemž pouhé monitorování natremie může být v rozporu s klinickým výsledkem užité léčby. Důležitým aspektem je rovněž diferenciální diagnóza hyponatremie. Při počáteční volbě léčby sice nezbývá čas k získání anamnestických a vyhodnocení doplňujících laboratorních údajů nezbytných k diferenciální diagnóze, to však neznamená, že je možné opomenout zajištění důležitých klinicko-laboratorních údajů, které později umožní rekonstruovat vznik a analyzovat příčiny hyponatremie.
V naší předchozí práci jsme se podrobně věnovali využití diference a poměru sérových koncentrací natria a chloridů u pacientů s hyponatremií v diferenciální diagnóze hyponatremie [1]. V předkládané práci uvádíme kazuistiku, která je příkladem klinického využití těchto veličin při monitorování efektivity terapie a zároveň je ukázkou diferenciálně diagnostického rozboru, který vychází z dalších laboratorních dat získávaných průběžně od počátku terapeutické intervence.
Popis případu
62letého muže dopravila rychlá záchranná služba na oddělení urgentního příjmu FN pro zhoršení dušnosti. Anamnestické údaje jsme čerpali ze starší dokumentace a objektivní anamnézy získané od družky a později je doplnili i údaji zjištěnými přímo od pacienta. Pacient kouřil od mládí až doposud nejméně 20 cigaret za den. Udával nejméně 6 let trvající námahovou dušnost a několik let měl chronický produktivní kašel. V posledních 6 dnech před přijetím se dušnost zásadně zhoršila, byl dušný i v klidu na lůžku. Před 9 lety byla zjištěna hypertenze a před 8 lety diabetes mellitus 2. typu. Před 6 lety byl hospitalizován pro tachyarytmii, jejíž původ byl shledán v přerušení terapie betablokátorem. Užíval řadu léků, ale jejich názvy, gramáž a způsob užívání si nepamatoval. Po doplnění objektivní anamnézy jsme zjistili, že měl v pravidelné medikaci Stadamet (metformin), Amaryl (glimepirid), Torvacard (atorvastatin), Verospiron (spironolakton) a Furon (furosemid). Na cílený dotaz popřel on sám i jeho družka zvracení a průjem v recentní anamnéze. Jeho družka navíc uvedla, že nejméně týden prakticky nic nejedl a nepil, celé dny prospal. Výrazně se zhoršila stabilita po vertikalizaci. Při pokusu o chůzi padal.
Verbální kontakt s pacientem byl obtížný pro somnolenci. Byl probuditelný, na cílený dotaz jednoslovně odpovídal a opět usínal. Vedle významně zanedbané osobní hygieny byly přítomny příznaky ventilační insuficience – tachypnoe 36 dechů/min, provázené poslechovým nálezem výrazně oslabeného dýchání nad oběma plicními křídly, forsírovaným a prodlouženým exspiriem s četnými pískoty a vrzoty na vrcholu exspiria. Vodorovnou polohu toleroval bez problému, neměl přeplněné krční žíly a nebyla vyjádřena cyanóza rtů a sliznice dutiny ústní. Akce srdeční byla pravidelná a na monitoru jsme zaznamenali sinusovou tachykardii 90/min. Krevní tlak byl 152/81 mm Hg. Jeho tělesná teplota byla 37,1 °C. Při významné centrální obezitě bylo břicho špatně prohmatné, játra a slezina nebyly s určitostí hmatné. Undulační fenomén byl negativní. Bérce byly bez otoků a neshledali jsme prosáknutí podkoží stěny břišní, sakrální krajiny ani dorsální strany stehen.
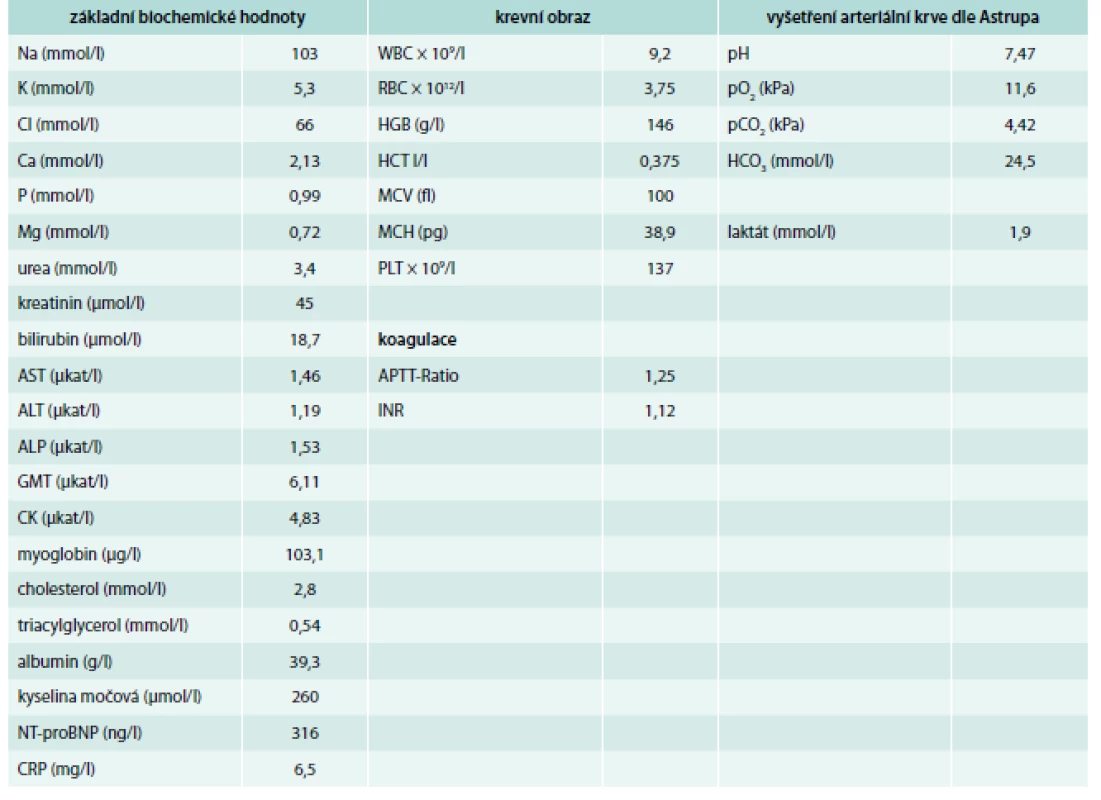
Na vstupně provedeném RTG hrudníku bylo srdce fyziologické velikosti, nebyla prokázána bronchopneumonická infiltrace, či jiné ložiskové změny v plicním parenchymu. Bronchovaskulární kresba byla diskrétně zvýšená. Vstupní laboratorní hodnoty jsou uvedeny v tab. 1.
Řešení a monitorace
Pacient byl první 3 hodiny pobytu léčen na lůžku urgentního příjmu. Zde dostal do žíly 20 mg furosemidu, pak F1/1 250 ml a F1/1 100 ml s 80 mg solumedrolu. Jakmile byla zjištěna hluboká hyponatremie, byly opětovně odebrány krev a moč k vyšetření elektrolytů, urey, kreatininu a osmolality v centrální laboratoři. Rovněž byla odebrána arteriální krev k vyšetření parametrů acidobazické rovnováhy, parciálních tlaků krevních plynů a laktátu. Rozšířené laboratorní vyšetření krve bylo provedeno následující den. Tyto laboratorní hodnoty jsou uvedeny v tab. 1.
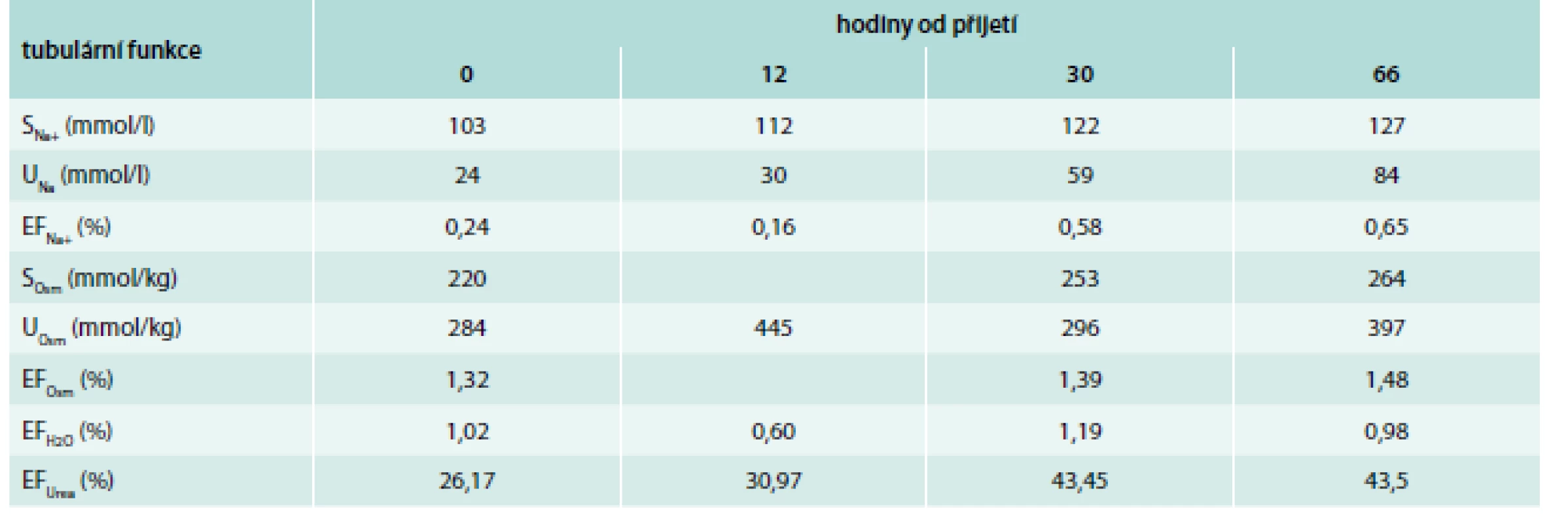
Další postup řešil lékař metabolické jednotky. Iniciálně bylo aplikováno 100 ml 3% NaCl za 1 hodinu a po kontrole natremie v bedside laboratorním přístroji byl podáván 3% roztok NaCl (celkem 600 ml za dobu 12 hodin). V následujících 4 dnech byla denně podávána infuze F1/1 1 000 ml/24 hod. Vývoj natrio-chloridové diference společně s natremií je uveden v grafu 1. Vývoj pH krve a natrio-chloridového poměru je uveden na grafu 2. Vývoj tubulárních funkcí v průběhu 66 hodin od iniciace terapie uvádí tab. 2.


Kromě terapie elektrolytové poruchy byl léčen antibiotiky (amoxicilin-klavulanát), kontinuálně byl podáván aminofylin a v 4hodinových intervalech inhalačně mukolytika.
Diferenciálně diagnostický rozbor
Hyponatremii jsme klasifikovali podle guideline (European practice guideline on diagnosis and treatment of hyponatremia) pro diagnózu a terapii [2]. Prvním krokem v klasifikaci hyponatremie je odlišení hypotonické hyponatremie od formy normotonické a hypertonické. Změřená osmolalita plazmy < 275 mmol/kg je vždy indikátorem hypotonické hyponatremie, protože efektivní osmolalita nemůže být nikdy vyšší než osmolalita totální (změřená). Změřená osmolalita našeho pacienta byla 220 mmol/kg a jednoznačně potvrdila hypotonickou formu. Absolutní hodnota natremie 103 mmol/l svědčila pro hlubokou (extrémní) úroveň hyponatremie, jež je spojena častěji s příznaky mozkového edému a vyžaduje pečlivou monitoraci při korekci [3]. Pro vyhodnocení rizika osmotického demyelinizačního syndromu je velmi důležité rozlišení akutní a chronické hyponatremie [4]. Hyponatremičtí pacienti se mohou klinicky manifestovat příznaky mozkového edému. Pokud tomu tak je, klasifikujeme hyponatremii jako symptomatickou. Příznaky edému mozku jsou častěji přítomny u akutní hyponatremie, při níž se elektrolytová porucha rozvíjí rychle po dobu 48 hodin. Příznaky mozkového edému při akutní hyponatremii se projevují jako nauzea bez doprovodu zvracení, zmatenost, bolesti hlavy, zvracení, kardiorespirační tíseň, abnormální somnolence, epileptické záchvaty a kóma (Glasgow Coma Scale ≤ 8). Při akutní hyponatremii není dostatek času k nastolení adaptivních procesů. Adaptivní procesy spočívají v redukci počtu osmoticky aktivních solutů (draslík a organické soluty) v mozkových buňkách s cílem obnovení původního objemu mozkové hmoty. Nastolení těchto adaptivních procesů potřebuje 24–48 hodin [5]. Nicméně také nemocní s chronickou hyponatremií se projevují subtilními příznaky, které lze přičíst mozkovému edému. Takovými příznaky jsou porucha chůze, pády, porucha koncentrace pozornosti a kognitivní deficit [6]. Příznaky akutní a chronické hyponatremie se mohou navíc překrývat [7]. Klasifikace symptomů svědčících pro mozkový edém je kvalifikována jako těžká nebo středně těžká. Tato klasifikace je podložena klinickou zkušeností, podle níž nemocní s těžkou symptomatickou akutní formou hyponatremie umírají častěji v porovnání s hyponatremickými pacienty se středně těžkou symptomatologií [8,9]. Středně těžké příznaky edému mozku jsou méně často spojeny s rizikem mortality. Pokyny pro terapii hyponatremie úmyslně opomíjejí kategorii asymptomatické hyponatremie, protože se předpokládá, že každý hyponatremický pacient má přinejmenším subtilní příznaky edému mozku a jejich opomenutí může vést k podcenění klinické závažnosti hyponatremie [2].
U našeho pacienta jsme s jistotou nevěděli, jak rychle se natremie rozvíjela, a proto jsme ji vyhodnotili jako hyponatremii chronickou. Poruchu vědomí, která se projevovala zvýšenou somnolencí (bez prokazatelné hyperkapnie a hypoxemie, které by mohly poruchu vědomí vysvětlit), nestabilitu po vertikalizaci spojenou s pády při pokusu o chůzi a mnesticko-kognitivní deficit, kterým se projevoval při vstupním klinickém vyšetření, jsme kvalifikovali jako příznaky mozkového edému a hyponatremii jako symptomatickou. Chronická hyponatremie je podstatně častější a terapie má být vedena s cílem zabránit rozvoji osmotické demyelinizace [10,11].
Zcela zásadním postupem je vyhodnocení volumového stavu pacienta, který je důležitým aspektem diferenciální diagnózy hyponatremie. Klinické vyšetření a výsledky pomocných laboratorních a RTG vyšetření hrudníku svědčily u našeho pacienta pro euvolemickou formu hyponatremie (systolická hypertenze, tolerance vodorovné polohy, nepřítomnost poslechového a RTG nálezu plicní kongesce, nevýznamné zvýšení NT-proBNP). Byli jsme si však vědomi toho, že se tradiční diagnostické algoritmy, které se opírají o klinické vyhodnocení volumového stavu [12] vyznačují velmi nízkou senzitivitou a specificitou [13,14]. Také není zcela jasné, zda je hodnocení vztaženo k objemu extracelulární tekutiny, efektivnímu cirkulujícímu objemu nebo k objemu celkové tělesné vody. Pro volbu léčebné strategie je však důležité přesně posoudit, zda se jedná o hyponatremii spojenou s deplecí objemu, dilucí solutů při významné retenci bezsolutové vody, nebo dokonce o poruchu kombinovanou. Kombinované poruchy jsou velmi časté a jejich analýza vyžaduje čas a doplňující anamnestické a laboratorní údaje, které klinik nemá k dispozici v době, v níž se musí urgentně rozhodnout pro způsobu terapie.
V naší předchozí práci [1] jsme v modelech patologických stavů spojených s hyponatremií a odchylkami v acidobazické rovnováze (ABR) zkoumali souvislost mezi změnami volumu tělních tekutin a acidobazické rovnováhy a odvozovali, jak dalece může analýza kombinací obou poruch napomoci k diferenciální diagnóze různých forem hyponatremie. Rozlišili jsme poruchy, které se vyznačují retencí bezsolutové vody (hyponatremie spojená s diluční acidózou), retencí sodíku v kombinaci s retencí vody (diluční hyponatremie spojená s diluční a hyperchloremickou acidózou), deplecí sodíku v kombinaci s deplecí vody (depleční hyponatremie spojená s depleční hypochloremickou alkalózou) a kombinace diluce a deplece (hyponatremie, která může být spojena s různými odchylkami ABR). Normální hodnota SNa+ – SCl- se pohybuje u zdravých dospělých jedinců v rozmezí 32–38 mmol/l a SNa+/SCl– v rozmezí 1,29–1,37, dle výsledků naší centrální laboratoře v kontrolní skupině [15]. Tyto údaje jsou jednoduše zjistitelné a vyžadují pouze přesné změřené sérové koncentrace elektrolytů. U hyponatremických pacientů v podmínkách urgentního příjmu, v nichž máme velmi málo informací, a je nutné předjímat rychlou progresi symptomů mozkového edému spojenou s rizikem náhlé smrti, je tato pomůcka velmi užitečná.
Pro diluční komponentu hyponatremie svědčil nález močové osmolality (UOsm), který byl při přijetí 284 mmol/kg při SNa+ 103 mmol/l. Pro depleční komponentu hyponatremie svědčil nález výrazně zvýšeného SNa+/SCl- (1,56), který podporoval předpoklad deplece Na+ a Cl- provázené rozvojem hypochloremické metabolické alkalózy. Hodnota SNa+ – SCl- byla ještě v mezích normy (37 mmol/l), ale při její horní hranici.
Při vyšetření ABR podle Astrupa bylo zjištěno zvýšení pH (alkalóza) při lehkém snížení pCO2 a normální koncentraci SHCO3-. Tento nález odpovídal respirační alkalóze, která nebyla renálně kompenzovaná snížením SHCO3-, a mohl být podmíněn buď nedostatečně dlouhou dobou trvání respirační alkalózy (což z celkového klinického obrazu bylo nepravděpodobné), nebo kombinací respirační alkalózy s metabolickou alkalózou. Z výše uvedeného nálezu výrazného a přetrvávajícího zvýšení SNa+/SCl - lze soudit, že v odchylce ABR od normy se významně uplatňovala hypochloremická metabolická alkalóza, která je součástí depleční hyponatremie. Navíc při revizi ABR dle Astrupa byla zjištěna hodnota SHCO3- 26,7 mmol/l. Nález SNa+ – SCl- nepřesahující horní hranici normy byl zřejmě dán tím, že stimuly vedoucí k hypovolemii (deplece) a hypervolemii (diluce) se prakticky rušily. Z těchto důvodů jsme hyponatremii u našeho pacienta hodnotili jako kombinovanou.
Kombinovaná dilučně-depleční hyponatremie vede zpravidla k extrémnímu snížení natremie, protože kombinace veličin vedoucích současně k diluci a depleci má na rozvoj hyponatremie aditivní efekt. Na druhé straně může dilučně-depleční hyponatremie překvapit překotně rychlou korekcí. Překotně rychlá korekce hyponatremie je pak spojena s vysokým rizikem osmotického demyelinizačního syndromu. Korekce natremie by neměla podle pokynů pro terapii chronické hyponatremie přestoupit 10 mmol/l za prvních 24 hodin a 18 mmol/l za prvních 48 hodin terapie [2].
Naším terapeutickým cílem bylo co nejrychlejší dosažení ústupu projevů mozkového edému. Proto jsme v prvních 12 hodin podávali infuzní roztok 3% NaCl, jehož úvodní rychlost aplikace byla propočtena podle Androgueovy-Madiasovy rovnice [5]. Hodnota natremie rostla příliš rychle (9 mmol/l za 12 hod). V té době jsme již měli k dispozici propočet tubulárních frakčních exkrecí. Výsledky svědčily pro vystupňovanou aktivitu renin-angiotenzin-aldosteronové osy. Frakční exkrece sérového Na+ byla významně snížená na 0,16 % (norma 0,4–1,2 %). Tento nález svědčil pro renální úsilí šetřit sodíkem a spolu s frakční exkrecí urey, sníženou pod kritickou hranici 30 %, dokládal přítomnost depleční složky hyponatremie. Na základě revize hodnot parametrů ABR (HCO3- 26,7 mmol/l) a významně zvýšeného Na+/Cl-, který potvrzoval metabolickou alkalózu, jsme se rozhodli pro suplementaci objemu v podobě F 1/1 (má acidifikační účinek) v opatrném dávkování 1 000 ml/24 hod. Vyšetření tubulárních funkcí dále prokázalo snížení frakční exkrece celkové vody. Činila pouze 0,6 % (norma 1–2 %). Tento nález spolu s hodnotou UOsm 445 mosm/kg nasvědčoval pro neschopnost distálního nefronu vylučovat dostatečné množství bezsolutové vody a aktivaci antidiuretického hormonu (ADH). Při hodnotě natremie 112 mmol/l by měla být zcela potlačena aktivita ADH, což by mělo vést ke snížení močové osmolality pod 100 mmol/kg. Ve skutečnosti však byla 445 mosm/kg. Konstelace těchto nálezů potvrzovala diluční složku hyponatremie. Od počátečního období terapie jsme monitorovali Na+ – Cl- a Na+/Cl-, které jsme se léčbou snažili udržet v normálním rozmezí, respektive je do normálního rozmezí přiblížit (graf 1 a graf 2) při současné adekvátní korekci natremie. Rovněž jsme v pravidelných intervalech monitorovali tubulární funkce.
Po zvolené terapii se normalizovala frakční exkrece sodíku i urey, nicméně přetrvávala snížená hodnota frakční exkrece celkové vody provázená vyšší hodnotou močové osmolality dokládající přetrvávající aktivaci antidiuretického hormonu (tab. 2). Výsledky monitorování nás vedly k rozhodnutí ponechat zvolený způsob terapie, při kterém došlo k téměř úplné normalizaci natremie, aniž by se u nemocného objevily neurologické příznaky vyplývající z překotné rychlosti korekce natremie či oběhové srdeční insuficience z důvodu hyperhydratace. Stav jeho vědomí se rovněž postupně zlepšoval. Přes antibiotickou terapii, nasazenou ihned po přijetí pacienta do nemocnice, však došlo k rozvoji horečky spojené s prudkým vzestupem CRP. Klinicko-laboratorní vývoj koreloval s vývojem nálezu na RTG plic svědčícím pro bilaterální pneumonii a prohlubováním ventilačně-respirační insuficience. Teprve změna antibiotické léčby (amoxycilin-klavulanát byl zaměněn za klaritromycin) vedla k ústupu příznaků plicní infekce a pacient mohl opustit lůžko intenzivní péče.
Neméně důležitým aspektem diagnostiky je hledání faktorů, které závažnou poruchu vnitřního prostředí vyprovokovaly. Depleci mohlo způsobit několikadenní hladovění a žíznění spolu s užíváním kličkového diuretika v několik dnů trvajícím prehospitalizačním období, kdy se začala rozvíjet plicní infekce. K diluční složce hyponatremie mohlo přispět snížení efektivního cirkulujícího objemu zodpovědné za baroreceptorovou (neosmotickou) aktivaci antidiuretického hormonu. Laboratorní známky aktivace ADH však přetrvávaly i po infuzní korekci deplece objemu, a proto se domníváme, že se na diluční složce hyponatremie podílela inadekvátní produkce ADH. Příčinou této reakce mohla být závažná plicní infekce (bilaterální pneumonie), která se rozvinula klinicky i v RTG nálezu v krátkém intervalu po přijetí, spojená s produkcí zánětlivých chemokinů [16–18].
Závěr
Uvedená kazuistika podporuje předpoklad, že využití diference a poměru sérových koncentrací natria a chloridů, které jsou snadno a rychle dosažitelné, může významně přispět k rychlé diferenciální diagnóze hyponatremie a jejich pravidelné monitorování může napomoci ke sledování efektivnosti užité terapie. Tyto jednoduché testy mohou napomáhat i méně zkušeným lékařům v urgentních situacích u pacientů s hyponatremií.
doc. MUDr. Miroslava Horáčková, CSc.
horackov@seznam.cz
Interní klinika 2. LF UK a FN v Motole, Praha
www.fnmotol.cz
Doručeno do redakce 28. 8. 2016
Přijato po recenzi 4. 10. 2016
Sources
1. Schück O, Horáčková M. Diference a poměr sérových koncentrací natria a chloridů u pacientů s hyponatremií. Vnitř Lék 2016; 62(7–8): 629–634.
2. Spasovsky G, Vanholder R, Allolio B et al. Clinical practice guidelines on diagnosis and treatment of hyponatremia. Nephrol Dial Transplant 2014; (Suppl 2): i1-i39. Dostupné z DOI: <http://dx.doi.org/10.1093/ndt/gfu040>.
3. Pirzada NA, Ali II. Central pontine myelinolysis. Mayo Clin Proc 2001; 76(5): 559–562.
4. Hoorn EJ, Zietse R. Hyponatremia revisited: translating physiology to practice. Nephron Physiol 2008; 108(3): 46–59. Dostupné z DOI: <http://dx.doi.org/10.1159/000119709>.
5. Androgue HJ, Madias NE. Hyponatremia. New Engl J Med 2000; 342(21): 1581–1589.
6. Reneboog B, Musch W, Vandemergel X et al. Mild chronic hyponatremia is associated with falls, unsteadiness, and attention deficits. Am J Med 2006; 119(1): 71.e1-e8.
7. Wald R, Jaber BL, Price LL et al. Impact of hospital-associated hyponatremia on selected outcomes. Arch Int Med 2010; 170(3): 294–302. Dostupné z DOI: <http://dx.doi.org/10.1001/archinternmed.2009.513>.
8. Arieff AI. Hyponatremia, convulsions, Respiratory arrest, permanent Brain damage after elective surgery in healthy women. New Engl J Med 1986; 314(24): 1529–1535.
9. Ayus JS, Wheeler JM, Arieff AI. Postoperative hyponatremic encephalopathy in menstruant women. Ann Int Med 1992; 117(11): 891–897.
10. Hsu YJ, Chiu JS, Lu KC et al. Biochemical and etiological characteristics of acute hyponatremia in the emergency department. J Emerg Med 2005; 29(4): 369–374.
11. Sterns RH. Treating hyponatremia: why haste makes waste. South Med J 1994 : 87(12): 1283–1287.
12. Horn EJ, Halperin MI, Zietse R. Diagnostic approach to patients with hyponatremia: traditional versus physiology based options. QJM 2005; 98(7): 529–540.
13. Chung HM, Kluge R, Schrier RW et al. Clinical assessment of extracellular fluid volume in hyponatremia. Am J Med1987; 83(5): 905–908.
14. McGee S, Abernethy WB, Simel DL. The rational clinical examination. Is this patient hypovolemic? JASN 1999; 281(11): 1022–1029.
15. Kříž J, Schück O, Horáčková M. Hyponatremia in spinal cord injury patients: a new insight in to differentiating the dilution and depletion form. Spinal Cord 2015; 53(4): 291–296. Dostupné z DOI: <http://dx.doi.org/10.1038/sc.2014.240>.
16. Schrier RW, Bansal S. Diagnosis and management of hyponatremia in acute illness. Curr Opin Crit Care 2008; 14(6): 627–634. Dostupné z DOI: <http://dx.doi.org/10.1097/MCC.0b013e32830e45e3>.
17. Swart RM, Hoorn E, Betjes MB et al. Hyponatremia and inflammation: The emerging role of interleukin-6 in osmoregulation. Nephron Physiol 2011; 118(2): 45–51. Dostupné z DOI: <http://dx.doi.org/10.1159/000322238>.
18. Park SJ, Shin JI. Inflammation and hyponatremia: an underrecognized condition? Korean J Pediatr 2013; 56(12): 519–522. Dostupné z DOI: <http://dx.doi.org/10.3345/kjp.2013.56.12.519>.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2016 Issue Suppl 6
-
All articles in this issue
- Bioimpedometrie a její využití v dialyzační léčbě
- Výsledky studie SPRINT z pohledu nefrologie
- Systémová a intraperitoneální inflamace u peritoneálně dialyzovaných pacientů
- Využitie salivárnych markerov v nefrológii
- IgA nefropatie – otázky, které nastolil výzkum
- Gitelmanův syndrom jako častá příčina hypokalemie a hypomagnezemie
- Osteoporóza – epidemiologie a patogeneze
- Suplementované restriktivní diety u nemocných vyššího věku s chronickým onemocněním ledvin
- Současné možnosti léčby hyponatremie
-
Chronická dysfunkce transplantované ledviny:
stále nevyřešený problém - Současné možnosti sledování efektivnosti terapie hyponatremie
- Theralite a mnohočetný myelom
- Rozdíl [Na+] – [Cl-] významně přispívá k acidemii pacientů s jaterní cirhózou
- Prevalence mikroalbuminurie u pacientů s diabetes mellitus v České republice: Projekt IDN-Micro
- Markery oxidačného a karbonylového stresu v plazme a slinách u chorých s akútnou intermitentnou porfýriou
- Metabolická acidóza u chronického onemocnění ledvin
- Suplementácia vitamínu D3 a bunková homeostáza vápnika u pacientov pri chronickej chorobe obličiek
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Metabolická acidóza u chronického onemocnění ledvin
- Současné možnosti léčby hyponatremie
- Gitelmanův syndrom jako častá příčina hypokalemie a hypomagnezemie
- Osteoporóza – epidemiologie a patogeneze
