Divertikulární choroba: diagnostika a léčba
Diverticular disease: diagnosis and treatment
Diverticular disease is one of the most common gastroenterological diseases. Its morphological basis are diverticula, whose prevalence in adults nears 50 %, with 25% clinical symptomatology and 5% occurrence of complications. It is a disease of older age, however its incidence is also rising in younger individuals, where it takes a more severe course. Its incidence is ascribed to a diet with a relatively low fibre content, however studies do not yield such clear results. Further risk factors include smoking, use of opiates and corticoids, obesity, alcoholism and smoking, hypertension, polycystosis, immunosuppression and use of non-steroid antiflogistics. Patients with diverticular disease also present with abnormal intestinal motility, intestinal dysbiosis and other physiological and morphological abnormalities. The most types of diverticulosis occur in the sigmoid colon, though especially in Asia the colon ascendens is more frequently affected. There are several classification schemes among which an individual assessment of complications is gaining in importance. The diagnosis includes clinical data, routine laboratory tests for inflammation, calprotectin in stool, coloscopy, ultrasound, CT and magnetic resonance. The basis for the treatment of symptomatic uncomplicated diverticular disease consists of drugs bringing symptomatic relief, fibre, probiotics, mesalazine and non-absorbable antibiotics, nonetheless the results of a number of studies are not fully convincing. The recommended treatment should be initiated with dietary fibre and probiotics, in the case of lasting problems add a non-absorbable antibiotic rifaximine with cyclic administration. Mild diverticulitis should essentially be treated by means of hydration and adjustments in the dietary regimen, antibiotics are not necessary when its course is uncomplicated and improvement is achieved, however the decision is individual and risk factors such as immunosuppression, diabetes, old age, pregnancy etc. Antibiotics are reserved for the treatment of severe or repeated diverticulitis, sepsis and complications. As prevention of further attacks, again probiotics, mesalazine and cyclically non-absorbable antibiotics are used, e,g. for a period of 10 days at monthly intervals. The proportion of surgeries is decreasing also where acute conditions are concerned and the efficiency of conservative treatment of diverticulitis is on the increase. Abscess should primarily be treated via non-surgical drainage. Even perforation and peritonitis can be treated via laparoscopic drainage without subsequent surgery being necessary, of course considering an overall condition an individual decision needs to be made. Generalized and fecal peritonitis are treated by open surgery. Earlier, elective resection was recommended after 2 attacks of diverticulitis, currently an individual approach is emphasized with respect to age, comorbidities and a character of the complaint and it is only indicated exceptionally. The proportion of laparoscopic resections is growing. The results are basically identical for Hartmann’s procedure as well as primary resection.
Key words:
calprotecin – diverticular disease – dietary fibre – diverticulosis – mesalazine – non-absorbable antibiotics – probiotics
Authors:
Julius Špičák 1; Miloš Kučera 2; Gabriela Suchánková 1
Authors‘ workplace:
Klinika hepatogastroenterologie IKEM, Praha
1; Klinika transplantační chirurgie IKEM, Praha
2
Published in:
Vnitř Lék 2018; 64(6): 621-634
Category:
Reviews
Overview
Divertikulární choroba je jednou z nejčastějších gastroenterologických chorob. Jejím morfologickým podkladem jsou divertikly, jejichž prevalence u dospělých se blíží 50 %, s 25% klinickou symptomatologií a 5% výskytem komplikací. Jedná s o chorobu zralého věku, nicméně narůstá incidence i u mladších jedinců, u nichž bývá průběh těžší. Její výskyt se dává do souvislosti s příjmem potravy s relativně nízkým obsahem vlákniny, nicméně výsledky studií nejsou jednoznačné. Mezi další rizikové faktory patří kouření, užívání opiátů či kortikoidů, obezita, alkoholizmus a kouření, hypertenze, polycystóza, imunosuprese a užívání nesteroidních antiflogistik. Nemocní s divertikulární nemocí také vykazují abnormální střevní motilitu, střevní dysbiózu a další fyziologické a morfologické abnormality. Většina divertikulóz je lokalizována v esovitém tračníku, avšak zejména v Asii je častější postižení v colon ascendens. Existuje několik klasifikačních schémat, z nichž nabývá na významu individuální hodnocení komplikací. Diagnostika zahrnuje kliniku, běžnou laboratoř zánětu, kalprotektin ve stolici, koloskopii, ultrasonografii, CT a magnetickou rezonanci. Základem léčby symptomatické nekomplikované divertikulární nemoci jsou léky přinášející symptomatickou úlevu, vláknina, probiotika, mesalazin a nevstřebávající se antibiotika, nicméně výsledky řady studií nejsou plně přesvědčivé. Lze doporučit zahájit léčbu vlákninou a probiotiky, v případě přetrvávání obtíží přidat cyklicky podávané nevstřebávající se antibiotikum rifaximin. Divertikulitida s mírným průběhem má být léčena zásadně hydratací a úpravou dietního režimu, antibiotika při nekomplikovaném průběhu a zlepšení nejsou nutná, nicméně rozhodnutí je individuální a je třeba zvážit rizikové faktory, jako jsou imunosuprese, diabetes, vysoký věk, těhotenství atd. Antibiotika jsou vyhrazena pro léčbu těžké či opakované divertikulitidy, sepse a komplikací. Jako prevence dalších atak se podávají opět probiotika, mesalazin a cyklicky nevstřebatelná antibiotika, např. po 10 dnů v jednoměsíčních intervalech. Poměr operovaných klesá i u akutních stavů a účinnost konzervativní léčby divertikulitid se zvyšuje. Absces by měl být primárně léčen nechirurgickou drenáží. I perforace a peritonitida může být léčena laparoskopickou drenáží bez nutné následné operace, záleží ovšem na celkovém stavu a rozhodnutí je individuální. Generalizovaná a fekální peritonitida se léčí otevřenou chirurgií. Elektivní resekce se v minulosti doporučovala po 2 atakách divertikulitid, dnes se zdůrazňuje individuální přístup s ohledem na věk, komorbiditity a charakter postižení a v podstatě se indikuje výjimečně. Zvyšuje se podíl resekcí prováděných laparoskopicky. Výsledky jsou prakticky shodné u Hartmannovy operace i primární resekce.
Klíčová slova:
divertikulární choroba – divertikulóza – kalprotektin – mesalazin – nevstřebávající se antibiotika – probiotika – vláknina
Úvod
Divertikulární choroba je běžné onemocnění, jehož incidence celosvětově dále vzrůstá. Vůdčím patogenetickým principem je relativní nedostatek vlákniny, nicméně uplatňují se také střevní dysbióza, zánětlivé změny a senzomotorické poruchy. Chronické obtíže mohou napodobovat dráždivý tračník či nespecifický střevní zánět a dlouhodobě snižovat kvalitu života pacienta. Epizody divertikulitidy mohou mít v těžších případech charakter náhlé břišní příhody a v případě komplikací mohou mít vážný i smrtelný průběh vyžadující chirurgickou léčbu. Jak chronické symptomy, tak epizody akutního zánětu běžně rekurují.
Klinika, terminologie, klasifikace
Termín divertikulóza odkazuje pouze na přítomnost výchlipků střevní stěny, tzv. divertiklů. Ty mohou být asymptomatické (nejčastěji) nebo symptomatické. V případě klinicky významné symptomatologie hovoříme o divertikulární chorobě, která se manifestuje několika klinicko-patologickými podjednotkami. Nejčastější manifestací divertikulární nemoci jsou vleklé gastrointestinální potíže bez klinicky manifestního zánětu, a tedy bez odpovídajících laboratorních markerů a makroskopických zánětlivých změn. Zahrnují variabilní bolesti, nadýmání, plynatost a změny vyprazdňování. Proti typickému dráždivému tračníku je může odlišit lokalizace bolesti v levém hypogastriu bez úlevy defekací a její přetrvávání i v noci na lůžku. V praxi je často otazné, nakolik je u těchto pacientů vyjádřena vlastní divertikulární choroba, či nakolik se na potížích podílí dráždivý tračník. U obou těchto skupin byla zjištěna viscerální hypersenzitivita [1] a současně u pacientů s dráždivým tračníkem bylo prokázáno zvýšené riziko vzniku divertikulózy [2]. Tato jednotka se nazývá symptomatická nekomplikovaná divertikulární nemoc. Divertikulitida je charakterizována zánětem přímo postihujícím divertikl a jeho okolí a může být akutní nebo chronická. Akutní divertikulitida je bakteriální zánětlivé onemocnění, které se může dále komplikovat a šířit. Bez průkazu se udává, že divertikulitida je způsobena obstrukcí divertiklu s následným zvýšením intradivertikulárního tlaku. Ten vede k poškození sliznice a jejím zánětlivým změnám s následnou bakteriální translokací. Komplikacemi jsou absces, perforace, peritonitida a krvácení, které se může objevit i bez projevů zánětu. Mikroskopické zánětlivé změny byly opakovaně popsány i pokud k manifestní divertikulitidě nedošlo, a odtud pocházejí hypotézy o možném preventivním podávání protizánětlivých léků a antibiotik. Incidence divertikulitidy se uváděla mezi 10–25 % divertikulóz, ale novější studie udávají riziko podstatně nižší [3–5]. Studie s více než 2 000 pacienty trvající po dobu 7 let prokázala kumulativní riziko vzniku divertikulitidy u 4,3 %, resp. při potvrzení pomocí CT jen u 1 % pacientů. Za každou další dekádu života bylo riziko vzniku divertikulitidy sníženo o dalších 24 %. Oproti dříve uváděnému až 25% riziku rozvoje divertikulitidy bylo v této studii po dobu 11letého sledování prokázáno riziko < 5 a více byli ohroženi vznikem divertikulitidy mladí pacienti [6]. Podle údajů z USA dochází k 71 hospitalizacím na 100 000 obyvatel za rok pro akutní divertikulitidu a ke 4 pro perforaci. Incidence krvácení je přibližně 10 na 100 000 obyvatel za rok a činí přibližně 50 % všech enteroragií [7,8]. Divertikly následované hemoroidy a ischemickou kolitidou jsou nejčastějším zdrojem masivní enteroragie. Chronický zánět vede ke stenóze, která může mít podobné histologické rysy jako nespecifický střevní zánět nebo ischemická či infekční kolitida. Popisuje se kryptitida, kryptové abscesy i granulomy [9]. V některých případech se může jednat o souběh 2 onemocnění [10]. Specifickou skupinou mohou být nemocní s bolestí v levém podbřišku a poruchami pasáže bez klinických a laboratorních známek zánětu (tzv. doutnající/smouldering divertikulitida) [11].
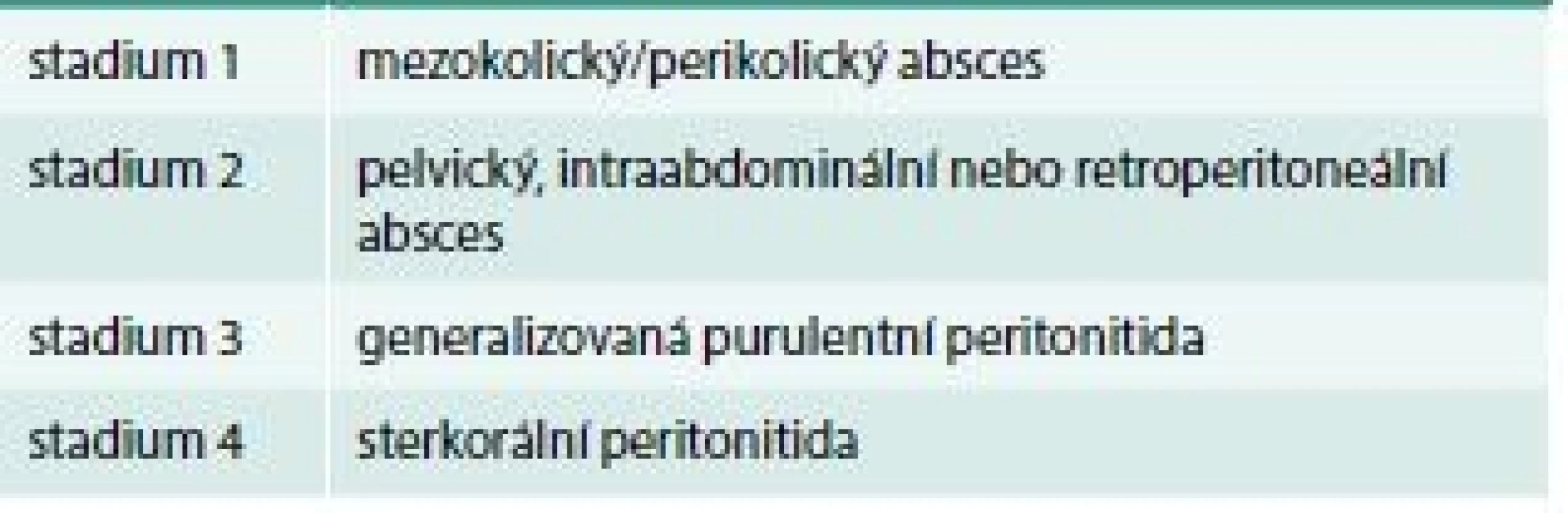
Klasifikace je vždy potřebnou komunikační platformou, přičemž smysl jednotlivých kategorií spočívá v následném diagnostickém a terapeutickém postupu. Již historická klasifikační schémata divertikulární choroby vytvořili v roce 1978 Hinchey a v roce 1999 Hansen a Stock (tab. 1 a tab. 2) [12,13] na zcela rozdílných principech (komplikace vs komplexní hodnocení).
Köhler dělí divertikulární nemoc na symptomatickou nekomplikovanou, rekurentní symptomatickou komplikovanou, zatímco Klarenbeekova klasifikace zahrnuje nekomplikovanou, chronickou a akutní nemoc. Z komplikací vyjmenovává krvácení, absces, flegmónu, fistulu, perforaci, stenózu, obstrukci v důsledku adhezí a peritonitidu, která může být purulentní nebo fekální [14].
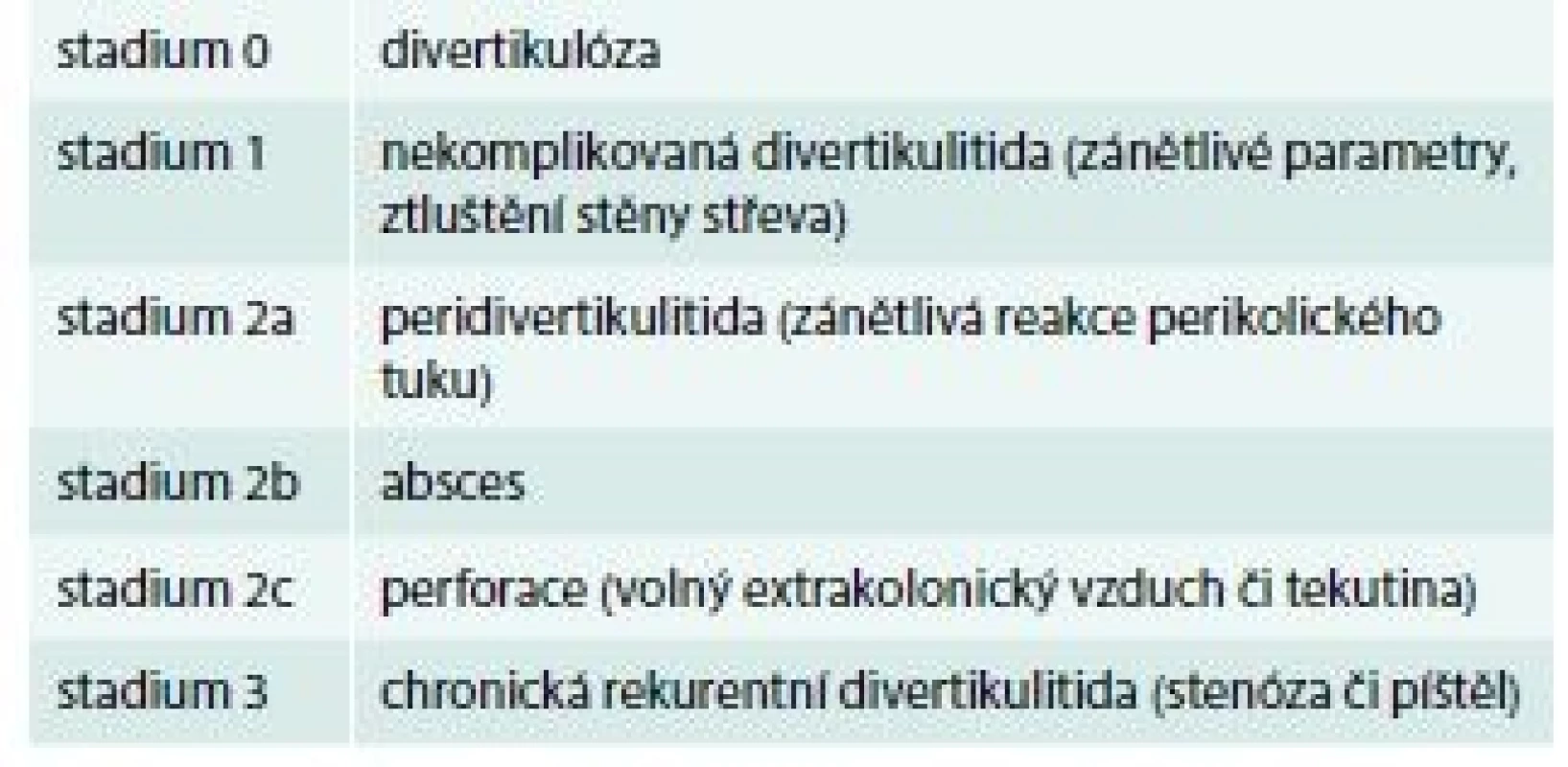
Velmi komplexní klasifikaci divertikulární nemoci zahrnuje doporučený postup Německé společnosti pro všeobecnou a abdominální chirurgii (Deutsche Gesellschaft für Allgemein - und Viszeralchirurgie – DGAV), tab. 3 [15].
![Klasifikace Německé společnosti pro všeobecnou a abdominální chirurgii. Upraveno podle [15]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/8505f587677512788e9d57544e1d1baa.jpeg)
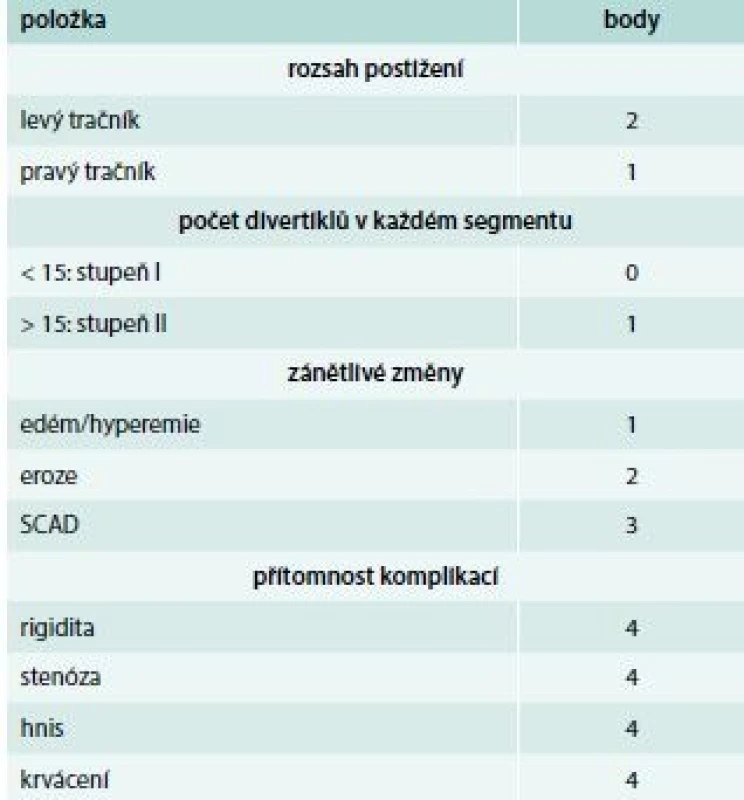
Recentně byla vytvořena a validována endoskopická klasifikace divertikulární nemoci, která zvažuje rozsah, počet divertiklů, přítomnost zánětu a komplikací (tab. 4): DICA (Diverticular Inflammation and Complication Assessment) 1: < 3, divertikulóza; DICA 2 : 4–7, symptomatická nemoc, malé riziko komplikací; DICA 3: > 7, těžká nemoc, velké riziko komplikací [16].
Epidemiologie a patogeneze
Prevalence divertikulózy je méně než 20 % ve věku do 40 let, avšak dále stoupá až k nadpolovičnímu výskytu u osob starších 80 let [5]. V poslední době dochází ke zvyšování incidence zejména v mladší populaci, zatímco u jedinců starších 65 let zůstává výskyt stabilní [7]. V mladším věku má toto onemocnění častěji agresivnější průběh vyžadující chirurgickou intervenci. Ve věku do 50 let je toto onemocnění častější u mužů (2 : 1), naopak mezi staršími pacienty dominují ženy (1,5 : 1) [17,18]. Spekulativními příčinami pohlavní diference jsou ochranný vliv testosteronu na zeslabování ténií střevní stěny a negativní vliv proběhlého těhotenství. Největší výskyt divertikulózy je v zemích s tzv. západním způsobem života, což se dává do souvislosti s příjmem potravy s relativně nízkým obsahem vlákniny. V roce 1971 uveřejnili Painter a Burkitt v British Medical Journal pravděpodobnou hypotézu spočívající v nedostatečném příjmu dietní vlákniny vedoucí ke zvýšenému intraluminálnímu tlaku v tračníku, a tím ke vzniku divertiklů [19]. Tuto hypotézu podpořila studie, ve které se srovnávala hmotnost stolice a trvání pasáže (transit time) u 1 200 jedinců z Velké Británie a Ugandy [20]. Delší pasáž a menší objem stolice u obyvatel Británie byly udávány jako důkaz vlivu dietních faktorů. Hypotézu také podporuje vývoj, při kterém dochází k nárůstu incidence divertikulózy v dalších zemích přijímajících západní styl života. Některá fakta a studie ovšem dietní hypotézu pravděpodobně v důsledku odlišné metodiky nepotvrzují. Překvapivě divertikulární chorobu nacházíme jen přibližně u 6 % pacientů se zácpou, a ta naopak provází jen 16 % pacientů s divertikulózou [21]. V roce 2012 Peery et al uveřejnili studii s účastí více než 2 000 respondentů, dle které preventivní role vysokého příjmu vlákniny v rozvoji divertikulózy nebyla potvrzena [22]. Zakořeněné dogma, že oříšky a semínka provokují divertikulitidu, nepotvrdila jiná studie zabývající se dietními faktory [23]. Recentní britská prospektivní studie zahrnula 690 075 žen středního věku vyšetřených validovaným dietním dotazníkem, z nichž 17 325 bylo hospitalizováno pro divertikulární chorobu. Průměrný denní příjem vlákniny byl 13,8 g denně (SD 5,0), z čehož 42 % pocházelo z obilovin, 22 % z ovoce, 19 % ze zeleniny a 15 % z brambor. Relativní riziko divertikulární nemoci na 5 g denního příjmu vlákniny bylo podle jejího původu 0,84 u obilovin, 0,81 u ovoce, 1,03 u zeleniny a 1,04 u brambor [24]. Rozdílné riziko u jednotlivých druhů vlákniny zůstává nevyjasněno. Mezi další rizikové faktory manifestace divertikulární choroby včetně vzniku komplikací patří malá fyzická aktivita, obezita, kouření a pravidelné užívání opiátů či kortikoidů [25,26]. Riziko krvácení zvyšují také nesteroidní antiflogistika [27], naproti tomu blokátory kalciových kanálů a statiny mohou mít protektivní efekt [28]. Tři japonské studie zjistily zvýšené riziko krvácení u hypertoniků [29], skandinávská studie nikoliv [30]. Podle dánské studie z let 1977–1993 znamenal alkoholizmus zvýšení rizika divertikulitidy u mužů 2,0krát a u žen 2,9krát. Spekulovalo se o vlivu alkoholické imunosuprese [31]. Incidence divertikulitidy u imunosuprimovaných nemocných po orgánových transplantacích (21 studií) dosáhla 1 % a mortalita operovaných pro akutní zánět 23 %, a byla tedy vyšší než v běžné populaci [32]. Recentně byla publikována analýza 1 578 nemocných po transplantaci ledviny v letech 2004–2013. Prevalence divertikulózy byla 43% a u 0,9 % vznikla akutní divertikulitida. Operováno bylo 6 nemocných, z toho 2 pro perforaci a 4 po opakovaných atakách [33].
Důležitou roli ve vzniku divertiklu hraje abnormální střevní motilita. Pacienti s divertikulózou vykazují výrazné segmentární kontrakce s nižší frekvencí, ale delším trváním charakteru spastického colon [34]. Příčina tohoto jevu není zcela jasná, dle některých dat by se mohla uplatňovat up-regulace M3 receptorů ve sliznici tlustého střeva [35,36]. Bylo také zjištěno, že u pacientů s divertikulózou je signifikantně snížena denzita Cajalových buněk, jímž je přisuzována funkce pacemakeru střevní peristaltiky [37]. K vzniku divertiklů také přispívá stařecká redukce neuronů a buněk glie v plexus myentericus. Potencionálním patogenetickým mechanizmem může být i změna v koncentraci vazoaktivního intestinálního peptidu ve střevní stěně [38]. Mění se poměr komponent extracelulární matrix: struktury kratších fibril kolagenu vykazují větší denzitu s následnou zvýšenou rigiditou a úbytkem pružnosti a elastóza hladké svaloviny vede k ztluštění stěny [39]. Podobně jako u Crohnovy nemoci byla prokázána větší exprese metaloproteináz matrix a současně snížený výskyt jejich inhibitorů [40]. Dalším rizikovým faktorem je dědičnost. S divertikulární nemocí se sdružují určitá geneticky podmíněná onemocnění jako Ehlersův-Danlosův, Williamsův-Beurenův a Coffinův-Lowryův syndrom podobně jako polycystická nemoc ledvin. Všechny tyto choroby jsou charakteristické deficientní extracelulární matrix s kumulací elastinu a kolagenu v hladké svalovině, kterýžto defekt se předpokládá i u divertikulární nemoci [41]. Roli dědičnosti potvrzuje i švédská a dánská populační studie (společný výskyt u jednovaječných dvojčat 7,15krát vyšší) [42,43]. Podobně jako u jiných chorob se hledají genetické souvislosti s těžkým průběhem [44].
Dalším zvažovaným mechanizmem manifestace divertikulární choroby a také dráždivého tračníku je změna ve složení střevní mikroflóry. Stagnace stolice v divertiklech může způsobit dysmikrobii se změnou profilu metabolitů uplatňujících se v patogenezi chronického zánětu. U pacientů s anamnézou akutní divertikulitidy bylo u 60 % z nich prokázáno bakteriální přerůstání [45].
Zánět probíhající ve střevní stěně při chronické divertikulární chorobě bývá identifikovatelný jen mikroskopicky [46]. Struktura divertiklu vzniká v místě fyziologického zeslabení střevní stěny, konkrétně v místě prostupu vasa recta cirkulární vrstvou svaloviny, přes kterou dochází k herniaci mukózy a submukózy a dochází tak ke vzniku pulzního, tzv. nepravého divertiklu krytého pouze serózou. Podle již historické studie byly u přibližně u 95 % pacientů divertikly lokalizovány v esovitém tračníku, přičemž u 65 % byly omezeny pouze na něj, ve 24 % postihovaly i další části tlustého střeva, v 7 % byly rozmístěny difuzně a u 4 % pacientů se nacházely pouze v pravostranném tračníku [47]. Podle nedávno publikované studie (CT-kolografie) bylo postižení pravostranného tračníku u nemocných nad 60 let častější: 14,2 % caecum a 18,5 % colon ascendens [48]. Rozvoj divertiklů převážně v esovitém tračníku může být vysvětlen Laplaceovým zákonem, který říká, že tlak je nepřímo úměrný poloměru daného prostoru. Vzhledem k tomu, že esovitý tračník je úsek střeva s nejmenším poloměrem, je to současně místo, v němž je v průběhu střevní kontrakce nejvyšší tlak [49]. Pozoruhodné je, že v Asii výrazně dominuje postižení vzestupného tračníku (asi 70 %), v těchto případech se jedná o divertikly pravé [50]. V Thajsku byla divertikulóza zjištěna u 28,5 % radiologických nálezů, z toho pravostranná v 641 případech a levostranná v 383 případech. U 98 nálezů se jednalo o pandivertikulózu [51]. Podle recentní studie byl u divertikulózy prokázán zvýšený výskyt polypů (OR 9,9), i adenomů (OR 5,1) [52]. Podle jiné asijské studie je častější současný výskyt kolorektálního karcinomu u levostranné divertikulární nemoci a polypů u pravostranné divertikulární nemoci [53].
Diagnostika
Příznaky divertikulózy zahrnují abdominální bolesti, nadýmání, plynatost a změny stolice, v podstatě podobně jako je tomu u dráždivého tračníku. Typickou manifestací akutní divertikulitidy je bolest v levém podbřišku doprovázená obvyklou obecnou symptomatologií a laboratorními parametry bakteriálního zánětu. Konkrétně se uplatňuje CRP, jehož hladina nad 50 mg/l svědčí pro akutní divertikulitidu. Se zánětlivým procesem koreluje vyšetření kalprotektinu ve stolici. Jeho hladina je zvýšena i u subklinického zánětu a s rozsahem a aktivitou postižení se zvyšuje. Predikuje úspěšnost léčby i případné rekurence a je třeba jej pravidelně sledovat [54]. V diagnostice divertikulární nemoci se využívají obvyklé zobrazovací metody: dříve kontrastní RTG, nyní koloskopie, ultrasonografie, výpočetní tomografie (computed tomography – CT) a zobrazení magnetickou rezonancí (magnetic resonance imaging – MRI). Diagnostickými kritérii při podezření na divertikulitidu jsou u sonografie a CT-zobrazení divertiklů, postižení perikolického tuku a ztluštění střevní stěny na 4–5 mm. Řada studií a metaanalýz prokázaly v podstatě shodnou senzitivitu i specificitu ultrasonografie, CT i MRI většinou převyšující 90 %. Koloskopie je patrně nejčastější diagnostickou metodou. Uplatňuje se elektivně i urgentně při krvácení. Asi u 15 % enteroragií se zdroj nalézá v oblasti horní části trávicí trubice, takže spolu s koloskopií se zvažuje i orální přístup. Indikována je koloskopie, která ovšem bez přípravy bývá nevýtěžná. Příprava by měla být zahájena okamžitě po zjištění krvácení a efektivitu vyšetření zásadně by zlepšila aplikace vody tryskou (tzv. clearpath), která je bohužel zatím nedostupná. Divertikly se mohou vyskytovat spolu s jakýmkoliv jiným střevním nemocněním včetně nádorů a mohou ztěžovat koloskopii jako takovou i polypektomii v důsledku spazmů či stenóz. Časná koloskopie při divertikulitidě zvyšuje riziko perforace. Doporučuje se provést vyšetření 6–8 týdnů po vyléčené epizodě [55–58]. Specifickým problémem je indikace koloskopie po vyléčené akutní divertikulitidě ve smyslu záchytu současné neoplazie. Podle retrospektivy Brara et al byl výskyt invazivního nádoru a pokročilé neoplazie 1,6 % a 9,2 %, u podskupiny s komplikovanou divertikulitidou 5,4 % a 18,9 %, metaanalýza Sharmy (11 studií) přinesla podobné výsledky (10,8 % malignit u komplikované divertikulitidy). Je zřejmé, že komplikovaná divertikulitida je u tumorů častější a časná koloskopie je zde plně oprávněná [59,60]. V diagnostice kolovezikálních píštělí je snad kupodivu nejpřesnější test s požitím makových zrnek, která se následně hledají v moči. Test předčil CT, MRI, kontrastní RTG i koloskopii [61].
Terapie
Základem léčby nekomplikované divertikulární choroby jsou léky přinášející symptomatickou úlevu, vláknina, mesalazin, probiotika a nevstřebávající se antibiotika. Vlákninou se jako první systematicky zabývali Painter a Burkitt. Painter prokázal, že dieta s nízkým obsahem vlákniny má za následek snížení objemu stolice, hypersegmentaci a zvýšení intraluminálního tlaku [19]. Následovala řada studií, při nichž se podávaly otruby nebo rozpustná vláknina psyllium (jitrocel indický: z 5 randomizovaných 3 prokázaly zlepšení ve skupině s vlákninou a 2 s relativně menším množství vlákniny nikoliv [62–66]. Důkaz o prospěšnosti vlákniny také přináší 2 rozsáhlé prospektivní studie [67,68].
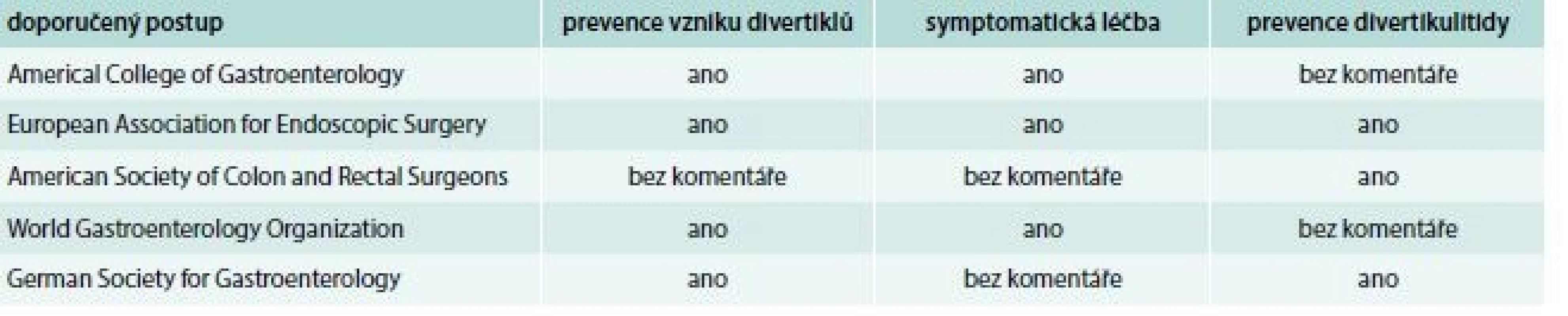
U nás se zabývali divertikulární nemocí a úlohou diety Adamová a především František Antoš. Zdůrazňují potřebu dostatečného množství vlákniny, které by mělo dosáhnout 30 g denně, a tedy dvojnásobku běžného příjmu v naší oblasti. Antoš specificky doporučuje vysoký příjem otrub a dalších potravin s vysokým obsahem vlákniny, což bylo v 80. letech minulého století s všeobecně velmi omezenou nabídkou nesnadno realizovatelné. Připomeňme, že vysoký obsah vlákniny je vlastní vedle otrub zejména hrubozrnnému pečivu, neloupané rýži, sušenému ovoci, ořechům, luštěninám, cizrně, jablkům a hruškám, kořenové zelenině, tmavému chlebu a pečeným bramborám [69,70]. Další aspekty této problematiky zpracovali Hoch a Kazil [71,72]. Nedávná precizní metaanalýza konstatovala, že vysoce kvalitní důkazy o prospěšnosti zbytkové diety chybí a většina doporučení je podporována studiemi nevalné kvality. Výsledky 3 randomizovaných placebem kontrolovaných studií přinesly rozporné výsledky a nebyly shledány rozdíly mezi rozpustnou a nerozpustnou vlákninou. Přesto je vláknina většinově doporučována i podle řady doporučených postupů (tab. 5) [73,74].
Léčba akutní divertikulitidy
Základem terapie akutní divertikulitidy je hydratace, lačnění a antibiotika. V případě nekomplikovaného onemocnění se doporučovala perorální širokospektrá antibiotika po dobu 7–10 dnů. Vhodné jsou kombinace ciprofloxacinu s metronidazolem nebo ampicilin-sulbaktam. Ambulantní terapie je ve většině případů účinná s méně než 10% rizikem rehospitalizace během následujících 2 měsíců. V případě komplikované divertikulitidy je nezbytností hospitalizace s intravenózní aplikací antibiotik pokrývající gramnegativní a anaerobní patogeny. Mezi doporučované antibiotické režimy patří opět ampicilin-sulbaktam, piperacilin-tazobaktam v monoterapii a cefalosporiny III. generace v kombinaci s metronidazolem. U pacientů alergických na betalaktamová antibiotika jsou alternativou ciprofloxacin nebo levofloxacin s metronidazolem nebo karbapenemy v monoterapii. Součástí terapie je dostatečná hydratace a přiměřená dietní opatření, tj. tekutá strava či parenterální výživa. Multicentrická studie zahrnující více než 600 pacientů s typickými symptomy nekomplikované divertikulitidy verifikované CT srovnávala terapii širokospektrými antibiotiky oproti samotné infuzní terapii, aniž byl prokázán signifikantní rozdíl. Ve skupině bez antibiotik se komplikace, konkrétně absces, rozvinula u pouze 3 (1 %) nemocných [75]. Autoři soudí, že antibiotika by měla být podávána pouze v případě komplikované divertikulitidy a stejné doporučení vydala i například Dánská gastroenterologická společnost ve svém oficiálním doporučení. Podávání antibiotik doporučuje pouze u nemocných se sepsí, deficitem imunity a u gravidních žen. Recentně byla publikována multicentrická prospektivní studie srovnávající podávání antibiotik s klidovým režimem a podpůrnou symptomatickou léčbou zahrnující 528 nemocných. Vyléčení bylo dosaženo v průměru 12. a 14. den, rozdíly v komplikacích (2,6 % vs 3,8 %), pokračující divertikulitidě (4,1 % vs 7,3 %), rekurenci (3,0 % vs 3,4 %), resekci (2,3 % vs 3,8 %), vedlejších účincích (54,5 % vs 48,5 %) a mortalitě (0,4 % a 1,1 %) byly nesignifikantní, nicméně ve všech položkách příznivější u antibiotické léčby [76].
5-ASA v terapii chronických forem divertikulární choroby
Vzhledem k zánětlivé složce onemocnění se nabízí využití mesalazinu jak v prevenci divertikulitidy, tak k léčbě symptomatické divertikulózy s předpokládanou zánětlivou složkou. Byla publikována celá řada metodicky rozdílných studií s různou metodikou i výsledky. Trepsi et al [77] v otevřené randomizované studii hodnotili 8týdenní užívání mesalazinu oproti placebu po proběhlé atace akutní divertikulitidy (15 % vs 46 % symptomatických relapsů). Tursi et al [78] porovnávali kontinuální (denní) podávání 5-ASA v dávce 1,6 g oproti cyklickému podávání 10 dní v měsíci po dobu 2 let. Ve větvi s kontinuálním podáváním bylo 78 % asymptomatických oproti 56 % při cyklické aplikaci. Ve dvojitě zaslepené placebem kontrolované studii se sledovalo 3měsíční podávání mesalazinu v dávce 2,4 g/den po epizodě akutní divertikulitidy. V mesalazinové skupině bylo pozorováno signifikantní snížení celkových gastrointestinálních potíží ve 12. (56,3 % vs 17,2 %) i 52. týdnu (59,3 % vs 27,3 %) [79]. Přehled 6 randomizovaných kontrolovaných studií s 818 pacienty prokázal, že mesalazin byl ve srovnání s placebem signifikantně účinnější v ústupu symptomů a prevenci rekurentní divertikulitidy [80]. Naproti tomu Raskin et al ve studiích PREVENT I a II zaměřených na prevenci divertikulitidy snížení atak při léčbě mesalazinem neprokázali, nezaměřili se ovšem na chronické abdominální obtíže. K rekurenci divertikulitidy nedošlo u 53–63 % vs 65 % u placeba, resp. u 59–69 % vs 68 % u placeba [81]. V prospektivní a randomizované studii srovnával Di Mario cyklicky podávaný rifaximin s mesalazinem v symptomatické úlevě u nemocných se symptomatickou nekomplikovanou divertikulózou. Při hodnocení globálního skóre byla účinnost obou režimů shodná [82].
Rifaximin
Stáza střevního obsahu může vést k bakteriálnímu přerůstání a tkáňovým zánětlivým změnám, což odůvodňuje podávání antibiotik i bez přítomnosti klinicky zjevné divertikulitidy. Rifaximin je špatně vstřebatelné širokospektré antibiotikum působící proti grampozitivním i gramnegativním, aerobním i anaerobním bakteriím. Jako ostatní antibiotika i rifaximin redukuje fekální bakteriální flóru, která se ovšem až pozoruhodně rychle během 1–2 týdnů obnovuje v původním složení. Nicméně přes tento jen dočasný doložitelný účinek se antibiotika podávají nejen u akutních infekcí, ale i u chronických zánětů, u nichž je hypotéza jejich účinku více diskutabilní. Podává se i u jiných z bakteriologického hlediska empirických indikací jako dráždivého tračníku a průjmu cestovatelů. Důsledkem redukce bakteriální flóry je snížení degradace vlákniny a produkce metanu. Rifaximin ovšem nepůsobí jen antibakteriálně, ale pozitivně ovlivňuje i imunitní systém působením na pregnane X receptor, jak naznačuje pokles zvýšených buněk CD103 v periferní krvi a poklesu TLR-CD4 buněk v střevní sliznici [83]. I v případě rifaximinu existuje značná metodická variabilita – léky se podávají v různých dávkách a kombinacích a liší se i kritéria hodnocení. Papi na počátku 90. let minulého století prokázal u 217 nemocných redukci skóre symptomů z 63,9 % na 47,6 % [84]. K podobným závěrům dospěly při cyklickém podávání i některé další randomizované studie (tab. 6) [85–90] a účinnost potvrdila metaanalýza 4 prospektivních randomizovaných studií zahrnujících 1 660 nemocných [91]. Vzhledem k opakovanému a dlouhodobému podávání je přirozeně na zvážení riziko komplikací, zejména selekce zkříženě rezistentních kmenů Mycobacterium tuberculosis k rifampicinu, ale tato rezistence zůstává pod 3 % a nezvyšuje se ani přes narůstající preskripci rifaximinu. Podobně nedochází k selekci rezistentních kmenů Clostridium difficile, resp. žádný případ se neobjevil ve studii u dráždivého tračníku a jen jeden (0,3 %) ve studii s morbus Crohn [92].
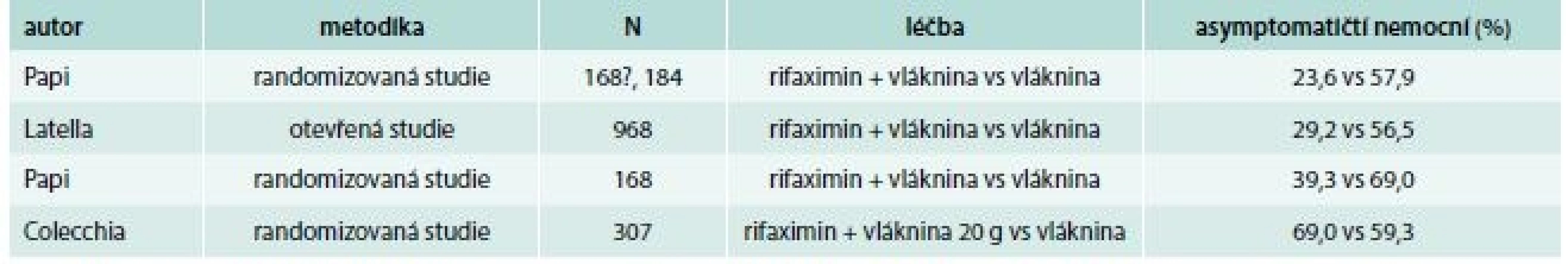
Poměrně recentní observační multicentrická studie pochází z Rakouska. Léčeno bylo 1 003 nemocných s nekomplikovanou symptomatickou divertikulózou a rifaximin se podával v 7–10denních kúrách měsíčně po dobu 3 měsíců. Celkově došlo k významnému zmírnění symptomů (plynatost, abdominální bolesti a průjem). Zaznamenáno bylo 24 potenciálně vedlejších účinků vesměs nezávažných u 20 nemocných, z toho 6 v příčinné souvislosti s podáním rifaximinu [93]. Nejčerstvější retrospektivní studie posuzovala intervalovou léčbu 10 dnů v měsíci rifaximinem vs mesalazinem. U celkem 124 nemocných byl výskyt rekurencí u rifaximinu poloviční [94]. Veškerá konzervativní léčba podávaná k léčbě symptomů a prevenci zánětlivých komplikací byla pečlivě zhodnocena obsáhlou nicméně již před 6 lety publikovanou metaanalýzou. Celkem bylo hodnoceno 31 prospektivních studií, často s problematickou kvalitou. Jen u 8 byl použit validizovaný dotazník a jen 14 přesně definovalo jednotlivé parametry. Pouze 1 studie splňovala náročná metodologická kritéria (dlouhodobá dvouslepá randomizovaná studie). Ta prokázala významné zlepšení symptomů při podávání rifaximinu s vlákninou proti vláknině samotné. Celkem 12 studií zkoumalo rifaximin a 8 mesalazin nebo balsalazid v různých dávkách a kombinacích v symptomatické léčbě u nekomplikované divertikulózy. 9 studií s rifaximinem a 2 studie s mesalazinem prokázaly redukci symptomů. Celkem v 11 studiích byla cílem prevence divertikulitidy. 6 z nich zkoumalo rifaximin v různých kombinacích proti vláknině nebo mesalazinu, z nich u všech s pozitivním výsledkem, který nicméně u 4 nedosáhl statistické významnosti. Kumulativní data z těchto studií prokázala při léčbě rifaximinem s vlákninou poměr jednoročního výskytu divertikulitidy 1,1 % vs 2,9 %. Autoři uzavírají, že výsledky jsou ve svém úhrnu přesvědčivější v léčbě symptomů, kdežto úloha léčby v prevenci divertikulitidy musí být dále definována [95].
Probiotika
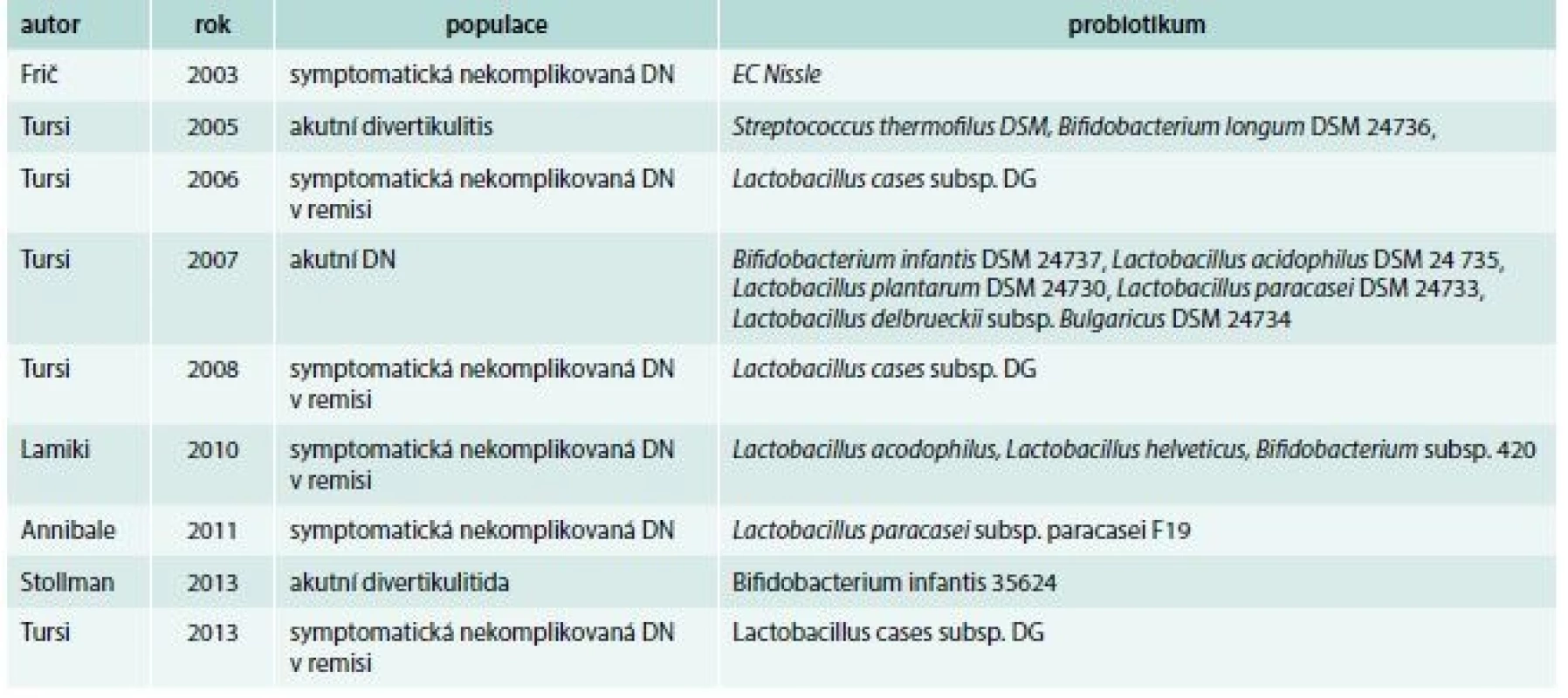
Probiotika jsou živé mikroorganizmy ovlivňující hostitelskou mikroflóru s pozitivním účinkem na zdravotní stav organizmu. Většina přípravků pocházejících z mléčných kultur obsahuje Bifidobacterium spp, Lactobacillus spp., některé kmeny Escherichia coli a kvasinku Saccharomyces boulardi. Mechanizmus účinku probiotik je víceúrovňový. Jedním z nich je suprese růstu a adheze bakterií na střevní sliznici se snížením bakteriální translokace [96,97]. Současně modulují imunitní systém – indukují tvorbu ochranně působících cytokinů, jako je interleukin 10 (IL10) a transformující růstový faktor beta (transforming growth factor beta – TGFβ), a potlačují proinflamatorně působící cytokiny – tumor nekrotizující faktor (tumor necrosis factor – TNF) [98,99]. Saccharomyces boulardi v zánětlivě změněné tkáni u myšího modelu s IBD snižuje migraci Th1 lymfocytů [100]. Ve vývoji jsou ale i další kmeny bakterií produkující imunomodulátory (např. IL10 a defensiny). Bolest a její vnímání ovlivňují některé kmeny laktobacilů indukcí exprese mikroopioidních a kanabioidních receptorů ve střevní sliznici [101]. Zdá se, že k dosažení účinku nemusí být nutné podávat organizmy v kompletní vitální podobě. Vylučované proteiny a DNA jednoho probiotika, konkrétně VSL#3, blokují aktivaci cytokinů a apoptózu epiteliálních buněk [102]. Účinek závisí na specifické DNA pocházející z různých bakteriálních kmenů, které jsou součástí probiotika. Nemetylovaná DNA z VSL#3, zrovna tak jako další náhodně vybrané některé kmeny Escherichia coli, potlačovaly experimentální kolitidu na několika zvířecích modelech [103]. Tyto léčebné účinky jsou zprostředkovány pomocí toll-like receptorů 9 a indukcí interferonu typu 1 α/β [104]. I z dalších probiotik, včetně Lactobacillus GG, mohou proteiny s definovanou molekulovou hmotností inhibovat prozánětlivou signalizaci a cytokiny navozenou apoptózu epiteliálních buněk tlustého střeva pomocí epidermálního růstového faktoru (epidermal growth factor receptor – EGFR) [105]. Některé studie prokázaly účinnost probiotik v terapii divertikulární choroby a jejích komplikací [106,107]. Lamiki et al publikovali studii s probiotiky obsahujícími kmeny Lactobacillus acidophilus a Bifidobacterium spp. u pacientů se symptomatickou divertikulární chorobou. Během 6měsíčního sledování bylo 70 % pacientů bez potíží a 77 % z nich hodnotilo terapii jako velmi účinnou [108]. V další randomizované studii zkoumal Tursi podávání mesalazinu a probiotika v kombinaci a separovaně. Kvalitní studie jednoznačně prokázala přínos obou léků, který byl větší při kombinovaném podávání [109]. Za zmínku stojí domácí studie Friče a Zavorala hodnotící účinnost nepatogenní Escherichia coli v udržení remise u 15 nemocných se symptomatickou nekomplikovanou divertikulózou. Přidání probiotika prodloužilo remisi z 2,43 na 14,1 měsíců a významně se snížila symptomatologie [110]. Metaanalýza probiotické léčby byla publikována před rokem. Zahrnula 11 studií, z nichž 7 bylo randomizovaných, a 7 645 nemocných. Populace, metodika a cíle studií byla tak odlišná, že vyhodnocení nebylo možné (tab. 7) [111].
Divertikulární nemoc (DN)
Ilustrativní jsou výsledky dotazníku mezi italskými lékaři primární péče. 44 % responderů doporučuje vlákninu, s omezením semínek u 30 %, z léků se u symptomatické nekomplikované nemoci nejčastěji podávaly rifaximin, probiotika a mesalazin u 82,8 %, 59,54 % a 36,3 % nemocných. Ve stejném pořadí se tyto léky podávaly v prevenci divertikulitidy [112]. Realitu širší klinické praxe také reflektuje dotazník vyplněný 115 gastroenterology a chirurgy z 8 evropských zemí. Vlákninu doporučovalo 59,1 %, probiotika byla nejčastější lékovou skupinou (25 %), v prevenci rekurence divertikulitidy se nejčastěji podával rifaximin (42,5 %). Většina oslovených doporučila léčbu divertikulitidy v domácím ošetření [113].
Chirurgická léčba
Úspěšnost konzervativní terapie u akutní nekomplikované divertikulitidy se pohybuje mezi 70–100 %. Po zaléčení první epizody akutní divertikulitidy asi třetina pacientů prodělá další epizodu a z nich další třetina prodělá epizodu třetí. Historicky přibližně u 20 % pacientů s akutní divertikulitidou byla v průběhu onemocnění nutná chirurgická intervence [114]; v současnosti potřeba intervencí vzhledem k úspěšnosti konzervativní léčby klesá. Většina pacientů podstupujících intervenci je indikována pro akutní či chronické komplikace, jako jsou např. perforace, píštěl, nedrénovatelný absces, peritonitida nebo obstrukce, u nichž je indikace operačního řešení zřejmá. Druhou skupinou jsou pak pacienti s těžkými epizodami rekurentní divertikulitidy, u nichž je operace preventivním elektivním výkonem. Je ovšem otázkou, kdy a jak načasovat ev. operační výkon. Do konce minulého století byl univerzálně akceptován pokyn k operaci po 2 atakách divertikulitidy. Dnes se zdůrazňuje individuální přístup vzhledem k celkově nízkému riziku její recidivy, variabilnímu průběhu i výskytu komorbidit. Specifická situace je u pacientů mladších 40 let, u kterých může být doporučována resekce postiženého úseku již po jedné epizodě akutní divertikulitidy. Důvodem je skutečnost, že její průběh bývá u těchto pacientů agresivnější a současně je u nich vyšší riziko rekurence. Tito mladší pacienti i častěji podstupují urgentní operační výkon, na kterém se kromě vlastních komplikací často podílí špatně stanovená diagnóza. Dle některých dat to je až 40–50 % [115–117]. Specifickou skupinou jsou pacienti s poruchou imunity, např. při dlouhodobé kortikoterapii či jiné imunosupresi, u diabetu nebo renálního selhání a při postižení systémovým onemocnění pojiva, např. systémovým lupus erythematodes, u nichž je vyšší riziko perforace [118]. Imunosuprimovaní pacienti často vykazují nevýrazné symptomy i přes těžce probíhající onemocnění. Pravostranná forma (ascendens-cekální) tvoří přibližně 1,5 % všech divertikulitid [119]. Většinou se jedná o mladší nemocné a bývá zaměněna za akutní apendicitidu, takže správná diagnóza bývá před operací stanovena jen výjimečně [120,121]. Perforace bývala automaticky indikací k resekci, nicméně alternativou se zdála být v první fázi laparoskopická drenáž. V multicentrické skandinávské prospektivní studii zahrnující 199 nemocných bylo 101 ošetřeno laparoskopickou drenáží a 98 resekcí střeva. Mortalita byla obdobná (rozdíl 2,4 %), nicméně reoperace byla nutná u 20,3 % vs 5,7 %. Primární laparoskopická drenáž tedy nepřinesla zřetelnou výhodu [122]. Abscesy byly primárně indikovány k chirurgické léčbě; nyní se často volí drenáž pod CT-kontrolou. Ambrosetti et al drénovali 73 nemocných. 18 % z nich muselo být operováno během iniciální hospitalizace a dalších 34 % během dalšího sledování [123]. Ve studii Siewerta muselo být operováno 8 z 22 nemocných s malým abscesem (do 2 cm) a 5 (62,5 %) s abscesem větším [124]. Ve studii Durmishiho byla drenáž úspěšná u 23 z 34 nemocných a 12 z nich bylo operováno s odstupem. U 11 s neúspěšnou drenáží byla provedena resekce u 10 s 80% nutností stomatu a 33% mortalitou [125]. Studie Kumara zahrnula 114 nemocných, z nichž polovina byla léčena jen anbitibiotiky. Drénovaná skupina měla abscesy významně větší a častěji se manifestovala zvýšenou teplotou [126]. V případě perforace byla po desetiletí univerzálně akceptovaná Hartmannova operace, tj. resekce s dočasnou kolostomií. Kronborg srovnával Hartmannovu operaci s primární kolostomií bez resekce a v této skupině byla mortalita nižší (0/21 vs 6/25) [127]. Zeitoun došel k částečně opačnému závěru – u primární kolostomie byly častější reoperace, rozdíl v mortalitě nebyl statisticky významný [128]. V jiné studii byla mortalita v resekované skupině s primární suturou nižší než u Hartmannovy operace (98 nemocných, 10 % vs 19 %) [129]. Roli v odlišných výsledcích hraje jako vždy selekce nemocných, protože u nemocných s těžší formou nemoci se autoři přikláněli k Hartmannově metodě. V přehledu studií srovnávajících primární resekci s Hartmannovou operací byla mortalita prakticky shodná (14,1 % vs 14,4 %) [130]. Jako v jiných indikacích i u peritonitidy se uplatnil laparoskopický přístup. V několika studiích byly popsány dobré výsledky u laparoskopické inspekce a drenáže u stadia III dle Hincheyho a Karoui et al nenalezli rozdíl při srovnání tohoto přístupu s Hartmannovou operací [131]. Myers popsal výsledky laparoskopické drenáže u 92 nemocných s perforovanou divertikulitidou léčených laparoskopicky a konzervativně. Jen u jednoho byla provedena resekce s kolostomií [132]. Zdá se, že po úspěšné laparoskopické drenáži peritonitidy elektivní resekce nemusí nevyhnutelně následovat. V současnosti je v běhu holandská multicentrická prospektivní studie. V plánu je zařadit dostatečný počet nemocných, aby výsledky byly validní. U purulentní peritonitidy se nemocní budou zařazovat do skupin peritoneální laváž/drenáž, Hartmannova operace a resekce s primární suturou v poměru 2 : 1 : 1, u sterkorální peritonitidy do dvou skupin: s Hartmannovou operací a resekcí s primární suturou v poměru 1 : 1 [133]. Elektivní resekce je také indikována u opakované divertikulitidy v prevenci dalších atak. V úvahu je třeba vzít riziko rekurence navzdory provedené resekci (do 10 %), nezanedbatelnou mortalitu (do 2,3 %) a riziko stomie blížící se 10 %. Vodítkem je znalost průběhu onemocnění. Mortalita opakované epizody divertikulitidy je nižší než u první epizody (2,5 % vs 10 %) [134]. U většiny nemocných s komplikovanou divertikulitidou se jedná o první epizodu a nepředcházejí varovné symptomy. Rizikovým faktorem relapsu divertikulitidy je pánevní absces léčený konzervativně (nechirurgicky), a jak už bylo uvedeno, těžký průběh mívá onemocnění u mladých jedinců. Podle studie Brodericka-Villy bylo relativní riziko rekurence divertikulitidy při věku nad 50 let RR 0,68 [135]. V mimořádně rozsáhlé retrospektivní studii zahrnující Washingtonský registr a čítající 25 058 nemocných s divertikulitidou 80,4 % podstoupilo konzervativní léčbu a z nich u 19 % došlo k relapsu, který byl léčen urgentní operací v 18,1 %. Riziko rekurence u mladších nemocných bylo 27 % vs 17 % u starších a podobně významně vyšší bylo také riziko urgentní operace. Nicméně mortalita ve věku do 40 let byla nulová, zatímco nad 50 let byla 3,4 % [136]. Podle kanadské retrospektivní studie (685 390 nemocných) poklesla během 15 let do roku 2005 operabilita z 18 % na 14 % u nekomplikovaných a ze 71 % na 56 % u komplikovaných případů [137]. Podle švédské studie poklesl podíl urgentních resekcí na 5 % divertikulitid s tím, že dalších 5 % operací následovalo elektivně. Mortalita byla zaznamenána jen u sterkorálních peritonitid [138]. Operace sama může být provedena laparoskopicky i klasicky. U laparoskopické resekce z jednoho portu (329 nemocných) byl výskyt komplikací 18,3 %, leaku 4 %, potřeba konverze 6,1 %, vznik hernie v jizvě 4,9 % a rekurentní divertikulitida a úmrtí u 1 nemocného [139]. Tzv. Sigma Trial, multicentrická studie, zahrnula 52 nemocných s opakovanou atakou divertikulitidy či drénovaným abscesem nebo stenózou. Méně komplikací a kratší hospitalizace byly ve skupině laparoskopické, nicméně doba laparoskopického zákroku byla delší a konverze byla nutná v 19,2 %. V kvalitě života (SF 36) byl rozdíl ve prospěch laparoskopie jen po 6 týdnech, ale po 6 měsících se skóre vyrovnalo. Náklady na léčbu byly shodné [140,141]. Podle jiné studie zahrnující 113 nemocných byly komplikace u obou postupů shodné, nedošlo k leaku ani k úmrtí a konverze dosáhla 8,3 %. Kratší dobu hospitalizace a kratší restituci střevní pasáže vykázala analýza u laparoskopického přístupu [142] a ke stejnému závěru dospěla metaanalýza nerandomizovaných studií [143]. Větší problémy lze očekávat u divertikulitidy komplikované abscesem nebo stenózou a výsledky rozsáhlé studie (konverze 5,3 %, morbidita 11,5 % a mortalita 0,9 %) nelze na jiných pracovištích automaticky očekávat [144]. Recentní metaanalýza 3 prospektivních randomizovaných studií srovnává laparoskopickou laváž a otevřenou resekci u divertikulitidy s generalizovanou peritonitidou. U laparoskopické laváže byl vyšší výskyt pooperačního intraabdominálního abscesu, ale méně ranných infekcí, reintervencí a kratší pobyt na lůžku. V zásadě se jeví oba přístupy jako odůvodnitelné [145]. Otázkou je optimální načasování operace. Reissfelder et al srovnávali operace provedené 5.–8. den a 4.–6. týden od ataky divertikulitidy v letech 1999–2001 a 2002–2005. Komplikace – absces v ráně (119/116 vs 5/94), leak (8/116 vs 0/94) a konverze (9/116 vs 1/94) byly významně častější při operaci časně po zánětlivé atace [146]. Riziko rekurence se zvyšuje při kolosigmoideální anastomóze ve srovnání s anastomózou kolorektální (12,5 % vs 2,9 %, 236 nemocných) [147]. Systematický přehled recentních 68 studií zaměřených na indikaci, technické aspekty a výsledky chirurgické léčby publikovali Regenbogen et al [148]. Komplikace po klinicky nekomplikované atace divertikulitidy jsou vzácnější než 5 %, četnější rekurence a věk po 50 let nepredikují komplikovaný průběh a chronické potíže přetrvávají po resekci v 5–22 %. Je zřejmé, že vývoj směřuje k rezervovanějšímu přístupu ke klasické chirurgické léčbě. Podobně jako u jiných indikací se zvažuje možnost přístupu NOTES (endoskopická chirurgie využívající přístupu přes přirozené otvory – natural orifices endoscopic surgery), v tomto případě z transvaginálního přístupu pod laparoskopickou kontrolou [149].
Alternativní instrumentální léčba
V případě určení divertiklů jako zdroje krvácení se okamžitě přistupuje k léčbě, při níž se využívají stejné principy jako při stavění krvácení z horní části trávicí trubice. Aplikuje se roztok adrenalinu, koagulace termickou sondou, klipy či adhezivní činidla a krvácející divertikl lze strangulovat ligací. Podle jedné studie bylo adrenalinem a klipy dosaženo zástavy krvácení u všech 5 nemocných, podle jiné bylo ligací zastaveno krvácení u 25 z 27 nemocných. Srovnávací studie ze zřejmých důvodů nelze očekávat. Je prokázáno, že časná endoskopie a následná léčba je provázena nižším rizikem recidivujícího krvácení než koloskopie opožděná. V případě inkluzivní koloskopie lze provést scintigrafii, její výtěžnost se ovšem pohybuje pod 80 %, a naopak nesprávné určení zdroje krvácení je běžné. Zejména v Asii se dosahuje dobrých výsledků u angiografie, kterou může následovat superselektivní katetrizace větví a. mesenterica a aplikace coilů, obturujícího gelu či mikročástic [150–152].
Závěr
U divertikulární nemoci se mění charakter onemocnění. V diagnostice je aktuálním přínosem vyšetření kalprotektinu ve stolici monitorující zánět i účinnost léčby. V léčebné praxi přes rozdílné výsledky studií víceméně panuje shoda o prospěšnosti diety s vyšším obsahem vlákniny, která se příznivě uplatňuje i z jiných důvodů. V medikamentózní léčbě se studoval účinek probiotik, mesalazinu i nevstřebatelných antibiotik, a to samostatně i v kombinacích, velmi často s kontraverzními závěry, nicméně opět v praxi se tyto léky doporučují. V léčbě nekomplikované nemoci je třeba tuto léčbu indikovat uvážlivě v korelaci s tíží symptomů i osobnostním profilem nemocného. Tato léčba se může podávat také v prevenci rekurence divertikulitidy. Ze všech farmak vykazují nejkonzistentnější výsledky studie s rifaximinem, který by se měl podávat intervalově. K léčbě nekomplikované zánětlivé ataky bez známek sepse může postačit dostatečná hydratace, v případě těžkého zánětu a komplikací jsou na místě antibiotika. Absces by měl být přednostně drenován pod CT-kontrolou. I perforace a peritonitida se ve většině případů zvládne drenáží bez následné resekce postiženého úseku. Případná elektivní operace a její načasování by se měly zvažovat individuálně. Zvyšuje se podíl laparoskopického přístupu. Časnější chirurgický zásah by měl být zvažován u mladších a imunokompromitovaných nemocných.
prof. MUDr. Julius Špičák, CSc.
Klinika hepatogastroenterologie IKEM, Praha
Doručeno do redakce: 6. 3. 2018
Přijato po recenzi: 18. 4. 2018
Sources
- Clemens CH, Samsom M, Roelofs J et al. Colorectal visceral perception in diverticular disease. Gut 2004; 53(5): 717–722.
- Jung HK, Choung RS, Locke GR et al. Diarrhea-predominant irritable bowel syndrome is associated with diverticular disease? A population-based study. Am J Gastroenterol 2010; 105(3): 652–661. Dostupné z DOI: <http://dx.doi.org/10.1038/ajg.2009.621>.
- Peery AF, Barrett PR, Park D et al. A high-fiber diet does not protect against asymptomatic diverticulosis. Gastroenterology 2012; 142(2): 266–272. Dostupné z DOI: <http://dx.doi.org/10.1053/j.gastro.2011.10.035>.
- Kang JY, Hoare J, Tinto A et al. Diverticular disease of the colon – on the rise: A study of hospital admission in England between 1989/1990 and 1999/2000. Aliment Pharmacol Ther 2003; 17(9): 1189–1195.
- Shaheen NJ, Hansen RA, Morgan DR et al. The burden of gastrointestinal and liver diseases, 2006. Am J Gastroenterol 2006; 101(9): 2128–2138. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1572–0241.2006.00723.x>.
- Stollman N, Raskin JB. Diverticular disease of the colon. Lancet 2004; 363(9409): 631–639. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(04)15597–9>.
- Etzioni DA, Mack TM, Beart RW et al. Diverticulisis in the United States: 1998–2005: Changing patterns of disease and treatment. Ann Surg 2009; 249(2): 210–217. Dostupné z DOI: <http://dx.doi.org/10.1097/SLA.0b013e3181952888>.
- Hart AR, Kennedy HJ, Stebbings WS et al. How frequently do large bowel diverticula perforate? An incidence and cross-sectional study. Eur J Gastroenterol Hepatol 2000; 12(6): 661–665.
- Lamps LW, Knapple WL. Diverticular disease-associated segmental colitis. Clin Gastroenterol Hepatol 2007; 5(1): 27–31. Dostupné z DOI: <http://dx.doi.org/10.1016/j.cgh.2006.10.024>.
- Mulhall AM, Mahid SS, Petras RE et al. Diverticular disease associated with inflammatory bowel disease-like colitis: a systematic review. Dis Colon Rectum 2009; 52(6): 1072–1079. Dostupné z DOI: <http://dx.doi.org/10.1007/DCR.0b013e31819ef79a>.
- Horgan AF, McConell EJ, Wolff BD et al. Atypical diverticular disease: surgical results. Dis Colon Rectum 2001; 44(9): 1315–1318.
- Hinchey EJ, Schaal PGH, Richards GK. Treatment of perforated diverticular disease of the colon. Adv Surg 1978; 12 : 85–109.
- Hansen O, Stock W. Prophylactische operation bei der divertikelkrankheit des kolons – stufenkoncept durch exakte stadienteilung. Lagenbecks Arch Chir 1999; 10(Suppl II): 1257–1260.
- Klarenbeek BR, de Korte N, van der Peet D et al. Review of current classifications for diverticular disease and translation into clinical practice. Int J Colorectal Dis 2012; 27(2): 207–214. Dostupné z DOI: <http://dx.doi.org/10.1007/s00384–011–1314–5>.
- Kruis W, Germer ChT, Leifeld L et al. Diverticular disease: guidelines of the German society for Gastroenterology, Digestive and Metabolic Diseases and the German Society for General and Visceral Surgery. Digestion 2014; 90(3): 190–207. Dostupné z DOI: <http://dx.doi.org/10.1159/000367625>.
- Tursi A, Brandimarte G, Di Mario F et al. Development and validation of an endoscopic classification of diverticular disease of the colon: the DICA classification. Dig Dis 2015; 33(1): 68–76. Dostupné z DOI: <http://dx.doi.org/10.1159/000366039>.
- Warner E, Crighton EJ, Moineddin R et al. Fourteen-year study of hospital admissions for diverticular disease in Ontario. Can J Gastroenterol 2007; 21(2): 97–99.
- Kang JY, Firwana B, Green AE et al. Uncomplicated diverticular disease is not a common cause of colonic symptoms. Aliment Pharmacol Ther 2011; 33(4): 487–494. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1365–2036.2010.04540.x>.
- Painter NS, Burkitt DP. Diverticular disease of the colon: a deficiency disease of Western civilization. BMJ 1971; 2(5759): 450–454.
- Burkitt DP, Walker AR, Painter NS. Effect of dietary fiber on stool and the transit-times, and its role in the causation of disease. Lancet 1972; 2(7792): 1408–1412.
- Arora G, Mannalittara A, Mithal A et al. Concurrent conditions in patients with chronic constipation: a population-based study. PLOS One 2012; 7(10): e42910. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pone.0042910>.
- Peery AF, Barrett PR, Park D et al. A high-fiber diet does not protect against asymptomatic diverticulosis. Gastroenterology 2012; 142(2): 266–272. Dostupné z DOI: <http://dx.doi.org/10.1053/j.gastro.2011.10.035>.
- Strate LL, Liu YL, Syngal S et al. Nut, corn, and popcorn consumption and the incidence of diverticular disease. JAMA 2008; 300(8): 907–914. Dostupné z DOI: <http://dx.doi.org/10.1001/jama.300.8.907>.
- Crowe FL, Balkwill A, Cairns BJ et al. Source of dietary fibre and diverticular disease incidence: a prospective study of UK women. Gut 2014; 63(9): 1450–1456. Dostupné z DOI: <http://dx.doi.org/10.1136/gutjnl-2013–304644>.
- Hjern F, Wolk A, Hakansson N Smoking and the risk of diverticular disease in women. Br J Surg 2011; 98(8): 997–1002. Dostupné z DOI: <http://dx.doi.org/10.1002/bjs.7477>.
- Humes DJ, Fleming KM, Spiller RC et al. Concurrent drug use and the risk of perforated colonic diverticular disease: a population-based case-control study Gut 2011; 60(2): 219–224. Dostupné z DOI: <http://dx.doi.org/10.1136/gut.2010.217281>.
- Strate LL, Liu YL, Huang ES et al. Use of aspirin or nonsteroidal antiinflammatory drugs increases risk for diverticulitis and diverticular bleeding. Gastroenterology 2011; 140(5): 1427–1433. Dostupné z DOI: <http://dx.doi.org/10.1053/j.gastro.2011.02.004>.
- Morris CR, Harvey IM, Stebbings WS et al. Do calcium channel blockers and antimuscarinics protect against perforated colonic diverticular disease? A case control study. Gut 2003; 52(12): 1734–1737.
- Nagata N, Niikura R, Aoki T et al. Risk factors for adverse in-hospital outcomes in acute colonic diverticular hemorrhage. World J Gastroenterol 2015; 21(37): Dostupné z DOI: <http://dx.doi.org/10697–10703.10.3748/wjg.v21.i37.10697>.
- Hjern F, Wolk A, Hakansson N. Obesity, physical inactivity, and colonic diverticular disease requiring hospitalization in women: a prospective cohort study. Am J Gastroenterol 2012; 107(2): 296–302. Dostupné z DOI: <http://dx.doi.org/10.1038/ajg.2011.352>.
- Tennesen H, Engholm G, Moller H. Association between alcoholism and diverticulitis. Br J Surg 1999; 86(8): 1067–1068. Dostupné z DOI: <http://dx.doi.org/10.1046/j.1365–2168.1999.01171.x>.
- Hwang SS, Cannom RR, Abbas MA et al. Diverticulitis in transplant patients and patients on chronic corticosteroid therapy: a systematic review. Dis Colon Rectum 2010; 53(12): 1699–1707. Dostupné z DOI: <http://dx.doi.org/10.1007/DCR.0b013e3181f5643c>.
- Rencuzogullari A, Ozuner G, Binboga S et al. Colonic diverticulosis and diverticulitis in renal transplant recipients. Management and long-term outcomes. Ann Surg 2017; 83(3): 303–307.
- Bassotti G, Sietchiping-Nzepa F, De Roberto G et al. Colonic regular contractile frequency patterns in irritable bowel syndrome: the “spastic colon” revisited. Eur J Gastroenterol Hepatol 2004; 16(6): 613–617.
- Golder M, Burleigh DE, Belai A et al. Smooth muscle cholinergic denervation hypersensitivity in diverticular disease. Lancet 2003; 361(9373): 1945–1951. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(03)13583–0>.
- Böttner M, Barrenschee M, Hellwig I et al. The enteric serotonergic system is altered in patients with diverticular disease. Gut 2013; 62(12): 1753–1762. Dostupné z DOI: <http://dx.doi.org/10.1136/gutjnl-2012–302660>.
- Bassotti G, Battaglia E, Bellone G et al. Interstitial cells of Cajal, enteric nerves, and glial cells in colonic diverticular disease. J Clin Pathol 2005; 58(9): 973–977. Dostupné z DOI: <http://dx.doi.org/10.1136/jcp.2005.026112>.
- Milner P, Crowe R, Kamm MA et al. Vasoactive intestinal polypeptid levels in sigmoid colon in idiopath0ic constipation and diverticular disease. Gastroenterology 1990; 99(3):666–675.
- Wess L, Eastwood M, Wess T et al. Cross linking of collagen is increased in colonic diverticulosis. Gut 1995; 37(1): 91–94.
- Meijer M, Mieremet-Ooms M, van der Zon et al. Increased matrix metalooproteinases-1, -2, -3 a -9 activity in patients with inflammatory bowel disease and the relation with Crohn disease phenotype. Dig Liver Dis 2007; 39(8): 733–739. Dostupné z DOI: <http://dx.doi.org/10.1016/j.dld.2007.05.010>.
- Tursi A, Papa A, Danese S et al. Review article: the pathophysiology and medici management of diverticulosis and diverticular disease of the colon. Aliment Pharmacol Ther 2015; 42(6): 664–684. Dostupné z DOI: <http://dx.doi.org/10.1111/apt.13322>.
- Strate L, Erichsen R, Baron J et al. Heritability and familial aggregation of diverticular disease: a population based study of twins and siblings. Gastroenterology 2013; 144(4): 736–742.e1; quiz e14. Dostupné z DOI: <http://dx.doi.org/10.1053/j.gastro.2012>.
- Granlund J, Svensson T, Olén O et al. The genetic influence on diverticular disease – a twin study. Aliment Pharmacol Ther 2012; 35(9): 1103–1107. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1365–2036.2012.05069.x>.
- Conelly T, Berg A, Hegarty J et al. The TNFSF15 gene single nucleotide polymorphism rs 7848647 is associated with surgical diverticulitis. Ann Surg 2014; 259(6): 1132–1137. Dostupné z DOI: <http://dx.doi.org/10.1097/SLA.0000000000000232>.
- Tursi A, Brandimarte G, Giorgetti GM et al. Assessment of small intestinal bacterial overgrowth in uncomplicated acute diverticulitis of the colon. World J Gastroenterol 2005; 11(18): 2773–2776.
- Horgan AF, McConnell EJ, Wolff BG et al. Atypical diverticular disease: surgical results. Dis Colon Rectum 2001; 44(9): 1315–1318.
- Parks TG. Natural history of diverticular disease of the colon. Clin Gastroenterol 1975; 4(1): 53.
- De Cecco CN, Ciolina M, Annibale B et al. Prevalence and dostibution of colonic diverticula assessed with CT colonography (CTC). Eur Radiol 2016; 26(3): 639–645. Dostupné z DOI: <http://dx.doi.org/10.1007/s00330–015–3866–1>.
- Painter NS, Truelove SC, Ardran GM et al. Segmentation and the localization of intraluminal pressures in the human colon, with special reference to the pathogenesis of colonic diverticula. Gastroenterology 1968; 54(4): Suppl): 778–780.
- Sugihara K, Muto T, Morioka Y et al. Diverticular disease of the colon in Japan: A review of 615 cases. Dis Colon Rectum 1984; 27(8): S531-S537.
- Lohsiriwat V, Suthikeeree W. Pattern and distribution of colonic diverticulosis: Analysis of 2877 barium enemas in Thailand. World J Gastroenterol 2013; 19(46): 8709–8713. Dostupné z DOI: <http://dx.doi.org/10.3748/wjg.v19.i46.8709>.
- Ashktorab H, Panchal H, Shokrani B et al. Association between diverticular disease and pre-neoplastic colorectal lesions in an urban African-american population. Digestion 2015; 92(2): 60–65.
- Wong ER, Idris F, Chong CF et al. Diverticular disease and colorectal neoplasms: association between left sided diverticular disease with colorectal cancers and right sided with slonic polyps. Asian Pac J Cancer Prev 2016; 17(5): 2401–2405.
- Tursi A, Elisei W, Picchio M et al. Moderate to severe and prolonged left lower-abdominal pain is the best symptom characterizing symptomatic uncomplicated diverticular disease of the colon: comparison with fecal calprotectin in clinical setting. J Clin Gastroenterol 2015; 49(3): 218–221. Dostupné z DOI: <http://dx.doi.org/10.1097/MCG.0000000000000094>.
- Green BT, Rockey DC, Portwood G et al. Urgent colonoscopy for evaluation and management of acute lower gastrointestinal haemorrhage: a randomised controlled trial. Am J Gastroenterol 2005; 100(11): 2395–2402. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1572–0241.2005.00306.x>.
- Laméris W, van Randen A, Bipat S et al. Graded compression ultrasonography and computed tomography in acute diverticulitis: Metaanalysis of the test accuracy. Eur Radiol 2008; 18(11): 2498–2511. Dostupné z DOI: <http://dx.doi.org/10.1007/s00330–008–1018–6>.
- Heverhagen JT, Sitter H, Zielke A et al. Prospective evaluation of the value of magnetic resonance imaging in suspected acute sigmoid diverticulitis. Dis Colon Rectum 2008; 51(12): 1810–1515. Dostupné z DOI: <http://dx.doi.org/10.1007/s10350–008–9330–4>.
- Saghnini E, Lahat A, Melzer E et al. Early colonoscopy in patients with acute diverticulitis. Results of a prospective pilot study. Endoscopy 2004; 36(6): 504–507. Dostupné z DOI: <http://dx.doi.org/10.1055/s-2004–814398>.
- Brar MS, Roxin G, Yaffe PB et al. Colonoscopy following nonoperative management of uncomplicated diverticulitis may not be warranted. Dis Colon Rectum 2013; 56(11): 1259–1264. Dostupné z DOI: <http://dx.doi.org/10.1097/DCR.0b013e3182a26bfd>.
- Sharma PV, Eglington T, Hider P et al. Systematic review and metaanalysis of the role of routine colonic evaluation after radiologically confirmed acute diverticulitis. Ann Surg 2014; 259(2): 263–272. Dostupné z DOI: <http://dx.doi.org/10.1097/SLA.0000000000000294>.
- Melchor S, Cudovic D, Jones J et al. Diagnostic and surgical management of colovesical fistulas due to sigmoid diverticulitis. J Urol 2009; 182(3): 978–982. Dostupné z DOI: <http://dx.doi.org/10.1016/j.juro.2009.05.022>.
- Taylor I, Duthie HL. Bran tablets and diverticular disease. Br Med J 1976; 1(6016): 988–990.
- Brodribb AJ. Treatment of symptomatic diverticular disease with a high-fiber diet. Lancet 1977; 1(8013): 664–666.
- Hodgson WJ. The placebo effect. Is it important in diverticular disease? Am J Gastroeterol 1977; 67(2): 157–162.
- Ornstein MH, Litlewood ER, Baird IM et al. Are fibre supplementation really necessary in diverticular disease of the colon? A controlled clinical trial. Br Med J 1981; 282(6273): 1353–1356.
- Smits BJ, Whitehead AM, Prescott P. Lactulose in the treatment of symptomatic diverticular disease: a comparative study with high-fiber diet. Br J Clin Pract 1990; 44(8): 314–318.
- Aldori VH, Giovannuci EL, Rimm EB et al. A prospective study of the diet and the risk of symptomatic diverticular disease in men. Am J Clin Nutr 1994; 60(5): 757–764. Dostupné z DOI: <http://dx.doi.org/10.1093/ajcn/60.5.757>.
- Tursi A. Diverticular disease: a therapeutic overview. World J gastrointest Pharmacol Ther 2010; 1(1): 27–35. Dostupné z DOI: <http://dx.doi.org/10.4292/wjgpt.v1.i1.27>.
- Adamová Z. Divertikulární nemoc tračníku. Rozhl Chir 2011; 90(8): 463–477.
- Antoš F. Divertikulární choroba tlustého střeva. 2. vyd. Avicenum: Praha 1990 : 141–149. ISBN 80–201–0027-X.
- Hoch J. Akutní chirurgie tlustého střeva. Maxdorf: Praha 1998. ISBN 80–85800–85–3.
- Kazil P, Kazilová MA Divertikulární nemoc tračníku. Grada: Praha 2007. ISBN 978–80–247–1916–0.
- Űnlű C, Daniels L, Bart C et al. A systematic review of highe-fibre dietary therapy in diverticular disease. Int J Colorectal Dis 2012; 27(4): 419–427. Dostupné z DOI: <http://dx.doi.org/10.1007/s00384–011–1308–3>.
- Eisei W, Tursi A. Recent advances in the treatment of colonic diverticular disease and prevention of acute diverticulitis. Ann Gastroenterol 2016; 29(1): 24–32.
- Chabok A, Pahlma L, Hjem F et al. Randomized clinical trial of antibiotics in acute uncomplicated diverticulitis. Br J Surg 2012; 99(4): 532–539. Dostupné z DOI: <http://dx.doi.org/10.1002/bjs.8688>.
- Daniels L, Ünlü C, de Korte N et al. Randomized clinical trial of observational versus antibiotic treatment for a first episode of CT-proven uncomplicated acute diverticulitis. Br J Surg 2017; 104(1): 52–61. Dostupné z DOI: <http://dx.doi.org/10.1002/bjs.10309>.
- Űnlű C, de Korte N, Daniels I et al. A multicenter randomized clinical trial investigating the cost-effectiveness of treatment strategies with or without antibiotic for uncomplicated acute diverticulitis (DIABOLO trial). BMC Surg 2010; 10 : 23. Dostupné z DOI: <http://dx.doi.org/10.1186/1471–2482–10–23>.
- Trepsi E, Colla C, Panizza P et al. Therapeutic and prophylactic role of mesalazine (5-ASA) in symptomatic diverticular disease of the large intestine. 4 year follow-up results. Minerva Gastroenterol Dietol 1999; 45(4): 245–252.
- Stollman N, Magowan S, Shanahn F et al. Efficacy of delayed relapse mesalazine in the prevention of GI symptoms following acute diverticulitis: results of the DIVA trial. J Clin Gastroenterol 2013; 47(7): 621–629. Dostupné z DOI: <http://dx.doi.org/10.1097/MCG.0b013e31828003f6>.
- Picchio M, Elisei W, Brandimarte G et al. Mesalazine for the Treatment of Symptomatic Uncomplicated Diverticular Disease of the Colon and for Primary Prevention of Diverticulitis: A Systematic Review of Randomized Clinical Trials. See comment in PubMed Commons below. J Clin Gastroenterol. 2016; 50(Suppl 1): S64-S69. Dostupné z DOI: <http://dx.doi.org/10.1097/MCG.0000000000000669>.
- Raskin JB, Kamm MA, Jamal MM et al. Mesalazine did not prevent recurrent diverticulitis in phase 3 controlled trials. Gastroenterology 2014; 147(4): 793–802. Dostupné z DOI: <http://dx.doi.org/10.1053/j.gastro.2014.07.004>.
- Di Mario F, Aragona G, Leandro G et al. Efficacy of mesalazine in the treatment of symptomatic diverticular disease. Dig Dis Sci 2005; 50(3): 581–586.
- Pandolfi F, Frosali S, Petruzziello L et al. Central and muskal immunity are modified by non-absorbable antibiotic treatment in uncomplicated diverticular disease. Mini Rev Med Chem July 2015; 16(3): 218–221.
- Papi C, Ciaco A, Koch M et al. Efficacy of rifaximin on symptoms of uncomplicated diverticular disease of the colon. A pilot multicentre open trial. Diverticular Disease Study Group. Gastroenterol 1992; 24(8): 452–456.
- Papi P, Ciaco A, Koch M et al. Efficacy of rifaximin in the treatment of symptomatic diverticular disease of the colon. A multicenter double-blind placebo-controled trial. Aliment Pharmacol Ther 1995; 9(1): 33–39.
- Latella G, Pimpo MT, Sottili S et al. Rifaximin improves symptoms of acquired uncomplicated diverticular disease of the colon. Int J Colorectal Dis 2003; 18(1): 55–62. Dostupné z DOI: <http://dx.doi.org/10.1007/s00384–002–0396–5>.
- Pistoia MA, Lombardi L, Rossi M et al. Does rifaximin prevent complications of diverticular disease? A retrospective study. Eur Rev Med Pharmacol Sci 2004; 8(6): 283–287.
- Colecchia A, Vestito A, Pasqui F et al. Efficacy of long term cyclic administration of the poorly absorbed antibiotic Rifaximin in symptomatic, uncomplicated colonic diverticular disease. World J Gastroenterol 2007; 13(2): 264–269.
- D´Inca H, Pomerri F, Vettorato GM et al. Interaction between rifaximin and dietary fibre in patients with diverticular disease. Alimet Pharmacol Ther 2007; 25(7): 771–779. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1365–2036.2007.03266.x>.
- Trivedi CD, Das KM. Emerging therapies for diverticular diseases of the colon. J Clin Gastroenterol 2008; 42(10): 1145–1151. Dostupné z DOI: <http://dx.doi.org/10.1097/MCG.0b013e318188adc1>.
- Bianchi M, Festa V, Moretti A et al. Meta-analysis: long-term therapy with rifaximin in the management of uncomplicated diverticular disease. Aliment Pharmacol Ther 2011; 33(8): 902–910. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1365–2036.2011.04606.x>.
- Calanni F, Renzulli C, Fogli MV. Comment on: Rifaximin in the treatment of irritable bowel syndrome. Is there a high risk for development of antimicrobial resistance? J Clin Gastroenterol 2013; 47(9): 814–815. Dostupné z DOI: <http://dx.doi.org/10.1097/MCG.0b013e318298a32c>.
- Stallinger S, Eller N, Högenauer C. Non-interventional study evaluating efficacy and tolerability of rifaximin for treatment of uncomplicated diverticular disease. Wien Klin Wochenschr. 2014; 126(1–2): 9–14. Dostupné z DOI: <http://dx.doi.org/10.1007/s00508–013–0447–7>.
- Festa V, Spoila Alegiani S, Chiesara F et al. Retrospective comparison of long-term ten-day month rifaximin or mesalazine in prevention of relapse in acute diverticulitis. Eur Rev Med Pharmacol Sci 2017; 21(6): 1397–1404.
- Maconi B, Babara G, Bosetti C et al. Treatment of diverticular disease of the colon and prevention of acute diverticulitis: a systematic review. Dis Colon Rectum 2011; 54(10): 1326–1338. Dostupné z DOI: <http://dx.doi.org/10.1097/DCR.0b013e318223cb2b>.
- Seth A, Yan F, Polk DB et al. Probiotics ameliorate the hydrogen peroxide-induced epithelial barrier disruption by a PKC - and MAP kinase-dependent mechanism. Am J Physiol Gastrointest Liver Physiol 2008; 294(4): G1060. Dostupné z DOI: <http://dx.doi.org/10.1152/ajpgi.00202.2007>.
- Yan F, Cao H, Cover TL et al. Soluble proteins produced by probiotic bacteria regulate intestinal epithelial cell survival and growth. Gastroenterology 2007; 132(2): 562. Dostupné z DOI: <http://dx.doi.org/10.1053/j.gastro.2006.11.022>.
- Borruel N, Carol M, Casellas F et al. Increased mucosal tumour necrosis factor alpha production in Crohn’s disease can be downregulated ex vivo by probiotic bacteria. Gut 2002; 51(5): 659.
- Lin YP, Thibodeaux CH, Peña JA et al. Probiotic Lactobacillus reuteri suppress proinflammatory cytokines via c-Jun. Inflamm Bowel Dis 2008; 14(8): 1068. Dostupné z DOI: <http://dx.doi.org/10.1002/ibd.20448>.
- Dalmasso G, Cottrez F, Imbert V et al. Saccharomyces boulardii inhibits inflammatory bowel disease by trapping T cells in mesenteric lymph nodes. Gastroenterology 2006; 131(6): 1812. Dostupné z DOI: <http://dx.doi.org/10.1053/j.gastro.2006.10.001>. Erratum in Gastroenterology 2007; 132(4): 1637.
- Rousseaux C, Thuru X, Gelot A et al. Lactobacillus acidophilus modulates intestinal pain and induces opioid and cannabinoid receptors. Nat Med 2007; 13(1): 35–37. Dostupné z DOI: <http://dx.doi.org/10.1038/nm1521>.
- Yan F, Polk DB. Probiotic bacterium prevents cytokine-induced apoptosis in intestinal epithelial cells. J Biol Chem 2002; 277(52): 50959–50965. Dostupné z DOI: <http://dx.doi.org/10.1074/jbc.M207050200>.
- Rachmilewitz D, Katakura K, Karmeli F et al. Toll-like receptor 9 signaling mediates the anti-inflammatory effects of probiotics in murine experimental colitis. Gastroenterology 2004; 126(2): 520.
- Katakura K, Lee J, Rachmilewitz D et al. Toll-like receptor 9-induced type I IFN protects mice from experimental colitis. J Clin Invest 2005; 115(3): 695. Dostupné z DOI: <http://dx.doi.org/10.1172/JCI22996>. Erratum in J Clin Invest 2005; 115(4): 1100.
- Yan F, Cao H, Cover TL et al. Soluble proteins produced by probiotic bacteria regulate intestinal epithelial cell survival and growth. Gastroenterology 2007; 132(2): 562. Dostupné z DOI: <http://dx.doi.org/10.1053/j.gastro.2006.11.022>.
- Tursi A, Brandimarte G, Giorgetti GM et al. Mesalazine and/or Lactobacillus casei in preventing recurrence of symptomatic uncomplicated diverticular disease of the colon: a prospective, randomized, open-label study. J Clin Gastroenterol 2006; 40(4): 312–316. Dostupné z DOI: <http://dx.doi.org/10.1097/01.mcg.0000210092.77296.6d>.
- Tursi A, Brandimarte G, Giorgetti GM et al. Balsalazide and/or high potency probiotic mixture (VSL#3) in maintaining remission after attack of acute, uncomplicated diverticulitis of the colon. Int J Colorectal Dis 2007; 22(9): 1103–1108. Dostupné z DOI: <http://dx.doi.org/10.1007/s00384–007–0299–6>.
- Lamiki P, Tsuchiya J, Pathak S et al. Probiotics in diverticular disease of the colon: an open label study. J Gastrointestin Liver Dis 2010; 19(1): 31–36.
- Tursi A, Brandimarte G, Elisei W. Randomised clinical trial: mesalazine and/or probiotics in maintaining remission of symptomatic uncomplicated diverticular disease – a double-blind, randomised, placebo-controlled study. Aliment Pharmacol Ther 2013; 38(7): 741–751. Dostupné z DOI: <http://dx.doi.org/10.1111/apt.12463>.
- Fric P, Zavoral M. The effect of non-pathogenic Escherichia coli in symptomatic uncomplicated diverticular disease of he colon. Eur J Gastroenterol Hepatol 2003; 15(3): 313–315. Dostupné z DOI: <http://dx.doi.org/10.1097/01.meg.0000049998.68425.e2>.
- Lahner E, Bellisario C, Hassan C et al. Probiotics in the Treatment of Diverticular Disease. A Systematic Review. J Gastrointestin Liver Dis 2016; 25(1): 79–86. Dostupné z DOI: <http://dx.doi.org/10.15403/jgld.2014.1121.251.srw>.
- De Bastiani R, Sanna G, Fracasso P et al. The management of patients with diverticulosis and diverticular disease in primary care: An online surfy among italian general practicioners. J Clin Gastroenterol 2016; 50: (Suppl 1): S89-S92. Dostupné z DOI: <http://dx.doi.org/10.1097/MCG.0000000000000580>.
- Tursi A, Picchio M, Elisei W et al. Current management of patients with diverticulitis and diverticular disease: a survey from the 2nd international symposium on diverticular disease. J Clin Gastroenterol 2016; 50(Suppl 1): S97-S100. Dostupné z DOI: <http://dx.doi.org/10.1097/MCG.0000000000000645>.
- Chappuis CW, Cohn I Jr. Acute colonic diverticulitis. Surg Clin North Am 1988; 68(2): 301–313.
- Biondo S, Parés D, Martí Ragué J et al. Acute colonic diverticulitis in patients under 50 years of age. Br J Surg 2002; 89(9): 1137–1141. Dostupné z DOI: <http://dx.doi.org/10.1046/j.1365–2168.2002.02195.x>.
- Schauer PR, Ramos R, Ghiatas AA et al. Virulent diverticular disease in young obese men. Am J Surg 1992; 164(5): 443–446; discussion 446–448.
- Chodak GW, Rangel DM, Passaro E Jr. Colonic diverticulitis in patients under age 40: need for earlier diagnosis. Am J Surg 1981; 141(6): 699–702.
- Young-Fadok T, Sgambati S, Wolff B. Increased morbidity and mortality after colectomy in patients with lupus: A case-matched series (abstract). Dis Colon Rectum 2000; 43: A57.
- Fischer MG, Farkas AM. Diverticulitis of the cecum and ascending colon. Dis Colon Rectum 1984; 27(7): 454–458.
- Markham NI, Li AK. Diverticulitis of the right colon – experience from Hong Kong. Gut 1992; 33(4): 547–549.
- Lo CY, Chu KW. Acute diverticulitis of the right colon. Am J Surg 1996; 171(2): 244–246. Dostupné z DOI: <http://dx.doi.org/10.1016/S0002–9610(97)89559–1>.
- Schultz JK, Yaqub S, Wallon C et al. Laparoscopic lavage vs. primary resection for acute perforated diverticulitis: the SCANDIV randomized clinical trial. JAMA 2015; 314(13): 1364–1375. Dostupné z DOI: <http://dx.doi.org/10.1001/jama.2015.12076>.
- Ambrosetti P, Chautems R, Siravia C et al. Long-term outcome of mesocolic and pelvic diverticular abscesses of the left colon: a prospective study of 73 cases. Dis Colon Rectum 2005; 48(4): 487–491. Dostupné z DOI: <http://dx.doi.org/10.1007/s10350–004–0853-z>.
- Siewert B, Tye G, Kruskal J et al. Impact of CT guided drainage in the treatment of diverticular abscesses: size matters. AJR Am J Roentgenol 2006; 186(3): 680–686. Dostupné z DOI: <http://dx.doi.org/10.2214/AJR.04.1708>. Erratum in AJR Am J Roentgenol 2007; 189(3): 512.
- Durmishi Y, Gervaz P, Brandt D et al. Results from percutaneous drainage of Hinchey stage II diverticulitis guided by computer tomography scan. Surg Endosc 2006; 20(7): 1129–1133. Dostupné z DOI: <http://dx.doi.org/10.1007/s00464–005–0574-y>.
- Kumar R, Kim JT, Haukoos JS et al. Factors affecting the successful management of intra-abdominal abscesses with antibiotics and the need for percutaneous drainage. Dis Colon Rectum 2006; 49(2): 183–189. Dostupné z DOI: <http://dx.doi.org/10.1007/s10350–005–0274–7>.
- Kronborg O. Treatment of perforated sigmoid diverticulitis: a prospective randomized trial. Br J Surg 1993; 80(4): 505–507.
- Zeitoun G, Laurent A, Fouffet F et al. Multicenter randomized clinical trial of primary versus secondary sigmoid resection in generalized peritonitis complicating sigmoid diverticulitis. Br J Surg 2000; 87(10): 1366–1374. Dostupné z DOI: <http://dx.doi.org/10.1046/j.1365–2168.2000.01552.x>.
- Saem L, Flum DR. Primary anastomosis or Hartmann´a procedure for patients with diverticular peritonitis. A systematic review. Dis Colon Rectum 2004; 47(11): 1953–1964.
- Constantidines VA, Tekkis PP, Athanasiou T et al. Primary resection with anastomosis vs. Hartmann procedure in nonelective surgery for acute colonic diverticulitis: a systematic review. Dis Colon Rectum 2006; 49(7): 966–981. Dostupné z DOI: <http://dx.doi.org/10.1007/s10350–006–0547–9>.
- Karoui M, Champault A, Pautrat K et al. Laparoscopic peritoneal lavage or primary anastomosis with defunctioning stoma for Hinchey 3 complicating diverticulitis: Results of a comparative study. Dis Colon Rectum 2009; 52(4): 609–615. Dostupné z DOI: <http://dx.doi.org/10.1007/DCR.0b013e3181a0a674>.
- Myers E, Hurley M, O´Sulivan GC et al. Laparoscopic peritoneal lavage for generalized peritonitis due to perforated diverticulitis. Br J Surg 2008; 95(1): 97–101. Dostupné z DOI: <http://dx.doi.org/10.1002/bjs.6024>.
- Swank HA, Vermeulen J, Lange JF et al. The Ladies Trial. Laparoscopic peritoneal lavage or resection for purulent peritonitis and Hartmmann´s procedure or resection with primary anastomosis for purulent or faecal peritonitis in perforated diverticulitis. BMC Surg 2010; 10 : 29. Dostupné z DOI: <http://dx.doi.org/10.1186/1471–2482–10–29>.
- Somasekar K, Foster ME, Haray PN et al. The natural history of diverticular disease. Is here a role for elective colectomy. J R Coll Surg Eding 2002; 47(2): 481–482.
- Broderick-Villa G, Burchette RJ, Collins JC et al. Hospitalization for acute diverticulitis does not mandate routine elective colectomy. Arch Surg 2005; 140(6): 576–581; discussion 581–583. Dostupné z DOI: <http://dx.doi.org/10.1001/archsurg.140.6.576>.
- Anaya DA, Flum DR. Risk of emergency colectomy and colostomy in patients with diverticular disease. Arch Surg 2005; 242(4): 576–581; discussion 581–583.
- Ricciardi R, Baxter N, Read TE et al. Is the decline in the surgical treatment for diverticulitis associated with an increase in complicating diverticulitis? Dis Colon Rectum 2009; 52(9): 1558–1563. Dostupné z DOI: <http://dx.doi.org/10.1007/DCR.0b013e3181a90a5b>.
- Hjern J, Josephson T, Altman D et al. Outcome of younger patients with acute diverticulitis. Br J Surg 2008; 95(6): 758–764. Dostupné z DOI: <http://dx.doi.org/10.1002/bjs.6137>.
- Vestweber B, Vestweber KH, Paiul C et al. Single-port laparoscopic resection for diverticular disease: experiences with more than 300 consecutive patients. Surg Endosc 2016; 30(1): 50–58. Dostupné z DOI: <http://dx.doi.org/10.1007/s00464–015–4160–7>.
- Klarenbeek BR, Bergamaschi R, Veenhof AA et al. Laparoscopic versus open sigmoid resection for diverticular disease: folow-up assessment of the randomized control Sigma Trial. Surg Endosc 2011; 25(4): 1121–1126. Dostupné z DOI: <http://dx.doi.org/10.1007/s00464–010–1327–0>.
- Klarenbeek BR, Coupé VM, van der Peet D Let al. The cost effectiveness of elective laparoscopic sigmoid resection for symptomatic diverticular disease: financial outcome of the randomized control Sigma trial.. Surg Endosc 2011; 25 : 776–783. Dostupné z DOI: <http://dx.doi.org/10.1007/s00464–010–1252–2>.
- Gervaz P, Inan I, Perneger T et al. A prospective, randomized, single-blind comparizon of laparoscopic vs. open sigmoid colectomy for diverticulitis. Ann Surg 2010; 252(1): 3–8. Dostupné z DOI: <http://dx.doi.org/10.1097/SLA.0b013e3181dbb5a5>.
- Purkayastha S, Constantidines VA, Tekkis PP et al. Laparoscopic vs. open resection for diverticular disease: a metaanalysis of non-randomized studies. Dis Colin Rectum 2006; 49(4): 446–463. Dostupné z DOI: <http://dx.doi.org/10.1007/s10350–005–0316–1>.
- Jones OM, Stevenson ARL, Clask D et al. Laparoscopic resection for diverticular disease: follow-up of 500 consecutive patients. Ann Surg 2008; 248(6): 1092–1097. Dostupné z DOI: <http://dx.doi.org/10.1097/SLA.0b013e3181884923>.
- Cirocchi R, Di Saverio S, Weber DG et al. Laparoscopic lavage versus surgical resection for acute diverticulitis with generalised peritonitis: a systematic review and meta-analysis. Tech Coloproctol 2017; 21(2): 93–110. Dostupné z DOI: <http://dx.doi.org/10.1007/s10151–017–1585–0>.
- Reissfelder C, Burh HJ, Ritz JP. What is the optimal time of surgical intervention after an acute attack of sigmoid diverticulitis: early or late elective laparoscopic resection? Dis Colon Rectum 2006; 49(12): 1842–1848. Dostupné z DOI: <http://dx.doi.org/10.1007/s10350–006–0730-z>.
- Thaler K, Baig MK, Berho M et al. Determinants of recurrence after sigmoid resection for uncomplicated diverticulitis. Dis Colon Rectum 2003; 46(3): 385–388. Dostupné z DOI: <http://dx.doi.org/10.1097/01.DCR.0000054638.76404.3B>.
- Regenbogen SE, Hardiman KM, Hendren S et al. Surgery for diverticulitis in the 21st century: a systematic review. JAMA Surg 2014; 149(3): 292–303. Dostupné z DOI: <http://dx.doi.org/10.1001/jamasurg.2013.5477>.
- Senft JD, Warschkow R, Diener MK et al. The transvaginal hybrid NOTES versus conventionally assisted laparoscopic sigmoid resection for diverticular disease (TRANSVERSAL) trial: study protocol or a randomized controlled trial. Trials 2014; 15 : 456. Dostupné z DOI: <http://dx.doi.org/10.1186/1745–6215–15–456>.
- Yap FY, Omene BO, Patel MN et al. Transcatheter emboltherapy for gastrointestinal bleeding: a single center review of safety, efficacy, and clinical outcomes. Dig Dis Sci. 2013; 58(7): 1976–1984. Dostupné z DOI: <http://dx.doi.org/10.1007/s10620–012–2547-z>.
- Couto-Wörner I, González-Conde B, Estévez-Prieto E et al. Colonic diverticular bleeding: Urgent colonoscopy without purging and endoscopic treatment with epinephrine and hemoclips. Rev Esp Enferm Dig 2013; 105(8): 495–498.
- Ghassemi KA, Jensen DM. Lower GI Bleeding: Epidemiology and Management. Curr Gastroenterol Rep 2013; 15(7): 333. Dostupné z DOI: <http://dx.doi.org/10.1007/s11894–013–0333–5>.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2018 Issue 6
-
All articles in this issue
- Současné trendy v diagnostice a léčbě refluxní nemoci jícnu
- Terapie peptického vředu
- Historie celiakie
- Celiakie v roce 2018
- Diagnostika poruch motility gastrointestinálního traktu
- Divertikulární choroba: diagnostika a léčba
- Familiární adenomatózní polypóza: komplexní péče o pacienty
- Konvenční a biologická terapie idiopatických střevních zánětů
- Péče o IBD pacienty v terénní praxi
- PSC-IBD: specifický fenotyp idiopatického střevního zánětu asociovaný s primární sklerózující cholangitidou
- Možnosti terapeutické manipulace se střevní mikrobiotou
- Prokinetika a jejich využití v gastroenterologii
- Screening kolorektálního karcinomu
- Terapeutická digestivní endoskopie I
- Terapeutická digestivní endoskopie II
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Prokinetika a jejich využití v gastroenterologii
- Divertikulární choroba: diagnostika a léčba
- Diagnostika poruch motility gastrointestinálního traktu
- Současné trendy v diagnostice a léčbě refluxní nemoci jícnu