Patofyziologie, příčiny a epidemiologie chronického srdečního selhání
Pathophysiology, causes and epidemiology of chronic heart failure
The prevalence of heart failure in developed countries is about 1–2 % in general and in patients above 70 years over 10 %. HFpEF is the cause of heart failure from 22 to 73 %, exact data are not available. If compared with HFrEF, patients with HFpEF are older, more frequent women with hypertension and atrial fibrillation, but less myocardial infarction in their history. Heart failure is a hemodynamic disorder and the pathophysiologic basis is cardiac output, cardiac contractility, filling pressures, wall stress during systolic and diastolic function and heart rate. The neurohumoral activation is very important for the diagnosis as well as prognosis and the most sensitive seems to be brain natriuretic peptide (BNP), respectively the precursor NT-proBNP, which become a part of the new diagnostic classification and are a part of modern treatment.
Key words:
heart failure – hemodynamics – neurohumoral activation
Authors:
Jindřich Špinar 1; Lenka Špinarová 2; Jiří Vítovec 2
Authors‘ workplace:
Interní kardiologická klinika LF MU a FN Brno, pracoviště Bohunice
1; I. interní kardio-angiologická klinika LF MU a FN u sv. Anny v Brně
2
Published in:
Vnitř Lék 2018; 64(9): 834-838
Category:
Reviews
Overview
Prevalence srdečního selhání v dospělé populaci průmyslově rozvinutých zemí je přibližně 1–2 %; u osob ve věku > 70 let se zvyšuje na hodnotu ≥ 10 %. Podíl pacientů se srdečním selháním se zachovanou ejekční frakcí (Heart Failure with preserved Ejection Fraction – HFpEF) se pohybuje v rozmezí 22–73 %. Zdá se, že HFpEF a HFrEF (srdeční selhání se sníženou ejekční frakcí – Heart Failure with reduced Ejection Fraction) mají různé epidemiologické a etiologické profily. Ve srovnání s HFrEF jsou nemocní s HFpEF starší, častěji se jedná o ženy a častěji mají v anamnéze hypertenzi a fibrilací síní, zatímco infarkt myokardu se v jejich anamnéze objevuje méně často. Srdeční selhání je považováno za hemodynamickou poruchu, jejíž patofyziologický základ vychází z parametrů určujících srdeční výdej, tj. ze srdeční stažlivosti, náplně komory na konci diastoly, napětí stěny komory během systoly a srdeční frekvence. Velmi důležitá je neurohumorální aktivace, z prognostického i diagnostického hlediska je zcela zásadní mozkový natriuretický peptid (Brain Natriuretic Peptide – BNP), resp. jeho prekurzor NT-proBNP secernovaný v srdečních komorách, který se stal i základním kamenem pro diagnostiku a jeho snížené odbourávání je součástí moderní léčby.
Klíčová slova:
hemodynamika – neurohumorální aktivace – srdeční selhání
Definice srdečního selhání
Srdeční selhání je klinický syndrom charakterizovaný typickými symptomy (např. dušností, otoky kotníků a únavou), jež mohou být doprovázeny známkami (např. zvýšeným tlakem v krčních žilách, chrůpky na plicích a otoky končetin) vyvolanými strukturálními anebo funkčními srdečními abnormalitami vedoucími ke sníženému srdečnímu výdeji nebo ke zvýšeným nitrosrdečním tlakům v klidu nebo při zátěži.
Diagnostika a klasifikace srdečního selhání
V roce 2016 zveřejnila Evropská kardiologická společnost (European Society of Cardiology – ESC) nová doporučení pro diagnostiku a léčbu akutního a chronického srdečního selhání (Heart Failure – HF) [1–4]. Změn se proti doporučením z roku 2012 objevila celá řada, a to jak v diagnostice, tak v léčbě farmakologické i nefarmakologické, ale také v organizaci péče o nemocné s HF.
Epidemiologie a etiologie srdečního selhání
Prevalence HF v dospělé populaci průmyslově rozvinutých zemí je přibližně 1–2 %; u osob ve věku > 70 let se zvyšuje na hodnotu ≥ 10 % (graf 1 a graf 2). Podíl pacientů se srdečním selháním se zachovanou ejekční frakcí (Heart Failure with preserved Ejection Fraction – HFpEF) se pohybuje v rozmezí 22–73 %. Zdá se, že HFpEF a HFrEF (srdeční selhání se sníženou ejekční frakcí – Heart Failure with reduced Ejection Fraction) mají různé epidemiologické a etiologické profily (graf 3). Ve srovnání s HFrEF jsou nemocní s HFpEF starší, častěji se jedná o ženy a častěji mají v anamnéze hypertenzi a fibrilací síní (FS), zatímco infarkt myokardu (IM) se v jejich anamnéze objevuje méně často. Charakteristiky pacientů s ejekční frakcí ve středním pásmu (Heart Failure with mid-range Ejection Fraction – HFmrEF) jsou někde mezi charakteristikami jedinců s HFrEF a HFpEF; přesnější popis této populace si však vyžádá další studie. (Poznámka autora: Není jasně stanoveno, kam řadit HFmrEF, zda do systolické či diastolické dysfunkce.)



Chronické srdeční selhání jako následek organických srdečních onemocnění má zákonitě heterogenní charakter. Znamená to jeho nejednotný klinický obraz, měnící se průběh, diagnostické a léčebné těžkosti. Protože je zpravidla spojené se špatnou prognózou, představuje HF nejen velikou zátěž pro zdravotnictví a rodinu, ale znamená též značné společensko-ekonomické břemeno a stalo se v posledních letech závažným celospolečenským problémem. Příčiny chronického srdečního selhání na konci 20. století jsou zcela odlišné, než byly před 30 či 50 lety. Dříve byla hlavní příčinou hypertenze a porevmatické chlopenní srdeční vady především mitrální stenóza. V současné době při správné kontrole hypertenze a včasné indikaci zákroku na chlopních je nejčastější příčinou chronického HF ischemická choroba srdeční (50–70 %) a dilatační kardiomyopatie (20–30 %). Chlopenní vady vrozené či získané se na celkovém výskytu chronického HF podílejí asi 10 %, samotná hypertenze taktéž asi 10 %. Poslední data z Framinghamské studie dokonce ukazují, že ischemická choroba srdeční a hypertenze (samostatně či v kombinaci) jsou hlavní příčinou až u 90 % nemocných [5]. Příčiny srdečního selhání ukazuje tab. 1.
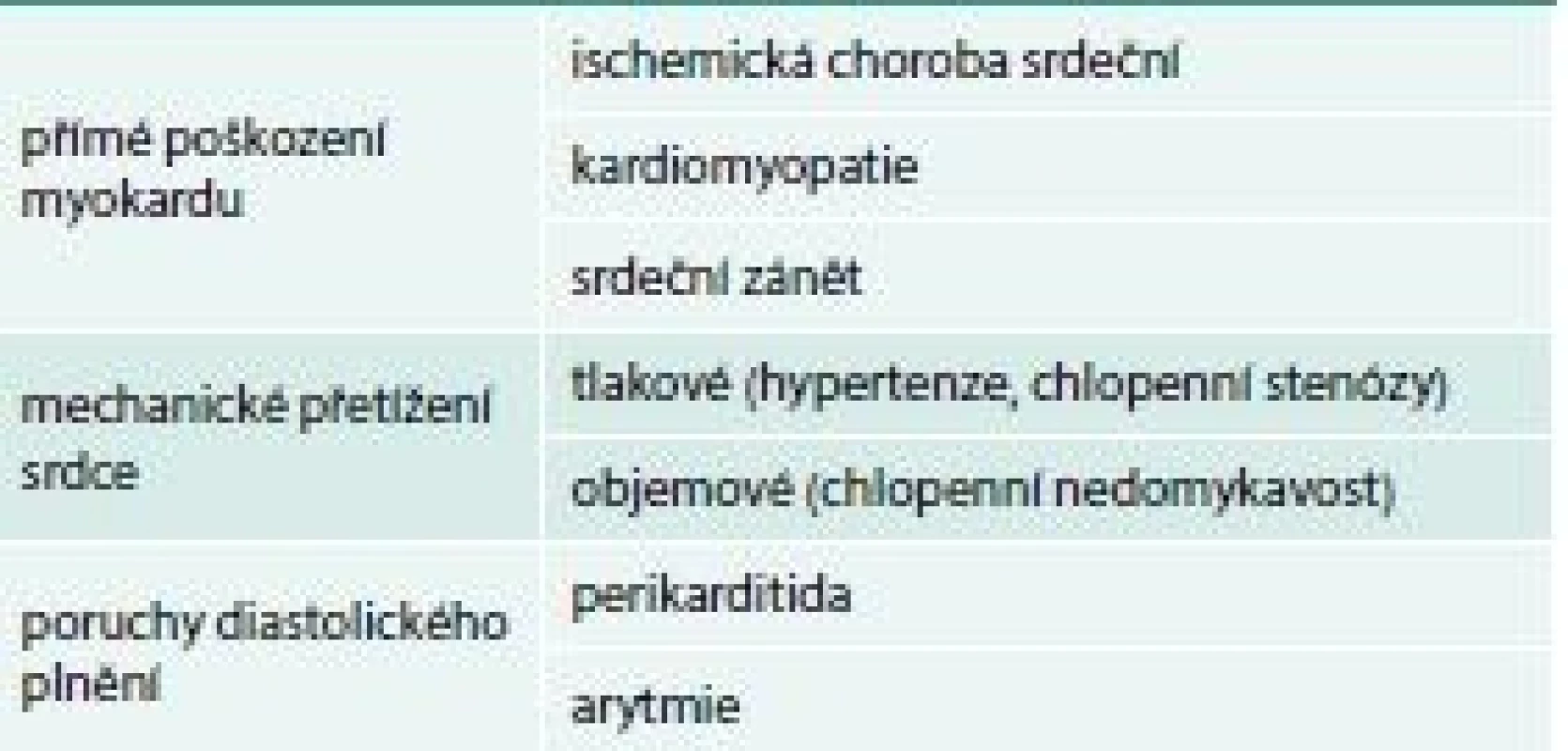
Patofyziologie srdečního selhání
Více než 40 let byl syndrom HF považován za hemodynamickou poruchu, jejíž patofyziologický základ vycházel z parametrů určujících srdeční výdej, tzn. ze srdeční stažlivosti, náplně komory na konci diastoly, napětí stěny komory během systoly a srdeční frekvence. Přesné odlišení centrálních a periferních hemodynamických faktorů je však velmi obtížné, neboť srdeční funkce určuje perfuzi tkání, a periferní cirkulace naopak ovlivňuje srdeční výdej [6,7].
Městnavé srdeční selhání nemocného obtěžuje a má tendenci se dále zhoršovat. Během měsíců až roků srdeční výkonnost klesá, snižuje se periferní prokrvení, postupně klesá tolerance tělesné zátěže, zvyšuje se obsah celkové cirkulující tekutiny s následnou tvorbou otoků a dochází k porušení funkce jater a ledvin. Většina nemocných s městnavou srdeční slabostí přes pečlivou kontrolu porušené hemodynamiky a klinických symptomů umírá na terminální selhání srdeční pumpy nebo náhlou smrtí v důsledku maligních arytmií.
Přestože hlavní roli při vzniku symptomů srdečního selhání jistě hrají hemodynamické faktory, není zcela jasné, které pochody jsou zodpovědné za progresi onemocnění. Na druhé straně je známo, že při určitém stupni poruchy srdeční funkce dochází k aktivaci neurohumorálního systému, což zpočátku pomáhá hemodynamické abnormality korigovat. Avšak počáteční příznivé ovlivnění srdeční funkce a periferní cirkulace sympatoadrenálním a renin-angiotenzinovým systémem je jen přechodné a později je naopak vystřídáno snížením srdečního výkonu a zhoršením onemocnění.
Při poklesu srdečního výdeje jsou aktivovány neurohumorální systémy, které pomáhají udržet oběhovou homeostázu tím, že zvyšují inotropii a chronotropii selhávajícího myokardu a tím, že modulují cévní reakci. Cévní tonus je tak řízen přes mediátory, které buď dilatují, nebo kontrahují cévy v různých oblastech organizmu tak, aby byl zajištěn průtok krve činnými orgány (metabolická vazodilatace) a aby se přitom vazokonstrikcí udržel přiměřený perfuzní tlak.
Snížení aktivity mechanoreceptorů v karotickém sinu a v aortálním oblouku, způsobené při srdečním selhání poklesem krevního tlaku, vede k vyplavení katecholaminů do krevního oběhu, z nervových zakončení se uvolňuje noradrenalin a z nadledvin adrenalin. Katecholaminy svým pozitivně chronotropním účinkem zvyšují srdeční frekvenci a pozitivně inotropním vlivem sílu a rychlost myokardiální kontrakce. Vazokonstrikce rezistenčních cév, renálních cév, žil splanchniku a kůže způsobená noradrenalinem, zvyšuje dotížení i předtížení.
V myokardu má zvýšená plazmatická koncentrace katecholaminů za následek snížení (down-regulation) hustoty β receptorů. Renin-angiotenzinový systém (RAS) je aktivován snížením perfuzního tlaku a průtoku v ledvinách, snížením koncentrace sodíku v macula densa, intenzivní léčbou diuretiky a některými vazodilatancii, zvýšením tonu sympatiku a vazopresinu. Těmito vlivy se zvýší sekrece proteolytického enzymu reninu z juxtaglomerulárních buněk. Renin štěpí α-globulin angiotenzinogen na dekapeptid angiotenzin I. Z něj po odštěpení dvou aminokyselin enzymem angiotenzinkonvertázou vzniká oktapeptid angiotenzin II (AII). Ten kromě silného vazokonstrikčního účinku stimuluje koru nadledvin k sekreci aldosteronu, způsobuje hypertrofii myokardu a cévní stěny (remodelling) a zvyšuje obsah kolagenu v myokardu a cévní stěně. Vlivem aldosteronu se zadržuje sodík a voda. Vedle zvýšeného objemu cirkulujících tekutin se to projeví větším turgorem cév daným retencí vody a sodíku v cévní stěně. Dále aldosteron aktivuje fibroblasty v myokardu ke zvýšené tvorbě kolagenu obdobně jako AII. Systém RA je daleko složitější, než se původně předpokládalo. Působí nejen jako oběhový endokrinní systém, ale též jako lokální systém tkáňový. Jednotlivé složky se tvoří a jsou přítomny v různých tkáních, v nichž také působí. Tato vlastnost se označuje jako autokrinní nebo parakrinní a doplňuje endokrinní působnost RAS. Systém renin-angiotenzin se jako celek účastní akutní regulace krevního oběhu, zatímco tkáňový RAS dlouhodobě ovlivňuje kardiovaskulární funkci a strukturu.
Sekrece vazopresinu je stimulována vyšší osmolaritou krve. U srdečního selhání je však vazopresin zvýšeně uvolňován podrážděním baroreceptorů v srdečních komorách přes vagová aferentní vlákna a mozkový kmen. Vazopresin kromě vazokonstrikce zvyšuje účinek noradrenalinu a angiotenzinu II; jeho hlavní úlohou je zadržování vody.
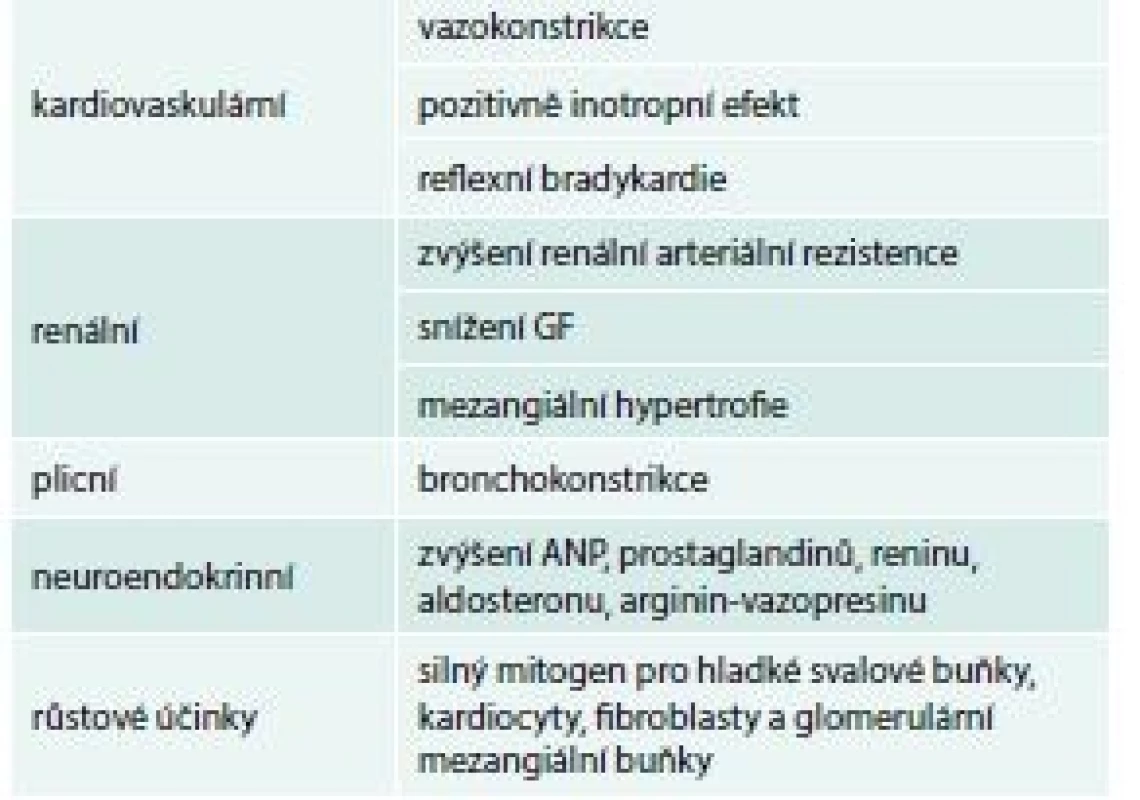
Z poškozeného endotelu se uvolňuje tzv. big endotelin, který je endotelin konvertujícím enzymem přeměněn na mohutný vazokonstriktor endotelin 1, který působí cestou svých receptorů ETA a ETB. Endotelin působí přes receptor A (ETA), který je vazokonstrikční, způsobuje hypertrofii a proliferaci buněk, zatímco ETB působí vazodilatačně. ETA receptor je umístěn v hladkých svalových buňkách a jeho stimulace vede ke konstrikci. Receptor ETB má duální aktivitu: na endoteliální buňce vede k uvolnění NO a prostaglandinu I2, a tím k vazodilataci, zatímco na svalové buňce vyvolává rovněž vazokonstrikci [8]. Zdrojem zvýšené hladiny endotelinu je spíše než systémová cirkulace plicní řečiště.
Endotelin je také významným prognostickým ukazatelem chronického srdečního selhání. Jeho hladina koreluje s tíží srdečního selhání a také se stupněm plicní hypertenze. Big endotelin, který je prekuzorem endotelinu, může lépe vyjádřit nadprodukci tohoto působku než samotný cirkulující endotelin, který je rychle štěpen a nemusí dosáhnout plicní cirkulace. V některých studiích big endotelin koreloval ještě lépe s hemodynamickými parametry při pravostranné katetrizaci a echo parametry než endotelin [9] a rovněž koreloval lépe s funkční třídou NYHA a dlouhodobou prognózou pacientů s chronickým srdečním selháním [10]. Biologické účinky endotelinu 1 ukazuje souhrnně tab. 2, schéma.

Vazodilatační mechanizmy jsou u srdečního selhání rovněž aktivovány, avšak jejich celkové působení je oslabeno vazokonstrikcí a také nižší reaktivitou cévní stěny, která má sníženou poddajnost díky zvýšenému obsahu sodíku a vody. Navíc je snížena hustota (denzita) receptorů pro vazodilatační působky. Prostaglandiny (E2, I2), které se zvýšeně uvolňují při hypoperfuzi ledvin spolu s AII, mají jako hlavní úlohu dilataci vas afferens, čímž zvyšují průtok glomerulárním cévním řečištěm. Dopamin stimuluje receptory D1 a D2 (dopaminergní) lokalizované postsynapticky v cévách renálních, mezenterických, koronárních a mozkových. Aktivace D1 receptorů zvyšuje prokrvení ledvin, aktivace D2 receptorů brání dalšímu vyplavování katecholaminů do synaptické štěrbiny. Při zvýšení tlaku v pravé síni při hypervolemii je secernován ze srdečních síní natriuretický peptid. Jeho účinky spočívají v uvolnění vazokonstrikce cév, ve zvýšeném vylučování sodíku ledvinami, v inhibici sekrece reninu a aldosteronu a ve snížení produkce vazopresinu. Natriuretických peptidů již známe v dnešní době několik, z prognostického hlediska i diagnostického hlediska je zcela zásadní mozkový natriuretický peptid (BNP), resp. jeho prekurzor NT-proBNP secernovaný v komorách, který se stal i základním kamenem pro diagnostiku [11,12] a jeho snížené odbourávání je součástí moderní léčby [13–15]. Neporušený endotel produkuje vazodilatační endotel-dependentní relaxační faktor (Endothel Derived Relaxing Factor – EDRF), který je identický s nitráty.
Adrenomedulin je peptid, jehož hladiny jsou u pacientů s chronickým srdečním selháním zvýšeny. Jeho struktura je podobná calcitonin-gene related peptidu. Původně byl izolován z buněk feochromocytu, později byl detekován v řadě dalších tkání, jako jsou nadledviny, mozek, plíce, ledviny, orgány zažívacího traktu a srdce. Zvýšené hladiny korelují se symptomatologií a hemodynamickou závažností syndromu a jsou prognostickým ukazatelem u pacientů s chronickým HF [16]. Adrenomedulin působí jako vazodilatátor v systémovém i plicním řečišti, indukuje vazodilataci v ledvinách, zvyšuje glomerulární filtraci, natriurézu a diurézu. Inhibuje sekreci aldosteronu ze zona glomerulosa a produkci endotelinu 1.
Při porušení funkce levé komory s poklesem srdečního výdeje se aktivují výše zmíněné neurohumorální mechanizmy s výraznou převahou vazokonstrikce a s retencí sodíku a vody. Nadměrně se zvyšuje předtížení a hlavně dotížení, čímž se srdeční funkce dále zhoršuje. Tím se uzavírá bludný kruh.
Kromě výše uvedených mechanizmů se aktivují i další neurohumorální mechanizmy, a proto u rozvinutého HF nalézáme zvýšené hladiny cytokinů, interleukinů, TNFα a dalších, které jsou v současné době předmětem mnoha preklinických i klinických výzkumů. Přehled vazokonstrikčních a vazodilatačních působků ukazuje tab. 3.
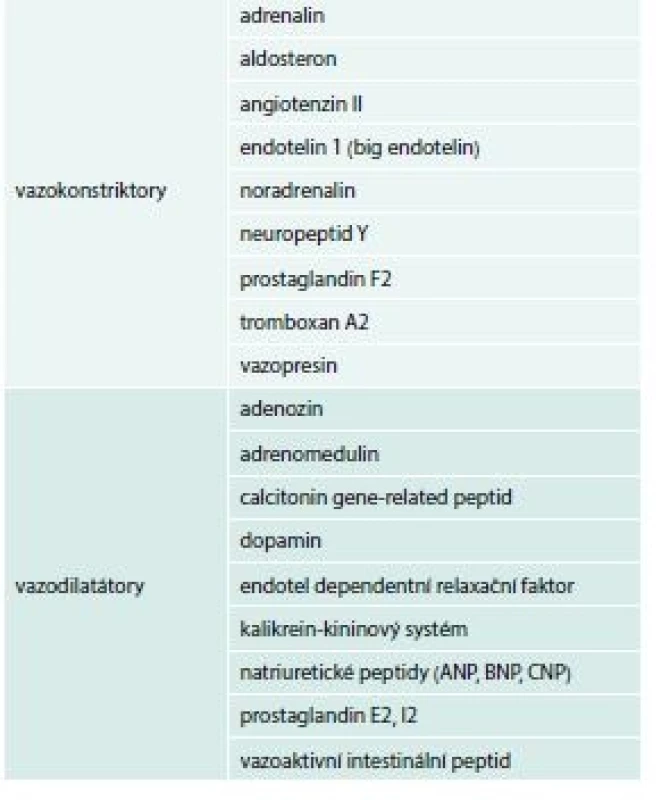
Prognóza srdečního selhání
V posledních 30 letech vedlo zdokonalování léčebných postupů a jejich uvádění do praxe k prodloužení přežití a snížilo počty hospitalizací pacientů s HFrEF. U pacientů se srdečním selháním dochází ve většině případů k úmrtí z kardiovaskulárních příčin, hlavně v důsledku náhlé srdeční smrti a zhoršování srdečního selhání. Celková mortalita je u HFrEF obecně vyšší než u HFpEF. K hospitalizacím často dochází z nekardiovaskulárních příčin, zvláště u pacientů s HFpEF.
prof. MUDr. Jindřich Špinar, CSc., FESC
Interní kardiologická klinika LF MU a FN Brno, pracoviště Bohunice
Doručeno do redakce 18. 7. 2018
Přijato po recenzi 13. 8. 2018
Sources
- Ponikowski P, Voors AA, Anker SD et al. [ESC Scientific Document Group]. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC)Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J 2016; 37(27): 2129–2200. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehw128>. Erratum in Erratum. [Eur Heart J. 2018].
- Antman EM, Bax J, Chazal RA. Updated Clinical Practice Guidelines on Heart Failure: An International Alignment. Eur Heart J. 2016; 37(27): 2096. Dostupné z DOI: <http://doi: 10.1093/eurheartj/ehw219>.
- Špinar J, Hradec J, Špinarová L et al. Summary of the 2016 ESC Guidelines on the diagnosis and treatment of acute and chronic heart failure. Prepared by the Czech Society of cardiology. Cor Vasa 2016; 58(5): e530-e568. Dostupné z DOI: <http://dx.doi.org/10.1016/j.crvasa.2016.09.004>.
- Špinar J, Hradec J, Špinarová L et al. Souhrn doporučených postupů ESC pro diagnózu a léčbu akutního a chronického srdečního selhání z roku 2016. Připraven Českou kardiologickou společností. Cor et Vasa 2016; 58(5): 455–494.
- Špinar J, Špinarová L. Chronické srdeční selhání. In: Táborský M. Novinky v kardiologii. Mladá fronta: Praha 2015: 212–229. ISBN 978–80–204–3712–9.
- Tanai E, Frantz S. Pathophysiology of Heart Failure. Compr Physiol 2015; 6(1): 187–214. Dostupné z DOI: <http://dx.doi.org/10.1002/cphy.c140055>.
- Widimský J, Lefflerová K, Sedlacek K. Srdeční selhání. 4. vyd. Triton: Praha 2013. ISBN 978–80–7387–680–7.
- Petrie MC, McClure SJ, Love MP et al. Novel neuropeptide in the pathophysiology of heart failure:adrenomedullin and endothelin-1. Eur J Heart Failure 1999; 1(1): 25–29. Dostupné z DOI: <http://dx.doi.org/10.1016/S1388–9842(98)00013–0>.
- Špinarová L, Toman J, Pospíšilová J et al. Humoral response in patients with chronic heart failure. Int J Cardiol 1998; 65(3): 227–232.
- Pacher R, Stanek B, Huelsman M et al. Prognostic impact of big endothelin-1 plasma concentrations compared with invasive hemodynamic evaluation in severe heart failure. J Am Coll Cardiol 1996; 27(3): 633–641.
- Kim HN, Januzzi JL. Natriuretic Peptide Testing in Heart Failure. Circulation 2011; 123(18): 2015–2019. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCULATIONAHA.110.979500>.
- Cheng V, Kazanegra R, Garcia A et al. A Rapid Bedside Test for B-Type Peptide Predicts Treatment Outcomes in Patients Admitted for Decompensated Heart Failure: A Pilot Study. J Am Coll Cardiol 2001; 37(2): 386–391.
- Maeda K, Tsutamoto T, Wada A et al. High Levels of Plasma Brain Natriuretic Peptide and Interleukin-6 After Optimized Treatment for Heart Failure Are Independent Risk Factors for Morbidity and Mortality in Patients With Congestive Heart Failure. J Am Coll Cardiol 2000; 36(5): 1587–1593.
- Špinarová L, Špinar J, Vítovec J Mají natriuretické peptidy novou šanci v léčbě srdečního selhání? Vnitř Lék 2014; 60(12): 1076–1080.
- Vítovec J, Špinar J, Špinarová L. Inhibice systému renin-angiotensin-aldosteron u srdečního selhání aneb od obecného souhlasu (CONSENSUS) po vzorec myšlení (PARADIGM-HF). Vnitř Lék 2015; 61(5): 470–474.
- Špinarová L, Špinarová M, Goldbergová-Pávková M et al. Prognostic impact of copeptin and mid-regional pro-adrenomedullin in chronic heart failure with regard to comorbidities. Cardiovasc Dis Diagn 2018; 6(4): 326. Dostupné z DOI: <http://dx.doi.org/10.4172/2329–9517.1000326.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2018 Issue 9
-
All articles in this issue
- Patofyziologie, příčiny a epidemiologie chronického srdečního selhání
- Čo vieme o epidemiológii srdcového zlyhávania na Slovensku a vo svete
- Diagnostika srdečního selhání: nová klasifikace srdečního selhání
- Farmakologická léčba chronického srdečního selhání
- Přidružená onemocnění u srdečního selhání
- Poruchy srdečního rytmu a srdeční selhání
- Otto Kahler a jeho rod (ke 125. výročí smrti): I. Předkové
- Ambulantní léčba proximální hluboké žilní trombózy
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Diagnostika srdečního selhání: nová klasifikace srdečního selhání
- Patofyziologie, příčiny a epidemiologie chronického srdečního selhání
- Ambulantní léčba proximální hluboké žilní trombózy
- Čo vieme o epidemiológii srdcového zlyhávania na Slovensku a vo svete
