Anafylaxe – akutní a dlouhodobý management
Anaphylaxis – acute and long-term management
Anaphylaxis is a serious, potentially life‑threatening condition, and all healthcare professionals should be aware of it. Prompt recognition of anaphylaxis signs and early initiation of adequate treatment are essential for successful acute management. The first‑line treatment is the administration of intramuscular adrenalin, followed by other interventions. Patients should be moni ‑ tored after recovery for possible biphasic reaction. Before discharge, the individual risk of further reaction should be assessed and where appropriate an adrenalin auto‑injector should be prescribed. Allergy specialist follow‑up is essential for the identification of possible triggers and cofactors. Elimination of these factors reduces the risk of future reactions. Useful preventive measure is allergen immunotherapy, which is definitely indicated in patients with anaphylaxis induced by an insect sting.
Keywords:
anaphylaxis – trigger – cofactor – adrenaline auto‑injector – allergen immunotherapy
Authors:
Martina Vachová
Authors‘ workplace:
Ústav imunologie a alergologie, Lékařská fakulta v Plzni, Univerzita Karlova
Published in:
Vnitř Lék 2020; 66(6): 335-339
Category:
Main Topic
Overview
Anafylaxe představuje závažný potencionálně život ohrožující stav, s kterým se může setkat lékař jakékoli specializace. Rychlé rozpoznání příznaků anafylaktické reakce a včasné zahájení adekvátní léčby patří tudíž mezi nezbytné znalosti všech zdravotníků a je zcela zásadní pro úspěšné zvládnutí tohoto akutního stavu. Lékem volby je neprodlené intramuskulární podání adrenalinu, další léčebná opatření následují až v dalším sledu. Délka observace po zvládnutí reakce závisí na tíži symptomů a doporučuje se z důvodu možného bifázického průběhu reakce. Před ukončením péče je nutné individuálně posoudit možnost opakování anafylaxe. Je‑li riziko recidivy, je nutné pacienta vybavit autoinjektorem s adrenalinem. Ná ‑ sledné alergologické vyšetření slouží k identifikaci spouštěče a případných kofaktorů podílejících se na vzniku anafylaxe. Jejich eliminace snižuje riziko opakování. Vhodným preventivním opatřením je alergenová imunoterapie, která je jedno ‑ značně indikována u pacientů po proběhlé anafylaktické reakci vyvolané alergií na hmyzí bodnutí.
Klíčová slova:
anafylaxe – spouštěč – kofaktor – autoinjektor s adrenalinem – alergenová imunoterapie
Definice a patofyziologie anafylaxe
Dle Evropské akademie pro alergologii a klinickou imunologii (EAACI) je anafylaxe definována jako závažná, život ohrožující systémová hypersenzitivní reakce. Pro anafylaxi je typický rychlý nástup potencionálně život ohrožující respirační či kardiovaskulární symptomatologie, která je většinou, ale ne vždy, spojena s kožními či slizničními projevy (1).
Při anafylaxi dochází k aktivaci řady buněk a patofyziologických systémů. Za zásadní efektorové buňky, schopné aktivace a degranulace s masivním uvolněním klíčových mediátorů (histamin, tryptáza, chymáza, leukotrieny, prostaglandiny, destičky aktivující faktory atd.) zodpovědných za klinické projevy anafylaxe, jsou považovány žírné buňky a bazofily (2).
Dle mechanismu vzniku lze anafylaxi dělit na IgE mediovanou, kdy jsou mastocyty a bazofily aktivovány IgE protilátkami, a non ‑IgE mediovanou. Při IgE mediované anafylaxi dochází k aktivaci mastocytů a žírných buněk po antigenním přemostění jejich povrchových FcεRI receptorů IgE protilátkami. Při nonIgE mediované anafylaxi jsou mastocyty a bazofily aktivovány bez účasti IgE protilátek. Tyto tzv. anafylaktoidní reakce mohou být způsobeny aktivací komplementu či jinými mechanismy (např. bradykininová kaskáda) nebo může dojít i k přímé aktivaci mastocytů a bazofilů. Aktivace komplementu byla popsána např. v souvislosti s hemodialýzou či aplikací radiokontrastních látek. Přímou aktivaci mastocytů a bazofilů mohou navodit některá léčiva, jako jsou nesteroidní antirevmatika, opiáty, neuromuskulární blokátory a další. Bez ohledu na patofyziologický mechanismus vzniku anafylaxe jsou klinické projevy i léčebný postup stejné (3, 4).
Epidemiologie a příčiny anafylaxe
Anafylaxe postihne alespoň jedenkrát za život zhruba 2 % populace, incidence se pohybuje v širokém rozmezí (v závislosti na designu studie) od 1,5 až k 42 případům/100 000 osob za jeden rok (5, 6). V dánské studii z let 2013–2014 byla incidence anafylaxe 26 případů/100 000 osob/rok a prevalence 0,04 % u dětí i u dospělých. Nejčastějším spouštěčem anafylaxe byly ve sledovaném souboru léky (41,1 %), hmyzí jedy (27,7 %) a potraviny (20,6 %). U 10,5 % pacientů nebyl spouštěč identifikován. Potraviny byly nejčastějším vyvolavatelem anafylaxe u dětí. U dospělých byly nejčastějšími spouštěči léky (zejména beta ‑laktamová antibiotika a ASA/NSAID (acetylsalicylová kyselina/nesteroidní protizánětlivé léky)) a hmyzí jedy. Atopické onemocnění (rýma, atopická dermatitida, astma, urtikárie a/nebo angioedém) bylo přítomno u 47,6 % všech případů, častěji u dětí (65,0 %) než u dospělých (44,2 %). Atopie byla významně asociována s potravinou indukovanou anafylaxí, a to jak u dětí, tak u dos pělých. Překvapivě alespoň jeden kofaktor byl zaznamenán u 58,1 % všech případů anafylaxe. Nejčastějším kofaktorem byla infekce, kterou v souvislosti s reakcí uvedlo téměř 30 % pacientů. Dalšími kofaktory byla fyzická námaha (20,9 % pacientů) a současné užití ASA/NSAID (16,1 % nemocných). Užití alkoholu zmiňovalo 13,7 % dospělých (7).
Podrobná analýza dat z evropského registru anafylaxe (European Anaphylaxis Registry) z let 2007–2015 cílená na děti do 18 let věku potvrdila v souladu s předchozí uvedenou studií potraviny (66 %) jako nejčastější vyvolavatel anafylaxe v této věkové kategorii, následované hmyzími jedy (19 %). Kravské mléko a vejce byly dle analýzy nejčastějším spouštěčem v prvních dvou letech věku, lískové ořechy a kešu u předškolních dětí a arašídy ve všech dětských věkových kategoriích. S narůstajícím věkem dětí byl zaznamenán posun od potravinové k hmyzími jedy a léky vyvolané anafylaxi. Anafylaxe vyvolaná hmyzími jedy byla jednoznačně častěji pozorována až u mladých dospělých. Naštěstí velmi vážné reakce jsou dle dat z registru v dětském věku velmi vzácné (1,3 %) (8).
Klinický obraz a diagnostika
K projevům anafylaxe dochází obvykle do 2 hodin od kontaktu s alergenem, v případě potravinové alergie obvykle během 30 minut, po podání parenterální medikace a po hmyzím bodnutí mnohem rychleji, řádově v minutách (1). Klinický obraz anafylaxe závisí na postiženém orgá ‑ novém systému. Nejčastěji bývá postižena kůže, následují kardiovaskulární projevy a respirační symptomy. Ač patří postižení kůže mezi nejčastější projevy, tak se anafylaxe může vyvinout i zcela bez této symptomatologie. Klinická kritéria, která pomáhají správně identifikovat pravděpodobnou anafylaxi, zdůrazňují zejména rychlý nástup multiorgánové symptomatologie (Tab. 1). Tato kritéria významně zlepšují rozpoznání anafylaxe, mají výbornou senzitivitu (96,7 %) a dobrou specificitu (82,4 %) (3, 9).
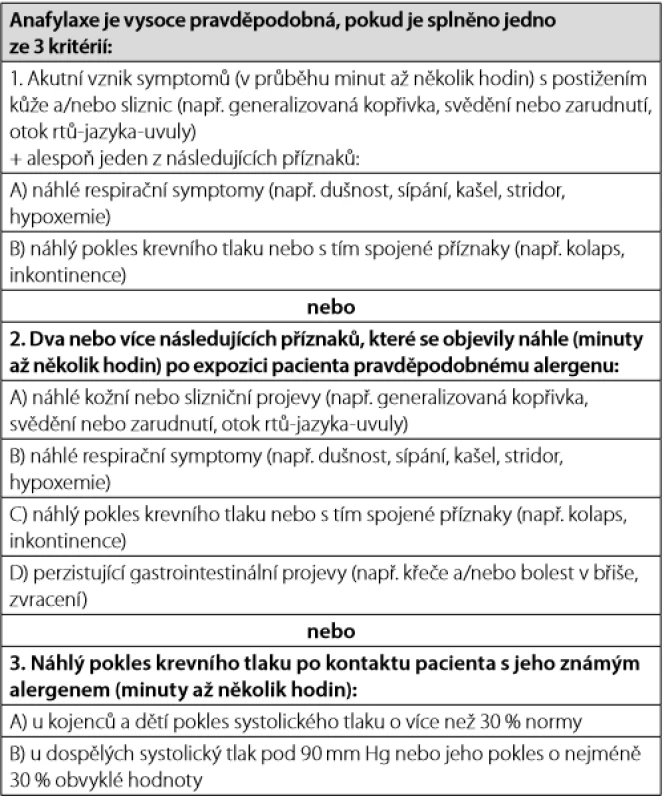
Až 20 % anafylaktických reakcí může mít bifázický průběh, kdy za 4–12 hodin dochází k druhé vlně reakce. Riziko jejího vzniku zvyšuje prodleva v podání či nedostatečná dávka adrenalinu, případně nedo ‑ statečná dávka kortikoidů (10).
Anafylaxe je čistě klinická diagnóza, která je založena na uvedených klinických kritériích (Tab. 1). Retrospektivně může být diagnóza podpořena zvýšením hladiny tryptázy po reakci oproti její bazální klidové hladině u daného pacienta. K přechodnému zvýšení hladiny tryptázy dochází v důsledku jejího uvolnění z aktivovaných žírných buněk. Za důkaz proběhlé aktivace mastocytů je považován nárůst bazální hodnoty tryptázy o 20 % plus 2 µg/l. Pokud je bazální hladina tryptázy u pacienta např. 5 µg/l, pak hodnota 8 µg/l nebo vyšší naměřená po suspektní anafylaktické reakci potvrzuje, že došlo k aktivaci žírných buněk (11). Byť je zvýšení tryptázy užitečným parametrem, až u 36 % pacientů nebylo zvýšení zaznamenáno, a to zejména u dětí s potravinou indukovanou anafylaxí (4, 12).
Znalost bazální hladiny tryptázy je s ohledem na zhodnocení nárůstu nezbytná, neboť „normální“ hodnota tryptázy (do 11,4 µg/l) odebrané po reakci nevylučuje proběhlou anafylaxi. Z praktického hlediska to znamená nutnost provedení 2 odběrů. Je doporučeno provést odběr v intervalu 15 až 180 minut po začátku příznaků, další odběr s odstupem 24 hodin či později (bazální tryptáza). Je možné stanovení tryptázy i post mortem (posouzení anafylaxe jako možné příčiny smrti), a to do 48 hodin od úmrtí (3, 13).
Rizikové faktory pro těžký průběh anafylaxe
Data vycházející z evropského registru anafylaxe (European Anaphylaxis Registry) pomohla rozpoznat faktory, které mohou zvyšovat riziko těžké anafylaxe. Jako nejvýznamnější prediktory těžké reakce byly identifikovány vyšší věk a mastocytóza. Fyzická námaha, mužské pohlaví a psychická zátěž byly také častěji spojeny s těžkými reakcemi. Jako další významné faktory bylo logistickou regresní analýzou určeno užívání betablokátorů a ACE inhibitorů (14). Mezi faktory zvyšující riziko těžké anafylaxe patří také přidružené astma (zejména pokud je nestabilní a nekontrolované) a kardiovaskulární onemocnění, s čímž souvisí i užívání uvedené medikace (4).
U pacientů s alergií na hmyzí bodnutí je jednoznačným rizikovým faktorem těžké anafylaxe vyšší věk pacienta. Zatímco u dětí je 60 % systémových reakcí mírných, omezených pouze na kožní projevy, u dospělých je 70 % reakcí těžkých, spojených s kardiovaskulární či respirační symptomatologií. Dalšími rizikovými faktory jsou v této skupině nemocných mastocytóza a/nebo vyšší bazální hladiny tryptázy a přidružená kardiovaskulární onemocnění. Bylo prokázáno, že zejména starší pacienti s kardiovaskulárním onemocněním mají vyšší riziko fatální reakce po bodnutí hmyzem (15).
Akutní management anafylaxe
Pacienti s anafylaxí vyžadují okamžitou lékařskou péči. Léčebná opatření se rozdělují na opatření I. až III. linie a zahrnují komplex farmakologických i nefarmakologických zásahů, jejichž cílem je stabilizace stavu nemocného. Lékem první volby je intramuskulární aplikace adrenalinu. Teprve po jeho aplikaci promptně navazují další léčebné kroky (4).
Opatření I. linie
Adrenalin
Adrenalin je potencionálně život zachraňující lék a musí být neprodleně podán všem pacientům s projevy anafylaxe. Časnější podání by mělo být zváženo i u pacientů s alergickými projevy, které pravděpodobně vyústí v anafylaxi. Neexistují žádné absolutní kontraindikace této léčby u osob s projevy anafylaxe, benefity léčby jednoznačně převyšují možná rizika i u starších osob a u pacientů s kardiovaskulárním onemocněním (3, 4). Adrenalin by měl být podán intramuskulárně do anterolaterální části střední třetiny stehenního svalu. Bezpečnostní profil adrenalinu podaného i.m. je velmi dobrý, ačkoli pacienti mohou po aplikaci pociťovat přechodné projevy charakteru např. palpitací či bolesti hlavy. Dávka intramuskulárně podaného adrenalinu (1 mg/ml) závisí na hmotnosti, aplikuje se 0,01 ml/kg tělesné váhy, maximálně však 0,5 ml (4). Při aplikaci adrenalinu v autoinjektoru použijeme autoinjektor s obsahem 0,15 mg u dítěte s hmotností 7,5–25 kg, pro osoby s hmotností nad 25 kg je obecně určen autoinjektor s obsahem 0,3 mg adrenalinu (13, 16). K dispozici je rovněž autoinjektor s obsahem 0,5 mg adrenalinu, o jehož užití bude podrobněji pojednáno v textu dále.
V případě nedostatečného efektu intramuskulární injekce adrenalinu je nutné dávku opakovat po pěti minutách, dle potřeby s tímto časovým intervalem i vícekrát. V případě nutnosti opakovaných intramuskulárních aplikací je zapotřebí zahájit intravenózní léčbu adrenalinem. Tato léčba je však spojena s vysokým rizikem nežádoucích účinků, proto by měla být realizována za monitorace pacienta lékařem se zkušeností s touto léčbou, obvykle anesteziologem či intenzivistou (3, 13).
Opatření II. linie
Odstranění spouštěče a přivolání pomoci
Je‑li to možné, pak musí být neprodleně odstraněn potencionální spouštěč anafylaxe (zastavení infuze léku, odstranění žihadla apod.). Rovněž musí být neprodleně přivolána rychlá záchranná služba, pří ‑ padně resuscitační tým v nemocnici.
Umístění pacienta do správné polohy
Poloha pacienta závisí na klinických projevech. V případě respi ‑ račních projevů je optimální poloha vsedě, při známkách oběhové nestability poloha vleže na zádech se zvednutými dolními končetinami.
Těhotné ženy umístíme do polohy v pololeže na levém boku s podlo ‑ ženými dolními končetinami.
Kyslík
Kyslík by měl být podáván maskou všem pacientům s anafylaxí.
Tekutiny
Tekutiny intravenózně by měly být podány všem pacientům s pro ‑ jevy kardiovaskulární nestability. Zajištění žilního vstupu kanylou se doporučuje hned při vzniku potíží. Doporučuje se podat bolusově krystaloidy v dávce 20 ml/kg.
Inhalace beta-2 agonistů s rychlým nástupem účinku
Inhalace beta‑2 agonistů s rychlým nástupem účinku se doporučuje podat k odstranění projevů bronchokonstrikce.
Opatření III. linie
Antihistaminika
Antihistaminika jsou při anafylaxi běžně užívána. Mají příznivý vliv na kožní projevy anafylaxe. Po jejich intravenózním podání však byly zaznamenány případy hypotenze, což pravděpodobně souvisí s rych ‑ lostí podání (17). V případě potřeby se doporučuje podání bisulepinu v dávce 0,5 mg (1 ml) dětem a 1 mg (2 ml) dospělým i.m., nebo ředěné i.v. (13). Kožní projevy mohou být ovlivněny i p. o. podáním antihistaminik, kdy v praxi volíme zejména novější generace antihistaminik, jejichž výhodou oproti bisulepinu je, že nemají sedativní efekt.
Glukokortikoidy
Orální nebo intravenózní kortikoidy jsou při anafylaxi rovněž běžně užívány. Jejich nástup účinku je však pomalý. Předpokládá se, že pravdě ‑ podobně brání protrahovanému průběhu anafylaxe, zejména u pacientů s přidruženým astmatem, a že zabraňují bifázickému průběhu reakce.
Další možná terapie
Intravenózní aplikace glukagonu může být užitečná u pacientů s anafylaxí, kteří jsou léčeni betablokátory a nereagují na podání adrenalinu. V ČR se však jedná o léčbu off ‑label (13).
V běžné praxi je bohužel stále často zvykem používat i.v. aplikované Calcium gluconicum, tento postup je však obsoletní a jeho podání není při anafylaxi indikováno.
Monitorace a propuštění pacienta
Pacienti s respiračními příznaky by měli být po zaléčení monitorováni 6–8 hodin, nemocní s projevy hypotenze vyžadují sledování alespoň 12–24 hodin. Před propuštěním musí být individuálně u každého pacienta posouzeno riziko opakování anafylaxe. Je‑li riziko recidivy reakce, musí být již při propuštění předepsán autoinjektor s adrenalinem. S jeho užitím musí být nemocný podrobně seznámen. Nedílnou součástí doporučení při propuštění je odeslání pacienta k alergologickému vyšetření, jehož cílem je identifikace spouštěče proběhlé reakce.
Dlouhodobý management anafylaxe
Dlouhodobý management pacienta, který prodělal anafylaxi, začíná alergologickým vyšetřením. Alergolog se na základě zhodnocení anamnézy rozhodne o provedení konkrétních testů, jejichž cílem je identifikovat alergen, který reakci vyvolal. Pacient je pak poučen, jakým způsobem se příčinného alergenu vyvarovat. V případě potravinové alergie je též informován o možnostech zkřížené alergie s jinými alergeny, o skrytých alergenech a o situacích, které představují zvýšené riziko reakce (4). Pacient s alergií na jed hmyzu je poučen o možných režimových opatřeních, která mohou pomoci snížit riziko opakovaného bodnutí (18, 19). Alergolog dále rozhoduje o zahájení specifické alergenové imunoterapie, která je indikována u pacientů, kteří prodělali anafylaktickou reakci po bodnutí blanokřídlým hmyzem (v našich geografických podmínkách nejčastěji včelou, vosou, sršní, vzácněji čmelákem), pokud alergologické vyšetření alergii na hmyzí jed jednoznačně potvrdí (20, 21). Tato léčba (VIT, venom immunotherapy) je určena dětem a dospělým, kteří po bodnutí prodělali těžkou či středně těžkou systémovou alergickou reakci (přesahující generalizovanou kožní symptomatologii – stupeň II–IV dle Ringa a Messmera; Tab. 2). Je ale také zvažována, a v případě vyššího rizika dalšího bodnutí indikována i pacientům, kteří po bodnutí prodělali lehčí systémovou reakci, která se manifestovala pouze generalizovanou kožní symptomatologií (stupeň I dle Ringa a Messmera; Tab. 2) (22). VIT spočívá v opakované subkutánní aplikaci malých dávek včelího/vosího jedu a spadá plně do kompetence alergologa. VIT je velmi bezpečná a vysoce účinná. Je doloženo, že poskytuje ochranu před recidivou systémové reakce v případě dalšího bodnutí až 96 % pacientů léčených vosím a 84 % nemocných léčených včelím jedem (15, 19, 22). Pro pacienty s alergií na potravinu není alergenová imunoterapie v současné době v ČR k dispozici (23). U pacientů s lékovou alergií jsou u některých léčiv vytvořeny desenzitizační protokoly, pomocí nichž lze navodit krátkodobou toleranci léčiva. K desenzitizaci se přistupuje jen v ojedinělých případech, po zvážení možných rizik, pokud není k dispozici alternativa léku a lék je pro pacienta životně důležitý. Desenzitizace poskytuje jen dočasnou toleranci, která je udržována trvalým podáváním léku. Po ukončení podávání tolerance mizí (4, 13).
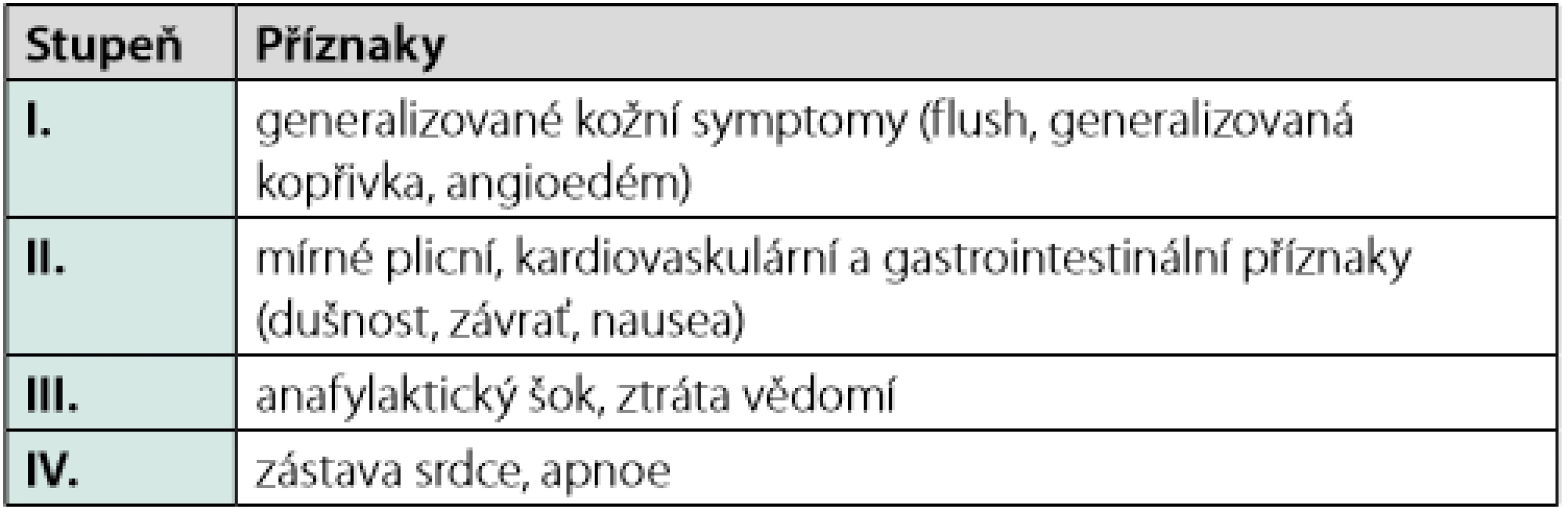
Trvalé vybavení pacienta s anafylaxí v anamnéze autoinjektorem s adrenalinem je samozřejmostí. Preskripce není vázána na specializaci, autoinjek ‑ tor může předepsat jakýkoli lékař, proto by k vybavení a seznámení s jeho užitím mělo optimálně dojít již při propuštění z akutního ošetření po reakci. Kromě pacientů s anamnézou proběhlé anafylaxe, mají být autoinjektorem vybaveni i pacienti, kteří jsou ve velkém riziku vzniku anafylaxe (16). Jasně vymezené indikace k preskripci autoinjektoru s adrenalinem shrnuje aktualizované doporučení ČSAKI z roku 2019 (Tab. 3). Vzhledem k tomu, že za určitých podmínek nemusí mít aplikace jednoho autoinjektoru dostatečný efekt, doporučuje ČSAKI na základě evropských guidelines v jistých situacích předpis dvou balení adrenalinového autoinjektoru (Tab. 4) (13, 16).


V ČR jsou registrovány adrenalinové autoinjektory Epipen (s obsahem 150 a 300 µg) a Emerade (s obsahem 150, 300 a 500 µg). K nácviku jejich užití jsou k dispozici trenažéry, které usnadňují edukaci pacienta. Autoinjektor s obsahem 0,15 mg (150 µg) je určený, jak již bylo zmíněno výše, pro děti vážící 7,5–25 kg, osobám s hmotností nad 25 kg je určen autoinjektor s obsahem 0,3 mg (300 µg). Pro použití autoinjektoru s obsahem adrenalinu 0,5 mg zatím nejsou k dispozici přesná data, dle doporučení ČSAKI se nabízí možnost preskripce tohoto autoinjektoru dospělému nemocnému s anamnestickým údajem téměř fatální anafylaxe, s nutností opakované aplikace dávky 0,3 mg (300 µg) v minulosti, s nadváhou či obezitou (BMI nad 30,0 kg/m2). Je‑li v rukou lékaře, může být použit u nemocného s hmotností nad 50 kg (13).
Kromě adrenalinu mohou být pacienti navíc vybaveni také tabletami nesedativního antihistaminika s rychlým nástupem účinku (např. pro dospělé levocetirizin 10 mg nebo cetirizin 20 mg, pro děti dvojnásobná dávka adekvátní pro věk) a tabletami kortikoidu (např. prednison tbl à 20 mg v dávce: pro dospělé 50–100 mg a pro děti 1–2 mg/kg tělesné hmotnosti). Nemocní s astmatem by měli mít také k dispozici rychle působící inhalační beta‑2‑mimetikum. Všechny tyto léky jsou však léky doplňkové, lékem volby při anafylaxi je jednoznačně adrenalin. Vybavení těmito léky se doporučuje zejména u pacientů s alergií na hmyzí jed. Jedná se totiž o specifickou skupinu nemocných, kteří jsou (měli by být) léčeni vysoce efektivní profylaktickou léčbou VIT, která, jak již bylo uvedeno, významně snižuje riziko opakování anafylaktické reakce po dalším hmyzím bodnutí. U těchto nemocných je možné bezprostředně po bodnutí nejprve podat, pokud je pacient zcela asymptomatický, doporučenou dávku orálního antihistaminika a kortikoidu. Nicméně pokud se jakýkoli příznak svědčící pro rozvoj celkové alergické reakce (obvykle jakýkoli příznak vyskytující se mimo místo vpichu, např. kašel, chrapot, dušnost, slabost apod.) objeví, musí být neprodleně užit autoinjektor s adrenalinem, a to bez ohledu na užitou p. o. medikaci (15, 18). Naštěstí v klinické praxi většinou k projevům anafylaxe u pacientů léčených VIT po bodnutí nedochází, a tak většina pacientů autoinjektor aplikovat nemusí.
Závěr
Pacient s anafylaxí vyžaduje nejenom akutní lékařské ošetření, které je nutné ke zvládnutí tohoto urgentního stavu, ale vyžaduje i dlouhodobou lékařskou péči. Ta zahrnuje zejména alergologické vyšetření s identifikací spouštěče reakce, dále edukaci a trvalé vybavení medikací potřebnou ke zvládnutí případné recidivy reakce. Lékem volby anafylaxe je adrenalin. Z dlouhodobého pohledu je nejúčinnějším preventivním opatřením u pacientů s anafylaxí po hmyzím bodnutí zahájení alergenové imunoterapie (VIT).
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Martina Vachová, Ph.D.,
Ústav imunologie a alergologie,
Lékařská fakulta v Plzni,
Univerzita Karlova,
Husova 3,
306 05 Plzeň
Cit. zkr: Vnitř Lék 2020; 66(6): 335–339
Článek přijat redakcí: 22. 7. 2020
Článek přijat po recenzích k publikaci: 14. 8. 2020
Sources
1. Muraro A, Roberts G, Worm M, et al. Anaphylaxis: guidelines from the European Academy of Allergy and Clinical Immunology. Allergy. 2014; 69(8): 1026–1045.
2. Reber LL, Hernandez JD, Galli SJ. The pathophysiology of anaphylaxis. J Allergy Clin Immunol. 2017; 140(2): 335–348.
3. Petrů V. Anafylaxe – život ohrožující reakce. Postgrad Med 2019; 21(4): 277–282.
4. Muraro A, Lemanske Jr. RF, Castells et al. Precision medicine in allergic disease-food allergy, drug allergy, and anaphylaxis ‑PRACTALL document of the European Academy of Allergy and Clinical Immunology and the American Academy of Allergy, Asthma and Immunology. Allergy 2017; 72 : 1006–1021.
5. Panesar SS, Javad S, de Silva D, et al. The epidemiology of anaphylaxis in Europe: a systematic review. Allergy. 2013; 68 : 1353–1361.
6. Lee S, Hess EP, Lohse C, et al. Trends, characteristics, and incidence of anaphylaxis in 2001–2010: a population‑based study. J Allergy Clin Immunol. 2017; 139 : 182–188.
7. Ruiz Oropeza A, Bindslev ‑Jensen C, Broesby ‑Olsen S, et al. Patterns of anaphylaxis after diagnostic workup: A follow‑up study of 226 patients with suspected anaphylaxis. Allergy. 2017; 72 : 1944–1952.
8. Grabenhenrich LB, Dölle S, Moneret ‑Vautrin A, et al. Anaphylaxis in children and adolescents: The European Anaphylaxis Registry. J Allergy Clin Immunol. 2016; 137(4): 1128–1137.
9. Simons FE, Ardusso LR, Bilò MB, et al. World allergy organization guidelines for the assessment and management of anaphylaxis. World Allergy Organ J. 2011; 4(2): 13–37.
10. Ellis AK, Day JH. Incidence and characteristics of biphasic anaphylaxis: a prospective evaluation of 103 patients. Ann Allergy Asthma Immunol. 2007; 98(1): 64–69.
11. Akin C. Mast cell activation syndromes. J Allergy Clin Immunol. 2017; 140(2): 349–355.
12. Sala‑Cunill A, Cardona V, Labrador ‑Horrillo M, et al. Usefulness and limitations of sequential serum tryptase for the diagnosis of anaphylaxis in 102 patients. Int Arch Allergy Immunol. 2013; 160(2): 192–199.
13. Petrů V. Doporučený postup léčby anafylaktické reakce – aktualizace 2019. Alergie 2019; 21(3): 216–219.
14. Worm M, Francuzik W, Renaudin JM, et al. Factors increasing the risk for a severe re ‑ action in anaphylaxis: An analysis of data from The European Anaphylaxis Registry. Allergy. 2018; 73(6): 1322–1330.
15. Vachová M. Alergie na blanokřídlý hmyz. Postgrad Med 2019; 21(4): 291–296.
16. Doporučení výboru České společnosti alergologie a klinické imunologie k použití adrenalinového autoinjektoru. Alergie 2018; 20(4): 260.
17. Ellis BC, Brown SG. Parenteral antihistamines cause hypotension in anaphylaxis. Emerg Med Australas. 2013; 25(1): 92–93.
18. Bilò MB, Cichocka ‑Jarosz E, Pumphrey R, et al. Selfmedication of anaphylactic reactions due to Hymenoptera stingsan EAACI Task Force Consensus Statement. Allergy. 2016; 71(7): 931–943.
19. Vachová M. Alergie na včelí a vosí jed. Remedia 2020; 30 : 68–70.
20. Vachová M, Panzner P, Malkusová I, et. al. Utility of laboratory testing for the diagnosis of Hymenoptera venom allergy. Allergy Asthma Proc. 2016; 37(3): 248–255.
21. Vachová M, Panzner P, Kopač P, et al. Routine clinical utility of honeybee venom allergen components. J Allergy Clin Immunol Pract. 2018; 6(6): 2121–2123.
22. Sturm GJ, Varga EM, Roberts G, et al. EAACI guidelines on allergen immunotherapy: Hymenoptera venom allergy. Allergy. 2018; 73(4): 744–764.
23. Bělohlávková S. Potravinová alergie v roce 2019. Postgrad Med 2019; 21(4): 283–289.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2020 Issue 6
-
All articles in this issue
- Anafylaxe – akutní a dlouhodobý management
- Potravinová alergie a intolerance
- Poruchy v komplementovém systému
- Imunosenescence – západ slunce nad imunitním systémem
- Chřipka a její komplikace
- Familiární plicní fibróza – doporučení pro diagnostiku a léčbu
- Nové dělení krystalopatií z pohledu nefrologa
- Infarkt myokardu nebo syndrom zlomeného srdce?
- Dieulafoy lézia jejuna ako zdroj život ohrozujúceho krvácania
- Co nového internistům přinášejí doporučené postupy pro diagnostiku a léčbu plicní embolie z roku 2019?
- Perkutánní okluze ouška levé síně
- Současné postavení dietních opatření u pacientů s pokročilým stupněm chronického onemocnění ledvin
- Dysfunkčný dialyzačný cievny prístup a jeho endovaskulárna liečba
- Histiocytózy a neoplazie odvozené od makrofágů a dendritických buněk. Srovnání WHO klasifikace z roku 2017 a klasifikace Histiocyte society z roku 2016
- Glykovaný hemoglobín ako marker zvýšenia LDL a TAG – kohortná štúdia
- Deriváty sulfonylurey a riziko hypoglykemie u diabetiků 2. typu
- Endoskopická diagnostika a terapie pankreatobiliárních onemocnění u osob po resekci žaludku podle Billrotha I
- Nozokomiální methemoglobinemie
- Alergie a imunopatologie – hlavní téma
- Postihnutie tráviaceho traktu pri zmiešanej chorobe spojivového tkaniva (Sharpovom syndróme)
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Infarkt myokardu nebo syndrom zlomeného srdce?
- Postihnutie tráviaceho traktu pri zmiešanej chorobe spojivového tkaniva (Sharpovom syndróme)
- Potravinová alergie a intolerance
- Poruchy v komplementovém systému
