Poruchy v komplementovém systému
Complement deficiencies
Complement system plays a crucial role in innate imunity. Complement deficiencies are often associated with severe infections, usually meningoccocal, pneumococcal or caused by Haemophilus influenzae, or with autoimmune diseases, especially systemic lupus erythematodes. Inherited complement deficiencies are very rare although their prevalence in population may be underestimated due to lower availability of adequate laboratory testing. Acquired complement deficiencies accompany other underlying diseases and often are caused by increased consumption and only partial.
Keywords:
infection – Complement – complement deficiency – autoimmune disease
Authors:
Marta Sobotková
Authors‘ workplace:
Ústav imunologie 2. LF UK a FN v Motole
Published in:
Vnitř Lék 2020; 66(6): 346-352
Category:
Main Topic
Overview
Komplementový systém je klíčovou složkou vrozené imunity. Jeho poruchy se často projevují zvýšeným sklonem k infekčním onemocněním, zejména meningokokovým, hemofilovým či pneumokokovým, nebo sklonem k autoimunitním chorobám, nejčastěji charakteru systémového lupusu erythematodes. Vrozené komplementové deficity jsou velmi vzácné, ale jejich výskyt v populaci může být podhodnocen zejména z důvodu horší dostupnosti vhodných vyšetření. Získané deficity doprovází jiná základní onemocnění a nejčastěji jsou vyvolaná zvýšenou konsumpcí složek komplementu. Oproti deficitům vrozeným však často bývají pouze parciální.
Klíčová slova:
komplement – deficit komplementu – infekce – autoimunitní onemocnění
Úvod
Systém komplementu představuje jednu z nejdůležitějších humorálních složek vrozené (nespecifické) imunity (1). Zahrnuje více než 30 solubilních a membránově vázaných proteinů, které kooperují nejen mezi sebou, ale také s dalšími komponentami imunitního systému (2, 3). Hlavními složkami je 9 sérových proteinů označených C1‑C9, jejichž kaskádovitá aktivace vede k tvorbě tzv. komplexu atakujícího membránu (MAC), který vyvolává perforaci a následně lýzu napadené buňky. V průběhu aktivace dochází k tvorbě štěpů s dalšími funkcemi, jako je opsonizace (složka C3b), chemotaxe či modulace zánětlivé odpovědi (C3a, C5a) (1, 3). Komplement se podílí na odstraňování apoptotických buněk a imunitních komplexů, podporuje protilátkovou odpověď a hraje roli i v časném embryonálním vývoji a reparaci tkání. Je propojen se systémem koagulačním a fibrinolytickým, což vysvětluje rozvoj trombotických komplikací u poruch některých komplementových složek (2, 4). Aktivace komplementu probíhá třemi různými cestami – klasickou, alternativní nebo lektinovou (viz schéma 1) (3, 4, 5). Komplement rozpoznává jak signály mikrobiální invaze (pathogen associated molecular patterns, PAMPs) tak i struktury sdružené s tkáňovým poškozením (damage associated molecular patterns, DAMPs). Tím se uplatňuje pozitivně nejen v zánětlivé odpovědi namířené proti infekčním agens, ale také při hojení tkání. Jeho nadměrná a nedostatečně kontrolovaná aktivace ovšem také může přispívat k tkáňovému poškození u celé řady patologických stavů (6).

Podle toho, zda poruchy komplementu vznikají na dědičném podkladě nebo doprovází jiné základní choroby, je lze rozdělit na vrozené a získané. Vrozené poruchy komplementového systému patří mezi vzácná onemocnění, jejichž prevalence se odhaduje na 0,03 %. Na základě údajů z mezinárodních registrů představují asi 1–10 % ze všech primárních imunodeficitů (5,2 % podle Evropské společnosti pro imunodeficity ESID). Tato čísla však mohou být podhodnocená z důvodu absence snadno dostupných laboratorních vyšetření. Vyšší prevalence se popisuje pouze u MBL deficience (5 %) a deficitů C4A (11–22 %) a C4B (30–45 %) (2, 5, 7). Získané poruchy zpravidla vznikají v důsledku zvýšené konsumpce, nedostatečné syntézy, zvýšených ztrát nebo působením autoprotilátek inhibujících jejich funkci. Jsou častější než poruchy vrozené, ale zpravidla bývají pouze parciální. Na druhou stranu ovšem často postihují více složek zároveň (2, 8).
U pacientů s poruchami v systému komplementu pozorujme zvýšený sklon k závažným infekcím, vyvolaným převážně opouzdřenými bakteriemi, autoimunitní projevy, zejména charakteru systémového lupusu erythematodes (SLE), nebo se mohou rozvíjet specifická onemocnění vznikající v důsledku poruchy některých regulačních složek (2, 7). Klinický obraz závisí na konkrétní postižené složce, ale u vrozených poruch bývají tyto projevy zpravidla více vyjádřené nežli u poruch získaných. Ačkoli k manifestaci vrozených poruch komplementu obvykle dochází již v dětství, v řadě případů se na ně nemyslí, a proto je třeba tuto diagnózu zvažovat i u dospělých pacientů. Přehled vrozených poruch komplementu viz tabulka 1.
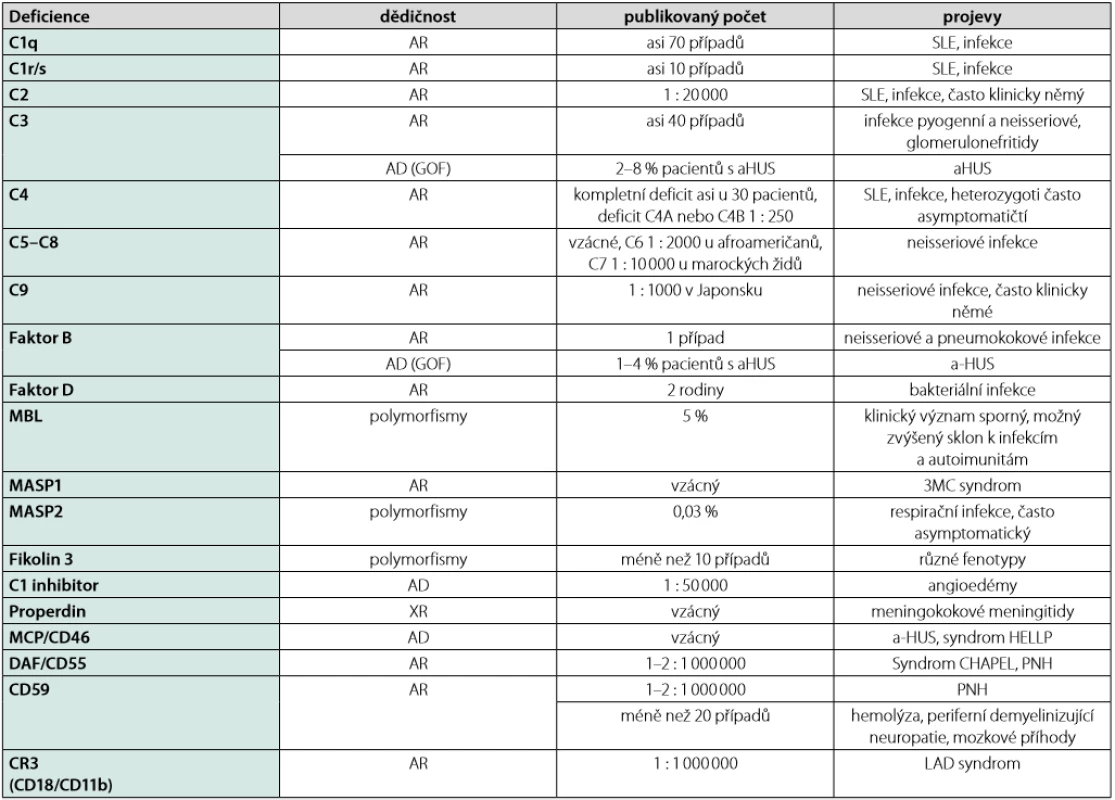
Vrozené poruchy komplementu spojené s vyšší vnímavostí k infekcím
Deficience naprosté většiny komponent komplementového systému je sdružena s vyšší vnímavostí k infekcím opouzdřenými bakteriemi. Oproti tomu infekce virové, mykotické či parazitární jsou u těchto pacientů méně časté, pravděpodobně v důsledku kompenzace komplementového deficitu jinými složkami imunity. Velmi častými patogeny jsou Neisseria meningitidis, Streptococcus penumoniae a Haemophilus influenzae typu b (2, 7).
Nejvyšší incidence meningokokových infekcí pozorujeme u dětí mladších dvou let (pravděpodobně v souvislosti nedostatečnou protilátkovou odpovědí) a ve věku 15–25 let (pravděpodobně v asociaci s deficity komplementovými) (2). K tomuto typu infekce disponují především deficity terminálních složek (C5–C9), složky C3 a složek alternativní cesty, jako je properdin, faktor B, D, I a H (2).
Pacienti s poruchou terminálních složek komplementu mají 1 000–10 000× vyšší riziko neisseriové infekce než běžná populace, ale nepozorujeme u nich vyšší výskyt jiných invazivních bakteriálních onemocnění (2). Infekce mohou být rekurentní, ale zpravidla mají mírnější průběh a nižší mortalitu (2, 5). Obvykle se jedná o infekce meningokokové, ale popsána byla i diseminovaná onemocnění gonokoková (5). Dědičnost deficitů složek C5–C9 je autozomálně recesivní a jiné komplikace než infekční u nich nejsou běžné. Jedná se o onemocnění velmi vzácná, vyskytující se s vyšší frekvencí pouze v některých populacích (5, 7). Například deficit složky C9 je velmi často popisován v japonské populaci a může být i asymptomatický, protože i komplex C5b–C8 je schopen s nižší účinností lyzovat atakované buňky (5, 7).
Meningokokové infekce jsou také hlavním projevem deficience properdinu (2, 5). Properdin je pozitivním regulátorem alternativní cesty a má stabilizační účinek na alternativní C3 konvertázu (5). Jeho deficit lze klasifikovat do tří typů. Typ I je charakterizovaný úplnou absencí properdinu v séru v důsledku porušené tvorby či sekrece, typ II velmi nízkou hladinou (< 10 %) v důsledku zvýšené degradace při abnormální oligomerizaci a typ III vykazuje normální hladinou proteinu, který je ovšem dysfunkční (2, 5). Dědičnost deficitu je X ‑vázaná a postihuje tedy především jedince mužského pohlaví (5, 7). Kromě neisseriových infekcí mohou pacienti trpět i na otitidy a pneumonie vyvolané opouzdřenými mikroorganismy (7). Deficity faktoru B a D jsou velmi vzácné (jednotky případů) a také u nich byly popisovány především infekce Neisseria meningitidis (5, 7). U pacienta s deficitem faktoru D však byly popsány i rekurentní infekce gonokokové a u některých pacientů s deficitem faktoru B infekce pneumokokové (2, 5). Deficity C3 složky komplementu, faktoru H a I kromě infekcí meningokokových disponují také k těžkým infekcím charakteru sepse, pneumonie či osteomyelitidy, které mohou být rekurentní a vznikají již v časném věku (2).
Infekční komplikace jsou méně časté u pacientů s deficity klasické cesty (složky C1, C2 a C4). Obvykle se jedná o infekce pneumokokové, zatímco meningokokové jsou u nich vzácné (2, 5).
Poruchy lektinové cesty bývají asociovány nejen s častějšími infekcemi opouzdřenými bakteriemi, ale také virovými, protozoárními či mykotickými (2). Zvýšená náchylnost k pneumokokovým infekcím byla popsána u deficitu fikolinu‑3 a MASP‑2, ale tato vnímavost nebyla zjištěna u všech identifikovaných pacientů (2, 5). Některé polymorfismy v genech pro fikolin‑3 a MASP‑2 by však mohly být spojeny s vyšší vnímavostí k lepře, Chagasově chorobě či hepatitidě C (2).
V bělošské populaci se relativně často vyskytuje deficit MBL (asi 5–7 % populace), nicméně jeho klinický význam je velmi diskutovaný a tento deficit není zařazen do oficiální klasifikace vrozených poruch imunity navržené IUIS (International Union of Imunological Societies) (2,9). Deficit pravděpodobně nabývá na významu u velmi malých děti, kde ještě nejsou plně vyvinuty mechanismy adaptivní imunity, a jedinců imunokompromitovaných (2). U některých pacientů s MBL deficitem byly popsány závažnější průběhy sepse, rekurentní respirační infekty či infekce HSV nebo těžší průběh malárie (5). Vliv MBL deficitu však může být i protektivní, například u tuberkulózy či CHOPN (2, 11).
Vrozené poruchy komplementu spojené s autoimunitními chorobami
Vyšší vnímavost k autoimunitám se popisuje především u pacientů s poruchou iniciálních komponent klasické cesty, tedy složek C1, C2 a C4. Nejčastěji se jedná o projevy charakteru SLE, ale také se může manifestovat jako Henochova ‑Schönleinova purpura, dermatomyositis, glomerulonefritidy či juvenilní revmatoidní artritida (2, 5, 7).
C1 složka komplementu je tvořena jednou molekulou C1q, dvěma molekulami C1r a dvěma molekulami C1s. Homozygotní deficit se vyskytuje nejčastěji u složky C1q, kde bylo popsáno asi 70 případů, nejčastěji u dětí konsangvinních párů. U postižených jedinců se až v 90 % případů rozvíjí SLE, ale kromě toho mohou trpět také na rekurentní bakteriální infekce. Deficience serinových proteáz C1r a C1s byly popsány asi u 10 pacientů. Také se projevují zvýšeným rizikem rozvoje SLE, zejména s renálním a kožním postižením (2, 5, 7, 11).
Deficit C2 patří mezi častější vrozené poruchy komplementu a jeho prevalence v evropské populaci je odhadována na 1 : 20 000. Autoimunitní projevy nacházíme však jen asi u 10–42 % pacientů, přičemž nejčastěji se jedná o onemocnění charakteru SLE postihující zejména ženy. Heterozygotní jedinci bývají asymptomatičtí (4, 5, 7, 11).
Složka C4 má dva izotypy kódované dvěma vysoce polymorfními geny C4A a C4B lokalizovanými na 6. chromozomu v oblasti kódující MHC III. třídy. U 50–65 % populace jsou přítomny dva geny pro C4A a dva pro C4B. Ostatní jedinci mají 1 nebo více genů duplikovaných nebo chybí. Jedinec tak může mít 1–8 funkčních genů. Úplný deficit C4 složky komplementu je proto vzácný (popsáno asi 30 případů).
Zhruba u 75–80 % pacientů dochází k rozvoji onemocnění charakteru SLE. Průběh bývá často závažný a příznaky začínají již v dětství (5, 7). Oproti tomu deficity C4A a C4B jsou podstatně častější a také jsou dávány do souvislosti s rozvojem autoimunitních onemocnění (11). U postižených jedinců byla popsána predispozice zejména ke vzniku SLE, ale například také sklerodermie, celiakie, vaskulitid, IgA nefropatie či subakutní sklerózující panencefalitidy (5, 7).
Také deficience C3 složky, která se sekundárně rozvíjí i při deficitech faktorů H a I, může být asociována s autoimunitními projevy, zejména charakteru glomerulonefritidy či SLE (2, 5).
Vrozené poruchy komplementu sdružené s poruchami vývoje a malformacemi
Velmi vzácný 3MC (Malpuech, Michaels a Mingarelli‑Carnevale) syndrom, charakterizovaný obličejovým dysmorfismem, rozštěpy rtů a patra, postnatální růstovou retardací, poruchou kognitivních funkcí a hluchotou, je způsoben homozygotní mutací v genu MASP1 či v genech pro kolektiny (COLEC10, COLEC11). Zvýšený sklon k infekcím nebyl u pacientů s 3MC syndromem popsán (2,5). Některé heterozygotní missense mutace v genu pro C1r a C1s mohou být asociovány s periodontální formou Ehlersova‑Danlosova syndromu (9, 12).
Onemocnění sdružená s vrozenými poruchami regulačních faktorů komplementového systému
Na regulaci komplementového systému se podílí řada solubilních i membránově vázaných proteinů, které zabraňují nadměrné aktivaci, amplifikaci a tvorbě MAC. Klinické projevy deficience jednotlivých regulačních faktorů mají většinou velmi specifický klinický obraz. Zatímco kompletní deficit zpravidla vede ke konsumpci více složek zapojených do příslušné dráhy, obvykle s projevy imunodeficitu, haploinsuficience způsobuje nadměrnou lokální zánětlivou odpověď v místě poranění či akumulace imunokomplexů (5). Mezi onemocnění asociovaná s vrozenými poruchami regulačních složek komplementu řadíme řadu chorob s pestrým klinickým obrazem (2, 5, 7).
Atypický hemolyticko‑uremický syndrom (aHUS) je trombotická mikroangiopatie, charakterizovaná trombocytopenií, hemolytickou anemií a renální insuficiencí. Zhruba u 50 % pacientů je možné detekovat příčinnou mutaci v genech kódujících regulační komponenty komplementového systému. Zpravidla se jedná o haploinsuficienci v genu pro faktor H (20–30 % případů), faktor I (5–10 %), nebo membránový kofaktorový protein (MCP)/CD46 (10–15 %) či gain of function (GOF) mutaci v genu pro C3 složku (2–10 %) nebo faktor B (1–4 %). Zhruba u 20 % pacientů je prokázáno současně více mutací a část pacientů také může tvořit protilátky proti regulačním faktorům (5, 7, 9).
Hereditární angioedém s deficitem C1 inhibitoru (HAE ‑C1‑INH) je autozomálně dominantně dědičné onemocnění podmíněné mutací v genu pro C1 inhibitor. Tato mutace vede k nedostatečné tvorbě a nízké koncentraci C1 inhibitoru (C1 INH) v séru (HAE‑1) nebo je produkovaná bílkovina dysfunkční (HAE‑2) (13). C1 inhibitor (C1 INH) je řazený mezi tzv. serpiny – inhibitory serinových proteáz. Inhibičně ovlivňuje nejen C1r a C1s složku komplementu a MASPs, ale například také kalikrein, plazmin, tkáňový aktivátor plazinogenu nebo faktor XIIa a XIa. Důsledkem jeho deficitu není jen nadměrná aktivace systému komplementového, ale také kalikrein‑kininového systému, což vede k nadprodukci bradykininu. Ten je považovaný za hlavní mediátor vzniku angioedému u pacientů s deficitem C1‑INH (2, 14). Onemocnění se projevuje rozvojem otoků v různých lokalitách, zejména v oblasti končetin, obličeje či sliznice trávicího systému. Nejzávažnější jsou otoky dýchacích cest, které mohou pacienty ohrožovat bezprostředně na životě. Jeho prevalence v populaci je odhadována na 1 : 50 000 bez ohledu na rasu či pohlaví (2, 13).
Věkem podmíněná makulární degenerace (AMD) je jednou z nejčastějších příčin ztráty zraku v rozvinutých zemích (2, 5). Její rozvoj je dávaný do souvislosti zejména s některými genovými polymorfismy
v genu pro faktor H. Například riziková alela 402H se vyskytuje asi u 30 % bělošské populace a 1,5–3× zvyšuje riziko AMD u heterozygotů a až 10× u homozygotů. U pacientů s AMD však byly popsány i další vzácné genové varianty v genech pro faktor H, I, C3 či B, které vedou k nadměrné aktivitě v alternativní cestě (5, 7).
C3 glomerulopatie představuje nově definovanou klinickou jednotku se závažnou prognózou, v jejíž patogenezi hraje roli nadměrná aktivace alternativní složky komplementu (15). Histologicky v ledvinách prokazujeme abnormální depozici C3 (7). Patogeneze choroby je heterogenní a uplatňují se v ní vlivy genetické a autoimunitní. Jako možný příčinný genetický faktor byly identifikovány některé varianty v genech pro C3 složku komplementu, faktor B, H a I (2).
Syndrom HELLP (hemolysis, elevated liver enzymes and low‑platelets) představuje závažnou komplikaci gravidity. U části pacientek byly detekovány heterozygotní mutace v genech pro faktor H, I a MCP. Přesná etiopatogeneze syndromu však zatím nebyla přesně objasněna (7).
Syndrom CHAPLE je onemocnění podmíněné deficitem molekuly CD55 (decay accelerating factor, DAF). DAF se nachází na povrchu hemopoetických, stromálních, endoteliálních a epiteliálních buněk a chrání je před působením komplementů tím, že rozkládá C3 a C5 konvertázy (2,3). Jeho deficience je příčinou onemocnění charakterizovaného nadměrnou aktivací komplementu, angiopatickými trombotickými komplikacemi a časně nastupující protein‑loosing enteropatií, označovaným jako CHAPLE syndrom (2).
Deficience CD59 (protektinu) představuje velmi vzácnou vrozenou poruchu v systému komplementu, která se projevuje chronickou hemolýzou, opakovanými mozkovými příhodami a zánětlivou demyelinizující polyneuropatií (2, 16). Funkce molekuly CD59 je inhibiční, tlumí polymeraci molekul C9, a tím brání vytvoření lytického póru (3). Bylo popsáno více mutací v genu pro CD59, které mohou vést k tomuto onemocnění, dědičnost je však vždy autozomálně recesivní (2,5).
Molekuly CD59 a CD56 jsou do buněčné membrány ukotveny glykofosfatidylinozitolovou (GPI) kotvou. Získaná mutace v genu pro tuto kotvu (PIG ‑A) v hematopoetických buňkách kostní dřeně vede k absenci obou výše zmiňovaných molekul na povrchu krevních elementů a tím k jejich zvýšené náchylnosti k lýze komplementem. Takto podmíněné onemocnění je označováno jako paroxysmální noční hemoglobinurie (PNH). Mezi jeho základní projevy patří intravaskulární hemolýza a trombotické komplikace (5, 7).
Také jednu z forem LAD (leukocyte-adhesion deficiency) syndromu, konkrétně typ 1, lze zařadit mezi poruchy komplementu. Je totiž podmíněna mutací v genu pro komplementový receptor 3 (CR3, CD11b/CD18). Onemocnění je velmi vzácné, autozomálně recesivně dědičné a projevuje se závažnými bakteriálními infekcemi kůže a sliznic, které začínají již krátce po narození. Chybějící protein je totiž důležitý pro adhezi, migraci a C3 dependentní fagocytózu (2, 7).
Získané poruchy komplementového systému
Sekundární (získané) poruchy v systému komplementu vznikají jako důsledek jiného základního onemocnění a jsou běžnější než deficity vrozené. Bývají obvykle pouze parciální, s méně vyjádřeným klinickým obrazem, ale na druhou stranu mohou postihovat současně více složek. K jejich rozvoji dochází nejčastěji v důsledku konsumpce při nadměrné tvorbě imunokomplexů nebo působením autoprotilátek, vzácněji potom při nedostatečné syntéze či zvýšených ztrátách (8).
Typickým příkladem onemocnění spojeným s konsumpcí složek komplementu je SLE. Nízké hodnoty C3 a C4 složky detekujeme asi u 50 % pacientů s touto chorobou (8). Tyto nálezy jsou důsledkem nadměrné aktivace klasické cesty komplementu imunitními komplexy. Jen asi u 3–5 % pacientů dochází k přednostní aktivaci cesty alternativní. Za této situace kromě snížení C3 a C4 detekujeme i nízkou hladinu faktoru B. Nízké hladiny složek komplementu korelují se závažnějším průběhem choroby a jejich návrat do normálních hodnot po terapii je příznivým prognostickým ukazatelem. Do jaké míry však hypokomplementémie u pacientů s SLE přispívá k vyšší vnímavosti k bakteriálním infekcím, zatím není jasné. Předmětem výzkumu je možnost měřit depozita fragmentů složek komplementu (C3d a C4d) na povrchu hematopoetických buněk nebo produktů štěpení (C3a, C5a, Bb, solubilní C5b ‑C9) v periferní krvi za účelem hodnocení aktivity choroby (17). K hypokomplementémii může obdobnými mechanismy jako u SLE vést i antifosfolipidový syndrom, celá řada nefritid, kryoglobulinemie a další vaskulitidy, IgG4 asociovaná nemoc, autoimunitní hemolytická anemie a také některé chronické infekce, jako je hepatitida B a C, nebo infekce parvovirové a flavivirové s vysokou virovou náloží (8, 19).
Ke konsumpci a funkčnímu deficitu složek komplementu mohou přispívat i autoprotilátky. Příkladem takového onemocnění může být získaný angioedém s deficitem C1 inhibitoru (AAE ‑C1‑INH). Obdobně jako hereditární forma se manifestuje otoky v různých lokalitách v důsledku nadprodukce bradykininu (8, 19). AAE ‑C1‑INH je ve většině případů asociován s lymfoproliferativními chorobami, jako jsou non ‑Hodgkinské lymfomy (zpravidla s nízkým stupněm malignity) a monoklonální gamapatie nejasného významu (MGUS). Asi u 70 % pacientů detekujeme protilátky proti C1‑INH, které mohou být neutralizační. Další teorie vysvětluje patogenezi nadměrnou aktivací klasické komplementové kaskády nádorovou tkání nebo autoprotilátkami, což následně vede ke konsumpci C1 INH (20). Autoprotilátky proti C3 složce komplementu (C3 nefritický faktor) nebo C4 složce (C4 nefritický faktor) způsobují nekontrolovanou aktivaci komplementového systému a konsumpci C3 složky. Mechanismus účinku spočívá ve vazbě a prodloužení biologického poločasu C3 konvertáz. Pacienti zpravidla trpí membranoproliferativní glomerulonefritidou vznikající v dětství, lipodystrofií a zvýšenou náchylností k infekcím opouzdřenými bakteriemi (8, 11). Anti ‑C1q protilátky prokazujeme u 100 % pacientů s urtikariální hypokomplementemickou vaskulitidou a asi u 30 % pacientů s SLE, kde jejich výskyt koreluje s renálním postižením (11, 20).
Nízká produkce složek komplementu jaterními buňkami je pod ‑ statně méně častou příčinou deficitu komplementového systému. Pro vznik hypokomplementemie musí být jaterní onemocnění už hodně pokročilé, a proto je pro monitoraci syntetické funkce jater vhodné použít jiné ukazatele (8).
Hypokomplementémie v důsledku ztrát může doprovázet některé velmi těžké formy nefrotického syndromu. Významné jsou zejména ztráty faktoru D, protože se jedná o nejmenší komponentu s molekulovou hmotností 25 000. Klinický význam těchto ztrát však zatím nebyl prokázán (8).
Vyšetření při podezření na poruchu v systému komplementu
Na možnou poruchu v komplementovém systému je třeba pomýšlet zejména při některých varovných znacích, mezi které patří meningokoková meningitida u jedinců starších 5 let, opakované a těžké infekce opouzdřenými mikroorganismy, autoimunitní choroby (zejména SLE), angioedémy bez kopřivky, zánětlivá onemocnění postihující ledviny nebo oko a neobvyklé infekce (např. epiglotitida navzdory vakcinaci proti Haemophilus influenzae typu b) (5, 21).
Základní laboratorní vyšetření zahrnuje vyšetření koncentrace jednotlivých složek a vyšetření funkční. V našich podmínkách lze stanovit koncentrace složek C1q, C2, C3, C4, C5, C1 INH a MBL, vyšetření ostatních komponent není v rutinních laboratořích běžně dostupné. Při hodnocení patologických nálezů je třeba mít na paměti, že snížená koncentrace složek komplementu, zvláště pokud se týká více komponent současně, bývá často sekundární, obvykle v souvislosti se zvýšenou konsumpcí. V takových případech zpravidla prokazujeme i zvýšení cirkulujících imunokomplexů (CIK). Snížení více složek také může být zapříčiněno špatným nakládáním se vzorkem, deficitem regulačních faktorů či přítomností autoprotilátek (5, 7).
Pro vyšetření funkce jsou již mnoho let využívány testy založené na hemolýze vyšetřující aktivaci klasické cesty (CH50) nebo alternativní cesty (AH50). Velmi nízké hodnoty CH50 nacházíme při deficitu C1, C2 nebo C4. Nízké AH50 může poukazovat na deficit properdinu nebo faktoru B a D. Oba testy budou nízké při deficitu C3 nebo složek C5–C9. Nověji jsou aktivity všech tří cest testovány metodou ELISA (5, 7). Při podezření na hereditární angioedém vyšetřujeme koncentraci a funkci C1 inhibitoru, které při podezření na získanou formu doplňujeme o vyšetření koncentrace C1q složky, která bývá u získaného deficitu C1 INH také snížená (13). V našich podmínkách je dostupné i vyšetření protilátek proti C1q, jejichž přítomnost prokazujeme u urtikární hypokomplementemické vaskulitidy a/nebo proliferativní SLE nefritidy. Pro potvrzení podezření na vrozený deficit v systému komplementu je vhodné provést genetické vyšetření, které je v případě deficitu některých složek také jedinou možnou definitivní verifikací diagnózy (5). Recentně byla publikována mezinárodní doporučení, která navrhují postup při testování pacientů se suspektním deficitem v systému komplementu (viz schéma 2). Jeho použití v naší praxi však naráží na nedostupnost některých doporučovaných vyšetření.

* doplnění funkčního vyšetření může pomoci k lepší lokalizaci dysfunkce
Terapie poruch komplementu
Pacienti s prokázanou poruchou komplementu by o své diagnóze měli být náležitě poučeni a vybaveni základními informacemi a doporučením v písemné podobě. Jelikož jsou především ohroženi vznikem závažné infekce, měli by znát možné příznaky (např. horečka, ztuhnutí šíje a petechiální výsev při meningokokové infekci) a v případě, že je rozpoznají, ihned vyhledat lékařskou pomoc. Rizikové mohou být pro tyto pacienty chirurgické zákroky, zejména z důvodu vyšší vnímavosti k infekci, a proto se doporučuje včasné zahájení antibiotické terapie při jejích příznacích. Gravidita u některých pacientek s komplementovými deficity zvyšuje riziko preeklampsie, a před cestováním je vždy třeba zvážit vhodnou vakcinaci a vybavení pohotovostní medikací (např. antibiotiky). U pacientů s HAE je kontraindikováno užívání inhibitorů enzymu konvertujícího angiotensin, estrogenů a dalších léků zasahujících do metabolismu bradykininu. Před chirurgickými zákroky se doporučuje podání koncentrátu C1 INH. V neposlední řadě by mělo být provedeno i vyšetření rodinných příslušníků (5, 7, 13).
Substituční léčba se u poruch komplementu s výjimkou deficitu C1 inhibitoru příliš neuplatňuje a jednotlivé složky nejsou kromě C1 INH ve formě koncentrátu běžně dostupné (7). Hypoteticky by bylo možné podání krevní plazmy, ale až na vzácné výjimky se nepoužívá z důvodu krátkého biologického poločasu jednotlivých složek, rizika alosenzibilizace a možného přenosu infekčního onemocnění (7). Příkladem jejího použití mohou být pacienti s aHUS na podkladě deficitu faktoru H, u kterých byla před zavedením ekulizumabu v některých případech krevní plazma úspěšně podána k dočasnému zmírnění symptomů a zvýšení hladiny C3 (22). U pacientů s hereditárním angioedémem lze koncentráty C1 inhibitoru (plazmatický nebo rekombinantní) použít k léčbě vzniklého angioedému a plazmatický koncentrát je indikovaný také k terapii preventivní. Lze ho podávat pravidelně u pacientů s častými nebo závažnými příznaky nebo jednorázově v situacích s rizikem rozvoje otoku (např. chirurgický nebo stomatologický zákrok) (13).
Základním opatřením u pacientů s komplementovými deficity je preventivní očkování. Vakcinace by měla zahrnovat nejen všechna běžná očkování doporučená pro zdravé jedince, ale měla by být doplněna i očkování proti pneumokoku, meningokoku a hemofilu konjugovanou vakcínou. Hladiny očkovacích protilátek je doporučeno kontrolovat a při nízkých hladinách má proběhnout přeočkování. U pacientů s hereditárním angioedémem, kteří jsou pravidelně léčeni krevními deriváty, je vhodné provést očkování proti virové hepatitidě B (5, 7).
U pacientů s opakovanými infekcemi se doporučuje antibiotická profylaxe, zpravidla s použitím antibiotik penicilinových či makrolidových. Profylaxi je vhodné zvážit i u pacientů s vysokými rizikem expozice bakteriálním agens (např. ti co jsou vyššímu riziku vystaveni profesně). Ostatní pacienti, u kterých profylaktická léčba není indikována, by měli být alespoň vhodným antibiotikem vybaveni pro případ potřeby (5).
Specifická terapie je u poruch komplementu dostupná jen v několika indikacích. Již výše bylo zmíněno použití koncentrátu C1 inhibitoru u pacientů s HAE ‑C1‑INH. U této diagnózy máme k dispozici i další preparáty. K dlouhodobé preventivní léčbě lze použít lanadelumab, monoklonální protilátku proti kalikreinu, nebo méně specifické látky, jako jsou atenuované androgeny, které pravděpodobně zvyšují syntézu
C1 INH, nebo antifibrinolytika, fungující jako inhibitory plazminu. Pro léčbu akutních otoků je určený ikatibant, antagonista B2 receptorů pro bradykinin, případně v USA registrovaný ecallantide, který funguje jako inhibitor kalikreinu (13). Pro léčbu PNH a aHUS máme k dispozici monoklonální protilátku proti C5 složce komplementu ekulizumab. Jelikož po jeho podání významně stoupá riziko infekce meningokoky, doporučuje se pacienty před zahájením léčby proti tomuto agens očkovat. Pro léčbu PNH je ještě k dispozici další monoklonální protilátka proti C5 složce ravulizumab (5, 7).
Transplantace hematopoetických kmenových buněk (HSCT) byla úspěšně použita u několika pacientů s deficitem C1q a u dvou pacientů s HAE ‑C1‑INH, kteří tento zákrok podstupovali z jiné indikace. Ačkoli za hlavní orgán syntetizující složky komplementu považujeme játra, tak výše uvedené případy efektivní terapie poruch složek komplementu pomocí HSCT, podtrhují význam jejich syntézy buňkami hematopoetického systému. Nadějí do budoucna by mohla být genová terapie, která je pro HAE ‑C1‑INH již ve stádiu klinických studií (5).
Závěr
Vrozené poruchy komplementového systému patří mezi vzácná onemocnění, která však v řadě případů mohou mít závažné projevy a ohrožovat pacienty bezprostředně na životě. Získané deficity jsou častější, nicméně zpravidla bývají pouze parciální. Typickou manifestací jsou rekurentní a závažné infekce vyvolané především opouzdřenými bakteriemi nebo autoimunitní projevy, nejčastěji charakteru SLE. Poruchy regulačních složek zpravidla způsobují onemocnění s typickým klinickým obrazem. Na možnou poruchu komplementu je třeba myslet hlavně u pacientů s meningokokovými a rekurentními pyogenními infekcemi, autoimunitními chorobami ledvin a SLE nebo angioedémy bez kopřivky. Diagnostika je však často obtížná, mimo jiné i z důvodu horší dostupnosti vhodného laboratorního vyšetření. Specifická terapie pro většinu komplementových deficitů zatím není k dispozici, je doporučeno pacienty očkovat zejména proti pneumokoku, meningokoku a hemofilu a nutná je i důsledná antibiotická terapie případných infektů nebo antibiotická profylaxe. Nově máme k dispozici monoklonální protilátky proti C5 složce, které brání nadměrné aktivaci komplementové kaskády a používají se v léčbě aHUS a PNH. Samostatnou kapitolou je potom léčba HAE ‑C1‑INH, kde máme k dispozici konkrétní doporučení a specifické preparáty.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Marta Sobotková,
Ústav imunologie 2. LF UK a FN v Motole,
V Úvalu 84,
150 06 Praha 5
Cit. zkr: Vnitř Lék 2020; 66(6): 346–352 Článek přijat redakcí: 19. 7. 2020 Článek přijat po recenzích k publikaci: 26. 8. 2020
Sources
1. Krejsek J, Andrýs C, Krčmová I. Imunologie člověka, Garamon: Hradec Králové, 2016. 495 stran. ISBN 978‑80‑86472‑74‑4
2. Schröder ‑Braunstein J, Kirschfink M, et al. Complement deficiencies and dysregulation: Pathophysiological consequences, modern analysis, and clinical management. Mol Immunol. 2019; 114 : 299–311.
3. Hořejší V, Bartůňková J, Brdička T, et al. Základy imunologie. 6., aktualizované vydání, Triton: Praha 2017 : 51–57. ISBN 979‑80‑7553‑250‑3
4. Mayilyan KR. Complement genetics, deficiencies, and disease associations. Protein Cell. 2012; 3(7):487–496.
5. Brodszki N, Frazer ‑Abel A, Grumach AS, et al. European Society for Immunodeficiencies (ESID) and European Reference Network on Rare Primary Immunodeficiency, Autoinflammatory and Autoimmune Diseases (ERN RITA) Complement Guideline: Deficiencies, Diagnosis, and Management. J Clin Immunol. 2020; 40(4): 576–591.
6. Ricklin D, Lambris JD. Complement in immune and inflammatory disorders: pathophysiological mechanisms. J Immunol. 2013; 190(8): 3831–3838.
7. Liszewski MK, Atkinson JP. Inherited disorders of the compleemnt system. Up ‑to‑date [Cit. 2020‑07‑08]. dostupné z WWW: https://www.uptodate.com/contents/ inherited ‑disorders ‑of ‑the ‑complement ‑system/print?search=complement%20defi ‑ ciencies & source=search_result & selectedTitle=1~107 & usage_type=default & dis ‑ play_rank=1
8. Liszewski MK, Atkinson JP. Acquired deficiencies of the complement systém. Up‑to‑date [Cit. 2020‑07‑08]. dostupné z WWW: https://www.uptodate.com/con ‑ tents/acquired ‑deficiencies ‑of ‑the ‑complement ‑system/print?search=complement%20deficiencies & source=search_result & selectedTitle=2~107 & usage_type=default & display_rank=2
9. Tangye SG, Al‑Herz W, Bousfiha A, et al. Human Inborn Errors of Immunity: 2019 Update on the Classification from the International Union of Immunological Societies Expert Committee. J Clin Immunol. 2020; 40(1): 24–64.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2020 Issue 6
-
All articles in this issue
- Anafylaxe – akutní a dlouhodobý management
- Potravinová alergie a intolerance
- Poruchy v komplementovém systému
- Imunosenescence – západ slunce nad imunitním systémem
- Chřipka a její komplikace
- Familiární plicní fibróza – doporučení pro diagnostiku a léčbu
- Nové dělení krystalopatií z pohledu nefrologa
- Infarkt myokardu nebo syndrom zlomeného srdce?
- Dieulafoy lézia jejuna ako zdroj život ohrozujúceho krvácania
- Co nového internistům přinášejí doporučené postupy pro diagnostiku a léčbu plicní embolie z roku 2019?
- Perkutánní okluze ouška levé síně
- Současné postavení dietních opatření u pacientů s pokročilým stupněm chronického onemocnění ledvin
- Dysfunkčný dialyzačný cievny prístup a jeho endovaskulárna liečba
- Histiocytózy a neoplazie odvozené od makrofágů a dendritických buněk. Srovnání WHO klasifikace z roku 2017 a klasifikace Histiocyte society z roku 2016
- Glykovaný hemoglobín ako marker zvýšenia LDL a TAG – kohortná štúdia
- Deriváty sulfonylurey a riziko hypoglykemie u diabetiků 2. typu
- Endoskopická diagnostika a terapie pankreatobiliárních onemocnění u osob po resekci žaludku podle Billrotha I
- Nozokomiální methemoglobinemie
- Alergie a imunopatologie – hlavní téma
- Postihnutie tráviaceho traktu pri zmiešanej chorobe spojivového tkaniva (Sharpovom syndróme)
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Infarkt myokardu nebo syndrom zlomeného srdce?
- Postihnutie tráviaceho traktu pri zmiešanej chorobe spojivového tkaniva (Sharpovom syndróme)
- Potravinová alergie a intolerance
- Poruchy v komplementovém systému
