Současné postavení dietních opatření u pacientů s pokročilým stupněm chronického onemocnění ledvin
Current status of dietary measures in patients with advanced-stage chronic renal failure
For patients with advanced chronic kidney disease (CKD) appropriately chosen and timely initiated dietary measures, as a complement to drug therapy, may slow the progression of the disease and delay the need for dialysis treatment. According to the results, dietary protein restriction may play a very important in management of such a patient. The effect of low protein diet is given by the early initiation and well cooperation of patients. The low protein diet with supplementation of ketoanalogues of amino acids is an attractive intervention to help maintain good nutritional status of patients and also have a positive role in calcium phosphate metabolism. Depending on the level of CKD´s progression it should not be forgotten either the fluid balance and the limitation of the intake of salt and phosphorus in the diet which may also have an unfortunate effect on the course of the disease.
Keywords:
fluid and mineral balance – chronic kidney disease – ketoanalogue – low protein diet
Authors:
Anna Maršáková; Karolína Krátká; Petra Bachroňová; Ivan Rychlík
Authors‘ workplace:
I. interní klinika 3. LF UK a FN Královské Vinohrady Praha
Published in:
Vnitř Lék 2020; 66(6): 10-13
Category:
Overview
U pacientů s pokročilým stupněm chronického onemocnění ledvin (chronic kidney disease – CKD) mohou vhodně zvolená a včasně zahájená dietní opatření, jako doplněk k medikamentózní terapii, zpomalit progresi onemocnění a oddálit tak nutnost dialyzační léčby. Podle dosavadních výsledků má svůj velký význam především nízkobílkovinná dieta, o jejímž efektu rozhoduje zejména včasné zahájení a spolupráce pacientů. Samotnou nízkobílkovinnou dietu je vhodné doplňovat o ketoanaloga esenciálních aminokyselin, která přispívají k zachování dobrého nutričního stavu pacientů a mají rovněž svůj význam i v problematice kalciumfosfátového metabolismu. Dle stupně pokročilosti CKD se ale nesmí zapomínat ani na tekutinovou bilanci a omezení příjmu soli a fosforu v potravě, které mohou mít rovněž negativní vliv na průběh onemocnění.
Klíčová slova:
chronické onemocnění ledvin – ketoanaloga – nízkobílkovinná dieta – tekutinová a minerálová bilance
Úvod
Dietní opatření u pacientů s onemocněním ledvin hrají významnou roli, neboť mohou zpomalit progresi onemocnění, a tím oddálit zahájení dialyzační léčby a současně u již dialyzovaných pacientů mají pozitivní vliv na celkový stav organismu.
Dietní režim u pacientů se sníženou renální funkcí se řídí dle toho, zda se jedná o pacienty v predialyzační péči, pacienty v programu peritoneální dialýzy či již chronicky hemodialyzované pacienty a následující text se soustředí na problematiku u pacientů s pokročilým stupněm CKD v predialyzační péči.
U veškerých dietních opatření se musí postupovat vždy přísně individuálně, tedy s ohledem na stupeň poškození renální funkce a na další komorbidity pacienta, protože průběh onemocnění se může vyvíjet a je tedy následně potřeba dietní opatření upravovat.
V následujícím textu podáváme souhrnný pohled na dietologickou problematiku u pacientů s pokročilým stupněm CKD z pohledu jednotlivých položek diety.
Bílkoviny v dietě
U pacientů v predialyzační péči hraje významnou roli na zpomalení progrese poškození ledvin nízkobílkovinná dieta (low protein diet – LPD). Efekt odloženého nástupu dialyzační léčby díky omezenému příjmu proteinů byl potvrzen metaanalýzou 10 studií, kdy redukce příjmu proteinů u pacientů s chronickým onemocněním ledvin snížila výskyt renální smrti o 32 % ve srovnání s vyšším nebo nerestrihovaným příjmem proteinů. Hlavním cílem je poskytnutí tzv. „funkčního odpočinku“ zbývajícím nefronům (1).
Při nadměrném přívodu bílkovin potravou totiž u pacientů s poškozením renální funkce dochází vlivem zvýšené hladiny dusíkatých katabolitů ke zvýšení glomerulární filtrace a tím k následné hyperfiltraci, resp. přetížení zbývajících nefronů. Patofyziologické mechanismy glomerulární hyperfiltrace, které se mohou v závislosti na základním onemocnění lišit, nejsou zatím dobře prozkoumány. Glomerulární hyperfiltrace může být způsobena buď vazodilatací aferentní arterioly – toto je vidět např. u pacientů s diabetem a za fyziologických podmínek např. v těhotenství, nebo po jídle s vysokým obsahem bílkovin. Nebo může být tento fenomén zapříčiněn vazokonstrikcí eferentní arterioly v důsledku aktivace systému renin-angiotenzin - aldosteron, což vede ke glomerulární hypertenzi. Glomerulární hypertrofie a zvýšený glomerulární tlak mohou být jak příčinou, tak následkem poškození ledvin (2).
Díky nízkému přísunu bílkovin ve stravě tudíž následně dochází k lepšímu využití dusíkatých sloučenin, kde je menší část vylučována a větší je naopak využita v resyntéze proteinů, a tím je tedy i snížen poměr mezi syntézou a katabolismem. Je potřeba zdůraznit, že při těžké restrikci proteinů naopak dochází po určité době k narušení koncentrační schopnosti ledvin a současně pacientům hrozí proteinoenergetická malnutrice se všemi negativními důsledky.
Bílkoviny patří společně s tuky a sacharidy k hlavním živinám. Jejich tvorba je závislá výhradně na jejich příjmu potravou a v dobře sestavěné stravě u zdravého člověka tvoří asi 10–15 % energie, kdy doporučený denní příjem se pohybuje kolem 0,8–0,9 g bílkovin/kg tělesné váhy (body weight – BW)/den (3).
Bílkoviny můžeme rozdělit na živočišné a rostlinné, kdy živočišné bílkoviny představují vysokou biologickou hodnotu se zastoupením vysokého procenta esenciálních aminokyselin a v závislosti na celkovém denním příjmu proteinů by měli u zdravého člověka tvořit asi 50–70 % z celkového zastoupení bílkovin – v takovém případě se jedná o diety selektivní. Oproti tomu diety s obsahem rostlinných bílkovin, tzv. neselektivní diety, jsou ve formě méně kvalitního proteinu s nízkým zastoupením esenciálních aminokyselin a s poměrně vysokým zastoupením neesenciálních aminokyselin. Udává se, že jsou lépe tolerovány, jsou pestřejší, ale příjem bílkovin celkově musí být vyšší (asi 0,8 g/kg BW/den) a nebo při příjmu 0,5 g/kg BW/den je vhodné tyto doplňovat ketoanalogy esenciálních aminokyselin, protože i za fyziologických podmínek probíhá v organismu určitý stupeň metabolické degradace bílkovin (0,6–0,8 g/kg BW/den). Nelze opominout, že nároky na přívod bílkovin ovlivňuje i řada faktorů v podobě stravitelnosti potravin, metabolického a klinického stavu pacienta, věku či farmakoterapie apod. (3–7).
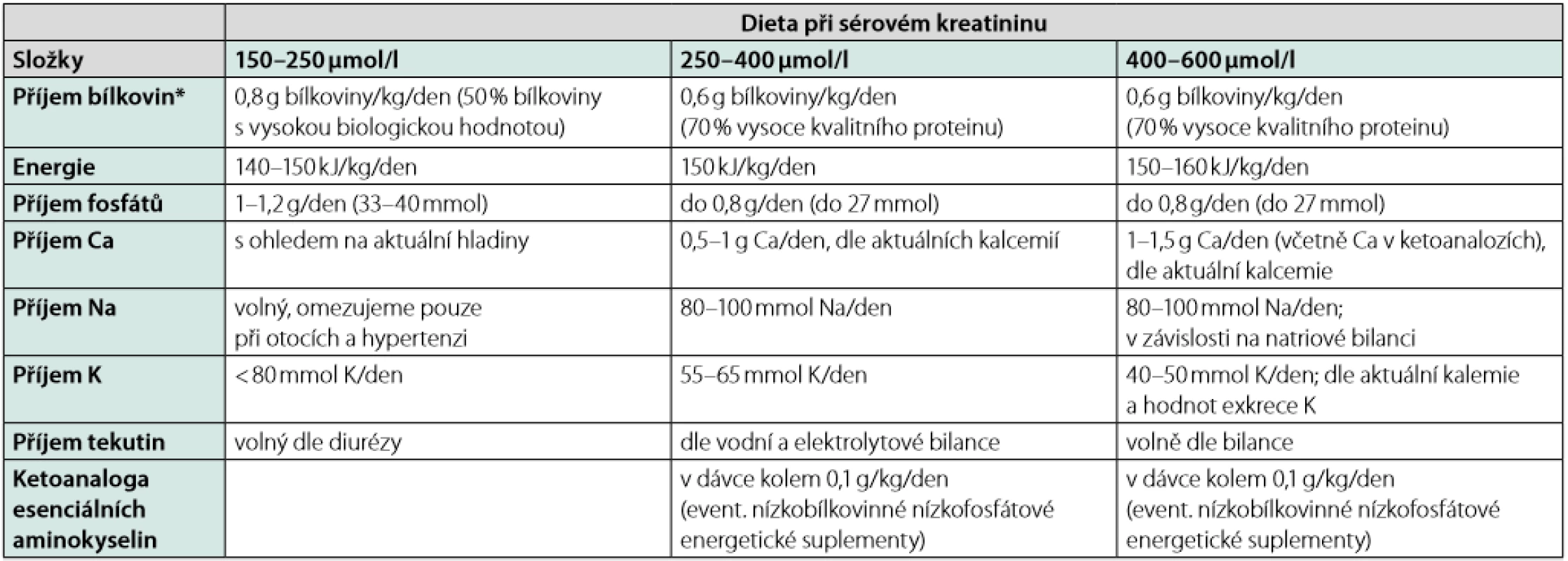
*Množství přijímaného proteinu se zvyšuje o hodnotu přítomné proteinurie
Nízkobílkovinná dieta má dále ještě svá dělení, kdy rozlišujeme samotnou nízkobílkovinnou dietu (LPD – low protein diet) s doporučeným denním příjmem bílkovin 0,6 g bílkoviny/kg/den a tzv. dietu s velmi nízkým obsahem bílkovin (VLPD – very low protein diet), tj. 0,3–0,4 g bílkovin/kg BW/den (3).
Při závažných metabolických poruchách výživy, nebo pokud nelze dosáhnout deklarovaného energetického množství, lze dietu suplementovat ketoanalogy či hydroxyanalogy esenciálních aminokyselin.
Ketoanaloga obsahují kromě esenciálních aminokyselin lysinu, treoninu, histidinu, tyrosinu, tryptofanu i α-ketoanaloga, resp. α-hydroxyanaloga esenciálních aminokyselin: ketoleucin, ketofenylalanin, ketovalin a hydroxymetionin ve formě kalciových solí. Tyto sloučeniny jsou v organismu enzymaticky transaminovány na odpovídající L-aminokyseliny za současného odbourávání dusíku močoviny. Ketoanaloga umožňují společně s nízkobílkovinnou dietou přívod esenciálních aminokyselin bez přívodu dusíku, reutilizaci dusíkových katabolitů, proteinoanabolismus při současném poklesu sérové močoviny, zlepšení dusíkové bilance, pokles sérového kalia, magnezia a fosforu (3).
Kontraindikovány jsou především u hyperkalcemie, v případě těžké jaterní léze, při uremické gastrointestinální symptomatologii a pro nedostatek informací není doporučené podávání v těhotenství (6, 7).
Léčba LPD nebo VLPD s doplněním ketoanalog je možná až do predialyzační fáze CKD, nicméně kontraindikací pro terapii s nízkobílkovinnou dietou je rozvoj uremických komplikací, dále stavy s pokročilou retencí tekutin a elektrolytů a nedostatečná compliance k léčbě. Efekt léčby je dán hlavně aktivní spoluprací pacientů, kteří jsou k léčbě motivováni především zlepšením metabolického stavu a oddálením terminálního stadia selhání ledvin (3–7).
Nízkoproteinová dieta doplněná o ketoanaloga může zpomalit pokles renálních funkcí s oddálením dialyzační léčby bez negativního dopadu na nutriční stav pacientů. Výsledky randomizované kontrolní studie zaměřené na rychlost progrese CKD odhalily o 57 % pomalejší pokles renálních funkcí u LPD suplementované ketoanalogy v porovnání s konvenční stravou s nízkým obsahem bílkovin a oddálení zahájení dialyzační léčby bylo téměř 1 rok, což mělo zásadní vliv na kvalitu života pacienta a na výdaje na zdravotní péči (8, 9).
Tuky v dietě
U pacientů s poklesem glomerulární filtrace (GFR) pod 0,9 ml/s je pozorována tzv. uremická dyslipidemie – nejčastěji se jedná o hypertriglyceridemii, ale současně může být zvýšena i koncentrace VLDL, IDL i LDL částic (10).
Při zahájení nízkobílkovinné diety se ale paradoxně kvůli pokrytí spotřeby kompenzatorně zvyšuje příjem sacharidů a tuků, a jak je známo, hyperlipidemie zvyšuje riziko kardiovaskulárních komplikací (11).
I zde by léčba měla být korigována v první řadě změnou životního stylu se zvýšením tělesné aktivity a dosažením optimální hmotnosti s BMI 20–25 kg/m2, dále dietním omezením ve smyslu omezení především živočišných tuků s nasycenými mastnými kyselinami o dlouhém řetězci. Denní dávka tuků by neměla překročit 1,0 g/kg/den. I v tomto případě je vhodné doplnění diety o ketoanaloga, neboť dle studií nízkobílkovinná dieta s doplněním o ketoanaloga vedla ke snížení hladiny triacylglycerolů a cholesterolu (3, 10).
Sacharidy
Kontrola glykemie je především u pacientů s diabetem stěžejní, neboť nedostatečně kompenzované onemocnění vede k rozvoji mikrovaskulárních komplikací s následnou progresí mikroalbuminurie (3, 12).
Tekutinová bilance
Pacienti s chronickým postižením ledvin mohu být na jedné straně ohroženi jak retencí tekutin, tak na straně druhé naopak dehydratací. Hypervolemie se může projevit jak akcelerací krevního tlaku, tak i srdečním selháním. Naopak dehydratace vede k dalšímu snížení reziduální glomerulární filtrace a projevuje se vzestupem sérového kreatininu a urey. Důležitá je tedy monitorace bilance natria a při vyrovnaném sodíkovém obratu a stabilní hmotnosti je doporučený denní příjem 5,8–8,2 g kuchyňské soli. V případě retence tekutin je již nutné zahájit terapii diuretikem (3).
Minerály a acidobazická rovnováha
V případě renálního postižení jsou pacienti ohroženi především rozvojem hyperkalemie, která může být zapříčiněna jak chronickou medikací, tak i zvýšeným přísunem potravin s obsahem draslíku (sušené ovoce, peckoviny, banány atd.). Naopak při zvýšených extrarenálních ztrátách nebo v polyurické fázi dochází k rozvoji hypokalemie. Pokud je zahájena nízkobílkovinná dieta, příjem kalia se pohybuje okolo 40 – 60 mmol/den (3).
I při ovlivnění metabolismu draslíku je třeba dbát na úpravu vnitřního prostředí, především se vyvarovat metabolické acidózy, která je dalším možným faktorem způsobující hyperkalemii (3).
V důsledku metabolické acidózy je zvýšená aktivita proteolytických enzymů a následně tedy závažný katabolismus, kdy vlivem nadměrné degradace proteinů dochází k další zátěži zbývajících nefronů. V důsledku toho jsou pacienti s chronickým postižením ledvin ohroženi mimo jiné i renální osteopatií s narušením kalciofosfátového metabolismu. V těchto případech je nutná suplementace kalcia a v těžších případech i vitaminu D. I zde hrají pozitivní roli ketoanaloga esenciálních aminokyselin. Současně se snažíme o snížení příjmu fosfátů v potravě, který je ve zvýšeném množství obsažen především v tavených sýrech, mléčných výrobcích, oříškách atd. V případě nedostatečné kompenzace dietou je nutné zahájení terapie vazači fosfátů (3, 13–15).
Vitaminy
V případech deficitu či zvýšené metabolické potřeby k dietám přidáváme především vitamin C v množství 50–100 mg, dále 50 mg pyridoxinu a 10 mg kyseliny listové. Výjimečně mohou být podávány vitaminy A a E, ale jejich hladiny bývají při chronické renální insuficienci zvýšené. Vitamin D je indikován v těžších případech poruch kalciofosfátového metabolismu, jako prevence rozvoje renální osteopatie (3, 14, 15).
Závěr
Mezi obecné charakteristiky nutriční terapie u pacientů s pokročilým onemocněním ledvin patří restrikce proteinů, snížení fosforu a soli, avšak současně přiměřený příjem energie. Je nutné ale zdůraznit, že na progresi onemocnění má vliv dlouhodobá konzervativní léčba zahájená již v časných stadiích renální insuficience, tedy již u pacientů s hodnotami sérového kreatininu kolem140–150 μmol/l a v neposlední řadě nelze opomenout také spolupráci pacientů.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Anna Maršáková,
I. interní klinika 3. LF UK a FN Královské Vinohrady
Šrobárova 50,
100 34 Praha 10
Cit. zkr: Vnitř Lék 2020; 66(6): e10–e13
Článek přijat redakcí: 22. 11. 2018
Článek přijat po recenzích k publikaci: 15. 11. 2020
Sources
1. Fouque D, Laville M, Boissel JP, et al. Controlled low protein diets in chronic renal insufficiency: meta-analysis. Br Med J 1992; 304 : 216–220.
2. Helal I, Fick-Brosnahan GM, Reed-Gitomer B, et al. Glomerular hyperfiltration: definitions, mechanisms and clinical implications. Nat Rev Nephrol. 2012; 8 : 293–300.
3. Teplan V, Mengerová O. Dieta a nutriční opatření u chorob ledvin a močových cest. Praha: Mladá fronta 2010 : 35–115.
4. Hahn D, Hodson EM, Fouque D. Low protein diets for non-diabetic adults with chronic kidney disease. Cochrane Database Syst Rev 2018; 10: CD001892.
5. Barril G, Nogueira A, Ruperto López M, et al. Influence of dietary protein intake on body composition in chronic kidney disease patients in stages 3-5: A cross-sectional study. Nefrologia 2018; pii: S0211-6995(18)30116-4.
6. Aparicio M, Bellizi V, Chauveau P, et al. Protein restricted diet plus keto/amino acids – a valid therapeutic approach for chronic kidney disease. J Ren Nutr 2012; 22(Suppl. 2): S1–S24.
7. Aparicio M, Bellizi V, Chauveau P, et al. Do ketoanalogues still have a role in delaying dialysis initiation in CKD predialysis patients? Sem Dial 2013; 26 : 714–719.
8. Garneata L, Mircescu G. Effect of low-protein diet supplemented with keto acids on progression of chronic kidney disease. J Ren Nutr 2013; 23 : 210–213.
9. Garneata L, Stancu A, et al. Ketoanalogue-supplemented vegetarian very low-protein diet and CKD progression. J Am Soc Nephrol 2016; 27 : 2164–2176.
10. Vachek J, Zakiyanov O, Tesař V. Sekundární dyslipidemie při onemocnění ledvin. AtheroRev 2016; 1 : 80–88.
11. Reiss AB, Miyawaki N, Moon J, et al. CKD, arterial calcification, atherosclerosis and bone health: Inter-relationships and controversies. Atherosclerosis 2018; 278 : 49–59.
12. Notaras S, Conti J. A qualitative analysis of eating behaviour change for patients with diabetes and non-dialysis dependent chronic kidney disease stages 4–5. J Ren Care 2018; 44 : 219–228.
13. Vachek J, Tesař V. Hyperfosfatémie. Remedia 2017; 27 : 278–280.
14. Dusilová Sulková S. Renální osteopatie a možnosti léčby. Remedia 2009; 19 : 183–189.
15. Sotorník I, Bubeníček P. Léčba renální osteopatie. In: Teplan V et al. Praktická nefrologie. Praha: Grada Publishing 2006 : 103–105.
16. Teplan V. Pharmacological features of a keto amino acids. Am J Nephrol 2005; 25(Suppl. 1): 13–14.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2020 Issue 6
-
All articles in this issue
- Anafylaxe – akutní a dlouhodobý management
- Potravinová alergie a intolerance
- Poruchy v komplementovém systému
- Imunosenescence – západ slunce nad imunitním systémem
- Chřipka a její komplikace
- Familiární plicní fibróza – doporučení pro diagnostiku a léčbu
- Nové dělení krystalopatií z pohledu nefrologa
- Infarkt myokardu nebo syndrom zlomeného srdce?
- Dieulafoy lézia jejuna ako zdroj život ohrozujúceho krvácania
- Co nového internistům přinášejí doporučené postupy pro diagnostiku a léčbu plicní embolie z roku 2019?
- Perkutánní okluze ouška levé síně
- Současné postavení dietních opatření u pacientů s pokročilým stupněm chronického onemocnění ledvin
- Dysfunkčný dialyzačný cievny prístup a jeho endovaskulárna liečba
- Histiocytózy a neoplazie odvozené od makrofágů a dendritických buněk. Srovnání WHO klasifikace z roku 2017 a klasifikace Histiocyte society z roku 2016
- Glykovaný hemoglobín ako marker zvýšenia LDL a TAG – kohortná štúdia
- Deriváty sulfonylurey a riziko hypoglykemie u diabetiků 2. typu
- Endoskopická diagnostika a terapie pankreatobiliárních onemocnění u osob po resekci žaludku podle Billrotha I
- Nozokomiální methemoglobinemie
- Alergie a imunopatologie – hlavní téma
- Postihnutie tráviaceho traktu pri zmiešanej chorobe spojivového tkaniva (Sharpovom syndróme)
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Infarkt myokardu nebo syndrom zlomeného srdce?
- Postihnutie tráviaceho traktu pri zmiešanej chorobe spojivového tkaniva (Sharpovom syndróme)
- Potravinová alergie a intolerance
- Poruchy v komplementovém systému
