Nozokomiální methemoglobinemie
Hospital-acquired methemoglobinemia
Methemoglobinemia is rare condition of hem iron. Ferrous form iron (Fe2+) is oxidised to Ferric form (Fe3+). Methemoglobin has reduced ability to release oxygen to tissues and thereby leads to tissue hypoxia. We present case of patient with methemoglobinemia of unknown etiology. Methemoglobinemia developed during hospitalization. Diferent causes of methemoglobinemia and also a treatment possibilities are discussed.
Keywords:
ascorbic acid, local anesthetic – methemoglobinemia – Methylene blue
Authors:
Jan Táborský 1; Martin Střelka 1; Marcela Káňová 2; Zdeněk Kořístek 3; Šárka Blahutová 3; Roman Černohorský 1; Tomáš Mičkal 1
Authors‘ workplace:
Interní oddělení Nemocnice Nový Jičín, a. s.
1; Klinika anesteziologie, resuscitace a intenzivní medicíny LF OU a FN Ostrava
2; Klinika hematoonkologie LF OU a FN Ostrava
3
Published in:
Vnitř Lék 2020; 66(6): 46-52
Category:
Case Report
Overview
Methemoglobinemie je vzácná porucha hemového železa, při které jsou atomy dvojmocného železa oxidovány na železo trojmocné. Trojmocné železo váže kyslík s daleko vyšší afinitou (posun disociační křivky doleva) a hemoglobin ztrácí svoji schopnost transportovat kyslík do tkání. V článku je prezentována kazuistika pacientky s methemoglobinemií nejasné příčiny, která se rozvinula za hospitalizace na JIP. Dále jsou v textu prezentovány možné příčiny methemoglobinemie a terapeutické možnosti tohoto život ohrožujícího stavu.
Klíčová slova:
kyselina askorbová – lokální anestetika – methemoglobinemie – metylenová modř
Úvod
Methemoglobinemie je vrozená či získaná porucha, při které je kation železa zvýšeně oxidován z železnatého (Fe2+) na železitý (Fe3+). Tím se hemoglobin mění na methemoglobin, který má výrazně vyšší afinitu ke kyslíku. Dochází k posunu disociační křivky kyslíku doleva s následnou tkáňovou hypoxií. Strukturní změna také snižuje schopnost vázat kyslík, což snižuje jeho vazebnou kapacitu. Většina autorů uvádí jako patologickou koncentraci vyšší než 1 % methemoglobinu v žilní krvi. V literatuře lze však dohledat i cut off 2 % (1).
Kazuistika
Na urologické oddělení okresní nemocnice byla přijata 60letá žena s uroinfektem. Pacientka byla do té doby sledována pouze v nefrologické ambulanci pro membranózní glomerulonefritidu s nefrotickým syndromem (diagnóza stanovena biopsií ledviny v únoru roku 2017). V minulosti byla na terapii kortikosteroidy a cyklosporinem s dobrým efektem, ale sama si léčbu opakovaně ukončila. Nyní medikovala pouze rosuvastatin, kyselinu acetylsalicylovou a fixní kombinaci perindopril/ indapapmid/amlodipin. Kouřila do 3 cigaret denně, alergická anamnéza byla negativní, stejně tak i v rodinné anamnéze jsme nenašli žádné pozoruhodnosti. Při příjmu byla pacientka hypotenzní (TK 85/60 mm Hg, puls 92/min) a febrilní – teplota v axile byla 38,2 °C. Kromě bilaterálně pozitivního tapottement byl fyzikální nález chudý. Laboratorní nález kromě známek zánětu a počínajícího renálního postižení nevykazoval výrazné patologie: CRP (C-reaktivní protein) 407 mg/l, leukocyty 13,5 × 109/l, urea 26 mmol/l, kreatinin 106 μmol/l (na poslední ambulantní kontrole urea 8,29 mmol/l, kreatinin 51 μmol/l). Hemoglobin 99 g/l odpovídal jejím chronickým hodnotám. V močovém sedimentu mimo vysoce pozitivní leukocyty i erytrocyty byly přítomny i bakterie (gramnegativní tyčky). Nitrity byly negativní. Ultrazvukem byla vyloučena obstrukce urotraktu a byla zahájena terapie cefotaximem 1 g à 8 hod a balancovanými krystaloidy. Navzdory uvedené léčbě se stav pacientky zhoršil, došlo k progresi hypotenze a anurii. Proto byla pacientka následující den přeložena na interní JIP k další péči.
Při příjmu na JIP pacientka tlakově hraniční (TK 105/60 mm Hg, puls 78/min), subfebrilní (37,1 °C) a kromě nově zjištěného šelestu nad aortální chlopní je i fyzikální nález shodný s příjmem z urologie. Laboratorně je lehký pokles CRP (328 mg/l), prokalcitonin je vysoký (25,8 μg/l), laktát jen lehce elevovaný (3,2 mmol/l). Pacientka byla nadále hydratována a pro prohloubení hypotenze bez reakce na volumovou výzvu byly nasazeny vazopresory. Navzdory obnovení perfuzního tlaku nedošlo k restartování diurézy, proto byla 4. den zahájena kontinuální dialýza (continual renal replacement therapy – CRRT) v režimu CVVHD (kontinuální veno-venózní hemodialýza) s regionální citrátkalciovou koagulací. Při této terapii se stav pacientky stabilizoval, vazopresory jsme vysadili a 7. den byla ukončena CRRT s obnovením diurézy. Desátý den hospitalizace došlo ke skokovému zhoršení stavu. Pacientka byla apatická, lehce cyanotická, v laboratorních nálezech dominovala nově hemolytická anémie (Hb 67 g/l, bilirubin 92 μmol/l, z toho konjugovaný 61 μmol/l, LD (laktátdehydrogenáza) 36 μkat/l, trombocyty 100 × 109/l – pokles z 220 × 109/l, INR (mezinárodní normalizovaný poměr, international normalized ratio) 1,3, aPTT ratio (aktivovaný parciální tromboplastinový čas, activated parcial tromboplastine time) 1,2, antitrombin 124 %). Ostatní laboratorní markery hemolýzy, např. haptoglobin, hemopexin či volný hemoglobin, nebylo možno „ve službě“ vyšetřit. Jako příčina deteriorace bylo zvažováno onemocnění ze skupiny mikroangiopatických hemolytických anémií (MAHA), postupně jsme však vyloučili diseminovanou intravaskulární koagulaci, trombotickou trombocytopenickou purpuru, hemolyticko-uremický syndrom i heparinem indukovanou trombocytopenii. V odpoledních hodinách progredovala cyanóza až hnědé zbarvení kůže navzdory oběhové stabilitě a jinak normálnímu nálezu při fyzikálním vyšetření. Proto jsme pojali podezření na methemoglobinemii, která byla následně potvrzena laboratorně (MetHb 30 %). V prvé fázi bylo podáno 5 g kyseliny askorbové (bez efektu na hladinu MetHb) a následně opakovaně transfuze. Pro postupné zhoršování stavu vědomí byla pacientka zaintubována a napojena na umělou plicní ventilaci (režim BiPAP, PEEP 4 cm H2O, FiO2 0,40, dechový objem kolem 400 ml). S další deteriorací stavu byla později FiO2 zvyšována až na 1,0 ve snaze o využití hypersaturované plazmy jako nosiče kyslíku. Jako antidotum jsme podali metylenovou modř (methylthioninii chloridum, Proveblue) v dávce 100 mg, kterou jsme s odstupem 2 h zopakovali. Ani přes opakované podání antidota však nedocházelo k poklesu MetHb, proto jsme od dalšího podávání metylenové modři ustoupili. Kromě čistě logistických potíží (omezené zásoby antidota a nutnost jeho dovozu z centrálního skladu antidot) nás k změně terapeutického postupu vedla i progredující hemolýza, která mohla být jak příčinou selhání metylenové modři, tak i jejím nežádoucím účinkem.
Po vyčerpání konvenčních terapeutických postupů (podání metylenové modři a kyseliny askorbové) jsme opakovali podání transfuzí a pro riziko hypervolemie a hypervizkózního syndromu jej doplnili venepunkcemi (výsledné zbarvení kůže a sklér Obr. 1 a 2).
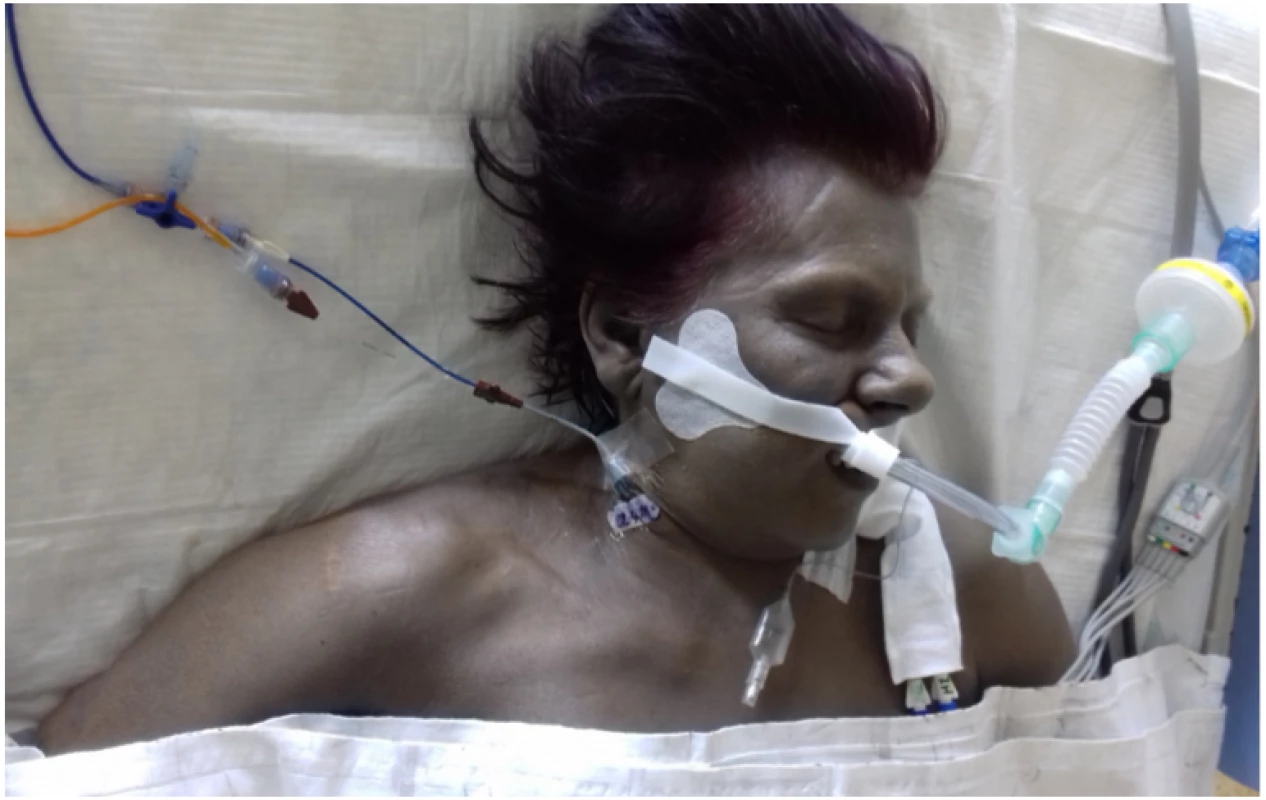

Jedenáctý den hospitalizace byla pacientka přeložena na KARIM spádové fakultní nemocnice. Při příjmu je stav pacientky kritický. Pacientka má hnědočerně zbarvenou kůži, je mírně prosáklá, s krvácivými projevy z dutiny ústní, nosní, krvácí ze vstupů. Bulby jsou ve středním postavení, bělmo je také zabarveno dohněda, zornice se jeví izokorické, miotické. Oběhově je nestabilní, noradrenalin v dávce 2 mg/ hod (vstupní laboratoř: pH 7,01, laktát 9,1 mmol/l, kalemie 6 mmol/l, MetHb 35 %, trombocyty 39 × 109/l, současně i vysoké parametry zánětu leukocytóza 56 × 109/l, PCT 5,86 μg/l, IL6 160 ng/l). Antibiotickou terapii eskalujeme na linezolid, meropenem. Ihned zahajujeme ve spolupráci s Klinikou hematoonkologie a Krevním centrem terapeutickou výměnnou erytrocytaferézu, při které bylo podáno 14 ERD, což odpovídalo 1,5násobku celkového objemu erytrocytů v krevním oběhu. Hladiny methemoglobinu však dostatečně neklesají ze vstupních 35 % na 10 %. Opakovaně je nutná korekce vnitřního prostředí. Vzhledem k hemolytickému stavu po ukončení erytrocytaferézy jsme navázali s plazmaferézou (8 × FFP, došlo tedy k výměně celého objemu plazmy) a dále pro anurii v šokovém stavu kontinuální dialýzou. Přes provedenou erytrocytaferézu kritický stav pacientky progreduje a následně zmírá během dalších 24 h pod obrazem refrakterního šoku.
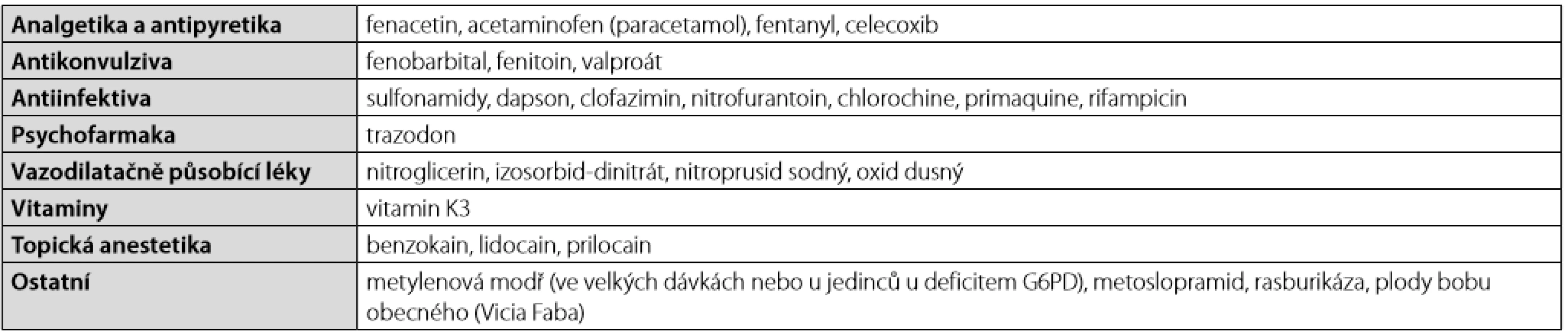
Přes veškerou snahu o identifikaci příčiny methemoglobinmie jsme v tomto směru nebyli úspěšní. Z níže uváděných léků, které mohou methemoglobinemii způsobit (Tab. 1), dostala pacientka 30 ml 1% roztoku trimecainu (Mesocain) s. c. při zavádění cévních vstupů. Proti lokálním anestetikům (LA) jako spouštěčům methemoglobinemie u naší pacientky svědčí delší časový odstup od aplikace léků. K příznakům methemoglobinemie by mělo dojít během několika desítek minut, nikoliv v odstupu 5 dní od podání. Další příčinou by mohla být kontaminace dialyzačního roztoku. Avšak na téže šarži roztoků byla paralelně dialyzovaná druhá pacientka v kritickém stavu, u které se methemoglobinemie nerozvinula (methemoglobin byl opakovaně vyšetřen na bed-side analyzátoru v rámci odběrů při CRRT s regionální citrátkalciovou antikoagulací, je součástí panelu na ABR z tepny). Teoreticky mohla vést k rozvoji methemoglobinemie i nastupující sepse s nadprodukcí oxidu dusnatého jako výrazného oxidačního činidla pro hemoglobin.
Stejně jako spouštěč, zůstává nejasná i velmi špatná terapeutická odezva. Selhání terapií kyselinou askorbovou lze vysvětlit její nízkou dávkou. Jako možná příčina selhání terapie metylenovou modří připadá v úvahu nepoznaný enzymatický deficit pentozafosfátové dráhy (ovšem u deficitu glukóza 6-fosfát dehydrogenázy (G6PD), který je vázaný na X chromozom, je existence homozygotky v české populaci extrémně nepravděpodobná, nicméně jej vyloučit zcela nelze. Deficit G6PD nebyl za časových důvodů vyšetřen). Účinek metylenové modři je závislý na intaktních erytrocytech, u hemolýzy selhává (1). Důsledkem těžké methemoglobinemie může být právě probíhající intravaskulární hemolýza, tzv. methemoglobinem-indukovaná hemolýza. V uveřejněných kazuistikách je nejčastěji vyvolána aromatickými aminosloučeninami (nitrobenzen, anilin), čínská review uvádí 1 146 případů, kdy intravaskulární hemolýza vedla k renálnímu i jaternímu selhání, ale v 98 % byla kurabilní (2). Avšak příčina perzistující methemoglobinemie po provedené erytrocytaferéze je málo častá. Podobnou kazuistiku získané methemoglobinemie s hladinou metHb 82,3 %, nicméně u mladého muže, kde byla stejně jako v našem případě léčba metylenovou modří, kyselinou askorbovou, hyperbaroxií a erytrocytaferézou neúspěšná, vyprovokovala expozice aminofenolu. Podobnost je i v rozvoji intravaskulární hemolýzy. V důsledku chronickému vystavování se sloučenině podobné anilinu došlo k rozvoji trombotické mikroangiopatie (mikroangiopatická hemolýza, elevace LDH, trombocytopenie, oligurie). V případě popisovaném danou kazuistikou však pacient přežil. Ke zlepšování stavu došlo až po nasazení výměnné plazmaferézy (methemoglobin pozvolna klesal, bylo nutno opakování plazmaferézy v 6 následujících dnech). Plazmaferéza přerušila „začarovaný kruh“ mezi methemoglobinem-indukovanou hemolýzou, endoteliální dysfunkcí a další hemolýzou. Volný hemoglobin vyvazuje oxid dusný z endotelu, následuje vazoparalýza, zvýšená agregace trombocytů (3).
Methemoglobinemie
Hemoglobin je metaloprotein vyskytující se v červených krvinkách v průměrném množství 28–32 pg na jeden erytrocyt. Jeho hlavním úkolem je transport kyslíku z plic do tkání. Pro plnění transportní funkce je nezbytné, aby železo v hemu bylo dvojmocné (Fe2+). Pouze dvojmocné železo může vázat a následně uvolňovat kyslík dle aktuálního pO2. V důsledku neustálého působení oxidačních činidel dochází v těle k permanentní přeměně Fe2+ na Fe3+ (a tím k vzniku methemoglobinu). Hladina methemoglobinu je však v důsledku redukční kapacity organismu neustále udržována velmi nízká (do 1–3 %). Pokud hladina methemoglobinu překročí 1 %, je stav označován jako methemoglobinemie.
U člověka je hemové železo chráněno před oxidací NADHmethemoglobinreduktázou (někdy označovanou jako cytochrom b5 reduktáza) a NADPH-methemoglobinreduktázou. Pro jejich správnou činnost jsou nezbytné kofaktory NAHD a NADPH, na jejichž produkci se podílí enzymy pyruvátkináza a G6PD (Obr. 4). I jejich deficit se tedy může projevit methemoglobinemií. Methemoglobinemie vzniká, pokud jsou enzymy deficitní či defektní (vrozená methemoglobinemie) nebo pokud je jejich redukční kapacita překročena v důsledku působení toxinu (získaná methemoglobinemie).
Hereditární methemoglobinemie
Hereditární methemoglobinemie (recesive congenital methemoglobinemia – RCM) je vzácné autozomálně recesivně dědičné onemocnění způsobené deficitním enzymem NADH cytochrome b5 reduktázou. Jeho prevalence v běžné populaci je velmi nízká, nicméně přesná data nejsou dostupná. Jsou známé uzavřené populace, kde v důsledku příbuzenského křížení je prevalence vyšší. Příkladem mohou být Yakutové ze Sibiře, Athabaskové a indiáni z kmene Navajo.
RCM se vyskytuje v minimálně 4 typech, které se odlišují klinickými projevy a genetickým pokladem. Typ I je podmíněn mutací v genu CYB5R3, a kromě typického zbarvení kůže, které je patrné již od narození, nemá závažnější klinické projevy. U některých pacientů se mohou objevovat bolesti hlavy, únava a námahová dušnost. Typ II je asociován s mutací v Cb5R genu, projevuje se typickým kožním koloritem a závažnými neurologickými poruchami (mikrocefalie, mentální retardace, růstová retardace, strabismus). Typ III má stejný genetický defekt jako typ II, ale chybí neurologické projevy. Typ IV je velmi vzácný, projevuje se pouze kožními projevy.
Další příčinou vrozené methemoglobinemie je výskyt abnormálního hemoglobinu, nejčastěji jde o hemoglobin M, v jehož molekule byl tyrosin zaměněn za histidin, což snižuje redukci železitého na železnatý iont. V těchto případech je dědičnost autozomálně dominantní. Cyanóza je přítomná brzy po porodu.

Získaná methemoglobinemie
Získaná methemoglobinemie vzniká v důsledku přetížení redukční kapacity výše uváděných enzymů. Příčinou mohou být některé léky (Tab. 1) či toxiny. Z toxinů se jedná nejčastěji o dusitany (či dusičnany – ty jsou ve střevě redukovány působením bakterií na dusitany) pocházející z hnojiv, chemických postřiků a odpadních vod, či anilinová barviva. K methemoglobinemii jsou nejnáchylnější děti do 6 měsíců v důsledku snížené jaterní syntézy methemoglobin-reduktázy (5). K prevenci nadměrné expozici dusitany a dusičnany jsou v ČR nastaveny přísné limity pro pitnou vodu (dusitany 0,5 mg/l a dusičnany 50 mg/l).
Lokální anestetika jako příčina methemoglobinemie
V literatuře jsou opakovaně popsány kazuistiky a série případů závažných methemoglobinemií po aplikaci lokálních/topických anestetik (LA). Velké soubory ukazují incidenci methemoglobinemie 0,035–0,15 % pacientů podstupujících zákrok s lokální anestezií (6, 7). Z dostupné literatury jednoznačně plyne, že riziko methemoglobinemie se mezi jednotlivými preparáty liší. Nejvyšší riziko je spojeno s esterovým LA benzokainem. Námi použité LA Mesocain (trimecain) patří do modernější skupiny amidových lokálních anestetik, která mají výskyt NÚ nižší. Nicméně i amidové LA prilokain a v menší míře i subkutánně podávaný trimecainu chemicky velmi podobný lidokainu jsou s methemoglobinemií spojovány (8, 9). Data pro trimecain nejsou ve světové literatuře k dispozici.
Rizikovými faktory rozvoje methemoglobinemie jsou hospitalizace v době výkonu a systémová infekce, které obě zvyšují riziko methemoglobinemie až 10krát (6, 8), anémie zvyšují riziko 1,9krát (6). Sepse výrazně zvyšuje uvolňování oxidu dusného. NO vede k produkci methemoglobinu (10). Vliv kardiálních a plicních komorbidit je ještě menší (6). Dopad renální insuficience se v jednotlivých studiích liší (6, 7). U naší pacientky byly splněny obě nejrizikovější podmínky.
Hemodialýza a methemoglobinemie
Ve světové literatuře je uváděno několik případů, kdy se u pacientů na hemodialýze (HD) vyvinula methemoglobinemie. U ambulantních pacientů na domácí dialýze byla příčinou kontaminace vody v domácím zdroji, nejčastěji ve studni (11). U hospitalizovaných pacientů na kontinuální náhradě funkce ledvin byla jako příčina identifikována neadekvátní clearance chloraminu z vodovodního řadu (12, 13). Řešením byla v obou případech výměna filtru. U nás na JIP filtr měněn nebyl a ani u nikoho s předchozích či následujících pacientů se klinické známky methemoglobinemie nerozvinuly.
Projevy methemoglobinemie
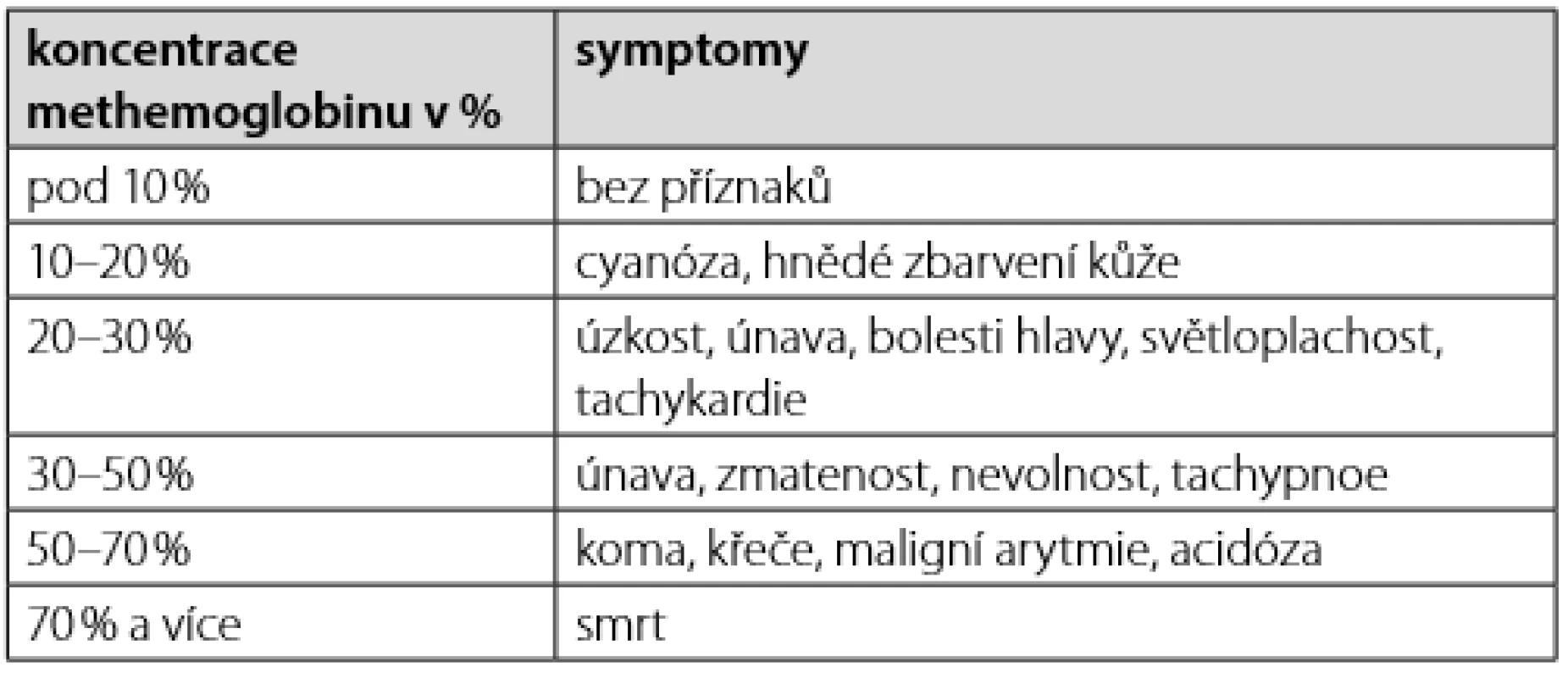
Klinické projevy methemoglobinemie jsou závislé na hladině methemoglobinu. Prvním projevem je modré či modrohnědé zbarvení kůže. Methemoglobin, na rozdíl od jasně červeného hemu, je totiž tmavý, což dává krvi, v závislosti na koncentraci, namodralou až čokoládově hnědou barvu. U lehčích, především vrozených, poruch se jedná o jedinou klinickou známky. Pokud je porucha vrozená, může být toto zbarvení kůže trvalé. Z oblastí s vysokou prevalencí RCM jsou známy celé „modré rodiny“.
S narůstající koncentrací methemoglobinu se začínají projevovat i symptomy z tkáňové hypoxie (Tab. 2).
Terapie
Základem léčby methemoglobinemie je ukončení účinku vyvolávajícího agens, nejčastěji se totiž setkáme se získanou methemoglobinemií. Léčbou první volby je podání metylenové modři (methylthioninium chloride) a donorů elektronů (kyselina askorbová, riboflavin), které mohou pomoci cestou NADPH methemoglobinreduktázy zbavit se organizmu nadbytku methemoglobinu. Terapie má být zahájena u symptomatických pacientů s hladinou > 20 % MetHb, u asymptomatických > 30 % MetHb (14).
Kyselina askorbová
Kyselina askorbová je silné redukční činidlo a účastní se celé řady enzymových reakcí. Nabízí se proto jako ideální terapeutická možnost methemoglobinemie. Není překvapivé, že se v této indikaci používá již od poloviny minulého století (15). Dávkování u methemoglobinemie není ustálené a jednotlivé studie nabízí různá dávkovací schémata (300 mg/ kg i. v. bolus, 300 mg i. v. během 24 hod, a 10 g i. v. IV během 6 hod) (16).
Stejně jako dávkování, není zcela jasná ani pozice kyseliny askorbové v terapeutickém algoritmu. Lékem první volby je u RCM I. typu, kdy veškerý požadovaný efekt je „kosmetické“ odstranění cyanózy. V literatuře existuje vesměs shoda, že může být lékem volby pro získanou methemoglobinemii v regionech či subpopulacích, kde je vysoká prevalence deficitu G6PD, pro riziko hemolytické anemie po podání metylenové modři těmto pacientům (viz dále) či u pacientů s renální insuficiencí a těhotných (17). Ve kterých situacích by již kyselina askorbová neměla být použita jako lék volby, není přesně známo. Dle některých autorů by to mělo být určeno klinickým stavem pacienta (18), jiné zdroje udávají cut off limity 20 % methemoglobinu + přítomnost symptomů (19) či 30 % methemoglobinu bez ohledu na symptomy (20).
Metylenová modř
Metylenová modř je obecně akceptována jako terapie volby pro většinu pacientů. Pomocí NADPH-methemoglobin reduktázy je redukována na leukomethylenovou modř. Ta dále vystupuje jako donor elektronů, což vede k redukci methemoglobinu na hemoglobin.
K přeměně methylenové modři na leukomethylenovou modř je třeba koenzym NADPH vznikající při metabolismu glukózy pentózofosfátovou drahou (ve které je G6PD prvním a rychlost limitujícím enzymem). To je důvodem, proč metylenová modř u pacientů s deficitem G6PD nejen nefunguje, ale může sama vést k hemolýze či methemoglobinemii (de novo vznikající či prohloubení preexistující methemoglobinemie). Methemoglobinemie indukovaná metylenovou modří dle dostupných literárních údajů reaguje na podání kyseliny askorbové (21).
Doporučené dávkování je 1–2 mg/kg tělesné hmotnosti podávané krátkou 5minutovou infuzí. Dávku je možné po hodině opakovat při případě rekurentních či perzistujících symptomů, nebo pokud methemoglobin zůstává výrazně zvýšený (22).
Hyperbarická terapie
Je dle mnoha autorů řazena mezi alternativní metody terapie methemoglobinemie, nicméně přesvědčivá data o její účinnosti stále chybí (23, 24). HBO redukuje koncentraci methemoglobinu, dle některých údajů, o 8 % za h (25).
Výměnná erytrocytaferéza
Výměnná erytrocytaferéza je rescue postupem v případech, kdy je terapie MM kontraindikována, není dostupná či selhala. V literatuře jsou na toto téma dostupná pouze kazuistická sdělení vesměs s příznivým výsledkem. Po nahrazení pacientových erytrocytů dárcovskými klesá MetHb na hodnoty blízké 0, a pokud nedojde k opakovanému působení oxidačního činidla, je stav vyřešen (26–28).
Plazmaferéza
Ačkoli v současné době chybí indikace plazmaferézy v terapii methemoglobinemie, může být rescue postupem v odstranění oxidačního činidla, odstranění volného hemoglobinu a tím umožní přerušení intravaskulární hemolýzy
Závěr
Cílem článku je upozornit na vzácný, avšak potenciálně fatální nežádoucí účinek běžně užívaných léků. Pokud je methemoglobinemie zavčas rozeznána a je dostatečně energeticky postupováno, je většinou rychle a efektivně léčitelná metylenovou modří. Ve vzácných případech však pacienti na iniciální léčbu nereagují a je třeba použít některé z rescue postupů. S jejich aplikací je však v českých podmínkách minimum zkušeností.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Jan Táborský,
JIP Interního oddělení nemocnice
Nový Jičín
Purkyňova 2 138/16,
741 01 Nový Jičín
Cit. zkr: Vnitř Lék 2020; 66(6): e46–e52
Článek přijat redakcí: 5. 11. 2019
Článek přijat po recenzích k publikaci: 12. 2. 2020
Sources
1. Bradberry SM. Occupational methaemoglobinaemia mechanisms of production, features, diagnosis and management including the use of methylene blue. Toxicol Rev 2003; 22 : 13–17.
2. Song P, Li X, Yan Y. Analysis of the literature on acute aromatic amino or nitro-compounds poisoning. Zhonghua Lao Dong Wei Sheng Zhi Ye Bing Za Zhi 2014; 32 : 366–369.
3. Shatila W, Verma A, Adam S. Plasmapheresis in severe methemoglobinemia following occupational exposure. Transfusion and Apheresis Science 2017; 56 : 341–344.
4. Souza do Nascimento T, Otávio Lami Pereira R, Luiz Dias de MelloH, et al. Methemoglobinemia: from diagnosis to treatment. Rev Bras Anestesiol 2008; 58: http://dx.doi. org/10.1590/S0034-70942008000600011
5. Richard Alyce M, Diaz James H, Kaye AD. Reexamining the Risks of Drinking-Water Nitrates on Public Health. The Ochsner Journal 2015; 14 : 392–398.
6. Gian M, Novaro MD, Herbert D, et al. Benzocaine-induced methemoglobinemia: Experience from a high-volume transesophageal echocardiography laboratory. J Am Soc Echocardiogr 2003; 16 : 170–175.
7. Kane GC, Hoehn SM, Behrenbeck TR, et al. Benzocaine-Induced Methemoglobinemia Based on the Mayo Clinic Experience From 28 478 Transesophageal Echocardiograms: Incidence, Outcomes, and Predisposing Factors. Arch Intern Med 2007; 167 : 1977–1982.
8. Mutlu M, Erduran E, Aslan Y. Acquired methemoglobinemia in infants. Turk J Haematol 2011; 28 : 131–134.
9. Barash M, Reich KA, Rademaker D. Lidocaine-induced methemoglobinemia: a clinical reminder. J Am Osteopath Assoc 2015; 115 : 94–98.
10. Ohashi K, Yukioka H, Hayashi M, et al. Elevated methemoglobin in patients with sepsis. Acta Anaesthesiol Scand 1998; 42 : 713–716.
11. Carlson DJ, Shapiro FL. Methemoglobinemia from Well Water Nitrates: A Complication of Home Dialysis. Ann Intern Med 1970; 73 : 757–759.
12. de Torres JP, Strom JA, Jaber BL, et al. Hemodialysis-associated methemoglobinemia in acute renal failure. Am J Kidney Dis 2002; 39 : 1307–1309.
13. Medarov BI, Pahwa S, Reed S, et al. Methemoglobinemia Caused by Portable Dialysis in the Critically. Crit Care Med 2017; 45: e232–e235.
14. Skold A, Cosco DL, Klein R. Methemoglobinemia: pathogenesis, diagnosis, and management. South Med J 2011; 104 : 757–761.
15. Sievers RF, Ryon JB. Congenital idiopathic methemoglobinemia: favourable response to ascorbic acis therapy. Arch Intern Med (Chic) 1945; 76 : 299–307. doi:10.1001/archinte.1945.00210350045007
16. Cortazzo JA, Lichtman AD. Methemoglobinemia: a review and recommendations for management. J Cardiothorac Vas Anesth 2014; 28 : 1043–1047.
17. Faust AC, Guy E, Baby N. Local Anesthetic-Induced Methemoglobinemia During Pregnancy: A Case Report and Evaluation of Treatment Options. J Emerg Med 2018; 54 : 681–684.
18. Wright RO, Lewander WJ, Woolf AD. Methemoglobinemia: etiology, pharmacology, and clinical management. Ann Emerg Med 1999; 34 : 646–656.
19. Toker I, Yesilaras M, Tur FC, et al. Methemoglobinemia caused by dapsone overdose: Which treatment is best? Turk J Emerg Med 2016; 15 : 182–184.
20. Waller HD, Benöhr HC, Tigges FJ. On the mechanism of ascorbic acid induced methemoglobin reduction of human erythrocytes. Klin Wochenschr 1977; 55 : 955–964.
21. Balwani MR, Bawankule CP, Ramteke V, et al. Methylene Blue Induced Methemoglobinemia with Acute Kidney Injury in a Glucose-6-Phosphate Dehydrogenase-deficient Patient. Indian J Nephrol 2017; 27 : 465–467.
22. Methylthioninium chloride Proveblue 5 mg/ml solution for injection, SPC, dostupné z https://www.ema.europa.eu
23. Prchal JT. Clinical Features, Diagnosis, and Treatment of Methemoglobinemia. UpToDate Web site http://www.uptodate.com/contents/clinical-features-diagnosis-and-treatment-of-methemoglobinemia; Accessed 12.02.14
24. Hoffman RS, Nelson LS, Howland MA (eds.). Goldfrank’s Manual of Toxicologic Emergencies. The McGraw-Hill Companies, Inc; 2007 : 977–985.
25. Hunter L, Gordge Ldargan PI, Wood DM. Methaemoglobinaemia associated with the use of cocaine and volatile nitrites as recreational drugs: A review. Br J Clin Pharmacol 2011; 72 : 18–26.
26. Patnaik S, Natarajan MM, James EJ, et al. Methylene blue unresponsive methemoglobinemia. Indian J Crit Care Med 2014; 18 : 253–255.
27. Lockhart V, Ong M. 367 Red Blood Cell Exchange for Treatment of Acquired Methemoglobinemia in a Hospitalized Patient: A Case Report. American Journal of Clinical Pathology 2018; 149: S159–S160.
28. Khetarpal A, Kotwal U. Role of Automated Therapeutic Red Cell Exchange in the Setting of Acute Methemoglobinemia: Our Experience. Indian J Hematol Blood Transfus 2018; 34 : 143–145.
29. Alanazi M. Drugs may be Induced Methemoglobinemia. Journal of Hematology & Thromboembolic Diseases 2017; 10.4172/2329-8790.1000270.
30. Mark Barash DO, Keith AR, Rademaker D. Lidocaine-Induced Methemoglobinemia: A Clinical Reminder. The Journal of the American Osteopathic Association 2015; 115 : 94–98.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2020 Issue 6
-
All articles in this issue
- Anafylaxe – akutní a dlouhodobý management
- Potravinová alergie a intolerance
- Poruchy v komplementovém systému
- Imunosenescence – západ slunce nad imunitním systémem
- Chřipka a její komplikace
- Familiární plicní fibróza – doporučení pro diagnostiku a léčbu
- Nové dělení krystalopatií z pohledu nefrologa
- Infarkt myokardu nebo syndrom zlomeného srdce?
- Dieulafoy lézia jejuna ako zdroj život ohrozujúceho krvácania
- Co nového internistům přinášejí doporučené postupy pro diagnostiku a léčbu plicní embolie z roku 2019?
- Perkutánní okluze ouška levé síně
- Současné postavení dietních opatření u pacientů s pokročilým stupněm chronického onemocnění ledvin
- Dysfunkčný dialyzačný cievny prístup a jeho endovaskulárna liečba
- Histiocytózy a neoplazie odvozené od makrofágů a dendritických buněk. Srovnání WHO klasifikace z roku 2017 a klasifikace Histiocyte society z roku 2016
- Glykovaný hemoglobín ako marker zvýšenia LDL a TAG – kohortná štúdia
- Deriváty sulfonylurey a riziko hypoglykemie u diabetiků 2. typu
- Endoskopická diagnostika a terapie pankreatobiliárních onemocnění u osob po resekci žaludku podle Billrotha I
- Nozokomiální methemoglobinemie
- Alergie a imunopatologie – hlavní téma
- Postihnutie tráviaceho traktu pri zmiešanej chorobe spojivového tkaniva (Sharpovom syndróme)
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Infarkt myokardu nebo syndrom zlomeného srdce?
- Postihnutie tráviaceho traktu pri zmiešanej chorobe spojivového tkaniva (Sharpovom syndróme)
- Potravinová alergie a intolerance
- Poruchy v komplementovém systému


