Heparínom indukovaná trombocytopénia a aktuálne možnosti liečby – prehľad literatúry
Heparin induced thrombocytopenia and up to date options of treatment – review of literature
Heparin-induced thrombocytopenia (HIT) is a profoundly dangerous, potentially lethal, immunologically mediated adverse drug reaction to unfractionated heparin or, less commonly, to low–molecular weight heparin. Some patients with HIT develop serious thrombotic complications like limb ischemia and gangrene, while others may not develop such complications. Current laboratory diagnostic tools incur significant time delays before confirming HIT, therefore upon clinical suspicion, treatment of HIT should start immediately. In this review, the authors highlight heparin-induced thrombocytopenia’s risk factors, clinical presentation, pathophysiology, diagnostic principles, and treatment.
Keywords:
Thrombocytopenia – autoimmunity – treatment – direct oral anticoagulants
Authors:
Juraj Sokol 1; František Nehaj 2; Juraj Chudej 1; Michal Mokáň 2; Marianna Kubašková 3; Martin Jozef Péč 4; Jana Žolková 1; Ubica Vadelová 1; Peter Galajda 2; Ján Staško 1
Authors‘ workplace:
Klinika hematológie a transfuziológie, Národné centrum hemostázy a trombózy, JLF UK a UN Martin, Slovenská republika
1; I. interná klinika JLF UK a UK Martin, Slovenská republika
2; Rádiologická klinika JLF UK a UN Martin, Slovenská republika
3; JLF UK Martin, Slovenská republika
4
Published in:
Vnitř Lék 2020; 66(8): 39-46
Category:
Overview
Heparínom indukovaná trombocytopénia (HIT) je nebezpečná, potenciálne smrteľná, imunologicky sprostredkovaná nežiaduca reakcia na nefrakcionovaný heparín, resp. menej často, na heparín s nízkou molekulovou hmotnosťou. U časti pacientov s HIT pozorujeme rozvoj závažných trombotických komplikácií, ako je ischémia končatín a gangréna, zatiaľ čo u iných sa takéto komplikácie nerozvinú. Súčasné laboratórne diagnostické nástroje majú značné časové oneskorenie; teda pri klinickom podozrení na HIT by sa malo s liečbou začať okamžite. V tomto článku sa autori zameriavajú na rizikové faktory rozvoja HIT, klinickú prezentáciu, patofyziológiu, diagnostické princípy a liečbu.
Klíčová slova:
trombocytopénia – autoimunita – liečba – priame perorálne antikoagulanciá.
Úvod
Heparín je dlhoročným osvedčeným antikoagulačným liekom. Napriek tomu, že znižuje mortalitu a morbiditu pri trombotických stavoch, jeho použitie je spojené aj so značnými problémami. Heparínom indukovaná trombocytopénia (HIT) je jedným z najbežnejších smrteľných nežiaducich účinkov liečby heparínmi (1). HIT je teda závažným protrombotickým stavom, ktorý sa vyskytuje pri nefrakciovaných heparínoch (UFH), ale aj pri terapii heparínmi s nízkou molekulovou hmotnosťou (LMWH). Spojený je s 50% rizikom rozvoja trombózy. Miera úmrtnosti je približne 20 % a približne 10 % pacientov má závažné pridružené následky, ako je napr. amputácia (1–3).
Klasifikácia
Existujú 2 typy HIT. Typ 1 je neimunologického pôvodu. Je spôsobený priamym vplyvom heparínu na trombocyty, ktoré aktivuje. Prvé klinické príznaky je možné pozorovať do 2 dní od prvej expozície heparínom. Počet trombocytov sa normalizuje bez potreby ukončenia liečby heparínom. Typ 2 je imunitného pôvodu. Typicky sa vyskytuje do 4–10 dní od aplikácie heparínu. Pozoruje sa rozvoj protilátok. Zároveň sa významne zvyšuje riziko rozvoja trombotickej udalosti (1, 4, 5).
Incidencia, epidemiológia a rizikové faktory
Štúdie ukázali, že prevalencia HIT sa pohybuje v rozmedzí od 0,1 % do 5 % u pacientov, ktorí dostávajú heparín (6–9). Z týchto pacientov približne 25–50 % prekoná trombózu (10, 11). K parametrom, ktoré sú asociované z rozvojom HIT patrí:
- trvanie liečby heparínom,
- typ a podávaná dávka heparínu,
- indikácia terapie,
- pohlavie.
Trvanie liečby heparínom
Predĺžená expozícia heparínom (> 5 dní) je častým rizikovým faktorom rozvoja trombocytopénia, ako aj neskoršieho rozvoja HIT (12–14).
Typ a podávaná dávka heparínu
Podávanie UFH je spojené z 10-násobne vyšším rizikom rozvoja HIT v porovnaní s LMWH (15–19). Na druhej strane je fondapainux, ktorého podávanie je spojené len zriedkavo s rozvojom HIT (20). Navyše aj pôvod heparínu je asociovaný s rizikom rozvoja HIT. UFH hovädzieho pôvodu je spojený s vyšším rizikom rozvoja HIT v porovnaní s UHF pôvodom z ošípaných (12, 21). Terapeutická antikoagulačná dávka je spájaná s väčším rizikom rozvoja trombocytopénie a HIT. Avšak aj nízka dávka heparínu môže viesť k tvorbe protilátok spájaných s HIT.
Indikácia terapie
Chirurgickí pacienti (obzvlášť ortopedickí a kardiochirurgickí), ako aj pacienti po traume majú vyššie riziko rozvoja HIT (1–5 %) ako pacienti hospitalizovaní na interných oddeleniach (< 1 %) (22, 23).
Pohlavie
Ženy majú asi 2× vyššie riziko rozvoja HIT v porovnaní s mužmi (24, 25).
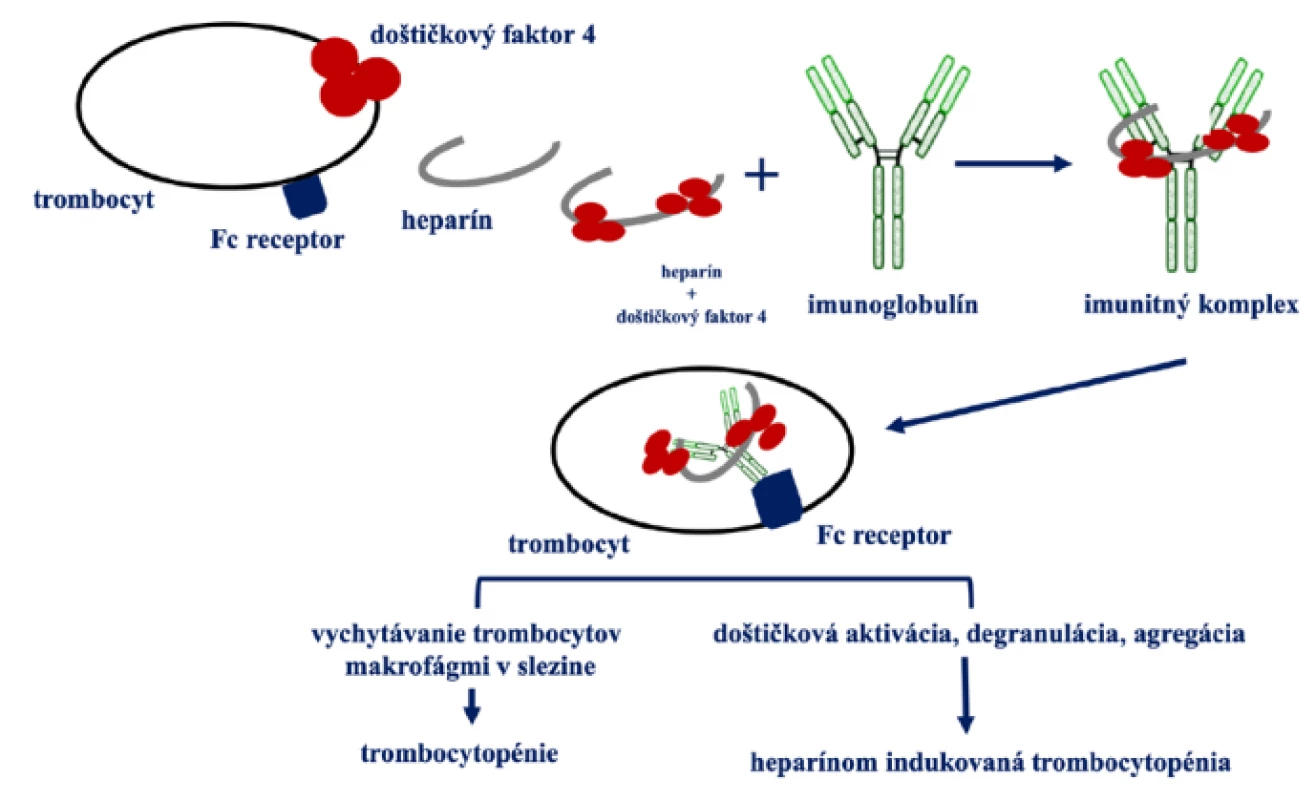
Patofyziológia: antigén, protilátky a mechanizmus trombózy
HIT je spôsobená protilátkami, ktoré rozpoznávajú komplex doštičkového faktora 4 (PF4) a heparínu (26).
Komplex PF4/heparín
PF4 je pozitívne nabitý proteín, ktorý je uskladnený v α‑granulách trombocytov. Tento proteín je uvoľňovaní vo veľkých množstvách v mieste aktivácie trombocytov. Uvoľnení PF4 sa viaže na negatívne nabité glykosaminoglykány (GAGs), ktoré sú súčasťou najbližšej endotelovej bunky. PF4 tak vytesňuje viazaný antitrombín a spôsobuje vznik lokálneho protrombotického prostredia. PF4 má voči heparínu vyššiu afinitu v porovnaní s inými GAGs (heparín > heparan sulfát > dermatán sulfát > chondroitín 6-sulfát > chondroitín 4-sulfát) (26).
Heparín je schopný aktivovať trombocyty priamo prostredníctvom väzby na integrínoch. V tomto prípade integríny slúžia ako receptory pre heparín. Najmä integrín βIII. Táto interakcia zvýši adhézne vlastnosti trombocytov a zároveň dochádza ku uvoľneniu PF4. PF4 sa viaže na cirkulujúci heparín, ale aj na heparan sufát, ktorý sa nachádza na endotelových bunkách. Vzniká teda komplex, ktorý spúšťa tvorbu protilátok prevažne typu IgG (9–11).
Protilátky
Dôležité si je hlavne uvedomiť, že ku tvorbe protilátok voči komplexu PF4/heparín dochádza oveľa častejšie ako ku klinickej manifestácii trombocytopénie alebo trombózy. Incidencia tvorby protilátok je pri podávaní UFH 8–17 % (27) a pri LMWH 2–8 % (28).
Voľné IgG protilátky sa špecificky viažu na doštičkový receptor Fc (FcγIIA). To vedie ku doštičkovej aktivácii.
Mechanizmus trombózy
Hlavným bunkovým cieľom protilátok sú trombocyty, ktoré exprimujú vyššie spomenutý receptor FcγIIA. Väzba protilátok na FcγIIA receptor vyvolá aktiváciu trombocytov prostredníctvom intracelulárnej signalizácie cez tyrozínkinázu Syk a uvoľnenie prokoagulačných mikročastíc. Čím viac väzieb protilátok na FcγIIA receptor existuje, tým je intenzívnejšia aktivácia trombocytov (26).
Protilátky naviazané na endotel sú rovnako schopné interagovať s FcγIIA receptorom na trombocytoch. Dochádza tak ku agregácii trombocytov priamo na endotelových bunkách (26).
Zjednodušený model HIT je na Obr. 1 (6).
Klinická prezentácia
Hlavným klinickým prejavom HIT je trombocytopénia. Po expozícii heparínom počet trombocytov rýchlo klesá, niekedy o 50 a viac percent oproti východiskovej hodnote. Počet trombocytov teda klesne pod 150 × 109 /l; medián počtu trombocytov u pacientov s HIT je 55 × 109 /l (29). Z hľadiska rýchlosti nástupu trombocytopénie rozlišujeme 3 vzory HIT, a to rýchly, typický a oneskorený. Skoro 60 % pacientov má typický nástup; počet trombocytov klesne do 5–10 dní od expozície heparínom. V 30 % je nástup rýchly, teda okamžite po expozícii heparínom (29, 30). Táto rýchla reakcia je výsledkom už predchádzajúcej expozície heparínom (< 100 dní od posledného podania). Prítomné sú teda už pre‑existujúce protilátky (29). Ostatní pacienti vykazujú oneskorený nástup. V priemere sa HIT rozvinie do 9,2 dní. Avšak príznaky HIT sa môžu objaviť aj po 3 týždňoch od prvej expozície heparínom (6, 29).
Osobitnú pozornosť si vyžadujú pacienti, ktorí absolvovali chirurgický zákrok. Títo vykazujú bimodálny profil poklesu trombocytov. Prvý pokles trombocytov sa zvyčajne objaví do 5–6 dní od operácie (6, 29). Druhé zníženie počtu trombocytov je obyčajne spojené s rozvojom HIT (31–36). Dôležité je si však uvedomiť, že ošetrujúci lekár musí vychádzať z pooperačného počtu trombocytov.
Pre HIT je teda typická trombocytopénia. Je preto paradoxné, že toto ochorenie je zároveň spojené s protrombotickou poruchou (6). Môže to viesť k devastujúcim arteriovým a venóznym trombózam, vrátane pľúcnej embólie, mezenteriálnej ischémie, ischémii končatín, akútneho infarktu a náhlej cievnej mozgovej príhody (6, 8, 37). Venózne príhody sú častejšie ako arteriové u pacientov s HIT. Výnimku tvoria pacienti s HIT po cievnych a kardiochirurgických zákrokoch. U týchto pacientov sa arteriové a venózne trombózy vyskytujú s rovnakou frekvenciou (38).
Klinické skórovacie systémy
Nakoľko diagnostika HIT je časovo veľmi náročná boli vypracované skórovacie systémy na predpovedanie pravdepodobnosti prítomnosti HIT. K týmto skórovacím systémom patrí:
- HIT Expert Probability Score (HEP), ktorý bol vypracovaný Cukerom (31),
- post‑CPB skórovací systém vypracovaný Lillo‑Le Louëtom (34),
- 4 T skórovací systém vypracovaný Warkentinom (39, 40).
HEP systém bol vypracovaný na základe odporúčania 26 expertov. Má vysokú senzitivitu (100 %) a špecificitu (60 %). Problémom je, že premenné požadované týmto systémom nemusia byť vždy ľahko dostupné. Druhý skórovací systém bol vypracovaný pre pacientov po kardiopulmonálnom bypasse (CPB), pozri Tab. 1.

Široko používaným skórovacím systémom je, tzv. 4 T klinický systém, pozri Tab. 2. 4 T skórovací systém má vysokú negatívnu prediktívnu schopnosť. Je preto preferovanou metódou vylúčenia diagnózy HIT. Pozitívna prediktívna schopnosť je veľmi variabilná (10–20 % pre strednú pravdepodobnosť rozvoja HIT a 40–60 % pre vysokú pravdepodobnosť rozvoja HIT). Preto v prípade strednej a vysokej pravdepodobnosti by mali pacienti absolvovať laboratórne vyšetrenia (6).
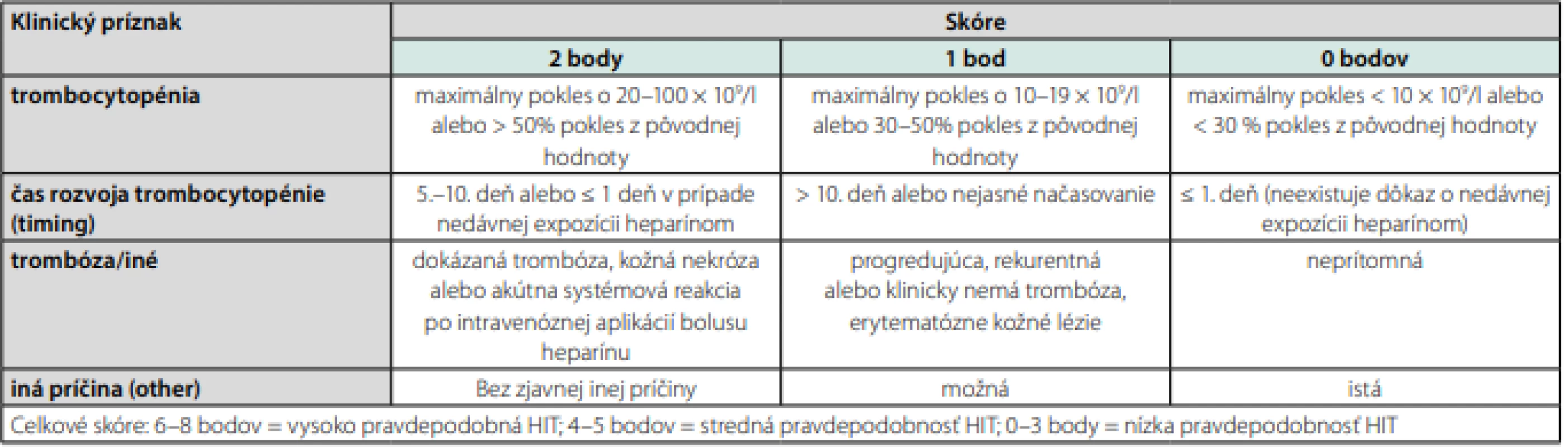
Zároveň si treba pamätať, že pri podozrení na HIT je pravdepodobnosť tejto diagnózy po použití UFH väčšia ako LMWH (až 10×), viac po intravenóznom ako subkutánnom podaní, pri dlhšom trvaní heparinoterapie, viac u chirurgických ako ostatných pacientov (najmä kardiochirurgia a ortopédia), skôr u žien ako u mužov (41).
Laboratórna diagnostika
Laboratórne testy je potrebné vykonať v prípade podozrenia na HIT. V súčasnosti máme k dispozícii 2 triedy testov, a to imunologické (antigénne) a funkčné (doštičková aktivácia). Vo všeobecnosti sa dá povedať, že tieto testy identifikujú rôzne kroky v patofyziologickom rozvoji HIT. Imunologické testy detegujú iniciálnu imunitnú odpoveď. Funkčné testy sa zameriavajú na detekciu aktivácie trombocytov (6).
Imunologické testy
Sú založené na princípe ELISA (enzyme‑linked imunosorbent assay) alebo na aglutinácii gélových častíc PaGIA (particle gel assay). Používané sú tiež testy s bočným tokom LFIA (lateral flow immunoassays), chemiluminiscenčné testy a testy latexovej aglutinácie LAA (latex agglutination assays) (41, 42). Potenciálnou nevýhodou týchto testov môže byť detekcia prítomnosti klinicky nevýznamných protilátok (neaktivujú krvné doštičky). Preto ďalším krokom v diagnostike HIT je realizácia funkčných testov (1).
Funkčné testy
K štandardným funkčným testom patrí:
- agregácia trombocytov indukovaná heparínom (heparin induced platelet activation assays – HIPA),
- test uvoľňovania sérotonínu z trombocytov (serotonin release assays – SRA),
- test za použitia prietokovej cytometrie, HIT Alert“
Test HIPA je rýchly (2–3 hod), jednoduchý a lacný, ale je menej senzitívny ako SRA (len 30–50 %). SRA predstavuje zlatý štandard pre laboratórne potvrdenie diagnózy, je však dostupný len v centrách zaoberajúcich sa výskumom HIT. Princíp testu je veľmi jednoduchý. Sérum pacienta sa inkubuje s darcovskými trombocytmi, ktoré obsahujú radioaktívny 14C. Inkubácia prebieha pri rôznych koncentráciách heparínu. Protilátky prítomné v sére pacienta sa viažu a aktivujú darcovské trombocyty. Následne dochádza k uvoľneniu rádioaktívne značeného serotonínu z granúl trombocytov. Očakáva sa, že pozitívny SRA test uvoľní > 20 % 14C‑serotonínu, v prípade zmiešania pacientského séra a nízkej dávky heparínu. Navyše testom sa musí preukázať závislosť uvoľ ‑ ňovania 14C‑serotonínu od dávky heparínu. Jeho senzitivita je 90-98 %, špecificita 95 % (3). Na Slovensku je z funkčných testov dostupný test s použitím prietokovej cytometrie, tzv. „HIT Alert“ (Klinika hematológie a transfuziológie v Martine) (1,41,43).
Diagnostický algoritmus HIT je znázornený na Obr. 2 (44).
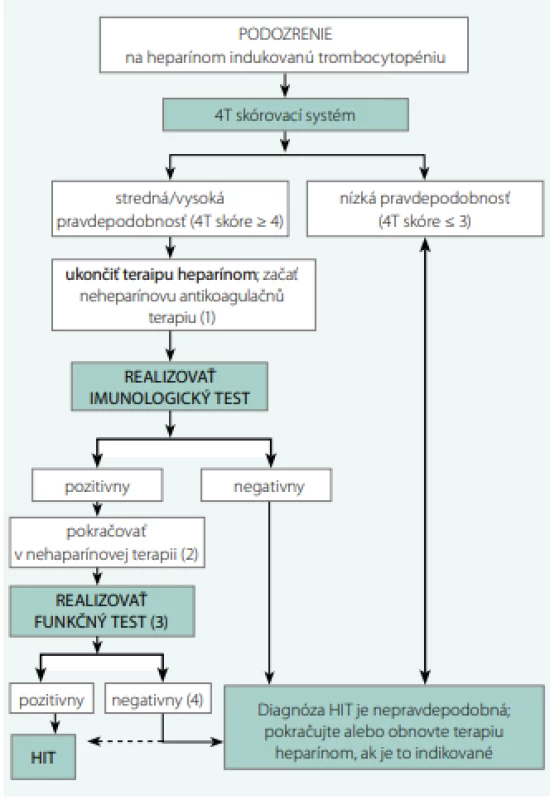
Liečba
V prípade, že 4 T skórovací systém preukáže strednú alebo vysokú pravdepodobnosť HIT, musíme okamžite ukončiť liečbu heparínmi a odstrániť katétre preplachnuté heparínom. Zároveň je potrebné zahájiť neheparínovú antikoagulačnú terapiu v rámci prevencie rozvoja trombózy.
Všetky liečebné možnosti sú zhrnuté v Tab. 3 (44).
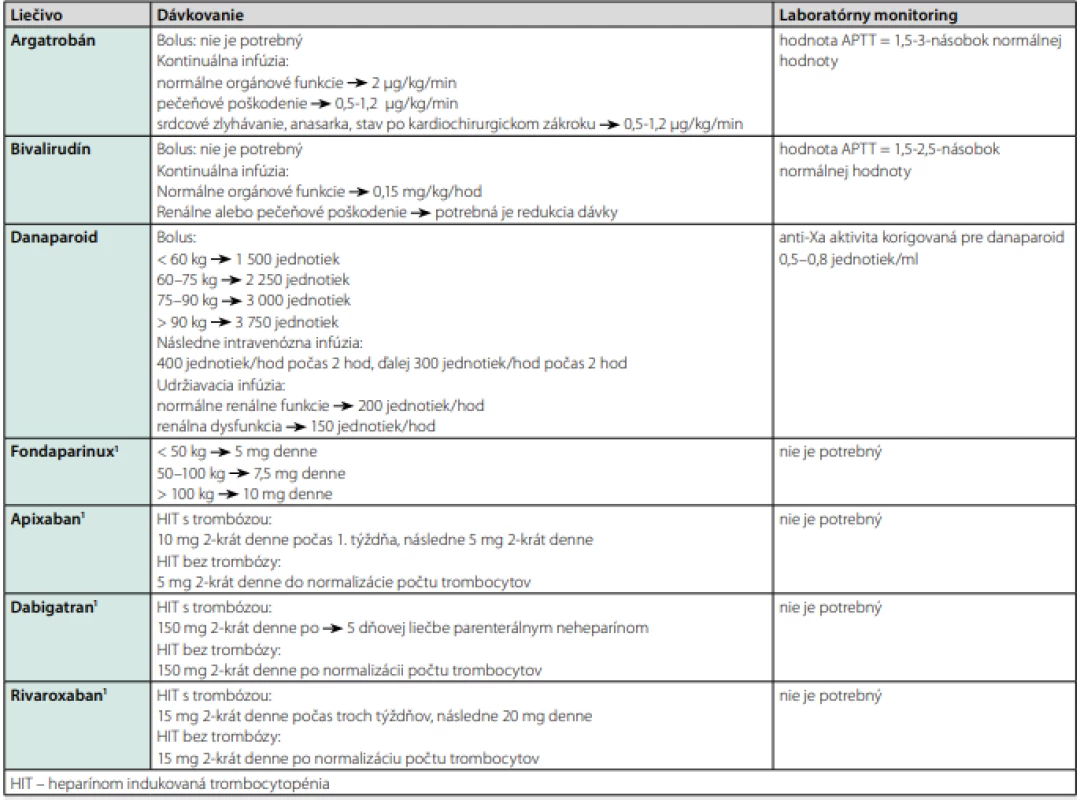
Existujú dve skupiny neheparínových antikoagulancií: priame inhibítory trombínu a nepriame inhibítory F Xa. K priamym inhibítorom trombínu patrí argatroban a bivalirudín. Podávajú sa intravenóznou infúziou, vyžadujú monitorovanie APTT, nie sú registrované v Slovenskej republike. K nepriamym inhibítorom F Xa patrí danaparoid a fondaparinux. Danaparoid nie je registrovaný v SR. V našich podmienkach je teda dostupný len fondaparinux. Podáva sa subkutánne raz denne, dávka sa upravuje podľa hmotnosti (< 50 kg = 5 mg; 50–100 kg = 7,5 mg; > 100 kg = 10 mg). Hoci nie je schválený na liečbu HIT, je široko používaný, nevyžaduje monitorovanie. Štúdie potvrdzujú, že je rovnako účinný ako lieky schválené na liečbu HIT (41, 45–47). Je kontraindikovaný prizávažnom renálnom poškodení. Možno ho použiť aj u tehotných, neprechádza placentou (41).
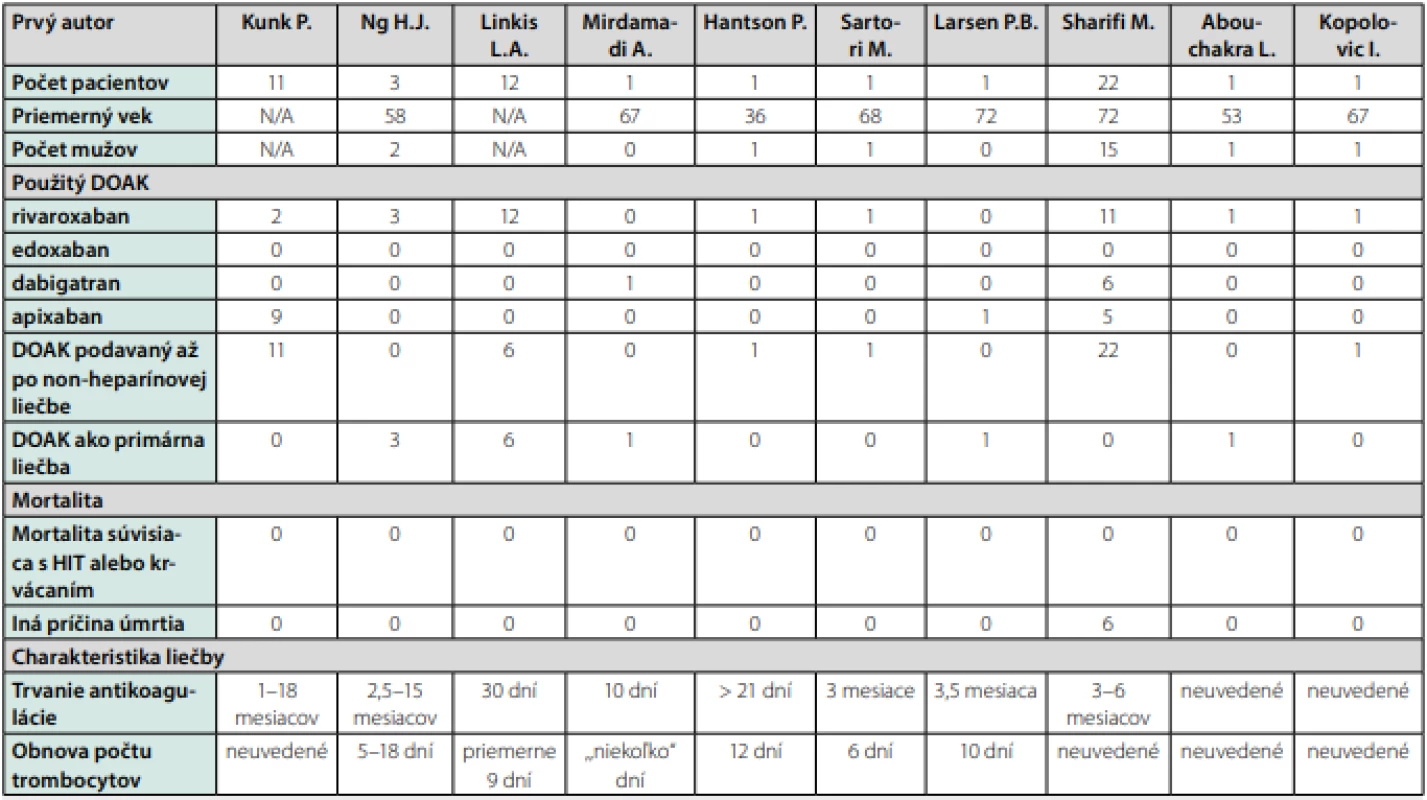
Liečba priamymi perorálnymi antikoagulanciami (DOAK) je atraktívnou liečebnou možnosťou liečby HIT z viacerých príčin (48, 49). Po prvé, neexistuje tu potenciálna imunologická interakcia medzi DOAK‑mi a protilátkami, ktoré sú produkované pri HIT (50, 51). Po druhé, DOAK majú rýchly nástup účinku a nespôsobujú redukciu aktivity proteínu C. Znamená to, že liečba DOAK‑mi je veľmi užitočná hlavne v akútnej fáze HIT (52). Po tretie, liečba DOAK‑mi by mala byť po obnove počtu trombocytou účinnou terapiou aj pri potrebe dlhodobej antikoagulačnej liečby. Z toho vyplýva, že odpadá nutnosť prechodu na vitamín K dependentného antagonistu (VKA) (53). V súčasnosti existuje len jedna prospektívna štúdia, do ktorej boli zaradení pacienti so sérologicky verifikovanou HIT. Ako antikoagulačný liek bol podávaný rivaroxaban (54). Táto štúdia bola však predčasne ukončená pre pomalý nábor pacientov. Avšak v roku 2017 boli publikované postštúdiové výsledky, do ktorých bolo zaradených väčšie množstvo pacientov. Pacienti s HIT bolizaradení do 2 skupín. Skupinu A tvorili pacienti (n = 25) s HIT, ktorí dostávali rivaroxaban v čase stanovenia diagnózy (primárna liečba). Skupinu B tvorili pacienti (n = 21) s HIT, ktorí dostávali rivaroxaban až po predchádzajúcej terapii non‑DOAK/non‑heparínovým antikoagulačným liekom. Trombóza sa vyskytla u 1 zo 46 pacientov (2,2 %; 95% CI 0,4–11,3 %). Išlo o pacienta zo skupiny A. Veľké krvácanie nebolo počas štúdie pozorované (55). V Tab. 4 je zoznam publikovaných kazuistík pacientov s HIT, ktorí boli liečení DOAK‑mi (54, 56–65). Celkovo ide o 54 pacientov (priemerný vek 68,4 rokov; 68 % muži), pričom 94 % z nich malo laboratórne potvrdenú HIT. Najčastejšie používaný DOAK‑om bol rivaroxaban (59 %), ďalej nasleduje apixaban (28 %) a dabigatran (13 %). Celkovo 78 % pacientov dostávalo v čase stanovenia diagnózy HIT non‑heparínový liek, a to argatroban, bivalrudín alebo fondaparinux. 22 % pacientov dostávalo v čase stanovenia diagnózy hneď DOAK. Z celkového počtu pacientov (n = 54) sa pozorovala progresia trombózy v čase podávania DOAK len u jedného pacienta (trombóza asociovaná s centrálnym venóznym katétrom). Klinicky signifikantné krvácanie bolo hlásené u 3 pacientov. Nebolo hlásené žiadne úmrtie v dôsledku krvácavých komplikácií.
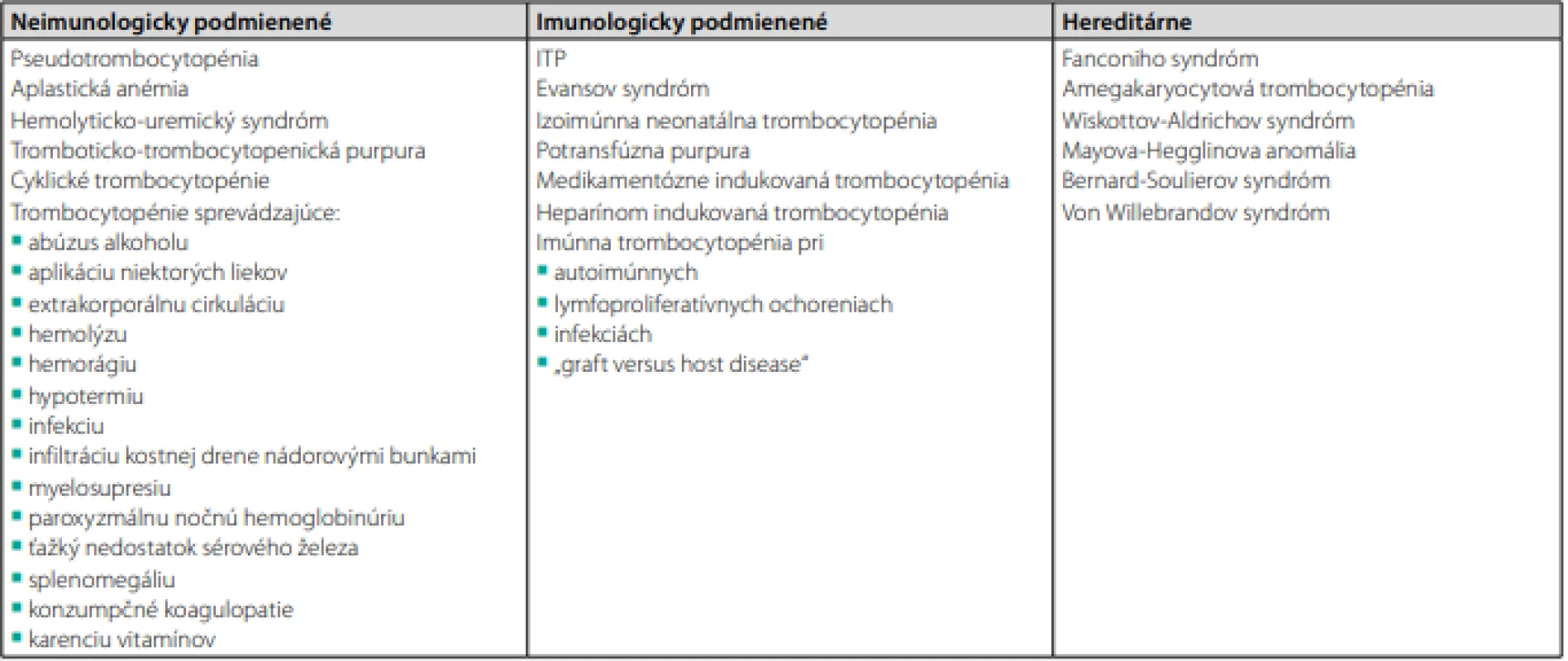
Diferenciálna diagnostika trombocytopénie
Nepravá trombocytopénia
Pseudotrombocytopénia – agregácia trombocytov in vitro vo vzorke krvi odobratej do EDTA. Je spôsobená väzbou prirodzenej protilátky (aglutinínu) na epitop integrínu GPIIb/IIIa, exponovaného v prítomnosti EDTA, ktorá z integrínu odstraňuje íony vápnika. Protilátka sa na druhej strane nešpecificky viaže na FcRγII receptor trombocytov. V tomto prípade je potrebné zopakovať odber krvi do iného antikoagulačného roztoku, napr. citrátu (66).
Hemodilúcia – zvýšenie objemu plazmy pri normálnom objeme cirkulujúcich trombocytov (napr. pri hyperhydratácii, hyperproteinémii, retencii tekutín a pod.). Vzniká aj po veľkom krvácaní s masívnou náhradou objemu krvnými derivátmi neobsahujúcimi trombocyty (trauma, operácia). Naopak, hemokoncentrácia pri dehydratácii, hypoproteinémii a pri forsírovanej diuréze môže prítomnú trombocytopéniu maskovať (66).
Výrazná splenomegália – niektoré trombocytopénie pri splenomegálii sú vlastne tiež nepravými (zvýšený lienálny pool trombocytov a hemodilúcia) (66).
Mikroangiopatické hemolytické anémie
Inou skupinou ochorení, kde sa môže vyskytovať trombocytopénia pri súčasne fyziologických hodnotách ostatných parametrov hemogramu, sú mikroangiopatické hemolytické anémie (TTP a HUS). Typickým nálezom je prítomnosť schistocytov v nátere periférnej krvi (66).
Vrodená trombocytopénia
V prípade izolovanej trombocytopénie pri normálnych ostatných parametroch hemogramu je nutné vylúčiť aj vrodenú trombocytopéniu (66).
Sekundárna trombocytopénia
Ochorenia krvotvorného systému – aplastická anémia, deficitné anémie (vitamín B12, kyselina listová, železo), dyserytropoetické anémie, myelodysplastický syndróm (MDS), hemolytické anémie, leukémie, myeloproliferatívne ochorenia, lymfómy a myelómy, infiltrácia kostnej drene nádorovým procesom (66).
Poškodenie fyzikálne, chemické, radiačné (66).
Ochorenia sleziny – kongestívne, infekčné, neoplázie (66).
Rôzne príčiny
Diseminovaná intravaskulárna koagulácia (DIK), urémia, aloimunizácia, alergia a iné.
V tab. 5 sa nachádza prehľadné rozdelenie trombocytopénií z hľadiska etiopatogenézy (66).
Záver
HIT je zriedkavou, ale závažnou komplikáciou liečby heparínom. Z dôvodu vysokej morbidity a mortality je dôležite na túto komplikáciu myslieť. Trombocytopénia môže teda predstavovať včasné varovanie, ktoré si vyžaduje ďalšie sledovanie od lekára. Zvýšená obozretnosť môže diagnózu potvrdiť už v skorej fáze. Následne začatá alternatívna antikoagulačná terapia vedie k zníženiu morbidity a mortality na toto ochorenie (67–69).
Táto práca bola podporená grantami VEGA 1/0187/17 a APVV-17-0054
KORESPONDENČNÍ ADRESA AUTORA:
doc. MUDr. Juraj Sokol, PhD.,
Klinika hematológia a transfuziológie JLF UK a UN,
Kollárova 2,
036 59 Martin,
Slovenská republika
Cit. zkr: Vnitř Lék 2020; 66(8): e39–e46
Článek přijat redakcí: 16. 10. 2020
Článek přijat po recenzích k publikaci: 22. 3. 2020
Sources
1. Fathi M. Heparin‑induced thrombocytopenia (HIT): Identification and treatment pathways. Glob Cardiol Sci Pract 2018; 2 : 1–13.
2. Arnold DM, Kelton JG. Heparin induced thrombocytopenia: an iceberg rising. Mayo Clin Proc 2005; 80 : 988–990.
3. WarkentinTE, Sheppard J‑AI, Heels‑Ansdell D, et al. Heparin‑induced thrombocytopenia in medical surgical critical illness. Chest 2013; 144 : 848–858.
4. Kanaan AO, Al‑Homsi AS. Heparin‑induced thrombocytopenia: Pathophysiology, diagnosis, and review of pharmacotherapy. J Pharm Pract 2009; 22 : 149–157.
5. Greinacher A, Levy JH. HIT happens: diagnosing and evaluating the patient with heparin‑induced thrombocytopenia. Anesth Analg 2008; 107 : 356–358.
6. Salter BS, Weiner MM, Trinh MA, et al. Heparin‑Induced Thrombocytopenia: A Comprehensive Clinical Review. J Am Coll Cardiol 2016; 67 : 2519–2532.
7. Battistelli S, Genovese A, Gori T. Heparin‑induced thrombocytopenia in surgical patients. Am J Surg 2010; 199 : 43–51.
8. Lovecchio F. Heparin‑induced thrombocytopenia. Clin Toxicol (Phila) 2014; 52 : 579–583.
9. Sachais BS, Rux AH, Cines DB, et al. Rational design and characterization of platelet factor 4 antagonists for the study of heparin‑induced thrombocytopenia. Blood 2012; 119 : 5955–5962.
10. Szokol JW. Heparin‑induced thrombocytopenia. Semin Cardiothorac Vasc Anesth 2010; 14 : 73–74.
11. Walenga JM, Jeske WP, Messmore HL. Mechanisms of venous and arterial thrombosis in heparin‑induced thrombocytopenia. J Thromb Thrombolysis 2000; 10: (Suppl. 1):13–20.
12. Cuker A, Cines DB. How I treat heparin‑induced thrombocytopenia. Blood 2012; 119 : 2209–2218.
13. Crespo EM, Oliveira GBF, Honeycutt EF, et al. for the CATCH Registry Investigators. Evaluation and management of thrombocytopenia and suspected heparin‑induced thrombocytopenia in hospitalized patients: the Complications After Thrombocytopenia Caused by Heparin (CATCH) registry. Am Heart J 2009; 157 : 651–657.
14. Kato S, Takahashi K, Ayabe K, et al. Heparin‑induced thrombocytopenia: analysis of risk factors in medical inpatients. Br J Haematol 2011; 154 : 373–377.
15. Martel N, Lee J, Wells PS. Risk for heparin‑induced thrombocytopenia with unfractionated and low‑molecular‑weight heparin thromboprophylaxis: a meta‑analysis. Blood 2005; 106 : 2710–2715.
16. Arepally GM, Ortel TL. Heparin‑induced thrombocytopenia. Annu Rev Med 2010; 61 : 77–90.
17. Visentin GP, Malik M, Cyganiak KA, et al. Patients treated with unfractionated heparin during open heart surgery are at high risk to form antibodies reactive with heparin: platelet factor 4 complexes. J Lab Clin Med 1996; 128 : 376–383.
19. Prandoni P, Siragusa S, Girolami B, et al. for the BELZONI Investigators Group. The incidence of heparin‑induced thrombocytopenia in medical patients treated with low‑molecular‑weight heparin: a prospective cohort study. Blood 2005; 106 : 3049–3054.
20. Warkentin TE. Fondaparinux: does it cause HIT? Can it treat HIT? Expert Rev Hematol 2010; 3 : 567–581.
21. Francis JL, Palmer GJ III, Moroose R, et al. Comparison of bovine and porcine heparin in heparin antibody formation after cardiac surgery. Ann Thorac Surg 2003; 75 : 17–22.
22. Selleng K, Warkentin TE, Greinacher A. Heparin‑induced thrombocytopenia in intensive care patients. Crit Care Med 2007; 35 : 1165–1176.
23. Warkentin TE. Heparin‑induced thrombocytopenia in critically ill patients. Crit Care Clin 2011; 27 : 805–823.
24. Warkentin TE, Sheppard JA, Horsewood P, et al. Impact of the patient population on the risk for heparin‑induced thrombocytopenia. Blood 2000; 96 : 1703–1708.
25. Warkentin TE, Sheppard JAI, Sigouin CS, et al. Gender imbalance and risk factor interactions in heparin‑induced thrombocytopenia. Blood 2006; 108 : 2937–2941.
26. Arepally GM. Heparin‑induced thrombocytopenia. Blood. 2017; 129 : 2864–2872.
27. Amiral J, Peynaud‑Debayle E, Wolf M, et al. Generation of antibodies to heparin‑PF4 complexes without thrombocytopenia in patients treated with unfractionated or low‑molecular‑weight heparin. Am J Hematol 1996; 52 : 90–95.
28. Warkentin TE, Sheppard JA, Horsewood P, et al. Impact of the patient population on the risk for heparin‑induced thrombocytopenia. Blood 2000; 96 : 1703–1708.
29. Warkentin TE, Kelton JG. Temporal aspects of heparin‑induced thrombocytopenia. N Engl J Med 2001; 344 : 1286–1292.
30. Warkentin TE, Greinacher A. Heparin‑induced thrombocytopenia and cardiac surgery. Ann Thorac Surg 2003; 76 : 2121–2131.
31. Cuker A, Arepally G, Crowther MA, et al. The HIT Expert Probability (HEP) Score: a novel pre‑test probability model for heparin‑induced thrombocytopenia based on broad expert opinion. J Thromb Haemost 2010; 8 : 2642–2650.
32. Pouplard C, May MA, Regina S, et al. Changes in platelet count after cardiac surgery can effectively predict the development of pathogenic heparin‑dependent antibodies. Br J Haematol 2005; 128 : 837–841.
33. Nuttall GA, Oliver jr. WC, Santrach PJ, et al. Patients with a history of type II heparin‑induced thrombocytopenia with thrombosis requiring cardiac surgery with cardiopulmonary bypass: a prospective observational case series. Anesth Analg 2003; 96 : 344–350.
34. Lillo‑Le Louët A, Boutouyrie P, Alhenc‑Gelas M, et al. Diagnostic score for heparininduced thrombocytopenia after cardiopulmonary bypass. J Thromb Haemost 2004; 2 : 1882–1888.
35. Shantsila E, Lip GYH, Chong BH. Heparin‑induced thrombocytopenia. A contemporary clinical approach to diagnosis and management. Chest 2009; 135 : 1651–1664.
36. Warkentin TE, Levine MN, Hirsh J, et al. Heparin‑induced thrombocytopenia in pa ‑ tients treated with low‑molecular‑weight heparin or unfractionated heparin. N Engl J Med 1995; 332 : 1330–1335.
37. Ahmed I, Majeed A, Powell R. Heparin‑induced thrombocytopenia: diagnosis and management update. Postgrad Med J 2007; 83 : 575–582.
38. Arepally GM, Ortel TL. Clinical practice. Heparin‑induced thrombocytopenia. N Engl J Med 2006; 355 : 809–817.
39. Lo GK, Juhl D, Warkentin TE, et al. Evaluation of pretest clinical score (4 T’s) for the diagnosis of heparin‑induced thrombocytopenia in two clinical settings. J Thromb Haemost 2006; 4 : 759–765.
40. Warkentin TE, Roberts RS, Hirsh J, et al. An improved definition of immune heparin‑induced thrombocytopenia in postoperative orthopedic patients. Arch Intern Med 2003; 163 : 2518–2524.
41. Lazúr J. Heprínom indukovaná trombocytopénia. Interná med 2019; 19 : 51–54.
42. Kubisz P, Hollý P, Staško J. Heparínom indukovaná trombocytopénia. In: Štvrtinová V et al. Venózny tromboembolizmus. Bratislava: SAP, 2018, 388 s.
43. Brieger DB, Mak KH, Kottke‑Marchant K, et al. Heparin‑induced thrombocytopenia. J Am Coll Cardiol 1998; 31 : 1449–1459.
44. Cuker A, Arepally GM, Chong BH, et al. American Society of Hematology 2018 guidelines for management of venous thromboembolism: heparin‑induced thrombocytopenia. Blood Adv 2018; 2 : 3360–3392.
45. He Y, He H, Liu D, et al. Fondaparinux in a critically ill patient with heparin‑induced thrombocytopenia. Medicine 2018; 97 : 37.
46. Linkins LA, Hu G, Warkentin TE. Systematic review of fondaparinux for heparin‑induced thrombocytopenia: When there are no randomized controlled trials. Res Pract Thromb Haemost 2018; 2 : 678–683.
47. Al‑Eidan FAS, Alrawkan S, Alshammary H, et al. Comparison of argatroban and fondaparinux for the management of patients with isolated heparin‑induced thrombocytopenia. Ann Hematol 2018; 47 : 12.
48. Skelley JW, Kyle JA, Roberts RA. Novel oral anticoagulants for heparin‑induced thrombocytopenia. J Thromb Thrombolysis 2016; 42 : 172–178.
49. Sokol J, Nehaj F, Mokán M, et al. Nové perorálne antikoagulanciá. Martin: Osveta. 2018. s. 266.
50. Walenga JM, Prechel M, Jeske WP, et al. Rivaroxaban - an oral, direct Factor Xa inhibi ‑ tor - has potential for the management of patients with heparin‑induced thrombocytopenia. Br J Haematol 2008; 143 : 92–99.
51. Walenga JM, Prechel M, Hoppensteadt D, et al. Apixaban as an alternate oral anticoagulant for the management of patients with heparin‑induced thrombocytopenia. Clin Appl Thromb Hemost 2013; 19 : 482–487.
52. Linkins LA, Warkentin TE, Pai M, et al. Design of the rivaroxaban for heparin‑induced thrombocytopenia study. J Thromb Thrombolysis 2014; 38 : 485–492.
53. Aljabri A, Huckleberry Y, Karnes JH, et al. Cost‑effectiveness of anticoagulants for suspected heparin‑induced thrombocytopenia in the United States. Blood 2016; 128 : 3043–3051.
54. Linkins LA, Warkentin TE, Pai M, et al. Abstract number 3468 Rivaroxaban for Treatment of Suspected or Confirmed Heparin‑Induced Thrombocytopenia Study. American Socie ‑ ty of Hematology 57th annual meeting Orlando FL, 2016.
55. Warkentin TE, Pai M, Linkins LA. Direct oral anticoagulants for treatment of HIT: update of Hamilton experience and literature review. Blood 2017; 130 : 1104–1113.
56. Shatzel JJ, Crapster‑Pregont M, Deloughery TG. Non‑vitamin K antagonist oral anticoagulants for heparin‑induced thrombocytopenia. A systematic review of 54 reported cases. Thromb Haemost 2016; 116 : 397–400.
57. Kunk P, Macik BG, Brown J. Abstract number 3547 Non‑Warfarin Oral Anticoagulants in Heparin‑Induced Thrombocytopenia. American Society of Hematology 57th annual meeting Orlando FL, 2015.
58. Ng HJ, Than H, Teo EC First experiences with the use of rivaroxaban in the treatment of heparin‑induced thrombocytopenia. Thromb Res 2015; 135 : 205–207.
59. Mirdamadi A Dabigatran, a direct thrombin inhibitor, can be a life‑saving treatment in heparin‑induced thrombocytopenia. ARYA Atheroscler 2013; 9 : 112–114.
60. Hantson P, Lambert C, Hermans C. Rivaroxaban for arterial thrombosis related to heparin‑induced thrombocytopenia. Blood Coagul Fibrinolysis 2015; 26 : 205–206.
61. Sartori M, Favaretto E, Cini M, et al. Rivaroxaban in the Treatment of Heparin‑Induced Thrombocytopenia. J Thromb Thrombolysis 2015; 40 : 392–394.
62. Larsen PB, Jørgensen M, Friis‑Hansen L, et al. Apixaban used for the management of heparin‑induced thrombocytopenia in a 72-year‑old woman with lung cancer. Clin Case Rep 2015; 3 : 987–989.
63. Sharifi M, Bay C, Vajo Z, et al. New oral anticoagulants in the treatment of heparin‑induced thrombocytopenia. Thromb Res 2015; 135 : 607–609.
64. Abouchakra L, Khabbaz Z, Abouassi S, et al. Rivaroxaban for treatment of heparin‑induced throm - bocytopenia after cardiac surgery: A case report. J Thorac Cardiovasc Surg 2015; 150: e19–e20.
65. Kopolovic I, Warkentin TE. Progressive thrombocytopenia after cardiac surgery in a 67-year‑old man. CMAJ 2014; 186 : 929–933.
66. Sninská Z, Chudej J, Guman T, et al. Primárna imúnna trombocytopénia: princípy klasifikácie, diagnostiky a liečby. Bratislava: GlaxoSmithKline Slovensko, 2014, 57 s.
67. Majdák P, Kubík jr. J, Harmátová L. Prípad vlajúceho infikovaného trombu v. jugularis interna, septických pneumónií a heparínom indukovanej trombocytopénie. Vnitř Lék 2011; 57 : 117–121.
68. Sárník S, Hofírek I. Opakovaná lokální trombolýza u poranení a trombózy axilární a pod ‑ klíckové zíly. Vnitř Lék 2009; 55 : 1102–1104.
69. Dulíček P, Chrobák L. Trombocytopenie indukovaná heparinem.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2020 Issue 8
-
All articles in this issue
- Změny farmakokinetiky léčiv u obézních pacientů
- Chirurgická léčba těžké obezity – bariatrie
- Současnost a perspektivy farmakoterapie obezity
- Fyzická aktivita v léčbě obezity v praxi
- Jak léčit obézního hypertonika?
- Suplementácia vitamínu D ako dôležitý faktor v prevencii a liečbe ochorenia COVID-19: aké máme dôkazy?
- Protidestičková léčba v sekundární prevenci nekardioembolických ischemických mozkových cévních příhod
- Věkem podmíněná remodelace myokardu: mýtus nebo realita?
- Fixní kombinace rosuvastatinu s ezetimibem
- Vplyv ageizmu na správnosť indikácie antikoagulancií u seniorov s fibriláciou predsiení v práci kardiologickej ambulancie medzi rokmi 2012 a 2017
- Akutní infekce, žilní trombóza a doporučená tromboprofylaxe
- Hypogonadismus obézních mužů
- Péče o hospitalizovaného dialyzovaného pacienta z pohledu internisty
- Monitorování farmakokinetiky infliximabu u idiopatických střevních zánětů
- Heparínom indukovaná trombocytopénia a aktuálne možnosti liečby – prehľad literatúry
- Neobvyklá manifestace CMV infekce – cirkulární stenóza žaludku
- Nebezpečí číhající v mořích – komplikace setkání s jedovatou rybou ropušnicí obecnou (Scorpion fish)
- Disekcia ascendentnej aorty, diagnóza na ktorú treba myslieť
- Prof. Jiří Šonka a obezitologie
- Molekula erdostein společnosti Recipharm byla s pozitivním výsledkem testována jako součást léčby pacientů s COVID-19
- Antioxidační a bronchoprotektivní účinek erdosteinu
- Zkrácená informace o přípravku ERDOMED
- K 100. výročí narození prof. MUDr. Jiřího Šonky, DrSc.
- 2020: rok, kdy ambulantní internisté vzali budoucnost do svých rukou. Konečně!
- Programy kvality Q‑OSTEOPORÓZA a Q‑DYSLIPIDEMIE – cesta k dlouhodobé stabilitě v oboru
- 110. výročí narození primáře Kadeřábka
- Role metabolického syndrome v indukci chronické pankreatitidy po první atace akutní pankreatitidy – multicentrická studie
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Péče o hospitalizovaného dialyzovaného pacienta z pohledu internisty
- Změny farmakokinetiky léčiv u obézních pacientů
- Heparínom indukovaná trombocytopénia a aktuálne možnosti liečby – prehľad literatúry
- Nebezpečí číhající v mořích – komplikace setkání s jedovatou rybou ropušnicí obecnou (Scorpion fish)
