Biologická léčba dyslipidemií
Biologic therapy for dyslipidemia
Dyslipidemia treatment represents a very dynamically growing segment of pharmacotherapy, including a production of biological agents. Nowadays, they are targeting at various proteins that are involved in the synthesis, transport, or metabolism of lipoproteins. This review provides a statement of current options for the biological treatment of dyslipidemias and for other products that have the potential to broaden its spectrum in the near future.
Keywords:
PCSK9-inhibitors – inclisiran – evinacumab – volanesorsen – APO(a)-LRx – mipomersen
Authors:
David Karásek
Authors‘ workplace:
III. Interní klinika – nefrologická, revmatologická a endokrinologická, LF UP a FN Olomouc
Published in:
Vnitř Lék 2021; 67(4): 206-211
Category:
Main Topic
Overview
Léčba dyslipidemie představuje velmi dynamicky rostoucí segment farmakoterapie včetně výroby biologických prostředků. Ty dnes cíleně míří na různé proteiny, které se podílejí na syntéze, transportu nebo metabolismu lipoproteinů. Sdělení podává přehled o současných možnostech biologické léčby dyslipidemií a o léčivých prostředcích, které mají potenciál rozšířit její spektrum v nejbližší době.
Klíčová slova:
PCSK9-inhibitory – inclisiran – evinacumab – volanesorsen – APO(a)-LRx – mipomersen
Úvod
Za biologickou léčbu v širším smyslu slova se považuje jakákoliv terapie, která využívá přirozené schopnosti organismu vybudovat obranný systém k potlačení nemoci nebo potenciálu ochránit ho před nežádoucími účinky jiných látek. Zahrnuje klinické využití preparátů odvozených nebo syntetizovaných z biologického materiálu, které velmi cíleně míří na různé struktury (buněčné receptory, enzymy, transportní proteiny, cytokiny, nukleové kyseliny atd.), jež hrají klíčovou roli v patogenezi daných chorob. Díky svému specifickému působení bývá biologická léčba velmi účinná, spojená s minimem nežádoucích účinků. Výhodou mohou být také některé její další vlastnosti, např. v řadě případů lze významně prodloužit dávkovací interval či využít alternativního způsobu aplikace.
V léčbě dyslipidemií se nejčastěji využívá terapie pomocí monoklonálních protilátek, anti-sense oligonukleotidů a interferujících ribonukleových kyselin (iRNA) (1, 2). Cílovými strukturami jsou pak proteiny (nebo jejich mesengerové ribonukleové kyseliny (mRNA)), které se podílejí na syntéze, transportu, nebo metabolismu lipoproteinů. Mezi perspektivní technologie patří i tzv. CRISPR (clustered regularly interspaced short palindromic repeats) – Cas9 technika genového inženýrství, která přímo v deoxyribonukleové kyselině (DNA) umožní odstranit stávající geny a/nebo přidat nové geny pomocí nukleázy Cas9 a syntetické vodicí ribonukleové kyseliny (gRNA). Genomická editace potom vede k nevratným změnám genomu. CRISPR-Cas9 metody se u dyslipidemií již začínají testovat na zvířecích modelech (2).
Monoklonální protilátky
Monoklonální protilátky se vážou na cílový protein a svým navázáním jej inaktivují. V léčbě dyslipidemií se zatím využívají monoklonální protilátky zaměřené proti proprotein konvertáze subtilisin/kexin typu 9 (PCSK9) a angiopoietin-like proteinu 3 (ANGPTL3).
Monoklonální protilátky proti PCSK9
Monoklonální protilátky proti PCSK9 se staly již běžnou součástí léčby hypercholesterolemie a smíšené hyperlipidemie. Jejich podávání vede ke snížení cirkulující hladiny PCSK9, což je provázeno zvýšenou recyklací LDL receptorů na povrchu buněčné membrány. Díky tomu se akceleruje clearence apolipoprotein-B (apo-B) obsahujících lipoproteinů (zejména LDL částic) a klesá jejich plazmatická koncentrace. PCSK9 inhibitory v průměru snižují hladinu celkového cholesterolu o 25–40 %, LDL-cholesterolu (LDL-C) o 50–65 %, triglyceridů (TG) o 8–20 % a zvyšují koncentraci HDL-cholesterolu (HDL-C) o 5–9 % (3, 4). Jako jedny z mála dostupných hypolipidemik také vedou k významnému poklesu lipoproteinu( a) asi o 20–30 %. Z hlediska aterogenní dyslipidemie je důležitý jejich vliv i na hladiny non-HDL-cholesterolu (non-HDL-C) a apo-B. U nemocných s diabetickou dyslipidemií vedlo podávání alirocumabu či evolocumabu k poklesu non-HDL-C o 40–55 % a apo-B o 30–50 % (5, 6, 7). Tato léčba je velmi dobře tolerovaná. Kromě lokální reakce v místě vpichu je výskyt nežádoucích účinků většinou srovnatelný s placebem (3, 4). K dispozici máme i výsledky velkých studií, které hodnotily efekt dlouhodobé terapie monoklonálními protilátkami proti PCSK9 na výskyt hlavních KV příhod.
Ve studii FOURIER bylo podávání evolocumabu u celkem 27 564 vysoce rizikových nemocných s prokázaným stabilním KV onemocněním provázeno 15% redukcí primárního kompozitního cíle (KV úmrtí, nefatálního infarktu myokardu – IM, cévní mozkové příhody – CMP, nestabilní angíny pectoris a koronární revaskularizace) a 20 % redukcí sekundárního cíle (KV úmrtí, nefatálních IM a CMP) (8). Následná subanalýza ukázala, že čím má nemocný rozsáhlejší postižení koronárního řečiště (je patrné vícečetné reziduální postižení tepen, kratší doba od IM či větší počet předchozích IM), tím více profituje z léčby evolocumabem (9). Evolocumab významně snížil výskyt hlavních KV příhod také u jedinců s ischemickou chorobou dolních končetin (DK) a navíc redukoval i výskyt hlavních končetinových příhod (tzn. akutních ischemií DK, urgentních revaskularizací a vysokých amputací DK), a to v závislosti na poklesu LDL-C (10). Obecně platilo čím nižších hladin LDL-C bylo ve studii FOURIER dosaženo, tím větší byla redukce KV rizika (11). Evolocumab snižoval výskyt KV příhod konzistentně bez ohledu na věk a pohlaví, přítomnost diabetu (12) nebo chronického onemocnění ledvin (13).
Do studie ODYSSEY OUTCOMES bylo zařazeno 18 924 jedinců s anamnézou akutního koronárního syndromu. Léčba alirocumabem vedla k 15% redukci primárního end-pointu (úmrtí pro ICHS, nefatálního IM, hospitalizací pro nestabilní anginu pectoris a ischemických CMP) a k 14% redukci dalšího tříbodového kompozitního cíle (úmrtí z jakékoli příčiny, nefatálního IM a CMP) (14). U nemocných po akutním koronárním syndromu byla léčba alirocumabem provázena i poklesem celkové mortality (15). Také v případě alirocumabu bylo dosaženo větší redukce KV příhod u vícečetného cévního postižení (u simultánního postižení koronárního, periferního a cerebrovaskulárního řečiště) (16), a dále u nemocných po aortokoronárním bypassu (17). Alirocumab snižoval též riziko končetinových příhod, a to v závislosti na vstupní hodnotě a redukci lipoproteinu(a) (18). Pokles lipoproteinu(a) navozený alirocumabem byl nezávislým prediktorem i pro redukci hlavních KV příhod (19). Podobně jako evolocumab snížil alirocumab KV riziko bez ohledu na přítomnost diabetu (DM) a jeho podávání nebylo ve srovnání s placebem spojeno s vývojem signifikantně většího počtu nových případů DM (20).
Léčba bococizumabem, což je (na rozdíl výše zmíněných plně humánních monoklonálních protilátek) tzv. humanizovaná protilátka (má asi 3 % myších sekvencí), byla testována v klinickém programu SPIRE u 27 438 jedinců s různou úrovní KV rizika. Signifikantní redukce hlavních KV příhod (KV úmrtí, nefatálních IM, CMP, hospitalizací pro nestabilní anginu pectoris a urgentních revaskularizací) byla zaznamenána pouze u pacientů s vysokým KV rizikem (21). Aplikace bococizumabu byla spojena asi 8krát častěji s lokální reakcí v místě vpichu. Při jeho podávání docházelo již během prvního roku u téměř poloviny nemocných k vývoji neutralizačních protilátek, což vedlo (v závislosti na jejich koncentraci) k částečnému nebo i k úplnému selhání léčby (22). Proto byl další vývoj této látky ukončen a bococizumab se nedostal do běžné klinické praxe. V současné době se testují další monoklonální protilátky proti PCSK9, které by mohly prodloužit současnou dobu podávání (jednou za 2 resp. za 4 týdny) na delší dávkovací interval (např. tafolecimab s možností aplikace jednou za 6–8 týdnů (23)).
Monoklonální protilátky proti ANGPTL3
Angiopoietin-like protein 3 je protein, který v játrech inhibuje lipoproteinovou a endotelovou lipázu, což má vliv na metabolismus a plazmatickou koncentraci především TG a HDL-C (2). Ztrátové mutace ANGPTL3 genu jsou kromě nízkých hladin TG a HDL-C provázeny také nízkou koncentrací LDL-C (24). Při podávání monoklonální protilátky proti ANGPTL3, evinacumabu byla u zdravých jedinců s hypertriglyceridemií pozorována až 80% redukce hladin TG (25). Evinacumab byl testován také u homozygotů s familiární hypercholesterolemií (FH) léčených standardní terapií (94 % z nich bralo statin, 77 % PCSK9 inhibitor, 75 % ezetimib a 34 % bylo léčeno LDL-aferézou) a po 24 týdnech léčby byl zaznamenán 49% pokles LDL-C vůči placebu (26). U pacientů s refrakterní hypercholesterolemií (většinou šlo o FH heterozygoty) vedlo podávání vyšších dávek evinacumabu (300 mg, resp. 450 mg/týden) k více jak 50% redukci hladin LDL-C (-51 %, resp. -56 %) (27). Došlo také k signifikantnímu snížení apo-B, non-HDL-C, TG a HDL-C. Léčba byla dobře tolerovaná, nebyly zaznamenány rozdíly v závažných nežádoucích účincích mezi aktivní a placebovou větví. Výhoda evinacumabu při léčbě FH spočívá hlavně v tom, že na rozdíl od jiné terapie (statiny, PCSK9 inhibitory, ezetimib) není závislá na aktivitě LDL receptorů (2).
Léky založené na interferenci s RNA
V léčbě dyslipidemií jsou také využívány anti-sense oligonukleotidy (ASO) a malé interferující ribonukleové kyseliny (siRNA) – viz obrázek 1. V případě ASO je kontrola genové exprese realizována pomocí krátké jednovláknové deoxyribonukleové kyseliny (typicky obsahující 5–25 nukleotidů), která se specificky váže na cílovou sekvenci mRNA. To vede k tvorbě dvouvláknové šroubovice (DNA-RNA duplex), která je štěpena endoribonukleázou (RNázou H1), jež má k tomuto duplexu větší afinitu než k homogenním duplexům (RNA-RNA, či DNA-DNA). Dojde pak k selektivní degradaci mRNA a ASO pak může atakovat další cílovou molekulu mRNA (28). U siRNA se iniciálně jedná o dvouvláknovou ribonukleovou kyselinu (většinou má 21–23 nukleotidů), která se po průniku do cytoplazmy rozdělí na vlastní aktivní část, jež se spolu s Argonaute-2 proteinem stane součástí tzv. RISC (RNA-induced silencing complex), a na komplementární transportní část, která je následně degradována. Jednovláknová siRNA se pak cíleně spojí s komplementární molekulou mRNA, a ta je pak RISC komplexem s endonukleázovou aktivitou rozštěpena (28, 29).
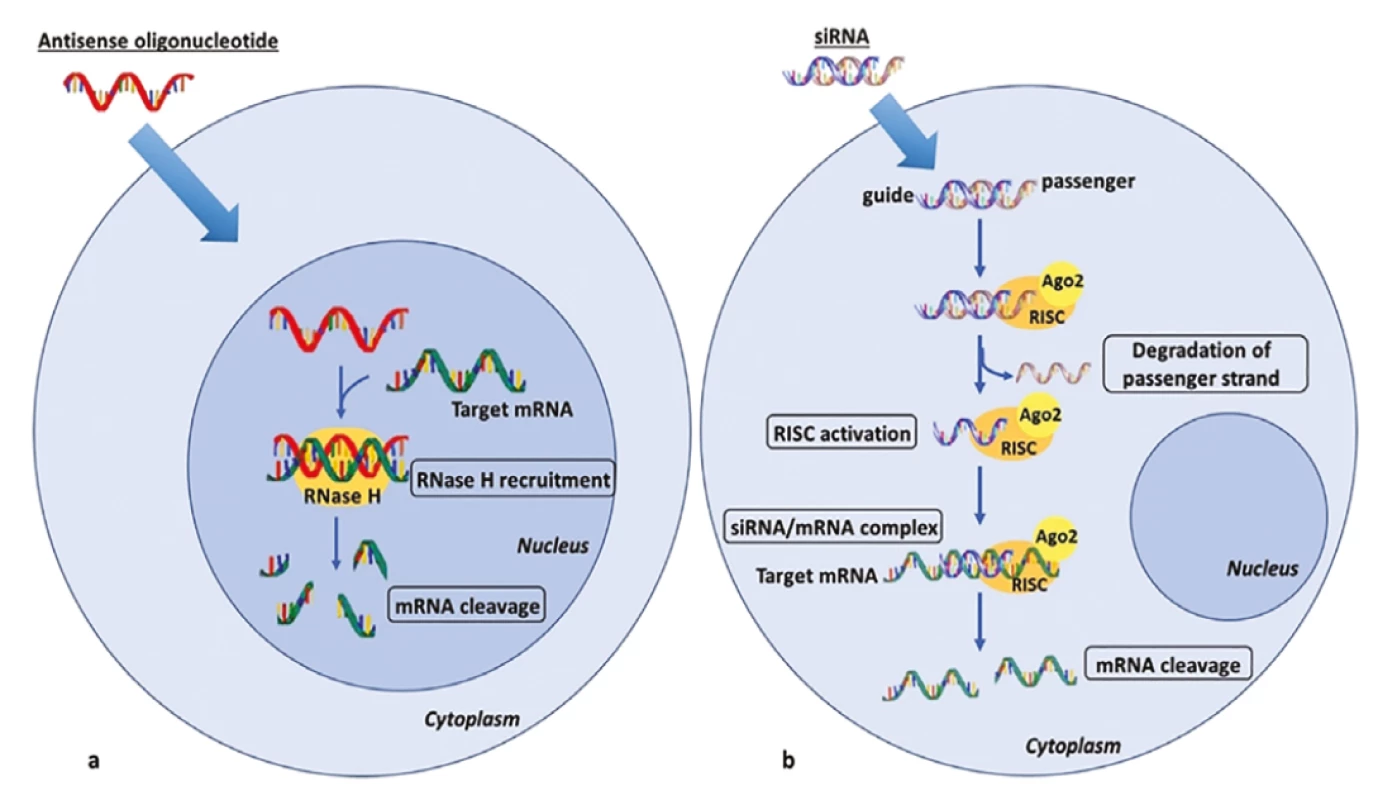
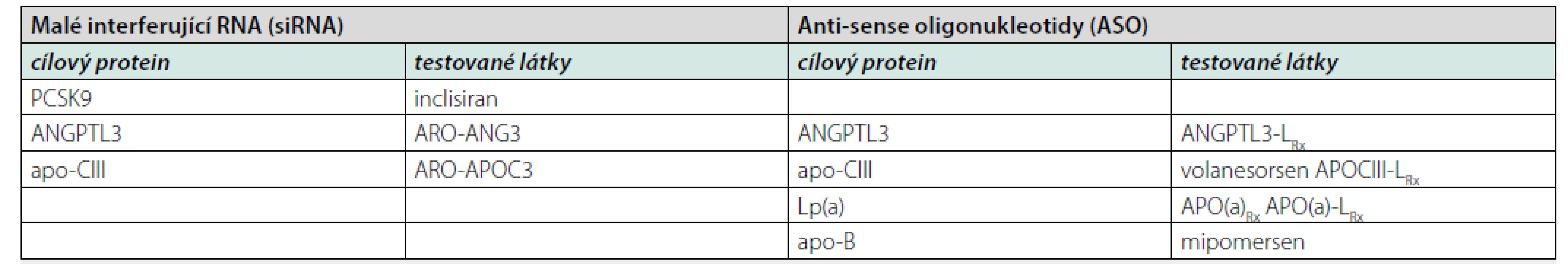
Jelikož většina metabolických pochodů týkajících se syntézy i degradace lipoproteinů probíhá v játrech, je nutno transport ASO i siRNA do jaterních buněk akcelerovat. Využívá se jejich konjugace s N-acetyl-galaktosaminem, který urychluje transport do jater pomocí vazby s asialoglykoproteinovým receptorem hepatocytů. Další možnost spočívá v jejich konjugaci s mastnými kyselinami nebo cholesterolem, následně s využitím vstupu pomocí LDL-receptoru (2, 28). Podobně jako u monoklonálních protilátek mohou být cílovými proteiny těchto léků PCSK9 i ANGPTL3. Navíc se testují preparáty, které inhibují produkci apolipoproteinu - CIII (apo-CIII) a lipoproteinu(a) – Lp(a). Historicky lze zmínit také mipomersen, což je jeden z prvních ASO redukující syntézu apo-B. Přehled preparátů udává tabulka 1. Podrobněji se budeme věnovat těm, jejichž zavedení na trh se dá v blízké době očekávat.
Inclisiran
Inclisiran je představitelem siRNA, který inhibuje syntézu PCSK9 v játrech. Má tedy potenciál redukovat hlavně LDL-C, podobně jako výše zmíněné monoklonální protilátky. Jeho velká výhoda spočívá v dlouhých intervalech mezi podáním účinné látky. Po první subkutánní aplikaci následuje druhá za 3 měsíce a další se pak podávají každých 6 měsíců (29). Inclisiran byl mimo jiné testován v rozsáhlém klinickém programu ORION, jehož některé části nadále pokračují.
Ve studii ORION-1 byly zkoušeny různé dávky inclisiranu u hypercholesterolemických pacientů s vysokým KV rizikem, kteří byli léčeni maximálně tolerovanou dávkou statinu. Největší pokles LDL-C byl pozorován po podávání dvou dávek 300 mg inclisiranu v odstupu 90 dní. Za 180 dní od první aplikace došlo k 53% redukci LDL-C, což je podobné snížení, jako pozorujeme u monoklonálních protilátek proti PCSK9. Signifikantní pokles LDL-C byl nadále patrný i po 240 dnech léčby. Nejběžnějšími nežádoucími účinky byly myalgie, bolesti hlavy, únava, nasofaryngitida, bolesti zad, hypertenze, průjem a závratě. Výskyt těchto příhod se významně nelišil mezi terapií inclisiranem a placebem. Lokální reakce v místě vpichu se vyskytly u 5 % léčených pacientů (30). Další sledování účinnosti, bezpečnosti a snášenlivosti inclisiranu pokračuje v otevřeném klinickém hodnocení ORION-3. Průběžná analýza ukázala na dlouhodobé trvání redukce hladin LDL-C (asi o 51 %). Během tříletého období nebyla registrována závažná elevace jaterních testů či pokles renálních funkcí (28). Bezpečnostní profil i účinek inclisiranu byl podobný u jedinců s normální či sníženou funkcí ledvin. Výsledky studie ORION-7 navíc ukázaly, že není nutné redukovat jeho dávku u pacientů s renální insuficiencí (31).
V pilotní studii ORION-2 u homozygotů s FH vedl inclisiran k poklesu LDL-C asi o 30 % (32). Tento efekt je nyní testován na větším vzorku nemocných v klinickém hodnocení ORION-5. Heterozygotům s FH byla věnována studie ORION-9 a pacientům s aterosklerotickým KV onemocněním (ASKVO) či jeho ekvivalentem pak studie ORION-10, resp. ORION-11. V porovnání s placebem bylo u heterozygotů s FH podávání inclisiranu provázeno snížením LDL-C o 47,9 % (33). U jedinců s ASKVO, či jeho ekvivalentem, léčených maximálně tolerovanou dávkou statinů s přetrvávající elevací LDL-C (> 1,8 mmol/l v případě ASKVO, nebo > 2,4 mmol/l v případě ekvivalentu ASKVO) vedla léčba inclisiranem k poklesu jeho hladin o 52,3% (ORION-10), resp. o 49,9 % (ORION-11) (34). Počet závažných nežádoucích účinků se nelišil mezi placebovou a aktivně léčenou skupinou. Dá se tedy shrnout, že terapie inclisiranem je provázena dlouhodobou, asi 50% redukcí LDL-C a je velmi dobře tolerovaná. V současné době probíhá zatím největší klinické hodnocení ORION-4, které testuje klinický efekt inclisiranu na výskyt hlavních KV příhod, a to přibližně u 15 000 jedinců s ASKVO (28).
Další malé interferující RNA
ARO-ANG3 je siRNA zaměřená na potlačení produkce ANGPTL3, která má za sebou teprve 1., resp. 2. fázi klinického testování. U zdravých dobrovolníků bylo její jednorázové podání v dávce 200, resp. 300 mg provázeno poklesem TG o 47–53 %, VLDL-C o 49–51 % a LDL-C o 33–46 %. ARO-APOC3 je siRNA inhibující syntézu apo-CIII, byla testována u zdravých dobrovolníků s hypertriglyceridemií a její jednorázová aplikace vedla k poklesu TG o 41–55 % a VLDL-C o 42–53 %. V obou případech nebyly zatím zaznamenány žádné závažné nežádoucí účinky (2). Je připraveno také testování siRNA, která cílí na Lp(a) (2).
Anti-sense oligonukleotidy (ASO)
Kromě monoklonální protilátky proti ANGPTL3 (již zmíněného evinacumabu) a siRNA (ARO-ANG3) je další zkoušenou látkou, která potlačuje produkci ANGPTL3 v játrech, ANGPTL3-LRx, jež účinkuje ASO mechanismem. Její subkutánní aplikace v týdenních intervalech vedla během 6 týdnů u jedinců se zvýšenou hladinou TG k jejich redukci až o 63 %, dále k poklesu LDL-C až o 33 %, non-HDL-C o 37 % a apo-B až o 26 % v závislosti na podané dávce (35). Zároveň bylo u testovaných myší zaznamenáno zpomalení progrese aterosklerotických plátů. Jiné ASO jsou zaměřeny na inhibici syntézy apo-CIII. Jedná se o volanesorsen a APOCIII-LRx. A dále jsou k dispozici ASO, které redukují tvorbu Lp(a), jde o APO(a)Rx a o APO(a)-LRx (2, 28, 36, 37).
Volanesorsen
Apo-CIII je produkován především v játrech a v menší míře také v tenkém střevu. V cirkulaci se pak nachází na povrchu HDL lipoproteinů a lipoproteinů bohatých na TG, což zahrnuje hlavně chylomikrony, VLDL a IDL lipoproteiny (28, 37). Jeho zvýšená produkce je spojena s hypertriglyceridemií, naopak snížená je provázena nízkými hladinami TG a chrání také před jejich postpradiálním vzestupem (37). Ztrátové mutace genu pro apo-CIII provází kromě nízkých koncentrací TG také snížené riziko ASKVO (2, 28). Volanesorsen (dříve označovaný také jako APOCIIIRx) byl primárně vyvinutý k léčbě familiární hyperchylomikronemie (FC).
Ve studii APPROACH byl u nemocných s FC volanesorsen podáván v dávce 300 mg s. c. jednou týdně. Po třech měsících došlo ve srovnání s placebem průměrně k 77% redukci hladin TG a asi u 77 % nemocných došlo k poklesu hladiny TG < 8,5 mmol/l (38). Byl zaznamenán také signifikantní pokles koncentrace chylomikronů (-83 %), apo-B48 (-76 %), non-HDL-C (-46 %) a VLDL-C (-58 %) a naopak vzestup HDL-C (+46 %), apo-A1 (+14 %), LDL-C (+136 %) a apo-B (+20 %). Mezi nejčastější nežádoucí účinky patřily reakce v místě vpichu a v léčené skupině byl také signifikantně častější vývoj trombocytopenie. Do studie COMPASS byli zařazeni jedinci s hypertriglyceridemií (TG > 5,7 mmol/l). Podáváním volanesorsenu bylo po 3 měsících dosaženo 73% redukce hladin TG (39). Úprava lipidového spektra byla v obou studiích provázena snížením rizika vzniku akutní pankreatitidy (40). Proto byl tento lék schválen Evropskou lékovou agenturou k léčbě dospělých s geneticky potvrzenou FC a vysokým rizikem pankreatitidy, naopak FDA jej pro obavy z rizika rozvoje trombocytopenie ke komerčnímu využití zatím neschválila (2, 28). Objevily se i první informace o výsledcích studie BROADEN, ve které byl volanesorsen testován u jedinců s familiární parciální lipodystrofií. Po 3 měsících vedla jeho aplikace k 88% poklesu sérových hladin TG a k 52% redukci množství tuku v jaterním parenchymu. Nejčastějším nežádoucím účinkem byla opět reakce v místě vpichu, dále nasofaryngitida, infekce močových cest a nezávažný pokles krevních destiček (41).
Nová generace ASO cílená proti apo-CIII, která se označuje jako APOCIII-LRx, využívá konjugaci s N-acetyl-galaktosaminem, což jí umožňuje snadnější průnik do hepatocytů. Již byla zkoušena u zdravých dobrovolníků a vedla k 71% redukci TG, k 51% vzestupu HDL-C a k 17% poklesu hladiny LDL-C. Její podávání nebylo provázeno poklesem počtu krevních destiček (42). Nyní probíhají studie, které tuto látku testují u nemocných s hypertriglyceridemií a ASKVO (28, 37).
APO(a)Rx a APO(a)-LRx
Lipoprotein(a) se skládá z lipidové částice bohaté na cholesterol (podobné s LDL částicí), která je prostřednictvím apo-B navázaná pomocí disulfidové vazby na vysoce glykosylovaný apolipoprotein(a). Vysoké koncentrace Lp(a) představují nezávislý rizikový faktor ASKVO. Hladiny Lp(a) jsou asi z 90 % determinovány geneticky (28). ASO, který inhibuje syntézu apolipoproteinu(a), snižuje produkci Lp(a) v játrech a vede také k poklesu cirkulujících hladin Lp(a).
ASO první generace APO(a)Rx byl testován v dávce 50 až 400 mg za den u jedinců s hladinou Lp(a) ≥ 1 000 mg/l. Zatímco po jednorázovém podání nebyl zaznamenán rozdíl mezi hodnocenou látkou a placebem, po šesti dávkách (100–300 mg/den) došlo během jednoho měsíce k poklesu hladin Lp(a) o 40–79 %, a to v závislosti na podávaném množství (43). V druhé fázi klinického hodnocení byl u jedinců s elevací Lp(a) aplikován APO(a)Rx ve zvyšujících se dávkách od 100 do 300 mg týdně a během 3 měsíců se snížily sérové koncentrace Lp(a) o 67–72 % (44). V novější generaci ASO byla u APO(a)-LRx opět využita konjugace s N-acetyl-galaktosaminem, aby se usnadnil vstup do jaterních buněk. Látka byla podávána zdravým dobrovolníkům v různém množství a porovnávána s efektem APO(a)Rx. Pomocí APO(a)-LRx bylo dosaženo až 92% redukce hladiny Lp(a) a léčba byla nejméně 30krát účinnější než aplikace APO(a)Rx (28, 44). Nedávno byla publikována práce, která hodnotila efekt APO(a)-LRx u jedinců s ASKVO a hladinou Lp(a) ≥ 600 mg/l. Největšího poklesu (o 80 %) bylo dosaženo při aplikaci 20 mg 1x s. c. za týden a při aplikaci 60 mg 1x s. c. za měsíc (o 72 %) (45). Ve srovnání s placebem nebyl registrován žádný rozdíl v počtu nežádoucích účinků typu trombocytopenie, elevace jaterních testů, zhoršení renálních funkcí nebo flu-like symptomů. Nejčastějším vedlejším účinkem byla reakce v místě vpichu. V současné době probíhá studie Lp(a)HORIZON, která má zhodnotit účinek APO(a)-LRx na redukci KV rizika u asi 7 000 nemocných s ASKVO (2).
Mipomersen
Mipomersen byl jeden z prvních ASO, který byl schválen FDA pro léčbu homozygotní formy FH (36). Inhibuje produkci apo-B, čímž snižuje hladiny VLDL-C i LDL-C, redukuje počet LDL částic, a to zejména malých denzních LDL (sdLDL) (28). Snižuje významně také hladinu non-HDL-C, Lp(a) a zvyšuje koncentraci HDL-C. Na koncentraci TG má nekonzistentní vliv. Vzhledem k častým nežádoucím účinkům – nauzee, hepatopatiím (časté steatóze s elevací transamináz), reakcím v místě vpichu a flu-like symptomům byl stažen z trhu (28).
Další směry biologické léčby
Intenzivně probíhá výzkum nových technologií, např. již zmíněné metody CRISPR/Cas9, kde se jako vektory nejčastěji používají adenoviry nebo lentiviry. Na zvířecích modelech již byla úspěšně vyzkoušena inhibice genů pro PCSK9 a ANGPTL3 či reparace genů pro LDL receptor (36). K dalším perspektivním postupům se řadí tzv. non-coding RNA terapie. Zahrnuje jednak efekt microRNA (miRNA), které obsahují většinou 20–22 nukleotidů, a dále dlouhých non-coding RNA o délce až 200 nukleotidových bází. Působení miRNA se vysvětluje prostřednictvím jejich post-transkripční regulace genové exprese. Zatím byla u myší vyzkoušena miR-98 s cílem ovlivnit účinek SREBP 2 regulátoru, což vedlo k poklesu cholesterolu v séru i v játrech, a to bez indukce hepatotoxicity. Také injekce dlouhé non-coding RNA LeXis vedla s přispěním adenovirového vektoru (AAV8.hTBG.LeXis) k signifikantnímu poklesu hladin cholesterolu i TG, a dokonce i k ovlivnění aterosklerotických změn u pokusných myší (36).
Závěr
Kardiovaskulární choroby nadále patří mezi hlavní příčiny morbidity i mortality v rozvinutých zemích a dyslipidemie představují jeden z jejich kruciálních rizikových faktorů. V současné době máme v klinické praxi již velmi účinný arzenál hypolipidemik, včetně některých představitelů biologické léčby, které primárně cílí na hladiny LDL-C. Monoklonální protilátky proti PCSK9 se staly běžnou součástí léčby a v relativně krátké době se dá očekávat také nástup inclisiranu. Vývoj v této oblasti však nadále probíhá velmi dynamicky, a tak můžeme předpokládat, že se na trhu zanedlouho objeví též biologické prostředky, které budou cíleně zasahovat do produkce lipoproteinů bohatých na TG a do syntézy Lp(a). Moderní technologie pak budou zřejmě schopné pomocí genomické editace provést dlouhodobé změny genů, které se podílejí na syntéze, transportu, nebo metabolismu různých lipoproteinů. Další rozvoj biologické léčby dyslipidemií by měl umožnit nejen účinnější, komplexnější a personalizovanější terapeutický zásah, ale měl by vést i k používání bezpečnějších léků s minimem nežádoucích účinků. Mohl by také zvýšit adherenci pacientů díky pohodlnější aplikaci s využitím dlouhých dávkovacích intervalů. Je zřejmé, že pro širší klinické využití bude limitací především cena těchto preparátů.
Podpořeno MZ ČR – RVO (FNOL, 00098892).
KORESPONDENČNÍ ADRESA AUTORA:
prof. MUDr. David Karásek, Ph.D.
III. interní klinika – nefrologická, revmatologická a endokrinologická, LF UP a FN Olomouc
I . P. Pavlova 6, 779 00 Olomouc
Článek přijat redakcí: 22. 3. 2021
Článek přijat po recenzích: 9. 4. 2021
Sources
1. Davidson MH. Biologic therapies for dyslipidemia. Curr Atheroscler Rep 2004; 6 : 69–72.
2. Jia X, Liu J, Mehta A et al. Lipid-Lowering Biotechnological Drugs: from Monoclonal Antibodies to Antisense Therapies-a Clinical Perspective. Cardiovasc Drugs Ther 2020; doi: 10.1007/s10557-020-07082-x.
3. Navarese EP, Kolodziejczak M, Schulze V et al. Effects of Proprotein Convertase Subtilisin/ Kexin Type 9 Antibodies in Adults With Hypercholesterolemia: A Systematic Review and Meta-analysis. Ann Intern Med 2015; 163 : 40–51.
4. Squizzato A, Suter MB, Nerone M et al. PCSK9 inhibitors for treating dyslipidemia in patients at different cardiovascular risk: a systematic review and a meta-analysis. Intern Emerg Med 2017; 12 : 1043–1053.
5. Zhang J, Tecson KM, Rocha NA, McCullough PA. Usefulness of alirocumab and evolocumab for the treatment of patients with diabetic dyslipidemia. Proc (Bayl Univ Med Cent) 2018; 31 : 180–184.
6. Taskinen MR, Del Prato S, Bujas-Bobanovic M et al. Efficacy and safety of alirocumab in individuals with type 2 diabetes mellitus with or without mixed dyslipidaemia: Analysis of the ODYSSEY LONG TERM trial. Atherosclerosis 2018; 276 : 124–130.
7. Ray KK, Leiter LA, Müller-Wieland D et al. Alirocumab vs usual lipid-lowering care as add-on to statin therapy in individuals with type 2 diabetes and mixed dyslipidaemia: The ODYSSEY DM-DYSLIPIDEMIA randomized trial. Diabetes Obes Metab 2018; 20 : 1479–1489.
8. Sabatine MS, Giugliano RP, Keech AC et al. FOURIER Steering Committee and Investigators. Evolocumab and Clinical Outcomes in Patients with Cardiovascular Disease. N Engl J Med 2017; 376 : 1713–1722.
9. Sabatine MS, De Ferrari GM, Giugliano RP et al. Clinical Benefit of Evolocumab by Severity and Extent of Coronary Artery Disease: Analysis From FOURIER. Circulation 2018; 138 : 756–766.
10. Bonaca MP, Nault P, Giugliano RP et al. Low-Density Lipoprotein Cholesterol Lowering With Evolocumab and Outcomes in Patients With Peripheral Artery Disease: Insights From the FOURIER Trial (Further Cardiovascular Outcomes Research With PCSK9 Inhibition in Subjects With Elevated Risk). Circulation 2018; 137 : 338–350.
11. Giugliano RP, Pedersen TR, Park JG et al. FOURIER Investigators. Clinical efficacy and safety of achieving very low LDL-cholesterol concentrations with the PCSK9 inhibitor evolocumab: a prespecified secondary analysis of the FOURIER trial. Lancet 2017; 390 : 1962–1971.
12. Sabatine MS, Leiter LA, Wiviott SD et al. Cardiovascular safety and efficacy of the PCSK9 inhibitor evolocumab in patients with and without diabetes and the effect of evolocumab on glycaemia and risk of new-onset diabetes: a prespecified analysis of the FOURIER randomised controlled trial. Lancet Diabetes Endocrinol 2017; 5 : 941–950.
13. Charytan DM, Sabatine MS, Pedersen TR et al. FOURIER Steering Committee and Investigators. Efficacy and Safety of Evolocumab in Chronic Kidney Disease in the FOURIER Trial. J Am Coll Cardiol 2019; 73 : 2961–2970.
14. Schwartz GG, Steg PG, Szarek M et al. ODYSSEY OUTCOMES Committees and Investigators. Alirocumab and Cardiovascular Outcomes After Acute Coronary Syndrome. N Engl J Med 2018; 379 : 2097–2107.
15. Steg PG, Szarek M, Bhatt DL et al. Effect of Alirocumab on Mortality After Acute Coronary Syndromes. Circulation 2019; 140 : 103–112.
16. Jukema JW, Szarek M, Zijlstra LE et al. ODYSSEY OUTCOMES Committees and Investigators. Alirocumab in Patients With Polyvascular Disease and Recent Acute Coronary Syndrome: ODYSSEY OUTCOMES Trial. J Am Coll Cardiol 2019; 74 : 1167–1176.
17. Goodman SG, Aylward PE, Szarek M el al. ODYSSEY OUTCOMES Committees and Investigators. Effects of Alirocumab on Cardiovascular Events After Coronary Bypass Surgery. J Am Coll Cardiol 2019; 74 : 1177–1186.
18. Schwartz GG, Steg PG, Szarek M et al. ODYSSEY OUTCOMES Committees and Investigators. Peripheral Artery Disease and Venous Thromboembolic Events After Acute Coronary Syndrome: Role of Lipoprotein(a) and Modification by Alirocumab: Prespecified Analysis of the ODYSSEY OUTCOMES Randomized Clinical Trial. Circulation 2020; 141 : 1608–1617.
19. Bittner VA, Szarek M, Aylward PE et al. ODYSSEY OUTCOMES Committees and Investigators. Effect of Alirocumab on Lipoprotein(a) and Cardiovascular Risk After Acute Coronary Syndrome. J Am Coll Cardiol 2020; 75 : 133–144.
20. Ray KK, Colhoun HM, Szarek M et al. ODYSSEY OUTCOMES Committees and Investigators. Effects of alirocumab on cardiovascular and metabolic outcomes after acute coronary syndrome in patients with or without diabetes: a prespecified analysis of the ODYSSEY OUTCOMES randomised controlled trial. Lancet Diabetes Endocrinol 2019; 7 : 618–628.
21. Ridker PM, Revkin J, Amarenco P et al. SPIRE Cardiovascular Outcome Investigators. Cardiovascular Efficacy and Safety of Bococizumab in High-Risk Patients. N Engl J Med 2017; 376 : 1527–1539.
22. Ridker PM, Tardif JC, Amarenco P et al. SPIRE Investigators. Lipid-Reduction Variability and Antidrug-Antibody Formation with Bococizumab. N Engl J Med 2017; 376 : 1517–1526.
23. Cui Y, Huo Y, Li X et al. Tafolecimab, a novel potential long-acting PCSK9 monoclonal antibody: efficacy and safety in healthy and hypercholesterolemia subjects. Eur Heart J 2020; doi.org/10.1093/ehjci/ehaa946.3327.
24. Pisciotta L, Favari E, Magnolo L et al. Characterization of three kindreds with familial combined hypolipidemia caused by loss-of-function mutations of ANGPTL3. Circ Cardiovasc Genet 2012; 5 : 42–50.
25. Ahmad Z, Banerjee P, Hamon S et al. Inhibition of Angiopoietin-Like Protein 3 With a Monoclonal Antibody Reduces Triglycerides in Hypertriglyceridemia. Circulation 2019; 140 : 470–486.
26. Raal FJ, Rosenson RS, Reeskamp LF et al. ELIPSE HoFH Investigators. Evinacumab for Homozygous Familial Hypercholesterolemia. N Engl J Med 2020; 383 : 711–720.
27. Rosenson RS, Burgess LJ, Ebenbichler CF et al. Evinacumab in Patients with Refractory Hypercholesterolemia. N Engl J Med 2020; 383 : 2307–2319.
28. Macchi C, Sirtori CR, Corsini A et al. A new dawn for managing dyslipidemias: The era of rna-based therapies. Pharmacol Res 2019; 150 : 104413.
29. https://www.escardio.org/Journals/E-Journal-of-Cardiology-Practice/Volume-19/new - -drugs-coming-up-in-the-field-of-lipid-control.
30. Ray KK, Landmesser U, Leiter LA et al. Inclisiran in Patients at High Cardiovascular Risk with Elevated LDL Cholesterol. N Engl J Med 2017; 376 : 1430–1440.
31. Wright RS, Collins MG, Stoekenbroek RM et al. Effects of Renal Impairment on the Pharmacokinetics, Efficacy, and Safety of Inclisiran: An Analysis of the ORION-7 and ORION-1 Studies. Mayo Clin Proc 2020; 95 : 77–89.
32. Hovingh GK, Lepor NE, Kallend D et al. Inclisiran Durably Lowers Low-Density Lipoprotein Cholesterol and Proprotein Convertase Subtilisin/Kexin Type 9 Expression in Homozygous Familial Hypercholesterolemia: The ORION-2 Pilot Study. Circulation 2020; 141 : 1829–1831.
33. Raal FJ, Kallend D, Ray KK et al. ORION-9 Investigators. Inclisiran for the Treatment of Heterozygous Familial Hypercholesterolemia. N Engl J Med 2020; 382 : 1520–1530.
34. Ray KK, Wright RS, Kallend D et al. ORION-10 and ORION-11 Investigators. Two Phase 3 Trials of Inclisiran in Patients with Elevated LDL Cholesterol. N Engl J Med 2020; 382 : 1507–1519.
35. Graham MJ, Lee RG, Brandt TA et al. Cardiovascular and Metabolic Effects of ANGPTL3 Antisense Oligonucleotides. N Engl J Med 2017; 377 : 222–232.
36. Tirronen A, Hokkanen K, Vuorio T, Ylä-Herttuala S. Recent advances in novel therapies for lipid disorders. Hum Mol Genet 2019; 28: R49–R54.
37. Zwol WV, Rimbert A, Kuivenhoven JA. The Future of Lipid-lowering Therapy. J Clin Med 2019; 8 : 1085.
38. Witztum JL, Gaudet D, Freedman SD et al. Volanesorsen and Triglyceride Levels in Familial Chylomicronemia Syndrome. N Engl J Med 2019; 381 : 531–542.
39. Gouni-Berthold I, Alexander V, Digenio A et al. Apolipoprotein C-III inhibition with volanesorsen in patients with hypertriglyceridemia (COMPASS): a randomized, double-blind, placebo-controlled trial. Atheroscler Suppl 2017; 28: e1–e2.
40. Gelrud A, Digenio A, Alexander V et al. Treatment with volanesorsen (VLN) reduced triglycerides and pancreatitis in patients with FCS and sHTG vs placebo: results of the APPROACH and COMPASS. J Clin Lipidol 2018; 12 : 537.
41. https://ir.ionispharma.com/news-releases/news-release-details/akcea-and-ionis-report - top-line-results-broaden-study-waylivrar.
42. Alexander VJ, Xia S, Hurh E et al. N-acetyl galactosamine-conjugated antisense drug to APOC3 mRNA, triglycerides and atherogenic lipoprotein levels. Eur Heart J 2019; 40 : 2785–2796.
43. Tsimikas S, Viney NJ, Hughes SG et al. Antisense therapy targeting apolipoprotein(a): a randomised, double-blind, placebo-controlled phase 1 study. Lancet 2015; 386 : 1472–1483.
44. Viney NJ, van Capelleveen JC, Geary RS et al. Antisense oligonucleotides targeting apolipoprotein(a) in people with raised lipoprotein(a): two randomised, double-blind, placebo-controlled, dose-ranging trials. Lancet 2016; 388 : 2239–2253.
45. Tsimikas S, Karwatowska-Prokopczuk E, Gouni-Berthold I et al. AKCEA-APO(a)-LRx Study Investigators. Lipoprotein(a) Reduction in Persons with Cardiovascular Disease. N Engl J Med 2020; 382 : 244–255.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2021 Issue 4
-
All articles in this issue
- Použití léků vyvinutých pro jiné indikace v léčbě infekce covid-19
- Targeted and biological drugs in the treatment of inflammatory rheumatic diseases
- Treating inflammatory bowel diseases in the 21st century: individualized therapy and telemedicine
- Biologic therapy for dyslipidemia
- Monitoring the dynamics of clinical and laboratory markers of chronic heart failure during 12 months of sacubitril/valsartan treatment
- Importance and efficiency of blood pressure control not only in type 2 diabetes patients
- Giant cell arteritis: controversial issues
- Chronic obstructive pulmonary disease: diagnosis and treatment of stable phase of disease; personalized treatment approach using phenotype features of the disease Summary of the 2020–2021 Czech Pneumological and Phthiseological Society position paper
- Thymoma – disease of many faces
- An effective communication between the physician and the patient in an early intervention of hypertension and dyslipidemia
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Chronic obstructive pulmonary disease: diagnosis and treatment of stable phase of disease; personalized treatment approach using phenotype features of the disease Summary of the 2020–2021 Czech Pneumological and Phthiseological Society position paper
- Thymoma – disease of many faces
- Targeted and biological drugs in the treatment of inflammatory rheumatic diseases
- Biologic therapy for dyslipidemia
