Zánět a vaskulární onemocnění
Inflammation and vascular diseases
Chronic venous disease and cardiovascular atherothrombotic diseases have a high prevalence worldwide. The aetiopathogenesis of both these vascular conditions may share certain aetiopathogenetic moments. Abnormal blood flow, altered intravascular tension, and subsequent endothelial dysfunction may all play an important role. Another plausible alternative is the correlation of some risk factors of both diseases, in particular obesity and metabolic syndrome with all its components and an impact on atherogenesis as well as chronic venous disease. The relationship may even be causal, that is a chronic vessel wall inflammation which is present in advanced venous insufficiency might accelerate atherogenesis. On the other hand, altered haemodynamics in right ventricular dysfunction with a subsequent elevation in venous pressure can worsen or induce venous insufficiency, and/or undoubtedly cause symptoms and signs typical of chronic venous disease. As suggested by the findings published recently in the Gutenberg Health Study, particularly its subanalysis regarding the relationship of venous disease and cardiovascular diseases, the venous and arterial beds can be affected by common aetiopathogenetic factors or both the systems can interfere with each other.
Keywords:
Atherosclerosis – inflammation – chronic venous disease – atherothrombosis – Gutenberg Health Study
Authors:
Debora Karetová; Jan Bultas
Authors‘ workplace:
Ústav farmakologie 3. LF UK Praha
; II. interní klinika kardiologie a angiologie 1. LF UK a VFN Praha
Published in:
Vnitř Lék 2022; 68(5): 309-314
Category:
Review Articles
doi:
https://doi.org/10.36290/vnl.2022.065
Overview
Chronické žilní onemocnění a kardiovaskulární aterotrombotická onemocnění mají celosvětově vysokou prevalenci. V etiopatogenezi obou těchto cévních postižení se mohou uplatnit některé společné etiopatogenetické momenty. Významnou úlohu může hrát abnormální krevní tok, změna intravaskulární tenze a následně endoteliální dysfunkce. Nabízí i souvztažnost některých rizikových faktorů obou nemocí – především obezity a metabolického syndromu se všemi jeho složkami s dopadem na aterogenezi i chronické žilní onemocnění. Vztah může být i příčinný, a sice chronický zánět cévní stěny, který je přítomen u pokročilých stavů žilní nedostatečnosti, by mohl akcelerovat aterogenezi. Na straně druhé alterovaná hemodynamika při dysfunkci pravé srdeční komory s následnou elevací žilního tlaku může zhoršit či vyvolat žilní nedostatečnost, resp. nepochybně působit symptomy a znaky typické pro chronické žilní onemocnění. Jak naznačují nálezy recentně publikované Gutenberg Health Study, konkrétně její subanalýzy týkající se vztahu žilní nemoci a kardiovaskulárních onemocnění, žilní a tepenné řečiště může být ovlivněno společnými etiopatogenetickými faktory či se mohou oba systémy vzájemně ovlivňovat.
Klíčová slova:
ateroskleróza – zánět – chronické žilní onemocnění – aterotrombóza – Gutenberg Health Study
Tepenné a žilní řečiště většinou vnímáme z pohledu patologického postižení jako dva zcela odlišné systémy. Kardiolog se, s výjimkou tromboembolické nemoci, mnoho nezajímá o chronickou žilní nemoc (CVD, chronic venous disease) a flebolog na straně druhé nepátrá po známkách aterotrombózy. Nové poznatky z patofyziologie a zejména recentní epidemiologická data z Gutenberg Health Study ukazují, že oba systémy zdaleka nemusí být tak rozdílné. Nejen, že se mohou vzájemně ovlivňovat, ale mohou být i pod etiopatogenetickým vlivem stejných faktorů. Zatím se nabízí zejména vztah chronického závěru v žilní stěně ke zvýšenému riziku aterogeneze, resp. aterotrombotických příhod.
Zánět jako rizikový faktor vzniku a manifestace tepenné aterosklerózy a trombózy
Vztah zánětu, resp. přesněji řečeno reparačně/zánětlivého pochodu, k cévnímu postižení je významně vyjádřen v tepenném řečišti (zda i v žilním, není zcela jasné). Zánět je důležitým etiopatogenetickým momentem aterotrombózy. Jak ve fázi vlastní aterogeneze, tak při vzniku komplikující trombózy. Patofyziologický vztah probíhá na dvou úrovních. Jednak jde o chronický zánět na úrovni systému (např. chronická periodontitida, revmatoidní artritida či chronické zánětlivé střevní onemocnění typu IBD (inflammatory bowel disease), který aktivuje degenerativně proliferační proces ústící v aterosklerotické postižení, jednak probíhající reparačně/zánětlivé pochody v tepenné stěně spolupůsobí dysfunkci endotelu, vývoj plátu a zvyšují riziko jeho eroze či ruptury s potenciálně nasedající trombózou.
Ve vývoji plátu se uplatní řada imunitně aktivních buněk, dominují buňky hladké svaloviny, makrofágy a neutrofily. Aktivace svalových buněk systémovým či lokálním zánětlivým procesem vede k hyperprodukci matrix a jejich přeměně na fibroblasty (fibromyocyty) či makrofágy, resp. pěnové buňky. Posun rovnováhy od produkce nebuněčných struktur krytu plátu (kolagenních a elastických vláken) k iniciaci degradačních pochodů (nekrotizace buněk, proteolýza vláknitých struktur) hraje úlohu při destabilizaci plátu. Kolonizace subendoteliálních struktur v oblasti aterosklerotické léze makrofágy potencuje negativní vliv aktivované inflamazomové kaskády. V její aktivaci hraje významnou úlohu oxidovaný či jinak modifikovaný cholesterol a jeho krystaly v subendoteliální vrstvě. Výsledný stav – uvolněné interleukiny, vazoadhezivní molekuly, chemokiny, stejně jako řada imunocytů – akceleruje vývoj vlastní léze. Imunocyty se účastní produkcí řady interleukinů (zejm. IL-1β) akcelerujících inflamazomovou kaskádu, chemokinů atrahujících další buněčné elementy a v neposlední řadě např. neutrofily akcelerují hemostázu tvorbou neutrofilní extracelulární sítě (NET), tedy vláken rozvolněné DNA tvořící vysoce trombogenní povrch (Obr. 1) (1, 2). Byl užit méně běžný pojem „inflamazomová kaskáda“, je vhodné tento pojem alespoň základně osvětlit. Reparačně/zánětlivý proces slouží k obraně proti škodlivým faktorům a opravě vzniklých škod. K tomu slouží řada mechanismů, jedním z nich je právě inflamazomová kaskáda, tedy komplex signálních proteinů a odpovídajících receptorů, které spouští sérii dějů – od odstranění poškozených tkání apoptózou, přes aktivaci řady buněk (včetně endotelií a imunocytů) až po vlastní reparaci novotvorbou tkáně. Klíčovými signálními proteiny jsou zde interleukiny a C‑reaktivní protein či řada dalších molekul „akutní fáze“.
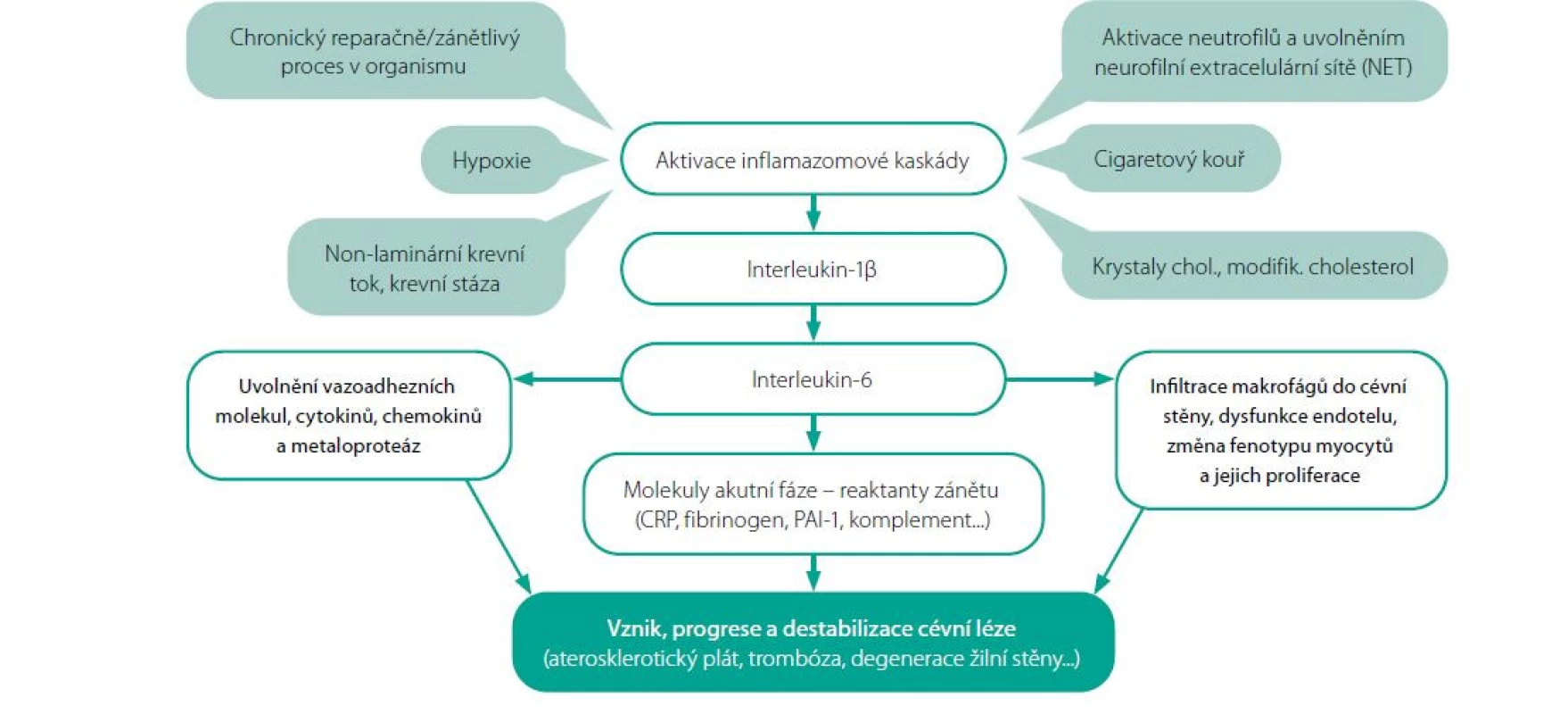
Vedle buněčných elementů je nutno zmínit řadu lokálních působků. Zejména ty, na které je úspěšně cílena farmakologická léčba, vedla jejich inhibice ke snížení výskytu aterotrombotických příhod. Chronickým zánětem aktivované endotelie uvolňují řadu cytokinů (zejm. interferony, interleukiny IL-1β či IL-6 a tumor necrosis factor TNFα), chemokinů a vazoadhezivních molekul (zejm. E‑selektin a P‑selektin, monocyty chemoatrahující protein MCP-1 či intercelulární adhezní molekula ICAM-1 a vaskulární adhezní molekula VCAM-1) účastnících se v rámci inflamazomové kaskády. Konkrétně přitahují monocyty do oblasti léze, kde umožňují jejich zrání a přeměnu na makrofágy a stimulují invazi dalších imunocytů do subendoteliálních prostor (3).
Jak je patrné, zánětlivě/reparační děj hraje významnou úlohu v patofyziologii řady cévních onemocnění. Zvýšením prostupnosti pro buněčné i nebuněčné elementy (zejm. imunocyty a lipoproteiny typu LDL) akceleruje tvorbu aterosklerotických lézí. Uvolněním metaloproteáz z monocytů/makrofágů se účastní na jejich destabilizaci a aktivaci protrombotických pochodů. V neposlední řadě inhibicí fibrinolýzy se zvyšuje riziko trombotické okluze.
Jak významný je vztah mezi přítomností chronického zánětu a rizikem aterotrombotické příhody?
Celá plejáda chronických onemocnění provázených aktivací reparačně/zánětlivého procesu je spojována s významně vyšším výskytem vaskulárních chorob, nejen na bázi aterotrombózy, ale konsenzus expertů konstatuje také vyšší výskyt fibrilace síní či srdečního selhání (4). To platí zejména pro periodontitidu, revmatoidní artritidu, zánětlivé střevní onemocnění (IBD) nebo také psoriázu. V databázi PUBMED lze nalézt několik tisíc článků věnovaných této problematice. Nejlépe je doložen vztah periodontitidy a aterotrombotických onemocnění v kardiovaskulární, cerebrovaskulární či periferní lokalizaci. Přehledná analýza dokládá vztah mezi tíží periodontitidy a aterotrombotickými příhodami; zde přítomnost závažné paradentózy zvýšila výskyt velkých vaskulárních příhod více než dvojnásobně, středně těžké postižení zvýšilo riziko asi o 60 % (5). Většina studií analyzovala vztah k výskytu infarktu myokardu. Výskyt ischemického (trombotického či kardioembolizačního) iktu byl zvýšen více než dvojnásobně a incidence ischemické choroby dolních končetin (ICHDK) stejně, více než dvojnásobně (4). Lze tak konstatovat, že dobrý stomatolog, resp. parodontolog, je pro prognózu nemocného stejně významný jako kardiolog.
Obdobná data jsou k dispozici též pro chronický zánět v jiných lokalizacích, např. pro kožní lokalizaci psoriázy. U těchto pacientů je riziko aterotrombotické příhody zvýšeno lehce nad 50 % (6). Léčba monoklonálními protilátkami blokujícími TNFα vedla ke snížení rizika kardiovaskulárních příhod o polovinu, při srovnání se skupinou psoriatiků takto neléčených (7). Doložen je i vztah střevních zánětů či revmatické polyartritidy k aterotrombotickému postižení.
Efekt farmakoterapie cílené na potlačení reparačně/ zánětlivé kaskády
Vztah přítomnosti chronického reparačně/zánětlivého procesu a akcelerace aterogeneze (se zvýšením rizika aterotrombotických příhod) byl doložen jak experimentálně, tak na základě epidemiologických dat. Dalším logickým krokem je zodpovězení otázky, zda cílená protizánětlivá léčba sníží výskyt cévních příhod a zlepší prognózu nemocných. Již bylo zmíněno, že cílená léčba systémové zánětlivé choroby, například periodontitidy, vede ke snížení výskytu velkých aterotrombotických příhod. Podobně bylo zjištěno, že inhibice TNFα vedla ke snížení koronárních příhod.
Dlouho se ví, že léčba řadou hypolipidemik, například inhibitory syntézy cholesterolu – statiny, inhibitory konvertázy PCSK9 zvyšující nabídku LDL‑receptoru či inhibice syntézy aterogenního lipoproteinu Lp(a) – pelacarsenem mají významný protizánětlivý efekt. Všechna tato hypolipidemika též významně a srovnatelně snižují koncentraci C‑reaktivního proteinu (CRP). Do jaké míry se tento efekt spolupodílí na snížení výskytu aterotrombotických příhod, není jasné.
Rozhodující je proto otázka, zda léčba cílená na potlačení zánětu sníží vaskulární postižení. Léčba může cílit na inhibici cytokinové kaskády: TNFα – NFΚB – IL-1β – IL-6 – molekuly akutní fáze zánětu nebo na buněčnou složku, tedy na potlačení imunocytů. Prvou strategii zastupuje canakinumab, monoklonální protilátka proti IL-1β, druhou kolchicin, inhibující mitózu a proliferaci zánětlivých buněk.
Řada klinických studií doložila, že jak canakinumab, tak kolchicin u nemocných s aterosklerotickým postižením snížily řadu ukazatelů intenzity zánětu (CRP, vazoadhezivních molekul, interleukinů apod.) a současně snížily výskyt velkých aterotrombotických příhod (Tab. 1) (8–11).
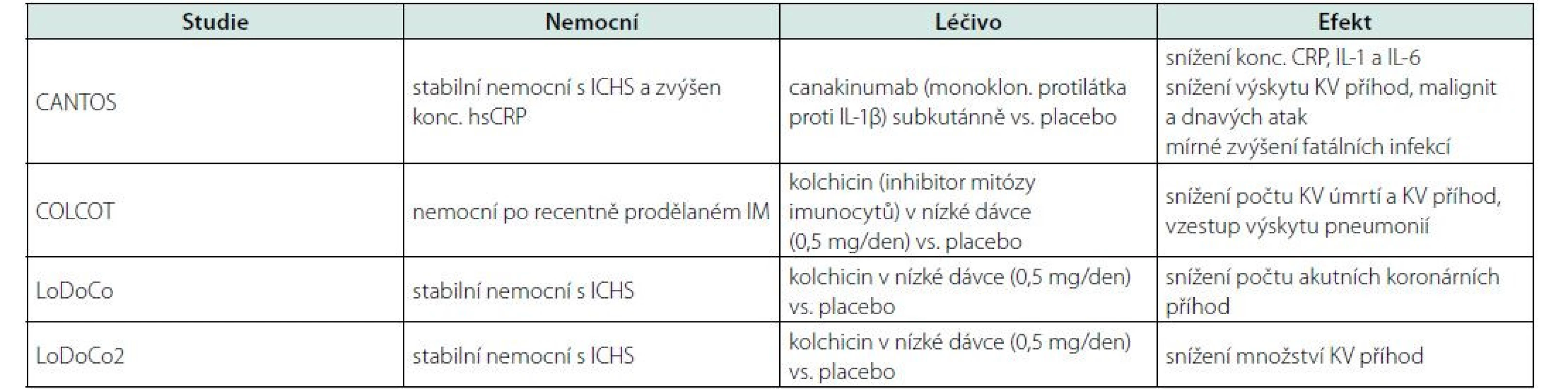
Tyto studie doložily, že zánětlivě/reparační proces s aktivací inflamazomu a uvolněním řady cytokinů a aktivací imunocytů má příčinný vztah k etiopatogenezi aterotrombotického postižení. Máme nejen experimentální a epidemiologická data, ale též doklad o účinnosti farmakologického zásahu.
Zánět jako následek přítomnosti žilní hypertenze u nemocných s chronickým žilním onemocněním
Chronické žilní onemocnění (chronic venous disease – CVD) zahrnuje velké spektrum onemocnění, která se vyznačují morfologickými a funkčními abnormitami žilního systému. Chronické žilní nemoci jsou v populaci velmi frekventní. Dle dat z Vein Consult Program (mezinárodní observační studie u více než 90 000 jedinců) jde celosvětově o vysokou prevalenci patologických stavů v různém rozsahu, dosahující až 80 %. Choroba neohrožuje prognózu končetiny, ale je spojena s poklesem kvality života a ve stadiu vředů nese i vysoké náklady na zdravotní péči. Rizikových faktorů vzniku je řada, ale dominuje ženské pohlaví (a související počet těhotenství), heredita, věk, tromboembolická anamnéza/dispozice, obezita a také celkový hemodynamický stav organismu. Stran hlavních příčin vzniku lze chronické žilní onemocnění členit na degenerativní (s vlivy výše uvedených rizikových faktorů), postihující zejména povrchové žíly, a na potrombotická, postihující zejména hluboké žíly. Trombogeneze, ať již v systému hlubokém, ale i povrchovém, může mít úzkou souvislost se zánětem v těle.
Chronické žilní onemocnění se liší morfologickým vyjádřením – od téměř neznatelných venektázií přes varixy po těžké kožní změny a možné ulcerace. Mohou se komplikovat jak trombózou těchto distendovaných povrchových žil (dříve varikoflebitis – tromboflebitis superficialis), tak poruchou kožního krytu, ale i lokálním krvácením, ať již spontánním, nebo vzniklém po malém inzultu. Klasifikace nemoci je prováděna systémem CEAP, kde „C“ vyjadřuje klinický obraz (C0-C6, od teleangiektázií přes varixy, edémy, kožní změny, po ulcerace), „E“ vyjadřuje etiologii (primární nebo sekundární), „A“ popisuje anatomický rozsah a „P“ vyjadřuje patofyziologii problému (zda jde o reflux, žilní okluzi, případně kombinaci obou).
Patofyziologie zánětu u chronických žilních onemocnění (CVD)
Patofyziologie chronických žilních onemocnění je dána kaskádou, na jejímž začátku je abnormita centripetálního žilního toku. Ta může mít různé příčiny, nejobvyklejší je venózní reflux u inkompetentních žilních chlopní, které přestanou plnit svoji roli v usměrnění žilního návratu. To vede ke stáze žilní krve, následně lokální hypoxii a rozvoji zánětlivě reaktivních změn endotelu žil a infiltraci intersticiálních prostor imunocyty (zejm. makrofágy, T ‑ lymfocyty a mastocyty), fibromyocyty a dalšími buňkami účastnícími se přestavby žilní stěny a podkoží. Zvýšený žilní tlak vede rovněž k aktivaci řady enzymů a uvolnění lokálních působků zvyšujících permeabilitu stěny žilních venul a ke změně složení intersticia. Aktivace lokálních tkáňových zánětlivých změn a porušení hemodynamiky vede k otokům, vyvíjejí se kožní změny (dermatitis, pigmentace, atrofie a venózní ulcerace) a krevní stáza může aktivovat koagulaci ve smyslu nevýhodné mikrotrombotizace (12).
Dalším významným mechanismem vzniku žilní hypertenze je obstrukce lumen, zejména v oblasti hlubokých žil (např. v rámci potrombotického syndromu). Důležitým podpůrným momentem vzniku žilní hypertenze je absence funkční žilně svalové pumpy (relativně častý stav vzniku žilní nemoci u nechodících nemocných z rozličných neurologických, ortopedických nebo revmatologických příčin), která za normálních okolností podstatně přispívá k žilnímu návratu.
Na celém ději se podílí i abnormální tok krve, resp. kontakt krevních elementů s endoteliemi žilní stěny. Za normálních podmínek žilního toku zůstávají leukocyty v klidovém stavu a produkují pouze malá množství adhezivních molekul. Zdravé endotelie fyziologicky přispívají průchodnosti a přiměřenému tonu produkcí protizánětlivých a antitrombotických působků (zejména oxidu dusnatého a prostacyklinu). Za patologických stavů vede abnormální shear stres ke zvýšení adhezivity leukocytů a jejich migraci, k produkci zánětlivých cytokinů. Perzistentní akumulace leukocytů (zejména T lymfocytů a makrofágů) v tkáních kolem postkapilárních venul je dokladem chronického zánětlivého stavu a následných lipodermatosklerotických změn. Následkem abnormální hemodynamiky lze pozorovat i trvalou dilataci, elongaci a tortuozitu v oblasti kapilárního řečiště (13).
Chronické žilní onemocnění tak v současnosti vnímáme jako onemocnění vznikající především na základě abnormálních tlakových poměrů v tomto řečišti, ať již primárním činitelem byl jakýkoliv moment iniciace vzestupu (obstrukce, reflux či pravostranné srdeční selhání). Přestavba žilní stěny, její dilatace, zvýšení mikrovaskulární permeability a trofické změny intersticia jsou zásadními ději při vzniku a rozvoji zánětu.
Vztah chronické žilní nemoci a dalších komorbidit
V literatuře lze nalézt práce zkoumající vliv přítomnosti diabetes mellitus na vznik a průběh chronické žilní nemoci. Změny u CVD jsou v mnoha ohledech podobné změnám u diabetické mikroangiopatie. U obou chorob dochází k remodelaci cévní stěny, poruše krevního toku, zvýšení oxidativního stresu, cévnímu zánětu a zvýšené permeabilitě endotelu. Patologicky zvýšená adhezivita leukocytů iniciuje zánětlivou reakci, mění endoteliální fenotyp a vede ke zmíněnému prozánětlivému a prokoagulačnímu stavu. Je přítomna destičková hyperagregabilita díky vzestupy hladin von Willebrandova faktoru, je snížena spontánní fibrinolýza, dochází k upregulaci prokoagulačních faktorů (14).
Koexistenci CVD a diabetes mellitus (DM) zkoumalo několik studií. Diabetes mellitus 2. typu je přítomen u 10–30 % nemocných s CVD a může být určitým rizikovým faktorem progrese žilního onemocnění. U nemocných se současným DM 2. typu a chronickým žilním onemocněním jsou změny mikrocirkulace výraznější než u nemocných s CVD bez diabetu (15). Obě tyto populace disponují ke vzniku lokální tkáňové hypoxie a vzniku ulcerací díky alteraci funkce kolagenu a imunitních reakcí. Společnými znaky jsou abnormální (mikro)cirkulace, ztluštění cévní stěny, edém a hypoxie. Vzniklý edém, typicky přítomný u CVD a žilních ulcerací, následně přetíží kapacitu lymfatické drenáže. Tento moment nevýhodně zvyšuje akumulaci makromolekul a cytokinů v cévním intersticiu (16).
Podobně je zkoumán vliv obezity na vznik a progresi chronického žilního onemocnění. Často u obézních nemocných není jednoznačně žilní patologie (reflux, obstrukce, nebo dilatace v povrchovém nebo hlubokém systému) při duplexní sonografii vyjádřena, nicméně klinický obraz pro ni svědčí (edémy vznikající v druhé polovině dne, při delší vertikalizaci apod.). Trvalé hemodynamické změny při zvýšeném intraabdominálním tlaku a defektní funkci žilně svalové pumpy (nebo absenci jejího využití při převážném sezení/stání, zejména u morbidně obézních) mohou být vysvětlením problému. Také ale zmnožení perivaskulární tukové tkáně s nadprodukcí angiogenních a zánětlivých faktorů se mohou na problému negativně účastnit (17).
Ovlivňuje chronický žilní zánět při CVD celkovou prognózu nemocných?
V letech 2012–2017 probíhala v Německu prospektivní, populační studie posuzující u 12 423 účastníků změny na končetinách svědčící pro chronickou žilní nemoc, s jejich následným zařazováním do systému CEAP klasifikace. Dále měla tato studie za cíl posoudit přítomnost rizikových faktorů jak vzniku CVD, tak KVO (kardiovaskulární onemocnění). Tato epidemiologická studie Prochasky a kol., týkající se vztahu CVD a kardiovaskulárního onemocnění, byla součástí velké studie prováděné na univerzitě v Mainzu, která je označována jako Gutenberg Health Study. Jde o průřezovou analýzu obecné populace ve věku mezi 40–80 lety. Nebyla žádná vylučovací kritéria, posuzovaní museli být schopni pouze přijít k vyšetření a souhlasit s účastí. Bylo rovnocenné zastoupení mužů i žen (51,2 % mužů), průměrný věk byl 59,5 roku (± 10,8 let).
Prevalence CVD byla kalkulována specificky pro obě pohlaví a pro určitý věk. Bez známek žilní choroby bylo pouze 906 vyšetřených (stadium C0 dle klasifikace CEAP), teleangiektázie nebo retikulární varixy (C1, C2) mělo 3 756 osob, významné varixy s edémy byly u 1 399 osob (C3). Známky pokročilého onemocnění – tedy chronické žilní insuficience (CVI) – byly přítomny u 4 603 nemocných (C3–C6), z nichž většina – 3 361 – vykazovala edém (C3) a 1 242 mělo již i kožní změny (C4–C6). Nemocní s CVI byli starší a častěji u nich byly přítomny tradiční rizikové faktory kardiovaskulárního onemocnění (arteriální hypertenze, diabetes mellitus, dyslipidemie, pozitivní rodinná anamnéza KV chorob, obezita a kouření), také měli vyšší prevalenci již přítomných kardiovaskulárních nemocí. Hlavními determinantami chronické venózní insuficience (CVI) byl věk, ženské pohlaví, přítomnost arteriální hypertenze, obezity, kouření a existence jakéhokoliv kardiovaskulárního onemocnění.
Vztahy mezi rozsahem žilního onemocnění (dle CEAP klasifikace), vyjádřenými rizikovými faktory KV onemocnění a již přítomnými komorbiditami, byly vyhodnoceny regresní analýzou. Věk a ženské pohlaví byly nezávislými prediktory všech stadií CVD. Chronická žilní insuficience byla nezávisle asociovaná s arteriální hypertenzí, obezitou, aktivním kouřením a také s kardiovaskulárním onemocněním, zejména s přítomností ischemické choroby dolních končetin a žilním trombembolismem.
Dále byla studována přítomnost CVD ve smyslu prediktoru kardiovaskulární nemoci a úmrtí. V modelu mutivariantní regrese s adjustací na věk, pohlaví a tradiční KV rizika byla CVD nezávisle asociována s přítomností manifestního kardiovaskulárního onemocnění. Predikované riziko (na základě Framinghamského skóre), související s přítomností ischemické choroby srdeční, rostlo s narůstající tíží CVI.
Studie ještě prospektivně stanovila riziko celkové mortality ve vztahu k CVD. Během 6,4 ± 1,6 let bylo registrováno 540 úmrtí. Mortalita byla signifikantně vyšší u nemocných ve stadiích žilní insuficience (C3–C6), v porovnání s jedinci bez známek žilní nemoci, a to dokonce trojnásobně. Chronická žilní nemoc, i po adjustaci na tradiční rizikové KV faktory, přítomnost KV manifestních onemocnění a malignity, zůstala nezávislým prediktorem celkové mortality (18).
Hlavním výsledkem této velké populační studie jsou tyto závěry:
• chronická žilní nemoc ve stadiu žilní insuficience (tedy v klasifikaci CEAP jde o stadia C3–C6) je v populaci vysoce prevalentní (36,5 %),
• kardiovaskulární nemoci a chronická žilní nedostatečnost sdílejí některé rizikové faktory vzniku; jde o věk a obezitu, liší se však vliv pohlaví,
• během sledování v délce 6,4 roků (± 1,6) se zjistilo, že vyjádřená CVI je silným prediktorem celkové mortality, bez ohledu na klinický profil nemocného a souběžnou medikaci.
Závěr
Aterogeneze a aterotrombóza jsou zásadními procesy vzniku kardiovaskulárních chorob. V rozvoji aterosklerózy se uplatňují tradiční rizikové faktory a hledají se další. Mezi ně patří systémový zánět. Ateroskleróza je v současnosti vnímána jako chronické onemocnění, provázené mírným stupněm zánětu. Intervence by pak měla zahrnout kontrolu jak konvenčních rizikových faktorů, tak těch, které působí reziduální riziko.
Chronické žilní onemocnění je v pokročilých stadiích provázeno zánětem v oblasti intersticia končetin. Základním a jednotícím momentem jeho vzniku je žilní hypertenze, která však může mít řadu příčin – lokálních v rámci končetin, ale i celkových (zejména kardiálních). U žilních onemocnění vnímáme jako velmi významné faktory rozvoje kromě věku zejména hereditu, ženské pohlaví a související těhotenství, dále typ zaměstnání. U kardiaků, zejména ve stadiu srdeční nedostatečnosti (zejména pravostranné), je následkem alterované hemodynamiky přítomna také žilní hypertenze, která vede k přetížení a zánětu, s dosahem do mikrocirkulace a intersticia.
Zánětlivý proces obecně (infekční i imunitně podmíněný) je vnímán jako prokoagulační stav a v oblasti tepenného řečiště může iniciovat trombotickou okluzi a také měnit stabilitu existujících aterosklerotických plátů.
Léčebné strategie v oblasti cévní jsou společné ve smyslu úpravy endoteliální dysfunkce na podkladě abnormálního krevního toku a negativních vlivů metabolických (v tepenném řečišti jde zejména o léčbu dyslipoproteinemie, arteriální hypertenze a intervenci nikotinismu), dále jde o zlepšení hemoreologických vlastností krve a léčbu případné alterace hemodynamické (léčba srdeční insuficience ke zmírnění progrese žilní nemoci). To vše by mělo vést ke snížení zánětu ve stěně cévní i v tkáních.
Protizánětlivá léčba – jak v oblasti tepen (statin a další hypolipidemika, kolchicin, canakinumab), tak v oblasti žil se stává součástí komplexní intervence.
Podpora PROGRES Q38
KORESPONDENČNÍ ADRESA AUTORA:
doc. MUDr. Debora Karetová, CSc.
1. lékařská fakulta UK
Kateřinská 1660/32, 121 08 Praha 2
Cit. zkr: Vnitř Lék. 2022;68(5):309-314
Článek přijat redakcí: 30. 5. 2022
Článek přijat po recenzích: 12. 7. 2022
Sources
1. Geovanini GR, Libby P. Atherosclerosis and inflammation: overview and updates. Clin Sci (Lond). 2018 Jun 21;132(12):1243-1252. doi: 10.1042/CS20180306.
2. Bai B, Yang Y, Wang Q, Li M, Tian C, Liu Y, Aung LHH, Li PF, Yu T, Chu XM. NLRP3 inflammasome in endothelial dysfunction. Cell Death, DiS. 2020 Sep 18;11(9):776. doi: 10.1038/s41419-020-02985-x.
3. Marchio P, Guerra‑Ojeda S, Vila JM et al, Targeting Early Atherosclerosis: A Focus on Oxidative Stress and Inflammation. Oxid Med Cell Longev. 2019 Jul 1;2019 : 8563845.
4. Sanz M, Del Castillo AM, Jepsen S, et al. Periodontitis and Cardiovascular Diseases. Consensus Report. Glob Heart. 2020;15(1):1.
5. Dietrich T, Sharma P, Walter C et al. The epidemiological evidence behind the association between periodontitis and incident atherosclerotic cardiovascular disease. Journal of Clinical Periodontology. 2013;40:S70-84
6. Garshick MS, Ward NL, Krueger JG et al. Cardiovascular Risk in Patients With Psoriasis: JACC Review Topic of the Week. J Am Coll Cardiol. 2021;77(13):1670-1680.
7. Wu JJ, Poon KY, Channual JC, Shen AY. Association between tumor necrosis factor inhibitor therapy and myocardial infarction risk in patients with psoriasis. Arch Dermatol 2012;148 : 1244-50.
8. Ridker, PM et al. Antiinflammatory therapy with canakinumab for atherosclerotic disease. N Engl J Med. 2017; 377 : 1119-1131.
9. Tardif JC. et al. Efficacy and safety of low - dose colchicine after myocardial infarction. N Engl J Med. 2019;381 : 2497-2505.
10. Nidorf SM, Eikelboom JW, Budgeon CA et al. Low - dose colchicine for secondary prevention of cardiovascular disease. J Am Coll Cardiol. 2013;61 : 404-410.
11. Nidorf SM et al. Colchicine in patients with chronic coronary disease. N Engl J Med. 2020;383 : 1838-1847.
12. Tisato V, Zauli G, Voltan R et al. Endothelial cells obtained from patients affected by chronic venous disease exhibit a pro‑inflammatory phenotype. PLoS ONE 2012, 7, e39543.
13. Raffetto JD, Mannello F. Pathophysiology of chronic venous disease. Int Angiol. 2014;33(3):212-221.
14. Kaur R, Kaur M, Singh J. Endothelial dysfunction and platelet hyperactivity in type 2 diabetes mellitus: molecular insights and therapeutic strategies. Cardiovasc Diabetol 2018;17 : 121.
15. Reka IE, Imre M. Socio‑demographic Characteristics of Patients Diagnosed with Advanced Chronic Venous Insufficiency (C4-C6) Correlated with Clinical and Para‑clinical Findings. Acta Marisiensis Ser Medica. 2015;61 : 94-99.
16. Singer AJ, Tassiopoulos A, Kirsner RS. Evaluation and Management of Lower‑Extremity Ulcers. N Engl J Med 2017;377 : 1559-1567.
17. Saxton SN, Clark BJ, Withers SB, Eringa EC, Heagerty AM. Mechanistic Links Between Obesity, Diabetes, and Blood Pressure: Role of Perivascular Adipose Tissue. Physiol Rev 2019;99 : 1701-1763.
18. Prochaska JH, Arnold N, Falcke A, Kopp S, Schulz A, Buch G, Moll S, PanovaNoeva M, Junger C, Eggebrecht L, Pfeiffer N, Beutel M, Binder H, Grabbe S, Lackner KJ, Cate‑Hoek A, Espinola‑Klein C, Munzel T, Wild PS. Chronic venous insufficiency, cardiovascular disease, and mortality: a population study. Eur Heart J 2021;doi:10.1093/eurheartj/ehab495
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2022 Issue 5
-
All articles in this issue
- Hlavní téma – Aktuality v revmatologii
- Léčba obrovskobuněčné arteriitidy – současnost a otevírající se možnosti
- Co nového v léčbě systémového lupus erytematodes?
- Novinky v léčbě axiálních spondyloartritid
- Časná diagnostika systémové sklerodermie
- Difuzní alveolární hemoragie jako život ohrožující manifestace nově diagnostikované granulomatózy s polyangiitidou navazující na infekci covid-19 – kazuistika
- Co je nového v doporučeních ESC 2021 pro kardiovaskulární prevenci?
- Proč brát vážně orgánové poškození u hypertenze?
- Zánět a vaskulární onemocnění
- Time in range: nový parametr v diabetologii
- Co je nového v Doporučených postupech ESC 2020 pro diagnostiku a léčbu akutních koronárních syndromů bez ST elevací?
- Diferenciální diagnostika bolestí zad
- Entresto (sakubitril-valsartan) získalo prestižní mezinárodní Galénovu cenu za nejlepší farmaceutický produkt pro rok 2022
- XXXIX. dny mladých internistů v Martině
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Diferenciální diagnostika bolestí zad
- Časná diagnostika systémové sklerodermie
- Co je nového v doporučeních ESC 2021 pro kardiovaskulární prevenci?
- Co nového v léčbě systémového lupus erytematodes?
