Črevný mikrobióm a transplantácia obličky
Gut microbiome and renal transplantation
Gut microbiome research has been a surge of interest in many branches of medicine in the last decade. Our main aim is to show ability of microbes to infuence the functions of human body, especially in the immune system, and on the other hand to clarify changes in composition of gut microbiome in the post-transplantation period and their function for the long-term survival of the graft and the patient in the context of the occurrence of a wide range of complications.
Kidney transplantation with the subsequent use of immunosuppressants and antibiotics affects the composition of gut microbiome. The subsequent development of dysbiosis significantly increases the risk of acute rejection, interstitial fibrosis and tubular atrophy of the graft, post-transplant diarrhoea, organ´s infections and metabolic complications such as post-transplant diabetes mellitus.
Also important is the influence of the microorganisms of the gut microbiome on metabolism of immunosuppressants with the production of less effective components and the subsequent necessity of modifying their levels with a higher risk of underdosing and the occurrence of graft rejection. Support of the composition of the gut microbiome in the post-transplantation period in favor of bacteria producing short chain fatty acids (SCFA) is possible by changing of diet with predominance of fiber, the application of probiotics, prebiotics.
According to available studies, it can lead to benefits in term of metabolic compensation, to the induction of donor-specific tolerance and many others, with an overall improvement in the quality of patient and graft survival.
Keywords:
dysbiosis – kidney transplantation – gut microbiome – immunosuppressants – SCFA
Authors:
Patrícia Kleinová 1,2; Monika Beliančinová 1,2; Matej Vnučák 1,2; Karol Graňák 1,2; Ivana Dedinská 1,2
Authors‘ workplace:
Transplantačné centrum Univerzitná nemocnica Martin
1; I. interná klinika, Univerzitná nemocnica Martin a Jesseniova lekárska fakulta Univerzity Komenského, Martin
2
Published in:
Vnitř Lék 2023; 69(1): 41-46
Category:
Case reports
doi:
https://doi.org/10.36290/vnl.2023.006
Overview
Výskum črevného mikrobiómu zaznamenal v poslednej dekáde vzostup záujmu v mnohých odvetviach medicíny. Naším hlavným cieľom je poukázať na schopnosť mikróbov širokospektrálne ovplyvniť funkcie ľudského organizmu, najmä imunitného systému, a naopak, objasniť zmeny zloženia črevného mikrobiómu v potransplantačnom období a ich funkciu na dlhodobé prežívanie štepu a pacienta v kontexte výskytu širokého spektra komplikácií.
Transplantácia obličky s následným užívaním imunosupresív a antibiotík (ATB) do značnej miery ovplyvňuje kompozíciu črevného mikrobiómu. Následný vznik dysbiózy signifikantne zvyšuje riziko rozvoja akútnej rejekcie, intersticiálnej fibrózy a tubulárnej atrofie štepu (IF/TA – interstitial fibrosis and tubular atrophy), potransplantačnej hnačky, orgánových infekcií a metabolických komplikácií ako je potransplantačný diabetes mellitus. Dôležitý je tiež vplyv mikroorganizmov črevného mikrobiómu na metabolizmus imunosupresív s produkciou menej efektívnych komponentov, a následnou nutnosťou modifikácie ich hladín s vyšším rizikom poddávkovania a vzniku rejekcie štepu.
Podpora zloženia črevného mikrobiómu v potransplantačnom období v prospech baktérií produkujúcich mastné kyseliny s krátkym reťazcom (SCFA – short chain fatty acids) je možná zmenou zloženia stravy s prevahou vlákniny, aplikáciou probiotík, prebiotík. Podľa dostupných štúdií môže viesť k benefitom v zmysle metabolickej kompenzácie, navodeniu donor‑špecifickej tolerancie a množstvo iných, s celkovým zlepšením kvality prežívania pacienta a štepu.
Klíčová slova:
imunosupresiva – dysbióza – Transplantácia obličky – črevný mikrobióm – SCFA
Zoznam použitých skratiek
ATB – antibiotikum
BPG – butyrate-producing gut bacteria – butyrát-produkujúce črevné baktérie
DM 2 – diabetes mellitus 2. typu
E. coli – Escherichia coli
ESKD – end-stage kidney disease – terminálne zlyhanie obličiek
FAO – Food and Agriculture Organization – Organizácia pre výživu a poľnohospodárstvo
FMT – fekálna mikrobiálna transplantácia
GLP-1 – glucagon-like peptid 1 – glukagónu podobný peptid
GPR – receptor asociovaný s G-proteínom
IEC – intestinal epithelial cells – interstinálne epitelové bunky
IF/TA – interstitial fibrosis and tubular atrophy – intersticiálna fibróza a tubulárna atrofia
IFN-γ – interferón γ
Ig – imunoglobulín
IL – interleukín
ILC – innate lymphoid cells – vrodené lymfoidné bunky
LP – lamina propria
LPS – lipopolysacharidy
MMF – mykofenolát mofetil
Olfr78 – olfactory receptor 78 – čuchový receptor 78
PCR – polymerase chain reaction – polymerázová reťazová reakcia
PPI – inhibítor protónovej pumpy
SCFA – short chain fatty acids – mastné kyseliny s krátkym reťazcom
TAC – tacrolimus – takrolimus
Tfh – folikulárne T-helpery
TGF-β – transforming growth factor β – transformujúci rastový factor β
Th – T-helper
TLR receptor – toll-like receptor
TMAO – trimetylamín N oxid
TNF-α – tumor-necrosis factor α – tumor nekrotizujúci faktor α
Treg – T-regulačné lymfocyty
UNM – Univerzitná nemocnica Martin
WHO – World Health Organization – Svetová zdravotnícka organizácia
Úvod
V odbornej verejnosti sa čoraz častejšie stretávame s pojmami ako sú mikrobiota a mikrobióm. V minulosti boli tieto termíny nezriedka chybne používané v domnení rovnakého významu, pričom ich rozdiel je signifikantný. Dnes v odbornej literatúre dominuje najmä ekologická definícia mikrobioty a mikrobiómu. Mikrobiota predstavuje súbor mikroorganizmov z rôznych ríš zahŕňajúc vírusy, baktérie, archeóny, baktériofágy, prvoky a huby, s ktorými sa stretávame v každej orgánovej sústave ľudského tela, čo predstavuje približne 3,8×1013 mikróbov. Mikrobióm je definovaný ako charakteristická mikrobiálna komunita s osídlením presne definovaného biotopu s odlišnými fyzikálno‑chemickými vlastnosťami. Mikrobióm nie je limitovaný len na mikroorganizmy, ale zahŕňa aj celé spektrum molekúl produkovaných mikroorganizmami (signálne molekuly, toxíny, organické a anorganické molekuly), vrátane ich štrukturálnych prvkov (proteíny, lipidy, polysacharidy a nukleové kyseliny). Ide o dynamický a interaktívny mikroekosystém, ktorý varíruje v rozsahu a čase, a jeho integrácia do makroekosystému – ľudský organizmus, je rozhodujúca pre funkciu imunitného systému, a tým aj toleranciu štepu po transplantácii obličky. Stav dysbiózy, keď nachádzame nerovnováhu medzi patogénnymi a protektívnymi mikróbami, tak môže vyvolať, prípadne zhoršiť množstvo ochorení. Zloženie mikrobiómu je dané genetickou výbavou jedinca, avšak z väčšej časti ho môžeme modifikovať vplyvom vonkajších faktorov (lieky – antibiotiká, imunosupresíva, strava, životný štýl, stresové faktory, narušenie spánkového režimu, atď.). Zistenie, akým spôsobom a do akej miery môžeme zlepšiť zloženie mikrobioty, nám môže následne pomôcť ovplyvniť výskyt infekčných komplikácií, rozvoj akútnej rejekcie až straty štepu v potransplantačnom období (1, 2).
Funkcie mikrobiómu
Medzi hlavné funkcie zabezpečované črevným mikrobiómom patrí štrukturálna, metabolická a imunitná funkcia. Zo štrukturálneho hľadiska je črevný mikrobióm súčasťou vlastnej hlienovej vrstvy v gastrointestinálnom trakte. Zabezpečuje dostatočnú vaskularizáciu villi intestinales a následný fyziologický vývoj krýpt. Vplyvom na tesné spojenia (tight junction) dochádza k zvýšenej permeabilite intestinálnej steny s únikom patogénov, antigénov, toxínov a cytokínov z lúmenu čreva do intersticiálneho priestoru. V stave dysbiózy s prevalenciou patogénov ako sú Clostridium perfrigens, Clostridium difficile alebo patogénne kmene Escherichia coli sa zvyšuje tvorba prozápalových cytokínov ako sú: interleukíny (IL-6, IL-1β), interferón γ (IFN‑γ), tumor nekrotizujúci faktor α (TNF‑α – tumor‑necrosis factor α) spolu so spätnou difúziou, čoho následkom môže dôjsť k rozvoju tzv. syndrómu deravého čreva (leaky gut syndrome) s rizikom vzniku rejekcie štepu, autoimunitných ochorení, non‑alkoholovej steatohepatitídy, či neurodegeneratívnych ochorení (3).
Z metabolického hľadiska črevné mikróby zabezpečujú syntézu aminokyselín, vitamínov a biotransformáciu žlčových kyselín. Najdôležitejšiu funkciu predstavuje fermentácia odlúčenej črevnej sliznice a nestráviteľnej zložky potravy – vlákniny. Produkty fermentácie predstavujú základný zdroj živín pre špecializované mikróby s ich následnou produkciou SCFA. Menované produkty po naviazaní sa na povrch bunky aktivujú receptor asociovaný s G‑proteínom (GPR) zahŕňajúci GPR41, GPR43 a GPR109A, ktoré sa nachádzajú na mnohých bunkách organizmu, čo prispieva k diverzite pôsobenia SCFA (4).
Medzi najvýznamnejšie SCFA zaraďujeme acetát, butyrát a propionát. Z pomedzi vymenovaných je najviac zastúpený acetát, ktorý slúži ako esenciálny metabolit pre rast ďalších baktérií črevného mikrobiómu. V periférnych tkanivách kontroluje lipogenézu, metabolizmus cholesterolu a podieľa sa na regulácii apetítu centrálnou cestou. Hlavné funkcie butyrátu zahŕňajú zdroj energie pre kolonocyty, indukciu apoptózy u nádorovo zmenených kolonocytov, aktiváciu intestinálnej glukoneogenézy, zachovanie kyslíkovej rovnováhy v čreve prostredníctvom konzumpcie značného množstva kyslíka v procesoch β‑oxidácie, a tým prevenciu rozvinutia črevnej dysbiózy. Propionát je transportovaný do pečene, kde sa podieľa na regulácii pocitu sýtosti a glukoneogenéze (5).
V stave prevalencie patogénnych mikróbov sa zvyšuje riziko rozvinutia obezity, diabetes mellitus 2. typu (DM 2) a inhibovaná je aj sekrécia glukagónu podobnému peptidu (GLP-1 – glucagon‑like peptid 1). Prostredníctvom väzby na čuchový receptor 78 (Olfr78 – olfactory receptor 78) sú SCFA schopné podieľať sa na regulácii arteriálneho tlaku krvi a inhibícii aterosklerotických procesov v organizme (6).
V prípade dysbalancie, mikroorganizmy črevného mikrobiómu produkujú metabolity s negatívnym efektom na vaskulárny systém. Trimetylamín N oxid (TMAO) ako produkt cholínu podporuje rozvoj intersticiálnej renálnej fibrózy. Produktom patogénych kmeňov E. coli (Escherichia coli) je indoxysulfát, ktorý podnecuje proliferáciu a remodeláciu buniek hladkej svaloviny ciev, a tiež indukciu protrombotických udalostí (7). Počas dysbiózy sa kvantitatívne zvyšuje množstvo uremických toxínov s rizikom renálneho poškodenia (8). Produkcia metabolitov a neuropeptidov črevným mikrobiómom je esenciálna pre komunikáciu medzi črevami a nervovým a neuroendokrinným systémom, čím je umožnené ovplyvnenie srdcovej frekvencie, nálady, apetítu, a iných fyziologických funkcií nášho organizmu (9).
Imunitná funkcia
Jednou z dôležitých funkcií črevného mikrobiómu je stimulácia enterického imunitného systému. Proces stimulácie sa uskutočňuje priamou a nepriamou cestou. V prípade priamej cesty mikróby produkujú substancie ako sú peptidoglykány, polysacharid A, ktoré sa naväzujú na povrchové receptory epitelových buniek čreva. Podľa štúdie Ahmad S. et al. z roku 2016, aktiváciou toll‑like receptora (TLR) a nukleotid naväzujúcej oligomerázovej domény (NOD – nucleotide‑binding oligomerization domain) je vyvolaná tvorba β‑defenzínov - 3, ktoré stimulujú transport B‑lymfocytov do lamina propria (LP) s následnou expresiou imunoglobulínov A (IgA). Súčasťou LP sú aj vrodené lymfoidné bunky (ILC – innate lymphoid cells), najmä subpopulácia ILC-3, ktoré spolu s mikrobiálnymi produktami a induktormi lymfatického tkaniva predstavujú základ vývoja intestinálnych lymfoidných folikulov. Okrem aktivácie lymfocytov, produkty komenzálnych baktérií zabezpečujú produkciu hlienu, biofilmu a baktericídnych molekúl, ktoré tak udržiavajú homeostázu črevného mikrobiómu. Nepriama stimulácia zahŕňa tvorbu cytokínov IL-33, IL-25, transformujúci rastový faktor β (TGF‑β – transforming growth factor β) produkovaných intestinálnymi epitelovými bunkami (IEC – intestinal epithelial cells), ktoré následne aktivujú makrofágy a dendritové bunky. Súčasťou tohto typu stimulácie je aj diferenciácia naivných CD4+ lymfocytov do 6 podtypov: T‑helpery (Th) 1, 2, 9, 17, 22, Tfh (folikulárne Th) a T‑regulačných lymfocytov (Treg) s následnou sekréciou príslušných cytokínov. Antigény patogénnych baktérií (Enterococcus faecalis, Clostridium difficile, Campylobacter) počas dysbiózy stimulujú sekréciu proinflamátorných cytokínov IL-6 a IL-1 s diferenciáciou Th1 a Th17, zatiaľ čo Bacteroides fragilis a Lactobacillus inhibujú expresiu génov proinflamátorných cytokínov. Základom intestinálnej homeostázy je interakcia medzi bunkami črevného epitelu a slizničného imunitného systému. Menovanú interakciu sprostredkúva IL-22, ktorý je produktom vrodenej aj získanej imunity. IL-22 zohráva kľúčovú úlohu v obrane proti patogénom prostredníctvom stimulácie sekrécie antimikrobiálnych peptidov (Reg3β a Reg3γ) a mucínu, čím bráni penetrácii baktérií cez črevný epitel (10, 11, 12).
Vzťah črevného mikrobiómu a transplantácie obličky
Prvý mesiac po trasplantácii obličky prebiehajú najväčšie zmeny v zložení črevného mikrobiómu. Dysbalancia je spôsobená aplikáciou vysokých dávok imunosupresív, inhibítorov protónovej pumpy (PPI), ATB profylaxiou a užívaním mykofenolát mofetilu (MFM) (13). V štúdii Lee et al. bolo zahrnutých 26 príjemcov transplantátu obličky, kde zloženie vzorky stolice bolo detegované pomocou metodiky polymerázovej reťazovej reakcie (PCR – polymerase chain reaction) pred a po transplantácii obličky so signifikantným rozdielom. Percentuálne zastúpenie Actinobacteria a Proteobacteria (E. coli) bolo zvýšené na úkor Firmicutes a Bacteroidetes (14). Zvýšené množstvo proteobakterií sa preto navrhuje použiť ako marker dysbiózy (15). Vzniknutá nerovnováha črevného mikrobiómu vedie k strate integrity črevnej steny s jej následnou zvýšenou permeabilitou, čo umožňuje translokáciu baktérií a ich produktov do interstícia. Takýmto spôsobom dochádza k systémovej zápalovej odpovedi a rozvinutiu inflamácie aj v štepe. Snahou imunitného systému je eliminovať prevalenciu patogénov prostredníctvom proinflamátorných cytokínov IL-1 a IL-6 produkovaných IEC, makrofágov podnecujúcich diferenciáciu Th1 a Th17 a dendritových buniek uvoľňujúcich IL-18 (16). Z hľadiska transplantačnej nefrológie je veľmi zaujímavý vzťah medzi črevným mikrobiómom a vznikom potransplantačných komplikácií ako sú: akútna rejekcia, infekcia, potransplantačná hnačka, intersticiálna fibróza, redukovaná produkcia SCFA a zmena hladín imunosupresív (17).
Dysbióza a akútna rejekcia
Jedna z najnovších štúdií vyhodnocovala vzorky sterov zo stolice 60 pacientov pred a po transplantácii obličky. Indukčná terapia s vysokými dávkami imunosupresív v prvom mesiaci viedla k zásadným zmenám v zložení črevných mikroorganizmov, ktoré sa dotkli najmä baktérií z kmeňa Firmicutes. U piatich pacientov s rozvojom akútnej rejekcie boli zachytené signifikantné zmeny v množstve Neisseria, Actinobacteria a Leptrotrichia. Štúdia taktiež poukázala na vzťah medzi pretransplantačným mikrobiómom a nástupom funkcie štepu, ako možným markerom úspešnosti transplantácie (17).
Dysbióza a IF/TA
Intersticiálna fibróza a tubulárna atrofia štepu (IF/TA – interstitial fibrosis and tubular atrophy) je proces médiovaný s najväčšou pravdepodobnosťou myofibroblastami, ako na úrovni gastrointestinálneho, tak aj močového traktu. Myofibroblasty vznikajú transformáciou a následnou diferenciáciou epitelových a endotelových buniek za prítomnosti patogénnych mikróbov (17). Štúdia Modena et al. porovnávala vzorky moču u 48 pacientov v 1. a 6. mesiaci po transplantácii obličky s histopatologickým výsledkom protokolárnej biopsie štepu, realizovanej v 6. mesiaci. U 25 pacientov s nálezom IF/TA bola prítomná dysbalancia močového mikrobiómu s poklesom Lactobacillov a rodu Streptococcus. U zvyšných 23 príjemcov nebola detegovaná ani IF/TA, ani močová dysbióza (18).
Dysbióza a orgánové infekcie
Autori jednej z najnovších štúdií zaznamenali zvýšenú incidenciu infekcií močového traktu v asociácii so zmenou charakteru črevného mikrobiómu, týkajúceho sa najmä poklesu zastúpenia baktérií s rodu Firmicutes (19). Medzi rizikové faktory rozvoja dysbiózy patrí životný štýl (sedavý spôsob, alkohol, fajčenie), diétne návyky, dĺžka črevnej pasáže, užívanie imunosupresív a antibiotík. Menované činitele vedú k zvýšenej produkcii bakteriálnych toxínov s následnou endotoxinémiou a zvýšenou bakteriálnou translokáciou (20). V štúdii Lee et al. so 168 pacientami po transplantácii obličky bol prítomný pokles vírusových infekcií v asociácii s dôkazom baktérií vysoko produkujúcich butyrát (21). Ako ukazuje ďalšia štúdia, jedným z možných terapeutických ovplyvnení rekurentných močových infekcií je fekálna mikrobiálna transplantácia (FMT – fecal microbial transplantation) (22).
Dysbióza a hnačka
Hnačka po transplantácii obličky predstavuje závažnú komplikáciu s postihnutím približne 20 % pacientov, ktorá môže viesť k rejekcii štepu až smrti pacienta. Rozvoj menovanej komplikácie bol pripisovaný na vrub užívania imunosupresív – najmä MMF, avšak zastavenie užívania MMF signifikantne zvyšuje riziko akútnej rejekcie (23). Už predtým zmieňovaná štúdia Lee et al. poukazuje na fakt, že potransplantačná hnačka je spôsobená črevnou dysbiózou s redukciou komenzálov, a nie prítomnosťou patogénov ako sú Clostridium difficile a norovírusy, ktoré najčastejšie vyvolávajú hnačku (14). V novšej štúdii Lee et al. autori porovnali vzorky stolice 25 pacientov s hnačkou v prvých troch mesiacoch po transplantácii obličky so vzorkami 46 pacientov bez výskytu hnačky. Nálezom u pacientov s hnačkou bolo zvýšeného množstvo Enterococcus, Escherichia a Lachnoclostridium a pokles komenzálov rodu Lachnospiraceae a Ruminococcaceae, ktorých metabolická funkcia je esenciálna pre zdravie čriev (21). Tieto údaje boli potvrdené aj štúdiou Zhang et al. s 97 pacientami po transplantácii obličky s následným rozvojom hnačky, ktorá bola asociovaná so zvýšeným množstvom fekálnej β‑glukuronidázy (24). Záver týchto štúdií poukazuje na fakt, že nie ani tak užívanie imunosupresie, ako črevná dysbióza spôsobuje potransplantačnú hnačku. Túto suspekciu potvrdzujú štúdie, kde FMT bola účinná v zvládnutí hnačky po transplantácii (25).
Interakcia imunosupresív a mikrobiómu
Interakcia medzi imunosupresívami a črevným mikrobiómom je vzájomná (17). Tento fakt potvrdzujú výsledky štúdie Lee et al., v ktorej boli skúmané vzorky stolice 19 pacientov po transplantácii obličky s rovnakou dávkou takrolimu (TAC – tacrolimus) a rovnakou profylaktickou antibiotickou terapiou. Pacienti boli postupne rozdelení na dve skupiny. Prvá skupina s potrebou navýšenia dávky TAC, a druhá so stabilnou dávkou imunosupresíva. Vo vzorke stolice prvej skupiny bolo signifikantne zvýšené množstvo Faecalibacterium prausnitzii v porovnaní s druhou skupinou, a navyše baktéria bola označená za hlavný faktor zvyšovania dávky TAC (26). Štúdia Guo et al. pristúpila k inkubácii spomínanej baktérie s TAC in vitro, čoho výsledkom bola detekcia M1 komponentu, ako metabolitu TAC s 15× nižším imunosupresívnym účinkom. Okrem menovanej baktérie zistili, že aj iné komenzály, ako Clostridia alebo Bacteroidales, sú schopné takejto metabolickej premeny TAC. Tento fakt ozrejmuje interindividuálne rozdiely v dávkach imunosupresíva (27). Ďalším veľmi často užívaným imunosupresívnym liekom po transplantácii obličky je MMF, ako prekurzor jeho aktívnej formy kyseliny mykofenolovej, ktorá podlieha enterohepatálnemu obehu. Výsledkom štúdie Taylor et al. je objavenie pôsobenia bakteriálnej β‑glukuronidázy, ktorá konvertuje glukuronidovanú kyselinu mykofenolovú na aktívnu formu (28). V štúdii aplikáciou vankomycínu došlo k eliminácii bakterií produkujúcich β‑glukuronidázu, čím sa znížilo množstvo aktívnej formy kyseliny mykofenolovej, a tým sa eliminovali aj jej nežiaduce účinky ako kolitída a strata hmotnosti (29). Štúdia Dery K. J. et al. z roku 2020 sa zamerala na možnosť imunomodulácie črevného mikrobiómu prostredníctvom aplikácie ATB a FMT po transplantácii solídnych orgánov, avšak doposiaľ len s použitím zvieracích modelov (30). Údaje o interakcii črevného mikrobiómu a liekov podávaných v rámci protokolu antirejekčnej terapie po transplantácii (basiliximab, antithymocytárny globulín, rituximab, kortikosteroidy, cyklofosfamid) a antibiotickej profylaxie (Valdamín, Biseptol) nie sú v literatúre k dispozícii.
SCFA v asociácii s transplantáciou obličky
SCFA ako hlavné produkty fermentácie črevného mikrobiómu majú antiinflamatórný a indukčný vplyv na tvorbu T regulačných lymfocytov, čím sa zabezpečuje navodenie donor špecifickej tolerancie (31). V štúdii Lee et al., ktorá obsahovala 168 recipientov transplantátu obličky, bolo rozdelených do dvoch skupín podľa zvýšenej, respektíve zníženej hladiny butyrát‑produkujúcich črevných baktérií (BPG – butyrate‑producing gut bacteria). Aplikácia ATB v potransplantačnom období viedla k signifikantného poklesu množstva BPG a zvýšenej incidencii respiračných infekcií u týchto pacientov (32).
Aplikácia mikrobiálnej terapie v transplantácii obličky
Liečbu črevnej dysbiózy je možné rozdeliť do niekoľkých krokov: príjem potravy s vysokým obsahom vlákniny, užívanie prebiotík, probiotík, či podstúpenie FMT (20).
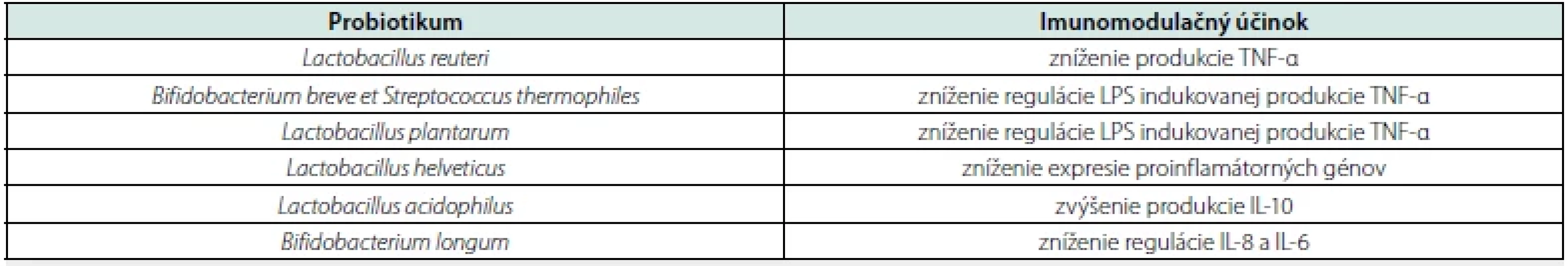
Probiotiká sú podľa Svetovej zdravotníckej organizácie (WHO – World Health Organization) a Organizácie pre výživu a poľnohospodárstvo (FAO – Food and Agriculture Organization) definované ako žijúce organizmy, ktoré v adekvátnom množstve poskytujú hostiteľovi zdravotný benefit (33). Musia byť schopné odolať náročným podmienkam v gastrointestinálnom trakte, s následným pomnožením a kompetitívnou inhibíciou patogénov, v zmysle adhézie na epitel črevnej sliznice a následnej redukcie bakteriálnych toxínov. Z potravín sú na probiotiká bohaté najmä vínny ocot, cottage cheese či biely jogurt (34). Funkcie jednotlivých probiotík sú zhrnuté v štúdii Wu Y. R. et al. z roku 2016 (tab. 1) (35).
Prebiotiká, ako z názvu vyplýva, sú neživé komponenty, ktoré poskytujú jedincovi zdravotné benefity prostredníctom modulácie mikrobioty (36). Tieto neživé elementy stimulujúce rast a diferenciáciu vlastných črevých baktérií musia byť taktiež rezistentné voči žalúdočnej a žlčovej kyseline, pankreatickým enzýmom a enzýmom tenkého čreva. Iba transgalaktooligosacharidy a inulín spĺňajú menované podmienky a môžu tak byť označené za plnohodnotné prebiotiká. Medzi potraviny s najväčším prebiotickým efektom zaraďujeme najmä zelené druhy zeleniny, banány a celozrnné výrobky. Kombináciou probiotík a prebiotík získavame symbiotiká, kde príkladom je inulín a Lactobacillus rhamnosus (37, 38). Pre pacientov po transplantácii obličky s rezistentnou infekciou a/alebo hnačkou spôsobenou Clostridium difficile a E. coli je najviac elektívnou terapiou práve FMT (22).
Záver
Keď sa na prelome tisícročí podarilo zmapovať celý genetický kód, vedecká spoločnosť bola v domnienke, že takýmto spôsobom bude možné liečiť každé ochorenie. Po viac ako dvoch dekádach vieme, že to bol omyl a ukazuje sa, že zdroj a hlavne možnosť ovplyvnenia mnohých ochorení ľudského tela pramení z mikroorganizmov žijúcich v naších črevách – črevný mikrobióm.
Črevný mikrobióm má nezastúpiteľnú funkciu vo fermentácii naším telom nestráviteľných súčastí potravy s následnou produkciou SCFA, ktorých funkcia v našom organizme je širokospektrálna. Mikrobióm a obličky fungujú ako circulus vitiosus. Príkladom je terminálne zlyhanie obličiek (ESKD – end‑stage kidney disease) s retenciou dusíkatých látok, čím dochádza k rozvoju dysbiózy a následne zhoršeniu renálnych funkcií.
Významné ovplyvnenie mikrobiómu nastáva aj u transplantovaných pacientov s následnou imunosupresívnou a antibiotickou profylaktickou liečbou, čo výrazne ovplyvní zloženie mikrobioty, najmä v prvom mesiaci po transplantácii. Výsledkom môžu byť infekčné komplikácie ako klostrídiová hnačka, renálna fibróza, akútna rejekcia, zmeny metabolizmu samotných imunosupresív, ale aj infekcie iných orgánových sústav. Z menovaných dôvodov je nevyhnutné pripraviť a posilniť črevný mikrobióm aplikáciou prebiotík, prípadne probiotík. Toho času však nie je dostupné dostatočné množstvo štúdií, ktoré by nám s určitosťou a spoľahlivosťou mohli pomôcť indikovať správny preparát pre pacienta s dysbiózou. Tento fakt predstavuje novú výzvu pre realizáciu mnohých štúdií u pacientov v ESKD a u pacientov po transplantácii obličky.
MUDr. Monika Beliančinová
Transplantačné centrum, Univerzitná nemocnica Martin
beliancinova.monika@gmail.com
Cit. zkr: Vnitř Lék. 2023;69(1):41-46
Článek přijat redakcí: 17. 10. 2022
Článek přijat po recenzích: 16. 1. 2023
Sources
1. Salvadori M, Tsalouchos A. The Microbiota and Kidney Transplantation: Influence on the Graft. EMJ Urol. 2021;9(1):95-106.
2. Berg G, Rybakova, D, Fischer, D, et al. Microbiome definition re‑visited: old concepts and new challenges. Microbiome 8, 103 (2020). https://doi.org/10.1186/s40168-020-00875-0
3. Lee SH. Intestinal permeability regulation by tight junction: implication on inflammatory bowel diseases. Intest Res. 2015;13(1):11-8.
4. Rowland I, et al. Gut microbiota functions: metabolism of nutrients and other food components. Eur J Nutr. 2018;57(1):1-24.
5. Valde AM, et al. Role of the gut microbiota in nutrition and health. BMJ 2018;361:k2179
6. Kiepura A, et al. Anti‑atherosclerotic potential of free fatty acid receptor 4 (FFAR4). Biomedicines. 2021;9(5):467.
7. Tang WH, Wang Z, Kennedy DJ, et al. Gut microbiota‑dependent trimethylamine N‑oxide (TMAO) pathway contributes to both development of renal insufficiency and mortality risk in chronic kidney disease. Circ Res. 2015; 116 : 448-455 [PMID: 25599331 DOI: 10.1161/ CIRCRESAHA.116.305360]
8. Satoh M, Hayashi H, Watanabe M, et al. Uremic toxins overload accelerates renal damage in a rat model of chronic renal failure. Nephron Exp Nephrol. 2003; 95: e111-e118 [PMID: 14646363 DOI: 10.1159/000074327].
9. Guo TL, Chen Y, Xu HS, et al. Gut microbiome in neuroendocrine and neuroimmune interactions: The case of genistein. Toxicol Appl Pharmacol. 2020; 402 : 115130 [PMID: 32673657 DOI: 10.1016/j.taap.2020.115130].
10. Ahmad S, Bromberg J. Current status of the microbiome in renal transplantation. Curr Opin Nephrol Hypertens. 2016 November; 25(6):570–576. doi:10.1097/ MNH.0000000000000262.
11. Human CD4+ T helper cells. Miltenyi Biotec. [cit. 2023–01–14]. Available from: https:// www.miltenyibiotec.com/DE‑en/ resources/macs‑handbook/ human‑cells‑and‑organs/ human‑cell‑types/ cd4-t‑cells‑human. html
12. Sabihi M, Böttcher M, Pelczar P, et al. Microbiota‑Dependent Effects of IL-22. Cells. 2020 Oct; 9(10): 2205. doi: 10.3390/cells9102205
13. Wang W, et al. Gut microbiota and allogeneic transplantation. J Transl Med. 2015;13 : 275.
14. Lee JR, Muthukumar T, Dadhania D, et al. Gut microbial community structure and complications after kidney transplantation: a pilot study. Transplantation. 2014;98 : 697 - 705 [PMID: 25289916 DOI: 10.1097/TP.0000000000000370].
15. Shin NR, Whon TW, Bae JW. Proteobacteria: microbial signature of dysbiosis in gut microbiota. Trends Biotechnol. 2015;33 : 496-503 [PMID: 26210164 DOI: 10.1016/j.tibtech. 2015. 06. 011]
16. Bromberg JS, et al. Microbiota – implications for immunity and transplantation. Nat Rev Nephrol. 2015;11(6):342-53.
17. Salvadori M, Tsalouchos A. Microbiota, renal disease and renal transplantation. World J Transplant. 2021 March 18;11(3):16-36.
18. Modena BD, Milam R, Harrison F, et al. Changes in Urinary Microbiome Populations Correlate in Kidney Transplants With Interstitial Fibrosis and Tubular Atrophy Documented in Early Surveillance Biopsies. Am J Transplant. 2017;17 : 712-723 [PMID: 27597148 DOI: 10.1111/ajt.14038].
19. Fricke WF, Maddox C, Song Y, et al. Human microbiota characterization in the course of renal transplantation. Am J Transplant. 2014;14 : 416-427 [PMID: 24373208 DOI: 10.1111/ ajt.12588].
20. Chan S, et al. Transplant associated infections – the role of the gastrointestinal microbiota and potential therapeutic options. Nephrology (Carlton). 2020;25(1):513.
21. Lee JR, Magruder M, Zhang L, et al. Gut microbiota dysbiosis and diarrhea in kidney transplant recipients. Am J Transplant. 2019;19 : 488-500 [PMID: 29920927 DOI: 10.1111/ ajt.14974].
22. Biehl LM, Cruz Aguilar R, Farowski F, et al. Fecal microbiota transplantation in a kidney transplant recipient with recurrent urinary tract infection. Infection. 2018;46 : 871-874 [PMID: 30109576 DOI: 10.1007/s15010-018-1190-9].
23. Bunnapradist S, Neri L, Wong W, et al. Incidence and risk factors for diarrhea following kidney transplantation and association with graft loss and mortality. Am J Kidney Dis. 2008;51 : 478-486 [PMID: 18295064 DOI: 10.1053/j.ajkd.2007. 11. 013].
24. Zhang LT, et al. Gut microbiota profiles and fecal beta‑glucuronidase activity in kidney transplant recipients with and without post‑transplant diarrhea. Clin Transplant. 2021:e14260.
25. Kelly CR, et al. Effect of fecal microbiota transplantation on recurrence in multiply recurrent clostridium difficile infection: a randomized trial. Ann Intern Med. 2016;165(9):609-16.
26. Lee JR, Muthukumar T, Dadhania D, et al. Gut microbiota and tacrolimus dosing in kidney transplantation. PloS One 2015; 10: e0122399 [PMID: 25815766 DOI: 10.1371/journal. pone.0122399].
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2023 Issue 1
-
All articles in this issue
- Jistoty a nejistoty na křižovatkách současné medicíny
- Izolovaná plicní embolie – specifická klinická jednotka?
- Co je nového v doporučeních ESC 2022 pro předoperační vyšetření a perioperační péči
- Infekční komplikace syndromu diabetické nohy – diagnostika a léčba
- Dentálne výkony pri perorálnej antitrombotickej liečbe
- Histaminová intolerance
- Črevný mikrobióm a transplantácia obličky
- Diferenciální diagnostika urychlení sedimentace erytrocytů
- Novinky v kardiologii 2022
- ESC 2022 a studie DELIVER
- Zprávy o knihách
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Histaminová intolerance
- Diferenciální diagnostika urychlení sedimentace erytrocytů
- Dentálne výkony pri perorálnej antitrombotickej liečbe
- Co je nového v doporučeních ESC 2022 pro předoperační vyšetření a perioperační péči
