Idiopatické střevní záněty a těhotenství
Inflammatory bowel disease and pregnancy
Inflammatory bowel disease (IBD) commonly affects women during the reproductive years. Opinion on the effect of IBD on fertility, conception, pregnancy and breastfeeding is varied. IBD does not have probably adverse effect on the outcome of pregnancy. Pregnancy in IBD patients should be closely monitored. This review provides the most current information on the inheritance, fertility, pregnancy, outcomes, foetal development and management of disease during pregnancy, and safety of medications in pregnancy and breastfeeding.
Key words:
inflammatory bowel disease, Crohn’s disease, ulcerative colitis, fertility, pregnancy, breastfeeding, therapy.
:
Karel Lukáš 1; prof. MUDr. Antonín Pařízek, CSc. 2; Jaroslav Kotlas 3; Aleš Novotný 1
:
Univerzita Karlova v Praze, 1. lékařská fakulta, IV. interní klinika VFN
1; Univerzita Karlova v Praze, 1. lékařská fakulta, Gynekologicko-porodnická klinika VFN
2; Univerzita Karlova v Praze, 1. lékařská fakulta, Ústav biologie a lékařské genetiky
3
:
Čas. Lék. čes. 2010; 149: 163-172
:
Review Article
Idiopatické střevní záněty postihují často ženy v reprodukčním věku a otázka jejich těhotenství je velmi závažná. Zkušenosti vlivu idiopatických střevních zánětů na fertilitu, koncepci, těhotenství a kojení se různí. Idiopatické střevní záněty nemají pravděpodobně nepříznivý vliv na těhotenství. Těhotenství u pacientek s idiopatickými střevními záněty musí být pečlivě sledováno. Článek přehledně uvádí současné informace o dědičnosti, fertilitě, těhotenství a jeho ukončení, vývoji plodu a léčbě a její bezpečnosti během těhotenství a kojení.
Klíčová slova:
idiopatický střevní zánět, Crohnova nemoc, ulcerózní kolitida, fertilita, těhotenství, kojení, léčba.
Úvod
Vzhledem k tomu, že idiopatické střevní záněty (ISZ) postihují ženy nejčastěji v reprodukčním věku, je otázka jejich těhotenství čím dál víc závažnější (1, 2). U žen s ISZ probíhá těhotenství s vyššími riziky komplikací. Tato rizika jsou způsobena jednak vlastním zánětlivým procesem, možnými zhoršenými výživovými parametry těhotné ženy a účinkem léků podávaných pro idiopatické střevní záněty. Infekce a zánět obecně mohou být příčinou předčasných porodů (< 37 týdnů) a nízké porodní váhy (< 2500 g) (3–5).
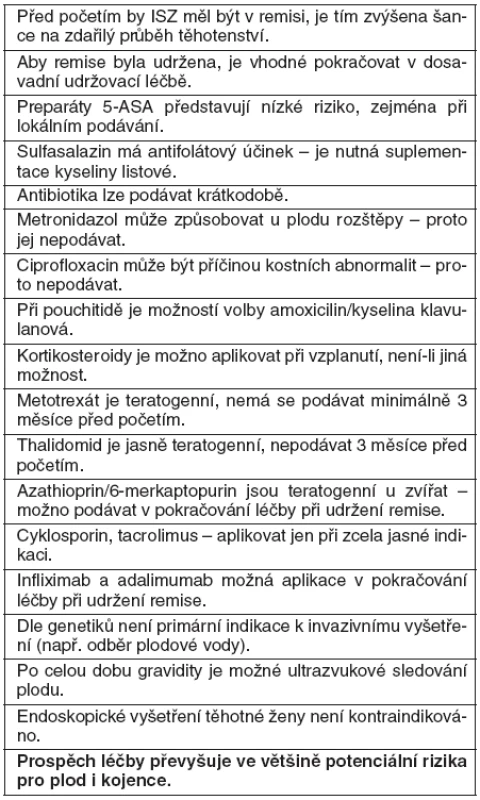
Pokud je plánováno těhotenství u ženy s idiopatickým střevním zánětem je vhodné si položit následující otázky (tab. 1), na které vyplynou odpovědi z dalšího textu a pokusíme se na ně odpovědět na konci tohoto přehledového článku (tab. 8).

Menstruace
Pokud začne ISZ u dívky před pubertou, pak bývá začátek menstruace opožděn. Příčinou je chronický zánět, který zpomaluje vývoj a v některých případech i zhoršené výživové parametry. V pozdějším věku může u ženy s ISZ nastat nepravidelná menstruační činnost (délka cyklů, sekundární amenorea apod.). Může docházet i ke zhoršování příznaků střevního zánětu jak v období premenstruačním, tak i v období menstruace („minivzplanutí“) (6).
Antikoncepce
V současné době je na trhu široké spektrum antikoncepčních přípravků. Často jsou používány preparáty s hormonálními účinky a nitroděložní tělíska (i když některá tělíska jsou konstruována tak, že postupně uvolňují hormon – gestagen). Podle způsobu podání se hormonální antikoncepce rozděluje na metody tabletové, injekční, již zmíněné nitroděložní, vaginální, podkožní implantáty a kožní náplasti.
Intrauterinní tělíska nejsou doporučována. Mohou být příčinou bolesti, která se obtížně odlišuje od bolesti při zánětu. U forem ISZ se sklonem k tvorbě píštělí, je zavedení intrauterinního tělíska kontraindikováno.
O užívání hormonální antikoncepce jsou v souvislosti s idiopatickým střevním zánětem rozporuplné informace. Na jedné straně je popisováno mírně zvýšené riziko rozvoje Crohnovy nemoci (CN) i ulcerózní kolitidy (UC), na straně druhé existuje studie souboru žen s hormonální antikoncepcí a současně kuřaček tabákových produktů, která popisuje přiznivý účinek u UC a naopak zhoršení onemocnění u CN (7).
Další studie o užívání hormonální antikoncepce a kouření popisují, že může nastat exacerbace idiopatického střevního zánětu (8, 9). Zcela odlišné jsou výsledky studie, která uvádí, že ani hormonální antikoncepce, ani kouření nemají vliv na exacerbaci CN (10). Zatím nejsou doporučení k užívání hormonální antikoncepce u idiopatických střevních zánětů zcela jasná (6).
Literární přehled zabývající se užitím antikoncepce v etiologii idiopatických střevních zánětů v letech 1983–2007 uvádí, že relativní riziko pro UC při užívání hormonální antikoncepce je 1,53, pro CN 1,51 (11).
Fertilita
Ženská fertilita není běžně u pacientek s ISZ zhoršena. Výjimkou jsou jen těžké formy ISZ, s tvorbou adhezí, píštělí, dyspareunií a často sekundárně sníženým libidem.
U pacientek s UC je fertilita normální. Počet těhotenství u těchto pacientek je podobný jako ve zdravé populaci (12).
U CN je situace komplikovanější. Při inaktivitě nemoci je fertilita normální, u aktivní CN jsou popisovány poruchy fertility a hraje zde roli i stav výživy. Po stanovení diagnózy CN byl zjištěn významně nižší počet dětí, ve srovnání s kontrolami. Důležitou roli hrají údajně vlivy psychosociální(13–15).
Na mužskou fertilitu mají při léčbě idiopatických střevních zánětů pravděpodobně vliv následující látky: sulfasalazin, metotrexát, 6-merkaptopurin (6-MP). Je zjišťován nepříznivý průběh u těhotenství počatých muži s idiopatickým střevním zánětem léčených 6-MP nejméně 3 měsíce před početím (19). Všechny výše uvedené léky by měly být vynechány 3 měsíce před plánovaným početím (16–19), protože nová spermiogeneze trvá stejnou dobu.
Sulfasalazin (sulfapyridin) způsobuje reverzibilní infertilitu u mužů; vyvolává oligospermii, redukuje motilitu spermií a zvyšuje počet abnormálních forem spermií (16).
TNF-α podporuje přežívání buněk během spermatogenezy v krysím varleti, a logicky anti-TNF-α tento účinek blokuje (20). Proto je doporučováno vynechat anti-TNF-α 2 měsíce před plánovaným početím.
Incidence dyspareunie se zvýší po ileoanální anastomóze s J-pouchem, což je i příčinou snížení fertility (21).
Retrospektivní studie hradeckých autorů uvádí, že aktivita Crohnovy choroby a anoperineální postižení jsou rizikové faktory, které prodlužují interval potřebný k otěhotnění; předchozí břišní operace neovlivňuje interval potřebný k otěhotnění (22).
Prednizon, prednizolon a metylprednizolon nejsou kontraindikací plánování početí (23).
Průběh těhotenství
Z hlediska prognózy průběhu těhotenství u pacientek s idiopatickým střevním zánětem je nejdůležitějším predikčním faktorem aktivita v době otěhotnění: je-li nemoc inaktivní, pak se výskyt vzplanutí v těhotenství neliší od „netěhotných“ žen s ISZ (24). Je-li idiopatický střevní zánět aktivní, je 60% šance, že nemoc zůstane aktivní nebo že se dokonce zhorší (25, 26).
Otěhotněním v aktivní fázi UC se výrazně zvyšuje riziko relapsu. U UC zůstává nemoc aktivní v 70 %, ke zlepšení nebo i k remisi dojde ve 30 %. U CN ke zhoršení dojde v 65 % a dokonce se vyskytují názory podporující ukončení těhotenství (26).
Pokud se ISZ objeví v těhotenství poprvé, tak je to obvykle v I., nebo ve II. trimestru. Kolektomie a ileostomie provedené před těhotenstvím – nemají vliv na průběh střevního zánětu. Průběh dalších těhotenství nemusí být stejný, i když obvykle tomu tak je.
Relaps střevního zánětu v těhotenství nastává v případě UC nejčastěji v I. trimestru a v případě CN ve III. trimestru. CN v těhotenství může být spojena se subfebriliemi (14).
Zásadní podmínkou u nemocných s idiopatickým střevním zánětem je plánované rodičovství (27)!
Spekulace o sezonním výskytu ISZ v těhotenství se nepotvrdily (28).
Udržení remise v těhotenství – vliv léků
Zvláštnosti léčby v těhotenství nejsou. Pokud má udržovací léčba dobrý účinek, pak se doporučuje ji nevysazovat, ale je vhodné přihlédnout k níže uváděným poznatkům. Případná je i suplementace kalcia jako prevence osteoporózy (29).
Medikamentózní udržovací léčba CN (s výjimkou metotrexátu) má pokračovat celé těhotenství, protože prospěch převažuje nad rizikem plynoucím z konzervativní léčby a před nebezpečím vzplanutí, které hrozí po ukončení léčby. Největším rizikem – jak pro matku, tak pro plod – je aktivita nemoci, nikoliv podávané léky (30).
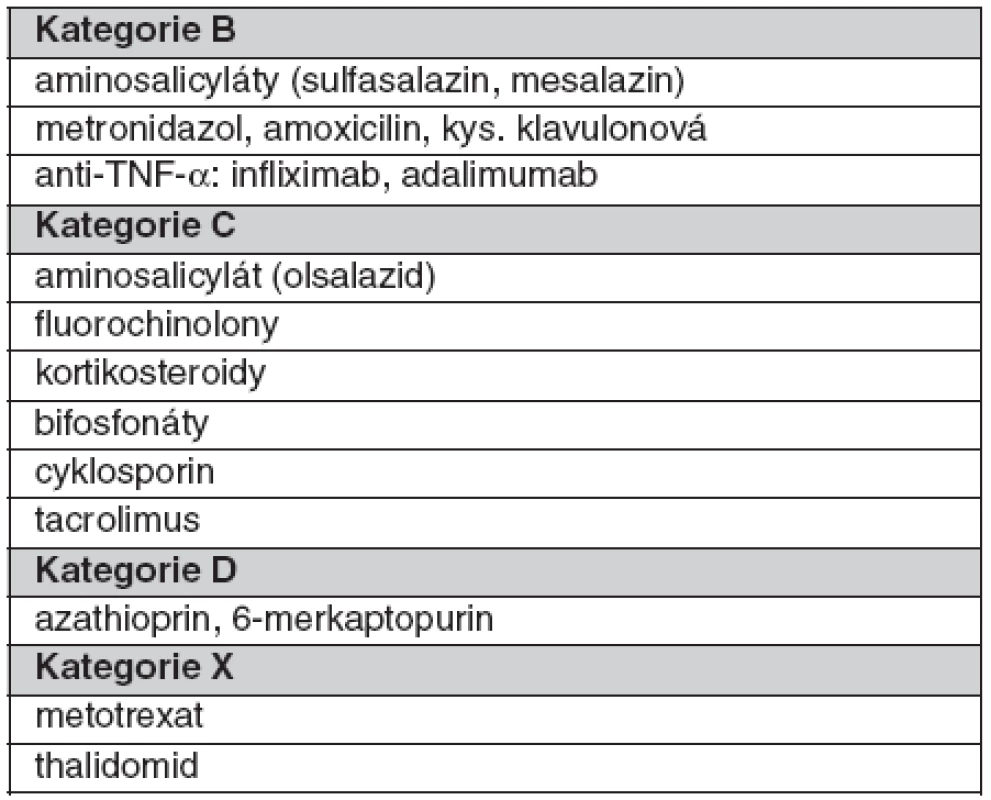
Při podávání léků v těhotenství je účelné přidržet se přehledné kategorizace FDA (31) (tab. 2).

Antidiaroika
Po podávání difenoxylátu s atropinem během I. trimestru byly zjištěny u malého počtu dětí malformace (32). Difenoxylát má být užit velmi opatrně (30). Loperamid není doporučován, i když jsou studie u zvířat negativní (32). Dle jiných je loperamid pravděpodobně bezpečný, ale u vybrané skupiny byly nalezeny kongenitální malformace (30). Opiová tinktura přechází placentou, je v těhotenství nevhodná. Kaolin a pektin – nejsou studie (32). Cholestyramin, užívaný k léčbě průjmu u postižení ilea nebo po resekci nebo u cholestázy, je účinný (30).
Antiemetika
Metoklopramid a ondasetron jsou bezpečné (30).
Sulfasalazin
Sulfasalazin je řazen do kategorie B. Při jeho aplikaci není zjištěn vznik vrozených vývojových vad (17, 24, 33). Je prokázán antifolátový účinek sulfasalazinu a je doporučováno přidávat 2 mg kyseliny listové/den po celé těhotenství (34, 35).
Mesalazin
Mesalazin je řazen do kategorie B. Při jeho podávání během těhotenství původně nebylo prokázáno riziko pro plod a dávka pod 3,0 g/den se jevila jako bezpečná (36–39). Pozdější studie popisují mesalazinem způsobené zvýšené riziko potratů, nízkou porodní váhu a mrtvý plod a negativní vliv na vývoj ledviny plodu, proto je nutné intrauterinní a postpartální sledování ledvin plodu a později i novorozence ultrazvukem (34, 40).
Metronidazol
Metronidazol je řazen do kategorie B. Kontrolované studie ve II. a III. trimestru ukázaly nesignifikantní výskyt rozštěpů rtu s/nebo bez rozštěpu patra (41, 42). Ale jeho krátkodobé podávání v průběhu těhotenství je možné, ale zatím není jasné, jak dlouho je možné jej užívat (32). Metronidazol je zřejmě bezpečný po prvním trimestru, a může být užit „opatrně“ jen není-li k němu alternativa (30).
Antibiotika
O většině dnes používaných antibiotik jsou známé informace ve vztahu k těhotenství (17, 25).
Jako bezpečné se jeví fluorochinolony, amoxicilin a kyselina klavulanová, ale mají být užívány jen po nejkratší dobu (30). Chinolony (např. ciprofloxacin) jsou řazeny do kategorie C, mají vysokou afinitu ke kostní tkáni a ke chrupavce a mohou být příčinou artropatií (40). Ale v kontrolovaných studiích nebylo prokázáno vysoké riziko (44, 45). Krátkodobá léčba metronidazolem nebo ciprofloxacinem je bezpečná, ale chybí přesná data o možné délce podávání (32). Nemají být užívány tetracykliny (jsou příčinou opoždění vývoje skeletu plodu a diskolorace zubů) a sulfonamidy, které interferují s metabolismem kyseliny listové (30).
Kortikosteroidy
Kortikosteroidy přecházejí placentární bariéru, ale jsou rychle konvertovány placentární 11-hydroxylázou na méně aktivní metabolity. Prednizon a prednizolon jsou metabolizovány rychleji než alternativní preparáty. Nálevy a čípky jsou přípustné do třetího trimestru (30).
Kortikosteroidy jsou řazeny do skupiny C. Studie v I. trimestru neprokázaly zvýšené riziko rozštěpu rtu (46) a jejich užívání v I. trimestru nepředstavuje riziko významných vrozených vývojových vad plodu (47).
Kortikosteroidy jsou užívány u mnoha nemocí v průběhu těhotenství a nebylo zjištěno zvýšené riziko nižší porodní hmotnosti, spontánních potratů nebo fetálních abnormalit, navzdory tomu, že zvýšená incidence těchto změn byla nalezena u zvířat, kterým byly podávány vysoké dávky steroidů. Kortikosteroidy procházejí placentou, ale kortizol je rychle konvertován na méně aktivní kortizon. Fetální hladina prednizonu a prednizolonu se rovná 10 % mateřské hladiny. Je teoretická možnost suprese fetální hypotalamo-pituitární-adrenální osy, ale riziko je považováno za extrémně nízké. Steroidy jsou bezpečné jak v těhotenství, tak při kojení a léčba kortikosteroidy má malý vliv na průběh těhotenství a na plod. Prednizon, prednizolon a metylprednizolon má být podáván v prvním trimestru a v posledním týdnu gravidity s velkou opatrností (23).
Pokud je zánět ohraničen na distální část tlustého střeva, jsou s výhodou podávány lokálně působící nehalogenované glukokortikoidy buď v nálevu, nebo v čípcích (48, 49). Budesonid je řazen do kategorie B. Je považován za bezpečný, stejně jako další (inhalační) kortikosteroidy – beclomethason a triamcinolon (50). Expozice matky orálně inhalovaným budesonidem není spojena se zvýšeným rizikem malformací nebo jiných nepříznivých důsledků pro plod. Ve studii bylo zahrnuto 6600 dětí a v další studii 2968 těhotných žen. Data o intranazální expozici budesonidu jsou omezená, ale zdá se, že výsledky budou stejné jako u orálního podání (46, 51–53).
Malá studie s osmi těhotnými pacientkami, užívajícími budesonid v dávce 6–9 mg/den pro postižení tenkého střeva CN ukázala, že nedošlo k supresi nadledvinek matky, k poruše glukózové tolerance, očním poruchám, hypertenzi ani ke kongenitálním abnormalitám. Budesonid se jeví jako bezpečný pro léčbu CN v těhotenství (54). Podávání glukokortikosteroidů v graviditě je spojeno s minimálním, ale přítomným rizikem teratogenity, hlavně rozštěpových vad a útlumu funkce nadledvin (zejména krátce před porodem).
Metotrexát
Metotrexát je zařazen do kategorie X! Je jasně teratogenní a v současné době se doporučení o ukončení jeho podávání před otěhotněním značně liší; nemá být podáván před oplodněním minimálně 6 měsíců a u jiných autorů je doporučován dokonce interval v trvání až 5 let! Preparát je původcem mnohočetných anomálií (tzv. metotrexátová embryopatie: intrauterinní retardace růstu, vývojové vady, mentální retardace) (17, 34, 55) a může vyvolávat potraty(32).
Azathioprin a 6-merkaptopurin
Azathioprin i 6-merkaptopurin je dle FDA ve skupině D, což je odvozováno ze studií na zvířatech, ale výsledky u humánních studií ukazují, že thiopuriny jsou bezpečné a dobře tolerované během těhotenství (30).
Studie se zvířaty prokazují zvýšenou frekvenci rozštěpů patra, kostních a urogenitálních anomálií. Je prokázán transplacentární přestup na plod, ale plod je chráněn, protože jeho játra v časném stadiu mají nedostatek enzymu inosinát pyrofosforylázy, který konvertuje 6-merkaptopurin na azatioprin a je i nízká orální biologická dostupnost (azathioprin 47 %, 6‑merkaptopurin 16 %) (34).
Užívání azathioprinu a 6-merkaptopurinu těhotnou ženou není spojeno se zvýšeným rizikem vrozených vývojových vad, poruchou intrauterinního růstu plodu a předčasných porodů (32).
Pokud je plánováno těhotenství při CN v remisi, je doporučeno přerušit podávání preparátů 3 měsíce před početím, při neplánovaném početí u CN v remisi je doporučeno aplikaci přerušit ihned a při početí neplánovaném, tam, kde je nezbytné podávání (např. u fistulizující formy) se doporučuje pokračovat za pravidelných kontrol leukocytů v periferní krvi matky (34).
Dle jiných je považováno za rozumné, aby v průběhu těhotenství u pacientek s idiopatickým střevním zánětem bylo pokračováno v udržovací léčbě azathioprinem a 6-merkaptopurinem (23, 56, 57).
Souhrnem lze citovat o imunosupresivech následující text. Riziko teratogenity je malé, opakovaně potvrzena možnost fyziologické gravidity. Jednoznačný teratogenní účinek však dosud nebyl prokázán. Obecně platí, že jestliže je azathioprin nebo 6-merkaptopurin v době gravidity indikován, převyšuje klinický prospěch pro matku potenciální riziko teratogenity pro plod. Plánování gravidity a/nebo gravidita probíhající u indikované léčby azathioprinem nebo 6-merkaptopurinem nejsou důvodem k ukončení gravidity ani léčby azathioprinem nebo 6-merkaptopurinem (23).
Cyklosporin
Cyklosporin je řazen do kategorie D. Nejsou dostatečná data o užití cyklosporinu u těhotných (30). Celkem jsou k dispozici necelé dvě desítky studií, kde počet malformací dětí, jejichž matky byly v těhotenství léčeny cyklosporinem, je 4,1 %, čímž se neliší od obecné populace. Při těžké UC k léčbě kortikosteroidy refrakterní je údajně léčba cyklosporinem lepší volbou (jak pro matku, tak pro plod), než kolektomie (34, 58–60). Podávání cyklosporinu může být spojeno s retardací růstu a předčasným porodem (32). Cyklosporin nemá prokázanou teratogenitu, která by indikovala přerušení gravidity v případě koncepce během léčby. Consupren® přechází do mateřského mléka, proto se při léčbě tímto preparátem kojení nedoporučuje (23).
Biologická léčba
Anti-TNF-α preparáty jsou řazeny do kategorie B. Je zjištěno, že nepřechází placentou v I. trimestru, je u nich předpokládán přestup placentou až ve III. trimestru (29, 31). Ale není ještě známo, zda indukují tvorbu protilátek u dítěte. Dvě práce podávají zprávu o 92 těhotenstvích. Nebylo nalezeno signifikantní zvýšení výskytu předčasných porodů, ektopických těhotenství, spontánních potratů a nízké porodní váhy (30). Konkrétní doporučení hovoří u aktivního onemocnění, o aplikování poslední infuze infliximabu před 22. týdnem těhotenství a při léčení adalimumabem jej nepodávat 6–8 týdnů před porodem. Pokud dojde do porodu k relapsu, který vyžaduje léčbu – pak podávat kortikosteroidy. Pokud je nemoc aktivní, je vhodné je začít aplikovat po porodu co nejdříve.
Adalimumab má podobný placentární přestup jako infliximab. The Organization for Teratology Information Specialists (OTIS) podává zprávu o 33 ženách zařazených do prospektivní studie a o 89 těhotných, kterým byl adalimumab podán. Výskyt spontánních potratů a mrtvě narozených dětí byl podobný jako u kontrol a obecné populace. Výskyt kongenitálních malformací a předčasných porodů se nelišil od kontrol (30).
Pokud se týká infliximabu i adalimumabu, počet spontánních potratů a předčasných porodů a vrozených vývojových vad je podobný jako v obecné populaci. Data jsou srovnatelná s pacientkami s CN bez biologické léčby. Počet potratů a neonatálních komplikací je stejný u infliximabem léčených vs. infliximab naivních (32, 34). Není zvýšené riziko pro nepříznivé ukončení těhotenství (61–63). Údaje o podávání biologické léčby v těhotenství jsou zatím velmi omezené, a teprve budoucnost prokáže její vliv na vývoj dítěte (35).
Tacrolimus
Zařazen do kategorie C. Jsou známé studie u transplantovaných, kdy bylo 68 % normálních porodů živých dětí, 12 % spontánních potratů a 3 % předčasných porodů. Zatím existuje jedna kazuistika u idiopatického střevního zánětu, která nepopisuje negativní vliv na dítě (34).
Thalidomid
Preparát je pochopitelně, po hojně medializovaných tragických následcích jeho podávání těhotným v šedesátých letech 20. století, řazen do kategorie X. Účinkuje proti TNF-α. V těhotenství je dnes přísně kontraindikován (34, 64)!
Přehled léků užívaných v léčbě idiopatických střevních zánětů dle kategorizace FDA ukazuje tabulka 3.
Enterální výživa
Enterální výživa (perorální nutriční doplňky nebo sondová výživa) přidávaná k normální stravě je indikována u podvyživených pacientů s CN nebo UC ke zlepšení stavu výživy. U aktivní CN je enterální výživa terapií první volby, zejména pokud terapie kortikosteroidy není možná. Enterální výživa kombinovaná s medikamentózní léčbou je indikována i u těch, kteří mají zánětlivou stenózu střeva (65–67).
Chirurgické řešení
Pokud není ohrožen život těhotné pacientky, je vhodné řešit situaci konzervativně. Je-li operační řešení nutné, pak nejvhodnější je II. trimestr, ve kterém se obvykle provádí rutinní „neporodnické“ operace – tak jako v obecné populaci (68). I na začátku III. trimestru jsou u non-ISZ pacientek prováděny chirurgické výkony, ale s vyšší mírou výskytu předčasných porodů v pooperačním období (69). Pokud je nutná břišní chirurgická intervence po 32. týdnu těhotenství, zpravidla se začíná provedením císařského řezu. Porod po tomto týdnu těhotenství obvykle zaručuje již velmi dobrou prognózu vývoje dítěte. Usnadní se technika i provedení vlastní operace (menší objem dělohy), zlepší se pooperační průběh hojení u matky a odpadnou rozpaky z hlediska prenatální péče a způsobu vedení porodu (49).
I v těhotenství, v kterémkoliv trimestru, jsou k neodkladnému chirurgickému řešení (ke kolektomii) plně indikovány následující stavy lokalizované v tračníku, které ohrožují život nemocné: toxické megakolon, střevní obstrukce a významné krvácení (68). Valná část kolitid v těhotenství probíhá ale klidně a končí porodem zdravého dítěte.
Indikacemi chirurgického zákroku při postižení tenkého střeva jsou: obstrukce, perforace, krvácení a absces. Dočasná ileostomie je preferována před primární anastomózou. Zákrok není vhodné oddalovat (34)!
Laparoskopie je v průběhu těhotenství velmi dobře snášena (68); musí být ale prováděna erudovaným operatérem.
Těhotenství po proktokolektomii není spojeno s nárůstem komplikací. Jen je zaznamenáváno zvýšení frekvence stolic ve III. trimestru. Porod přirozenou cestou po proktolektomii je bezpečný (21).
Při těžkém průběhu idiopatických střevních zánětů v těhotenství 83 % pacientek odpoví na i.v. podání kortikosteroidů nebo na cyklosporin A, je tak možné oddálit kolektomii. Léčba by měla být prováděna ve specializovaných perinatologických centrech. Těžké relapsy během těhotenství zvyšují riziko předčasných porodů a nízké porodní váhy dítěte (26).
Souhrnem k chirurgickým výkonům: indikace pro chirurgický výkon u těhotných žen s CN jsou stejné jako u pacientek, které těhotné nejsou. Tedy obstrukce, perforace, krvácení a absces. U těžce nemocných pacientek je větším rizikem pro plod trvání onemocnění než chirurgická intervence (30).
Cíle léčby idiopatických střevních zánětů v těhotenství ukazuje tabulka 4.

Spontánní potrat
Spontánní potraty se vyskytují u pacientek s idiopatickými střevními záněty ve 12,2 %, oproti normální populaci, kde je výskyt 9,9%. Potraty jsou častější u nemocných, které mají provedenu střevní resekci před otěhotněním. Délka resekátu a aktivita onemocnění úměrně souvisí se zvýšeným rizikem spontánního potratu (70).
Předčasný porod
Názory na předčasné porody u nemocných s ISZ se rozcházejí. Jejich původ je vysvětlován vysokou hladinou prostaglandinů během relapsu střevního onemocnění, které způsobují kontrakce hladkého svalstva (74).
Procento předčasných porodů v běžné populaci v České republice je okolo 8 %. Práce, které popisují zvýšené procento předčasných porodů u nemocných s idiopatickými střevními záněty, uvádějí 11,5 –14 – 16 % (75–77).
Proti tomu stojí další práce, které tvrdí, že u těhotných s ISZ není signifikantní zvýšení rizika předčasného porodu, ale ani ektopického těhotenství, spontánních potratů a nízké porodní váhy, a to ani při léčbě 5-aminosalicyláty, kortikosteroidy, azathioprinem, biologickou léčbou ani cyklosporinem (27, 70, 78).
Vedení porodu
Rozhodnutí o způsobu vedení porodu u ženy s idiopatickým střevním zánětem je vždy závažné. Pokud není porodnická indikace, je primárně indikován císařský řez s ohledem na ochranu análního svěrače. Z hlediska vaginálního porodu je problematická i exacerbace onemocnění v rektu, ať se jedná o proktitidu při UC či CN. Stejně závažné je perianální postižení s abscesy a píštělemi (34, 71–73). CN lehce zvyšuje potřebu císařského řezu (incidence u zdravé populace 15 % u CN 20,9 %). Porod by neměl být veden vaginální cestou u CN s perianálním onemocněním, i když toto je v době těhotenství a období porodu zcela inaktivní. Hrozí dystokie ve II. době porodní s rizikem vážných porodních poranění perinea a anatomie sfinkterového uzávěru konečníku, a to i při preventivně provedené mediolaterální nebo dokonce laterální epiziotomii. Ani použití porodnických kleští nebo vakuumextraktoru nelze nikdy předem vyloučit a při těchto instrumentálních porodech je zvýšená incidence rozsáhlých porodních poranění. Vaginální porod u těhotné s anamnézou idiopatického střevního zánětu by se měl povolit jen u ženy bez projevů prodělaného rektálního a perianálního onemocnění.
Rozhodnutí o způsobu vedení porodu má být přísně individuální a vždy by mělo být výsledkem shody porodníka, gastroenterologa a eventuálně i chirurga (34).
Nízká porodní hmostnost a předčasný porod u těhotných s idiopatickými střevními záněty
Nízká porodní hmotnost dítěte přináší špatné kognitivní funkce, poruchy chování a sociální adaptace, zvýšené riziko kardiovaskuláních onemocnění a zvýšené riziko dalších chronických onemocnění (4, 78–81). Jiná klinická studie uvedené souvislosti popírá (82). Riziko nízké porodní hmotnosti a předčasného porodu je uváděno častěji u CN (29, 83, 84) než u UC (85).
Nízká porodní hmotnost u dětí matek s ISZ je vysvětlována tím, že je zhoršen nutriční stav matky během relapsu a dlouhodobě podávané kortikosteroidy působí negativně na plod (inhibice proteosyntézy) spíše než na matčino onemocnění (24, 86).
Malformace
Idiopatické střevní záněty nejsou spojeny s rizikem kongenitálních malformací (27). Nebylo prokázáno větší riziko pro vznik malformací plodu ani u UC (85, 87)ani u CN (87, 88).
Závěry dánské studie uvádí, že při léčbě azathioprinem a merkaptopurinem je zvýšené riziko kongenitálních malformací, perinatální mortality a předčasných porodů (89).
Šestinedělí
Období po porodu je obdobím potenciální exacerbace, kdy se uplatní různé vlivy: obnovení kouření, vysazení medikace v období před porodem, změna medikace v období po porodu, hormonální změny, možná infekce Clostridium difficile po pobytu v nemocnici, pokles hodnot protizánětlivých cytokinů (IL-10, IL-4,TGFß), které jsou inhibovány estrogeny v graviditě a vzestup prozánětlivých cytokinů (IL-12, TNF-α, INF-γ) (34, 90, 91)
Kojení
Některé studie zjišťují, že kojení má protektivní vliv vůči riziku idiopatického střevního zánětu, riziko vzniku CN se snižuje na 33 % a riziko vzniku UC se snižuje na 23 %. Kojení má vliv na výskyt a tíži mnoha infekčních onemocnění. Vliv by mohlo mít zřejmě i velké znečištění ovzduší v průmyslových oblastech, když se „nečistoty“ dostávají do mléka. Ale další studie vyvrací protektivní vliv kojení u CN a nevyvrací pozitivní působení kojení u UC. Poslední sumarizující práce nedávají jednoznačný závěr týkající se vlivu kojení na vznik idiopatického střevního zánětu. Prolaktin, který je zvýšen během laktace, alteruje produkci cytokinů, čímž má působit protizánětlivě (34, 92–96).
Aminosalicyláty
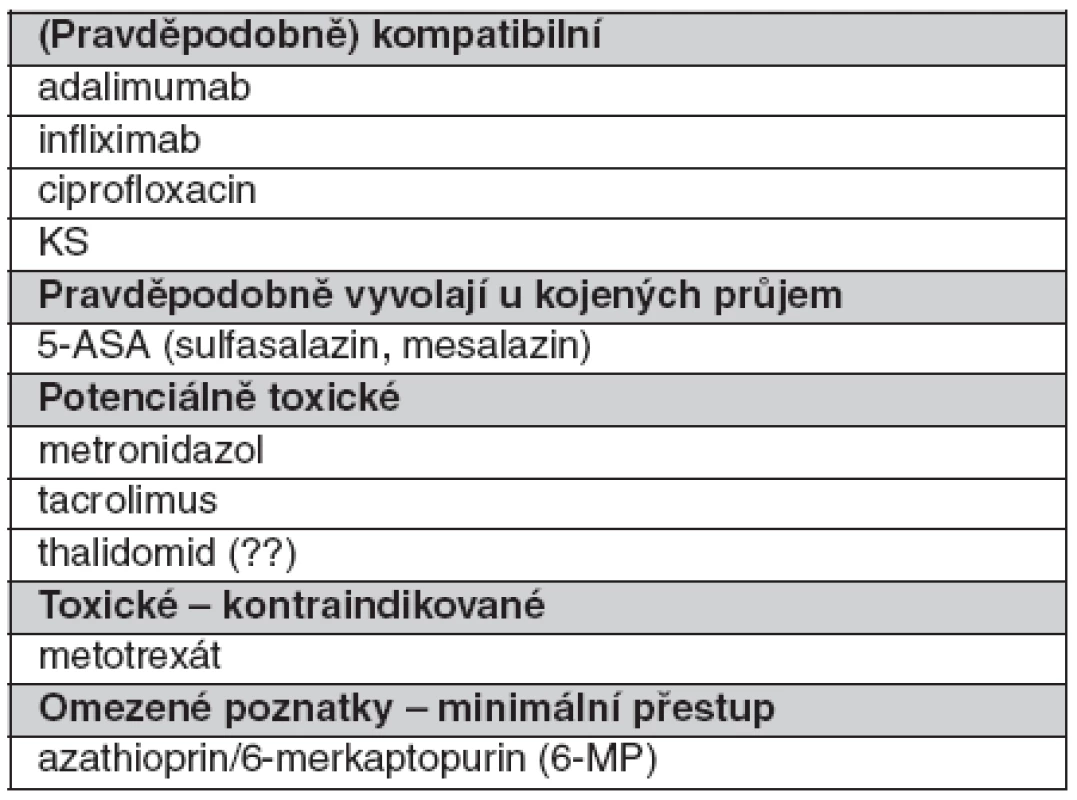
Aminosalicyláty přestupují do mateřského mléka v minimálních bezvýznamných množstvích. Lze je užívat při kojení, ale objeví-li se u dítěte signifikantní průjem, pak je nutné zastavit kojení nebo podávání léku (34, 35).
Kortikosteroidy
Na užívání kortikosteroidů jsou lehce rozdílné pohledy. Kortikosteroidy pronikají do mateřského mléka a novorozenci tyto látky obtížně ve svém organismu odbourávají, což činí kojení problematickým (23). Kortikosteroidy je možné užívat při kojení, nebyly zaznamenány vedlejší účinky u dětí. Kortikosteroidy přechází do mateřského mléka minimálně, ale doporučuje se nekojit 4 hodiny po požití kortikosteroidů, čímž je minimalizována expozice kojeného dítěte (97).
Antibiotika
Ciprofloxacin je zatím při kojení neznámou veličinou, přestupuje do mléka, ale data jsou nedostatečná. Je podáván při jeho nezbytnosti a vliv na dítě není známý (34, 98).
Metronidazol
Přechází do mléka, ale nebyly zjištěny žádné reakce ani vedlejší účinky (99).
Azathioprin/6-merkaptopurin
WHO nedoporučuje užívat tyto preparáty během kojení. Působí u dětí potlačení krvetvorby, imunosupresi, hepatitidu a pankreatitidu. I když studiemi je prokazován jen minimální přechod do mateřského mléka (100–104). Je potřebné pečlivě zvážit riziko při podávání proti prospěchu. V současnosti nejsou udávány absolutní kontraindikace (34).
Cyklosporin
Je v období kojení kontraindikován pro možnou imunosupresi a neznámý účinek na růst a nejasný vztah ke karcinogenéze (34, 105). Ale koncentrace v krvi kojených je velmi nízká (hladina není terapeutická), je málo prokázaných vedlejších účinků, a tak jsou někteří i přes konvenční zákaz přesvědčeni, že cyklosporin je možné při kojení podávat – a na malých studiích to dokazují (105).
Metotrexát
Je vylučován do mateřského mléka v nízké koncentraci, nižší než 10% hladina, která je v plazmě. Účinek na dítě není známý, předpokládána je dlouhodobá akumulace s pravděpodobnou imunosupresí, neutropenií a neznámým účinkem na růst a karcinogenezi. Je doporučeno nepodávat jej během kojení (34, 106).
Biologická léčba
Pokles hladiny infliximabu u kojených novorozenců ukazuje na přestup placentou, ale nikoliv do mateřského mléka (63).
Aplikace adalimumabu u kojící pacientky s idiopatickým střevním zánětem je závislá na důležitosti podávání pro matku (34, 105, 106).
Přehled léků užívaných pro léčbu idiopatických střevních zánětů při kojení je uveden v tabulce 5.
Ukončení těhotenství
Idiopatické střevní záněty nemají nežádoucí účinek na ukončení těhotenství, nejsou jim popisována úmrtí novorozenců.
Častější jsou: předčasné porody (< 37 týden) navýšení 1,87× a nízká porodní váha (< 2500 g) navýšení 2× (4, 78). Prognózu uvádí tabulka 6 a souhrn základních znalostí o idiopatických střevních zánětech a těhotenství tabulka 7.
Genetika
Z genetického hlediska jsou CN a UC typickým příkladem multifaktoriálně podmíněných onemocnění. Znamená to, že na jejich vzniku se podílí množství genů a výsledný klinický projev (fenotyp) je pak výrazně ovlivňován faktory zevního prostředí.
Genetický výzkum je v současnosti zaměřen především na určení tzv. kandidátních genů, které se spolupodílejí na vzniku idiopatického střevního zánětu. Tyto geny jsou lokalizovány pomocí vazebných nebo asociačních studií. Druhá část výzkumu spočívá v určení variant (mutací) v jednotlivých kandidátních genech a především ve snaze stanovit jejich fenotypový efekt. Oba tyto přístupy používají nejmodernější metody molekulární genetiky. V databázi lidských genů a dědičných onemocnění OMIM (Online Mendelian Inheritance in Man), dostupné na internetu (107, 108), můžeme v současné době nalézt 28 tzv. IBD (Inflammatory bowel disease) lokusů (genů). Toto číslo se však mění a kandidátních genů přibývá.
Jako první z kandidátních genů pro CN byl určen gen NOD2 /CARD1, dnestzv. IBD1 (MIM 605956), který je umístěn na chromozomu 16 a který slouží jako intracelulární receptor v monocytech při detekci bakteriálního muramyl dipeptidu. V následné kaskádě signálů ovlivňuje aktivitu imunitního systému. V genu byly nalezeny tři mutace asociované s CN: mutace L1007fsinsC způsobující posun čtecího rámce a zkrácení výsledného proteinu a missense mutace R702W a G908R, jejichž důsledkem jsou záměny aminokyseliny ve vznikajícím proteinu.
Dále byly stanoveny v chronologickém pořadí geny SLC22A4 (OCTN1) a SLC22A5 (OCTN2) – dnes jako IBD5 (MIM 606348), oblast HLA (hlavního histokompatibilitního komplexu) – dnes jako IBD3. Následovala řada genů kódujících buď interleukiny, nebo jejich receptory; silnou asociaci s oběma chorobami – CN i UC – vykazují například genetické změny v genu pro receptor interleukinu 23 (IL23R, MIM 607562, nyní též jako lokus IBD17).
Znalost fenotypového efektu jednotlivých změn v genech asociovaných s CN a UC by v budoucnu mohla umožnit predikci klinického vývoje onemocnění, včetně predikce vzniku onemocnění u potomků postižených osob. Zároveň by mohly být vytvořeny předpoklady k cílenější terapii. Protože uvedených 28 kandidátních genů pro idiopatický střevní zánět lze pokládat za geny relativně „malého účinku“. Výsledný klinický obraz choroby je výrazně ovlivněn jednak vlivy zevního prostředí, ale i kompletním genetickým pozadím (background) jedinců. Proto interpretace významu změn (mutací) v genech asociovaných s ISZ naráží na neznalost interakcí mezi nimi samými a na neznalost interakcí s ostatními geny jedince. Významnou negativní roli v interpretaci hrají i rozdíly mezi populacemi. Dosažené výsledky nejsou zatím v praxi použitelné (108, 109).

Zkratky
- CN – Crohnova nemoc
- IBD – Inflammatory bowel disease
- ISZ – idiopatické střevní záněty
- OMIM – Online Mendelian Inheritance in Man
- OTIS – Organization for Teratology Information Specialists
- 6-MP – 6-merkaptopurin
- UC – ulcerózní kolitida
- WHO – Světová zdravotnická organizace
Adresa pro korespondenci:
MUDr. Karel Lukáš, CSc.
IV. interní klinika 1. LF UK a VFN
U Nemocnice 2, 128 08 Praha 2
e-mail: klukas@vfn.cz
Sources
1. Bortoli A, Saibeni S, Tatarella M, Prada A, Beretta L, Rivolta R, Politi P, Ravelli P, Imperiali G, Colombo E, Pera A, Daperno M, Carnovali M, de Franchis R, Vecchi M. Study Group for Inflammatory Bowel Diseases GSMII: Pregnancy before and after the diagnosis of inflammatory bowel diseases: retrospective case-control study. J Gastroenterol Hepatol 2007; 22(4): 542–549.
2. Dignass AU, Hartmann F, Sturm A, Stein J. Management of inflammatory bowel diseases during pregnancy. Dig Dis 2009; 27(3): 341–346.
3. Mahadevan, U, Sandborn, WJ, Li D-K, Hakimian S, Kane S, Corley DA. Pregnanacy Outcomes in Women With Inflammatory Bowel Disease: A Large Community-Based Study From Nothern Kalifornia. Gastreonterology 2007; 133(4): 1106–1112.
4. Cornish J, Tan E, Teare J, Teoh TG, Rai R, Clark SK, Tekis PP. A meta-analysis on the influence inflammatory bowel disease on pregnancy. Gut 2007; 56 : 830–837.
5. Sigmund B, Zeitz M. Inflammatory bowel disease and pregnancy. Z Gastroenterol 2009; 47(10): 1069–1074.
6. Cohen RD. Inflammatory Bowel Dis. Totowa New Jersey: Humana Press 2003; s. 299.
7. Godet PG,May GR, Sutherland LR. Meta-analysis of the role of oral contraceptive agents in inflammatory bowel disease. Gut 1995; 37 : 668–673.
8. Timmer A, Sutherland LR, Martin F. Oral contraceptive use and smoking are risk factors for relapse in Crohn‘s disease. The Canadian Mesalamine for Remission of Crohn‘s Disease Study Group. Gastroenterology 1998; 114(6): 1143–1150.
9. Cottone M, Orlando A, Viscido A, Calabrese E, Cammą C, Casą A. Review article: prevention of postsurgical relapse and recurrence in Crohn‘s disease. Aliment Pharmacol Ther 2003; 17 (Suppl 2): 38–42.
10. Cosnes J, Carbonnel F, Carrat F, Beaugerie L, Gendre JP. Oral contraceptive use and the clinical course of Crohn‘s disease: a prospective cohort study. Gut 1999; 45(2): 218–222.
11. Cornish JA, Tan E, Simillis C, Clark SK, Teare J, Tekkis PP. The risk of oral contraceptives in the etiology of inflammatory bowel disease: a meta-analysis. Am J Gastroenterol 2008; 103(9): 2394–2400.
12. Ida A, Koyama K. Ulcerative colitis and pregnancy. Nippon Rinsho 1999; 57(11): 2603–2607.
13. Alstead EM. Inflammatory bowel disease in pregnancy. Postgrad Med J 2002; 78(923): 572.
14. Mayberry JF, Weterman IT. European survey of fertility and pregnancy in women with Crohn‘s disease: a case control study by European collaborative group. Gut 1986; 27(7): 821–825.
15. Zimmermann EM. Approach to Gastrointestinal Disease in the Female Patiens. In: Textbook of Gastroenterology. Yamada, T. ed.: Lippincott Williams & Wilkins 1999, s. 1059–1080.
16. Korelitz BI. Inflammatory bowel disease and pregnancy. Gastreonterol Clin N Amer 1998; 27(1): 213–224.
17. Heetun ZS, Byrnes C, Neary P, O‘Morain C. Review article: Reproduction in the patient with inflammatory bowel disease.Aliment Pharmacol Ther 2007; 26(4): 513–533.
18. Hinkes E, Plotkin D. Reversible drug-induced sterility in a patient with acute leukemia. JAMA 1973; 223(13): 1490–1491.
19. Rajapakse RO, Korelitz BI, Zlatanic J, Baiocco PJ, Gleim GW. Outcome of pregnancies when fathers are treated with 6‑mercaptopurine for inflammatory bowel disease. Am J Gastroenterol 2000; 95(3): 684–688.
20. Suominen JS, Wang Y, Kaipia A, Toppari J. Tumor necrosis factor-alpha (TNF-alpha) promotes cell survival during spermatogenesis, and this effect can be blocked by infliximab, a TNF-alpha antagonist. Eur J Endocrinol 2004; 151(5): 629–640.
21. Cornish JA, Tan E, Teare J, Teoh TG, Rai R, Darzi AW, Paraskevas P, Clark SK, Tekkis PP. The effect of restorative proctocolectomy on sexual function, urinary function, fertility, pregnancy and delivery: a systematic review. Dis Colon Rectum 2007; 50(8): 1128–1138.
22. Pintérová Kolesárová M, Pintér M, Rejchrt S, et al. Vliv idiopatického střevního zánětu na interval potřebný pro početí pacientek. Čes Gynek 2008; 73 : 109–112.
23. Zbořil V, et al. Imunosupresiva v éčbě idiopatických střevních zánětů. Praha: Grada Publishing 2007; s. 100–112.
24. Mogadam M, Korelitz BI, Ahmed SW, Dobbins WO 3rd, Baiocco PJ. The course of inflammatory bowel disease during pregnancy and postpartum.. Am J Gastroenterol 1981; 75(4): 265–269.
25. Miller JP. Inflammatory bowel disease in pregnancy: a review. J R Soc Med 1986; 79(4): 221–225.
26. Reddy D, Murphy SJ, Kane SV, Present DH, Kornbluth AA. Relapses of inflammatory bowel disease during pregnancy: in-hospital management and birth outcomes. Am J Gastroenterol 2008; 103(5): 1203–1209.
27. Mountfield R, Bampton P, Prosser R, Muller K, Andrews JM. Fear and Fertility in Inflammatory Bowel Disease: A Mismatch of Perception and Reality Affects Family Planning Decisions. Inflamm Bowel Dis 2009; 15(5): 720–725.
28. Sonnenberg A. Date of birth in the occurrence of inflammatory bowel disease. Inflamm Bowel Dis 2009; 15(2): 206–211.
29. Dominitz JA, Young JC, Boyko EJ. Outcomes of infants born to mothers with inflammatory bowel disease: a population-based cohort study. Am J Gastroenterol 2002; 97(3): 641–648.
30. Van Assche G, Dignass A, Reinisch W, et al. The second European evidence-based Consensus on the diagnosis and management of Crohn’s disease: Speciál situations. Journal of Crohn’s Colitis (2010), doi: 10.1016/j.crohns.2009.09.009.
31. American Gastroenterological Association Institute: American Gastroenterological Association Institute Position Statement on the Use Gastrointestinal Medications in Pregnancy. Gastroenterology 2006; 131 : 278–282, 283–311.
32. Ferrero S, Ragni N. Inflammatory bowel disease: management issues during pregnancy. Arch Gynecol Obstet 2004; 270(2): 79–85.
33. Mogadam M, Dobbins WO 3rd, Korelitz BI, Ahmed SW. Pregnancy in inflammatory bowel disease: effect of sulfasalazine and corticosteroids on fetal outcome. Gastroenterology 1981; 80(1): 72–76.
34. Dubinsky M, Abraham B, Mahadevan U. Management of the pregnant IBD patient.. Inflamm Bowel Dis 2008; 14(12): 1736–1750.
35. Brar H, Einarson A. Effects and treatment of inflammatory bowel disease during pregnancy. Can Fam Physician 2008; 54(7): 981–983.
36. Habal FM, Hui G, Greenberg GR. Oral 5-aminosalicylic acid for inflammatory bowel disease in pregnancy: safety and clinical course. Gastroenterology 1993; 105(4): 1057–1060.
37. Marteau P, Devaux CB. Mesalazine during pregnancy. Lancet 1994; 344(8938): 1708–1709.
38. Marteau P, Tennenbaum R, Elefant E, Lémann M, Cosnes J. Foetal outcome in women with inflammatory bowel disease treated during pregnancy with oral mesalazine microgranules. Aliment Pharmacol Ther 1998; 12(11): 1101–1108.
39. Trallori G, d‘Albasio G, Bardazzi G, Bonanomi AG, Amorosi A, Del Carlo P, Palli D, Galli M, Pacini F. 5-Aminosalicylic acid in pregnancy: clinical report. Ital J Gastroenterol 1994; 26(2): 75–78.
40. NŅrgĆrd B, Puho E, Pedersen L, Czeizel AE, SŅrensen HT. Risk of congenital abnormalities in children born to women with ulcerative colitis: a population-based, case-control study. Am J Gastroenterol 2003; 98(9): 2006–2010.
41. Czeizel AE, Rockenbauer M. A population based case-control teratologic study of oral metronidazole treatment during pregnancy. Br J Obstet Gynaecol 1998; 105(3): 322–327.
42. Czeizel AE, Tóth M. Birth weight, gestational age and medications during pregnancy. Int J Gynaecol Obstet 1998; 60(3): 245–249.
43. Niebyl JR. Antibiotics and other anti-infective agents in pregnancy and lactation. Am J Perinatol 2003; 20(8): 405–414.
44. Loebstein R, Addis A, Ho E, Andreou R, Sage S, Donnenfeld AE, Schick B, Bonati M, Moretti M, Lalkin A, Pastuszak A, Koren G. Pregnancy outcome following gestational exposure to fluoroquinolones: a multicenter prospective controlled study. Antimicrob Agents Chemother 1998; 42(6): 1336–1339.
45. Larsen H, Nielsen GL, SchŅnheyder HC, Olesen C, SŅrensen HT. Birth outcome following maternal use of fluoroquinolones. Int J Antimicrob Agents 2001; 18(3): 259–262.
46. Rodríguez-Pinilla E, Martínez-Frías ML. Corticosteroids during pregnancy and oral clefts: a case-control study. Teratology 1998; 58(1): 2–5.
47. Gur C, Diav-Citrin O, Shechtman S, Arnon J, Ornoy A. Pregnancy outcome after first trimester exposure to corticosteroids: a prospective controlled study. Reprod Toxicol 2004; 18(1): 93–101.
48. Boulton R, Hamilton M, Lewis A, Walker P, Pounder R. Fulminant ulcerative colitis in pregnancy. Am J Gastroenterol 1994; 89(6): 931–933.
49. Kment M, a kol. Choroby gastrointestinálního traktu v raviditě. Praha: Triton 2003; 58 s.
50. Gluck JC, Gluck PA. Asthma controller therapy during pregnancy. Am J Obstet Gynecol 2005; 192(2): 369–380.
51. Gluck PA, Gluck JC. A review of pregnancy outcomes after exposure to orally inhaled or intranasal budesonide. Curr Med Res Opin 2005; 21(7): 1075–1084.
52. Norjavaara E, de Verdier MG. Normal pregnancy outcomes in a population-based study including 2,968 pregnant women exposed to budesonide. J Allergy Clin Immunol 2003; 111(4): 736–742.
53. Källén B, Rydhstroem H, Aberg A. Congenital malformations after the use of inhaled budesonide in early pregnancy. Obstet Gynecol 1999; 93(3): 392–395.
54. Beaulieu DB, Ananthakrishnan AN, Issa M, Rosenbaum L, Skaros S, Newcomer JR, Kuhlmann RS, Otterson MF, Emmons J, Knox J, Binion DG. Budesonide induction and maintenance therapy for Crohn‘s disease during pregnancy. Inflamm Bowel Dis 2009; 15(1): 25–28.
55. Del Campo M, Kosaki K, Bennett FC, Jones KL. Developmental delay in fetal aminopterin/methotrexate syndrome. Teratology 1999; 60(1): 10–12.
56. Stenson WF, Hanauer SB, Cohen RD. Inflammatory bowel disease. In: Texbook of Gastroenterology. Yamada, T. ed.: Willey-Blackwell; Oxford: Hoboken 2009; 1386–1472.
57. Lichtenstein GR, Hanauer SB, Sandborn WJ, The Practice Parameters Comittee of the American College of Gastroenterology. Management of Crohn’s Disease in Adults. Amer J Gastroenterol 2009; 104: www.amjgastro.com.
58. Angelberger S, Reinisch W, Dejaco C. Prevention of abortion by ciclosporin treatment of fulminant ulcerative colitis during pregnancy. Gut 2006; 55(9): 1364–1365.
59. Bertschinger P, Himmelmann A, Risti B, Follath F. Cyclosporine treatment of severe ulcerative colitis during pregnancy. Am J Gastroenterol 1995; 90(2): 330.
60. Reindl W, Schmid RM, Huber W. Cyclosporin A treatment of steroid-refractory ulcerative colitis during pregnancy: report of two cases. Gut 2007; 56(7): 1019.
61. Coburn LA, Wise PE, Schwartz DA. The successful use of adalimumab to treat active Crohn‘s disease of an ileoanal pouch during pregnancy. Dig Dis Sci 2006; 51(11): 2045–2047.
62. Mishkin DS, Van Deinse W, Becker JM, Farraye FA. Successful use of adalimumab (Humira) for Crohn‘s disease in pregnancy. Inflamm Bowel Dis 2006; 12(8): 827–828.
63. Hoentjen F, van Bodegraven AA. Safety of anti-tumor necrosis factor therapy in inflammatory bowel disease. World J Gastroenterol 2009; 15(17): 2067–2073.
64. Ehrenpreis ED, Kane SV, Cohen LB, Cohen RD, Hanauer SB. Thalidomide therapy for patients with refractory Crohn‘s disease: an open-label trial. Gastroenterology 1999; 117(6): 1271–1277.
65. Griffiths AM, Ohlsson AP, Herman M, et al. Meta-analysis of enteral nutrition as a primary treatment of active Crohn’s disease. Gastroenterology 1995; 108 : 1056.
66. Griffiths AM. Inflammatory bowel disease. Nutrition 1998; 14 : 788.
67. ESPEN Doporučené postupy pro enterální výživu: Gastroenterologie. http: //www.nutriciamedical.sk/tinymce/ jscripts/tiny_mce/plugins/filemanager/files/espen_guidelines.pdf.
68. Kilpatrick CC, Monga M. Approach to the acute abdomen in pregnancy. Obstet Gynecol Clin North Am 2007; 34(3): 389–402.
69. Upadhyay A, Stanten S, Kazantsev G, Horoupian R, Stanten A. Laparoscopic management of a nonobstetric emergency in the third trimester of pregnancy. Surg Endosc 2007; 21(8): 1344–1348.
70. Katz JA. Pregnancy and inflammatory bowel disease. Curr Opin Gastroenterol 2004; 20(4): 328–332.
71. Mottet C, Juillerat P, Gonvers JJ, Froehlich F, Burnand B, Vader JP, Michetti P, Felley C. Pregnancy and Crohn‘s disease. Digestion 2005; 71(1): 54–61.
72. Guessous I, Juillerat P, Pittet V, Froehlich F, Burnand B, Mottet C, Felley C, Michetti P, Vader JP. Evaluating appropriateness of treatment for Crohn‘s disease: feasibility of an explicit approach. Digestion 2007; 75(1): 46–52.
73. Brandt LJ, Estabrook SG, Reinus JF. Results of a survey to evaluate whether vaginal delivery and episiotomy lead to perineal involvement in women with Crohn‘s disease. Am J Gastroenterol 1995; 90(11): 1918–1922.
74. Gould SR, Brash AR, Conolly ME, Lennard-Jones JE. Studies of prostaglandins and sulphasalazine in ulcerative colitis. Prostaglandins Med 1981; 6(2): 165–182.
75. Baird DD, Narendranathan M, Sandler RS. Increased risk of preterm birth for women with inflammatory bowel disease. Gastroenterology 1990; 99(4): 987–994.
76. Wilcox AJ, Weinberg CR, Baird DD. Risk factors for early pregnancy loss. Epidemiology 1990; 1(5): 382–385.
77. Morales LS, Staiger D, Horbar JD, Carpenter J, Kenny M, Geppert J, Rogowski J. Mortality among very low-birthweight infants in hospitals serving minority populations. Am J Public Health 2005; 95(12): 2206–2212.
78. Fedorkow DM, Persaud D, Nimrod CA. Inflammatory bowel disease: a controlled study of late pregnancy outcome. Am J Obstet Gynecol 1989; 160(4): 998–1001.
79. Larzilliere I, Beau P. Chronic inflammatory bowel disease and pregnancy. Case control study Gastroenterol Clin Biol 1998; 22(12): 1056–1060.
80. Kornfeld D, Cnattingius S, Ekbom A. Pregnancy outcomes in women with inflammatory bowel disease – a population-based cohort study. Am J Obstet Gynecol 1997; 177(4): 942–946.
81. Elbaz G, Fich A, Levy A, Holcberg G, Sheiner E. Inflammatory bowel disease and preterm delivery. Int J Gynaecol Obstet 2005; 90(3): 193–197.
82. UbiĖa-Aznar E, De Sola-Earle C, Rivera-Irigoin R, Fernández-Moreno N, Vera-Rivero F, Fernández-Pérez F, Navarro-Jarabo JM, García-Fernández G, Moreno-Mejías P, Pérez-Aisa A, Perea-Milla E. Crohn‘s disease and pregnancy. A descriptive and retrospective study. Gastroenterol Hepatol 2006; 29(5): 277–280.
83. Fonager K, SŅrensen HT, Olsen J, Dahlerup JF, Rasmussen SN. Pregnancy outcome for women with Crohn‘s disease: a follow-up study based on linkage between national registries. Am J Gastroenterol 1998; 93(12): 2426–2430.
84. Moser MA, Okun NB, Mayes DC, Bailey RJ. Crohn‘s disease, pregnancy, and birth weight. Am J Gastroenterol 2000; 95(4): 1021–1026.
85. NŅrgĆrd B, Puho E, Pedersen L, Czeizel AE, SŅrensen HT. Risk of congenital abnormalities in children born to women with ulcerative colitis: a population-based, case-control study. Am J Gastroenterol 2003; 98(9): 2006–2010.
86. Reinisch JM, Simon NG, Karow WG, Gandelman R. Prenatal exposure to prednisone in humans and animals retards intrauterine growth. Science 1978; 202(4366): 436–438.
87. Nielsen OH, Andreasson B, Bondesen S, Jarnum S. Pregnancy in ulcerative colitis. Scand J Gastroenterol 1983; 18(6): 735–742.
88. NŅrgĆrd B, Fonager K, Pedersen L, Jacobsen BA, SŅrensen HT. Birth outcome in women exposed to 5-aminosalicylic acid during pregnancy: a Danish cohort study. Gut 2003; 52(2): 243–247.
89. NŅrgĆrd B, Pedersen L, Fonager K, Rasmussen SN, SŅrensen HT. Azathioprine, mercaptopurine and birth outcome: a population-based cohort study. Aliment Pharmacol Ther 2003; 17(6): 827–834.
90. Įstensen M, Sicher P, Förger F, Villiger PM. Activation markers of peripheral blood mononuclear cells in late pregnancy and after delivery: a pilot study. Ann Rheum Dis 2005; 64(2): 318–320.
91. Įstensen M, Förger F, Nelson JL, Schuhmacher A, Hebisch G, Villiger PM. Pregnancy in patients with rheumatic disease: anti-inflammatory cytokines increase in pregnancy and decrease post partum. Ann Rheum Dis 2005; 64(6): 839–844.
92. Jantchou P, Turck D, Baldé M, Gower-Rousseau C. Breastfeeding and risk of inflammatory bowel disease: results of a pediatric, population-based, case-control study. Am J Clin Nutr 2005; 82(2): 485–486.
93. Klement E, Cohen RV, Boxman J, Joseph A, Reif S. Breastfeeding and risk of inflammatory bowel disease: a systematic review with metaanalysis. Am J Clin Nutr 2004; 80 : 1342–1352.
94. Baron S, Turck D, Leplat C, et al. Environmental risk factors in pediatric inflammatory bowel diseases: a population-based case-control study. Gut 2005; 54 : 357 – 363.
95. Farrukh A, Mayberry JF. Breastfeeding and Inflammatory Bowel Disease. Inflamm Bowel Dis 2008; 14 (Suppl 2): 39–40.
96. Sodhi A, Tripathi A. Prolactin induced production of cytokines in macrophages involves Ca++ and p42/44 MAP kinase signaling pathway. Growth Factors 2008; 26(4): 212–219.
97. Ost L, Wettrell G, Björkhem I, Rane A. Prednisolone excretion in human milk. J Pediatr 1985; 106(6): 1008–1011.
98. Physician Desk Reference, Thomson Health Care Inc, NJ 2008 (www.PDR.net).
99. Heisterberg L, Branebjerg PE. Blood and milk concentrations of metronidazole in mothers and infants. J Perinat Med 1983; 11(2): 114–120.
100. Moretti ME, Verjee Z, Ito S, Koren G. Breast-feeding during maternal use of azathioprine. Ann Pharmacother 2006; 40(12): 2269–2272.
101. Gardiner SJ, Gearry RB, Roberts RL, Zhang M, Barclay ML, Begg EJ. Exposure to thiopurine drugs through breast milk is low based on metabolite concentrations in mother-infant pairs. Br J Clin Pharmacol 2006; 62(4): 453–456.
102. Gardiner SJ, Gearry RB, Barclay ML, Begg EJ. Two cases of thiopurine methyltransferase (TPMT) deficiency – a lucky save and a near miss with azathioprine. Br J Clin Pharmacol 2006; 62(4): 473–476.
103. Sau A, Clarke S, Bass J, Kaiser A, Marinaki A, Nelson-Piercy C. Azathioprine and breastfeeding: is it safe? Br J OBstet Gynecol 2007; 114(4): 498–501.
104. American Academy Ped Comittee on Drugs. Pediatrics 2001; 108 : 776–789.
105. Moretti ME, Sgro M, Johnson DW, Sauve RS, Woolgar MJ, Taddio A, Verjee Z, Giesbrecht E, Koren G, Ito S. Cyclosporine excretion into breast milk. Transplantation 2003; 75(12): 2144–2146.
106. Mikhailov TA, Furner SE. Breastfeeding and genetic factors in the etiology of inflammatory bowel disease in children. World J Gastroenterol 2009; 15(3): 270–279. http: //www.ncbi.nlm. nih.gov/sites/entrez?db=omim
107. http://www.ncbi.nlm.nih.gov/sites/entrez?db=omim
108. Zhang H, Massey D, Tremelling M, Parkes M. Genetics of inflammatory bowel disease: clues to pathogenesis. Review. Br Med Bull 2008; 87 : 17–30.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental HygienistArticle was published in
Journal of Czech Physicians

- Advances in the Treatment of Myasthenia Gravis on the Horizon
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
-
All articles in this issue
- Adipose tissue blood flow and metabolic syndrome
- Plasma citrulline concentration – a reliable noninvasive marker of functional enterocyte mass
- Inflammatory bowel disease and pregnancy
- Examination of exhaled breath condensate in cystic fibrosis
- Cancer multiplicities in the Czech population
- Toxoplasmosis of the central nervous systems after allogeneic stem cell transplantation
- Concept of nicotine dependence treatment in Mayo Clinic, USA
- Journal of Czech Physicians
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Plasma citrulline concentration – a reliable noninvasive marker of functional enterocyte mass
- Inflammatory bowel disease and pregnancy
- Cancer multiplicities in the Czech population
- Examination of exhaled breath condensate in cystic fibrosis

