Shyův-Dragerův syndrom
Shy-Drager syndrome
Shy-Drager syndrome is a rare neurological disease with a poor prognosis causing a generalised autonomy dysfunction. The disorder is also known as multiple system atrophy, the orthostatic hypotension syndrome or Shy-McGee-Drager syndrome. Patients have mainly dysautonomic symptoms. Patients suffer from orthostatic hypotension, bradycardia, anhidrosis, failure of accommodation, sialoporia, low tears secretion, gastrointestinal dysmotility and incomplete emptying of the urinary bladder. Neuropathological examination of patient’s brains demonstrated neurodegenerative changes of the structures of central nervous system, mainly of brainstem. The Shy-Drager syndrome results from striatonigral and olivo-ponto-cerebellar atrophy and from accumulation of alpha - synuclein in these structures. The patients suffering from the Shy-Drager syndrome are very often misdiagnosed because of overlap of symptomatology with psychiatric and psychosomatic diseases. It is also very difficult to make the diagnosis because of complexity of symptoms. The prognosis of Shy-Drager syndrome is very poor; patients are markedly disabled and have shorter survival.
Key words:
Shy-Drager syndrome, multiple system atrophy, catecholamines, parkinsonian syndrome, autonomy dysfunction, orthostatic hypotension.
Authors:
Magdaléna Dušejovská; Tomáš Vařeka; Jaroslav Macášek; Karel Hrubant; Aleš Žák; Miroslav Zeman
Authors‘ workplace:
Univerzita Karlova v Praze, 1. lékařská fakulta, IV. interní klinika VFN
Published in:
Čas. Lék. čes. 2010; 149: 225-228
Category:
Case Report
Overview
Je popsán nepříliš častý, prognosticky však velmi závažný typ autonomní vegetativní dysfunkce, Shyův-Dragerův syndrom, jenž je také znám pod názvy multisystémová atrofie, neurogenní ortostatická hypotenze nebo Shy-McGee-Drager syndrom. Jedná se o soubor příznaků vyplývajících z postižení autonomního nervového systému. Charakteristickými znaky jsou ortostatická hypotenze, bradykardie, porucha akomodace, anhidróza, porucha sekrece slz a slin, dysmotilita gastrointestinálního traktu a porucha vyprazdňování močového měchýře. Patofyziologickým podkladem onemocnění jsou neurodegenerativní změny centrálního nervového systému v oblasti mozkového kmene s následnou atrofií a patologickým ukládáním alfa-synukleinu v těchto částech centrálního nervového systému. Vzhledem k rozmanitosti a různorodosti klinických příznaků je diagnostika velmi složitá. Potíže nemocných bývají často mylně vysvětlovány psychosomatickým onemocněním. Prognóza je závažná, onemocnění zhoršuje kvalitu života a významně zkracuje jeho délku.
Klíčová slova:
Shyův-Dragerův syndrom, multisystémová atrofie, katecholaminy, parkinsonský syndrom, autonomní dysfunkce, ortostatická hypotenze.
Úvod
V roce 1960 popsal Milton Shy spolu s Glenem Albertem Dragerem ortostatickou hypotenzi spojenou s neurologickým postižením a tento stav nazvali multisystémová atrofie (MSA) (1). Schatz (2) později zrevidoval nozologii autonomních dysfunkcí a rozdělil je takto:
- primární autonomní selhání (Bradburyův-Egglestonův syndrom), při kterém je přítomna pouze ortostatická hypotenze bez neurologického postižení a příznaků autonomní dysfunkce;
- multisystémová atrofie (Shyův-Dragerův syndrom – SDS) vyznačující se ortostatickou hypotenzí s neurologickým postižením;
- sekundární autonomní selhání (například při diabetes mellitus, amyloidóze,
deficitu dopamin b-hydroxylázy, intoxikaci těžkými kovy, drogami nebo při
maligních onemocněních jako paraneoplastický projev). Diagnóza SDS byla
oficiálně uznána až v roce 1996 (2). V roce 1998 bylo dělení
zjednodušeno na:
- cerebelární – MSA-C, cca 20 % a
- parkinsonskou – MSA-P, cca 80 % případů (3).
Demografie
Shyův-Dragerův syndrom postihuje dospělé jedince, muži jsou postiženi častěji než ženy – přibližně v poměru 9 : 1. Onemocnění se řadí mezi raritní choroby, údaje o incidenci se v literatuře rozcházejí. Výskyt v České republice není znám, světové písemnictví odhaduje incidenci MSA na 1,86–4,9/100 000/rok (4). Většina případů MSA je diagnostikováno u pacientů ve věku mezi 52–55 lety (5).
Etiologie a patofyziologie
Patofyziologickým podkladem onemocnění jsou neurodegenerativní změny postihující striato-nigrální a olivo-ponto-cerebelární oblast centrálního nervového systému (CNS) s jejich následnou atrofií a patologickým ukládáním alfa--synukleinu v postižených částech CNS (6). Jedná se o progresivní onemocnění nervového systému nápadné především ortostatickou hypotenzí.
Symptomatologie
Klinická symptomatologie – vedoucí příznaky u SDS – ukazuje tabulka 1
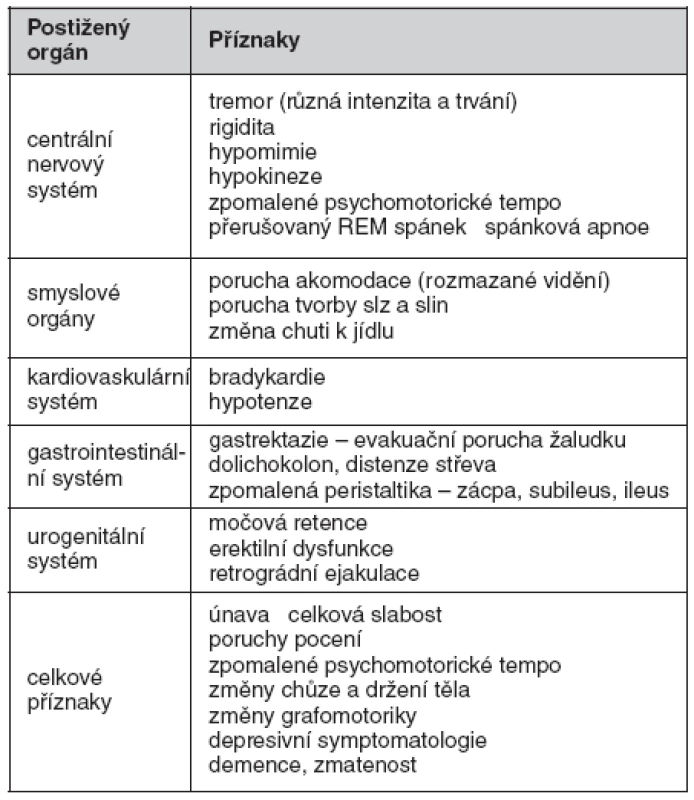
Mezi celkové příznaky patří únava, hubnutí, celková slabost, nevýkonnost, myalgie, změny chůze a celkového držení těla, popisovány jsou i změny písma. Intelekt ve většině případu zůstává nezměněn, často je ale přítomna depresivní symptomatologie, zřídka se může objevit demence či zmatenost (8).
Diagnostika
V případě podezření na multisystémovou atrofii je třeba – při získávání anamnestických dat – se aktivně ptát na přítomnost příznaků, ukazujících na postižení autonomního nervového systému a jejich zpětného vzájemného zhodnocení.
Fyzikální vyšetření je zaměřeno na celkový vzhled, chůzi, držení těla. Při vyšetření hlavy se soustředíme na reakci zornic – bývá mydriáza, dále nacházíme suché sliznice, rozbrázděný a povleklý jazyk. Při vyšetření hrudníku mohou být slyšet tiché srdeční ozvy, často zjišťujeme bradykardii a chronotropní inkompetenci (9–11). Při auskultačním vyšetření břicha je možné zaznamenat obleněnou peristalitiku. Neurologické vyšetření většinou neprokazuje motorickou či senzitivní lézi. Může být přítomen různě vyjádřený extrapyramidový syndrom a známky vegetativní dysfunkce (12). Oční vyšetření potvrdí suchost spojivek a poruchu akomodace. Je nutné provést holterovské monitorování krevního tlaku a EKG, kde bývá obvykle zjišťována hypotenze a bradykardie nereagující na zátěž vzestupem tepové frekvence.
Pro stanovení diagnózy je podstatné prokázat pokles hladiny katecholaminů v plazmě a moči (13). K vyloučení sekundární etiologie dysfunkce autonomního nervového systému pomůže vyšetření krevního obrazu, onkomarkerů, stimulačního hormonu tyroidey (TSH), glykémie. Dále se provádí skiagrafie hrudníku, EKG, elektro-myografie (EMG), základní screening neoplazií – ultrazvukové vyšetření břicha, gastroskopie, koloskopie, CT hrudníku a břicha, nukleární magnetická rezonance (NMR) mozku a celé páteře a urologické vyšetření.
V diferenciálně diagnostické rozvaze musíme uvážit: vrozené postižení vegetativního nervového systému, organické onemocnění srdce, zažívacího traktu, urologické onemocnění či vrozenou poruchu metabolismu.
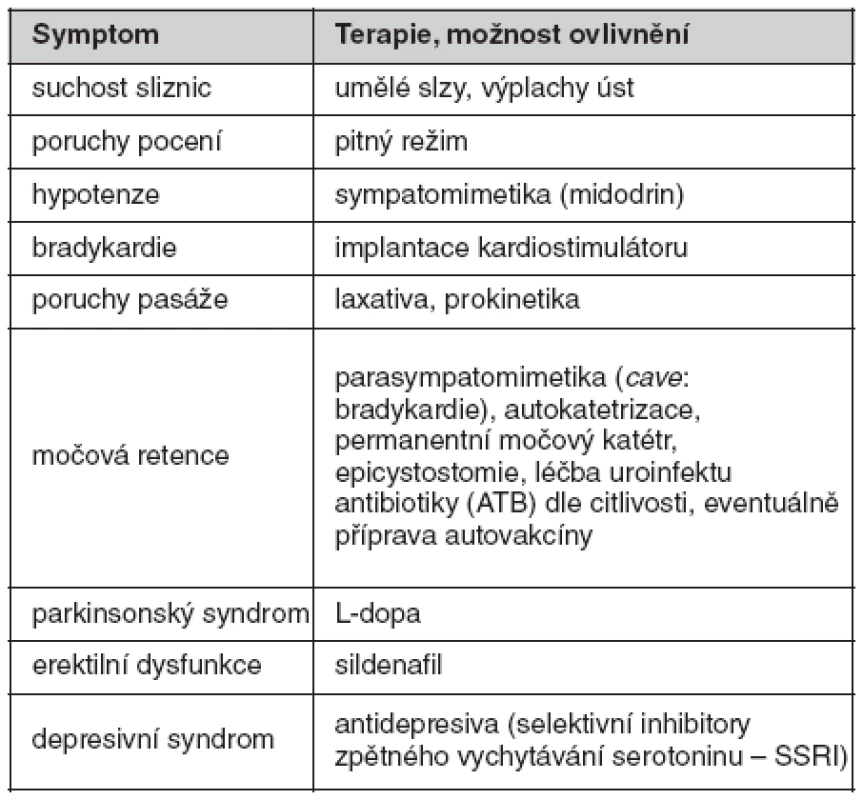
Terapie
Prognóza
Prognóza je velmi vážná, pacienti umírají během 7–10 let od počátku onemocnění na pneumonii, uroinfekci, arytmii. Do budoucna se zvažuje použití neurotransplantace (zatím probíhají experimentální studie) (8).
Kazuistika
Pacient (46 let) byl na naši kliniku přijat k vyšetření recidivujících subileozních stavů. V té době měl asi jeden a půl roku dlouhou anamnézu opakovaných pobytů v různých zdravotnických zařízeních pro polymorfní obtíže, jež byly uzavírány diagnózou psychosomatického onemocnění. Před tímto obdobím pacient vážněji nestonal. Je ženatý, má tři zdravé děti, pět sourozenců – jeden z bratrů zemřel na sarkom ve 42 letech, další prodělal infekční hepatitidu, matka má chronickou bronchitidu, otec se léčí se srdcem. Jinak byla rodinná anamnéza bez pozoruhodností. Pracoval jako soukromý podnikatel v obchodu, nyní je v invalidním důchodu.
Nynější onemocnění
Nemocný udával zejména zažívací obtíže spojené s recidivujícím subileozními stavy a váhovým úbytkem 23 kg za poslední rok. Při rozboru anamnézy však byla zjištěna ještě řada dalších obtíží – porucha sekrece slz, slin, závratě, porucha vyprazdňování močového měchýře a erektilní dysfunkce.
Objektivní nález při přijetí
Pacient byl při vědomí, orientovaný osobou, místem i časem, eupnoický, normostenický, mobilita – aktivní poloha na lůžku, stoj a chůze pouze s pomocí pro výraznou ortostatickou hypotenzi. TK v leže 90/50 mm Hg, po postavení pacient kolaboval s téměř neměřitelným tlakem, stále však přetrvávala bradykardie s frekvencí pod 60 tepů za minutu, bez vegetativního doprovodu. Dále bylo zjištěno mírně vzedmuté břicho a obleněná peristaltika a podezření na distenzi močového měchýře. Po zavedení močového katétru bylo v močovém měchýři nalezeno reziduum kolem 400 ml.
Laboratorní a pomocné vyšetřovací metody
Sedimentace v normě – FW 6/18, krevní obraz a koagulační parametry a hodnoty základních biochemických parametrů byly ve fyziologických rozmezích až na nízké HDL (0,59 mmol/l). Na EKG sinusová bradykardie, skiagrafie hrudníku bez patologických změn. Nativní snímek břicha s obrazem subileozního stavu s distenzí lienálního ohbí tračníku na 7 cm. Sonografie břicha ukázala pouze vícečetnou cholecystolitiázu. Při gastroskopii byla pozorována evakuační porucha žaludku a endoskopické známky duodenitidy. Koloskopie popsala dolichokolon. Současně byly odebrány biopsie s nálezem Helicobacter pylori v žaludku, ve střevní sliznici pouze nepříznačná chronická neaktivní kolitida. Amyloid nebyl prokázán. Irigografie dvojím kontrastem potvrdila dolichokolon, enteroklýza i CT hrudníku nezjistily patologické nálezy, při CT břicha obraz poruchy pasáže tračníkem a distenze močového měchýře. Neurolog konstatoval smíšenou autonomní dysfunkci s etiologií a prognózou nejasnou – bylo doporučeno provést EMG (normální nález) a odběr krve na gangliosidy. Gangliosidy byly ve třídě IgG slabě pozitivní (GD1), při rehospitalizaci byla nalezena slabá pozitivita ve třídě IgM (GM2), ve třídě IgG již negativní. Bylo vyloučeno autoagresivní demyelinizační onemocnění typu sclerosis multiplex. Urologické konsilium s urodynamickým vyšetřením prokázalo hyporeaktivní detrusor a pacient byl indikován a edukován k autokatetrizaci močového měchýře. Laboratorními vyšetřeními byl také prokázán stav po prodělané infekční hepatitidě typu A a po očkování proti hepatitidě B. Dále byly pozitivní protilátky anti-HSV1 IgG , CMV IgG, EBV IgM, anti-EBV/EA IgM, EBV-EA IgG, anti-CCP (493,8 U/ml (norma 0,25), v opakovaných odběrech s časovým odstupem cca 1 roku hodnoty narůstaly a dosahovaly až 1098–3200 U/ml); protilátky proti HIV, boreliím, treponemám byly negativní. Výsledek protilátek anti-CCP byl konzultován s revmatologem, který doporučil jen sledování. V opakovaných kontrolách byl zaznamenán vzestup anti-CCP (viz výše), bez klinického korelátu. Bylo doplněno vyšetření hladiny katecholaminů v plazmě a moči: v plazmě byla prokázána snížená hladina noradrenalinu 0,13 nmol/l (při normě 1,20–3,40) i adrenalinu – v 1. vzorku 0,39 a ve 2. vzorku 0,03 nmol/l (norma 0,10–0,80), hladina ACTH byla v normě – 6,7 ng/l (norma 1,0–50,0), odpady močí za 24 hodin byly zcela při dolní hranici normy (množství moče 2500 ml/24 h): noradrenalin 63,25 nmol/d (norma 60–475), adrenalin 31,0 nmol/d (norma 27–110), dopamin 3942,0 nmol/d (norma 1300–2900), odpad v moči za den (DU) u kyseliny vanilmandlové (VMA) 30,8 umol/d (norma 3–30), u kyseliny homovanilmandlové (HVA) DU 35,8 (norma 11–38). Tyto výsledky potvrzují diagnózu SDS. Hladina dopaminu byla zvýšena ještě pravděpodobně v souvislosti s předchozí léčbou levodopou s carbidopou (preparát Nakom) – byť byl lék dle doporučení před odběry vysazen.
Při screeningovém vyšetření k detekci vrozených poruch metabolismu nebyly zjištěny žádné odchylky (profil aminokyselin v krvi nesvědčil pro leucinozu, fenylektonurii/ hyperfenylalaninemii a tyrosinemii, metabolity typické pro deficit thymidinfosforylázy (thymidin a deoxyuridin) nedetekovány, profil acylkarnitinů v krvi nesvědčil pro poruchy β-oxidace mastných kyselin a organické acidurie). Rovněž byla vyloučena intoxikace olovem, amoniakem i rtutí. V dalším průběhu byla doplněna NMR mozku a celé páteře (s normálním nálezem) a nakonec CT PET k vyloučení paraneoplastické příčiny autonomní dysfunkce, kde se prokázala pouze zvýšená akumulace glukózy v oblasti Waldayerova lymfatického okruhu, hodnocená jako klinicky nevýznamná reaktivace lymfatické tkáně.
Po zhodnocení klinického stavu a všech nálezů byl pacientovi implantován kardiostimulátor, nasazena sympatomimetika (midodrini hydrochloridum) a zavedena symptomatická terapie dle tabulky 2. Tato léčebná opatření vedla k významnému zlepšení kvality života nemocného. Zatímco před léčbou byl pacient schopen pohybu jen za pomoci invalidního vozíku a ve stoje často kolaboval, v současné době je schopen samostatné chůze a sebeobsluhy.
Závěr
Zjištěné klinické nálezy spolu s poklesem hladiny katecholaminů svědčí pro diagnózu SDS. Význam zvýšené koncentrace protilátek anti-CCP v tomto případě není jasný. Jde o protilátky proti proteinu fillagrinu, jejichž zvýšená hladina je typická pro nemocné s revmatoidní artritidou (RA). Nález těchto protilátek většinou manifestaci RA předchází, podle některých studií je medián doby nálezu anti-CCP před manifestací RA cca 2,5–4,5 roku, přičemž senzitivita vyšetření je minimálně srovnatelná s vyšetřením revmatoidního faktoru (14). V odborné literatuře dosud jejich vztah k SDS nebyl popsán.
Zkratky
ACTH – adrenokortikotropní hormon
anti-CCP – protilátky proti cyklickému citrulin peptidu
anti-EBV/EA IgM – imunoglobuliny třídy M proti Ebsteina-Barrové viru
anti-HSV1 IgG – imunoglobuliny třídy G proti Herpes simplex viru 1
ATB – antibiotika
CMV IgG – imunoglobuliny třídy G cytomegalovirus
CNS – centrální nervový systém
CT PET – computerová pozitronová emisní tomografie
DU – odpad v moči za den
EBV-EA IgG – imunoglobuliny třídy G Ebsteina-Barrové viru
EBV IgM – imunoglobuliny třídy M Ebsteina-Barrové viru
EMG – elektro-myografie
HDL – high-density lipoprotein
HVA – kyselina homovanilmandlová
MSA – multisystémová atrofie
NMR – nukleární magnetická rezonance
RA – revmatoidní artritida
SDS – Shyův-Dragerův syndrom
SSRI – selektivní inhibitory zpětného vychytávání serotoninu
TSH – stimulační hormon thyroidey
VMA – kyselina vanilmandlová
Adresa pro korespondenci:
MUDr. Tomáš Vařeka
IV. interní klinika 1. LF UK a VFN
U Nemocnice 2, 128 08 Praha 2
e-mail: vareka.t@seznam.cz
Sources
1. Shy M, Drager GA. A neurological syndrome associated with ortostatic hypotension: a clinical – pathologic study. Arch Neurol 1960; 2 : 511–527.
2. Schatz IJ. Farewell to the „Shy-Drager syndrome“. Ann Int Med 1996; 125 : 74–75.
3. Gilman S, Wenning GK, Low PA, et al. Second consensus statement on the diagnosis of multiple system atrophy. Neurology 2008; 71 : 670–676.
4. Vanacore N. Epidemiological evidence on multiple system atrophy. J Neural Transm 2005; 112 : 1605–1612.
5. Ward C. An ethical dilemma involving a Shy-Drage patient: a case study. Journal of Neuroscience Nursing 2006; 38 : 6.
6. Quinn N, Wenning GK. Multiple system atrophy. Current Opinion in Neurology 1995; 8 : 323–326.
7. Benarroch EE. New finding on the neuropathology of multiple system atrophy. Autonomic Neuroscience: Basic and Clinical 2002; 96 : 59–62.
8. Wenning GK, Braune S. Multiple System Atrophy. CNS Drugs 2001; 15 : 839–852.
9. Mathias C J, Matthews WB, Spalding JMK. Postural changes in plasma renin activity and responses to vasoactive drugs in a case of Shy-Drager syndrome. J Neurol Neurosurg Psychiatry 1977; 40 : 138–143.
10. Furlan R, Piazza S, Bevilacqua M, et al. Pure Autonomic Failure: Complex abnormalities in the neural mechanisms regulating the cardiovascular system. J Auton Nerv Syst 1995; 51 : 223–235.
11. Smith GDP, Watson LP, Pavitt DV, Mathias CJ. Abnormal cardiovascular and catecholamine responses to supine exercise in human subjects with sympathetic dysfunction. J Physiol 1995; 484 : 255–265.
12. Gilman S, Low PA, Quinn N, et al. Consensus statement on the diagnosis of multiple system atrophy. J Neurol Sci 1999; 163 : 94–98.
13. Gross G, Nagel-Hiemke M, Krause KH. Plasma Catecholamines During Activation of the Sympathetic Nervous System in a Patient with Shy-Drager Syndrome. J Neurol 1980; 224 : 125–131.
14. van Boekel MA, Vossenaar ER, van den Hoogen FH, van Venrooij WJ. Autoantibody systems in rheumatoid arthritis: specificity, sensitivity and diagnostic value. Arthritis Res 2002; 4 : 87–93.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental HygienistArticle was published in
Journal of Czech Physicians

- Advances in the Treatment of Myasthenia Gravis on the Horizon
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
-
All articles in this issue
- Deficit rastového hormónu a jeho vplyv na kostnú minerálnu denzitu a riziko osteoporotických fraktúr
- Kontaktný ekzém a atopická dermatitída – vzácna komorbidita?
- Možnosti časné identifikace a následné péče o nestabilního nemocného
- Shyův-Dragerův syndrom
- Virus bez duše a ani v duších – úvod do ságy HIV viru
- Vývoj zdravotnej situácie v Českej republike a v Európskej únii
- Vztah terapie hyperglykémie a riziko ischemické choroby srdeční: rok 2010
- Journal of Czech Physicians
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Shyův-Dragerův syndrom
- Možnosti časné identifikace a následné péče o nestabilního nemocného
- Kontaktný ekzém a atopická dermatitída – vzácna komorbidita?
- Deficit rastového hormónu a jeho vplyv na kostnú minerálnu denzitu a riziko osteoporotických fraktúr
