Histologické hodnocení vlivu in vivo aplikace biomateriálů na hojení chrupavky, kosti a kůže
Histological evaluation of biomaterials administration in vivo on the cartilage, bone and skin healing
Our aim was to show the benefits and limitations of histological assessment of healing supported by implantable biomaterials. We reviewed and showed photographs of the histological and immunohistochemical methods applicable for the assessment of desirable and undesirable effects of biomaterials on the healing of hard and soft tissues. Currently used methods for evaluating the microscopic effects of bioengineered materials on the recipient tissue are reviewed. For histopathological analysis, semiquantitative scoring systems can be used. Alternatively, the main tissue constituents may be quantified using continuous variables giving the numerical densities of cells, lengths of microvessels or connective tissue fibres, area surfaces, area and volumes fractions, or clustering and colocalization of microscopic objects. Using systematic uniform random sampling strategies at the level of tissue blocks, sections, and image fields leads to a reasonable low variability of the quantitative results.
Keywords:
tissue engineering – stereology – immunohistochemistry
Authors:
Tereza Kubíková 1; Eva Filová 2; Eva Prosecká 2; Martin Plencner 2; Milena Králíčková 1; Zbyněk Tonar 1
Authors‘ workplace:
Ústav histologie a embryologie a Biomedicínské centrum LF UK, Plzeň
1; Oddělení tkáňového inženýrství, Ústav experimentální medicíny AV ČR, v. v. i.
2
Published in:
Čas. Lék. čes. 2015; 154: 110-114
Category:
Review Article
Overview
Cílem příspěvku je ukázat přínosy i omezení histologického hodnocení ovlivnění hojení při implantaci podpůrných biomateriálů. Podáváme přehled a fotodokumentaci histologických přehledných a imunohistochemických metod využitelných pro posouzení žádoucích i nežádoucích účinků biomateriálů při hojení tvrdých i měkkých tkání. Diskutujeme jednak mikroskopické hodnocení hojení s využitím semikvantitativních skórovacích systémů, jednak kvantifikaci složení tkáně pomocí jednotlivých spojitých proměnných, které popisují např. počet buněk v jednotkovém objemu, délky cév či vláknitých struktur matrix, plochy povrchů, plošné a objemové podíly složek tkáně, shlukování a kolokalizaci mikroskopických objektů. Strategie systematického nestranného náhodného výběru vede v histologii k významné redukci variability kvantitativních dat.
Klíčová slova:
tkáňové inženýrství – stereologie – imunohistochemie
ÚVOD
Termínem biomateriál označujeme podpůrný prostředek určený k ochraně, posílení nebo náhradě tkání, orgánů nebo tělesných funkcí, používaný v těsném kontaktu s živou tkání (1). Může jít o materiál živočišného či rostlinného původu nebo inspirovaný přírodou. Funkcí biomateriálů je nejčastěji mechanická opora buněk, ale mohou být také modifikovány k podnícení buněčné reakce (např. k adhezi molekul) nebo ke změně jejich chemických vlastností v čase (např. uvolňování růstových faktorů) (2). Od takového podpůrného prostředku očekáváme biokompatibilitu s přijatelnou odezvou u příjemce. Jednou z možností, jak ověřujeme bezpečnost a zároveň účinnost zdravotního prostředku, je analýza vlivu in vivo aplikovaného biomateriálu. Náš příspěvek je zacílen na histologické vyšetření, které je součástí hodnocení účinnosti biomateriálu při in vivo implantaci.
HODNOCENÍ BIOMATERIÁLŮ
Biokompatibilita materiálů je testována z bezpečnostního hlediska jak in vitro, tak in vivo podle vyhlášky ISO 10993 s názvem „Biologické hodnocení zdravotnických prostředků“ (3).
K in vitro analýze například patří zkoušky na cytotoxicitu in vitro, zkoušky interakce s krví a zkoušky na genotoxicitu, karcinogenitu a reprodukční toxicitu.
In vivo analýza zahrnuje zkoušky na dráždivost a přecitlivělost oddáleného typu, zkoušky systémové toxicity, zkoušky lokálních účinků po implantaci a kvalitativní a kvantitativní stanovení degradačních produktů z prostředků zdravotnické techniky vyrobených z polymerních materiálů (4).
Při in vivo hodnocení účinků biomateriálu na hojení se využívají modelová zvířata. Biomateriál je jim implantován do poškozeného orgánu a v různě dlouhých časových úsecích jsou odebírány vzorky pro analýzu. Hojení defektu poté hodnotíme pomocí neinvazivních zobrazovacích metod (skiagrafie, výpočetní tomografie, ultrasonografie, magnetická rezonance) nebo histologickým vyšetřením.
HISTOLOGICKÉ HODNOCENÍ VLIVU BIOMATERIÁLŮ
Při hodnocení vhodnosti biomateriálu lze s výhodou kombinovat testy mechanické, biochemické a histologické. Komplementárně k makroskopickým zobrazovacím metodám, biochemickému vyšetření a mechanickému testování poskytuje histologie informaci o mikroskopické morfologii, lokalizaci, historii i aktuální fázi hojení, tvorbě extracelulární matrix (ECM), vaskularizaci, architektonice tkáně, zánětlivé reakci na přítomnost biomateriálu aj. U vzorků měkkých tkání je nejběžnější metodou chemická fixace a parafinový proces, avšak teplota parafínu při zalévání bločků (56 °C) vede k poškození termolabilních materiálů. Alternativně lze tedy obejít parafinový proces zmražením (cca –25 °C) a pořídit řezy na zmrazovacím mikrotomu.
U vzorků tvrdých tkání lze volit dvojí cestu – výbrusy nedemineralizovanou tkání nebo odvápnění a klasické histologické řezy. Pro techniky výbrusů jsou vzorky po odvodnění zality do pryskyřice (často epoxidové či polymetylmetakrylátové) a cca 0,5 mm tenké plátky uříznuté na přesné pile jsou dále broušeny na tloušťku kolem 60–80 µm a leštěny na konečných 30–60 µm. K získání výbrusů jsou velmi vhodné pomaloběžné pily a poloautomatické brusky používané v petrografii. Výbrus dobarvujeme např. toluidinovou modří, která dokáže odlišit plnohodnotně mineralizovanou kostní tkáň od dosud nekalcifikovaného osteoidu (5). Pokud chceme využít imunohistochemické metody na standardních 3–5 µm silných řezech, bločky tkáně nejprve demineralizujeme působením naředěných anorganických či slabších organických kyselin (kyselina dusičná, kyselina mravenčí aj.) nebo roztokem disodné soli kyseliny etylendiaminotetraoctové (EDTA) (6). Takto demineralizovanou tkáň pak můžeme zalít do parafínu a s využitím speciálních žiletek krájet obdobně jako běžné měkké tkáně.
Části buněk a orgánů na sebe vážou různá barviva, díky tomu jsme pak schopni v mikroskopu odlišit jednotlivé buňky a tkáně při vhodně zvolené metodice barvení. Ke specifickému průkazu antigenů proteinové povahy využíváme jeho reakce s protilátkou. Tabulka 1 shrnuje přehledné barvící metody a běžně využívané imunohistochemické metody využitelné v histologii pro in vivo hodnocení hojení tkání. Některé z těchto metod jsou ilustrovány na obrázku 1 a 2.
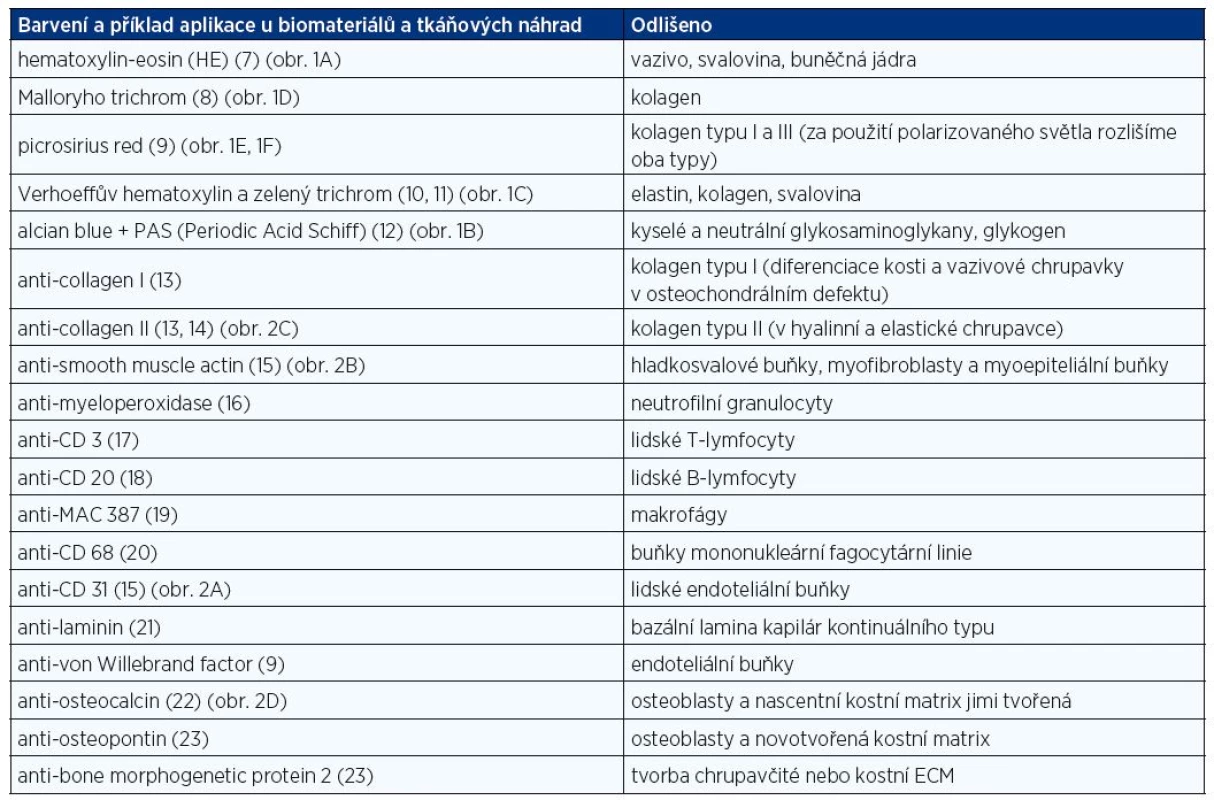
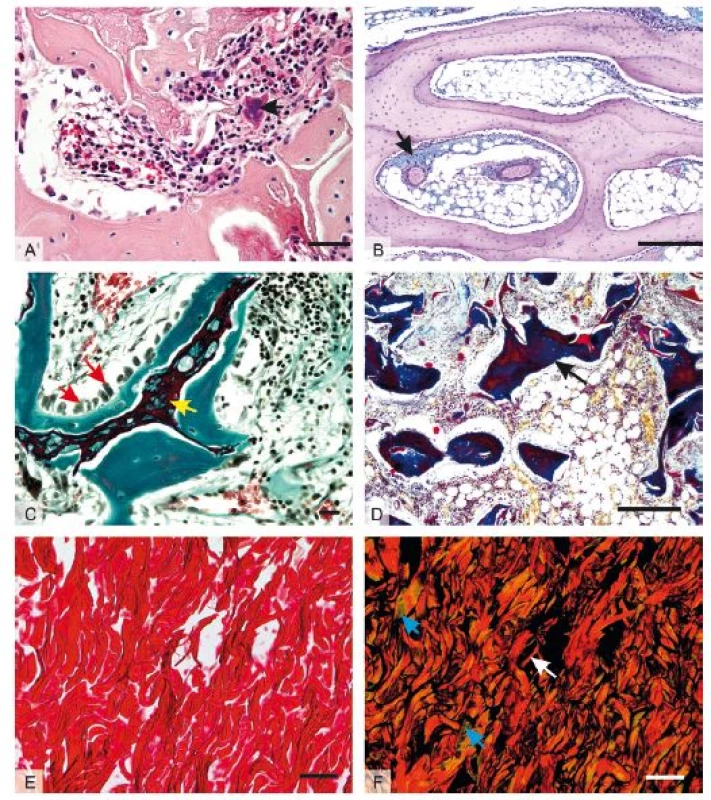
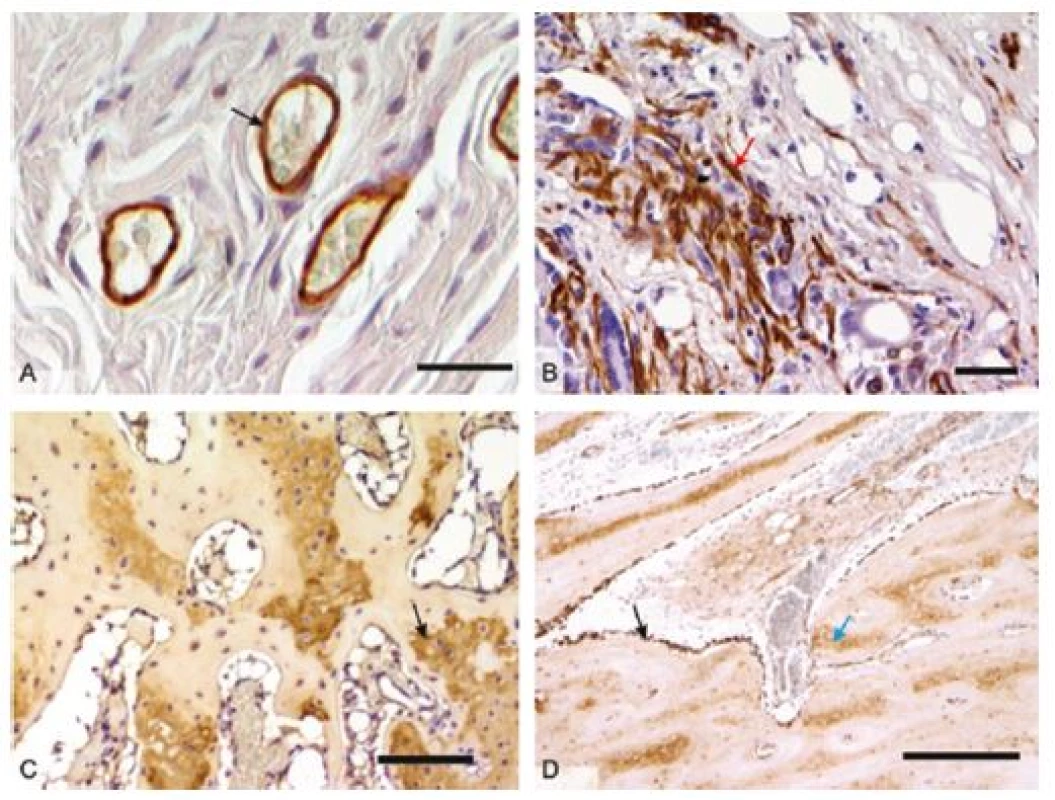
Úkolem histologa při hodnocení vlivu biomateriálů je také vybrat správnou techniku hodnocení. Jednou z možností jsou skórovací systémy, v nichž jsou vyšetřované parametry klasifikovány pomocí semikvantitativní bodovací škály, do níž se promítají např. buněčná morfologie, pozitivita pojivové matrix na neutrální či kyselé glykosaminoglykany, pravidelnost povrchu, strukturální integrita, tloušťka, míra integrace s přilehlou tkání, celularita, shlukování chondrocytů, přítomnost degenerativních změn aj. (24,25). Výhodou je relativní robustnost škál umožňující posoudit heterogenní skupiny vzorků a integrálně zhodnotit řadu vlastností do celkové pozice na škále, jejímž jednotlivým parametrům může být přiřazována různá váha dle jejich biologické důležitosti. Na druhou stranu se do výsledků značně promítají zkušenosti hodnotitele, což negativně ovlivňuje reprodukovatelnost výsledků. Robustnost skórovacích systémů se může projevit i jako jejich slabina, protože nadprůměrně dobré skóre v některých parametrech může být kompenzováno podprůměrnými výsledky v parametrech jiných a v celkovém pořadí mohou skončit vzorky s naprosto odlišným biologickým chováním blízko sebe.
Odlišnou strategií je proto kvantifikace složení tkáně pomocí jednotlivých spojitých proměnných, které popisují např. počet buněk v jednotkovém objemu, délky cév či vláknitých struktur matrix, plochy povrchů, plošné a objemové podíly složek tkáně, shlukování a kolokalizaci mikroskopických objektů. V současnosti je pro výzkumné účely k dispozici řada technik analýzy obrazu, která většinou vychází z automatické či poloautomatické segmentace obrazu pomocí prahování v barevných či fázových prostorech, eventuálně může kombinovat více kritérií pro automatické odlišení tkáňových komponent (např. kritéria založená na analýze kontrastu a tvarových charakteristikách). Obrazová analýza dokáže zpracovat velké objemy dat, vyžaduje však vysokou uniformitu vstupních obrazů. Ta nebývá i přes pečlivou laboratorní práci v histologii vždy dosažitelná a spolu s přítomností artefaktů (prachové částečky, precipitáty barviva, mikrotrhliny ve vzorcích) zvyšuje riziko jak nadhodnocení, tak podhodnocení. Proto v řadě aplikací kvantitativní mikroskopie dominují postupy stereologie, s jejíž pomocí můžeme získat informace o trojrozměrném objektu z měření provedených na dvourozměrných rovinných řezech (26). Na rozdíl od prahovacích postupů využívaných v analýze obrazu je ve stereologický přístup založen na efektivním využití stochastické geometrie, kdy jednotlivé charakteristiky vzorku jsou statisticky vypočítávány z interakce hodnocených preparátů s geometricky definovanými testovacími mřížkami. U interaktivních stereologických metod je obvykle posuzování pozitivity histologických struktur ponecháno na posouzení hodnotitele. Vedle vlastního hodnocení mikroskopických objektů je nezbytně nutné zachovat na všech úrovních, kdy dochází k redukci materiálu, nevychýlenou strategii vzorkování (systematický náhodný sběr tkáňových bločků z celého orgánu, výběr histologických řezů k hodnocení a výběr mikroskopických zorných polí při zvětšení potřebném pro jednoznačnou identifikaci mikrostruktur). Zachování strategie systematického nestranného náhodného výběru vede pak k významné redukci variability kvantitativních dat (26). Příklady interpretace takto získaných kvantitativních parametrů jednotlivých tkáňových komponent podává tabulka 2.
Biomateriály, u nichž in vitro a in vivo analýza neprokáže negativní vliv na buňky nebo organismus zvířete a u nichž po analýze usoudíme, že jsou účinnější, postupují dále do jednotlivých fází klinického testování.
SHRNUTÍ
Hodnocení in vivo experimentů při aplikaci biomateriálů zahrnuje analýzu jak měkkých tkání s konvenční metodikou, tak tkání tvrdých, které vyžadují méně obvyklé postupy. Histologie má při in vivo hodnocení vlivu biomateriálů na hojení nezastupitelnou úlohu, protože poskytuje informaci o distribuci a vzájemných vztazích tkáňových nosičů, buněk i mezibuněčné hmoty. Histologie je tak vhodným doplňkem k biochemické a molekulárně-biologické analýze tkáňových vzorků. Zatímco biochemické analýzy vykazují obvykle vysokou reprodukovatelnost i přesnost, často navíc kontrolovanou akreditacemi a kontrolami laboratoří s vyšetřováním testovacích vzorků, jejich data jsou často založena na vyšetření supernatantů a extraktů z tkáňových homogenátů. Při homogenizaci vzorků je však strukturální informace ztracena. Histopatologické vyšetření dále odráží i historii vzorku, a umožňuje tak odlišit déletrvající procesy hojení od akutních změn. Vhodný výběr přehledných či histochemických metod je spolu s náležitými víceúrovňovým vzorkováním orgánů, tkáňových bločků a řezů základem pro kvantitativní posouzení jak žádoucích, tak nežádoucích účinků biomateriálů.
Seznam zkratek
CD cluster of differentiation
ECM extracellular matrix
EDTA etylenediaminetetraacetic acid
HE hematoxylin-eosin
ISO International Organization for Standardization
MAC macrophage
PAS periodic acid Schiff
Práce byla podpořena projektem ED2.1.00/03.0076 Evropského fondu pro regionální rozvoj a částečně financováno z Univerzity Karlovy v Praze, projektem č. SVV266801, projektem PRVOUK č.P36 a projektem č. LO1309 Ministerstva školství, mládeže a tělovýchovy na podporu výzkumu, experimentálního vývoje a inovací Národní program udržitelnosti.
Konflikt zájmů: žádný.
ADRESA PRO KORESPONDENCI:
Mgr. Tereza Kubíková
Ústav histologie a embryologie a Biomedicínské centrum LF v Plzni UK v Praze
Karlovarská 48, 301 66 Plzeň
e-mail: tereza.kubikova@lfp.cuni.cz
Sources
1. Williams DF. Definitions in biomaterials: proceedings of a consensus conference of the European Society for Biomaterials, Chester, England, March 3–5, 1986. Elsevier Science Ltd; 1987.
2. Palsson B, Bhatia S. Tissue engineering. Upper Saddle River, N.J.: Pearson Prentice Hall; 2004.
3. Frey, Köppel A. Requirements for the admission of medical products made of NiTinol according to the German Medical Products Act (MPG). Minim Invasive Ther Allied Technol 2004; 13 : 222–227.
4. Anderson JM. Biological Responses to Materials. Annu Rev Mater Res 2001; 31 : 81–110.
5. Metzler P, et al. Nano-crystalline diamond-coated titanium dental implants – a histomorphometric study in adult domestic pigs. J Cranio-Maxillo-fac Surg Off Publ Eur Assoc Cranio-Maxillo-fac Surg 2013; 41 : 532–538.
6. Bancroft JD, Gamble M. Theory and practice of histological techniques. Edinburgh: Churchill Livingstone; 2008.
7. Truong A-TN, et al. Comparison of dermal substitutes in wound healing utilizing a nude mouse model. J Burns Wounds 2005; 4: e4.
8. Prosecká E, et al. Collagen/hydroxyapatite scaffold enriched with polycaprolactone nanofibers, thrombocyte-rich solution and mesenchymal stem cells promotes regeneration in large bone defect in vivo. J Biomed Mater Res 2015; 103(2): 671–682.
9. Meruane MA, et al. The use of adipose tissue–derived stem cells within a dermal substitute improves skin regeneration by increasing neoangiogenesis and collagen synthesis. Plast Reconstr Surg 2012; 130 : 53–63.
10. Kocová J. Overall staining of connective tissue and the muscular layer of vessels. Folia Morphol 1970; 18 : 293–295.
11. Kochová P, et al. The contribution of vascular smooth muscle, elastin and collagen on the passive mechanics of porcine carotid arteries. Physiol Meas 2012; 33 : 1335–1351.
12. Filová E, et al. A cell-free nanofiber composite scaffold regenerated osteochondral defects in miniature pigs. Int J Pharm 2013; 447(1–2): 139–149.
13. Breinan HA, et al. Autologous chondrocyte implantation in a canine model: change in composition of reparative tissue with time. J Orthop Res Off Publ Orthop Res Soc 2001; 19 : 482–492.
14. Rampichová M, et al. Fibrin/Hyaluronic Acid Composite Hydrogels as Appropriate Scaffolds for In Vivo Artificial Cartilage Implantation: ASAIO J 2010; 56 : 563–568.
15. Plencner M, et al. Abdominal closure reinforcement by using polypropylene mesh functionalized with poly–ε–caprolactone nanofibers and growth factors for prevention of incisional hernia formation. Int J Nanomedicine 2014; 9 : 3263–3277.
16. Andrade TAM, et al. The inflammatory stimulus of a natural latex biomembrane improves healing in mice. Braz J Med Biol Res Rev Bras Pesqui Médicas E Biológicas Soc Bras Biofísica Al 2011; 44 : 1036–1047.
17. Bosch U, et al. Arthrofibrosis is the result of a T cell mediated immune response. Knee Surg Sports Traumatol Arthrosc Off J ESSKA 2001; 9 : 282–289.
18. Hussein MR, et al. Immunohistological analysis of immune cells in blistering skin lesions. J Clin Pathol 2007; 60 : 62–71.
19. Marin ML, et al. Human transluminally placed endovascular stented grafts: preliminary histopathologic analysis of healing grafts in aortoiliac and femoral artery occlusive disease. J Vasc Surg 1995; 21 : 595–604.
20. Böhm G, et al. Biocompatibility of PLGA/sP(EO-stat-PO)-Coated Mesh Surfaces under Constant Shearing Stress. Eur Surg Res 2011; 47 : 118–129.
21. Nakaya N, et al. Protein kinase in cultured plant cells. Biochim Biophys Acta 1975; 410 : 273–278.
22. Nishi M, et al. Engineered bone tissue associated with vascularization utilizing a rotating wall vessel bioreactor. J Biomed Mater Res A 2013; 101A: 421–427.
23. Ramazanoglu M, et al. Bone response to biomimetic implants delivering BMP-2 and VEGF: an immunohistochemical study. J Cranio-Maxillo-fac Surg Off Publ Eur Assoc Cranio-Maxillo-fac Surg 2013; 41 : 826–835.
24. Van Susante JL, et al. Resurfacing potential of heterologous chondrocytes suspended in fibrin glue in large full-thickness defects of femoral articular cartilage: an experimental study in the goat. Biomaterials 1999; 20 : 1167–1175.
25. Filová E, et al. Composite hyaluronate – type I collagen-fibrin scaffold in the therapy of osteochondral defects in miniature pigs. Physiol Res Acad Sci Bohemoslov 2007; 56(Suppl 1): S5–S16.
26. Mouton PR. Principles and practices of unbiased stereology: an introduction for bioscientists. Baltimore: Johns Hopkins University Press 2002.
27. Fung YC. Biomechanics: mechanical properties of living tissues. 2nd ed. New York: Springer Verlag; 1993.
28. Screen HRC. Investigating load relaxation mechanics in tendon. J Mech Behav Biomed Mater 2008; 1 : 51–58.
29. Junge K, et al. Decreased collagen type I/III ratio in patients with recurring hernia after implantation of alloplastic prostheses. Langenbecks Arch Surg Dtsch Ges Für Chir 2004; 389 : 17–22.
30. Nowak D, et al. Actin in the wound healing process. Postepy Biochem 2009; 55 : 138–144.
31. Van Beurden HE, et al.Myofibroblasts in palatal wound healing: prospects for the reduction of wound contraction after cleft palate repair. J Dent Res 2005; 84 : 871–880.
32. Götz W, et al. Coupling of osteogenesis and angiogenesis in bone substitute healing – a brief overview. Ann Anat Anat Anz Off Organ Anat Ges 2012; 194 : 171–173.
33. Kanczler JM, et al. Osteogenesis and angiogenesis: the potential for engineering bone. Eur Cell Mater 2008; 15 : 100–114.
34. Adamson R. Role of macrophages in normal wound healing: an overview. J Wound Care 2009; 18 : 349–351.
35. Reitinger S, et al. Hyaluronan, a ready choice to fuel regeneration: a mini–review. Gerontology 2013; 59 : 71–76.
36. Li L-J, et al. Osteogenic scaffolds for bone reconstruction. BioResearch Open Access 2012; 1 : 137–144.
37. Kavukcuoglu NB, et al. Effect of osteocalcin deficiency on the nanomechanics and chemistry of mouse bones. J Mech Behav Biomed Mater 2009; 2 : 348–354.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental HygienistArticle was published in
Journal of Czech Physicians

- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Advances in the Treatment of Myasthenia Gravis on the Horizon
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
-
All articles in this issue
- Kmenové buňky v ortopedii
- Histologické hodnocení vlivu in vivo aplikace biomateriálů na hojení chrupavky, kosti a kůže
-
Spiritualita a etika v psychosomatické medicíně –
biopsychosociospirituální vztahy - miRNA jako nový ukazatel u diabetes mellitus a u rozvoje karcinomu pankreatu
- První zkušenosti s preimplantačním genetickým screeningem chromozomových abnormalit pomocí komparativní genomové hybridizace na oligonukleotidových DNA mikročipech
- Připravenost izraelského zdravotnictví na krizové situace
- Historie výroby inzulinu v Československu
- Zásluhy prof. Josefa Hally o rozvoj pražské lékařské fakulty
- Journal of Czech Physicians
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Historie výroby inzulinu v Československu
-
Spiritualita a etika v psychosomatické medicíně –
biopsychosociospirituální vztahy - Kmenové buňky v ortopedii
- Připravenost izraelského zdravotnictví na krizové situace
