Role cévní chirurgie v onkologické chirurgii
The role of the vascular surgery in oncosurgery
Surgical resection remains the cornerstone for the curative treatment of oncological disease. In a situation when a tumour encases a critical arterial or venous structure, long term oncological control may be achieved only through careful preoperative planning within a multidisciplinary team incorporating oncological and vascular specialists. The present review addresses the principles in planning oncovascular surgery, describes the oncovascular procedure in pancreatic, liver, renal and endometriosis cancer as well as vascular involvement in retroperitoneal soft sarcoma and sarcoma in lower extremity. In conclusion, the present review highlights that major vessel involvement of a tumour mass should not necessarily be considered as a barrier to en bloc resection and hence curative oncosurgery procedure.
Keywords:
vascular surgery – oncology – oncovascular surgery
Authors:
Peter Baláž 1,2; Robert Gürlich 1; Lukáš Havlůj 1; Petr Klézl 3; Radovan Turyna 4
Authors‘ workplace:
Chirurgická klinika 3. LF UK a FN Královské Vinohrady, Praha
1; Cievna chirurgia, Národný ústav srdcových a cievnych chorôb, a. s., Bratislava
2; Urologická klinika 3. LF UK a FN Královské Vinohrady, Praha
3; Ústav pro péči o matku a dítě, Praha-Podolí, IPVZ a 3. LF UK v Praze
4
Published in:
Čas. Lék. čes. 2020; 159: 203-209
Category:
Review Article
Overview
Radikální odstranění nádoru u onkologicky nemocného je základem úspěšné léčby. V případech, kdy nádor infiltruje nebo těsně adheruje k cévním strukturám, je odstranění nádoru spolu s vaskulární rekonstrukcí mnohdy jedinou možností dosažení radikálního výkonu. Nový směr onkochirurgické léčby, označovaný jako onkovaskulární chirurgie, ukazuje, že invaze tumoru do cévního svazku nemá být automaticky vnímána jako bariéra radikální resekce, ale jen jako technická překážka. Uvádíme možnosti onkovaskulární chirurgie u karcinomu pankreatu, jater, ledvin, endometria, retroperitoneálních sarkomů a sarkomů dolních končetin.
Klíčová slova:
onkovaskulární chirurgie – onkologie – cévní chirurgie
ÚVOD
Radikální odstranění nádoru u onkologicky nemocného pacienta je základem úspěšné léčby. V případech, kdy nádor infiltruje nebo těsně adheruje k velkým cévám, je operační výkon někdy ukončen jako explorace nebo jako debulking výkon, a to z důvodu domnělé inoperability související s infiltrací velkých cév. V roce 2011 Ghosh et al. definovali termín onkovaskulární chirurgie (OVS – oncovascular surgery) jako resekci nádoru se současnou rekonstrukcí velkých cévních struktur. Paradigmatem OVS je, že invaze tumoru do cévního svazku není automaticky překážkou radikální resekce, ale jen technickou komplikací, jejíž zdolání je nadějí pro jinak nevyléčitelně nemocného pacienta (1). Roli cévních chirurgů v onkologii definovali Han et al. (2) následovně:
a) primární chirurg u nádoru cév (např. angiosarkomu aorty, leiomyosarkomu dolní duté žíly, intravenózní leiomyomatózy) a u retroperitoneálních tumorů infiltrující cévy (např. metastáz germinálních nádorů do retroperitoneálních lymfatických uzlin;
b) tzv. rescue chirurg přivolaný na pomoc onkochirurgovi v případě iatrogenního poranění cév a vzniklým krvácením, trombózou, disekcí nebo jiným cévním poškozením během nevaskulární operace;
c) konzultant a člen onkologického multidisciplinárního týmu provádějící vaskulární část onkologické operace.
Přestože je rozumné, aby byl cévní chirurg členem multidisciplinárního týmu, tento koncept není zatím široce akceptován, stejně tak nejsou definovaná další pravidla pro cévní chirurgické postupy v onkochirurgii (týkající se výběru materiálu, techniky a taktiky revaskularizace, pooperační péče, sledování atd.).
Cílem tohoto sdělení je vymezit všeobecné zásady a principy onkovaskulárního přístupu u pacientů s nádory pankreatu, jater, ledvin, endometriálních nádorů, sarkomů retroperitonea a dolních končetin.
VŠEOBECNÉ ZÁSADY ONKOVASKULARNÍHO PŘÍSTUPU
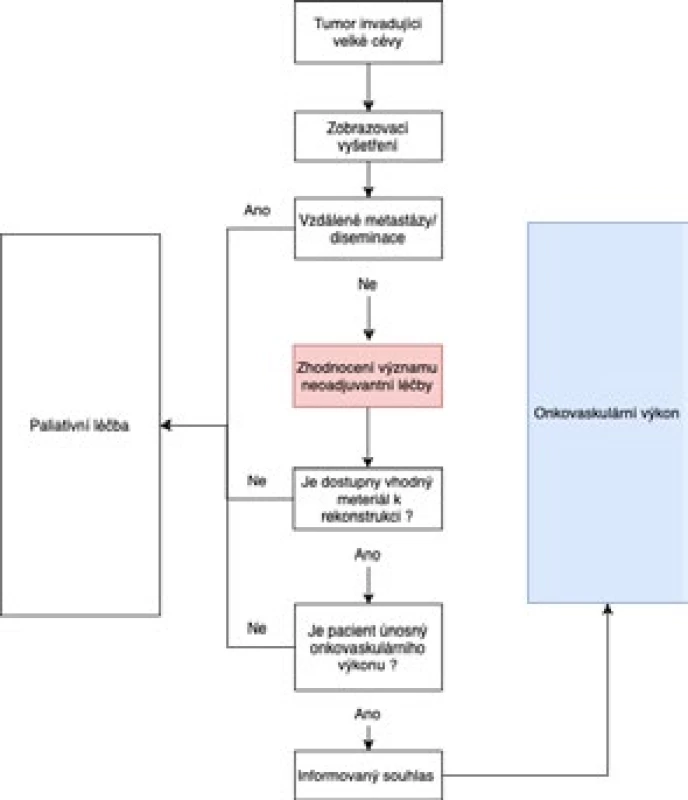
Staging nádoru, předoperační zobrazení vztahu nádoru k cévám, detailní plánování možností cévní rekonstrukce s ohledem na dostupný materiál použitý k rekonstrukci, zvážení perioperačních hemodynamických komplikací a detailní diskuze s pacientem o možných komplikacích včetně správně formulovaného informovaného souhlasu jsou pro úspěch léčby kruciální. Platí 7 základních zásad:
- Zhodnotit indikaci neoadjuvantní chemo/radioterapie a význam tzv. downstagingu tumoru.
- Vyloučit diseminaci, která je kontraindikací onkovaskulární operace.
- Před plánovanou cévní rekonstrukcí provést multidetektorovou CT angiografii s 0,5mm řezy včetně žilní fáze klíčové pro plánovaný typ rekonstrukce – je upřednostňována před DSA (3).
- Vzít v potaz, že masivní expanze tumoru a rozsáhlá infiltrace do cévního svazku může být kontraindikací k cévní resekci, i když je diseminace vyloučena (např. při expanzi tumoru pankreatu do druhého jejunálního větvení VMS – vena mesenterica superior).
- Předoperačně stanovit kardiovaskulární riziko kardiologem a anesteziologem, zejména pokud se předpokládá omezení průtoku tzv. svorkou na thorakoabdominální aortě a dolní duté žíle během onkovaskulární operace.
- Předoperačně posoudit dosažitelnost materiálu pro potřeby cévní rekonstrukce pomocí USG mappingu VSM oboustranně a USG mappingu VJI a průchodnost hluboké stehenní žíly při plánovaném odběru povrchové femorální žíly.
- S pacientem detailně probrat kromě onkologické části výkonu i rizika související s cévní rekonstrukcí (krvácení, trombózu, stenózu, infekce, dlouhodobé užívání antikoagulační/antiagregační léčby atd.).
Algoritmus onkovaskulárního přístupu znázorňuje obr. 1.
CÉVNÍ REKONSTRUKCE U KARCINOMU PANKREATU
Karcinom pankreatu (CaP) patří mezi nejagresivnější nádory s 5letým přežíváním 6 % (4) pacientů; z důvodů vaskulární invaze nebo vzdálených metastáz má resekabilní tumor méně než pětina pacientů (5). Podle doporučení Evropské společnosti pro klinickou onkologii (ESMO) je chirurgická resekce s dosažením negativních okrajů resekátu (resekce R0) jedinou kurativní léčbou (6). Metodou volby v zobrazovacích technikách hraje multidetektorová počítačová tomografie (CT), díky níž je až v 77 % možné potvrdit lokální pokročilost, vaskulární infiltraci a vzdálené metastázy a v 93 % případech predikovat neresekabilitu CaP (7).
Kritéria resekability CaP závisejí na míře kontaktu mezi tumorem a cévami, a to konkrétně s vena portae (VP), VMS, horní mezenterickou tepnou (AMS), truncus coeliacus (TC) a hepatickou arterií (AH). Podle TNM klasifikace se jedná o nádory T3, T4, což je označení pro CaP přesahující hranice pankreatu s invazí do výše zmíněných cévních struktur. Pro dosažení resekce R0, která je pro kurativní léčbu zásadní, je nutné dosažení „čistých okrajů“ i za cenu cévní rekonstrukce.
Rekonstrukce portomezenterické žíly
V definici resekability u T3 CaP s invazí do VP a/nebo VMS je u většiny doporučení odborných společností shoda. Podle doporučení ESMO, která přijala kritéria resekability od National Comprehensive Cancer Network (NCCN) (8), je pro dosažení resekce R0 indikovaná rekonstrukce VP/VMS v případě kontaktu/prorůstání nebo kompletního uzávěru nádorem. Stejnou definici resekability doporučuje i Americká hepatopankreatobiliární asociace (AHPBA) (9). Typ cévní rekonstrukce závisí na rozsahu infiltrace VP/VMS (označované jako portomezenterická žíla) tumorem (obr. 2).
Rekonstrukce VP/VMS
V případě, že se jedná o nástěnnou infiltraci laterálního nebo zadního okraje VP/VMS bez invaze tumoru, je provedena prostá ostrá resekce části vény na nástěnné svorce s primárním uzávěrem. V případě, že hrozí riziko zúžení lumen o více než 30 %, je doporučovaná plastika defektu pomocí cévní záplaty. Zlatým standardem a materiálem volby je autovenózní materiál odebrán z vena safena magna, vena jugularis interna nebo je k záplatě použitá část jedné z gonadálních žil. Další možností je použití xenograftu nebo umělé cévní záplaty.
Resekce VP/VMS s použitím náhrady či bez ní
Jako první popsali resekci VP v 1951 More et al. (10) a resekce VP/VMS během pankreatektomie byla vyhodnocena jako bezpečná metoda se stejnými komplikacemi a přežíváním ve srovnání se standardní pankreatektomií (11). V případě infiltrace segmentu VP ≤ 2 cm je možné provedení prosté resekce s end-to-end anastomózou. V situaci, kdy tumor infiltruje confluens VP s vena lienalis (VL), není primární anastomóza většinou technicky možná, a je nutné provedení resekce celé infiltrované oblasti pomocí interponátu. Obecně se resekce s interpozicí indikuje u infiltrací ≥ 2 cm. I přesto, že neexistuje jasné doporučení ve výběru materiálu pro interpozitum, je obecně v cévní chirurgii metodou volby autovenózní materiál.
Diskutovanou otázkou je rekonstrukce VL v případě nutnosti resekce jejího confluens s VP. Podstatou problému je možný vznik levostranné portální hypertenze způsobené poruchou žilní drenáže žaludku a sleziny přes krátké gastrické žíly a levou gastroepiploickou žílu, které mají tak omezený výtok přes podvázanou VL. Může dojít k vzniku gastroezofageálních varixů a jejich krvácení. Implantace VL však není nutná, pokud je zachován typický anatomický průběh a VMI se vlévá do VL a drenáž při rekonstrukci podvázané VL je zabezpečena cestou VMI. Na druhé straně v případě, že VMI se drénuje do VMS, je otázka implantace VL do interponátu nebo vytvoření splenorenálního zkratu možnou alternativou. Vzhledem k tomu, že vznik levostranné portální hypertenze po přerušení VL není nevyhnutelný, je přístup k rekonstrukci VL mezi chirurgy nejednotný.
Tepenné rekonstrukce u CaP
Na rozdíl od jednotného přístupu k rekonstrukci portomezenterické žíly u CaP, u infiltrace tepen existují malé odchylky v indikacích rekonstrukce truncus coeliacus. Pro posouzení radikality je důležité posouzení, jestli se jedná o tzv. abutment (tumor je v kontaktu nanejvýš s polovinou obvodu cévy), nebo tzv. encasement (tumor je v kontaktu s více než polovinou obvodu cévy), a to v korelaci s uložením nádoru v pankreatu (hlava/processus uncinatus/tělo/ocas). Rozdílná kritéria resekability tepen ukazuje tab. 1.
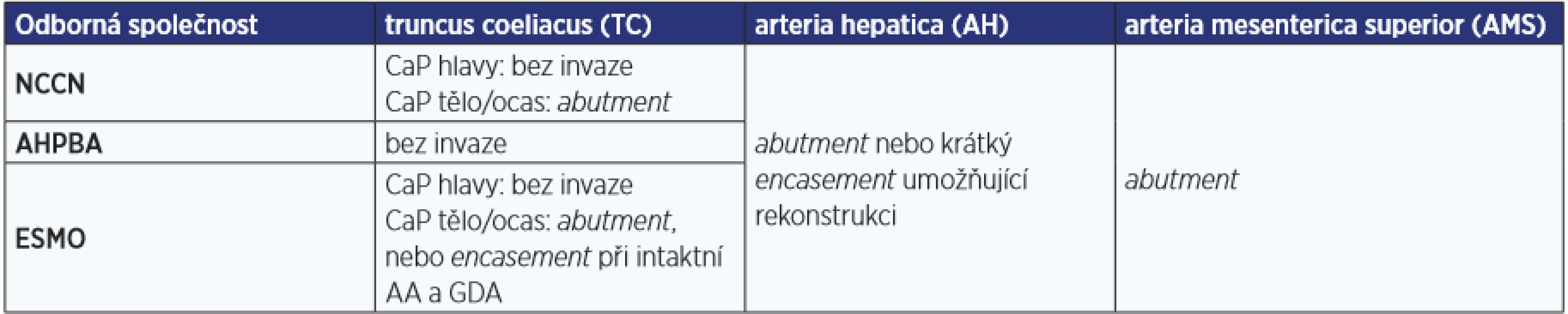
Podle některých autorů není arteriální infiltrace jednoznačně spojená s agresivnějším chováním nádoru a tato známka lokální pokročilosti, pokud lze provést resekci R0, by měla být chápána spíše jako „nepříznivá topografická lokalizace“ (12–14). Tento postoj bohužel vyvrací recentní metaanalýza, kterou publikovali Mollberg et al. a v níž prokázali vyšší pooperační komplikace a kratší přežívání u pacientů po pankreatektomii s arteriální resekcí (15), proto je rozsáhlá tepenná rekonstrukce indikována hlavně u mladých pacientů s dobrým efektem neoadjuvantní terapie a vysokým předpokladem dosažení resekce R0.
Rekonstrukce truncus coeliacus a arteria hepatica
Invaze do AH je výsledkem růstu CaP v hlavě nebo krčku pankreatu. Při krátké infiltraci AH proximálně od odstupu a. gastroduodenalis (GDA) je většinou možné provedení resekce postižené tepny s EtE anastomózou s použitím autovenózního interponátu z VSM, nebo bez něho. Encasement TC je většinou známkou pokročilého stadia CaP a rekonstrukce není indikována. U případů, kdy CaP je lokalizován v těle a ocasu pankreatu a invaduje do AH a TC proximálně od odstupu GDA, která je průchodná, je možné provedení pankreatektomie podle Applebyho, kdy je zásobení jater zabezpečené přes AMS cestou pankreatikoduodenalní arkády (16). V případě akcesorní pravé hepatické arterie z AMS (9,8–21 %) (17), která je pro zásobení jater a žlučovodu zásadní, je její zachování nezbytné. V případě, že tumor invaduje do akcesorní pravé hepatiky, nebo je iatrogenně přerušena během preparace, existuje několik způsobů rekonstrukce: a) EtE implantace do GDA, b) implantace po prodloužení autovenózním štěpem s anastomózou do pravé renální tepny, c) její náhrada aortohepatálním bypassem.
Rekonstrukce AMS
Encasement AMS je známkou pokročilého stadia CaP a radikální resekce s náhradou AMS většinou nedosáhne resekce R0 (18), proto rekonstrukce AMS u encasementu tumorem není obecně doporučována. Navíc je v jejím případě vysoké riziko střevní ischemie. Dalším nepříznivým faktorem je porucha inervace střev při resekci sympatických plexů u rozsáhlých náhrad AMS, což vede k nekontrolovatelným průjmům. Jediným všeobecně akceptovaným přístupem k resekci AMS pomocí autovenózního štěpu je abutment AMS, kdy tumor infiltruje méně než polovinu obvodu tepny.
CÉVNÍ REKONSTRUKCE U KARCINOMU JATER
Hepatocelulární karcinom (HC) s incidencí v Evropě 10/100 000 u mužů a 3,3/100 000 u žen je celosvětově druhou nejčastější příčinou úmrtí souvisejících s maligními nádory (19). Zobrazovací metodou volby je MRI anebo CT vyšetření, které kromě počtu a rozsahu cévní invaze odhalí i extrahepatální diseminaci. Podle TNM klasifikace je invaze HC do větví portální nebo hepatálních žil označeno stadiem T4 a podle ESMO doporučení je resekce R0 se zachováním kapacity funkce jater základním typem léčby. Kromě resekce jater jsou při splnění určitých kritérií dalšími možnostmi chirurgické léčby transplantace a radiofrekvenční ablace ložiska.
Obecně jsou pacienti označení jako Child-Pugh A bez známek portální hypertenze kandidátem pro resekci jater, kdežto pacienti Child-Pugh B jsou k resekci jater kontraindikováni. Kontroverzní skupinou jsou pacienti Child-Pugh B, kteří v dobře selektovaných případech vykazují akceptovatelné výsledky po jaterní resekci (19). Resekce jater pro dosažení resekce R0 může zahrnovat rekonstrukci VP, AH, rekonstrukci dolní duté žíly (VC) a rekonstrukci hepatálních žil (HŽ) (20).
Při plánování rozsahu resekce jater je podle všeobecných doporučení nutné zachovat tzv. future liver remnant (FLR) > 20 % (21) jako prevenci pooperační jaterní dysfunkce. U resekcí s nutností cévní rekonstrukce, u níž se předpokládá vyšší ischemické poškození, je doporučeno zachovat FLR > 40 % (22). Předoperační volumetrie je právě pro výše zmíněná fakta doplněna o možnost předoperační embolizace VP a hypertrofii jater, klíčovou komponentou při plánování onkovaskulární resekce jater.
Resekce VP
Poprvé resekce VP provedl Blumgart v roce 1990 u resekce hilárního cholangiokarcinomu a excelentní výsledky s blokovou resekcí jater a VP potvrdili Neuhaus et al. v roce 1999 (23). Cílem u všech onkovaskulárních výkonů je zajistit resekci R0 za cenu anastomózy VP. Pro technické zvládnutí portální anastomózy u resekce jater je nutné ponechat minimálně 1 cm dlouhý pahýl portální žíly pro bezpečné naložení svorek a EtE anastomózu, která je primárním typem anastomózy. V případech, kdy nelze bezpečně/beznapěťově provést anastomózu VP, je možné použití interponátu z levé renální žíly, povrchové stehenní žíly, jugulární žíly nebo pomocí štěpu vytvořeného z VSM. Pokud tyto materiály nejsou dostupné, je možné použít PTFE protézu, allograft nebo xenograft s ohledem na vyšší riziko trombózy a infekci. U těchto operací je extrémně důležitá znalost předoperační anatomie portálního intra hepatického systému s perioperačním potvrzením (20).
Resekce AH
Nejčastějším případem resekce jater a resekce AH je tumorem infiltrovaná část bifurkace hepatické arterie. Resekce části AH včetně resekce VP je v této situaci jedinou možností dosažení resekce R0. Metodou volby je EtE anastomóza AH s použitím nebo bez použití autoarteriálního/autovenózního štěpu. Ve specifických situacích, kdy je GDA dostatečného kalibru a průtoku, je možné ji využít jako zdrojovou přítokovou tepnu pro bypass s AH. Ve výjimečných případech, kdy nelze arteriální část rekonstrukce provést, je možné k arterializaci jater použít anastomózu mezi AH a VP anebo AMI „anastomozovanou“ do VMI. Samozřejmě tento AV zkrat vede ke zvýšené pooperační incidenci biliárních komplikací a vzniku portální hypertenze (20). I přesto, že je resekce a rekonstrukce AH technicky možná, jsou tyto onkovaskulární výkony zatíženy vysokou mortalitou (33–56 %) a krátkodobým jednoročním přežíváním (17 %) (24).
Rekonstrukce VCI a hepatálních žil
Pacienti s nádorem invadujících do VCI anebo hepatální žíly mají omezené možnosti léčby a bez operace je jejich přežití kratší než 1 rok. Pro dosažení resekce R0 je pro techniku onkovaskulární resekce klíčová lokalizace nádoru ve vztahu k VCI a confluens s hepatálními žilami. Pokud je infiltrovaná jenom malá část VCI, je možné provedení jednoduché resekce na nástěnné svorce bez omezení průtoku dolní dutou žílou. U větších infiltrací VCI, které neinvadují do hepatální žíly s rozsahem do 4 cm, je možné provést kompletní resekci s EtE anastomózou, kdežto u infiltrace více než 4 cm je většinou nutná substituce resekované VCI pomocí goretexové protézy. U nádoru, kdy je tumorem infiltrována VCI a confluens hepatálních žil, je nutné provést kompletní vaskulární exkluzi (TVE – total vascular exclusion), nebo explantaci jater s ex situ perfuzí, ex situ resekci tumoru s následnou reimplantací jater (20).
Tyto technicky náročné operace jsou zatížené dlouhou anhepatální fází, vysokou perioperační a pooperační mortalitou s krátkodobým přežíváním na vrub technické náročnosti, současné cholestázy jater a vysokou pravděpodobností rekurence nádoru. Proto resekce nádoru ex situ a resekce vyžadující TVE jsou indikované jen výjimečně, a to jen u mladých jinak zdravých přísně selektovaných pacientů bez jiné možnosti léčby (25).
CÉVNÍ REKONSTRUKCE U KARCINOMU LEDVINY
Karcinom ledviny (RC) je 7. nejčastějším nádorem u mužů a tvoří 3–5 % všech malignit dospělých. Zlatým standardem zobrazovacích technik je u něj CT. Klasifikace TNM pro RC, který je rozšířený mimo parenchym ledviny, je označena jako T3, přičemž T3a je lokalizován pouze do v. renalis (VR), T3b do v. cava (VC) pod bránici a T3c je označení invaze tumoru do dolní duté žíly nad bránici nebo infiltrace stěny duté žíly. Podle ESMO je kurativním řešením radikální nefrektomie spolu s odstraněním nádoru z v. cava i za cenu rekonstrukce (26).
Trombektomie nádoru zlepšuje přežití pacienta v porovnání s ponechaným trombem, s nímž pacienti umírají do 1 roku (27). RC (T3) ve vztahu k invazi VC rozdělují Naves a Zincke do 4 kategorií podle rozsahu intrakaválního nádorového trombu (28). Přijímanější je ovšem klasifikace Mayo Clinic, která rozděluje propagaci nádorového trombu do 5 stupňů, přičemž stupeň 0 je označení pro trombus lokalizovaný jenom do VR, stupeň 1 pro extenzi < 2 cm nad odstup VR, stupeň 2 pro propagaci tumoru > 2 cm nad odstup VR, ale pod bránici pod odstup hepatálních žil, stupeň 3 pro situaci, kdy trombus zasahuje do úrovně hepatálních žil pod bránici a stupeň 4 pro jeho zasahování nad bránici, většinou do pravé síně srdce (29) (obr. 3).
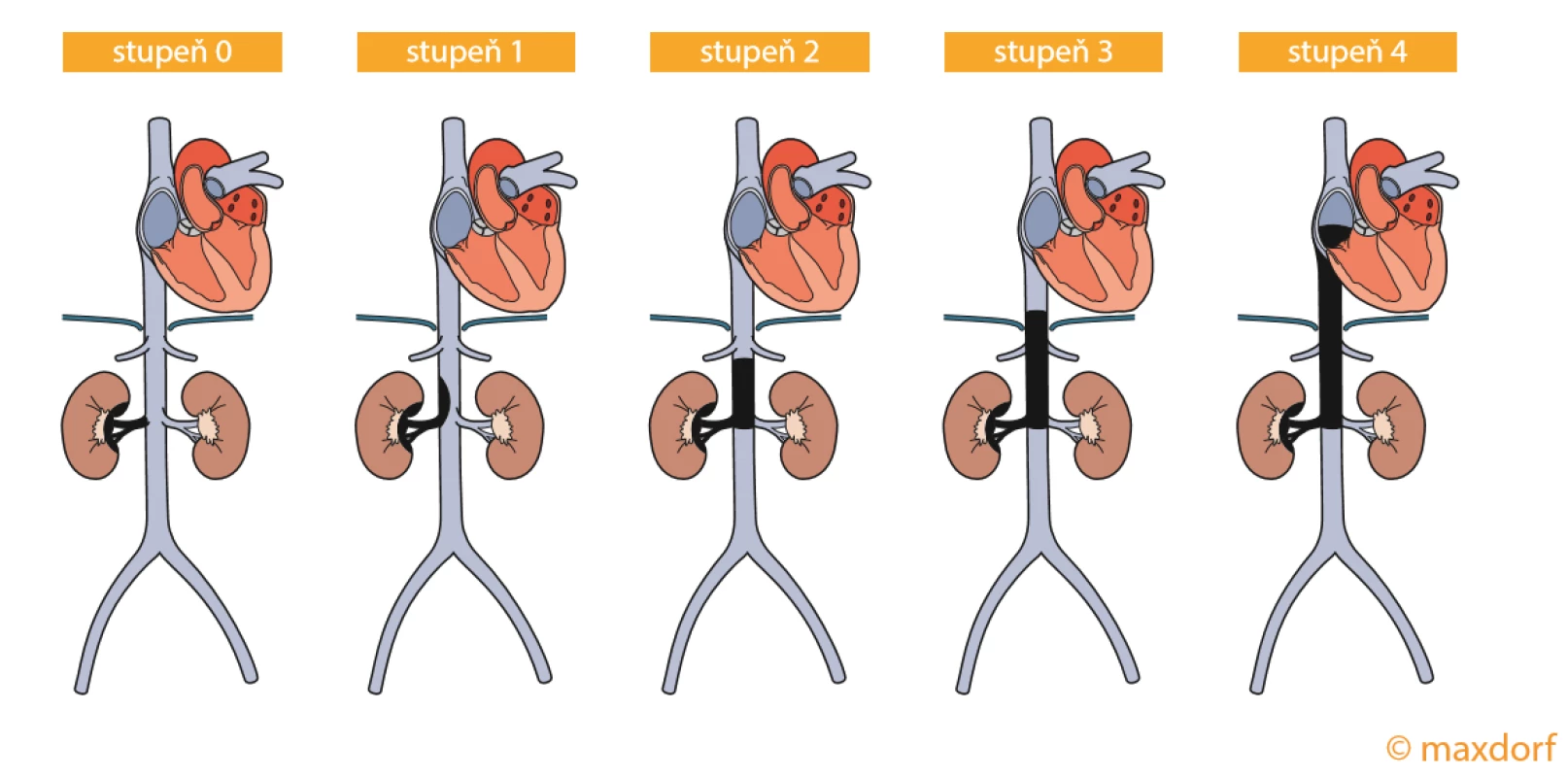
Rekonstrukce VC
U většiny případů, kdy nádorový trombus zasahuje do VC v úrovni odstupu renální žíly nebo se propaguje do oblasti pod bránici (stupeň 0–2), si většinou vystačíme s prostou kavotomií na Satinského svorce a nádorový trombus je jemně z VC vybaven a kavotomie uzavřena prostou suturou. V případě, kdy nádorový trombus zasahuje retrohepatálně a/nebo nad bránici, se lze pokusit o „vytažení“ trombu z jednoduché kavotomie (stupeň 3–4).
Bohužel existují případy, kdy konec nádorové masy pevně infiltruje ke stěně VC, a exstirpace nádoru z kavotomie tak není technicky možná a existuje riziko poranění stěny VC s masivním krvácením. V tomto případě je nutné vypreparování celé VC s mobilizací a rotací jater na levou stranu až do oblasti, kde je viditelný a hmatný konec nádorového trombu. Dále je provedena kavotomie a v případě, že tumor adheruje ke stěně, může být provedena její parciální resekce a uzávěr biologickou záplatou. Stejně tak u ostatních typů rekonstrukce se preferuje autovenózní štep před xenograftem a protetickou náhradou. V raritním případě, kdy trombus dosahuje pravé síně, je nutná kooperace s kardiochirurgy a provedení pravostranné atriotomie pro zajištění kontroly trombu včetně kardiopulmonálního dočasného bypassu (30).
Resekce a náhrada VC
V případech, kdy RC invaduje do stěny VC, a parciální resekce není pro rozsah infiltrace technicky možná, je indikována resekce a náhrada VC. Problémem těchto náročných rekonstrukcí je, že kromě samotné náhrady VC vyžadujících implantaci druhostranné renální žíly, je zde vysoké procento uzávěru způsobené externí kompresí nahrazené VC. Preferovaným materiálem je proto použití PTFE vyztužené protézy, která má při externímu útlaku oproti poddajným biologickým materiálům vyšší rezistenci vůči trombóze (31). Bohužel i tyto náhrady mají průchodnost jenom kolem 60 % v 9 měsících (32).
Resekce tumoru ex situ a autotransplantace ledviny
Ačkoliv resekce nádoru ledviny po nefrektomii mimo tělo pacienta s následnou autotransplantací nemá jasné místo v doporučeních odborných společností, je tato metoda jednou z možností, jak zachovat renální funkci u pacientů se solitární ledvinou postiženou nádorem, kdy je technicky nemožná in situ resekce. I když v pravém slova smyslu se o cévní rekonstrukci nejedná, je autotransplantace de facto cévním chirurgickým výkonem.
Nejdříve se provede nefrektomie s ponechanou dlouhou arterií a v. renalis (pokud to není možné, je provedena jejich extenze pomocí VSM), následuje ex situ perfuze ledviny konzervačním roztokem a odstranění nádoru. Na závěr je ledvina autotransplantována do kyčelní jámy a perfuze je obnovena přes anastomózu a. renalis se zevní pánevní tepnou a v. renalis se zevní pánevní žílou. Ureterocystoneoanastomóza je zajištěna JJ stentem. I když je tato technika využívaná většinou u lézí proximálního močovodu nebo iatrogenních poranění cévního svazku ledviny, existují práce, které dokládají dlouhodobé dobré výsledky s tímto typem výkonu u pacientů s karcinomem solitární ledviny ve specializovaných centrech (33).
CÉVNÍ REKONSTRUKCE U GYNEKOLOGICKÝCH MALIGNIT
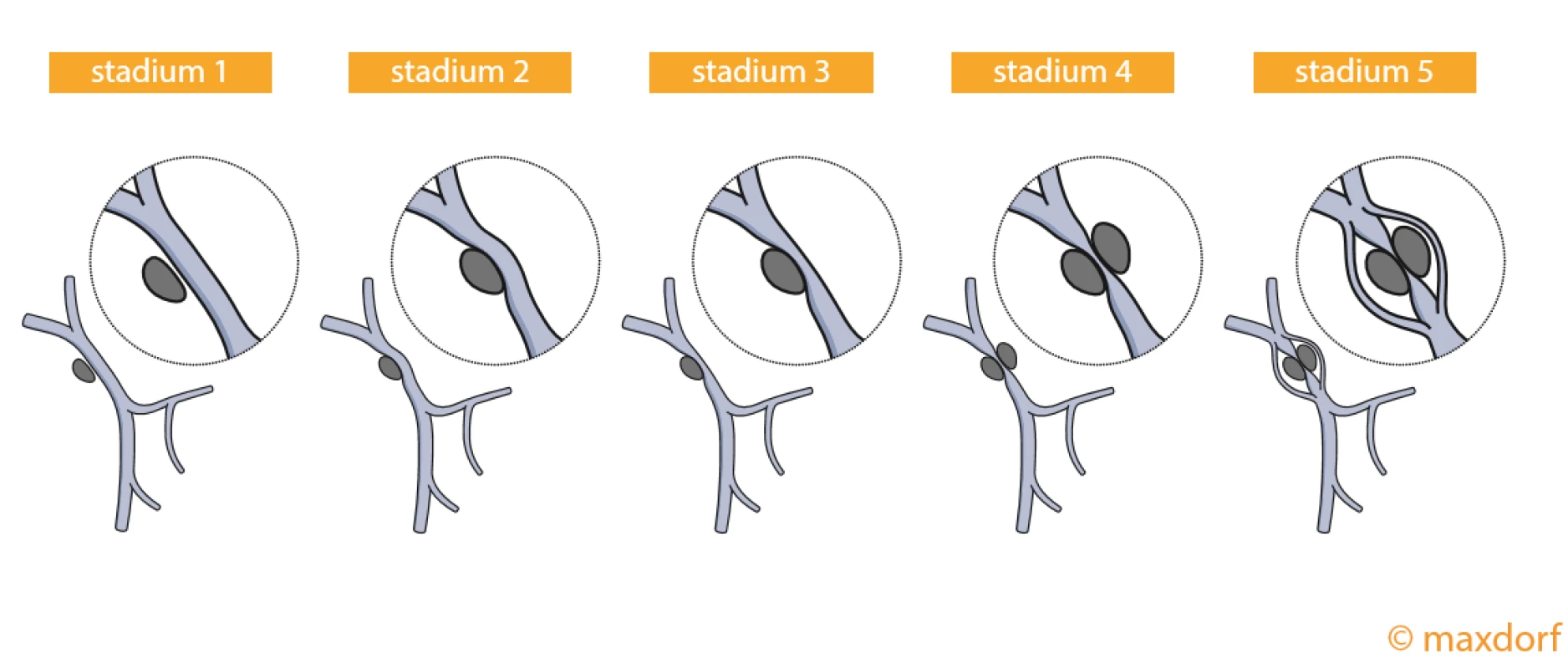
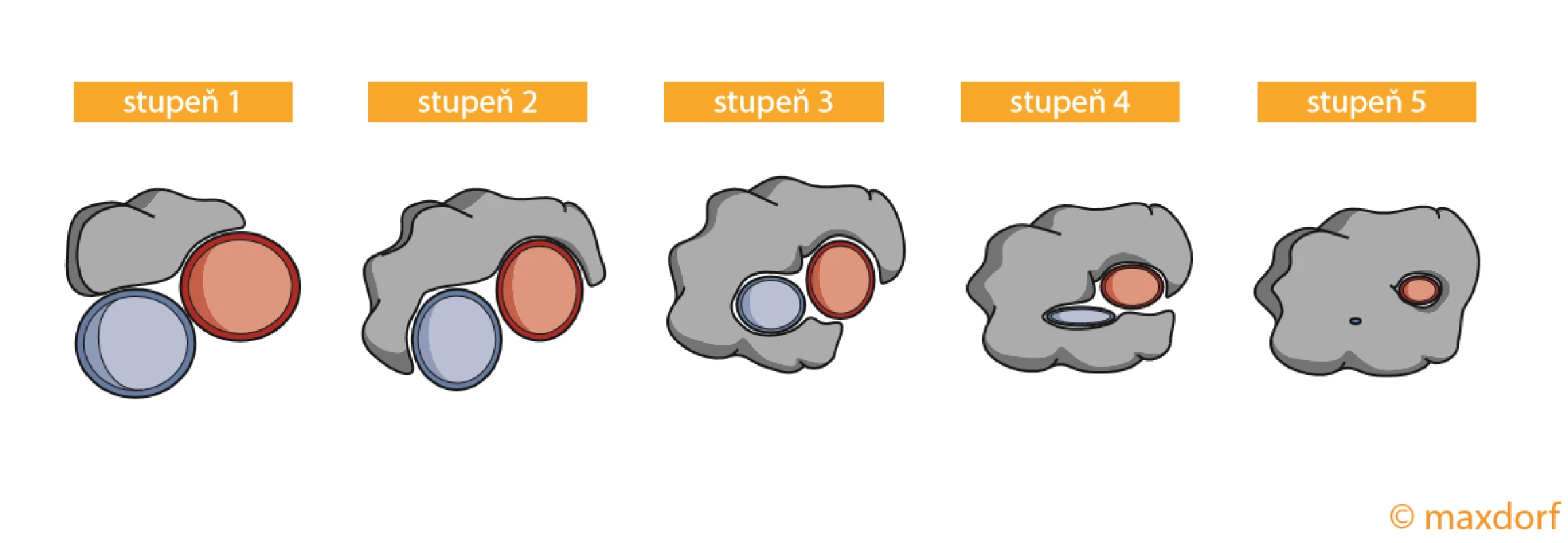
Karcinom endometria je čtvrtým nejčastějším nádorem u žen a radikální hysterektomie je u něj metodou volby pro dosažení resekce R0 (34). Pro staging nádoru endometria je stěžejní CT vyšetření, na jehož základě diferencujeme nádory do čtyřech stadií, přičemž vaskulární invaze do pánevních cév je přítomná u stadií III a IV. Staging invaze do cévního svazku byl popsán pomocí Tinelliho skóre, které rozděluje vaskulární infiltraci do pěti stupňů. Stupeň 1 označuje těsný kontakt nádoru s cévním svazkem a stupeň 5 je určen pro kompletní opouzdření cév nádorem (obr. 4) (35). Ačkoliv nejsou dostupná robustní literární data o frekvenci postižení jednotlivých cévních struktur, jsou pro anatomickou lokalizaci pravděpodobně nejčastěji postižené pánevní cévy.
REKONSTRUKCE PÁNEVNÍCH CÉV
V případě, že je pánevní tepna/žíla infiltrovaná tumorem, je pro dosažení resekce R0 indikovaná resekce postižené části cévy. Pokud se jedná o lokální infiltraci stěny tepny/žíly, je většinou možné provedení prosté sutury s použitím záplaty na nástěnné svorce nebo bez ní (Tinelli 1–2). V případě, že je postižení < 2 cm a infiltrace zabírá celý obvod cévy (Tineli skóre 3–5), je indikována resekce postižené cévy s pokusem o EtE anastomózu. Pro dosažení uvolnění okrajů je možný podvaz vnitřních pánevních cév, čím se dosáhne větší mobility cévních struktur. Jako záplatu je zlatým standardem použití autovenózního štepu následované xenograftem a protetickou náhradou.
Resekce a náhrady pánevních cév
U pokročilé invaze karcinomu endometria (Tinelli 3–5) s rozsahem > 2 cm už není rekonstrukce bez použití interpozita možná. V těchto případech se používá pro dosažení resekce R0 po resekci tumoru z části postižené cévy jako interpozitum nejčastěji vena femoralis superficialis, která je ideálním materiálem pro průměrovou shodu s pánevní žílou. V případě infiltrace pánevní tepny je metodou volby PTFE protéza s anastomózou EtE.
CÉVNÍ REKONSTRUKCE U RETROPERITONEÁLNÍCH MĚKKOTKÁŇOVÝCH SARKOMŮ A METASTÁZ GERMINÁLNÍCH TUMORŮ
Retroperitoneální měkkotkáňové sarkomy (RSTS – retroperitoneal soft tissue sarcoma) jsou sice ojedinělé, ale o to více extenzivní nádory. Jejich roční incidence (kromě GIST) je 4–5/100 000 obyvatel v Evropě. RSTS mají více než 80 různých histologických typů a nejčastěji vyskytujícími jsou liposarkom a leiomyosarkom (36). Role cévního chirurga je u těchto nádorů zásadní, protože svou expanzí často obkružují velké cévní struktury, jako je dolní dutá žíla a abdominální aorta. Pro dosažení dlouhodobého přežívání je nepodkročitelnou podmínkou resekce R0 doplněná o předoperační a pooperační radio/chemoterapii (36).
Pokud má být dosažená resekce R0, je často nutné provedení „blokové“ resekce tumoru s infiltrovanými velkými cévami. Jeden z největších publikovaných souborů onkovaskulární blokové resekce pro RSTS publikovali Bertrand et al. Tyto výkony provedl u 126 pacientů s akceptovatelnou morbiditou a nulovou mortalitou (37). Při blokové resekci dolní duté žíly a/anebo abdominální aorty se upřednostňuje radikální resekce a substituce pomocí protézy s implantací viscerálních tepen a žil do těla protézy.
Situace u nádorem infiltrovaných spádových uzlin germinálních tumorů je stejná jako u RSTS, přičemž radikální metastazektomie s vaskulární resekcí je pro dosažení „čistých okrajů“ resekčních zón základem. Typickým příkladem jsou metastázy karcinomu varlat u mladých mužů, které metastazují do spádových paraaortokaválních lymfatických uzlin.
CÉVNÍ REKONSTRUKCE U SARKOMU DOLNÍCH KONČETIN
Podobně jako RSTS jsou i sarkomy dolních končetin málo časté malignity a zastupují méně než 0,2 % všech malignit. Kromě měkkých tkání můžou postihovat především dlouhé kosti s výskytem v prvních dekádách života (38). Lokální resekce/excize nádoru se zachováním končetiny je zatížena vysokou pravděpodobností rekurence bez dosažení resekce R0, a proto je historicky končetinová amputace považovaná jako onkologicky radikální výkon. V poslední době se objevují studie s dlouhodobým sledováním, které prokazují akceptovatelný efekt revaskularizace dolní končetiny s radikální excizí nádoru při zachování bezpečných resekčních zón.
Preferenční je infraingvinální rekonstrukce zastoupena femoropopliteálním/krurálním bypassem jak na arteriálním, tak i na žilním řečišti. Materiálem volby je u obou typů rekonstrukce VSM následovaná PTFE grafitem. V jednom z největších publikovaných souborů hodnotící výsledky cévní rekonstrukce jako končetinu šetřící výkon u resekce sarkomu bylo dosaženo 5leté přežívání ve 42 % případů vs. 5leté přežívání 40 % u pacientů bez končetinu šetřícího výkonu (39).
ZÁVĚR
Cévní chirurgie na poli onkologie je v některých případech pro záchranu nebo prodloužení života nezbytná. Důraz by tak měl být kladen na včlenění cévních chirurgů do multidisciplinárních onkologických týmů – cévní chirurg je klíčový pro správné zvolení předoperačního vyšetření, posouzení rizika a samotné provedení vaskulární části onkochirurgické operace. Závěrem si dovolujeme tvrdit, že správné pochopení principu a zásad onkovaskulární chirurgie může posunout hranice soudobé onkochirurgické léčby napříč všemi onkologickými obory.
Poděkování
Děkujeme nakladatelství Maxdorf za poskytnutí obrázků.
Adresa pro korespondenci:
doc. MUDr. Peter Baláž, Ph.D., FEBS, MPH
Chirurgická klinika 3. LF UK a FNKV
Šrobárova 50, 100 34 Praha 10
Tel.: 236 055 268,776 882 216
e-mail: peter.balaz@lf3.cuni.cz
Sources
1. Ghosh J, Bhowmick A, Baguneid M. Oncovascular surgery. Eur J Surg Oncol 2011; 37 : 1017–1024.
2. Han A, Ahn S, Min SK. Oncovascular surgery: essential roles of vascular surgeons in cancer surgery. Vasc Specialist Int 2019; 35(2): 60–69.
3. Yoshitomi H, Kato A, Shimizu H et al. Tips and tricks of surgical technique for pancreatic cancer: portal vein resection and reconstruction (with videos). J Hepatobiliary Pancreat Sci 2014; 21: E69–E74.
4. Siegel R, Ma J, Zou Z, Jemal A. Cancer statistics 2014. CA Cancer J Clin 2014; 64 : 9–29.
5. Aier I, Semwal R, Sharma A, Varadwaj PK. A systematic assessment of statistics, risk factors, and underlying features involved in pancreatic cancer. Cancer Epidemiol 2019; 58 : 104–110.
6. Ducreux M, Cuhna AS, Caramella C et al. Cancer of the pancreas: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2015; 26 Suppl. 5: v56–68.
7. Valls C, Andia E, Sanchez A et al. Dual-phase helical CT of pancreatic adenocarcinoma: assessment of resectability before surgery. Am J Roentgenol 2002; 178 : 821–826.
8. Tempero MA, Malafa MP, Behrman SW et al. Pancreatic adenocarcinoma, version 2.2014: featured updates to the NCCN guidelines. J Natl Compr Canc Netw 2014; 12 : 1083–1093.
9. Callery MP, Chang KJ, Fishman EK et al. Pretreatment assessment of resectable and borderline resectable pancreatic cancer: expert consensus statement. Ann Surg Oncol 2009; 16 : 1727–1733.
10. Moore GE, Sako Y, Thomas LB. Radical pancreatoduodenectomy with resection and reanastomosis of the superior mesenteric vein. Surgery 1951; 30 : 550–553.
11. Tseng JF, Raut CP, Lee JE et al. Pancreaticoduodenectomy with vascular resection: margin status and survival duration. J Gastrointest Surg. 2004; 8 : 935–950.
12. Harrison LE, Klimstra DS, Brennan MF. Isolated portal vein involvement in pancreatic adenocarcinoma. A contraindication for resection? Ann Surg 1996; 224 : 342–349.
13. Rehders A, Stoecklein NH, Guray A et al. Vascular invasion in pancreatic cancer: tumor biology or tumor topography? Surgery 2012; 152(3, Suppl. 1): 143–151.
14. Vicente E, Quijano Y, Ielpo B. Arterial resection for pancreatic cancer: a modern surgeon should change its behavior according to the new therapeutic options. G Chir 2014; 35 : 5–14.
15. Mollberg N, Rahbari NN, Koch M et al. Arterial resection during pancreatectomy for pancreatic cancer: a systematic review and meta-analysis. Ann Surg 2011; 254 : 882–893.
16. Latona JA, Lamb KM, Pucci MJ et al. Modified Appleby procedure with arterial reconstruction for locally advanced pancreatic adenocarcinoma: A literature review and report of three unusual cases. J Gastrointest Surg 2016; 20 : 300–306.
17. Shukla PJ, Barreto SG, Kulkarni A et al. Vascular anomalies encountered during pancreatoduodenectomy: do they influence outcomes? Ann Surg Oncol 2010; 17 : 186–193.
18. Fuhrman GM, Leach SD, Staley CA et al. Rationale for en bloc vein resection in the treatment of pancreatic adenocarcinoma adherent to the superior mesenteric-portal vein confluence. Pancreatic Tumor Study Group. Ann Surg 1996; 223 : 154–162.
19. Vogel A, Cervantes A, Chau I et al. Hepatocellular carcinoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2018; 29: iv238–iv255.
20. Berumen J, Hemming A. Vascular reconstruction in hepatic malignancy. Surg Clin North Am 2016; 96 : 283–298.
21. Shindoh J, Tzeng CW, Aloia TA et al. Safety and efficacy of portal vein embolization before planned major or extended hepatectomy: an institutional experience of 358 patients. J Gastrointest Surg 2014; 18 : 45–51.
22. Hemming AW, Reed AI, Howard RJ et al. Preoperative portal vein embolization for extended hepatectomy. Ann Surg 2003; 237 : 686–691.
23. Neuhaus P, Thelen A, Jonas S et al. Oncological superiority of hilar en bloc resection for the treatment of hilar cholangiocarcinoma. Ann Surg Oncol. 2012; 19 : 1602–1608.
24. Abbas S, Sandroussi C. Systematic review and meta-analysis of the role of vascular resection in the treatment of hilar cholangiocarcinoma. HPB (Oxford) 2013; 15 : 492–503.
25. Oldhafer KJ, Lang H, Schlitt HJ et al. Long-term experience after ex situ liver surgery. Surgery 2000; 127 : 520–527.
26. Escudier B, Porta C, Schmidinger M et al. Renal cell carcinoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up dagger. Ann Oncol 2019; 30 : 706–720.
27. Jibiki M, Iwai T, Inoue Y et al. Surgical strategy for treating renal cell carcinoma with thrombus extending into the inferior vena cava. J Vasc Surg 2004; 39 : 829–835.
28. Neves RJ, Zincke H. Surgical treatment of renal cancer with vena cava extension. Br J Urol 1987; 59 : 390–395.
29. Blute ML, Leibovich BC, Lohse CM et al. The Mayo Clinic experience with surgical management, complications and outcome for patients with renal cell carcinoma and venous tumour thrombus. BJU Int 2004; 94 : 33–41.
30. Wotkowicz C, Wszolek MF, Libertino JA. Resection of renal tumors invading the vena cava. Urol Clin North Am 2008; 35 : 657–671.
31. McAree BJ, O’Donnell ME, Fitzmaurice GJ et al. Inferior vena cava thrombosis: a review of current practice. Vasc Med 2013; 18 : 32–43.
32. Gloviczki P, Pairolero PC, Toomey BJ et al. Reconstruction of large veins for nonmalignant venous occlusive disease. J Vasc Surg 1992; 16 : 750–761.
33. Janssen MWW, Linxweiler J, Philipps I et al. Kidney autotransplantation after nephrectomy and work bench surgery as an ultimate approach to nephron-sparing surgery. World J Surg Oncol 2018; 16 : 35.
34. Colombo N, Preti E, Landoni F et al. Endometrial cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2013; 24 Suppl 6: vi33–38.
35. Tinelli G, Cappuccio S, Parente E et al. Resectability and vascular management of retroperitoneal gynecological malignancies: A large single-institution case-series. Anticancer Res 2017; 37 : 6899–6906.
36. Casali PG, Abecassis N, Bauer S et al. Soft tissue and visceral sarcomas: ESMO –EURACAN Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2018; 29: iv51–iv67.
37. Bertrand MM, Carrere S, Delmond L et al. Oncovascular compartmental resection for retroperitoneal soft tissue sarcoma with vascular involvement. J Vasc Surg 2016; 64 : 1033–1041.
38. Casali PG, Bielack S, Abecassis N et al. Bone sarcomas: ESMO – PaedCan – EURACAN Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2018; 29: iv79–iv95.
39. Nishinari K, Krutman M, Aguiar S jr. et al. Surgical outcomes of vascular reconstruction in soft tissue sarcomas of the lower extremities. J Vasc Surg 2015; 62 : 143–149.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental HygienistArticle was published in
Journal of Czech Physicians

- Advances in the Treatment of Myasthenia Gravis on the Horizon
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
-
All articles in this issue
- Úvodem
- The role of the vascular surgery in oncosurgery
- Perioperative management of metformin: is there something new?
- Obstacles and problems in global elimination of viral hepatitis C
- Exploratory drilling: how to set up, carry out, and evaluate a seroprevalence study
- Memorandum Johna Snowa: Vědecký konsensus k pandemii COVID-19. Je potřeba jednat
- Opinions and attitudes of experts to the digitization of the Czech healthcare: preliminary report on the implementation of the first wave of the DELPHI study
- Hydroterapie v díle Aula Cornelia Celsa
- Veřejné wittenberské pitvy Jana Jessenia
- Josef Jan Čejka, Božena Němcová a George Sandová
- James Whyte Black (1924–2010)
- Dva v jednom: Polytrauma a komplikace v chirurgické péči + Dopravní úrazy
- Moje vzpomínky na prof. Jiřího Widimského st.
- Zemřel Nicola Scopinaro, legenda bariatricko-metabolické chirurgie
- Zemřel prof. MUDr. František Perlík, DrSc.
- Journal of Czech Physicians
- Journal archive
- Current issue
- About the journal
Most read in this issue
- The role of the vascular surgery in oncosurgery
- Exploratory drilling: how to set up, carry out, and evaluate a seroprevalence study
- Opinions and attitudes of experts to the digitization of the Czech healthcare: preliminary report on the implementation of the first wave of the DELPHI study
- Perioperative management of metformin: is there something new?
