Mikrobiálna kolonizácia horných dýchacích orgánov a imunita u detí s adenoidnými vegetáciami
Microbial Colonization of Upper Respiratory Pathways and Immunity in Children with Adenoid Vegetation
Introduction:
The upper aerodigestive tract is the most common point of entry for pathogens and serves as a first step in interaction between microorganisms and immune system. Many disorders of immune system are manifested as infection of upper aerodigestive tract. On the other hand, those infections are also common in patients with an intact immunity, especially among children.
Methods:
The prospective study was conducted with 61 children that were scheduled to endoscopic adenotomy for adenoid vegetation at the Department of Otorhinolaryngology, Head and Neck Surgery, Comenius University, Jessenius Faculty of Medicine, University Hospital in Martin, Slovakia. Relationship between microbiological findings in middle meatus and nasopharynx, presence of atopy, as well humoral and cellular components of immunity were evaluated.
Results:
Pathogenic bacteria were isolated in 58 % samples from middle nasal meatus and 72 % samples from nasopharynx. Streptococcus pneumoniae, Staphylococcus aureus, Haemophillus influenzae and Moraxella catarrhalis were the most common identified pathogens in both middle nasal metaus and nasopharynx. Identification of pathogenic bacteria in middle nasal meatus did not correlate with isolation of pathogenic bacteria in nasopharynx. Atopy was diagnosed in 83 % children with adenoid hypertrophy. Presence of atopy was associated with significantly decreased presence of saprophytes and more often colonization of pathogenic bacteria in the middle nasal meatus (P=0.37, P=0.45, respectively). Severe impairment of immunity was not detected.
Conclusion:
Identification of pathogenic bacteria in middle nasal meatus does not correlate with isolation of pathogenic bacteria in nasopharynx. Targeted antibiotic treatment should be chosen by a result from nasopharyngeal swab and not from the nasal cavity. Atopy is an important factor in the pathogenesis of adenoid vegetation. Therefore, immunoallergologic examination should be a standard part of the management and diagnostic procedures in children with adenoid vegetations. Children with recurrent respiratory infections are rarely caused by inborn defects of immunity.
KEYWORDS:
pathogens, upper airways, immunity, atopy, adenoid vegetatios
Authors:
G. Bugová 1; B. Uhliarová 2; M. Jeseňák 3
; A. Hajtman 1
Authors‘ workplace:
Klinika ORL a ChHaK UK JLF a UNM v Martine
1; ORL odd., FNsP FD Roosevelta, Banská Bystrica
2; Klinika detí a dorastu UK JLF a UNM v Martine
3
Published in:
Otorinolaryngol Foniatr, 66, 2017, No. 1, pp. 16-21.
Category:
Original Article
Overview
Úvod:
Horná časť aerodigestívneho traktu je najčastejším miestom vstupu mikroorganizmov do tela a prvým miestom vzájomnej interakcie mikroorganizmu a imunitného systému človeka. Veľká časť porúch imunity sa manifestuje práve infekciami horného aerodigestívneho traktu. Tieto infekcie sa vyskytujú pomerne často aj u pacientov s neporušeným imunitným systémom, a to najmä v detskom veku.
Metodika:
Do prospektívnej štúdie bolo zaradených 61 detí, ktorým bola vykonaná endoskopická adenotómia v celkovej anestézii na Klinike otorinolaryngológie a chirurgie hlavy a krku, UK JLF a UNM v Martine. Autori určovali mikrobiologický nález v strednom nosovom priechode a v nosohltane, ich vzájomný vzťah, sledovali výskyt atopie a stanovovali vybrané parametre humorálnej a celulárnej imunity.
Výsledky:
Patogénne baktérie sme izolovali u 58 % detí v strednom nosovom priechode a u 72 % v nosohltane. Z patogénov sme najčastejšie identifikovali druhy Streptococcus pneumoniae, Staphylococcus aureus, Haemophillus influenzae a Moraxella catarrhalis, a to v strednom nosovom priechode ako aj v nosohltane. Identifikácia baktérií v nosovej dutine nekorelovala s ich nálezom v nosohltane. Atopiu sme diagnostikovali u 83 % detí. U detí s atopiou sme detegovali signifikantne nižšiu kolonizáciu saprofytmi (p=0,037) a vyššie zastúpenie patogénov (p=0,045) v strednom nosovom priechode v porovnaní s deťmi bez atopie. Závažnú poruchu imunity sme nedetegovali.
Záver:
Identifikácia baktérií v nosovej dutine nekoreluje s ich nálezom v nosohltane. Pri výbere cielenej ATB liečby je smerodajný výsledok steru z nosohltana a nie z nosovej dutiny. Atopia je dôležitý faktor v patogenéze adenoidných vegetácií. Imunoalergologické vyšetrenie by preto malo byť štandardnou súčasťou manažmentu a diagnostického postupu u detí s adenoidnými vegetáciami. Deti s recidivujúcimi respiračnými infekciami majú len zriedkavo závažnú vrodenú poruchu imunity.
KĽÚČOVÉ SLOVÁ:
patogénne baktérie, horné dýchacie orgány, imunita, atopia, adenoidné vegetácie
ÚVOD
Najčastejším miestom vstupu mikroorganizmov do tela človeka je horná časť aerodigestívneho traktu, kde dochádza k vzájomnej interakcii mikroorganizmov a imunitného systému človeka. Podľa toho kde interakcia vyvolá zápalovú reakciu hovoríme o rinosinusitíde, otitíde, stomatitíde, faryngolaryngitíde či lymfadenitíde. Pri správnom fungovaní imunitného systému chráni organizmus pred prienikom infekcie zo slizníc do hlbších oblastí organizmu a z toho vyplývajúcich komplikácií (16).
Priemerný počet zápalov horných dýchacích orgánov (HDO) u detí je okolo 6-8 za rok. Ak tieto infekcie prebiehajú nekomplikovane, dobre reagujú na liečbu a objavujú sa najmä v jesenných a zimných mesiacoch, hovoríme o tzv. fyziologickej chorobnosti. Z hľadiska ďalšieho diagnostického ako aj terapeutického manažmentu je však dôležitejšie ako samotný počet infekcií sledovať priebeh zápalov, ich komplikácie a následky, reakciu na liečbu, alebo či sa ďalší infekt objaví ešte u nedoliečeného pacienta. Ak sa vylúčia štandardné príčiny (napr. adenoidné vegetácie, alergia, gastroezofageálny a laryngofaryngeálny reflux), malo by sa uvažovať aj o primárnej poruche imunity (3). Obzvlášť by sa malo myslieť na túto skutočnosť, ak u dieťaťa vnikne závažná komplikácia ako je meningitída, absces mozgu, subperiostálny absces očnice pri rinosinusitíde alebo mastoiditída pri otitíde. Ak je pôvodca ťažkého zápalu oportúnny patogén, ktorý väčšinou nevyvoláva ochorenie u imunokompetentných jedincov, je potrebné tiež myslieť na možnú poruchu imunity (8, 16).
MATERIÁL A METODIKA
Do prospektívnej štúdie bolo zaradených 61 detí s adenoidnými vegetáciami, ktorým bola vykonaná endoskopická adenotómia v celkovej anestézii na Klinike otorinolaryngológie a chirurgie hlavy a krku, UK JLF a UNM v Martine. Adenotómia bola indikovaná pre obturáciu nosohltana a recidivujúce infekcie horných dýchacích orgánov.
Zo súboru boli vyradení pacienti:
- s recidivujúcimi tonzilitídami,
- so zvýšeným C-reaktívnym proteínom,
- s infekciou horných dýchacích orgánov počas 2 týždňov pred endoskopickou adenotómiou,
- ktorým boli podávané lokálne a/alebo celkové antibiotiká v priebehu 4 týždňov pred endoskopickou adenotómiou,
- bez úplnej dokumentácie.
Všetci pacienti a ich zákonní zástupcovia boli informovaní o charaktere štúdie a podpísali informovaní súhlas. Štúdia bola schválená Etickou komisiou Jesseniovej lekárskej fakulty Univerzity Komenského v Martine.
V sledovanom súbore pacientov sme určovali mikrobiologický nález v strednom nosovom priechode a v nosohltane a stanovovali sme imunologický stav dieťaťa.
Mikrobiologické vyšetrenie
Pred plánovaným výkonom v celkovej anestézii sme odobrali ster zo stredného nosového priechodu a z nosohltana pomocou sterilného vatového tampónu. Tampón s odobratou vzorkou sme v sterilnom transportnom systéme (skúmavka s pôdou Stuart) v priebehu 2-4 hodín zaslali na mikrobiologické vyšetrenie. Vzorka sa naočkovala na kultivačné pôdy – ovčí krvný agar (Columbia Bio-Rad), čokoládový agar s bacitracínovým diskom, Mac Conckey agar (Bio rad) a vložili sa do inkubátora s 7% CO2 pri teplote 37° C. Kultivačné pôdy sa hodnotili po 18-24 hodinách inkubácie. Na detekciu pomaly rastúcich mikroorganizmov sa doba inkubácie predĺžila na 48 hodín. Jednotlivé kolónie baktérií boli identifikované na základe ich typickej morfológie, farbením podľa Grama, použitím štandardných rýchlych testov (katalázy, pyrrolidonylaminopeptidázy - PYR a oxidázové testy), latex aglutinačných a biochemických testov.
Parametre imunitného systému
V deň operácie bol realizovaný odber periférnej venóznej krvi do skúmaviek ošetrených EDTA alebo sodnou soľou heparínu. Pomocou štandardného multifunkčného biochemického analyzátora boli stanovené štyri izotypy imunoglobulínov (IgG, IgA, IgM, IgE), koncentráciu C3 a C4 zložky komplementu ako aj krvný obraz s diferenciálnym rozpočtom bielych krviniek. Základné populácie a subpopulácie lymfocytov (CD3+, CD19+, CD3+CD4+, CD3+CD8+) a NK bunky (CD16+CD56+) boli vyšetrené pomocou multiparametrickej prietokovej cytometrie s využitím monoklonálnych protilátok označených fluorescenčnými farbivami (prietokový cytometer FACScalibur, Becton Dickinson, USA).
Atopia
Kožné prick testy (SPT) boli realizované na základe platných odporúčaní Európskej akadémie pre klinické imunológiu a alergológiu (EAACI), pričom panel testovaných alergénov zahŕňal: roztoče (Dermatophagoides pteronyssinus, Dermatophagoides farinae), zmes brezovitých stromov (breza, lieska, jelša, hrab), zmes drevín (buk, gaštan, dub), zmes 5 tráv (lipnica, reznačka, mätonoh, tomka, timotejka), palina, pes, mačka, Alternaria alternata a Aspergilus fumigatus). Ako pozitívnu kontrolu sme použili roztok histamín dihydrochloridu v destilovanej vode (10 mg/ml) a glycerol vo fyziologickom roztoku bol použitý ako negatívna kontrola. Alergénové extrakty, pozitívna a negatívna kontrola boli nanesené po kvapkách na očistenú a klinicky kľudnú volárnu stranu predlaktia. V mieste kvapky bol povrch kože narušený lancetou s krátkym hrotom a po 1-2 minútach bola kvapka zotretá. Na každý prick bola použitá samostatná jednorázová lanceta (Stallerpoint, Francúzko). Po 15 minútach bola vzniknutá kožná reakcia odčítaná. Za pozitívnu reakciu bola považovaná indurácia (papula) s minimálnym priemerom 3 mm. Deti s aspoň jedným pozitívnym výsledkom SPT na inhalačné alergény sme označili za atopické.
ŠTATISTICKÁ ANALÝZA
Charakteristiku súboru pacientov a sledované dáta sme vyhodnotili pomocou frekvenčnej sumarizácie a deskriptívnej štatistiky: priemer, medián, smerodajná odchýlka, medián, kvartil minima a maxima. Rozdiely medzi sledovanými parametrami sme vyhodnotili štandardnými neparametrickými testami. Neparametrické metódy sme zvolili preto, lebo nebol splnený predpoklad parametrických testov, normalita dát.
Pri hodnotení vzťahu kategoriálnych premenných pre dve kategórie binárneho charakteru (áno/nie) sme použili Pearsonov c2-test s Yatesovou koreláciou. Rozdiely sledovaných parametrov medzi sledovanými skupinami pacientov sme vyhodnotili pomocou Mann-Whitney U testu (2 nezávislé kategórie) a Kruskal-Wallis testu (3 nezávislé kategórie). Na analýzu rozptylu sledovanej hodnoty s prítomnosťou viacerých faktorov sme použili dvojfaktorovú ANOVA s post hoc Duncan testom.
Za štatisticky významné sme v rámci všetkých použitých testov považovali hodnoty hladiny významnosti p < 0,05. Na štatistickú analýzu sme použili program STATISTICA Cz 10.
VÝSLEDKY
Do prospektívnej štúdie bolo zaradených 61 detí s adenoidnými vegetáciami, ktorým bola vykonaná endoskopická adenotómia v celkovej anestézii na Klinike ORL a ChHaK UK JLF a UN v Martine. V súbore bolo 43 chlapcov, priemerný vek 4,5 ± 2 rokov (2-12,5 roka) a 18 dievčat, priemerný vek 5 ± 4 rokov (2,5-16 rokov).
Mikrobiologický nález v strednom nosovom priechode a v nosohltane
Na základe kultivačného vyšetrenia sme identifikovali baktérie u 50 (82 %) vzoriek zo stredného nosového priechodu a u 60 (98 %) vzoriek z nosohltana. Identifikované baktérie zo stredného nosového priechodu a nosohltana sú uvedené v tabuľke 1.
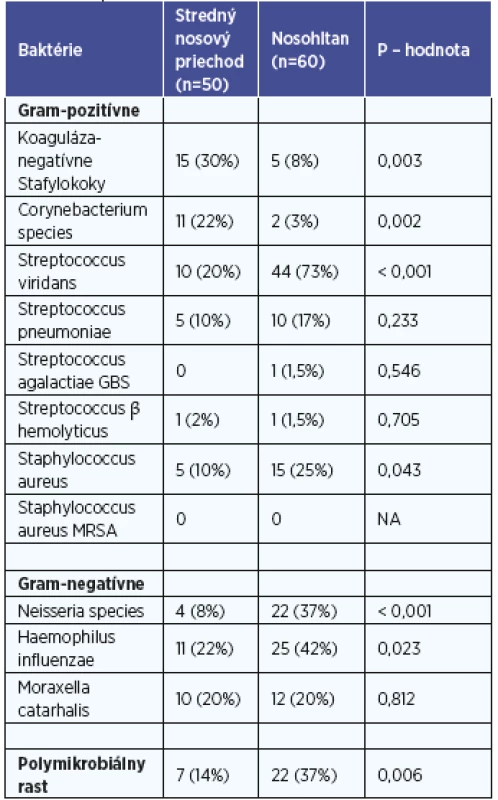
Koaguláza-negatívne Staphylococcus spp., Corynebacterium spp., druh Streptococcus viridans a Neisseria spp. kolonizujú respiračnú sliznicu za normálnych podmienok a tvoria tak súčasť nepatogénnej bakteriálnej flóry sliznice horných dýchacích orgánov. Preto výskyt patogénnych baktérií v našom súbore bol nasledovný: 29 (58 %) v strednom nosovom priechode a 43 (72 %) v nosohltane. Signifikantné rozdiely medzi výskytom patogénnych baktérií v nosovej dutine a nosohltane sme nezaznamenali (p=0,133). Polymikrobiálny rast patogénnych baktérií sa vyskytoval častejšie v nosohltane v porovnaní so stredným nosovým priechodom (p=0,006).
Porovnaním vzťahu medzi mikrobiálnou kolonizáciou stredného nosového priechodu a nosohltana sme zhodu medzi izoláciou patogénnych baktérií v obidvoch lokalitách horných dýchacích ciest detegovali iba u 18 % (patogény neprítomné) a u 12 % (patogény prítomné) detí. Najčastejšie sme zaznamenali skupinu, kedy patogény boli izolované z nosohltana, avšak nie zo stredného nosového priechodu (p=0,004) (graf 1).

Imunologický stav
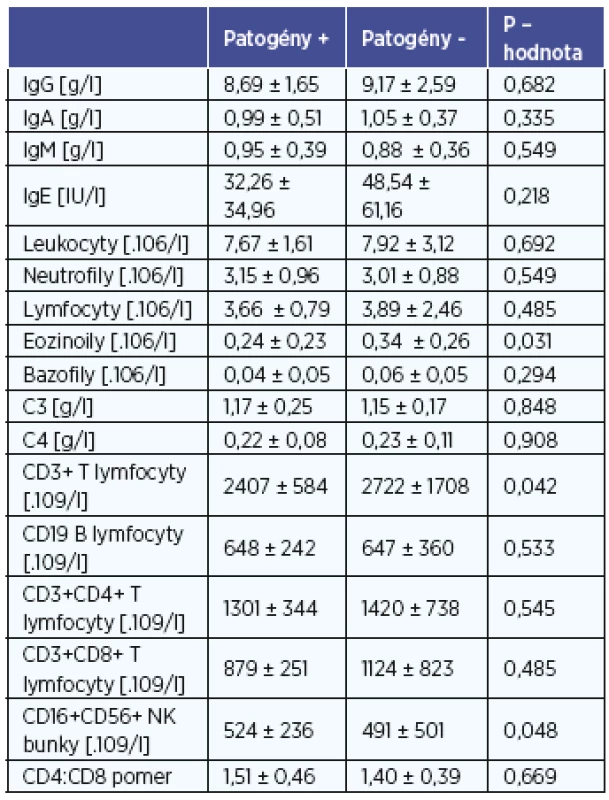
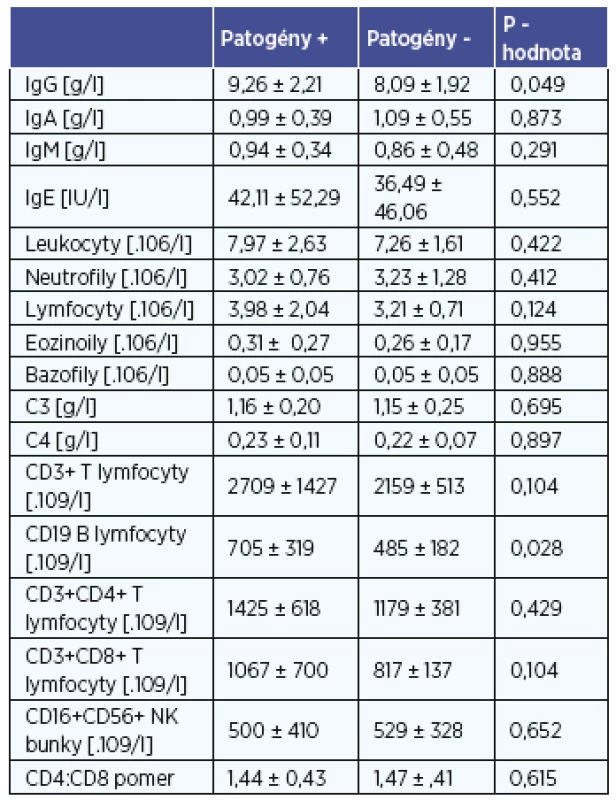
Zmeny v parametroch celulárnej a humorálnej imunity u detí v súvislosti s prítomnosťou patogénnych baktérií v strednom nosovom priechode a v nosohltane sú uvedené v tabuľke 2 a 3. U detí bez záchytu patogénov v nosovej dutine sme zaznamenali vyšší absolútny počet eozinofilov v periférnej krvi v porovnaní s deťmi so záchytom patogénneho mikroorganizmu (tab. 2). U detí s prítomnosťou patogénov v nosohltane sme naopak zaznamenali vyššie koncentrácie IgG v periférnej krvi v porovnaní s deťmi bez kolonizácie patogénnymi mikroorganizmami (tab. 3). Pri porovnaní vybraných imunitných parametrov vzhľadom na prítomnosť patogénov v nosovej dutine sme zaznamenali u detí so záchytom patogénnych mikroorganizmov vyšší absolútny počet NK buniek a nižší počet celkových T-lymfocytov v porovnaní s deťmi bez záchytu patogénov (tab. 2). Záchyt patogénov v nosohltane bol spojený s vyššou koncentráciou IgG a vyšším počtom B-lymfocytov (tab. 3). Ostatné vyšetrované parametre nevykazovali štatisticky významné rozdiely medzi podskupinami detí, a to tak pre nosovú dutinu ako aj nosohltan.
Atopia
Atopiu na základe výsledkov prick-testov sme diagnostikovali u 83 % detí. U detí s atopiou sme v strednom nosovom priechode identifikovali signifikantne nižšiu kolonizáciu saprofytmi (p=0,037) a vyššie zastúpenie patogénov (p=0,045) v porovnaní s deťmi bez atopie (graf 2A). Podobné rozdiely v kolonizácii nosohltana sme nezaznamenali (graf 2B).


DISKUSIA
Horné dýchacie a prehĺtacie orgány sú často iniciálnym miestom vstupu baktérii do organizmu. Kolonizácia mikroorganizmami je prvým krokom k rozvoju chorôb tejto oblasti. U pediatrických pacientov sú recidivujúce respiračné infekcie frekventné, často nereagujú na selektívne antibiotiká a protizápalovú liečbu. To viedlo viacero odborníkov k predpokladu, že baktérie, či už jeden alebo viacero druhov, sa organizujú a vytvárajú určitý biofilm. Ide o kolóniu jedného alebo viacerých druhov baktérií, ktoré sú „obalené“ v extracelulárnej polymérovej matrix, ktorá obsahuje nukleové kyseliny, polysacharidy a proteíny. To im zaručuje lepšie prežívanie a ochranu pred makrofágmi, ATB, zmenami telesnej teploty či pH. Tieto formácie sú pravdepodobne zodpovedné za vznik rezistencie na antibiotiká a zohrávajú úlohu aj v recidíve ochorenia (5, 12). Je dokázané, že niektoré druhy baktérií ako Haemophillus influenzae, Pseudomonas aeruginosa, Streptococcus pneumoniae a Staphylococcus aureus zodpovedné za choroby v HDO sú schopné vytvárať takýto biofilm (11, 14).
Najčastejšie izolované patogénne baktérie, ktoré spôsobujú respiračné infekcie, ale aj akútny zápal stredného ucha a zápal pľúc, rovnako ako i invazívne infekcie, bakteriémiu či meningitídy u detí sú Streptococcus pneumoniae, Haemophillus influenzae a Moraxella catarrhalis (6).
V práci sme porovnávali osídlenie mikroorganizmami v nosohltane a v strednom nosovom priechode. Patogénne baktérie sme izolovali u 29 (58 %) detí v strednom nosovom priechode a u 43 (72 %) v nosohltane. Z patogénov sme najčastejšie identifikovali druhy Streptococcus pneumoniae, Staphylococcus aureus, Haemophillus influenzae a Moraxella catarrhalis, a to v strednom nosovom priechode ako aj v nosohltane. Podobné výsledky zaznamenali aj iní autori (4, 10, 15). Na druhej strane polymikrobiálny rast, čiže identifikácia viacerých patogénov súčasne, bol častejší v nosohltane v porovnaní s nosovou dutinou. Vysvetľujeme si to hypertrofiou lymfoepitelového tkaniva, ktoré predstavuje zdroj infekcie. Opakujúce sa infekcie lymfoepitelového tkaniva vedú k chronickej aktivácii bunkami sprostredkovanej a humorálnej imunitnej odpovede s následnou hyperpláziou lymfoidného tkaniva, ktoré zase predstavuje vhodné prostredie pre kolonizáciu patogénnymi baktériami (15).
Zaujímavé sú výsledky vzťahu patogénov v nosovej dutine a nosohltane. Signifikantne najčastejšie sme detegovali nezhodu v zmysle identifikácie patogénov v nosohltane, ale nie v strednom nosovom priechode. Práve preto považujeme za smerodajný výsledok steru z nosohltana a nie z nosovej dutiny, ktorý je často predovšetkým u malých detí odobratý len z nosovej predsiene a nie z hlbších častí nosovej dutiny. Na základe toho môže byť liečba indikovaná len na základe výteru z prednej časti nosovej dutiny nesprávna a nemusí viesť k zmene v klinickom stave a príznakom z HDO. Ster z nosohltana sa vykonáva bežnou „výterovkou“, a to cez nosovú alebo ústnu dutinu. Preto voľba ATB u detí by sa mala riadiť výsledkom steru z nosohltana, z lymfoepitelového tkaniva, ktoré je častým zdrojom infekcie.
V našej práci sme zaznamenali vysoké percento detí s atopiou. Atopiu na základe prick-testov sme diagnostikovali až u 83 % detí, ktoré podstúpili endoskopickú adenotómiu. Ide o jednoznačný dôkaz, že atopia je dôležitý faktor v patogenéze adenoidných vegetácií. Komplexná antialergická liečba (systémová, lokálna) môže teda prispieť spolu s adenotómiou k normalizácii zápalu v HDO ako aj zmierneniu príznakov obštrukcie dýchacích ciest, prípadne k reštitúcii slizničných pomerov po adenotómii. Atopia navyše signifikantne ovplyvňuje mikrobiálnu kolonizáciu HDO a jej zloženie (2). Aj v našej práci sme u detí s atopiou detegovali signifikantne nižšiu kolonizáciu saprofytmi a vyššie zastúpenie patogénov v strednom nosovom priechode v porovnaní s deťmi bez atopie.
U detí bez záchytu patogénov z nosovej dutiny sme zaznamenali zvýšenie absolútneho počtu eozinofilov v periférnej krvi v porovnaní s deťmi u ktorým boli detegované patogénne baktérie v tejto časti HDO. Eozinofília v periférnej krvi je asociovaná s alergickým zápalom v dýchacích orgánoch (2), a preto sa domnievame, že v tejto podskupine detí môže prispievať k symptómom z HDO aj pridružený alergický zápal. Niektorí autori opisujú aj obraz tzv. alergických adenoidov, kde základom pre hyperpláziu nosohltanovej mandle je zmnoženie IgE-pozitívnych imunitných buniek (napr. mastocytov) (9). Deti s identifikovanými patogénnymi mikroorganizmami v nosohltane mali zvýšenú celkovú koncentráciu IgG v periférnej krvi, čo môže byť prejavom chronickej stimulácie slizničného imunitného systému a zvýšenej aktivácie B-lymfocytov u detí s chronickým fókusom infekcie v HDO. Po odstránení fókusu v HDO bol pozorovaný mierny pokles IgG (7). Aj iní autori pozorovali zvýšené koncentrácie imunoglobulínov ako aj B-lymfocytov u pacientov s rekurentnými tonzilitídami v porovnaní s pacientmi s idiopatickou tonzilárnou hypertrofiou bez infekčných komplikácií (13). Aj naša práca podporuje teórie, ktoré poukazujú na vplyv chronickej fokálnej infekcie v HDO na systémovú imunitu u detí (1).
ZÁVER
Identifikácia baktérií v nosovej dutine nekoreluje s ich nálezom v nosohltane. Lymfoepitelové tkanivo nosohltana v detskom veku predstavuje najčastejší fokus infekcie horných dýchacích orgánov, preto pri výbere cielenej ATB liečby je smerodajný výsledok steru z nosohltana a nie z nosovej dutiny.
Častou asociovanou komorbiditou adenoidných vegetácií je aj atopický (alergický) terén v dýchacích cestách. Atopia je dôležitý faktor v patogenéze adenoidných vegetácií. Imunoalergologické vyšetrenie by preto malo byť štandardnou súčasťou manažmentu a diagnostického postupu u detí s adenoidnými vegetáciami. Včasnou diagnostikou a liečbou alergických chorôb sa tak môže predchádzať vzniku ich komplikácií.
Deti s recidivujúcimi respiračnými infekciami majú len zriedkavo závažnú vrodenú poruchu imunity. Na druhej strane sú ORL orgány častým prejavom vrodených porúch imunity. Ak majú infekcie špecifický charakter – ťažký, komplikovaný priebeh, sú perzistujúce alebo vyvolané oportúnnym patogénom, je potrebné myslieť na vrodenú poruchu imunity.
Poďakovanie
Práca bola podporená grantom VEGA 1/0252/14.
Adresa ke korespondenci:
MUDr. Barbora Uhliarová, Ph.D.
ORL odd., FNsP FD Roosevelta
Nám. L. Svobodu 1
974 01 Banská Bystrica
Slovenská republika
e-mail: b.uhliarova@gmail.com
Sources
1 Baradaranfar, M. H., Dodangeh, F., Taghipour-Zahir, S. et al.: Humoral and cellular imunity parameters in children before and after adenotonsillectomy. Acta Med. Iran, 45, 2007, 5, s. 345-350.
2. Barreto, M., Villa, M. P., Monti, F. et al.: Additive effect of eosinophilia and atopy in exhaled nitric oxide levels in children with or without a history of respiratory symptoms. Pediat. Allergy Immunol., 16, 2005, 1, s. 52-58.
3. Brndiarová, M., Mikler, J., Bánovčin, P. et al.: Extraeozofágový reflux – otolaryngologické komplikácie gastroezofágového refluxu. Čes-slov. Pediat, 66, 2011, 2, s. 85-91.
4 Brook, I., Shah, K.: Bacteriology of adenoids and tonsils in children with recurrent adenotonsillitis. Ann. Otol. Rhinol. Laryngol., 110, 2001, 9, s. 844-848.
5. Fergie, N., Bayston, R., Pearson, J. P. et al.: Is otitis media with effusion a biofilm infection? Clin. Otolaryngol., 29, 2004, s. 38-46.
6. Greenberg, D., Givon-Lavi, N., Broides, A. et al.: The contribution of smoking and exposure to tobacco smoke to Streptococcus pneumoniae and Haemophilus influenzae Carriage in children and their mothers. Clin. Infect. Dis., 42, 2006, s. 897–903.
7. Ikinciogullari, A., Dogu, F., Ikinciogullari, A. et al.: Is immune system influenced by adenotonsillectomy in children? Int. J. Pediatr. Otorhinolaryngol., 66, 2002, s. 251-257.
8. Jeseňák, M., Rennerová, Z., Bánovčin, P. et al.: Recidivujúce infekcie dýchacích ciest a imunomodulácia u detí. Praha, Mladá Fronta, 1. vydanie, 2012; s. 632.
9. Marseglia, G. L., Caimmi, D., Pagella, F. et al.: Adenoids during childhood: the facts. Int. J. Immunopathol. Pharmacol., 24, 2011, 4, s. 1-5.
10. Marzouk, H., Aynehchi, B., Thakkar, P. et al.: The utility of nasopharyngeal culture in the management of chronic adenoiditis. Int. J. Pediatr. Otorhinolaryngol., 76, 2012, 10, s. 1413-1415.
11. Post, J. C, Stoodley, P., Hall-Stoodley, L. et al.: The role of biofilms in otolaryngologic infections. Curr. Opin. Otolaryngol. Head Neck Surg, 12, 2004, s. 185-190.
12. Stoodley, H. L., Costerton, J. W., Stoodley, P.: Bacterial biofilms: from the natural environment to infectious disease. Nat. Rev. Microbiol., 2, 2004, s. 1-15.
13. Šemberová, J., Rychlý, B., Hanzelová, J. et al.: The immune status in situ of recurrent tonsillitis and idiopathic tonsillar hypertrophy. Bratisl. Lek. Listy, 114, 2013, s. 140-144.
14. Wang, E. W., Jung, J. Y., Pashia, M. E. et al.: Otopathogenic pseudomonas aeruginosa strains as complent biofilm formers. Arch. Otol. Head Neck Surg., 131, 2005, s. 983-989.
15. Zautner, A. E.: Adenotonsillar disease. Recent Pat Inflamm Allergy Drug Discov, 6, 2012, 2, s. 121-129.
16. Zeleník, K., Komínek P.: Prejavy vrodených porúch imunity v ORL oblasti. Pediatr. Prax, 14, 2013, s. 18-20.
Labels
Audiology Paediatric ENT ENT (Otorhinolaryngology)Article was published in
Otorhinolaryngology and Phoniatrics

2017 Issue 1
-
All articles in this issue
- Radiografie paranazálních dutin: význam v diagnostice akutní rinosinusitidy a současné možné indikace
- Hluboké krční záněty jako komplikace zánětu hltanu (retrospektivní studie)
- Středoušní rekonstrukce u dětí
- Mikrobiálna kolonizácia horných dýchacích orgánov a imunita u detí s adenoidnými vegetáciami
- Recidivující respirační papilomatóza - nové rizikové faktory
- Overenie vplyvu hyperbarickej oxygenoterapie v liečbe náhlej sezorineurálnej straty sluchu
- Histologická a histochemická analýza retrakční kapsy pars tensa ušního bubínku u dětí
- Chirurgické komplikácie kochleárnej implantácie na Klinike ORL chirurgie hlavy a krku v skupine prvých 100 implantovaných pacientov
- Otorhinolaryngology and Phoniatrics
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Radiografie paranazálních dutin: význam v diagnostice akutní rinosinusitidy a současné možné indikace
- Hluboké krční záněty jako komplikace zánětu hltanu (retrospektivní studie)
- Histologická a histochemická analýza retrakční kapsy pars tensa ušního bubínku u dětí
- Overenie vplyvu hyperbarickej oxygenoterapie v liečbe náhlej sezorineurálnej straty sluchu
