Traumatická poranění mozku – vliv alkoholu a kofeinu na intrakraniální tlak a průtok krve mozkem
Traumatic Brain Injuries – Effects of Alcohol and Coffein on Intracranial Pressure and Cerebral Blood Flow
Introduction:
Alcohol and caffeine is intermittently or regularly used by majority of people. These drugs may have acute or chronic effects on patients with traumatic brain injury. Alcohol intoxication increases cerebral blood flow from 8 to 24%. Caffeine decreases cerebral blood flow from 10 to 20%. These facts create a theoretical hypothesis that the decrease of CBF may reduce incranial pressure. The aim of this study was to investigate the effect of caffeine on intracranial pressure in rats following traumatic brain injury.
Methods:
Ten Wistar male rats underwent weight drop closed head injury. The second stage of the experiment was done 12 to 18 hours later. Intracranial pressure, respiration, heart rate and the mean arterial pressure was monitored. Intraperitoneal injection of caffeine (20mg/kg) was administered and repetitive measurement of vital signs and intracranial pressure was done.
Results:
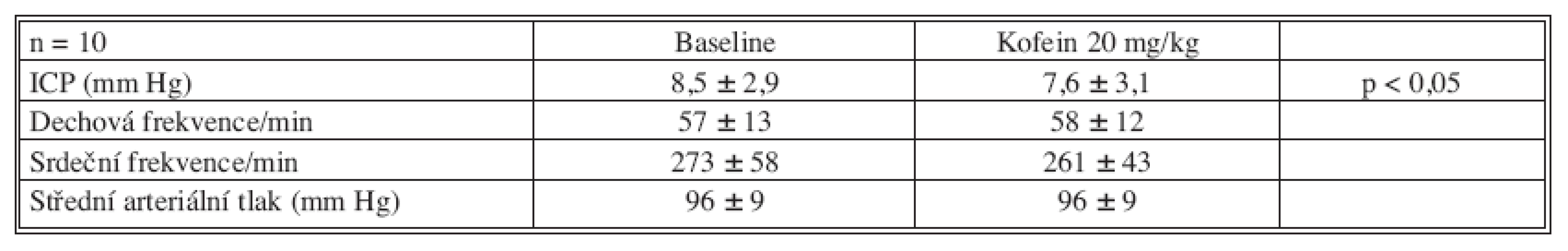
The baseline ICP after head injury was 8.5 ± 2.9 mm Hg. Ten minutes after intraperitoneal caffeine administration ICP dropped to 7.6 ± 3.1 mm Hg (p < 0.05). This represents a 11% decrease from baseline value. Mean arterial pressure, respiration and heart rate were stable.
Conclusion:
Intracranial pressure decrease of 11 % from baseline value. This drop was compatible with our hypothesis. The exact dosage of caffeine, its form and rate, should be more precisely specified in further studies.
Key words:
traumatic brain injury – caffeine – alcohol – intracranial pressure – rats
Authors:
M. Bláha; O. Vajnerová 1; M. Bednář 2; L. Vajner 3; M. Tichý
Authors‘ workplace:
Neurochirurgické oddělení FN Motol, Ústav fyziologie 2. LF UK Praha, primář doc. MUDr. M. Tichý, CSc.
; Ústav fyziologie 2. LF UK Praha, prof. MUDr. J. Herget, DrSc.
1; Anesteziologicko-resuscitační oddělení CLINICUM a. s., Praha, primář MUDr. M. Bednář
2; Ústav histologie a embryologie 2. LF UK Praha, doc. MVDr. L. Vajner, CSc.
3
Published in:
Rozhl. Chir., 2009, roč. 88, č. 11, s. 682-686.
Category:
Monothematic special - Original
Overview
Cíl:
Alkohol a kofein konzumuje intermitentně nebo pravidelně většina populace. Při péči o pacienty s traumatickým poraněním mozku je tedy nutné počítat s chronickými nebo s akutními účinky těchto látek na mozkové funkce a na parametry mozkové krevní cirkulace. Alkohol zvyšuje průtoku krve mozkem o 8–24 %. Kofein naopak snižuje globální průtok krve mozkem o 10–20 %. Naší pracovní hypotézou bylo, že takto farmakologicky navozené snížení mozkového průtoku kofeinem by mohlo sekundárně vést k poklesu intrakraniálního tlaku. Pro zkoumání této hypotézy jsme zvolili model zavřeného poranění hlavy u potkanů.
Metodika:
Deset samců laboratorního potkana kmene Wistar podstoupilo v první fázi studie zavřené poranění hlavy akceleračně-deceleračním mechanismem pomocí modifikovaného impaktoru s volitelným závažím. S odstupem 12 až 18 hodin od úrazu jsme v druhé části experimentu monitorovali v celkové anestezii intrakraniální tlak a ostatní vitální funkce. Kofein v dávce 20 mg/kg jsme podali intraperitoneálně a pokračovali v monitoraci vitálních funkcí a intrakraniálního tlaku.
Výsledky:
Průměrný intrakraniální tlak po úraze byl 8,5 ± 2,9 mm Hg. Deset minut po podání kofeinu došlo k poklesu ICP na 7,6 ± 3,1 (p < 0,05). To reprezentuje pokles o 11 % z poúrazového intrakraniálního tlaku. Hodnoty středního arteriálního tlaku, dechové a srdeční frekvence zůstaly po podání kofeinu stabilní.
Závěr:
Pokles intrakraniálního tlaku po podání kofeinu o 11 % byl statisticky signifikantní a takto významná redukce ICP by jistě byla i klinicky významná. Kofein působí přes adenosinové receptory mozkových cév se subsequentní vazokonstrikcí mikrocirkulace a snížením krevního průtoku mozkem. Aplikace těchto výsledků do humánní medicíny však vyžaduje další studie.
Klíčová slova:
poranění mozku – intrakraniální tlak – alkohol – kofein – laboratorní potkani
ÚVOD
Alkohol (etylalkohol, etanol, CH3CH2OH) intermitentně nebo pravidelně užívá většina populace. Kofein (C2H10N4O2) je nejužívanější stimulant centrálního nervového systému u člověka. Většina lidí má pravidelný denní příjem kofeinu ve formě kávy, čaje, čokolády nebo jiných potravin [1, 2]. Při péči o pacienty s traumatickým poraněním mozku je tedy nutné počítat s chronickými nebo s akutními účinky těchto látek na mozkové funkce a na parametry mozkové krevní cirkulace. Při úrazovém poranění mozku dochází k výrazným změnám mozkového krevního průtoku a nitrolebního tlaku. I přes vývoj nových diagnostických a terapeutických postupů je možnost terapie postižení mozkového krevního průtoku, mozkové autoregulace a nitrolební hypertenze stále omezená. Hodnota intrakraniálního tlaku (ICP) je nezávislá proměnná, statisticky signifikantně spojená s kvalitou neurologického zotavení [3]. Nitrolebeční tlak u dospělého člověka má vleže hodnotu mezi 7–15 mm Hg. Protrahované hodnoty ICP nad 20 mm Hg jsou považovány za patologické [4]. Mozkový perfuzní tlak je definován jako střední arteriální tlak mínus intrakraniální tlak (CPP = MABP – ICP). U pacientů s kraniotraumatem je snaha terapeuticky udržet CPP mezi 50 až 70 mm Hg [5]. Změny mozkového krevního průtoku (CBF) po kraniotraumatu jsou velice heterogenní, závisí na časovém odstupu od úrazu a výrazně se liší v různých oblastech mozku. Globální i regionální změny CBF závisí též na typu poranění a lokalizaci patologických změn [6, 7]. Globální průtok krve mozkem může být po traumatickém poranění mozku zvýšen nebo snížen [8–13]. Většina současných výsledků ukazuje iniciální snížení CBF v prvních hodinách po úraze s následnou hyperemickou fází s maximem po 24 hodinách od traumatu [7, 12, 14–16]. Klinický význam posttraumatické hyperémie není zatím zcela jasný. Předpokládaný vztah mezi zvýšeným intrakraniálním tlakem a hyperémií nebyl zatím konzistentně prokázán [8]. Pokles CBF v iniciálním období po traumatickém poranění mozku (TBI – traumatic brain injury) je výraznější na ipsilaterální straně k ložiskové patologii [15]. Regionální průtoky krve se v oblastech mozkových laloků, bazálních ganglií a mozkového kmene liší až o 25 procent [14]. Výrazné nebo přetrvávající snížení regionální nebo globální mozkové perfuze je statisticky významně spojeno s časnou úmrtností a špatným neurologickým zotavením po TBI [7, 12]. Komplexita změn CBF po úrazech je velice výrazná a závisí tedy na typu úrazu, na daném regionu mozku a jeho vztahu k intrakraniální patologii, na věku pacienta, eventuálně jeho přidružených chorobách ovlivňujících cerebrovaskulární řečiště před úrazem. Všechny tyto hodnoty CBF dále nejsou statické, ale vyvíjí se v čase společně s postupující progresí nitrolební patologie a jsou ovlivňovány medicínskou léčbou. CBF je modifikováno chirurgickými dekompresními zákroky, změnou ventilačních parametrů, léčbou nitrolebního tlaku a podáváním anestetik.
Alkohol
Studie u 2657 pacientů přivezených s úrazem do nemocnice ukázala, že 47 % z nich mělo pozitivní test na alkohol (35,8 % bylo dokonce výrazně intoxikováno) [17]. V podskupině 520 pacientů s kraniotraumatem bylo intoxikováno alkoholem 36,7 % [18]. Tři čtvrtiny z těchto akutně intoxikovaných pacientů mělo historii chronického užívání alkoholu. Vzhledem k závažnosti tohoto problému bylo již provedeno mnoho klinických i laboratorních studií zaměřených na akutní i chronický vliv alkoholu na mozkovou hemodynamiku, vliv na mozkový metabolismus, risk přidružených komplikací a kvalitu zotavení po úrazu. Většina klinických studií prokázala zvýšenou morbiditu a mortalitu v korelaci s alkoholovou intoxikací [18–20]. Avšak další rozdělení do podskupin ukazuje, že samotná akutní intoxikace etanolem nezvyšuje mortalitu nebo riziko komplikací. To je zvýšené právě u pacientů se známkami chronického užívání alkoholu. Ti mají až dvojnásobný počet komplikací [21].
Nepříznivý vliv etanolu u kraniotraumatu byl též prokázán na animálních modelech [22, 23]. Jiné studie však naopak ukázaly neuroprotektivní efekt nižších dávek etanolu (1–2,5 g/kg) podaných před poraněním mozku [24]. Toto „profylaktické“ podání ethanolu před úrazem je na rozdíl od terapie kortikoidy u spinálních traumat reálné. Zatímco prakticky je nereálné podat kortikoidy před poraněním míchy, pacienti často utrpí úraz mozku již s „profylaktickou“ hladinou alkoholu v krvi. Mechanismem tohoto pozitivního efektu ethanolu je zřejmě rozpojení (uncoupling) vazby mezi mozkovým krevním průtokem (CBF) a glukózovým metabolismem.
Regionální změny CBF byly studovány pomocí 133Xe-CT a 99TcSPECT a ukázaly přednostní vazodilataci v prefrontálních a temporálních oblastech mozku [25, 26]. V naší předchozí studii jsme k neinvazivnímu měření parametrů mozkové cirkulace použili transkraniální Dopplerovský ultrazvuk u zdravých dobrovolníků. Po požití alkoholu (whisky Wild Turkey) došlo ke zvýšení průtoku krve mozkem o 8–24 % [27].
Kofein
Kofein je chemická látka trimethylxantin, neboli v systematickém názvosloví 3,7-Dihydro-1,3,7-trimethyl-1H-purin-2,6-dion, sumárním vzorcem C8H10N4O2. V šálku kávy je přibližně 40 až 170 mg kofeinu, v čaji 50 až 80 mg kofeinu, v plechovce Coca-Coly Light 50 mg, v 30 gramech čokolády 20 mg kofeinu [1, 2]. Po konzumaci kofeinu dochází k jeho rychlému vstřebávání do krve a do tělesných tkání. V těle se neakumuluje a je rychle metabolizován a vylučován. Mechanismem účinku kofeinu v centrální nervové soustavě je antagonistické působení na adenosinových receptorech, mobilizace intracelulárního kalcia a inhibice specifických fosfodiesteráz, aktivace noradrenalinových receptorů a ovlivnění lokálního uvolňování dopaminu [2, 28]. Na mozkové cévní řečiště působí primárně kofein jako antagonista adenozinových receptorů. Adenozin v mozkovém cévním řečišti má silný vazodilatační účinek a je zvažován jako metabolický regulátor mozkového cévního průtoku [29]. Adenozinem indukovaná vazodilatace v mozkové mikrocirkulaci působí přes aktivaci cGMP a cGMP dependentních proteinkináz [30]. Experimenty potvrdily vazokonstrikční působení kofeinu blokádou A2A a A2B receptorů [28, 31, 32].
Naše předchozí studie ukázaly snížení globálního průtoku krve mozkem o 10–20 % [33, 34]. Tento nález je podporován i dalšími pracemi používající inhalaci 133Xe a PET [32, 35–37]. Naše výsledky ukázaly významné snížení mozkového krevního průtoku po podání kofeinu v normálním cerebrovaskulárním řečišti i při výrazné vazodilataci periferních cév. Tento nález podporuje důležitou roli, kterou může hrát kofein v regulaci CBF při různých patologických procesech. I přes závažnou vazodilataci mozkové mikrocirkulace je kofein stále schopný působit jako kompetitivní antagonista CO2 v mozkových cévách [33].
Další výzkum se zaměřil na kofeinol (směs kofeinu a alkoholu). Kofeinol působí neuroprotektivně ve zvířecím modelu dočasné okluze společné karotidy a MCA. Redukuje až o 80% ztrátu tkáně infarktovým ložiskem a zlepšuje motorickou koordinaci zvířat po proběhlém inzultu [38–40]. Pilotní studie u lidí (23 pacientů s ischemickým iktem) posuzovala bezpečnost podání kofeinolu samotného nebo v kombinaci s tkáňovým aktivátorem plasminogenu [41]. Při časném podání kofeinolu po úrazu se u potkanů výrazně snížil objem kontuzních ložisek a zlepšila se posttraumatická pracovní paměť [42].
Cíl studie
V námi koncipované studii jsme vycházeli z prokázaného poklesu průtoku krve mozkem po podání kofeinu o 10 až 20 procent. Naší pracovní hypotézou bylo, že takto farmakologicky navozené snížení mozkového průtoku by mohlo sekundárně vést k poklesu intrakraniálního tlaku. Předpokládali jsme předběžně pokles o 10 až 20 procent. Hlavní terapeutickou cílovou skupinou by pak byli spíše pacienti s posttraumatickou hyperémií. Pro zkoumání této hypotézy jsme zvolili reprodukovatelný model zavřeného poranění hlavy potkanů akceleračně-deceleračním mechanismem pomocí modifikovaného impaktoru s volitelným závažím [43].
MATERIÁL A METODA
Studie byla schválena Odbornou komisí pro ochranu zvířat 2. LF UK Praha podle nařízení Evropské Unie číslo 86/609. Samci laboratorního potkana kmene Wistar byli chováni v 12hodinovém cyklu světlo – tma a měli neomezený přístup k vodě a potravě.
Patnáct samců laboratorního potkana kmene Wistar o hmotnosti 307 ± 115 gramů bylo použito v tomto experimentu. Pět potkanů jsme vyřadili ze studie protože po indukovaném kraniotraumatu byl jejich intrakraniální tlak menší než 6 mm Hg. Zbylých deset potkanů (264 ± 40 gramů) podstoupilo obě fáze experimentu a jejich data jsme zpracovali.
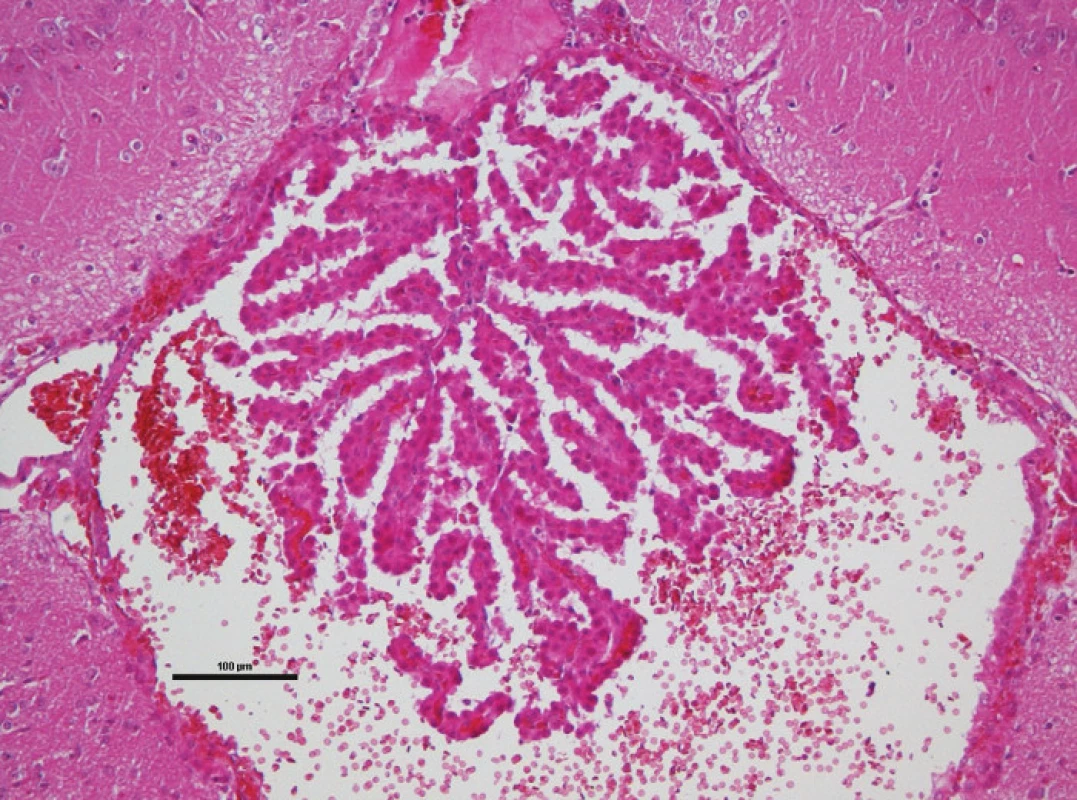
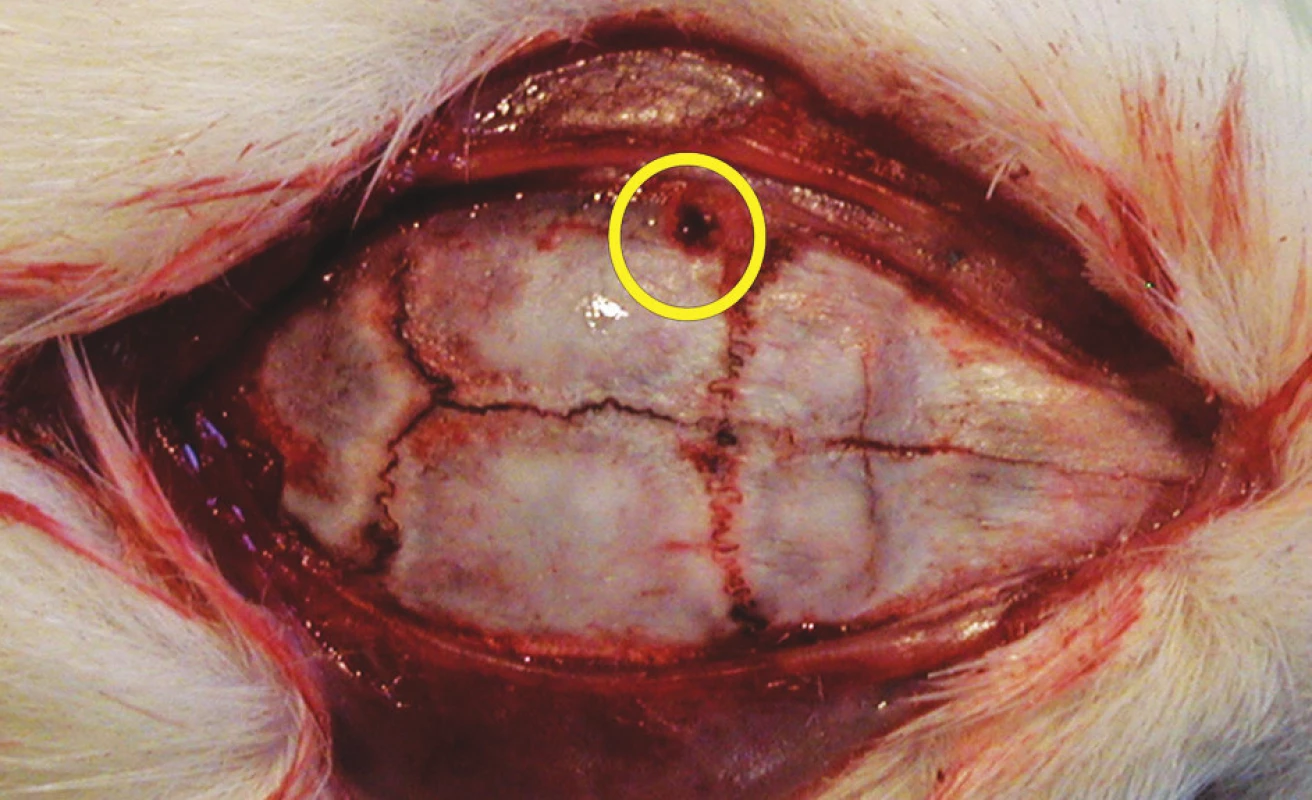
Pro první část pokusu jsme potkany uvedli do celkové anestezie v indukční komoře dvouminutovým podáním 8% sevofluranu ve směsi s 60 % O2 a 40 % N2O. Poté jsme spontánně ventilujícího a anestezovaného potkana umístili do zařízení impaktoru mozkových úrazů na odpruženou horizontální desku. Toto zařízení je naší modifikací impaktoru s volitelným závažím umožňující vytvářet reprodukovatelné kraniotrauma [43]. Shozem 400gramového závaží z výšky 35 až 40 cm centrovaného ve střední čáře doprostřed mezi interaurikulární a interokulární linii je vytvořeno těžké poranění mozku. Laboratorní zvíře je umístěno na pohyblivé desce a k poranění tak dochází akceleračně-deceleračním mechanismem – viz histologické vyšetření (Obr. 1). Po indukci traumatu jsme potkany přenesli do prázdné plastové klece k zotavení. Pozorovali jsme a zaznamenávali apnoické pauzy, krvácení z úst a uší, křečovou aktivitu a rychlost zotavení. Po 60 minutách jsme potkany vrátili do původních klecích se zjednodušeným přístupem k vodě a potravě. Druhou část experimentu následující den, 12 až 18 hodin od úrazu, byla provedena v celkové anestezii podáním intraperitoneálního ketaminu (100 mg/kg) a intramuskulárního xylazinu (16 mg/kg). Monitorovali jsme srdeční a dechovou frekvenci, invazivní tlak krve ve femorální tepně (OmniCare CMS 24, Hewlett Packard). Návrt lebky jsme provedli za koronárním švem a 4 mm od střední čáry vlevo (Obr. 2). Po punkci dury jsme zavedli mikrosenzor k měření intrakraniálního tlaku (Codman Microsensor, ICP Express). Po deseti minutách ponechaných ke stabilizaci vitálních funkcí jsme pět minut měřili baseline hodnoty monitorovaných parametrů. Poté jsme intraperitoneálně podali kofein v dávce 20 mg/kg a pokračovali v monitoraci a záznamu všech parametrů dvacet minut.
Naměřené hodnoty referujeme jako aritmetický průměr ± směrodatná odchylka (SD). Analýza dat byla zpracována Studentovým t-testem. Hodnota p < 0,05 je považována za statisticky významnou.
VÝSLEDKY
Výsledky naší studie jsou uvedeny přehledně v tabulce 1. Průměrný intrakraniální tlak po úraze byl 8,5 ± 2,9 mm Hg. Deset minut po podání kofeinu došlo k poklesu ICP na 7,6 ± 3,1 (p < 0,05). To reprezentuje pokles o 11 % z poúrazového intrakraniálního tlaku. Dechová frekvence před podáním (57 ± 13) a po podání kofeinu (58 ± 12) byla velice stabilní. Srdeční frekvence po podání kofeinu mírně poklesla z 273 ± 58 tepů za minutu na 261 ± 43. Tento pokles však nebyl statisticky signifikantní. Invazivně měřený střední arteriální tlak zůstal stabilní 96 ± 9 mm Hg před i po podání kofeinu.
DISKUSE
Komplexní péče o pacienty s traumatickým poraněním mozku vychází z mnoha variabilních parametrů. K jedněm z nejdůležitějších fyziologických parametrů patří mozkový krevní průtok a intrakraniální tlak. V naší studii jsme se snažili využít prokázaný efekt kofeinu na adenosinové receptory mozkových cév se subsequentní vazokonstrikcí mikrocirkulace a snížením mozkové krevního průtoku. Naše pracovní hypotéza o následném poklesu intrakraniálního tlaku byla v této studii potvrzena. Pokles ICP o 11 % byl statisticky signifikantní a takto významná redukce ICP by jistě byla i klinicky významná. Přímo aplikovat tento výsledek do humánní medicíny však nelze. Za prvé v naší studii se intrakraniální tlak po kraniotraumatu pohyboval mezi 6 až 12 mm Hg. U potkanů bez kraniotraumatu jsme v předchozích experimentech naměřili klidové hodnoty ICP okolo 2 mm Hg. Podařilo se nám tedy kraniotraumatem dosáhnout výrazné zvýšení ICP, avšak patologické hodnoty u nemocných, které bychom chtěli terapeuticky ovlivňovat, jsou výrazně vyšší (ICP > 20 mm Hg). Za druhé, prostý pokles ICP za cenu snížení průtoku krve mozkem může vést spíše k dalšímu postižení mozkové tkáně protože snížení regionální nebo globální mozkové perfuze je statisticky významně spojeno s časnou úmrtností a špatným neurologickým zotavením po TBI [7, 12]. Je možné, že z eventuální terapie blokátory adenosinových receptorů by tedy profitovala pouze podskupina pacientů s posttraumatickou hyperemií. Další studie a výzkum by se tedy měl pokusit o prokázání poklesu ICP při jeho výrazně vyšších základních hodnotách, což však nemusí být v tomto potkaním modelu možné. Nesmírně důležitým přínosem by také byla stratifikace pokusů pro úrazy s následnou posttraumatickou hyperémií či pro úrazy s perzistentním poklesem CBF. Potřebujeme také lépe specifikovat potřebnou dávku a způsob podání účinné látky. Tato studie je tedy pouze částečkou nových informací nabízejících eventuální možnosti odlišného přístupu a terapie mozkových traumat.
ZÁVĚR
Pokles intrakraniálního tlaku po podání kofeinu o 11 % byl statisticky signifikantní a takto významná redukce ICP by jistě byla i klinicky významná. Kofein působí přes adenosinové receptory mozkových cév se subsequentní vazokonstrikcí mikrocirkulace a snížením mozkové krevního průtoku. Aplikace těchto výsledků do humánní medicíny však vyžaduje další studie.
Tato práce byla podpořena grantem Ministerstva zdravotnictví České republiky IGA MZ NR 9514.
MUDr. Martin Bláha
Ebenová 1486
250 82 Úvaly
e-mail: drmartinblaha@yahoo.com
Sources
1. Galasko, G. T., Furman, K. I., Alberts, E. The caffeine contents of non-alcoholic beverages. Food Chem. Toxicol., 1989; 27(1): 49–51.
2. Nehlig, A., Daval, J.L., Debry, G. Caffeine and the central nervous system: mechanisms of action, biochemical, metabolic and psychostimulant effects. Brain Res. Rev., 1992; 17(20): 139–170.
3. Marmarou, A. Increased intracranial pressure in head injury and influence of blood volume. J. Neurotrauma, 1992 Mar; vol. 9, Suppl. 1 : 327–332.
4. Marshall, L. F., Smith, R. W., Shapiro, R. M. The outcome with agressive treatment in severe head injuries. Part I: The significance of intracranial pressure monitoring. J Neurosurg., 1979; 50 : 20–25.
5. Brain Trauma Foundation; American Association of Neurological Surgeons; Congress of Neurological Surgeons; Joint Section on Neurotrauma and Critical Care, AANS/CNS, Bratton, S.L., Chestnut, R.M., Ghajar, J. et al.: Guidelines for the management of severe traumatic brain injury. XIV.Hyperventilation. Intracranial pressure tresholds. J Neurotrauma., 2007; 24 Suppl 1: S55-58.
6. Sioutos, P. J., Orozco, J. A., Carter, L. P., et al. Continuous regional cerebral blood flow monitoring in head-injured patients. Neurosurgery, 1995; 36(5): 949–950.
7. Bouma, G. J., Muizelaar, J. P., Stringer, W. A., et al. Ultra-early evaluation of regional cerebral blood flow in severely head-injured patients using xenon-enhanced computerized tomography. J. Neurosurg., 1992; 77(3): 360–368.
8. Bouma, G. J., Muizelaar, J. P. Cerebral blood flow, cerebral blood flow volume, and cerebrovascular reactivity after severe head injury. J Neurotrauma, 1992; 9 Suppl 1: S333–348.
9. Aygok, G. A., Marmarou, A., Fatouros, P., et al. Assessment of mitochondrial impairment and cerebral blood flow in severe brain injured patients. Acta Neurochir. Suppl., 2008; 102 : 57–61.
10. Hattori, N., Huang, S. C., Wu, H. M., et al. PET investigation of post-traumatic cerebral blood volume and blood flow. Acta Neurochir. Suppl., 2003; 86 : 49–52.
11. Weber, B. B., Kerr, M. E., Wechsler, L. R., et al. Absence of diastolic velocity notch does not indicate hyperemia in traumatic brain injured patients without elevated cerebral blood flow velocity. J. Neurosurg. Anesthesiol., 2002; 14(4): 279–286.
12. Ojha, B. K., Jha, D. K., Kale, S. S., et al. Trans-cranial Doppler in severe head injury: evaluation of pattern of changes in cerebral blood flow velocity and its impact on outcome. Surg. Neurol., 2005; 62(2): 174–179.
13. Wintermark, M., van Melle, G., Schnyder, P., et al. Admission perfusion CT: prognostic value in patients with severe head trauma. Radiology, 2004; 232(1): 211–220.
14. Marion, D. W., Darby, J., Yonas, H. Acute regional cerebral blood flow changes caused by severe head injuries. J. Neurosurg., 1991; 74(3): 407–414.
15. van Santbrink, H., Schouten, J. W., Steyerberg, E. W., et al. Serial transcranial Doppler measurements in traumatic brain injury with special focus on the early posttraumatic period. Acta Neurochir. (Wien), 2002; 144(11): 1141–1149.
16. Soustiel, J. F., Sviri, G. E. Monitoring of cerebral metabolism: non-ischemic impairment of oxidative metabolism following severe traumatic brain injury. Neurol. Res., 2007; 29(7): 654–660.
17. Rivara, F. P., Jurkovich, G. J., Gurney, J. G., et al. The magnitude of acute and chronic alcohol abuse in trauma patients. Arch. Surg., 1993; 128(8), 907–913.
18. Gurney, J. G., Rivara, F. P., Mueller, B. A., et al. The effects of alcohol intoxication on the initial treatment and hospital course of patients with acute brain injury. J. Trauma., 1992; 33(5): 709–713.
19. Pories, S. E., Gamelli, R. L., Vacek, P., et al. Intoxication and injury. J. Trauma., 1992; 32(1): 60–64.
20. Zink, B. J., Maio, R. F., Chen, B. Alcohol, central nervous system injury, and time to death in fatal motor vehicle crashes. Alcohol Clin. Exp. Res., 1996; 20(9): 1518–1522.
21. Jurkovich, G. J., Rivara, F. P., Gurney, J. G., et al. The effect of acute alcohol intoxication and chronic alcohol abuse on outcome from trauma. JAMA, 1993; 7, 270(1): 93–94.
22. Zink, B. J., Sheinberg, M. A., Wang, X., et al. Acute ethanol intoxication in a model of traumatic brain injury with hemorrhagic shock: effects on early physiological response. J. Neurosurg., 1998; 89 : 983–990.
23. Zink, B. J., Walsh, R. F., Feustel, P. J. Effects of ethanol in traumatic brain injury. J. Neurotrauma., 1993; 10(3): 275–286.
24. Kelly, D. F., Kozlowski, D. A., Haddad, E., et al. Ethanol reduces metabolic uncoupling following experimental head injury. Journal of Neurotrauma., 2000; 17(4): 261–272.
25. Sano, M., Wendt, P. E., Wirsen, A., et al. Acute effects of alcohol on regional cerebral blood flow in man. J. of Studies on Alcohol, 1993; May: 369–376.
26. Tiihonen, J., Kuikka, J., Hakola, P., et al. Acute ethanol-induced changes in cerebral blood flow. Am. J. Psychiatry, 1994; 151(10): 1505–1508.
27. Blaha, M., Aaslid, R., Douville, C. M., et al. Cerebral blood flow and dynamic cerebral autoregulation during ethanol intoxication and hypercapnia. J. Clin. Neurosci., 2003 : 10(2): 195–198.
28. Ngai, A. C., Coyne, E. F., Meno, J. R., et al. Receptor subtypes mediating adenosine-induced dilation of cerebral arterioles. Am. J. Physiol. Heart Circ. Physiol., 2001; 280(5): 2329–2335.
29. Phillis, J. W., DeLong, R. E. An involvement of adenosine in cerebral blood flow regulation during hypercapnia. Gen. Pharmacol.,1987; 18(2): 133–139.
30. West, G. A., Meno, J. R., Nguyen, T. S., et al. cGMP-dependent and not cAMP-dependent kinase is required for adenosine-induced dilation of intracerebral arterioles. J. Cardiovasc. Pharmacol., 2003; 41(3): 444–451.
31. Meno, J. R., Nguyen, T. S., Jensen, E. M., et al. Effect of caffeine on cerebral blood flow response to somatosensory stimulation. J. Cereb. Blood Flow Metab., 2005; 25(6): 775–784.
32. Mathew, R. J., Wilson, W. H. Substance abuse and cerebral blood flow. Am. J. Psychiatry, 1991; 148(3): 292–305.
33. Blaha, M., Benes, V., Douville, C. M. et al. The effect of caffeine on dilated cerebral circulation and on diagnostic CO2 reactivity testing. J. Clin. Neurosci., 2007; 14 (5): 464–467.
34. Bláha, M., Ostrý, S. Vliv kofeinu na průtok krve mozkem. Cesk. Slov. Neurol. N., 2003; 5 : 335–337.
35. Mathew, R. J., Wilson, W. H. Caffeine induced changes in cerebral circulation. Stroke., 1985; 16 : 814–817.
36. Mathew, R. J., Barr, D. L., Weinman, M. L. Caffeine and cerebral blood flow. Br. J. Psychiatry, 1983; 143 : 604–608.
37. Cameron, O. G., Modell, J. G., Hariharan, M. Caffeine and human cerebral blood flow: a positron emission tomography study. Life Sci., 1990; 47(13): 1141–1146.
38. Aronowski, J., Strong, R., Shirzadi, A., et al. Ethanol plus caffeine (caffeinol) for treatment of ischemic stroke: preclinical experience. Stroke, 2003; 34(5): 1246–1251.
39. Strong, R., Grotta, J. C., Aronowski, J. Combination of low dose ethanol and caffeine protects brain from damage produced by focal ischemia in rats. Neuropharmacology, 2000; 39(3): 515–522.
40. Zhao, X., Liu, S. J., Zhang, J., et al. Combining insulin-like growth factor derivatives plus caffeinol produces robust neuroprotection after stroke in rats. Stroke, 2005; 36(1): 129–134.
41. Piriyawat, P., Labiche, L. A., Burgin, W. S., et al. Pilot dose escalation study of caffeine plus ethanol (caffeinol) in acute ischemic stroke. Stroke, 2003; 34 : 1242–1245.
42. Dash, P. K., Moore, A. N., Moody, M. R., et al. Post-trauma administration of caffeine plus ethanol reduces contusion volume and improves working memory in rats. J. Neurotrauma., 2004; 21(11): 1573–1583.
43. Bláha, M., Schwab, J., Vajnerová, O., et al. Model zavřeného poranění hlavy u potkana – experimentální studie. Cesk. Slov. Neurol N., 2009; 72/105(3): 235–241.
Labels
Surgery Orthopaedics Trauma surgeryArticle was published in
Perspectives in Surgery

2009 Issue 11
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
-
All articles in this issue
- Endovaskulární léčba spontánního hemotoraxu u neurofibromatózy I. typu
- Pacient s entrapment syndrómom a. poplitea a infekčnou endokarditídou (kazuistika)
- Endoskopický odběr v. saphena magna – výskyt ranných komplikací
- Gastrointestinální stromální tumor – analýza vlastní sestavy pacientů, přehled literatury
- Artroplastika krční ploténky (Prodisc-C): analýza výsledků po 3–4 letech sledování
- Prodloužená profylaxe tromboembolické nemoci u pacientů po chirurgické resekci kolorekta pro malignitu
- Syndrom tukové embolie – přehled problematiky a kazuistika: závažný průběh po traumatu dlouhých kostí
- Peritonitidy způsobené perforací trávicí trubice – analýza gerontologické skupiny pacientů
- Transplantace tenkého střeva v experimentu
- Hybridní NOTES cholecystektomie transgastrickým a transrektálním přístupem v experimentu
- Laparoskopická chirurgie karcinomu rekta – dlouhodobé výsledky
- Traumatická poranění mozku – vliv alkoholu a kofeinu na intrakraniální tlak a průtok krve mozkem
- Karcinom prsu u nemocné po transplantaci ledviny – kazuistika
- Perspectives in Surgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Syndrom tukové embolie – přehled problematiky a kazuistika: závažný průběh po traumatu dlouhých kostí
- Traumatická poranění mozku – vliv alkoholu a kofeinu na intrakraniální tlak a průtok krve mozkem
- Pacient s entrapment syndrómom a. poplitea a infekčnou endokarditídou (kazuistika)
- Artroplastika krční ploténky (Prodisc-C): analýza výsledků po 3–4 letech sledování