Náhrady medzistavcových platničiek v liečbe degeneratívnych ochorení krčnej chrbtice
Interbody Spacers in the Treatment of Cervical Spine Disorders
Degenerative conditions of the spine represent a group of most common lifestyle associated diseases with significant medical and important social impact.
Clinical symptoms and syndromes of surgically considerable degenerative diseases of the spine mostly result from nerve root or spinal cord compression caused by a herniated intervertebral disc or a dorsal osteophyte. Therefore, the main goal of the surgical treatment is decompression of the neural structures by complete removal of the intervertebral disc and the osteophytes followed by insertion of an artificial disc spacer into the remaining space.
The most frequently used procedure for treating such findings is called anterior cervical discectomy. Since its first introduction in 1950, several modifications of the original technique have been introduced. Their common feature is that removal of the degenerated intervertebral disc or the osteophytes requires stabilization of the adjacent segments by fusion. Thus, implantation of an interbody spacer results not only in intervertebral space reconstruction, but by immobilizing the adjacent vertebral bodies also in forming a firm bony bridging between them – and ultimately a solid bony block.
Our paper provides a review of cervical interbody spacers in the order of their evolution from auto - and allografts, through compact materials, cages and dynamic artificial disks. Furthermore, different types of cage filling materials used for fusion augmentation are also discussed.
Key words:
anterior cervical discectomy – interbody spacer – fusion
:
F. Pataky; M. Gajdoš; V. Kaťuch
:
Neurochirurgická klinika LF UPJŠ, Fakultná nemocnica L. Pasteura Košice, Slovenská republika
prim. MUDr. Vladimír Kaťuch / doc. MUDr. Miroslav Gajdoš, CSc., mim. prof.
:
Rozhl. Chir., 2010, roč. 89, č. 6, s. 336-343.
:
Monothematic special - Original
Degeneratívne ochorenia chrbtice patria medzi najčastejšie civilizačné ochorenia, ktoré okrem medicínskeho majú aj dôležitý spoločenský rozmer.
Klinické symptómy a syndrómy z chirurgického hľadiska relevantných degeneratívnych ochorení chrbtice vyplývajú najmä z priameho mechanického útlaku miechových koreňov a samotnej miechy. Na patogenéze týchto ochorení a priamej kompresii nervových štruktúr sa najväčšou mierou podieľa predovšetkým herniovaná medzistavcová platnička, poprípade zadné osteofyty tiel stavcov. Hlavným cieľom operačnej liečby je preto dekompresia neuroštruktúr, ktorú po nevyhnutnom odstránení celej medzistavcovej platničky následne paušálne dopĺňame implatnáciou umelej náhrady disku.
Najčastejší operačný zákrok, ktorý pri ošetrení uvedených nálezov používame je predná krčná discektómia. Prvýkrát bola vykonaná už v roku 1950, následne v ďalších rokoch boli rozpracované viaceré modifikácie pôvodnej operácie. Spoločnou všetkých bolo, že ich autori pokladali po odstránení degenerovanej medzistavcovej platničky event. osteofytov za nevyhnutnú aj stabilizáciu operovaného segmentu kostnou fúziou. Fúzia znamená, že po implantácii umelej náhrady disku okrem rekonštrukcie výšky medzistavcovej štrbiny docielime aj vzájomnú imobilizáciu susedných stavcov, v dôsledku ktorej po čase dôjde k vytvoreniu pevného kostného premostenia intervertebrálneho priestoru medzi priľahlými plochami sfúzovaných stavcov. Výsledkom je ich zrastenie do jedného solídneho kosteného bloku.
Predkladaný článok je venovaný prehľadu jednotlivých druhov náhrad krčných medzistavcových platničiek v chronologickom poradí ich evolúcie od autológneho a alogéneho kostného štepu cez kompaktné a duté syntetické implantáty až po dynamické umelé náhrady. Zmieňuje sa aj o rôznych druhoch výplní klietok, ktoré sa v súčasnosti využívajú za účelom maximalizácie úspešnosti fúzie.
Kľúčové slová:
predná krčná discektómia – náhrada medzistavcovej platničky – fúzia
ÚVOD
Degeneratívne ochorenia (krčnej) chrbtice patria medzi najčastejšie civilizačné ochorenia a keďže postihujú predovšetkým dospelú populáciu v produktívnom veku, okrem medicínskeho majú aj dôležitý spoločenský rozmer. Ich prevalencia sa pohybuje v rozmedzí 5–25 %, pričom bolesti chrbtice s alebo bez radikulárnych prejavov postihujú 30–90 % populácie aspoň raz za život. Nakoľko v 75 % prípadov obtiaže ustúpia už behom týždňa spontánne, terapeutické opatrenia vyžaduje len zvyšných 25 % pacientov, u ktorých v prípade, že sú splnené indikačné kritériá, je indikovaná operačná liečba.
Klinické symptómy a syndrómy z chirurgického hľadiska relevantných degeneratívnych ochorení chrbtice vyplývajú najmä z priameho mechanického útlaku miechových koreňov a samotnej miechy. Na patogenéze týchto ochorení a priamej kompresii nervových štruktúr sa najväčšou mierou podieľa predovšetkým herniovaná medzistavcová platnička, poprípade zadné osteofyty tiel stavcov.
Hlavným cieľom operačnej liečby je preto dekompresia neuroštruktúr, ktorá je následne paušálne doplnená aj implatnáciou umelej náhrady disku, čím sa docieli prevencia eventuálneho kolapsu medzistavcovej štrbiny a foramen interevertebrale ako aj obnovenie fyziologickej lordózy.
Najčastejší operačný zákrok, ktorý v uvedených indikáciách v oblasti krčnej chrbtice používame je predná krčná discektómia, podstatou ktorej je, že odstránenie medzistavcovej platničky sa deje z predného prístupu. Operatér sa z krátkeho kožného rezu mediálne od m. sternocleidomastoideus dostáva tupou preparáciou na prednú plochu chrbtice pomedzi krčný nervovocievny zväzok a viscerálne štruktúry (pažerák, trachea). Potom nasleduje samotná discektómia, pri ktorej sa paušálne používa operačný mikroskop – jeho hlavným prínosom pre operáciu je minimalizácia poškodenia nervových a cievnych štruktúr pri ich dobrej vizualizácii. Po odstránení útlaku neuroštruktúr nasleduje implantácia umelej náhrady medzistavcovej platničky, po ktorej operačnú ranu uzatvárame.
Uvedený operačný zákrok bol prvýkrát vykonaný už v roku 1950. V ďalších rokoch boli rozpracované viaceré modifikácie pôvodnej operácie, pričom spoločnou črtou všetkých bolo, že ich autori pokladali po odstránení degenerovanej medzistavcovej platničky event. osteofytov za nevyhnutnú aj stabilizáciu operovaného segmentu kostnou fúziou.
Fúzia vlastne znamená, že po implantácii umelej náhrady disku do medzistavcového priestoru postihnutého segmentu okrem rekonštrukcie výšky medzistavcovej štrbiny docielime aj vzájomnú imobilizáciu susedných stavcov. Po čase dôjde k vytvoreniu pevného kostného premostenia intervertebrálneho priestoru medzi priľahlými plochami sfúzovaných stavcov, ktoré takto zrastú do jedného pevného bloku.
Uplatňujú sa pri tom autoreparačné pochody organizmu, pričom kostné hojenie pozostáva z troch stupňov: osteoindukcie (naštartovanie kaskády dejov), osteokondukcie (migrácia mezenchýmových osteoprogenitorových buniek na povrch náhrady) a samotnej osteogenézy (čiže kostnej novotvorby).
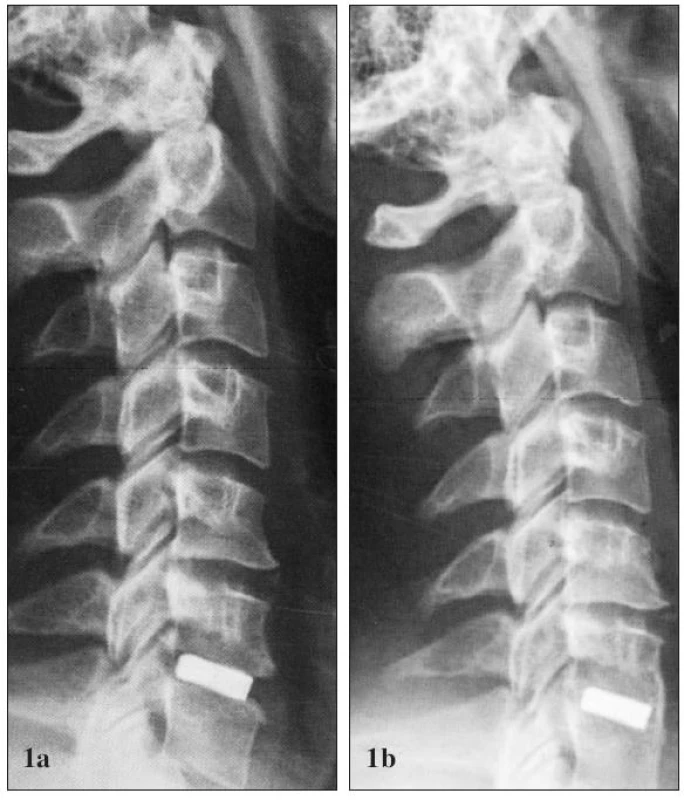
PREHĽAD NÁHRAD MEDZISTAVCOVÝCH PLATNIČIEK V KRČNOM ÚSEKU CHRBTICE
Náhrady medzistavcových platničiek používané v krčnej spondylochirurgii sa v zásade dajú rozdeliť do dvoch veľkých skupín kostných a syntetických náhrad, tie sa následne členia na ďalšie podkupiny. Ich stručný prehľad uvádza tabuľka 1.
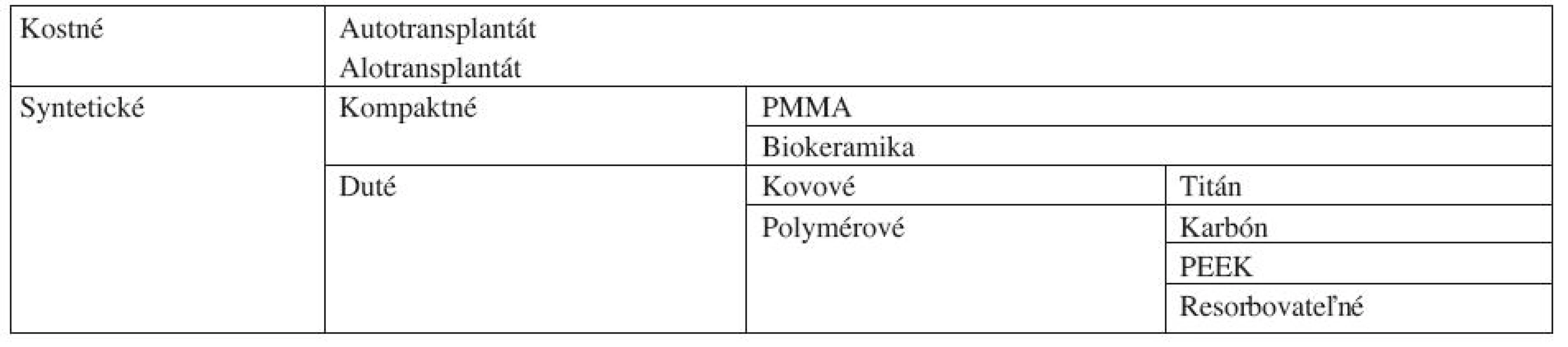
Tradičnou a aj v súčasnosti často používanou kostnou náhradou je autológny kostný štep z lopaty bedrovej kosti (menej často z fibuly, z priľahlých krčných stavcov, z rebra a kalvy) [1, 2]. Vzhľadom k jeho biologickým vlastnostiam a imunologickej identite je možné očakávať optimálne morfologické výsledky a pre svoje vynikajúce osteoproduktívne vlastnosti je ešte stále mnohými považovaný za zlatý štandard medzi užívanými štepmi. Spongióza a kortikalis sa svojimi funkciami vhodne dopĺňajú: vzhľadom k živým mezenchýmovým bunkám prítomným v spongióze je autoštep osteoinduktívny; ako prirodzená kosť má vlastnosti osteokonduktívne; a s ohľadom na minerálové zloženie je osteogénny. Biomechanické požiadavky náhrady zabezpečuje kortikalis poskytujúci mechanickú oporu [3].
Úspešnosť fúzie v prípade autológnych štepov sa po zdokonalení klasických chirurgických metód u väčšiny autorov pohybuje medzi 90 a 97 % pri jednoúrovňovej discektómii; v prípade dvoch segmentov je to o 10–20 % menej [4, 5, 6]. Čo sa týka zlepšenia klinického stavu, približne u 70 % pacientov sa dostaví dobrý až vynikajúci výsledok [7]. Jeho aplikácia je však zaťažená pomerne častou perioperačnou komorbiditou z oblasti odberu štepu a to až v 25 % [8]. Nepríjemná je predovšetkým chronická lokálna bolesť, ktorá u značnej časti pacientov perzistuje (podľa niektorých prác až u 20 % operovaných) [2, 9]. Menej často (8,6 %) sa vyskytuje infekcia, hematóm, pooperačné fraktúry, poškodenie n. ilioinguinalis a n. iliohypogastricus, poranenie močového mechúra, enterokutánna fistula, svalová hernia a herniácia brušného obsahu alebo kozmetický defekt [10].
Vysoký výskyt pooperačných komplikácií súvisiacich predovšetkým s miestom odberu autoštepu motivoval chirurgov k hľadaniu alternatívnych možností. Použitie alogénneho kostného štepu odporúčal už aj sám Cloward [11]. Zdrojom sú kadaverózne štepy z lopaty bedrovej kosti a fibuly, pričom riziko kolapsu je menšie pri použití fibuly [12]. Tieto materiály majú z hľadiska osteoprodukcie predovšetkým osteokondukčné vlastnosti. Svoju osteoindukčnú schopnosť strácajú v priebehu sterilizácie a konzervácie spolu so všetkými živými mezenchýmovými elementami. Primárnym zdrojom osteoprogenitorových buniek sú preto periférna krv a kostná dreň pochádzajúca z chirurgicky pripraveného lôžka krycích doštičiek tiel stavcov [13]. Výhodou oproti autoštepu je eliminácia pooperačnej komorbidity, pričom incidencia solídnej kostnej fúzie aloštepom je celým radom autorov popisovaná ako porovnateľná s incidenciou fúzie autológnymi štepmi. Ich ďalšou prednosťou je väčšia dostupnosť kostného materiálu, čo je dôležité pri rozsiahlejších výkonoch. Nevýhodou je predĺžený čas vytvorenia definitívneho kostného spojenia a väčšie riziko kolapsu náhrady v porovnaní s autológnou kosťou [14]. Predpokladá sa, že príčinou je fyzikálno-chemické spracovanie štepu po odbere [15, 12]. Relatívne častý výskyt tejto komplikácie je pomerne limitujúcim faktorom používania tohto typu náhrady. Nebezpečenstvo prenosu infekčných agens (HIV, HBV, HCV) touto cestou je vďaka dôkladnému skríningu darcov a sterilizačným a konzervačným metódam prakticky už len teoretickou možnosťou [13].
Po zvážení všetkých plusov a mínusov auto a alogénnych štepov, väčšina autorov sa zhodne na tom, že autológny kostný štep má viac predností ako alogénny [16]. K prevahe tohto názoru prispeli aj výsledky publikované Martinom, podľa ktorých fúzia dosiahnutá pri použití alotransplantátu bola 90% po jednoúrovňovom a 70% po dvojúrovňovom výkone v porovnaní s úspešnosťou fúzie pri použití autológnej kosti [17].
Úsilie prekonať vyššie uvedené nedostatky autológnych a alogénnych kostných štepov viedlo k zavedeniu syntetických materiálov do praxe. Od polovice 80. rokov sa stále častejšie používajú pri operáciách cervikálnej spondylózy rôzne syntetické náhrady medzistavcových platničiek.
Jedným z prvých syntetických materiálov v úlohe kompaktnej náhrady odstránenej medzistavcovej platničky bol polymér polymetyl-metakrylát (PMMA), ktorý predstavil Grote v roku 1967 [18]. Namiesto kostného štepu použil rýchlo tvrdnúcu umelú hmotu, ktorá je v súčasnosti dostupná pod rôznymi firemnými názvami. Veľké štúdie s PMMA ukázali nízky výskyt komplikácií a dobré klinické výsledky bez výraznejšieho dyskomfortu a preto tieto materiály sú aj v súčasnosti veľmi obľúbené [19, 20]. Najmä v Nemecku je frekvencia ich použitia väčšia ako v prípade iných telu vlastných alebo syntetických náhrad [21, 22]. Pooperačná stabilita operovaného segmentu sa popisuje v 90–98 %, avšak vytvorenie skutočnej kostnej fúzie zostáva aj naďalej otázne [23]. Kredit PMMA o niečo znižujú výsledky poukazujúce na fakt, že pri jeho použití dochádza ku kostnému premosteniu oveľa neskôr ako u pacientov bez fúzie alebo s fúziou pomocou kostného štepu [24, 25]. Vyplýva to z vytvorenia fibróznej medzivrstvy medzi kosťou a kostným cementom, čo bolo potvrdené aj pokusmi na zvieratách [26]. Dôsledkom tejto reakcie je osteolýza okolitej kosti, ktorá vedie k remodelácii kosti a k možnej migrácii štepu. Kosť nemôže vrásť do PMMA a preto osifikácia prebieha okolo akrylátu, čo zreteľne vyžaduje dlhšie časové obdobie. Veľkou prednosťou akrylátovej výplne oproti preformovaným náhradám je okrem nízkych ekonomických nákladov aj to, že sa dokonale prispôsobí individuálnej výške a tvaru operovaného medzistavcového priestoru [25].
Aj napriek tomu, že polymér ako náhrada dostatočne efektívne zabraňuje kolapsu medzistavcového priestoru a zmenšuje intersegmentálnu kyfózu, hľadali sa ďalšie syntetické materiály s lepšími osteoproduktívnymi schopnosťami. V tomto smere prospešnými vlastnosťami disponuje syntetický hydroxyapatit zo skupiny kalciových fosfátov (chemicky Ca10(PO4)6(OH)2), ktorý je aj hlavnou anorganickou zložkou kostného tkaniva. Náhrady vyrobené zo tohto materiálu našli využitie pod názvom biokeramické implantáty. Ich najpozoruhodnejšou vlastnosťou je schopnosť potencovať novotvorbu kostného tkaniva na rozhraní kosť-implantát po celej styčnej ploche náhrady s telom stavca [27]. Je to dané porozitou materiálu a z nej vyplývajúca vysoká osteokondukčná schopnosť. Optimálny pomer medzi poróznou a solídnou zložkou je 30 %, čím sa dosiahne dostatočná mechanická odolnosť a zároveň sa zachová vysoká schopnosť novotvorby kostného tkaniva [28].
Prvé výsledky publikované v súvislosti s hydroxyapatitovými implantátmi svedčili pre dobré klinické aj radiologické výsledky 6 mesiacov po operácii. Fúzia nastala v 92 % pri jednoúrovňovom a v 80 % pri dvojúrovňovom výkone. Spomedzi nevýhod je treba spomenúť, že novotvorba kostného tkaniva v tomto prípade prebieha o niečo pomalšie ako bol pôvodný predpoklad na základe skúseností predovšetkým v ortopédii. Bude teda potrebné dlhšie časové obdobie na dosiahnutie solídnej fúzie [27]. Okrem toho bol pozorovaný kolaps alebo zlomenie náhrady, kedy implantát neplní jednu zo svojich základných funkcií a to rekonštrukciu výšky medzistavcového priestoru [29].
V súčasnosti majú dominantné postavenie v cervikálnej spondylochirurgii nie kompaktné materiály, ale tzv. duté klietky (podľa anglického ekvivalentu zvané aj „cage“) a to buď kovové alebo polymérové. Majú výnimočné mechanické vlastnosti, ktoré prakticky vylučujú riziko kolapsu náhrady. Keďže ide o syntetické materiály, sú neobmedzene dostupné. V ponuke sú implantáty rôznej veľkosti, tvaru, designu a povrchovej úpravy, ktoré sa tým do značnej miery približujú potrebám operácie. Súčasne je povrch styčných plôch upravený zárezmi, ostrými výbežkami, hranami, čepeľami a poróznym nástrekom tak, aby slúžil na pevné ukotvenie náhrady v lôžku [30]. Popri svojich vynikajúcich biomechanických atribútoch však syntetické náhrady disponujú len minimálnou alebo žiadnou primárnou osteogénnou vlastnosťou, ktorá je nevyhnutná ku vzniku stabilnej artrodézy. Na rozdiel od kostných štepov totiž nie sú nositeľmi rastových faktorov alebo osteoprogenitorových aktívnych buniek. Samotný proces osteogenézy pri ich použití teda nevychádza priamo z implantátu, ale z dostatočne dôkladne pripraveného lôžka náhrady chirurgickými technikami [31].
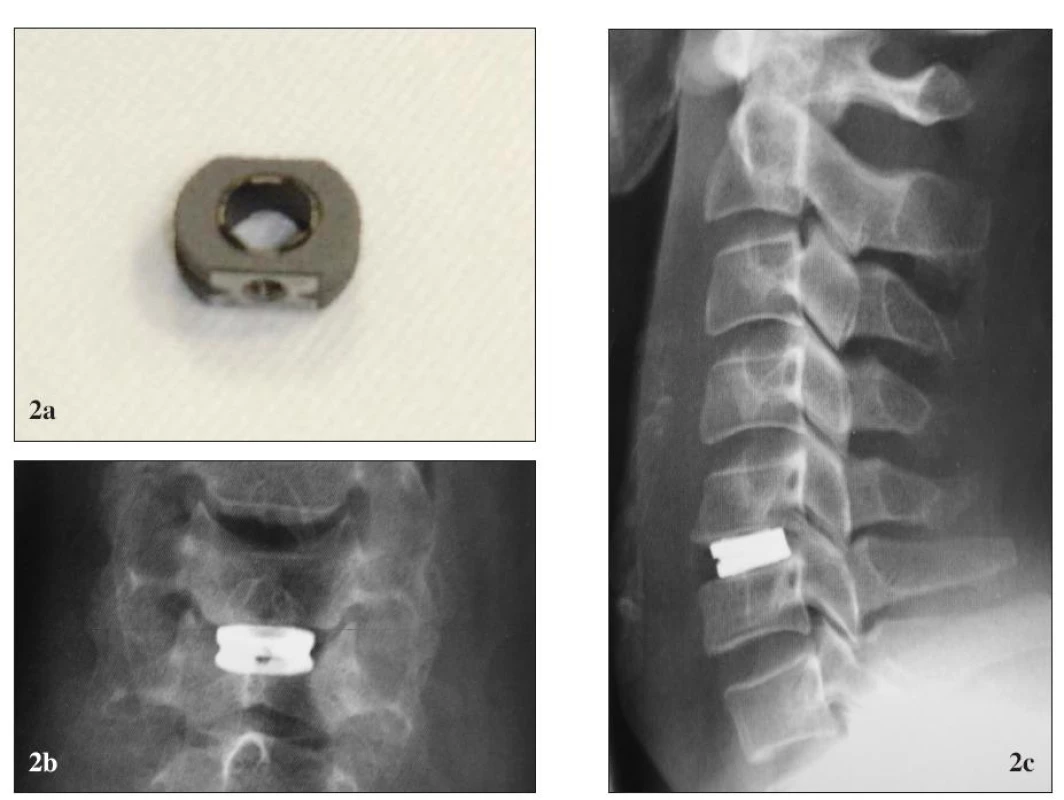
Nedostatočná osteoproduktívna schopnosť samotných syntetických implantátov je v prípade „cage“-ov riešená tým, že do preformovaného centrálneho otvoru je možné za účelom osteoindukcie vložiť výplň. Fúzia sa teda deje nielen okolo náhrady, ale aj v jej vnútri, čo dáva dobrý predpoklad k vzniku pevnej artrodézy. Väčšina autorov ako výplň implantátu využíva autológnu alebo alogénnu kosť, prípadne ich biokeramickú náhradu pozostávajúcu z anorganických zložiek kostného tkaniva [3]. Do tejto skupiny patrí aj už spomínaný hydroxyapatit, ďalej trikalcium-fosfát alebo bikalcium-fosfát [32]. Nakoniec, vhodným materiálom na výplň sa javia aj organické komponenty kosti, ktoré získame demineralizáciou kostnej matrix [13]. Ide o zmes organických zložiek kosti s excelentnými osteoinduktívnymi vlastnosťami, pričom samotnou osteoinduktívnou komponentou sú dve skupiny glykoproteínov: kostné morfogénne proteíny (BMP) a non-BMP rastové faktory [33]. Z nich experimentálne aj klinicky je dôkladnejšie prebádaná najmä prvá skupina. A práve kombinácia ľudského rekombinantného BMP (rh-BMP) s polymérovými klietkami z polyéteréterketónu (PEEK) sa javia ako najideálnejšie z hľadiska úspešnosti fúzie. Použitím tejto kombinácie dosiahol Boakye použitím PEEK klietky s výplňou rh-BMP 100% úspešnosť fúzie pri jedno-, dvoj - aj trojúrovňovej discektómii s fúziou v súbore 24 pacientov [34]. Podobné výsledky produkoval aj Burkus, avšak v lumbálnej lokalizácii [35]. Žiaľ, zatiaľ je použitie BMP limitované vysokou cenou a nedostatočnými klinickými skúsenosťami.
Výsledky štúdií zameraných na úspešnosť fúzie pri použití rôznych druhov dutých náhrad krčných medzistavcových platničiek svedčia o vynikajúcich výsledkoch, väčšinou v rozmedzí 95–100 % pri jedno - aj dvojúrovňových výkonoch [36, 30, 37].
Spomedzi kovových „cage“-ov bola ako prvá do praxe zavedená celokovová zliatina, titánová klietka.
Je jednoduchá, nevyžaduje náplň a disponuje vynikajúcimi biomechanickými vlastnosťami. Nakoľko však ide o materiál, ktorý tvrdosťou prevyšuje ľudskú kosť, môže dôjsť k zanoreniu náhrady cez krycie plôšky do spongiózy tiel stavcov [22]. Neodporúča sa preto jeho implantácia pacientom s osteoporózou, osteolytickým procesom priľahlých tiel stavcov a extrémnou instabilitou. Znížiť riziko zanorenia môžme umiestnením náhrady v intervertebrálnom priestore čo najventrálnejšie a zvolením implantátu s čo najväčším povrchom. Druhou nevýhodou je, že použitie titánu výrazne obmedzuje výpovednú hodnotu pooperačných radiologických vyšetrení. Aj keď je MRI-kompatibilný, pri vyšetrení magnetickou rezonanciou spôsobuje artefakty, ktoré môžu sťažovať interpretáciu pooperačných zmien [31]. Sledovanie prerastania kostného tkaniva cez centrálny otvor pomocou natívneho röntgenu je taktiež veľmi obtiažne, vhodnejšie sú na to sagitálne CT rezy [38].
Konkurencieschopnou alternatívou kovových „cage“-ov sa ukazujú byť syntetické klietky vyrábané z polymérov. Patria sem predovšetkým karbón, PEEK a najnovšie aj bioresorbovateľné materiály.
Ich spoločnou črtou je, že poskytujú dobrú kombináciu sily, pevnosti, kompaktnosti a odolnosti únave vo všetkých rovinách a smeroch. Vďaka rôznorodým povrchovým fixačným elementom nie je potrebné pri príprave lôžka pred implantáciou príliš zoškrabávať chrupkovité krycie platničky a radikálne pripravovať krycie plôšky stavcov, čo do značnej miery znižuje traumatizáciu susedných kostných štruktúr. Tvrdosťou a elastickými vlastnosťami sú polyméry v porovnaní s titánom oveľa bližšie kosti, čo podporuje tvorbu kostnej fúzie a znižuje namáhanie krycích plôšok tiel stavcov. Tým sa signifikantne redukuje riziko zanorenia náhrady [39, 40]. Veľkou prednosťou je aj ich radiotransparencia, čo umožňuje priebežne hodnotiť úspešnosť fúzie pomocou RTG alebo CT. Polohu implantátu vieme určiť na základe malých kontrastných elementov inkorporovaných v náhrade. Ďalšou výhodou oproti titánu je, že polyméry sa v magnetickom prostredí správajú inertne a tak nežiadúce artefakty nesťažujú hodnotenie MRI snímkov [37]. Keďže tieto materiály nemajú osteoinduktívne ani osteokonduktívne vlastnosti, je potrebné ich centrálne otvory vyplniť kosťou alebo jej náhradou. Takouto kombináciou sa do 12 mesiacov podarilo dosiahnuť takmer 100% úspešnosť fúzie [37, 34, 41, 42].
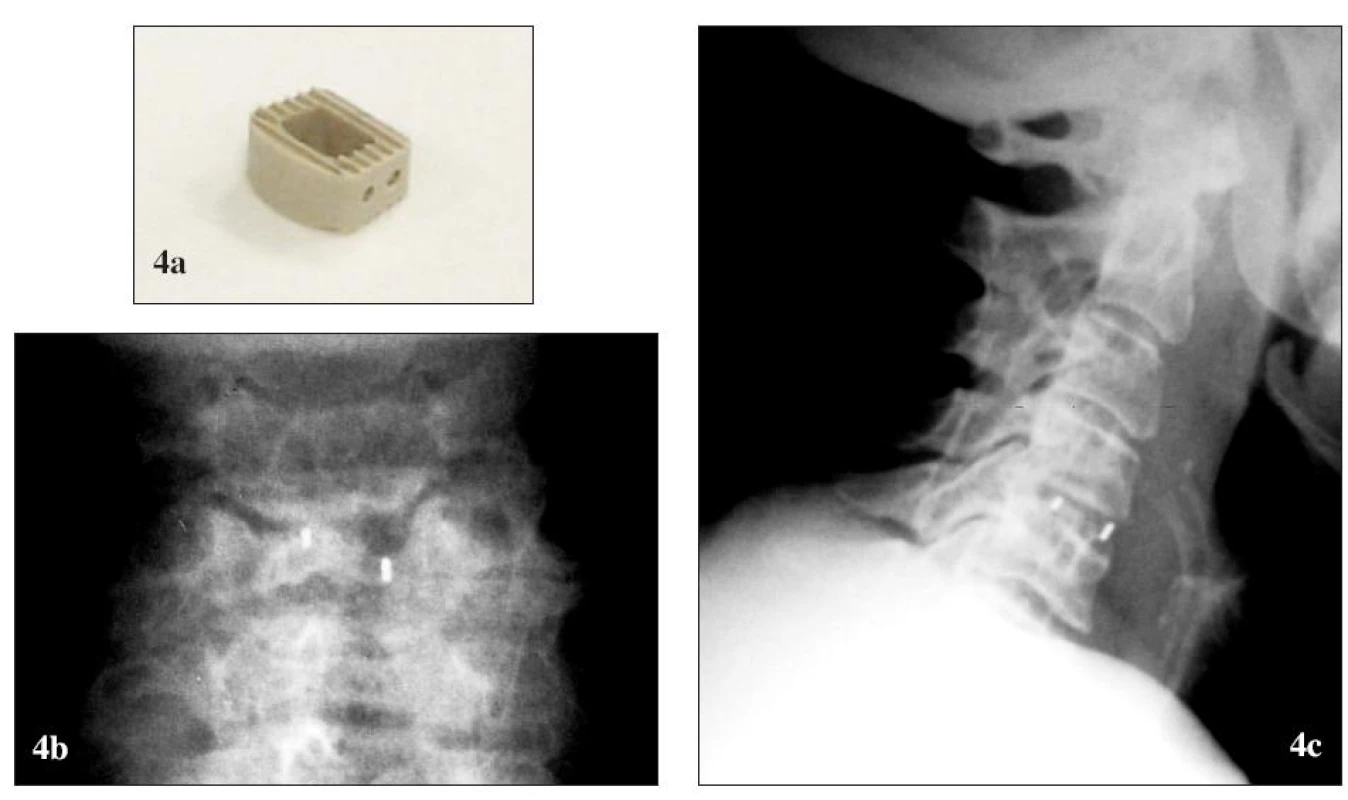
Určitou limitáciou karbónových klietok môže byť prekvapivo vysoká incidencia zanorenia (až do 30%) aj napriek nízkemu elastického modulu a možný nepriaznivý účinok jednotlivých karbónových vlákien na okolité tkanivá – po intraartikulárnych výkonoch bola pozorovaná synovitída a vycestovanie vlákien lymfatickými cestami [43, 40].
Ako už bolo spomenuté, zatiaľ vynikajúce výsledky boli dosiahnuté použitím PEEK-ových „cage“-ov s výplňou rh-BMP [34, 42].
S veľkým záujmom sa budú sledovať aj prvé praktické skúsenosti s biodegradovateľnými materiálmi, ktoré sa po splnení svojej biomechanickej a ostegénnej funkcie postupne hydrolyzujú na H2O a CO2. Takýmito materiálmi sú poly(L-laktid) a poly(D,L-laktid) resp. ich zmes v pomere 70 : 30, čím vznikne poly(L-laktid-ko-D,L-laktid) s ideálnymi mechanickými vlastnosťami a pomerom degradácie po 18 mesiacoch [44, 45].
Na základe vyššie uvedených faktov a výsledkov je zrejmé, že v súčasnosti sme schopní realizovať prvotné ciele zakladateľov cervikálnej spondylochirurgie a priekopníkov predného prístupu k degeneratívnym zmenám tejto oblasti s pomerne vysokou radiologickou aj klinickou úspešnosťou. Aj napriek mnohým otáznikom a diskusiám, ktoré v súvislosti s najideálnejším druhom výkonu a typom náhrady pretrvávajú, úspešnosť fúzie priľahlých stavcov sa čoraz viac blíži k 100 %. Pri týchto výborných krátkodobých výsledkoch sa ale pozornosť lekárov a výskumníkov čoraz viac zameriava na benefit artrodézy v dlhšom časovom horizonte.
Jedným z možných stredne - až dlhodobo negatívnych vplyvov solídnej fúzie je, že záťaž sa prenáša na susedné segmenty a intervertebrálne disky, dochádza k ich preťaženiu a urýchleniu degeneratívnych zmien, ktoré môžu mať aj klinickú odozvu. Najmä vplyvom práce Hilibranda a Goffina sa v posledných rokoch živo diskutuje o tzv. chorobe susedného segmentu [46, 47].
Ako najlepšia prevencia tejto svojím spôsobom komplikácie sa v posledných rokoch črtá nová alternatíva klasickej artrodézy v podobe dynamických náhrad medzistavcových platničiek, tzv. „arteficiálnych diskov“. Tie nielen obnovujú fyziologickú výšku medzistavcovej štrbiny, ale snažia sa jej navrátiť aj jej pôvodnú mobilitu, čím redukujú nadmerné mechanické a dynamické nároky na susedné segmenty. Umožňujú totiž pohyb v postihnutom segmente chrbtice a súčasne plnia aj funkciu nárazníkového absorbéra, tlmiča. Rozdeľujeme ich do rôznych skupín na základe druhu použitého materiálu, tvaru artikulačných plôch náhrady a jej dizajnu. Pohybový mechanizmus je zabezpečený buď tak, že medzi dvoma anatomicky tvarovanými kovovými platničkami je umiestnené flexibilné jadro nahradzujúce funkciu nucleus pulposus, alebo dochádza k priamemu kontaktu dvoch vzájomne mobilných pevných súčastí. Podľa toho rozlišujeme rôzne dizajny: kov na kov, kov na polymér (polyetylén s ultravysokou molekulovou hmotnosťou), keramika na polymér a keramika na keramiku [48].
Arteficiálne náhrady krčnej medzistavcovej platničky sa v praxi používajú od roku 2001 [49]. Európske a austrálske klinické štúdie artroplastík typu kov na kov a kov na polymér svedčia o signifikante lepších výsledkoch v porovnaní s artrodézou [50, 51, 52, 53]. Reálnou otázkou pri krátkosti klinických skúseností je čas, keď dôjde k opotrebovaniu mobilnej náhrady. Čiastočnou odpoveďou sú laboratórne skúšky, ktoré preukázali predpokladanú životnosť Bryanovej náhrady disku 47 rokov [54]. S veľkým očakávaním sú spojené i prvé klinické prospektívne randomizované štúdie prebiehajúce v súčasnosti v Spojených štátoch amerických. Ich definitívne výsledky by mali prispieť k vyjasneniu úlohy arteficiálnych diskov v oblasti cervikálnej spondylochirurgie ako aj k upresneniu indikačných kritérií [55]. Zatiaľ však prevláda názor, že symptomatická hypermobilita a akcelerácia degeneratívnych zmien susedného segmentu nie je až tak častá a k použitiu mobilnej náhrady sa prikláňame skôr u mladších jedincov so zachovanou mobilitou postihnutého segmentu. U starších pacientov v danej indikácii aj naďalej uprednostňujeme jednoduchšiu a lacnejšiu fúziu [31].
MUDr. František Pataky
Čermeľská
23
040
01 Košice
Slovenská
republika
e-mail:
frantisek.pataky@fulp.sk
Sources
1. Casey, A. T., Hayward, R. D., Harkness, W. F., et al. The use of autologous skull bone grafts for posterior fusion of the upper cervical spine in children. Spine, 1995; 20 : 2217–2220.
2. Sawin, P. D., Traynelis, V. C., Menezes, A. H. A comparative analysis of fusion rates and donor-site morbidity for autogenic rib and iliac crest bone grafts in posterior cervical fusions. J. Neurosurg., 1998; 88 : 255–265.
3. Marchesi, D. G. Spinal fusion: bone and bone substitutes. Eur. Spine J., 2000; 9 : 372–378.
4. Smith, G. W., Robinson, R. A. The treatment of certain cervical-spine disorders by anterior removal of the intervertebral disc and interbody fusion. J. Bone Joint Surg. Am., 1958 Jun; 40-A(3): 607–624.
5. Robinson, R. A., Walker, A. E., Ferlic, D. C., et al. The results of anterior interbody fusion of the cervical spine. J. Bone Joint Surg., 1962; 44A: 1569–1587.
6. Dowd, G., Wirth, F. Anterior cervical dissectomy: Is fusion necessary? J. Neurosurg., 1999; 90 : 8–12.
7. Whitecloud, T. S. III. Cervical spondylosis: The anterior approach. In: Frymoyer, et al.: The adult spine. New York, Raven Press, 1991 : 1165–1186.
8. Banwart, J. C., Asher, M. A., Hassanein, R. S. Iliac crest bone graft harvest donor site morbidity. A statistical evaluation. Spine, 1995; 20 : 1055–1060.
9. Summers, B. N., Eisenstein, S. M. Donor site pain from the ilium: a complication of lumbar spine fusion. J. Bone Joint Surg., 1989; 71 : 677–680.
10. Younger, E. M., Chapman, M. W. Morbidity at bone graft donor site. J. Orthop. Trauma., 1989; 3 : 192–195.
11. Cloward, R. B. Gas-sterilised cadaver bone grafts for spinal fusion operations. A simplified bone bank. Spine, 1980; 5(1): 4–10.
12. Bishop, R. C., Moore, K. A., Hadley, M. N. Anterior cervical interbody fusion using autogenic and allogenic bone graft substrate: a prospective comparative analysis. J. Neurosurg., 1996; 85 : 206–210.
13. Barsa, P., Suchomel, P. Organické materiály v prednej krčnej diskektomii a fúzii (souborný referát). Acta Spondylologica, 2002; 2 : 123–129.
14. Suchomel, P., Barsa, P., Buchvald, P. Autologous versus allogenic bone grafts in instrumented anterior cervical discectomy and fusion: a prospective study with respect to bone union pattern. Eur. Spine J., 2004 Oct; 13(6): 510–515. Epub 2004 Mar 20.
15. Zdeblick, T. A., Ducker, T. B. The use of freeze-dried allograft bone for anterior cervical fusion. Spine, 1991; 16 : 726–729.
16. Murphy, M. A., Trimble, M. B., Piedmonte, M. R., et al. Changes in the cervical foraminal area after anterior discectomy with and without a graft. Neurosurgery, 1994; 34 : 93–96.
17. Martin, G. J., Haid, R. W., MacMillan, M., et al. Anterior cervical discectomy with freeze-dried fibula allograft. Overview of 317 cases and literature review. Spine, 1999; 24 : 852–859.
18. Grote, W., Rottgen, P. The ventral fusion in cervical osteochondrosis and its treatment results. Acta Neurochir. (Wien), 1967; 16(3): 218–240.
19. Kalff, R., Rauhut, F., Roosen, K., et al. Complications of ventral fusion operations in degenerative intervertebral disc diseases. Neurochirurgia, 1990, Nov; 33(6): 184–189.
20. Hamburger, C., Festenberg, F. V., Uhl, E. Ventral discectomy with pmma interbody fusion for cervical disc disease: long-term results in 249 patients. Spine, 2001, Feb 1; 26(3): 249–255.
21. Schroder, J., Wassmann, H. Polymethylmethacrylate (PMMA) in anterior cervical spine surgery – current situation in Germany. Zentralbl. Neurochir., 2001; 62(2): 33–36.
22. Schroder, J., Palkovic, S. Anterior surgery for degenerative disorders of the cervical spine – techniques and innovations. In: Rudinský, B.: Spinálna chirurgia. Bratislava, Slovak Academic Press, 2006 : 109–114.
23. Barlocher, C. B., Barth, A., Krauss, J. K., et al. Comparative evaluation of microdiscectomy only, autograft fusion,polymethylmethacrylate interposition, and threaded titanium cage fusion for treatment of single-level cervical disc disease: a prospective randomized study in 125 patients. Neurosurg. Focus, 2002, Jan 15; 12(1): E4.
24. Bent, M. J., Oosting, J., Wouda, E. J. Anterior cervical discectomy with or without fusion with acrylate. A randomized trial. Spine, 1996, Apr 1; 21(7): 834–839; discussion 840.
25. Levkuš, P., Šulla, I., Novotný, V., et al. Naše skúsenosti s prednou krčnou mikrodiskektómiou s fúziou pomocou akrylátu. Acta Spondylologica, 2003; 1 : 24–27.
26. Horowitz, S. M., Doty, S. B., Lane, J. M. Studies of the mechanism by which the mechanical failure of polymethylmethacrylate leads to bone resorption. J. Bone Joint Surg. Am., 1993, Jun; 75(6): 802–813.
27. Rudinský, B., Hill, R., Koleják, K. Anterior cervical interbody fusion with bioceramic cages: initial experience. In: Kaech, D. L., Jinkins, J. R.: Spinal restabilization procedures. Elsevier, 2002 : 249–255.
28. Kim, P., Wakai, S., Matsuo, S. Bisegmental cervical interbody fusion using hydroxyapatite implants: surgical results and long-term observation in 70 cases. J. Neurosurg., 1998, Jan; 88(1): 21–27.
29. Hill, R. Chirurgická liečba degeneratívnych ochorení krčnej chrbtice. In: Rudinský, B.: Spinálna chirurgia. Bratislava, Slovak Academic Press, 2006 : 115–138.
30. Brooke, N. S., Rorke, A. W., King, A. T. Preliminary experience of carbon fibre cage prosthesis for treatment of cervical spine disorders. Br. J. Neurosurg., 1997, Jun; 11(3): 221–227.
31. Suchomel, P., Barsa, P. Náhrada krční meziobratlové ploténky vložkou Cespace bez použití kosti či její náhrady. Prospektivní studie. Acta Spondylologica, 2004; 1 : 5–9.
32. Daculsi, G., LeGeros, R., Nery, E., et al. Transformation of biphasic calcium phosphate ceramics in vivo: ultrastructural and physicochemical characterisation. J. Biomed. Mater Res., 1989; 23 : 883–894.
33. Urist, M. R. Bone formation by autoinduction. Science, 1965; 150 : 893–899.
34. Boakye, M., Mummaneni, P. V., Garrett, M. Anterior cervical discectomy and fusion involving a polyetheretherketone spacer and bone morphogenetic protein. J. Neurosurg. Spine, 2005, May; 2(5): 521–525.
35. Burkus, J. K., Transfeldt, E. E., Kitchel, S. H. Clinical and radiographic outcomes of anterior lumbar interbody fusion using recombinant human bone morphogenetic protein-2. Spine, 2002, Nov 1; 27(21): 2396–2408.
36. Assieti, R., Beretta, F., Arienta, C. Two-level anterior discectomy and cage-assisted fusion without plates. Neurosurg. Focus, 2002; 12(1): 1–5.
37. Cho, D. Y., Liau, W. R., Lee, W. Y., et al. Preliminary experience using a polyetheretherletone (PEEK) cage in the treatment of cervocal disc disease. Neurosurgery, 2002, December; 51(6): 1343–1350.
38. Brantigan, J. W., Steffee, A. D. A carbon fiber implant to aid interbody lumbar fusion. Two-year clinical results in the first 26 patients. Spine, 1993, Oct 15; 18(14): 2106–2107.
39. Wenz, L. M., Merritt, K., Brown, S. A., et al. In vitro biocompatibility of polyetheretherketone and polysulfone composites. J. Biomed. Mater Res., 1990; 24 : 207–215.
40. Bartels, R., Donk, R., Azn, R. Height of cervical foramina after anterior discectomy and implantation of a carbon fiber cage. J. Neurosurg., 2001; 95 (1 Suppl): 40–42.
41. Frederic, S., Benedict, R., Payer, M. Implantation of an empty carbon fiber cage or a tricortical iliac crest autograft after cervical discectomy for singlelevel disc herniation: a prospective comparative study. J. Neurosurg. Spine, 2006; 4 : 292–299.
42. Mastronardi, L., Ducati, A., Ferrante, L. Anterior cervical fusion with polyetheretherketone (PEEK) cages in the treatment of degenerative disc disease. Preliminary observations in 36 consecutive cases with a minimum 12-month follow-up. Acta Neurochir., 2006; 148 : 307–312.
43. Parsons, J. R., Bhayani, S., Alexander, H., et al. Carbon fiber debris within the synovial joint: A time-dependent mechanical and histologic study. Clin. Orthop., 1985; 196 : 69–76.
44. Kandziora, F., Pflugmacher, R., Scholz, M. Bioabsorbable interbody cages in a sheep cervical spine fusion model. Spine, 2004, Sep 1; 29(17): 1845–1855; discussion 1856.
45. Pflugmacher, R., Schleicher, P., Gumnior, S., et al. Biomechanical comparison of bioabsorbable cervical spine interbody fusion cages. Spine, 2004, Aug 15; 29(16): 1717–1722.
46. Goffin, J., van Loon, J., van Calenbergh, F., et al. Long-term results after anterior cervical fusion and osteosynthetic stabilization for fractures and/or dislocations of the cervical spine. J. Spinal Disord., 1995; 8 : 499–508.
47. Hilibrand, A. S., Yoo, J. U., Carlson, G. D., et al. The success of anterior cervical arthrodesis adjacent to a previous fusion. Spine, 1997; 22 : 1574–1579.
48. Phillips, F. M., Garfin, S. R. Cervical disc replacement. Spine, 2005; 30: S27–33.
49. Bryan, V. E. Cervical motion segment replacement. Europ. Spine J., 2002; 11 : 92–97.
50. Wigfield, C. C., Gill, S. S., Nelson, R. J., et al. The new Frenchay Artificial Cervical Joint: results from a two-year pilot study. Spine, 2002; 27 : 2446–2452.
51. Goffin, J., Casey, A., Kehr, P., et al. Preliminary clinical experience with the Bryan Cervical Disc Prosthesis. Neurosurgery, 2002; 51 : 840–847.
52. Goffin, J., van Calenbergh, F., van Loon, J., et al. Intermediate follow-up after treatment of degenerative disc disease by the Bryan Cervical Disc Prosthesis: single-level and bi-level. Spine, 2003; 28 : 2673–2678.
53. Sekhon, L. Cervical arthroplasty in the management of spondylotic myelopathy. J. Spinal Disord. Tech., 2003; 16 : 307–313.
54. Rudinský, B., Koleják, K. Totálna artroplastika – arteficiálny disk cervikálnej chrbtice. In: Rudinský, B.: Spinálna chirurgia. Bratislava, Slovak Academic Press, 2006 : 139–147.
55. Sawin, P. D., Ceola, W., Mummaneni Praveen, V., et al. Cervical disc arthroplasty with the Prestige ST cervical disc: preliminary results from a multicenter randomized controlled trial. Neurosurgery, 2005 August; 57(2): 421–422.
Labels
Surgery Orthopaedics Trauma surgeryArticle was published in
Perspectives in Surgery

2010 Issue 6
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
-
All articles in this issue
- Current Diagnostic and Treatment Options in Thyroid Carcinoma
- Interbody Spacers in the Treatment of Cervical Spine Disorders
- Quality of Life after Gastrectomy
- Postoperative Ileus – Pathophysiology, Prevention and Treatment (Overview)
- Gastrointestinal Stromal and Other Mesenchymal Gastric Tumors – Laparoscopic Management?
- Abdominal Catastrophe – Surgeon’s View
- Detection of Minimal Residual Disease and its Significance for Eestablishing Prognoses in Patients with Laparoscopic Resections of Colorectal Carcinomas
- Arteriovenous Malformation in Small Intestine as Atypical Etiology of Lower Gastro-intestinal Bleeding – A Case Report
- Dissection of Arteria Poplitea, Managed with Endovascular Procedure
- Pseudodiverticulitis coeci – atypická etiológia bolesti v pravom hypogastriu
- Laparoscopic Hernioplasty TAPP in Treatment of Groin Hernia – 10 Years Experience
- Perspectives in Surgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Interbody Spacers in the Treatment of Cervical Spine Disorders
- Laparoscopic Hernioplasty TAPP in Treatment of Groin Hernia – 10 Years Experience
- Abdominal Catastrophe – Surgeon’s View
- Quality of Life after Gastrectomy
